En los últimos años se ha detectado un incremento de los casos graves de enfermedad invasiva (EI) por Streptococcus pyogenes o estreptococo beta-hemolítico del grupo A (SGA). El objetivo del estudio fue determinar la epidemiología y las características clínicas de las EI por SGA en un hospital pediátrico de tercer nivel.
Material y métodosEstudio retrospectivo realizado en un hospital urbano materno-infantil de tercer nivel. Se incluyeron los pacientes ingresados con diagnóstico final de EI por SGA durante 6 años (2009-2014).
Se consideró EI cuando SGA se aisló en muestras estériles, en pacientes con fascitis necrosante cuando se aisló en muestras de la zona de la lesión y en pacientes con síndrome shock tóxico estreptocócico (SSTS) cuando se aisló en cualquier muestra.
Se recogieron datos demográficos, tipo de infección, factores de riesgo, presentación clínica, datos analíticos al ingreso, tratamiento, necesidad de ingreso en unidad de cuidados intensivos pediátricos (UCIP), datos microbiológicos, estancia hospitalaria y evolución.
ResultadosSe incluyeron 52 casos (12/10.000 ingresos); edad mediana de 3 años (p25-75: 1,4-6,9 años); 28 (53,8%) eran varones. Presentaban factores de riesgo 14 (26,9%) casos. El motivo de consulta incluía fiebre en 51 (98,1%); la clínica acompañante más frecuente fue la cutánea (21; 40,4%). En 50 (96%) casos se aisló SGA en al menos un medio estéril. Se diagnosticaron 14 (26,9%) infecciones de piel y partes blandas, 14 (26,9%) neumonías, 12 (23,1%) infecciones osteoarticulares, 10 (19,2%) SSTS, 6 (11,5%) bacteriemias ocultas, 4 (7,7%) meningitis y 2 (3,8%) sepsis.
Requirieron cirugía 18 (34,6%) casos y 17 (32,7%) ingreso en unidad de cuidados intensivos. La mediana de estancia hospitalaria fue de 9,5 días (p25-75: 8-15 días). Presentaron secuelas 3 pacientes y hubo un fallecimiento.
ConclusiónLa EI por SGA fue un motivo poco frecuente aunque grave de hospitalización. Las infecciones de piel y partes blandas, y las pleuroneumonías fueron las formas de EI más habituales. A pesar de la gravedad, la mortalidad en la serie fue baja.
The last years an increase of severe cases of invasive disease (ID) due to Streptococcus pyogenes or streptococcus b-hemolytic group A (SGA) had been detected. The aim of this study was to analyze the epidemiology and the clinical features of ID due to SGA in a tertiary Pediatric Hospital.
Material and methodsRetrospective study in a Pediatric hospital, of all in-patients with final diagnosis of ID due to SGA during 6 years (2009-2014).
To consider ID, SGA had to be isolated in sterile samples; in patients with fascitis necroticans in skin samples or in any sample in patients with the diagnostic of Streptococcal Toxic Shock Syndrome (STSS). The SSTS was defined as hypotension and at least 2 of these criteria: renal failure, hepatic failure, acute respiratory distress, tissue necrosis or desquamative erythematous rash.
Demographic data, type of infection, risk factors, clinical presentation, analytical data at admission, treatment, need for admission to a pediatric intensive care unit, microbiological data, hospital stay and evolution were collected.
ResultsFifty-two (52) cases were included (12/10,000 of all inpatients); 3 years-old was the medium age (p25-75: 1.4-6.9 years); 28 (53.8%) were boys. Fourteen patients (26.9%) had risk factors. Fever was the major symptom (51 patients, 98.1%). The skin lesions were the most frequent clinical manifestations found (21; 40.4%). In 50 (96%) cases, SGA was isolated in at least one sterile sample. Skin and soft tissue infections were diagnosed in 14 patients (26.9%), 14 (26.9%) pneumonias, 12 (23.1%) bones and joints infections, 10 (19.2%) SSTS, 6 (11.5%) occult bacteremia, 4 (7.7%) meningitis and 2 (3.8%) sepsis.
Surgery was required in 18 cases (34.6%) and 17 patients (32.7%) needed intensive care. The medium hospital stay was 9.5 days (p25-75: 8-15 days). Three patients presented sequels and one patient died.
ConclusionThe ID due to SGA was a rare but serious reason for hospital admission. Skin and soft tissue infections, and pleuroneumonia were the most common forms of ID. The mortality of our sample was low despite the serious clinical manifestations.
La enfermedad invasiva (EI) por Streptococcus pyogenes (SGA) es poco frecuente en pediatría, estimándose una incidencia de 2-3 casos cada 100.000 habitantes y año1,2. Es una enfermedad grave, que afecta mayoritariamente a pacientes previamente sanos y que presenta una mortalidad importante, en torno al 5-20%3-6, sobre todo en relación con la presencia de fascitis necrosante, síndrome del shock tóxico estreptocócico (SSTS) o patología de base. Entre los años 1982 y 2002, el programa de vigilancia avalado por la unión europea Euro-STREP detectó un incremento progresivo de casos7. La causa de este aumento fue desconocida, barajándose diversas hipótesis como el aumento del poder infectivo de la bacteria, alteraciones del sistema inmune y patrones cíclicos de incidencia de infecciones focales8-11. Este programa incluye pacientes de todas las edades (España no forma parte del mismo). Por otro lado, las publicaciones en pediatría sobre EI por SGA son escasas y la mayoría se basan en series con pocos casos5,12. El objetivo de este estudio fue describir la epidemiología y las características clínicas de las EI por SGA en un hospital pediátrico de tercer nivel.
MétodosDiseñoEstudio retrospectivo realizado en un hospital urbano materno-infantil de tercer nivel con 275 camas pediátricas, que atiende a un área de influencia de 1.800.000 habitantes (300.000 menores de 18 años) y recibe anualmente alrededor de 100.000 visitas pediátricas.
Población de estudioSe incluyeron los pacientes de un mes a 18 años de edad ingresados en el hospital con diagnóstico final de EI por SGA durante 6 años (enero 2009-diciembre 2014).
DefinicionesEI:
- •
Pacientes con aislamiento de SGA en muestras habitualmente estériles (sangre, orina, líquido cefalorraquídeo [LCR], etc.).
- •
Pacientes con fascitis necrosante cuando se aísla de muestras procedentes de la lesión.
- •
Pacientes con SSTS cuando se aísla SGA de cualquier muestra (frotis faríngeo, herida, piel, secreción ótica, etc.).
SSTS: presencia de hipotensión y al menos dos de los siguientes: fallo renal, alteraciones de la coagulación o hepáticas, síndrome de distrés respiratorio agudo, necrosis tisular o rash eritematoso con descamación13.
Sepsis: síndrome de respuesta inflamatoria sistémica (SRIS) en presencia, o como resultado, de infección sospechada o confirmada14.
Bacteriemia oculta: la bacteriemia oculta se define como la presencia de bacterias en la sangre en un niño febril con buen estado general, en ausencia de una fuente identificable de infección15.
Para la identificación de los casos, por un lado, se seleccionaron de la base de datos de laboratorio del hospital todos los pacientes con algún cultivo de medio estéril positivo a SGA y, por otro, se seleccionaron, de la base de datos de altas hospitalarias, los pacientes con diagnóstico de alta de fascitis necrosante y SSTS (CIE M72.6 y A48.3). Se revisaron sus historias clínicas y se escogieron los que cumplían los criterios de inclusión.
Las muestras biológicas fueron procesadas en el laboratorio de microbiología mediante tinción de Gram y cultivo en medios convencionales. La identificación bacteriana se obtuvo mediante pruebas bioquímicas y enzimáticas habituales (API 20 STRP. Biomérieux; Marcy l’Etoile, Francia) y fue confirmada por aglutinación en látex específica de antígeno de SGA (Strep Kit. Diamondial; Langenhagen, Alemania).
Variables de estudioDe cada caso, se recogieron datos demográficos, tipo de infección, factores de riesgo, presentación clínica, datos analíticos al ingreso, tratamiento, necesidad de ingreso en unidad de cuidados intensivos pediátricos (UCIP), datos microbiológicos, estancia hospitalaria y evolución.
Análisis estadísticoLos datos extraídos se almacenaron y procesaron en una base de datos Microsoft Access específica. Se tabularon variables cuantitativas y categóricas. Posteriormente se analizaron con el programa estadístico SPSS v 21.0 parar Windows. Se mostró la estadística descriptiva mediante medianas y rango intercuartil en las variables cuantitativas y números absolutos y porcentajes en las categóricas.
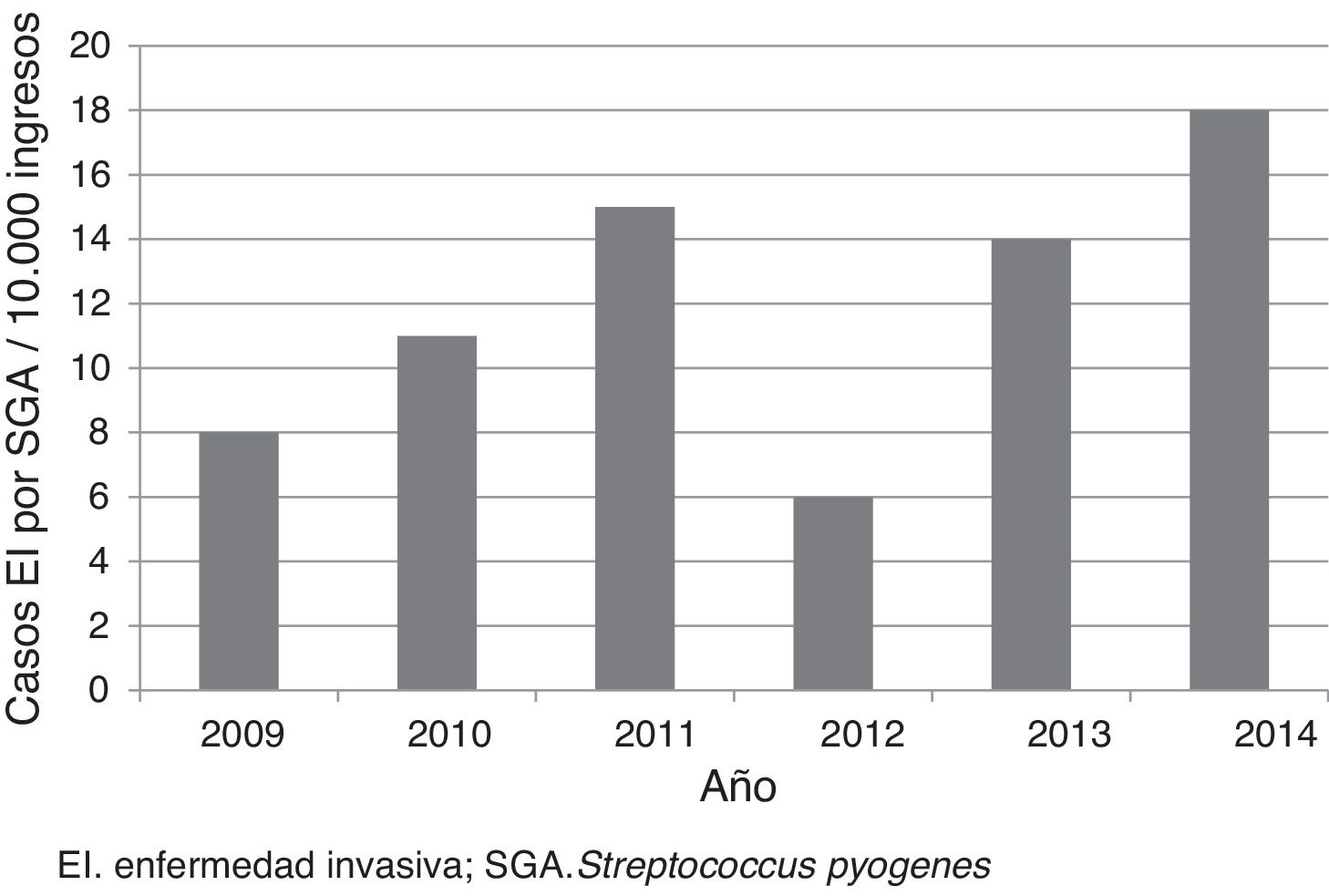
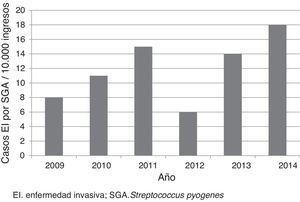
ResultadosSe incluyeron 52 casos, que correspondieron a una tasa media anual de 12 casos por cada 10.000 ingresos (fig. 1). La edad mediana de los pacientes fue de 3 años (p25-75: 1,4-6,9 años); 33 (63,5%) tenían menos de 5 años; 28 (53,8%) eran de sexo masculino. Diecinueve (36,5%) fueron remitidos de otros centros para valoración e ingreso, de los cuales 12 procedían de centros hospitalarios y 7, de centros de atención primaria. Seis pacientes estaban en tratamiento previo con amoxicilina, 3 por faringoamigdalitis y 3 por otitis.
Presentaban factores de riesgo 14 (26,9%) pacientes:
- •
Doce presentaban patología cutánea; 8, enfermedades cutáneas agudas (4 heridas, 2 dermatitis y 2 varicela); 4, enfermedades cutáneas crónicas (2 pacientes con epidermólisis, uno con aplasia cutis y otro con dermatitis atópica), 3 de ellos con brote agudo de su enfermedad.
- •
Dos estaban en tratamiento inmunosupresor; corticoides y tacrolimus.
Ningún paciente presentaba antecedentes quirúrgicos ni de lesiones por quemaduras.
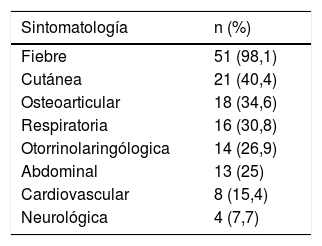
La clínica más frecuente se detalla en la tabla 1. El motivo de consulta incluía fiebre en 51 (98,1%) pacientes, de entre 1-7 días de evolución y con una mediana de temperatura máxima registrada de 39,4°C (p25-75: 38,7-40°C); en 5 casos fue el único síntoma. Hubo un caso sin fiebre que correspondía a un paciente con abscesos cutáneos y hemocultivo positivo.
Clínica de presentación en urgencias de los pacientes con enfermedad invasiva por Streptococcus pyogenes (n=52)
| Sintomatología | n (%) |
|---|---|
| Fiebre | 51 (98,1) |
| Cutánea | 21 (40,4) |
| Osteoarticular | 18 (34,6) |
| Respiratoria | 16 (30,8) |
| Otorrinolaringólogica | 14 (26,9) |
| Abdominal | 13 (25) |
| Cardiovascular | 8 (15,4) |
| Neurológica | 4 (7,7) |
Varios pacientes presentaron más de un tipo de sintomatología.
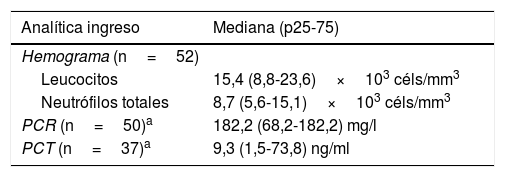
En la tabla 2 se muestran los resultados de la analítica de ingreso y de los estudios microbiológicos: en 50 (96%) se aisló SGA en al menos un medio estéril, y los 2 casos restantes corresponden a niños con fascitis necrosante y cultivo de herida positivo a SGA. Se realizó faringotest a 48 pacientes, siendo positivo en 12.
Resultados de la analítica de ingreso y de los cultivos realizados a los pacientes con enfermedad invasiva por Streptococcus pyogenes
| Analítica ingreso | Mediana (p25-75) |
|---|---|
| Hemograma (n=52) | |
| Leucocitos | 15,4 (8,8-23,6)×103 céls/mm3 |
| Neutrófilos totales | 8,7 (5,6-15,1)×103 céls/mm3 |
| PCR (n=50)a | 182,2 (68,2-182,2) mg/l |
| PCT (n=37)a | 9,3 (1,5-73,8) ng/ml |
| Cultivos estériles | Positivos (%) |
|---|---|
| Hemocultivo (n=51) | 33 (64,7) |
| Líquido pleural (n=12) | 11 (91,6) |
| LCR (n=8) | 4 (50) |
| Cultivos drenaje quirúrgico (n=7) | 4 (57,1) |
| Líquido articular (n=6) | 3 (50) |
| Cultivo óseo (n=1) | 1 (100) |
LCR: líquido cefalorraquídeo; PCR: proteína C reactiva; PCT: procalcitonina.
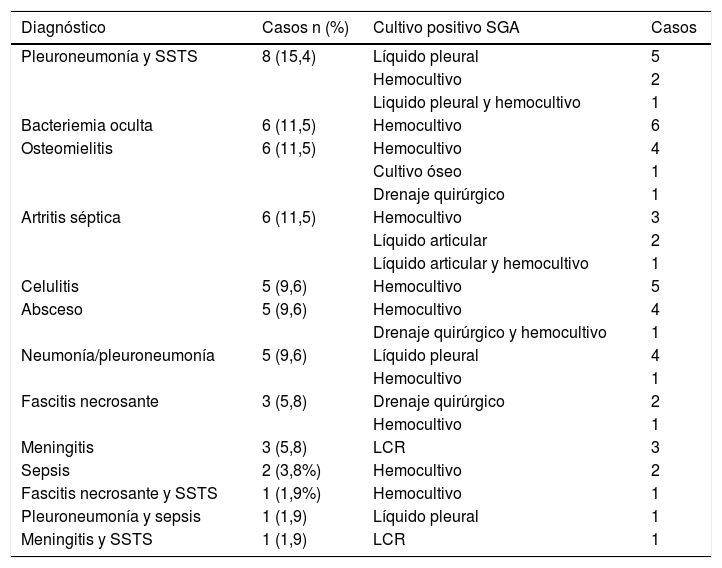
Se diagnosticaron 14 (26,9%) casos de infección de piel y partes blandas (10 de ellos tenían como factor de riesgo patología cutánea), 14 (26,9%) de neumonía/pleuroneumonía, 12 (23,1%) de infección osteoarticular, 10 (19,2%) de SSTS, 6 (11,5%) de bacteriemia oculta, 4 (7,7%) de meningitis y 2 (3,8%) de sepsis. Hubo 11 pacientes con más de un diagnóstico (tabla 3).
Diagnósticos y cultivos estériles positivos de los de los 52 pacientes con enfermedad invasiva por Streptococcus pyogenes
| Diagnóstico | Casos n (%) | Cultivo positivo SGA | Casos |
|---|---|---|---|
| Pleuroneumonía y SSTS | 8 (15,4) | Líquido pleural | 5 |
| Hemocultivo | 2 | ||
| Liquido pleural y hemocultivo | 1 | ||
| Bacteriemia oculta | 6 (11,5) | Hemocultivo | 6 |
| Osteomielitis | 6 (11,5) | Hemocultivo | 4 |
| Cultivo óseo | 1 | ||
| Drenaje quirúrgico | 1 | ||
| Artritis séptica | 6 (11,5) | Hemocultivo | 3 |
| Líquido articular | 2 | ||
| Líquido articular y hemocultivo | 1 | ||
| Celulitis | 5 (9,6) | Hemocultivo | 5 |
| Absceso | 5 (9,6) | Hemocultivo | 4 |
| Drenaje quirúrgico y hemocultivo | 1 | ||
| Neumonía/pleuroneumonía | 5 (9,6) | Líquido pleural | 4 |
| Hemocultivo | 1 | ||
| Fascitis necrosante | 3 (5,8) | Drenaje quirúrgico | 2 |
| Hemocultivo | 1 | ||
| Meningitis | 3 (5,8) | LCR | 3 |
| Sepsis | 2 (3,8%) | Hemocultivo | 2 |
| Fascitis necrosante y SSTS | 1 (1,9%) | Hemocultivo | 1 |
| Pleuroneumonía y sepsis | 1 (1,9) | Líquido pleural | 1 |
| Meningitis y SSTS | 1 (1,9) | LCR | 1 |
LCR: líquido cefalorraquídeo; SGA: Streptococcus pyogenes; SSTS; síndrome de shock tóxico estreptocócico.
Inicialmente todos los pacientes fueron tratados con cefalosporinas de tercera generación o penicilinas. En 16 pacientes se añadió clindamicina durante el ingreso. Dieciocho pacientes (34,6%) precisaron procedimientos quirúrgicos: 11 drenajes pleurales, 5 desbridamientos cutáneos (4 fascitis y un absceso) y 2 osteoarticulares. Ningún paciente recibió tratamiento con gammaglobulina inespecífica.
Diecisiete pacientes (32,7%) ingresaron en UCIP, todos los afectos de SSTS (8 asociaban pleuroneumonía, uno meningitis y otro fascitis necrosante), 3 con meningitis, 3 con pleuroneumonía y uno con celulitis y brote activo de epidermólisis bullosa. Estos pacientes, respecto a los que no precisaron UCIP, tenían mayor elevación de los reactantes de fase aguda en la analítica de ingreso (PCR mediana: 298 vs. 139mg/l, p=0,006 y PCT mediana: 17,9 vs. 3,7ng/ml, p=0,04; respectivamente). La mediana de estancia en UCIP fue de 7 días (p25-75: 3-12 días). Once (21,2%) necesitaron ventilación mecánica, 12 (23,1%) soporte inotrópico con fármacos vasoactivos, y una paciente requirió circulación con membrana extracorpórea.
Tres casos presentaron coinfecciones; un paciente presentó bronquiolitis por virus respiratorio sincitial y 2 pacientes presentaron bacteriemia asociada (Streptococcus pneumoniae y Escherichia coli).
La mediana de la estancia hospitalaria fue de 9,5 días (p25-75: 8-15 días). La evolución fue buena en 48 (92,3%) pacientes y 3 presentaron secuelas: uno neuropatía del paciente crítico e insuficiencia renal mantenida; otro hipoacusia y el restante, paresia del VI par craneal. El primer caso se trataba de un paciente con síndrome nefrótico congénito y trasplantado renal afecto de SSTS que falleció unos meses después. Los 2 últimos casos, de niños afectos de meningitis.
DiscusiónEste estudio constató la baja frecuencia de ingresos por EI por SGA. Sin embargo, la tasa fue superior a la descrita en la literatura (tasa de 4,6-5,6 por cada 10.000)6,16. Las diferencias podían en parte deberse a las características propias de cada centro. En nuestro caso, al tratarse de un estudio realizado en un hospital pediátrico de referencia, el número de casos remitidos para completar el diagnóstico y tratamiento fue elevado. Cabe destacar la tendencia ascendente de casos descrita en varios artículos, sobre todo realizados en población general y en diferentes localizaciones geográficas17-21. No se conocen los motivos que causan este aumento a nivel mundial, pero puede deberse a la aparición de clones más virulentos8,10.
La corta edad de los pacientes parece facilitar la adquisición de este tipo de infecciones, al ser habituales en menores de 5 años12,22 probablemente por la inmadurez del sistema inmunológico, estando la mayoría de pacientes previamente sanos.
Entre los pacientes con factores de riesgo, los más frecuentes fueron las enfermedades cutáneas. Clásicamente se ha descrito la varicela como un factor predisponente para la EI por SGA, especialmente en menores de 4 años, en quienes el riesgo de padecer la enfermedad puede ser 20 veces superior2. En nuestro estudio solamente un 3,8% de los casos habían presentado varicela, siendo los datos muy variables en otras series publicadas, dependiendo de la tasa de vacunación antivaricela de la población estudiada (0-45%)6,16,23-25. Durante el periodo de estudio, en nuestro entorno la vacuna de la varicela no era universal en la infancia, por lo que se desconoce la tasa vacunal, aunque se estima que entre los 10 y 14 años el 20,1% de los adolescentes no estaban inmunizados26. Desde 2016, la vacuna está financiada por el sistema nacional de salud en la infancia, administrándose 2 dosis a los 12-15 meses y a los 2-3 años, lo que permitirá valorar en un futuro el impacto de su administración.
En cuanto a la presentación clínica inicial, casi todos los pacientes referían fiebre acompañada de clínica inespecífica, habitualmente cutánea, osteoarticular y/o respiratoria, característica que dificulta el diagnóstico diferencial con otros procesos pediátricos de carácter leve5, retrasando el diagnóstico y el inicio del tratamiento. Ante la sospecha de EI por SGA, disponer de datos analíticos básicos fue de utilidad, ya que en la mayoría de los pacientes existió elevación marcada de reactantes de fase aguda, sobre todo en aquellos que necesitaron ingreso en UCIP por la mayor gravedad. Asimismo, cabe destacar el papel del test de diagnóstico rápido de SGA como herramienta diagnóstica, técnica disponible y rápida que puede resultar de gran ayuda.
Los diagnósticos más frecuentes fueron las infecciones de piel y partes blandas, seguidas de las neumonías con o sin derrame y las infecciones osteoarticulares, datos que coincidieron con los tipos de infección más frecuentes asociados a EI por SGA descritos en la literatura5,6,8,12. La tasa de bacteriemia observada, del 64,7%, estuvo dentro de los intervalos descritos, que oscilan entre el 56 y el 85%7,8,17,22. El SSTS, entidad grave y con mortalidad elevada, es más frecuente en adultos25,27. Las series publicadas en población general presentan entre un 8-14% de SSTS y las de población pediátrica, entre un 7-8%16, sin embargo, en la serie presentada, 10 pacientes (19,2%) cumplieron criterios de dicha entidad. Este acúmulo de casos pudo deberse a las características de nuestro hospital, que facilitó la concentración de casos graves, aunque también pudiera haber influido la virulencia de las bacterias y la susceptibilidad de los huéspedes implicados.
SGA es sensible a β-lactámicos ya que a día de hoy no se han descrito cepas resistentes, por lo que estos antibióticos se mantienen como tratamiento de primera línea8. Todos los pacientes del estudio recibieron β-lactámicos por vía intravenosa de forma empírica en el momento de la sospecha diagnóstica. En los pacientes con evolución más desfavorable se añadió clindamicina con la finalidad de mejorar el rendimiento de la monoterapia28.
En este tipo de enfermedad es frecuente el ingreso en UCIP de los pacientes y/o tratamientos quirúrgicos5. En nuestra serie, una tercera parte de los pacientes requirieron ingresos en UCIP y casi un 40%, tratamiento quirúrgico. La estancia hospitalaria fue larga, prolongándose más allá de una semana en el 75% de los casos. La evolución fue buena en la mayoría de los casos y solo hubo un fallecimiento (1,9%), proporción inferior a la publicada (3-10%)3,5,6. Este dato quizá estuvo en relación con los tipos de EI incluidos en nuestro estudio y con el diagnóstico precoz realizado.
Las limitaciones de este estudio fueron principalmente las propias de su carácter retrospectivo. Determinados aspectos, principalmente relacionados con la presentación y sintomatología, pudieron no quedar reflejados de forma adecuada y completa en las historias clínicas, lo que pudo condicionar que la frecuencia real de los distintos síntomas difiriera en cierta medida de la finalmente constatada. Por otro lado, el que fuese un estudio unicéntrico dificulta la comparación de la tasa de ingreso y del tipo de EI por SGA con otros estudios. Al tratarse nuestro hospital de un centro de referencia, es posible que los casos más graves estuvieran sobrerrepresentados, dato ya comentado previamente.
En conclusión, la EI por SGA fue un motivo muy poco frecuente de hospitalización. Las formas de presentación más habituales fueron la infección de piel y partes blandas, y la neumonía. Debido a su gravedad y elevada morbimortalidad puede considerarse un problema de salud pública. Creemos que sería importante establecer medidas de vigilancia epidemiológica que permitieran conocer la situación real de esta enfermedad, pudiéndose considerar la opción de incluirla en el listado de enfermedades de declaración obligatoria a nivel estatal, ya que el conocimiento de la distribución del SGA permitiría avanzar en el desarrollo y evaluación de nuevas vacunas así como mejoras en el diagnóstico y en el tratamiento precoz.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este trabajo ha sido presentado parcialmente como comunicación oral en el 64.o Congreso de la Asociación Española de Pediatría (Valencia, 2016).