Streptococcus pneumoniae es un patógeno para el ser humano que precisa de colonización nasofaríngea previa para causar enfermedad. Realizamos un estudio epidemiológico de portadores nasofaríngeos de neumococo en niños sanos en Murcia, tras la introducción de la vacuna neumocócica conjugada heptavalente (VCN7) y ante la inmediata comercialización de las nuevas vacunas con el objetivo de conocer, en nuestro ámbito geográfico, la influencia de la vacunación y de otros factores sobre el estado de portador y los diferentes serotipos circulantes.
MétodosEn verano de 2009 e invierno de 2010 realizamos un estudio multicéntrico en 60 consultas de atención primaria, recogiéndose una muestra nasofaríngea y cumplimentándose una encuesta epidemiológica en 1.562 niños de 1 y 4años. De las 1.562 muestras nasofaríngeas se obtuvieron 489 neumococos, habiéndose podido serotipar 343 (72% de los aislados).
ResultadosEl 31,3% (489/1.562) de los niños eran portadores. El 61,7% (964/1.562) de los pacientes incluidos habían recibido al menos una dosis de la VCN7. El 12,8% (44/343) de los serotipos identificados eran serotipos vacunales. Fueron factores protectores independientes de colonización: el periodo de verano en todas las edades, la vacunación en el total de los niños (OR: 0,73; IC95%: 0,56–0,93; p=0,010) y en niños de 1año (OR: 0,6; IC95%: 0,42–0,84; p=0,002) y haber tomado antibióticos en el último mes en el total de la población (OR: 0,69; IC95%: 0,50–0,96). Por el contrario, para todo el grupo, la escolarización (OR: 1,85; IC95%: 1,27–2,18; p=0,001), el número de hermanos (OR: 1,31; IC95%: 1,01–0,91) y la exposición al tabaco (OR: 1,33; IC95%: 1,02–1,73) fueron factores de riesgo. Los serotipos 6A, 19A, 23B, 15A/B, 11A, 14, 23A/F, 3 y 19F fueron los más prevalentes.
ConclusionesLa proporción de serotipos vacunales encontrados fue baja, persistiendo el 14, el 23F y el 19F. Hallamos una alta prevalencia de serotipos 6A y 19A. El periodo estival, la vacunación y la administración previa de antibióticos demostraron ser protectores de la colonización; y la escolarización, el hábito tabáquico y el número de hermanos, facilitadores de la misma.
Streptococcus pneumoniae is a human pathogen that requires prior nasopharyngeal colonization to cause disease. An epidemiological study was conducted on nasopharyngeal carriers of pneumococci in healthy children in Murcia after the introduction of the VCN7, and immediately before the marketing of new vaccines, with the aim of determining the influence of vaccination in our geographic area, and other factors in relation to the state of being a carrier, and the different circulating serotypes.
MethodsA multicentre study was conducted in in 60 primary care health centres in summer 2009 and winter of 2010. A nasopharyngeal swab was collected, and an epidemiological study was carried out on 1562 children aged 1 and 4 years. Of the 1562 nasopharyngeal samples, pneumococci were found in 489 of them, with 343 of them able to be serotyped (70.2%).
ResultsThe prevalence of carriers was 31.3%. Of the patients included, 61.7% (964/1562) had received at least one dose of VCN7. Only 12.8% of the identified serotypes were vaccine serotypes. The independent protective factors against colonization were; Summer time in all age groups, previous vaccination in all the children (OR: 0.75; 95%CI: 0.56–0.93]; P=.01, and in 1-year-olds (OR: 0.6; 95%CI: 0.42–0.84; P=.002), and had taken antibiotics in the last month in the total cohort [OR: 0.69; 95%CI: 0.50–0.96). On the other hand, attendance at school or day-care centre (OR: 1.85; 95%CI: 1.27–2.18; P=.001), number of siblings (OR: 1.3; 95%CI: 1.01–1.91), and passive tobacco smoke exposure (OR: 1.33; 95%CI: 1.02–1.73), were colonization risk factors. The serotypes 6A, 19A, 23B, 15A/B, 11A, 14, 23A/F, 3 y 19F were the most prevalent.
ConclusionsA low proportion of SV was found, with 14, 23F and 19F are persisting. A high prevalence of serotypes 6A and 19A was found. Summer time, vaccination, and the prior administration of antibiotics proved to be protective against colonization, whereas schooling, smoking, and siblings contributed to it.
Streptococcus pneumoniae es uno de los patógenos más importantes en el hombre. Causa enfermedad invasiva grave (ENI), como sepsis, meningitis y neumonía, además de otros procesos menos graves pero mucho más frecuentes, como otitis y sinusitis, por lo que su impacto en la salud pública es muy elevado. La colonización de las vías aéreas, estado de portador (EPN), es un proceso dinámico en el que hay cambios de especies y serotipos. Es frecuente, generalmente asintomática y premisa necesaria para padecer una enfermedad por este microorganismo1,2. Este proceso está condicionado, entre otros factores, por la introducción de las vacunas antineumocócicas conjugadas, la presión antibiótica y la propia evolución temporal1,3. El porcentaje de EPN en la población pediátrica es muy alto, sobre todo en menores de 5años1,3,4, constituyendo el principal reservorio y siendo vectores de transmisión para el resto de la población4. Se han identificado múltiples factores favorecedores, siendo los más constantes la edad, la asistencia a guarderías y colegios, el mayor número de hermanos y las malas condiciones sociales1–3. Desde la introducción de la vacuna neumocócica conjugada heptavalente (VCN7), se ha observado en todo el mundo un descenso en la colonización de serotipos vacunales (SV) y un aumento de serotipos no vacunales (SNV). Se hacían necesarios estudios previos a la introducción de las nuevas vacunas conjugadas que aumentan la cobertura de los serotipos, con el objetivo de conocer, en nuestro ámbito geográfico, la influencia de la vacunación y de otros factores sobre el EPN y los diferentes serotipos circulantes y poder evaluar, en el futuro, los posibles cambios que puedan producirse.
Material y métodosRealizamos un estudio multicéntrico transversal en niños sanos de 1 y 4años de la comunidad autónoma de la Región de Murcia (CARM). La población de la CARM en 2009 era de 18.479 niños de 1año y de 17.555 de 4años (INE)5.
Criterios de inclusiónNiños sanos de 12meses (10–14meses) y de 4años (3,5–4,5años) vacunados o no con VCN7.
Criterios de exclusiónSujetos que presentaban procesos febriles o enfermedades crónicas, fibrosis quística o inmunodeprimidos.
En colaboración con la Asociación de Pediatría Extrahospitalaria y Atención Primaria de la Región de Murcia (APERMAP), participaron en el estudio 60 pediatras de atención primaria de la CARM en todas las áreas de salud excepto una (que representa únicamente el 10% de la población) y microbiólogos de los hospitales de cada área de salud, donde fueron analizadas las muestras recogidas. Se nombró un pediatra como coordinador de cada área hospitalaria participante y se incluyeron aquellos otros que de forma voluntaria quisieron participar, respetando una proporción entre el número de pediatras de cada área y el número y las características de la población atendida en ella. El estudio se realizó en niños sanos que acudían para la revisión en el «Programa del niño sano», de forma discrecional.
Recogida de datosSe realizó en 2 fases: entre junio-agosto de 2009, que denominaremos «verano» o «2009» y enero-marzo de 2010, que denominaremos «invierno» o «2010». Tras explicación verbal, se recogió consentimiento informado y se realizó un cuestionario epidemiológico que incluía los siguientes datos: centro de salud, fecha de recogida, edad, sexo, vacunación antineumocócica, lactancia materna y factores de riesgo, como escolarización/asistencia a guardería, antibióticos en el último mes, padres fumadores y número de hermanos. La información se recogió de forma preferente de la historia clínica y se completó, en los casos necesarios, mediante entrevista a los padres. El proyecto fue aceptado por la Fundación para la Formación e Investigación Sanitarias de la Región de Murcia (FFIS) y becado por el programa «Proyectos Fundación Cajamurcia» con la beca FFIS/CM09/037.
Procesamiento microbiológico de las muestrasLa toma de las muestras (exudado nasofaríngeo) se realizó mediante torunda pernasal por personal de enfermería de las consultas de pediatría de cada centro. Se remitieron a su hospital de área, donde se sembraron en placas de agar-sangre y se incubaron durante 24–48h en atmósfera de CO2 (5–10%) a una temperatura de 37°C. La identificación del neumococo se efectuó mediante la morfología de la colonia, sensibilidad a la optoquina y aglutinación. Tras su identificación, se congelaron en skim milk a –80°C y fueron remitidos al hospital de referencia, en el que se realizó el estudio de sensibilidades, y posteriormente se enviaron para su serotipado al Laboratorio Nacional de Referencia de neumococos del Instituto CarlosIII de Madrid.
Análisis estadísticoSe calculó el tamaño muestral en 318 niños en cada uno de los 4 grupos, suponiendo un 30% de portadores6,7, con una precisión del 5% para un nivel de confianza del 95%. Para la comparación de las medias se utilizó la prueba estadística t de Student. Para el estudio de asociación entre variables cualitativas se realizó análisis de tablas de contingencia empleando el estadístico chi-cuadrado de Pearson. Para la identificación de factores asociados al EPN de neumococo se realizó un análisis multivariante mediante regresión logística incluyendo todas aquellas variables que tenían —o estaban muy cercanas a— la significación estadística en el univariante. Se realizó, además, este mismo análisis estadístico estratificado para la edad. Todos los resultados se consideraron significativos para un valor α<0,05
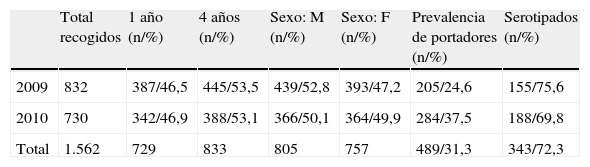
ResultadosSe incluyeron 1.562 niños; 729 de 1año (387 verano, 342 invierno) y 833 de 4años (445 verano, 388 invierno). El 61,7% (964/1.562) habían recibido al menos una dosis de VCN7 y el 58% (905/1562) habían recibido 2 o más dosis. El porcentaje total de EPN fue del 24,6% (205/832) en verano y del 37,5% (274/730) en invierno (OR: 0,63; IC95%: 0,51–0,77), y un valor medio, para toda la cohorte estudiada, del 31,3% (489/1.562) (tabla 1). Por edades, el 28,1% (204/728) y el 34% (285/834) de los niños de 1 y 4años, respectivamente, eran EPN (p=0,056), y por edades y periodos obtuvimos una prevalencia de colonización del 23,8% (92/386) en verano y del 32,7% (112/342) en invierno para niños de 1año (p=0,045) y del 25,8% (115/445) en verano y del 43,5% (170/388) en invierno para el grupo de 4años (p=0,0002). Por sexo, existió un mayor número de portadores en las niñas, tanto en verano (25,7% [103/396] vs 23,7% [104/439]), como en invierno (41,2% [149/364] vs 36,3% [133/366]), sin significación estadística. También observamos importantes diferencias entre algunas de las áreas (20% [23/112] en verano en el área de Lorca,y 60% [67/111] en invierno en el área de Murcia capital correspondiente al Hospital Clínico Virgen de la Arrixaca), mientras las demás permanecían cercanas a la media.
Datos generales y prevalencia de portadores por edad, sexo y periodo (343/489)
| Total recogidos | 1 año (n/%) | 4 años (n/%) | Sexo: M (n/%) | Sexo: F (n/%) | Prevalencia de portadores (n/%) | Serotipados (n/%) | |
| 2009 | 832 | 387/46,5 | 445/53,5 | 439/52,8 | 393/47,2 | 205/24,6 | 155/75,6 |
| 2010 | 730 | 342/46,9 | 388/53,1 | 366/50,1 | 364/49,9 | 284/37,5 | 188/69,8 |
| Total | 1.562 | 729 | 833 | 805 | 757 | 489/31,3 | 343/72,3 |
F: femenino; M: masculino; N: número niños de cada variable.
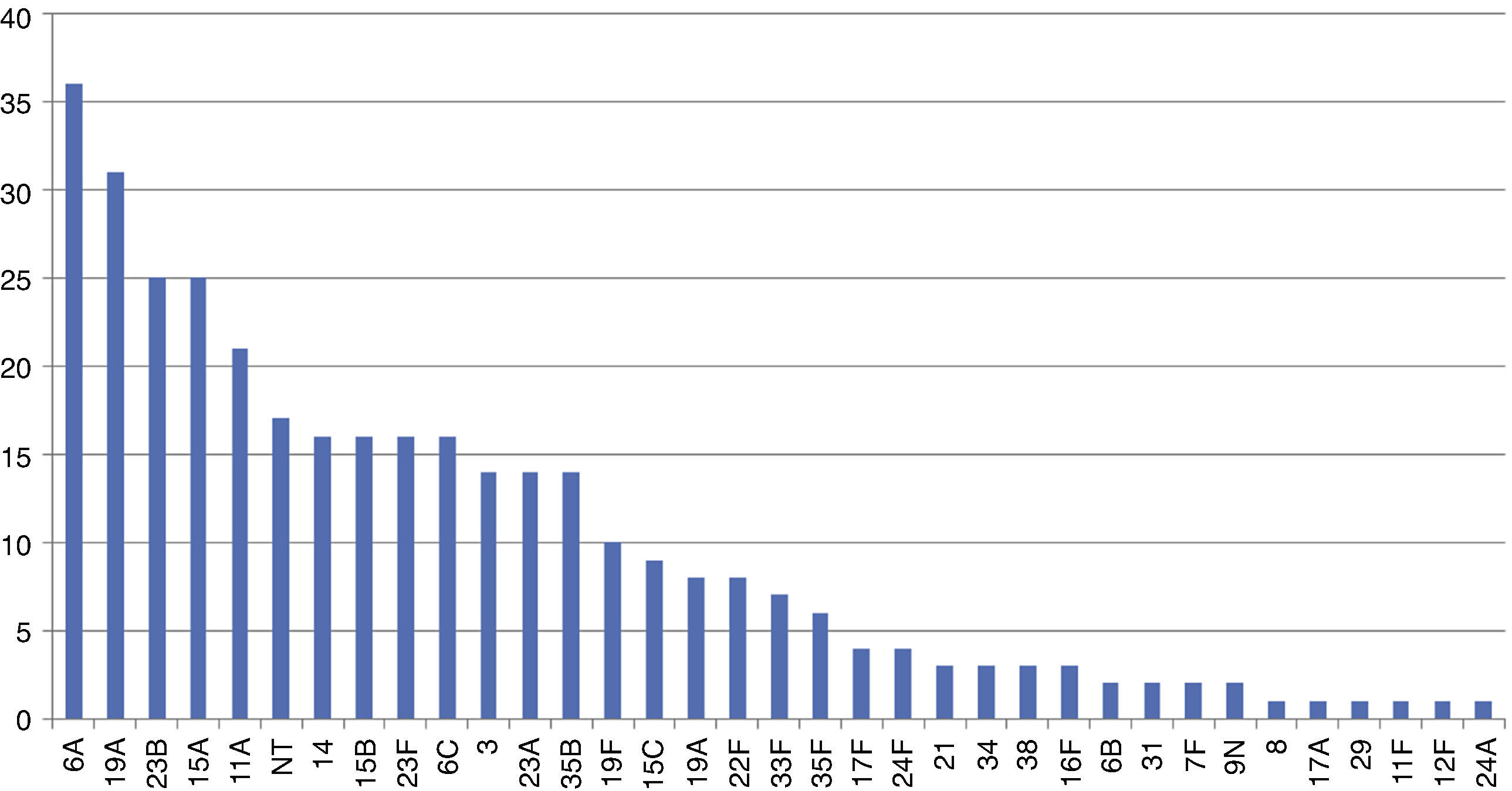
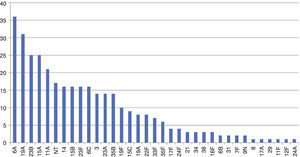
Los serotipos encontrados se reflejan en la figura 1. Destacan con más de 20 aislamientos los serotipos 6A con 35 (10,2%), 31 del 19A (9,2%), 25 del 23B y 15A (7,3%), 21 del 11A (6,1%), continuando con otros serotipos en menor número hasta un total de 35. No encontramos diferencias significativas en los serotipos de mayor prevalencia según el periodo estacional. En relación al 6A, encontramos una reducción en el EPN de los niños vacunados de un año con respecto a los no vacunados (5 de 88/15 de 59) (OR: 0,226; IC95%: 0,0779–0,6556) y del total del grupo (14 de 200/22 de 143) (OR: 0,456; IC95%: 0,225–0,92), pero no en los de 4años (9 de 112/7 de 81) (OR: 0,961; IC95%: 0,344–2,687). Solo el 12,8% de los serotipos encontrados eran SV y estarían cubiertos por la VCN7, el 13,4% por la decavalente y el 37% en la trecevalente.
El 29,4% (284/964) de los vacunados eran portadores frente al 34,8% (205/598) de los no vacunados (OR: 0,8; IC95%: 0,64–0,99; p=0,047). Entre los niños vacunados, el 9,5% (19/198) estaban colonizados por SV frente al 17,13% (25/145) de los no vacunados (OR: 0,55; IC95%: 0,29–1,04; p=0,07).
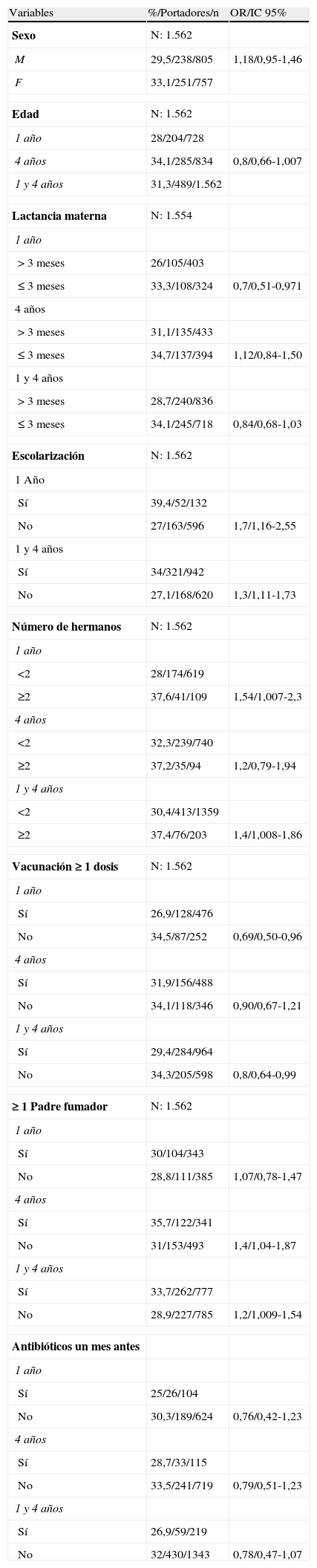
Realizamos análisis univariante de las variables sexo, edad, lactancia materna, exposición al tabaco, escolarización, número de hermanos, vacunación con al menos una dosis y administración de antibióticos en el último mes para analizar el EPN en general (tabla 2) y encontramos significación estadística como factores protectores la vacunación y la lactancia materna (>3 meses) en los niños de 1año, pero no en los de 4años. Como factores asociados al EPN encontramos la exposición al tabaco para todo el grupo (OR: 1,2; IC95%: 1,09–1,54) y para los de 4años (OR: 1,4; IC95%: 1,04–1,87); la escolarización en todos los grupos y el número de hermanos (≥2) en el grupo general (OR: 1,4; IC95%: 1,008–1,86) y en los de 1año (OR: 1,54; IC95%: 1,007–2,3). El uso de antibióticos un mes antes no alcanzó significación estadística como factor protector para el EPN en su conjunto (p=0,2). También realizamos el análisis univariante con las mismas variables para conocer los factores asociados al EPN de SV (tabla 3), encontrando que el haber tomado antibióticos un mes antes fue el único factor que tuvo influencia estadística en la colonización por SV en niños de 1año (OR: 4,36; IC95%: 1,41–13,4), en los de 4años (OR: 3,3; IC95%: 1,36–8,2) y en el total (OR: 3,7; IC95%: 1,8–7,47), de forma que los que habían tomado antibióticos el mes anterior tenían una significativa mayor probabilidad de estar colonizados por SV.
Análisis univariante de los factores asociados a colonización faríngea (343/489)
| Variables | %/Portadores/n | OR/IC 95% |
| Sexo | N: 1.562 | |
| M | 29,5/238/805 | 1,18/0,95-1,46 |
| F | 33,1/251/757 | |
| Edad | N: 1.562 | |
| 1 año | 28/204/728 | |
| 4 años | 34,1/285/834 | 0,8/0,66-1,007 |
| 1 y 4 años | 31,3/489/1.562 | |
| Lactancia materna | N: 1.554 | |
| 1 año | ||
| >3 meses | 26/105/403 | |
| ≤ 3 meses | 33,3/108/324 | 0,7/0,51-0,971 |
| 4 años | ||
| >3 meses | 31,1/135/433 | |
| ≤ 3 meses | 34,7/137/394 | 1,12/0,84-1,50 |
| 1 y 4 años | ||
| >3 meses | 28,7/240/836 | |
| ≤ 3 meses | 34,1/245/718 | 0,84/0,68-1,03 |
| Escolarización | N: 1.562 | |
| 1 Año | ||
| Sí | 39,4/52/132 | |
| No | 27/163/596 | 1,7/1,16-2,55 |
| 1 y 4 años | ||
| Sí | 34/321/942 | |
| No | 27,1/168/620 | 1,3/1,11-1,73 |
| Número de hermanos | N: 1.562 | |
| 1 año | ||
| <2 | 28/174/619 | |
| ≥2 | 37,6/41/109 | 1,54/1,007-2,3 |
| 4 años | ||
| <2 | 32,3/239/740 | |
| ≥2 | 37,2/35/94 | 1,2/0,79-1,94 |
| 1 y 4 años | ||
| <2 | 30,4/413/1359 | |
| ≥2 | 37,4/76/203 | 1,4/1,008-1,86 |
| Vacunación ≥ 1 dosis | N: 1.562 | |
| 1 año | ||
| Sí | 26,9/128/476 | |
| No | 34,5/87/252 | 0,69/0,50-0,96 |
| 4 años | ||
| Sí | 31,9/156/488 | |
| No | 34,1/118/346 | 0,90/0,67-1,21 |
| 1 y 4 años | ||
| Sí | 29,4/284/964 | |
| No | 34,3/205/598 | 0,8/0,64-0,99 |
| ≥ 1 Padre fumador | N: 1.562 | |
| 1 año | ||
| Sí | 30/104/343 | |
| No | 28,8/111/385 | 1,07/0,78-1,47 |
| 4 años | ||
| Sí | 35,7/122/341 | |
| No | 31/153/493 | 1,4/1,04-1,87 |
| 1 y 4 años | ||
| Sí | 33,7/262/777 | |
| No | 28,9/227/785 | 1,2/1,009-1,54 |
| Antibióticos un mes antes | ||
| 1 año | ||
| Sí | 25/26/104 | |
| No | 30,3/189/624 | 0,76/0,42-1,23 |
| 4 años | ||
| Sí | 28,7/33/115 | |
| No | 33,5/241/719 | 0,79/0,51-1,23 |
| 1 y 4 años | ||
| Sí | 26,9/59/219 | |
| No | 32/430/1343 | 0,78/0,47-1,07 |
F: femenino; IC 95%: intervalo de confianza al 95%; M: masculino; N: número total de la columna; n: número total cada variable; OR: odds ratio; %: relación entre portador y número total de cada variable.
Análisis univariante de los factores asociados a colonización faríngea por SV
| Variables | %/Portadores SV/n1 | OR [IC 95%] |
| Sexo | N: 343 | |
| M | 13,6/23/169 | |
| F | 12/21/174 | 0,74 [0,38-1,42] |
| Edad | N: 343 | |
| 1 año | 10,7/16/149 | |
| 4 años | 14,4/28/194 | 1,12 [0,60-2,11] |
| 1 y 4 años | ||
| Lactancia materna | N: 343 | |
| 1 año | ||
| >3 meses | 12/11/91 | |
| ≤ 3 meses | 8,6/5/58 | 1,4 [0,46-4,24] |
| 4 años | ||
| >3 meses | 14,5/16/110 | |
| ≤ 3 meses | 14,2/12/84 | 1,01 [0,45-2,26] |
| 1 y 4 años | 13,4/27/201 | |
| >3 meses | ||
| ≤ 3 meses | 11,9/17/142 | 1,12 [0,58-2,13] |
| Escolarización | N: 343 | |
| 1 año | ||
| Sí | 2,9/34/1 | |
| No | 13/15/115 | 0,22 [0,03-1,7] |
| 1 y 4 años | ||
| Sí | 12,9/29/224 | |
| No | 12,6/15/119 | 1,02 [0,52-1,99] |
| Número de hermanos | N: 343 | |
| 1 año | ||
| < 2 | 8,4/10/118 | |
| ≥ 2 | 19,3/6/31 | 0,43 [0,14-1,3] |
| 4 años | ||
| < 2 | 12,9/22/170 | |
| ≥ 2 | 25/6/24 | 0,5 [0,19-1,40] |
| 1 y 4 años | ||
| < 2 | 11,1/32/288 | |
| ≥ 2 | 21,8/12/55 | 0,5 [0,24-1,05] |
| Vacunación ≥ 1 dosis | N: 343 | |
| 1 año | ||
| Sí | 8/7/87 | |
| No | 14,5/9/62 | 0,5 [0,19-1,56] |
| 4 años | ||
| Sí | 10,8/12/111 | |
| No | 19,3/16/83 | 0,56 [0,2-1,24] |
| 1 y 4 años | ||
| Sí | 9,6/19/198 | |
| No | 17,2/25/145 | 0,55 [0,29-1,04] |
| ≥ 1 Padre fumador | N: 343 | |
| 1 año | ||
| Sí | 12,3/7/57 | |
| No | 9,7/9/92 | 1,2 [0,44-3,55] |
| 4 años | ||
| Sí | 12/10/83 | |
| No | 16,2/18/111 | 0,74 [0,32-1,7] |
| 1 y 4 años | ||
| Sí | 12,1/17/140 | |
| No | 13,3/27/203 | 0,91 [0,47-1,73] |
| Antibióticos un mes antes | N: 343 | |
| 1 año | ||
| Sí | 30/6/18 | |
| No | 7,6/10/131 | 4,36 [1,41-13,4] |
| 4 años | ||
| Sí | 37,6/9/24 | |
| No | 11,1/19/170 | 3,3 [1,36-8,2] |
| 1 y 4 años | ||
| Sí | 35,7/15/42 | |
| No | 9,6/29/301 | 3,7 [1,8-7,48] |
F: femenino; IC 95%: intervalo de confianza al 95%; M: masculino; N: número total de la columna; n1: número total de serotipados para cada variable; OR: odds ratio; %: relación entre portador y número total de cada variable; Portador SV: portador de serotipos vacunales.
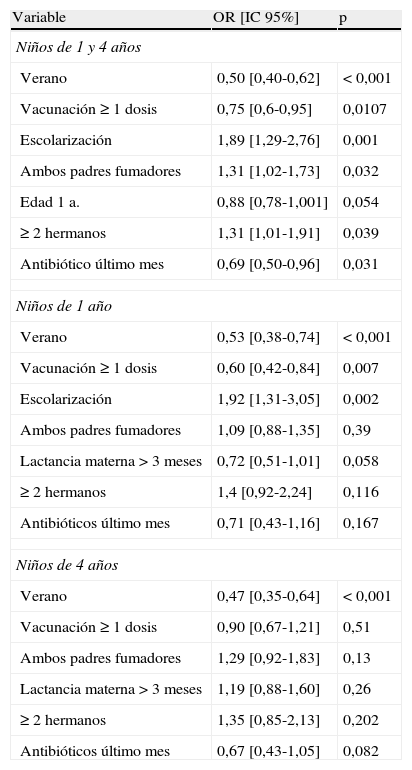
Una vez realizado el análisis univariante, realizamos un estudio multivariante para todos los EPN mediante un modelo de regresión logística, incluyendo todas las variables estudiadas en el univariante: sexo, lactancia materna, vacunación, estacionalidad, toma previa de antibióticos, escolarización, número de hermanos, exposición al tabaco y edad, y lo realizamos de forma global y por grupos de edad. Los resultados se resumen en la tabla 4 y reflejan, para el total del grupo, que la escolarización, tener 2 o más hermanos y ambos padres fumadores fueron factores de riesgo independientes. La vacunación, el periodo de verano y haber tomado antibióticos el último mes fueron factores de protección. Aunque hay una clara tendencia a que la edad de 1año sea también un factor protector, no alcanzó significación estadística. Cuando estratificamos por edad, solo el periodo estival y la vacunación fueron factores protectores para los de 1año, mostrando la lactancia materna durante más de 3meses (OR: 0,72; IC95%: 0,51–1,01) una gran tendencia. Para los de 4años el periodo estival fue el único factor influyente en la colonización. La asistencia a guardería fue un factor de riesgo en los niños de 1año. De la misma forma realizamos análisis multivariante de los factores asociados a EPN por SV. En la tabla 5 reflejamos las variables que han alcanzado significación estadística en cualquiera de los grupos. Observamos que la vacunación ejerció un efecto protector para el total del grupo y para los de 1año, pero no para los de 4años, y que el hecho de haber tomado antibióticos un mes antes fue un factor de riesgo en todos los grupos de edad.
Estudio multivariante de los factores asociados a colonización nasofaríngea
| Variable | OR [IC 95%] | p |
| Niños de 1 y 4 años | ||
| Verano | 0,50 [0,40-0,62] | < 0,001 |
| Vacunación ≥ 1 dosis | 0,75 [0,6-0,95] | 0,0107 |
| Escolarización | 1,89 [1,29-2,76] | 0,001 |
| Ambos padres fumadores | 1,31 [1,02-1,73] | 0,032 |
| Edad 1 a. | 0,88 [0,78-1,001] | 0,054 |
| ≥ 2 hermanos | 1,31 [1,01-1,91] | 0,039 |
| Antibiótico último mes | 0,69 [0,50-0,96] | 0,031 |
| Niños de 1 año | ||
| Verano | 0,53 [0,38-0,74] | < 0,001 |
| Vacunación ≥ 1 dosis | 0,60 [0,42-0,84] | 0,007 |
| Escolarización | 1,92 [1,31-3,05] | 0,002 |
| Ambos padres fumadores | 1,09 [0,88-1,35] | 0,39 |
| Lactancia materna>3 meses | 0,72 [0,51-1,01] | 0,058 |
| ≥ 2 hermanos | 1,4 [0,92-2,24] | 0,116 |
| Antibióticos último mes | 0,71 [0,43-1,16] | 0,167 |
| Niños de 4 años | ||
| Verano | 0,47 [0,35-0,64] | < 0,001 |
| Vacunación ≥ 1 dosis | 0,90 [0,67-1,21] | 0,51 |
| Ambos padres fumadores | 1,29 [0,92-1,83] | 0,13 |
| Lactancia materna>3 meses | 1,19 [0,88-1,60] | 0,26 |
| ≥ 2 hermanos | 1,35 [0,85-2,13] | 0,202 |
| Antibióticos último mes | 0,67 [0,43-1,05] | 0,082 |
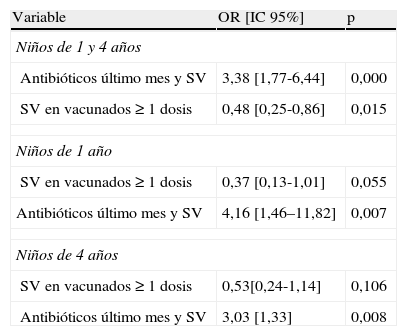
Estudio multivariante de los factores asociados a colonización nasofaríngea por serotipos vacunales (SV)
| Variable | OR [IC 95%] | p |
| Niños de 1 y 4 años | ||
| Antibióticos último mes y SV | 3,38 [1,77-6,44] | 0,000 |
| SV en vacunados ≥ 1 dosis | 0,48 [0,25-0,86] | 0,015 |
| Niños de 1 año | ||
| SV en vacunados ≥ 1 dosis | 0,37 [0,13-1,01] | 0,055 |
| Antibióticos último mes y SV | 4,16 [1,46–11,82] | 0,007 |
| Niños de 4 años | ||
| SV en vacunados ≥ 1 dosis | 0,53[0,24-1,14] | 0,106 |
| Antibióticos último mes y SV | 3,03 [1,33] | 0,008 |
Ocho años después de la introducción de la VCN7 y ante la inminente introducción de 2 nuevas vacunas que ampliaban el número se serotipos neumocócicos, pensamos que era un buen momento para realizar un estudio de EPN de este microorganismo en nuestro medio para de esta manera, conociendo la realidad del momento, poder valorar los cambios que pudieran producirse tras la implantación de estas nuevas vacunas. Nuestro principal objetivo era conocer la prevalencia de los serotipos de neumococo portados por niños de 1año, población sobre la que gravita el mayor peso de las formas de ENI8, y en los de 4años, la edad de mayor incidencia de colonización nasofaríngea1,8, y realizar este estudio en periodos estacionales diferentes9. Es difícil valorar el impacto de la vacunación sobre los EPN por la escasa uniformidad de los estudios poblacionales2, y más en nuestro país, en el que no ha habido una actuación uniforme, lo que hizo que las coberturas vacunales fueran dispares. En España, antes de la introducción de la VCN7 existían 2 estudios de EPN10,11, y posteriormente, ya con la vacuna en el mercado, secuencialmente en el tiempo se han realizado otros en distintas poblaciones, tanto de atención primaria como de urgencias hospitalarias o mixtos6,7,12. La prevalencia global de la colonización neumocócica fue del 31,3%, datos muy cercanos a los estudios españoles más recientes6,7, así como otros foráneos13,14. Sin embargo, existen en la literatura cifras muy variables, como el 80% en Noruega en 200815 o el 8,6% en Italia16 en el año 2000 y los recientes 12,6% en Taiwan17 y 15,7% en Hong-Kong18. En nuestro estudio, si separamos los niños por hospitales, también encontramos cifras muy dispares: en torno al 20% en verano en el área de Lorca y el 60% en invierno en un área de la capital, mientras que el resto de áreas tenía cifras medias. No tenemos una explicación clara para ello, aunque pensamos que la estacionalidad, que condiciona la escolarización, puede ser un factor decisivo, además de existir, por ser periodo estival, la posibilidad de que en alguna zona la toma de la muestra fuera recogida por personal menos entrenado.
Como serotipos más prevalentes encontramos que el serotipo 6A es el más frecuente (10,2%), seguido del 19A, el 23B, el 15A, el 11A, no tipables (NT), 14, 15B, 23F, 6C, 3, 23A, 35B y del 19F, siendo similares a los encontrados en Zaragoza y en Sevilla7,19. Entre los SV persisten, en nuestro estudio, el 23F, el 14 y el 19F; de forma significativa, teniendo también cierta similitud con estudios españoles7,19 y ante los cambios detectados, pensamos que pueden deberse a que se han realizado en años distintos y con coberturas vacunales distintas.
Respecto a los SNV, 6A, 19A, 23B, 15A/B,11A, 6C, 3, 23A y 35B son los más frecuentes y concordantes, de forma general, con los españoles y extranjeros4,7,13,19–22, exceptuando el 6A, para el que refieren una bajísima incidencia en algunos de ellos13,15,20, sin que haya una explicación convincente para ello. Algunos autores suponen que es por protección cruzada con el 6B13. En nuestro estudio el EPN para el 6A es significativamente menor en los vacunados tanto de un año (OR: 0,19; IC95%: 0,07–0,56) como en la población total (OR: 0,45; IC95%: 0,2–0,92), pero no para los de 4años (OR: 0,96; IC95%: 0,34–2,69), por lo que pensamos que existe una protección cruzada mayor cuanto más cercana a la vacunación y dependiente, por tanto, de la edad de los sujetos incluidos en cada estudio.
Como factores protectores, el periodo estival se demostró como el más importante en todos los grupos (24,6% [22% en vacunados y 27,7% en no vacunados], que en invierno se eleva al 38,7% [35,6% en vacunados y 40,1% en no vacunados]), cifras muy similares a las obtenidas por Lakshman et al.9. La influencia de la vacunación sobre el descenso de los SV es una observación unánime2, y en zonas con elevada cobertura vacunal estos son casi testimoniales, menores al 5%13,22,23. Encontramos un porcentaje de SV del 12,8%, muy similar a otros estudios15,20,24, ligeramente superior al 8,7 descrito en Zaragoza7 o en Grecia21 y menor que el de Sevilla (20%), que en ese momento tenía una tasa de vacunación inferior6. Sin embargo, sobre el EPN existen datos discordantes, encontrándose descensos significativos en unos trabajos4,22,23, pero no en otros13,15,24. Para nosotros, en el multivariante, la vacunación ejerció, en el total de la población, un efecto protector sobre los SV (p=0,015) y sobre el total de EPN (p=0,010). En el grupo de 1año se mantuvo el efecto protector para el EPN [OR: 0,6; IC95%: 0,42–0,84), pero no para los SV, aunque está muy cerca de él (OR: 0,37; IC95%: 0,13–1,01), posiblemente por tratarse de una muestra muy pequeña. No observamos efecto alguno para los de 4años. Este dato podría explicar, en parte, esas variaciones, ya que la mayoría de los estudios no separan grupos de edad.
La administración de antibióticos un mes antes disminuyó el porcentaje de EPN en el multivariante para el total de niños incluidos, pero no separados por edades. Si la relacionamos con los SV, observamos una elevación muy importante del riesgo de colonización por ellos. Esto ha sido observado por otros autores25, y se cree que, tras el aclaramiento producido en la nasofaringe tras la administración de antibióticos, hay una rápida sustitución por serotipos menos susceptibles, como los incluidos en la vacuna heptavalente25.
La edad es un factor de influencia sobre el EPN, siendo este más elevado entre los más pequeños13,20. Nosotros, sin embargo, no pudimos mostrar esta influencia. Por sexo, aunque el porcentaje de EPN fue más elevado en niñas, no fue significativo, al contrario de lo que ocurre en Sevilla6, donde la diferencia fue significativa, siendo los niños los más colonizados. La lactancia materna fue, solo en los niños de 1año, un factor de protección en el univariante (p= 0,04) y muy próximo en el multivariante (p=0,058). Finkelstein et al.25 obtuvieron resultados similares.
Como factores favorecedores de la colonización destacamos la escolarización, la exposición al humo de tabaco y tener 2 o más hermanos. La escolarización fue el factor favorecedor del EPN de mayor impacto y es el más reconocido en la literatura revisada1,3,6,7,13. La exposición al humo de tabaco en el análisis univariante fue un factor de riesgo significativo para todo el grupo y para los de 4años, aunque en el multivariante esta exposición solo se confirma en el total del grupo. Como posible explicación pensamos que los padres son muy conscientes del daño del humo de tabaco en los lactantes más pequeños, y que estos hábitos se relajan cuando el niño se hace mayor. Esta asociación fue observada en un metaanálisis realizado por Lee et al.26 y el amplio estudio de Taiwan17. El número de hermanos (2 o más) es un factor de riesgo asociado en el multivariante para el total del grupo, datos que concuerdan con otros estudios1,3,17
Fortalezas y debilidadesLas principales fortalezas de este trabajo estriban en el momento de su realización, justo antes de la comercialización de las nuevas vacunas, y la cantidad de muestras recogidas. Otro punto fuerte es que los datos epidemiológicos estaban recogidos en la historia clínica, por lo que no dependía, salvo raras ocasiones, de la memoria de los padres y evitan el sesgo ante preguntas «sensibles», como hábito tabáquico o duración de la lactancia materna. Sin embargo, como suele suceder en este tipo de estudios, no existe aleatorización previa, dado que la participación es voluntaria, por lo que podría ser una muestra no totalmente representativa. No se recogieron los datos de dosis y duración de la antibioterapia previa, ni se evaluaron las colonizaciones múltiples, lo que ha podido modificar los resultados finales.
ConclusionesEn este estudio hemos encontrado un porcentaje de SV relativamente bajo, con un porcentaje de EPN similares a los estudios previos realizados en nuestro país. Existen serotipos incluidos en la vacuna trecevalente (6A, 19A) con gran prevalencia en el estado de portador. Observamos una relativamente alta prevalencia del serotipo 3, más frecuente en niños mayores y adultos, y las ausencias esperadas, por su alta capacidad invasiva, del 1 y del 5 y baja del 7F. Se confirman la lactancia materna y la vacunación como factores protectores, y la escolarización, el número de hermanos y la exposición al humo de tabaco como factores de riesgo.
Anexo. Componentes del Grupo de estudio de Enfermedades infecciosas de la comunidad autónoma de MurciaPediatría:
H. U. V. Arrixaca: Ángela Casquet Barceló, Guillermo Nieves González, José M. Calderón Sánchez, Luisa Camps Martínez, Nadia Sayed Sancho, M. Ángeles Chumilla Valderas, Joaquina Villalobos Pérez, M. Matilde Cuenca Gómez, Fuensanta Costa Guirao, Begoña Pelegrin López, Rosario Hurtado del Cerro, José Saura Sánchez Parra, Francisco España, Inmaculada Martínez Artero.
H. U. Morales Meseguer: Antonio Iofrío de Arce, Luisa M. García Sandoval, Jesús Meca Garrido, Enrique Gutiérrez, Beatriz Garnica Martínez, Rosa M. Pérez Tomás, Esperanza Moreno Gomáriz, M. Dolores Hernández-Gil, M. José Vicente Fernández.
H. U. Reina Sofía: Gonzalo Sanz Mateo, Fuensanta Alemán Lorca, Alí Ghandour Houmani, Enrique López Conesa, Silvia Martínez García, Cristina Cañavate González, Mercedes Gutiérrez Pérez, y Antonio Lao García.
H. U. Los Arcos-Mar Menor: Rosa M. Sánchez Andrada, Isabel Cascales Barceló, María Vera Lorente, Maria Teresa José Hernangómez Cuesta, Monserrat Martínez López, Josefina Martínez Garre y Jose Maria Ojeda Escuriet.
H. U. Rafael Méndez: Sebastián Lorente García, Francisco Pérez Navarro, Carmen Nelia Vicente de Jiménez, Manuel García Moreno, Teresa Domínguez Rodríguez, Juan Francisco Soriano Ibarra y Francisco Jaldo Alba.
H. U. Sta. Lucía: M. Pilar Espejo García, M. Paz Ortuño del Moral, Lorena Conesa Hernández, M Dolores Rosique Conesa, Clara Ferrández García, Gloria Heredero García, Javier Peñalver Manrrubia, M. Teresa Fábrega Valverde, M. Eugenia Serna de Miquel, Eva Rodríguez Martínez, Ana González Pacanowska, Teresa Vidal Vidal.
H. U. Yecla-Altiplano: Juan José Vigueras Abellán, M. Eugenia Fuentes Sebastián, Josefina Romero Ortiz, Lucía González-Moro Azorín, José M. Ibáñez García y Víctor Sánchez Quiñones
Microbiología: Joaquín Ruiz Gómez, M. Luisa López Yepes, Carmen Guerrero Gómez, Ana Blázquez Abellán, M. Luz Núñez, José M. Zarauz García, M. Mar Ortiz Romero, Margarita Pérez Simón.
FinanciaciónEste proyecto ha sido aceptado por la Fundación para la Formación e Investigación Sanitarias de la Región de Murcia (FFIS) y becado por el programa «Proyectos Fundación Cajamurcia» con la beca FFIS/CM09/037.
Conflicto de interesesSantiago Alfayate ha recibido honorarios de Pfizer por conferencias y Asunción Fenoll ha recibido honorarios de Pfizer por conferencias y reuniones de asesoramiento y de GlaxoSmithKline por conferencias. El resto de los autores declaran no tener ningún conflicto de intereses.
A Guadalupe Ruiz Merino, de la Unidad de Apoyo Metodológico de la Fundación para la Formación e Investigación Sanitarias, por la realización del proceso estadístico.
Los nombres de los componentes del Grupo de estudio de Enfermedades infecciosas de la comunidad autónoma de Murcia están relacionados en el anexo.