Este documento fue preparado por un grupo multidisciplinario de expertos seleccionados por la Asociación Colombiana de Infectología (ACIN) para poner al día las recomendaciones previas dadas por nuestro grupo en cuanto a la inmunización del adolescente, de la población adulta y de aquellos mayores de 60 años de edad. Para este último grupo, hemos decidido, como lo han hecho en otros países, el inmunizar a esta edad (y no después), debido a la carga de enfermedad incrementada por afecciones respiratorias y otros factores propios para América Latina y las condiciones socioeconómicas de nuestro país.
Esta edición reescribe ciertos párrafos y actualiza en parte las recomendaciones hechas anteriormente y publicadas en Infectio en mayo de 2012. Las guías están orientadas al uso por aquellos que cuidan de estos pacientes y hacemos énfasis en el anciano, el inmunocomprometido y en aquellos que sufren de varias comorbilidades. Aunque en un momento dado el documento pudiera parecer incompleto, la intención deseada fue la de abarcar los recientes cambios en la administración de nuevas vacunas y otros regímenes en dosificación. Se incluye por primera vez el uso de las vacunas de 4valencias contra la influenza. El uso de la vacuna contra el herpes zóster se discute, y se toma un cuidado especial en cuanto a la redacción del «cuándo y por qué» de la vacunación contra Streptococcus pneumoniae. En la administración de esta vacuna, el tiempo de aplicación y la secuencia asociada con la aplicación de la administración de la vacuna polisacárida de 23 valencias puede variar de acuerdo con la edad del paciente, las comorbilidades y en aquellos previamente vacunados con dicha vacuna. Finalmente, exponemos las nuevas recomendaciones de vacunación contra fiebre amarilla y dengue y le damos la bienvenida a la vacuna nonavalente contra el virus humano del papiloma.
This document was prepared by a multi-disciplinary panel of experts who have been selected by the Asociación Colombiana de Infectologia (ACIN) to revise and update previous recommendations (by our group) for the immunization of adolescents and adult population and those older than 60 years of age. For the latter group, we have chosen to move forward, like many others, and immunize them at that age because of the particular burden of disease due to respiratory conditions, and other factors strictly related to Latin America and Colombian socio-economic conditions.
This edition replaces in part, updates or ads to previous recommendations published in Infectio, May 2012. The guidelines are intended to assist those caring for these patients, and emphasizes on the elderly, the immunocompromissed and on those who suffer from several co-morbidities. The contents of the guidelines could seem incomplete at some point; nevertheless, they were purposefully thought as such to embrace on major changes in new vaccines or new dosing regimens. It is included for the first time the use of cuadri-valent vaccines against influenza. The use of herpes zoster vaccine is discussed and special care is placed in the phrasing for the reader so he (she) understands the «when and why» of vaccine administration against Streptococcus pneumoniae. With pneumococcal vaccines, timing of administration may vary according to age, co-morbidities and in those previously vaccinated with the 23-polyvalent polysaccharide vaccine. There are new recommendations for the vaccination against yellow fever and dengue and we welcome the new nona-valent vaccine against the human papilloma virus.
El presente documento corresponde a la tercera actualización de las guías de inmunización para el adulto (1999, 2012, 2016), con la intención de darle una estructura más formal y confiable al calificar mediante el sistema GRADE1 de nuevo cada una de las recomendaciones, de manera que el usuario pueda entender la validez de cada una de estas y la fuerza de la recomendación. No muchos meses después de la segunda publicación en el suplemento de 2012, ocurrían cambios en cuanto al desarrollo de nuevas vacunas, y estudios como CAPITA2 marcaban un hito en inmunización contra Streptococcus pneumoniæ (S. pneumoniæ), al escoger una población no previamente inmunizada contra este germen y actuar de forma aleatorizada en la selección de pacientes, de forma prospectiva y con valoración doble ciego: se demostró por primera vez la efectividad vacunal contra neumonía en el paciente sano y mayor de 65años de edad con enfermedades de base y, a la vez, se demostró su eficacia contra enfermedad invasiva.
En nuestra edición previa, se incluyeron en el contenido los posibles beneficios de la aplicación de la nueva vacuna contra S. pneumoniæ pero circunstancialmente en ese momento de la publicación, entidades como el Advisory Committee for Immunization Practices (ACIP) y otras posteriormente, concurrieron en dar claridad en el uso de las 2vacunas existentes en poblaciones con inmunocompromiso y también en aquellos con enfermedades crónicas. Por lo tanto, en esta publicación se reflejan y aclaran estos cambios, aunque aún el Centers for Disease Control (CDC) no haya formalizado estas sugerencias. Acompañando la prevención de enfermedad respiratoria, se discute ahora la inmunización contra influenza con la utilización de inmunógenos que incluyen las 4cepas circulantes que causan la enfermedad en los diferentes continentes, lo que conlleva un aumento en la concordancia entre las cepas contenidas en las vacunas y las cepas circulantes.
En un capítulo siguiente, se discute la propuesta generada por los miembros de la ACIP3 en cuanto a las nuevas recomendaciones de vacunación contra fiebre amarilla e igualmente se dan guías preliminares de inmunización contra otro flavivirus, el dengue. Más adelante se amplían y aclaran las necesidades y recomendaciones de vacunación contra herpes zóster (HZ), enfermedad que representa una alta carga para el adulto y el inmunocomprometido, e igualmente se ilustran las indicaciones y contraindicaciones en el uso de esta vacuna atenuada mientras esperamos en un futuro no muy lejano una vacuna con un perfil superior de seguridad y protección.
En otros capítulos, hacemos énfasis en la vacunación a la mujer en cuanto a la inmunización contra el virus del papiloma humano con un inmunógeno de 9valencias contra las cepas más frecuentes y se insiste de forma más autoritaria y clara en la inmunización contra influenza en el embarazo y contra pertusis en cada uno de los embarazos. Los temas de inmunización en pacientes con enfermedad autoinmune, inflamatoria y trasplante de médula ósea también hacen parte de esta guía.
Si bien el tema no es tratado en detalle en este documento, aunque sí en el anterior, no podemos sino insistir en que, en este siglo, la vacunación en el consultorio pediátrico ya no es el estándar, aunque ciertamente sí un complemento. Hoy día, debemos estar encaminados a adquirir una política de institucionalización de la vacunación como cualquier otro procedimiento médico, en el que todos los operadores en salud estén alineados en esta maniobra preventiva, atiendan los conceptos básicos de inmunización y puedan aprovechar la oportunidad de vacunar en los hospitales y centros de atención médica. Lo anterior está especialmente dirigido a aquellos pacientes que por edad o por presentar mayor riesgo de enfermedad y complicaciones necesiten más de esta importante herramienta.
Metodología y forma de usar este documentoEl grupo de trabajo se reunió a finales del 2014 para determinar, en particular, los temas pertinentes a esta revisión. Una buena mayoría de los participantes trabajaron previamente en la edición del 2012. Fueron asignados de tal manera que se constituyera un grupo multidisciplinario representado por varias sociedades incluyendo geriatría, medicina interna, hematología, cardiología y neumología, ginecología y obstetricia, reumatología, pediatría, enfermedades infecciosas y epidemiologia clínica. Este último, en particular, para revisar la validez de muchos de los artículos. Después de una reunión presencial donde se propusieron los temas más importantes y se atendieron nuevas propuestas en inmunización que ya estaban siendo discutidas por las agencias americanas y europeas ACIP y CDC 3, así como por el European Center for Disease Control (ECDC)4 entre las más importantes. Otros artículos examinados por los diferentes miembros no fueron sujetos estrictamente a fechas de publicación, aunque la gran mayoría correspondieron a los años 2010 al 2015.
Después de trabajar por varios meses, y haber oído las presentaciones de varios de los temas, 3de nosotros, incluyendo el editor principal y el epidemiólogo clínico, contribuimos a mejorar la redacción de los textos y a discutir la validez de las calificaciones que fuesen apropiadas para nuestro territorio. El sistema americano de calificación (IDSA, United States Health Service Grading System for ranking recommendations in clinical guidelines)5 usado en diferentes disciplinas médicas, es un sistema en el que se usan letras (A, B, C, D, E) que indican la validez y fuerza de la recomendación acorde con la evidencia presentada y números (I, II y III) que indican la calidad de los estudios para dar soporte a la fuerza de la recomendación.
Los siguientes indicadores hacen parte igualmente del sentido general para dar el soporte a favor o en contra de una recomendación: la seguridad de una vacuna, la carga de enfermedad en nuestro país, y la eficacia y efectividad sobre una población determinada. Es decir, en la balanza se compara el posible beneficio de una vacuna frente a la posible reacción adversa en el vacunado. En nuestro caso, no nos esforzamos por dar una calificación relacionada necesariamente con costos, ya que la mayoría de la literatura se origina en otros países, y más bien nos propusimos presentar las recomendaciones más actualizadas usando los biológicos existentes al día. Cabe anotar que en este manuscrito hay cierta heterogeneidad en los diferentes capítulos; en algunos, en donde hay nuevos conceptos y diferencias radicales sobre antiguas recomendaciones, los autores añaden un resumen de la evidencia que explica el nuevo fraseado y conductas, y en otros, el autor se limita a hacer la mejor redacción del texto, usualmente con la añadidura de referencias bibliográficas.
Aclaramos aquí que las políticas gubernamentales de vacunación tanto en niños como en adultos no son regidas por nosotros y son más bien acordadas por comités especializados, en los que, además, se discuten las posibilidades económicas de inmunizar a uno u otro grupo poblacional y la costo-efectividad de la maniobra. Nuestra función e intención es mostrar al lector la situación actual en la inmunización del adulto y las mejores opciones para los diferentes pacientes.
La calidad y fuerza de la evidencia que dan soporte a nuestras recomendaciones se indica de la siguiente manera en la tabla 1.
IDSA. Servicio de Salud Pública de los Estados Unidos. Sistema de calificación para recomendaciones en guías clínicas
| Fuerza de la recomendación | |
| A | Buena evidencia que da soporte a la recomendación para el uso de la vacuna y siempre debe ser ofrecida al paciente |
| B | La evidencia es moderada para el uso de la vacuna y en general la vacuna debe ser ofrecida al paciente |
| C | La evidencia es pobre para dar la recomendación y es opcional |
| D | La evidencia es moderada en contra de la administración de este inmunógeno |
| E | La evidencia es clara contra el uso de esta vacuna y la recomendación va en contra del uso del inmunógeno |
| Calidad de la evidencia | |
| I | La evidencia proviene de ensayos clínicos bien diseñados y controlados y aleatorizados satisfactoriamente |
| II | La evidencia proviene de un ensayo bien diseñado sin aleatorización; generalmente de estudios de cohortes y control de casos y análisis de casos o de múltiples series y resultados contundentes |
| III | Usualmente es una evidencia que proviene de autoridades respetadas con base en experiencia clínica, estudios descriptivos y reportes de comité de expertos |
Nota: Adaptado del sistema canadiense del capítulo de examinación periódica de salud6.
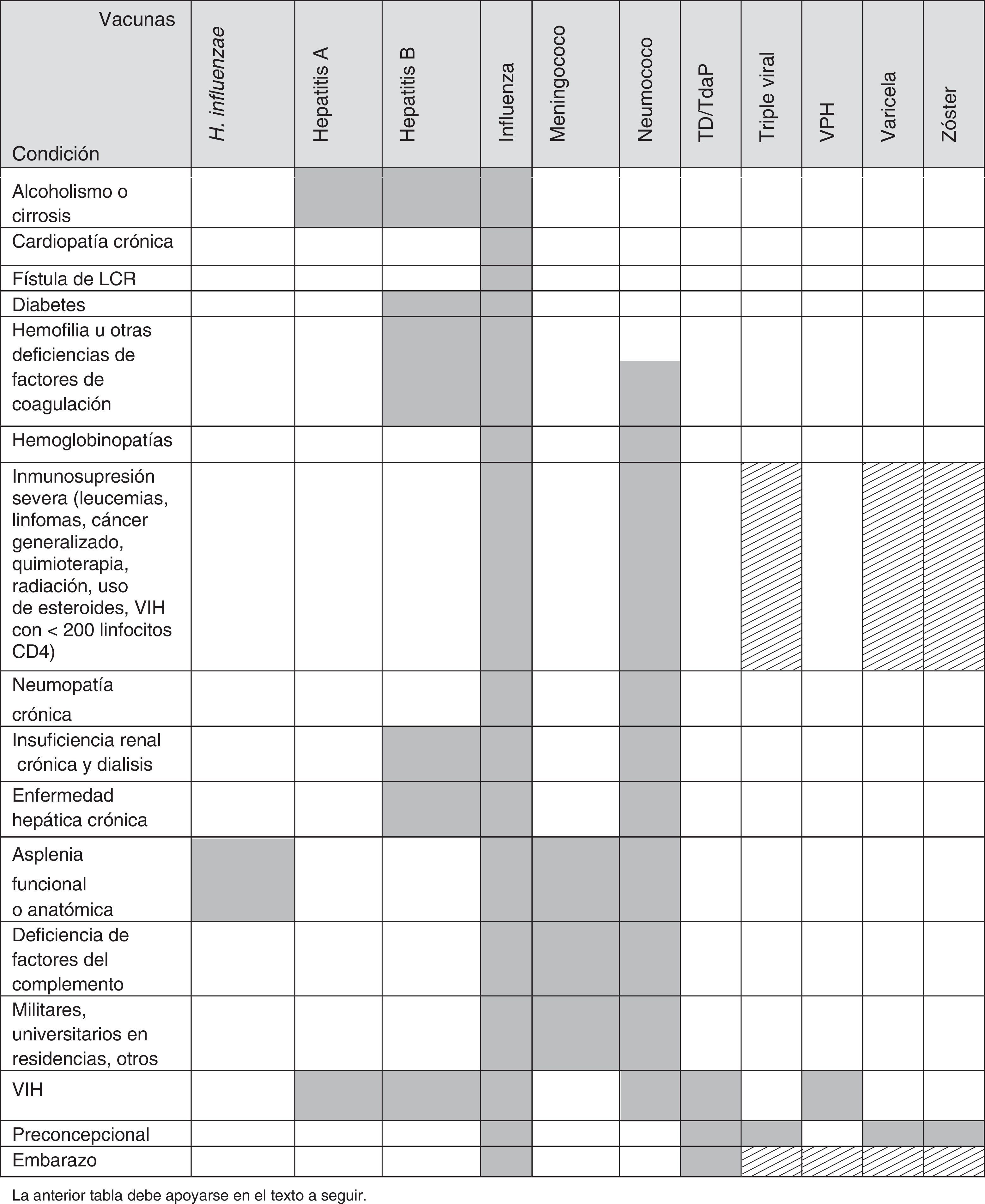
Las tablas 2 y 3 se han diseñado para que, con una mirada rápida, se obtenga una orientación sencilla en la inmunización para el paciente según criterios de edad e, igualmente, para aquel que sufre de enfermedades crónicas o que lo comprometen inmunológicamente. En las tablas no se dan calificaciones ya que cada una de estas está calificada posteriormente.
Vacunación de acuerdo con la edad
Gris: indicada para este grupo etario; rayas horizontales: indicada en presencia de factores de riesgo o condiciones adicionales; rayada oblicuamente: contraindicada.
a Aprobada por INVIMA entre los 9 y los 45 años en mujeres. En hombres hasta los 26 años la vacuna de 4valencias.
b En viajeros y grupos de riesgo. Revisar condiciones de ingreso a cada país para necesidad de revacunación. Por OMS y ACIP solo una dosis en la vida es suficiente.
c Para nacidos después de 1966 en Colombia.
d Aplicar Td cada 10 años. Ver texto para TdaP en mujeres.
e Indicada hasta 55 años en vacuna conjugada. Se puede administrar vacuna polisacárida a mayores de 55 en grupos de riesgo.
f Vacunación con 13 serotipos conjugada, seguida al año o 6meses por polisacárida de 23 serotipos (ver texto).
g Aplicar a menos que la persona haya recibido vacuna contra varicela anteriormente.
Para facilitar la comprensión del texto, se han añadido los siguientes términos que aparecen en los capítulos siguientes.
- •
Adolescente: persona mayor de 11 años y que no ha cumplido 19.
- •
Adulto: persona mayor de 19 años.
- •
Adulto joven: persona entre los 19 y 60 años.
- •
Adulto mayor o anciano: persona mayor de 60 años.
- •
Con respecto a definición de enfermedad crónica o comorbilidades son: enfermedad respiratoria crónica como la enfermedad pulmonar obstructiva crónica, bronquiectasias, fibrosis quística, fibrosis pulmonar intersticial, displasia broncopulmonar, alcoholismo, asma y consumo de cigarrillo; hepatopatía; enfermedad neurológica crónica; diabetes mellitus; enfermedad cardiaca crónica como enfermedad coronaria isquémica, congénita, hipertensión arterial complicada; enfermedad hepática crónica como cirrosis, atresia biliar, hepatitis crónica.
- •
Con respecto a la definición de paciente inmunocomprometido: paciente con enfermedad renal crónica con insuficiencia, trasplante renal, síndrome nefrótico, asplenia o disfunción esplénica como en anemia de células falciformes. Presencia de fístula de líquido cefalorraquídeo por trauma o por cirugía, implantes cocleares, inmunosupresión por medicamentos, cáncer, mieloma múltiple, leucemia o linfoma entre otras; administración de quimioterapia o infección por virus de la inmunodeficiencia humana (VIH) o paciente que toma glucocorticoides sistémicos por más de 2semanas a una dosis equivalente a 20mg diarios de prednisolona, entre otras.
- •
Con respecto a las siglas que identifican ciertas vacunas:
- ∘
PCV13: vacuna conjugada con proteína 13-valente contra neumococo.
- ∘
PPSV23: vacuna polisacárida 23-valente contra neumococo.
- ∘
MCV4-D meningococcal conjugated cuadri-valent vaccine.
- ∘
MCV4-CRM: vacuna conjugada con proteína CRM 197.
- ∘
MPSV4: vacuna polisacárida.
- ∘
MenB-4C compuesta de proteínas recombinantes Neisserial adhesin A (NadA), factor H binding protein y Neisserial heparin binding antigen (NHBA) y outer membrane vesicles.
- ∘
MenB-FHbp: factor H binding protein, por sus siglas en inglés.
- ∘
CYD-TDV: chimeric yellow dengue vaccine.
- ∘
Con respecto a la definición de paciente con alto grado de inmunosupresión: pacientes que reciben quimioterapia por cáncer, el paciente con enfermedad por VIH con recuento de células CD4 < 200/mm (<15% de CD4), el que recibe 20mg o más de prednisona por más de 14 días consecutivos o su equivalente para otros corticosteroides, el que recibe más de 0,4mg/kg/semana de metotrexato, el que toma más de 3mg/kg/día de azatioprina o 1,5mg/kg/día de mercaptopurina o recibe inhibidores de factor de necrosis tumoral como etanercept, adalimumab, infliximab y, especialmente, si recibe inhibidores del CD20 (rituximab o similares).
Capítulo 1. Inmunización contra influenza y herpes zóster en adultos y mayores de 60 años de edadEn este capítulo, se incluyen únicamente las vacunas contra HZ e influenza. Más adelante somos explícitos en cuanto a la vacunación contra S. pneumoniae y la inmunización contra pertussis y otras que también están indicadas para esta población, como se advierte en la edición de la revista Infectio del 2012 y en otros textos7–13.
Influenza- •
La vacunación contra influenza está claramente indicada en población cautiva (hogares geriátricos, centros de día, clubes de ancianos y comedores comunitarios, entre otros) (AII).
- •
La vacunación contra influenza se recomienda en toda persona mayor de 60 años de edad, sana o con enfermedades asociadas (AII).
- •
En Colombia se debe administrar la vacuna disponible y aprobada para nuestro territorio, de acuerdo con las recomendaciones hechas por los expertos (usualmente cepa sur) y las entidades administrativas sanitarias (BIII).
- •
Idealmente se prefiere administrar la vacuna tetravalente para evitar la posible discordancia entre cepas vacunales y salvajes circulantes (BIII).
- •
La inmunización contra influenza del personal de salud y cuidador de la persona mayor podría disminuir la infección en el anciano y viceversa (BIII).
- •
En población cautiva (hogares geriátricos, centros de día, clubes de ancianos y comedores comunitarios, entre otros), se debe tener actualizado el carné de vacunación y, en caso de que no esté completo, aplicar las vacunas contra influenza, neumococo y otras, a necesidad (BIII).
- •
La vacunación contra influenza y HZ puede ser realizada en el mismo día (BII).
- •
La respuesta de anticuerpos para HZ medida por ELISA es menor cuando se administra simultáneamente con la vacuna polisacárida 23-valente contra neumococo (PPSV23) por lo que no se deben administrar estas 2vacunas en el mismo momento. Treinta días entre la aplicación de las 2vacunas es el tiempo mínimo permitido (DIII).
- •
La inmunización contra HZ está indicada en mayores de 50 años sanos que desean evitar la aparición de zóster. Está contraindicada en individuos inmunosuprimidos (BIII).
- •
Los beneficios de la vacuna atenuada contra HZ encuentran mayor costo-efectividad para la población entre los 60 a 69 años de edad, sin embargo, se puede administrar después de esta edad (AIII).
- •
No hay datos que indiquen el intervalo de tiempo óptimo para la vacunación en el paciente que ha sufrido previamente de HZ. Aunque el beneficio de la vacunación para prevención de recurrencias es cuestionable en el inmunocompetente, se propone la administración de la vacuna no antes de un año de haber presentado el episodio clínico de HZ (CIII).
- •
Si hay necesidad de administrar de forma simultánea las vacunas contra HZ y antineumocóccica PCV13, se puede hacer (AII). La aplicación previa de dos dosis de vacuna antivaricelosa es una indicación en contra de administrar la vacuna cntra zoster en ese individuo (DII).
Consideramos que este capítulo debe aclarar suficientemente las indicaciones de inmunización contra S. pneumoniae, igualmente las edades y los espacios y orden en que se deben aplicar los 2tipos de vacunas en el mercado. Debemos insistir en que se debe aprovechar al máximo la «oportunidad de vacunación» cuando tenemos a un paciente que sufre de varias comorbilidades, está inmunocomprometido o bien es mayor de 60 años de edad, y usar el mismo momento para la aplicación de la vacuna contra influenza y aquella contra neumonía.
Adolescentes- •
Se recomienda que todo adolescente que haya sido previamente vacunado con PCV13 por las condiciones anotadas arriba según inmunocompromiso reciba una dosis de PPSV23 después de 8 semanas de haber recibido PCV13. Debe ser repetida (PPSV23) en una única dosis a los 5 años si persisten las condiciones de riesgo (AIII).
- •
Se recomienda que todo adolescente que ya fue previamente vacunado con PPSV23, y que amerite ser vacunado con PCV13 por condiciones de inmunocompromiso, lo haga por lo menos después de 8 semanas de la aplicación de PPSV23. La vacuna PPSV23 se debe repetir en una única dosis 5 años después de la aplicación de la primera PPSV23 (AII).
- •
Todos los adultos de cualquier edad y con condiciones de inmunocompromiso o comorbilidades ya mencionadas deben ser inmunizados con PCV13 y PPSV23. (AII/III).
- •
Si un adulto sano mayor de 50 años desea ser inmunizado contra enfermedad invasiva y neumonía por S. pneumoniæ, se recomienda que sea vacunado con la vacuna PCV13 (AII).
- •
Se recomienda que todo adulto que ha recibido PCV13 por inmunocompromiso reciba una dosis de PPSV23 a las 8 semanas después de la aplicación de PCV13 y sea repetida una única dosis de PPSV23 en 5 años a partir de la dosis previa de PPSV23 (AII).
- •
Se recomienda que todo adulto previamente inmunizado con PPSV23 por cualquier razón y que amerite ser vacunado con PCV13 por presentar una de las condiciones de inmunocompromiso mencionadas arriba, espere por lo menos un año desde la aplicación de PPSV23 para recibir la vacuna conjugada PCV13 (AII).
- •
Se recomienda que todo adulto con enfermedades crónicas sea inmunizado contra neumococo, empezando con PCV13 (vacuna conjugada) (AIII).
- •
La vacuna PCV13 puede ser coadministrada con la vacuna inactivada contra influenza (AII).
- •
Se recomienda no administrar la vacuna atenuada contra HZ de manera simultánea con PPSV23 y debe esperarse por lo menos un mes entre la aplicación de las vacunas (DIII).
- •
Las mujeres, estén embarazadas o no, pueden seguir las recomendaciones de inmunización contra S. pneumoniæ. No hay estudios del uso de vacuna conjugada PCV13 en gestación, pero no se esperan eventos adversos para ellas o el fruto de su embarazo (CIII).
Se recomienda que todo anciano sano reciba inicialmente la vacuna PCV13, si previamente no ha sido inmunizado con esta. Lo anterior, para disminuir el riesgo de enfermedad invasiva y neumonía por S. pneumoniæ (AII).
Un adulto sano que ha sido inmunizado con PCV13 antes de los 60 años, una vez los cumpla se recomienda que reciba una dosis de vacuna polisacárida PPSV23. Es necesario, de todas maneras, que hayan pasado 12 meses de la aplicación de la vacuna PCV13 o, por lo menos, 6meses para aplicar PPSV23 (AII, CIII, respectivamente).
Un adulto sano que ha adquirido inmunocompromiso y ha sido inmunizado con PCV13 antes de los 60 años, una vez los cumpla se recomienda que reciba una dosis de vacuna polisacárida PPSV23. Es necesario en este caso, que hayan pasado 8 semanas desde la aplicación de PCV13 (BII).
Todo adulto mayor de 60 años debe recibir una dosis de PPSV23, aunque haya recibido una dosis antes de dicha edad, pero la diferencia entre la aplicación de estas 2debe ser de por lo menos 5 años (AII).
Se recomienda que el anciano que ha recibido PPSV23 previamente y no ha recibido PCV13, la reciba después de un año de haber recibido PPSV23 (AII).
Uso de PCV13+PPSV23 en adultos sanos e inmunocomprometidos entre los 19 y 59 años de edad. Resumen de la evidenciaDesde el 20 de junio del 2012, el ACIP dio recomendaciones de inmunizar contra neumococo con PCV13 a adultos inmunocomprometidos. Las condiciones de inmunosupresión pueden ser variadas y se destacan arriba en el glosario. La vacuna fue inicialmente aprobada en los Estados Unidos para su uso en mayores de 50 años, en diciembre del 2011, después de que Colombia lo hiciera en abril del mismo año como el primer país en el mundo en conceder dicha aprobación. De igual forma y como estaba aprobado anteriormente, se ha recomendado la administración de PPSV23. La evidencia para dichas recomendaciones (el uso asociado de los 2inmunógenos) se ha calificado mediante el sistema GRADE como de categoría fuerte o A1,14.
El punto clave es que la incidencia de enfermedad invasiva por neumococo en esas edades es causada, en el 50% de las ocasiones, por serotipos contenidos en la vacuna de 13 valencias (PCV13) y el 21%, adicionalmente, están solo incluidos en la vacuna polisacárida de 23 valencias (PPSV23); de ahí que las recomendaciones dadas se hayan dirigido a esta población inmunocomprometida, que está especialmente en riesgo, pues la incidencia de enfermedad puede multiplicarse de 6a 20veces al comparar con la incidencia de enfermedad invasiva en aquellos mayores de 65 años sanos. Tal es el caso, por ejemplo, para aquellos que sufren de cáncer hematológico o VIH15.
Dos estudios originales realizados en América y Europa fueron conducidos en adultos inmunocompetentes y compararon la inmunogenicidad entre la vacuna conjugada PCV13 y la polisacárida PPSV23. Los resultados de medición de anticuerpos por opsonofagocitosis (la capacidad demostrada in vitro por un anticuerpo en causar efecto bactericida) demostraron títulos iguales o más altos para la vacuna conjugada PCV13 en la mayoría de los serotipos compartidos en las 2vacunas e igualmente se mostró que la aplicación inicial de la vacuna PPSV23, administrada antes que PCV13, se asoció con disminución de la producción de anticuerpos efectivos (PPSV23+PCV13)16.
Está claro que no hay muchos estudios en cuanto al uso de PCV13 en pacientes con diferentes grados de inmunocompromiso, sin embargo, estudios previos con PCV7 en Malawi demostraron eficacia vacunal del 75% en la prevención de enfermedad invasiva por neumococo (IPD, por sus iniciales en inglés)17.
En otro estudio realizado en pacientes con VIH y recuentos de células CD4 mayor a 200/mm, se obtuvo mejor respuesta de anticuerpos usando PCV7 al compararlo con aquellos que recibieron PPSV2318–21.
La evidencia en cuanto al uso de PPSV23 en la población inmunocomprometida por VIH es aún más imprecisa. Sin embargo, se ha concluido, mediante el uso del sistema GRADE y el consenso de muchos expertos, que los efectos potencialmente benéficos en la población inmunocomprometida son mayores que la posibilidad de un efecto deletéreo cuando se usan los 2inmunógenos en una forma secuencial. Obviamente, considerar la carga de enfermedad por serotipos incluidos en PPSV23 nos obliga al uso de esta vacuna en adición a PCV13. Una dosis de PPSV23 debe repetirse al quinto año de la administración de la primera en este tipo de pacientes (PC13+PPSV23+PPSV23). Todo adulto mayor de 60 años debe recibir una dosis de PPSV23, aunque haya recibido una dosis antes de dicha edad, y la diferencia entre la aplicación de estas 2debe ser de por lo menos 5 años21.
Con relación a la inmunización de adultos entre los 19 y 50 años de edad, es de valor mencionar que la Agencia Europea del Medicamento (EMA) se pronunció en enero de 201522 a favor de la inmunización de adultos entre esos grupos de edad con comorbilidades y no solo con alteraciones en el sistema de inmunidad. Particularmente se ha referido al adulto que tiene enfermedad pulmonar crónica, enfermedad cardiovascular crónica y diabetes, pero posiblemente podemos pensar en muchas otras enfermedades crónicas que pueden merecer esa necesidad. El INVIMA igualmente ha aceptado dichas recomendaciones. Lo anterior, a nuestro parecer, es sensato, puesto que las respuestas a la inmunización deben ser tan buenas o mejores en ese grupo de edad que en personas de mayor edad. Por otro lado, no solo estas personas pertenecen a un grupo claramente de mayor riesgo, sino que también se trata de aplicar la misma secuencia antigénica que en todas las edades y grupos de riesgo (idealmente PCV13+PPSV23).
Uso de PCV13+PPSV23 en adultos mayores de 60 años. Resumen de la evidenciaEl 13 de agosto de 2014 se revisaron por ACIP los resultados del estudio CAPITA2 realizado en Holanda con una población de 85.000 personas mayores de 65 años. En este se pretendió averiguar no solo la efectividad de la vacuna PCV13 contra la enfermedad invasiva, sino también la efectividad sobre la prevención del primer episodio de neumonía por serotipos asociados a dicha vacuna. La efectividad de la vacuna en esta población no previamente inmunizada fue de un 45,6% (II). Se determinó que la evidencia fue sólida para dar la recomendación en el uso de la vacuna (IC95%: 21,8-62,5%); contra enfermedad invasiva, demostró una efectividad de la vacuna del 75,0% (IC955: 41,4-90,8%). No sobra recalcar que este es el primer estudio aleatorizado, doble ciego y prospectivo con un poder razonable que ha demostrado el beneficio de una vacuna contra esta bacteria en población anciana, aun con comorbilidades.
Aunque a través del tiempo, la vacunación infantil con PCV13ha tenido beneficios indirectos sobre la casuística de IPD en el adulto mayor, aún alrededor del 25% de los casos de IPD y el 10% de aquellos con neumonía se debieron a serotipos incluidos en esta vacuna en el 2013 en la población americana23. Con base en los beneficios ofrecidos sobre esta población y la carencia de efectividad de la vacuna polisacárida en esta población anciana y con mayor número de comorbilidades, se dio aprobación para el uso de esta vacuna conjugada seguida de la vacuna polisacárida aplicada a los 6-12meses de la administración de la primera, puesto que el 38% de la enfermedad invasiva en adultos de esta edad es causada por serotipos incluidos únicamente en la PPSV2324.
Recientemente ocurrió una modificación en términos de tiempo para la administración de PPSV23: que se administrase al año (y no a los 6meses), después de la aplicación de PCV para armonizar con los esquemas de inmunización y las posibles visitas al médico a esa edad, pero desde el sexto mes la indicación también es válida25.
Capítulo 3. Enfermedad meningocócica, fiebre amarilla y dengueEn este capítulo se discute la enfermedad causada por Neisseria meningitidis (N. meningiditis), no solo por la carga que representa sobre los jóvenes, sino también ante el aumento en el número de viajeros a áreas donde claramente se ha presentado exceso de muertes durante la peregrinación. El desarrollo de nuevas vacunas y con nuevas tecnologías es también motivo del escrito. La vacuna contra la fiebre amarilla ha demostrado a través de muchos años que una sola aplicación causaría inmunidad eficiente para toda la vida en la mayoría de las personas y, por tanto, la discusión. Finalmente, y aunque aún por hacer presencia en nuestro país, se discute principalmente la carga de enfermedad causada por dengue y el impacto que esta vacuna tendría en la población de mayor riesgo, dado que conlleva costos importantes de forma directa e indirecta. En un escrito posterior se darán recomendaciones completas acerca de la aplicación de esta.
Enfermedad meningocócicaPara efectos de inmunización en el inmunocomprometido, se consideran aquellos con los siguientes factores de riesgo, aunque pueden existir otros no mencionados aquí:
- •
Personas con deficiencia persistente en la vía del complemento (C3, properdina, factor D, factor H, o C5-C9).
- •
Personas que reciben eculizumab para el síndrome urémico hemolítico atípico, o hemoglobinuria paroxística nocturna, debido a que el medicamento se une al C5 e inhibe la vía terminal del complemento.
- •
Personas con asplenia funcional o anatómica (incluyendo pacientes con enfermedad falciforme).
- •
Personal de laboratorio que trabaja rutinariamente con aislamientos de meningococo.
- •
Las personas en periodo de brote tienen entre 200 y 1.400 veces más riesgo de adquirir enfermedad meningocócica que la población general.
Se debe considerar la primovacunación para quienes no la hayan recibido previamente entre las edades de 11 a 21 años y de la siguiente manera con las vacunas disponibles de 4valencias (MCV4-D o MCV4-CRM) (AII):
- •
Aplicar una dosis a adolescentes entre los 11 y los 12 años, y una dosis de refuerzo a los 16 años.
- •
Los adolescentes quienes reciban su primera dosis a la edad de 13-15 años deberían recibir un refuerzo entre los 16-18 años.
- •
Los adolescentes quienes reciban su primera dosis de vacuna de meningococo conjugada a los 16 años o después no ameritan una dosis de refuerzo, salvo que tengan factores de riesgo (ver abajo).
- •
No se recomienda la vacunación de rutina contra el meningococo a las personas sanas mayores de 21 años, a menos que presenten factores o estén en un grupo de riesgo. (DIII).
- •
Las vacunas de meningococo tetravalentes conjugadas (MCV4-D o MCV4-CRM) se pueden usar en este grupo etario (22 a 55 años), con la aplicación de una sola dosis de vacuna: durante brotes atribuibles a uno de los serogrupos incluidos en la vacuna (serogrupo A, C, Y, W) o en personas que van a viajar a países con enfermedad hiperendémica o endémica de meningococo o que desean obtener protección en forma individual.
- •
No existe ninguna indicación en las personas mayores a 55 años de edad para aplicar las vacunas tetravalentes conjugadas (MCV4-D o MCV4-CRM) contra el meningococo (EIII).
- •
Los adultos mayores de 55 años de edad dentro de un grupo de riesgo deben recibir una dosis de la vacuna polisacárida contra el meningococo (MPSV4) (BII).
- •
La vacunación está recomendada en pacientes con factores de riesgo para enfermedad meningocócica invasiva:
- ∘
Deficiencia de: complemento, C3, C5-C9, properdina, factor H, factor D.
- ∘
Asplenia funcional o anatómica.
- ∘
Inmunodeficiencias primarias.
- ∘
Pacientes con VIH.
- ∘
Fuerzas militares, poblaciones cautivas, residencias universitarias.
- ∘
Residencia en una comunidad con brote de meningococo (AII).
- ∘
- •
Las personas de 11 a 55 años de edad que presenten asplenia, enfermedad por VIH, o persistencia de deficiencia de componentes del complemento deben recibir vacunas conjugadas tetravalentes (MCV4-D o MCV4-CRM) contra el meningococo: una serie primaria de 2dosis con un intervalo de 8 semanas entre dosis y con una dosis de refuerzo (para personas quienes permanecen en riesgo) cada 5 años (AII).
- •
En caso de esplenectomía programada, la vacuna contra el meningococo se administra idealmente 2 semanas antes de esta. Si se hace esplenectomía de urgencia, se recomienda que la vacuna contra el meningococo se aplique dentro de las 6semanas siguientes (CIII).
- •
Para las personas de 11 a 55 años que viajen o residen en países o zonas donde la enfermedad meningocócica es hiperendémica o epidémica, o viajeros a áreas con alta endemicidad (África sub-sahariana, o en peregrinación a La Meca) está recomendada una sola dosis de vacuna que incluya los serogrupos A y W, como las vacunas tetravalentes (MCV4-D o MCV4-CRM), aplicada 15 días antes de iniciar el viaje; el plazo mínimo de aplicación de la vacuna entre el inicio del viaje y la llegada al área endémica es de 10 días (BIII). Las entidades de migración pueden pedir el carnet internacional.
- •
A las personas de 11 a 55 años que sean contactos íntimos de pacientes con enfermedad invasiva por meningococo y no vacunados previamente, se recomienda aplicar una o 2dosis de acuerdo con el hospedero (sin riesgo elevado o de alto riesgo), no más allá de 10 días luego del contacto con el caso (BII).
- •
A los trabajadores del área de la salud (bacteriólogos, microbiólogos) expuestos a N. meningitidis se recomienda aplicarles una dosis de vacuna tetravalente conjugada contra el meningococo y un refuerzo cada 5 años si persiste o hay riesgo aumentado de exposición al meningococo (BII).
- •
Para el control de brote, además de la quimioprofilaxis, se pueden usar tanto las vacunas polisacáridas tetravalentes (MPSV4) como las conjugadas tetravalentes (MCV4-D o MCV4-CRM), con los esquemas previamente mencionados (BII).
- •
Las personas con un riesgo alto para enfermedad meningocócica deben recibir vacuna recombinante de meningococo contra el serogrupo B (si están disponibles en el país), en el esquema de 2dosis para la vacuna MenB-4C o en esquema de 3dosis para la vacuna MenB-FHbp.
- •
Ambas vacunas (MenB-4C y MenB-FHbp) están aprobadas (por la Food and Drug Administration [FDA] de Estados Unidos) para usarse en personas entre 10 y 25 años; sin embargo, pueden ser usadas en personas mayores de 25 años con riesgo alto de enfermedad meningocócica por serogrupo B (CIII).
- •
Las vacunas contra N. meningitidis B no están actualmente recomendadas como uso rutinario en estudiantes universitarios que vivan en residencias en su primer año, ni en reclutas militares, ni en todos los adolescentes (DII).
- •
Con base en datos disponibles y opinión de expertos, las vacunas de MenB-4C o MenB-FHbp pueden ser administradas concomitantemente con vacuna tetravalente conjugada contra meningococo (MenACWY), pero en sitios anatómicos diferentes, si es factible (CIII).
Las vacunas conjugadas se distinguen por la conjugación del polisacárido del meningococo a una proteína transportadora. Tres vacunas conjugadas monovalentes contra el serogrupo C, una conjugada monovalente contra el serogrupo A y 2tetravalentes conjugadas (A, C, Y, W) están disponibles actualmente26. Una conjugada con CRM-197 (MCV4-CRM) y la otra conjugada con toxoide diftérico (MCV4-DT)27–29. Las 3vacunas monovalentes conjugadas contra el serogrupo C están actualmente disponibles en Europa, Australia, Canadá y en la mayoría de los países de América Latina30.
El polisacárido del serogrupo B no genera anticuerpos bactericidas, por lo cual, el desarrollo de vacunas contra el serogrupo B se ha focalizado sobre proteínas de la membrana externa del meningococo31,32.
Dos vacunas han sido aprobadas para protección de enfermedad endémica por serogrupo B en la actualidad. Una vacuna recombinante que contiene 2 variantes de proteínas de unión del factor H (fHbp): un antígeno de cada subfamilia (A y B) de la fHbp es incluido en la vacuna; esta es la MenB-FHbp. Es también conocida como LP2086, aprobada en octubre 2014 por la FDA para individuos entre los 10 y 25 años de edad33,34. Y la otra vacuna es la MenB-4C, diseñada por tecnología de vacunología reversa, la cual contiene 3 proteínas recombinantes.
En ciertos grupos de personas que tienen un riesgo alto para enfermedad meningocócica se recomienda rutinariamente vacunación con vacuna tetravalente conjugada contra meningococo (Men-ACYW), pero muchas de estas personas también tienen riesgo alto para enfermedad meningocóccica por serogrupo B. Los datos disponibles de inmunogenicidad y seguridad dan soporte al uso de MenB en estos grupos (tabla 4).
Vacunas recombinantes contra meningococo serogrupo B aprobadas por la FDA
| Edad | Vacuna | Esquema | Fecha de aprobación | Indicación |
|---|---|---|---|---|
| 10-25 años | Trumenba® (MenB-FHbp) | 0-2-6 meses (3 dosis) | 29/10/2014 | Prevención de enfermedad meningocócica por serogrupo B |
| 10-25 años | Bexsero® (MenB-4C) | 0-1 mes (2 dosis) | 23/01/2015 | Prevención de enfermedad meningocócica por serogrupo B |
Menos del 10% de los casos de enfermedad meningocócica ocurren en pacientes con factores de riesgo35. La enfermedad meningocócica invasiva afecta principalmente a los lactantes entre los 3 y 12 meses de edad en quienes la tasa de mortalidad es alta, seguidos de los adolescentes. Sin embargo, durante los brotes epidémicos, la tasa de incidencia puede aumentar entre los niños de mayor edad y entre los adultos36,37.
Además de la edad, otros factores de riesgo demostrados son vivir en condiciones de hacinamiento, tener un estrato socioeconómico bajo, los viajes a lugares de alta endemicidad, estar en lugares que pueden albergar altas congregaciones de gente como bares o discotecas, ser fumadores activos o pasivos, usuarios o consumidores de drogas ilícitas intravenosas, presenatr déficit persistentes de componentes del complemento (C5-C9, properdina, factor H y D), asplenia anatómica o funcional e infección por el VIH38–40.
En Latinoamérica y el Caribe la distribución de los serogrupos ha sido dinámica y cambiante año tras año41. En Brasil, Centroamérica y el Caribe, el serogrupo C es el más frecuentemente aislado; en la región andina (Bolivia, Colombia, Perú, Ecuador, Venezuela) el serogrupo B es el más frecuente, con un 70%, seguido del serogrupo C y Y con un 15% y, en el cono sur, (Argentina, Chile, Paraguay, Uruguay), predominan los serogrupos W y B, seguidos por el serogrupo C en un menor porcentaje42. Últimamente ha habido aumento del serogrupo W, con brote notificado en Chile en el periodo 2012-201343–45.
En Colombia según datos suministrados por el Sistema Regional de Evaluación de los Aprendizajes de Arequipa (SIREVA), el serogrupo predominante es el B, con un 70%46. Las vacunas polisacáridas son inmunogénicas en niños mayores y adultos, pero no en lactantes menores de 2 años de edad. No presentan inmunidad de rebaño ni efecto amplificador, ni sobre el estado de portador, y los títulos de anticuerpos bactericidas del suero declinan rápidamente47,48.
Vacunación contra fiebre amarilla- •
La vacuna contra la fiebre amarilla está contraindicada en mujeres embarazadas (DIII).
- •
La vacuna está contraindicada por encima de los 60 años de edad ante la mayor incidencia de eventos adversos (DII).
- •
La aplicación de vacuna contra la fiebre amarilla en una mujer gestante no es motivo para interrumpir el embarazo (BIII).
- •
La inmunización para grupos selectos como el trasplantado de médula ósea, el paciente con VIH, la embarazada durante su tercer trimestre y otros inmunocomprometidos puede conducir a títulos de anticuerpos neutralizantes inefectivos o de corta duración y la aplicación de un refuerzo vacunal debe ser sugerida acorde con el riesgo de exposición y los posibles eventos adversos del inmunógeno (CIII).
- •
Esta vacuna está contraindicada en la lactancia por el riesgo de transmitir el virus al neonato y causarle encefalitis (DII).
- •
El Reglamento Sanitario Internacional y el libro amarillo (Yellow book) de los CDC indican que se debe aplicar la vacuna válida por 10 años, para entrar a algunos países, y cuando se procede de regiones o países donde haya brotes recientes de fiebre amarilla o puedan existir (BIII).
- •
La vacunación es efectiva como requisito internacional si se hace por lo menos con 10 días de antelación al viaje, e igualmente el certificado se debe actualizar cada 10 años. En su reunión de mayo del 2014, la Organización Mundial de la Salud (OMS) decidió eliminar la necesidad de revalidar el carnet cada 10años y estableció que una dosis sería suficiente para el resto de la vida. Este dictamen se implementaría desde junio del 2016. Sin embargo, el grupo desconoce al momento qué países han adoptado esta medida o bien se adhieren aún a las recomendaciones previas. Se sugiere dirigirse a los sitios consulares para preguntar por dichos requisitos. Desde el punto de vista de efectividad vacunal, es claro que personas inmunocomprometidas o embarazadas podrían necesitar más de una dosis en la vida49.
El grupo de ACIP encargado de revisar los datos acerca de la inmunización contra la fiebre amarilla votó en contra de administrar más de una dosis de esta vacuna para la gran mayoría de las personas49, ya que se ha demostrado protección de larga duración50,51. Sin embargo, es probable que algunos vacunados, como mujeres embarazadas o niños o aquellos que tienen VIH o bien estén trasplantados de médula ósea, puedan necesitar otras dosis de refuerzo. Para dicha recomendación se revisaron además los eventos adversos relacionados con enfermedad viscerotrópica y neurotrópica; después de revisar más de 450 millones de dosis distribuidas y los eventos adversos reportados para enfermedad viscerotrópica, 72 sujetos la presentaron y solo en el 63% de ellos se supo si ocurrió durante la primera dosis o durante una dosis de refuerzo y, en los casos en los que sí se conoció, se supo que solo en el 3% ocurrieron durante una dosis de refuerzo. Es decir, los eventos graves en su mayoría ocurren durante la vacunación inicial. En cuanto a enfermedad neurotrópica, de igual forma, la mayoría de los eventos ocurridos en 110 sujetos ocurrieron después de la primera dosis (97%).
En cuanto a la efectividad vacunal en el embarazo se sabe que, de las embarazadas que recibieron vacuna en el tercer trimestre, solo el 39% seroconvirtieron, a diferencia del 94% para la población general52. Cuando un grupo fue vacunado en el primer trimestre, el 98% desarrollaron anticuerpos adecuados53. Hay información de que una buena parte de los trasplantados de médula pierden protección contra virus vivos54 y 2estudios publicados para pacientes con VIH55,56 demuestran que hay disminución de protección de anticuerpos a los pocos años de la administración de la vacuna, lo cual podría explicarse en asociación directa con el número de linfocitos CD4 y, recíprocamente, con el conteo de carga viral57.
Igualmente, se debe tener en cuenta que la mayoría de los casos de fiebre amarilla ocurren en África y no en Suramérica y que la mayoría proviene de los países occidentales de dicho continente y en viajeros cuyos viajes son extensos en el tiempo y en época de brotes.
DengueEl dengue es una arboviriasis que puede ser producida por cualquiera de los 4serotipos del virus del dengue (Den-1, Den-2, Den-3 y Den-4), que pertenece a la familia Flaviviridae, y al igual que la fiebre amarilla es transmitido a través de la picadura de los mosquitos hembra del Aedes aegypti, o del Aedes albopictus en menor proporción58.
Actualmente existen más de 3,9 billones de personas en el mundo en riesgo de contraer la enfermedad, y se estima que ocurren alrededor de 390 millones de casos al año en el mundo59, principalmente en el trópico o en áreas entre los 40° latitud norte y 40° latitud sur. Hasta 500.000 de esos casos llegan a ser severos, y aproximadamente un 2,5% de esos casos tienen desenlaces fatales60.
El patrón de incidencia creciente de la enfermedad a través de los últimos años ha hecho que las políticas de promoción y prevención contra ella sean insuficientes, a lo que se suman las altas tasas de resistencia de los mosquitos a los insecticidas y piretroides actuales. Todas estas características hacen del dengue un problema de salud pública a la cual la OMS quiere ponerle freno, y cuyo objetivo para el 2020 es disminuir la morbilidad en un 25% y la mortalidad por esta enfermedad en un 50%59.
Colombia es uno de los países con mayores casos de dengue en América Latina y la incidencia de la enfermedad ha alcanzado cifras superiores a los 600 casos por cada 100.000 habitantes en la región, con un predominio de casos en Cali, Ibagué, Bucaramanga, Cúcuta y Villavicencio. En el 2015 hasta la semana epidemiológica número 52, el total de casos fue de 94.91661.
Según el Instituto Nacional de Salud, el dengue en Colombia representa un problema prioritario en salud pública debido a la reemergencia e intensa transmisión con tendencia creciente, el comportamiento de ciclos epidémicos cada 2o 3años, el aumento en la frecuencia de brotes de dengue grave, la circulación simultánea de los 4serotipos, la reintroducción del serotipo 3y la infestación por Aedes aegypti en más del 90% del territorio nacional situado por debajo de los 2.200 m sobre el nivel del mar y, además, la urbanización desordenada en algunas ciudades y municipios. En Colombia durante 2010 ocurrieron más de 157.000 casos, con una incidencia de aproximadamente 650 casos por cada 100.000 habitantes. Otro brote similar ocurrió en 2013 y tanto en 2010 como en 2013 se contabilizaron más de 378 casos confirmados letales por dengue en Colombia. En cuanto a la información epidemiológica según edad, el 46% de los casos de dengue en 2013 ocurrió entre los 5 y los 19 años de edad62.
Según datos del Ministerio de la Protección Social y el Instituto Nacional de Salud en cuanto a la circulación de serotipos, en un análisis hecho del 2008 al 2013 se demostró una cocirculación de los 4serotipos, con una mayor circulación del serotipo 1 seguido del serotipo 4en 2009 y 2013. Tanto en 2010 como en 2013 el serotipo que más circuló con una proporción de aproximadamente un 40% fue el serotipo 1.
Según estudios realizados en nuestro país, se estima que el gasto anual por dengue en un periodo de brote puede ascender hasta los 167 millones de dólares, como ocurrió en el 2010, en uno de los peores brotes de Colombia, con más de 157.000 casos y una incidencia de más de 650 casos por 100.000 habitantes63.
La vacuna más adelantada proviene de Sanofi Pasteur, que ha llevado a cabo más de 25 estudios clínicos con la participación de más de 40.000 individuos a nivel global con una vacuna tetravalente contra la enfermedad. Es producida mediante técnica de quimerización y utilizando los genes no estructurales de la vacuna 17D de la fiebre amarilla, más el material genético que codifica para la cápside, junto con los genes que codifican para la premembrana y la envoltura de los 4serotipos del dengue.
Los estudios de desarrollo preclínico y clínico de la vacuna candidata contra el dengue siguieron al pie de la letra las recomendaciones de la OMS sobre el desarrollo de estudios clínicos de vacunas en zonas endémicas y no endémicas para la evaluación de una vacuna. Dentro de los estudios de fase I, II y III se evaluó la seguridad de la vacuna y su inmunogenicidad en adultos, adolescentes y niños en diferentes países tanto en población nunca antes expuesta como en población de individuos que viven en zonas donde el dengue es endémico y donde representa un grave problema de salud pública.
Dos estudios multicéntricos, aleatorizados, contra placebo de fase III en más de 10 países de Asia CYD14 (Malasia, Indonesia, Filipinas, Vietnam y Tailandia) y Latinoamérica CYD15 (Brasil, Colombia, Puerto Rico, Honduras y México) midieron la eficacia y seguridad de la vacuna tetravalente contra el dengue (CYD-TDV) en más de 30.000 sujetos de los cuales al menos 2/3 partes recibieron al menos una dosis de la vacuna contra el dengue64.
Los 2resultados de eficacia de un metaanálisis de los estudios de Asia y Latinoamérica en individuos de 9 a 16 años (CYD14 y CYD15 respectivamente) cumplieron el objetivo final primario con una eficacia del 65,6% contra los casos de dengue sintomático producidos por cualquier serotipo e independientemente de la severidad del dengue y, en cuanto a la reducción de los casos, mostró una reducción del 80,8% de los casos hospitalizados y del 93% de los casos severos y con manifestaciones hemorrágicas cuando se administró un esquema de 3dosis a los 0, 6y 12meses de forma subcutánea. La indicación hoy en día para algunos países de América Central y del Sur es inmunizar entre los 9y 45años de edad64.
Durante el desarrollo preclínico y clínico de la vacuna no se observaron casos de neurotropismo ni de viscerotropismo asociados a la vacunación, y el evento adverso local más frecuente fue dolor en el sitio de la inyección. La vacuna es, entonces, una herramienta más que contribuirá a alcanzar las metas de la OMS de reducir la mortalidad en un 50% y la morbilidad en un 25% para el año 2020.
Capítulo 4. Recomendaciones en pacientes con trasplante de médula óseaEn este capítulo se recuerdan los tiempos y productos con los cuales se debe inmunizar al paciente trasplantado de médula ósea, pero se debe tener en cuenta que en muchas ocasiones los textos o artículos revisados no clarifican en detalle si se trata de un paciente trasplantado de manera autóloga o por alogenia. Igualmente, como en cualquier paciente inmunocomprometido, es el especialista quien eventualmente decide entre el beneficio que podría prestar la vacuna versus el posible evento adverso severo.
Recomendaciones generales antes del trasplante de médula- •
Se recomienda poner al día los esquemas de vacunación de los candidatos a trasplante antes del procedimiento, acorde con los esquemas recomendados para su edad, mientras no estén inmunocomprometidos (AII).
- •
Se recomienda vacunar contra influenza a los miembros de la familia antes del trasplante y por lo menos continuar en los siguientes 2 años después del trasplante, o mientras que el paciente se encuentre inmunocomprometido (BIII).
- •
Se recomienda vacunar también contra la influenza a los miembros de la unidad de trasplantes, para evitar la circulación del virus en el grupo cercano al enfermo (BIII).
- •
No se deben aplicar vacunas atenuadas en pacientes con enfermedad activa injerto contra huésped o con inmunosupresión alta (EIII).
- •
Se recomienda que las vacunas atenuadas sean administradas con 4semanas de antelación al trasplante y aquellas inactivadas, con 2semanas de antelación (AIII).
- •
Se recomienda que las vacunas contra sarampión, paperas, rubéola, varicela y zóster no se apliquen dentro de las 4 semanas antes de la recolección de células (DIII).
- •
No se recomienda la vacunación del donante para beneficio del receptor del trasplante (DII).
- •
Se recomienda que los candidatos a trasplante que no son inmunes a varicela zóster reciban 2dosis de la vacuna contra varicela (siempre y cuando no estén altamente inmunocomprometidos) y que la última dosis se administra al menos 30 días antes del trasplante (AIII).
- •
Se recomienda inmunizar a todos los pacientes trasplantados con 3dosis de PCV13, iniciando 3-6 meses después del trasplante (AIII). Las 3 dosis deben ser aplicadas con 30-60 días de intervalo. Se debe administrar una dosis de PPSV23 después de 8 semanas de acabar el esquema de PCV13 (AIII).
- •
Al quinto año de la administración de PPSV23 se administra una dosis única de PPSV23 (AIII).
- •
Se recomienda en pacientes con enfermedad crónica de injerto contra hospedero aplicar una cuarta dosis de PCV13, 12 meses después del trasplante (CIII).
- •
Se recomienda inmunizar con 3dosis de la vacuna conjugada contra el Haemophilus influenzæ (H. influenzæ) tipo B a todos los pacientes trasplantados, comenzando a los 6-12 meses del trasplante (AII).
- •
Se recomienda que todos los pacientes trasplantados sean vacunados contra tétanos, difteria y pertusis con 3dosis de TdaP (tétanos, diphtheria y acellular pertusis por sus siglas en inglés), iniciando 6 meses después del trasplante (BIII) y otra en el mes 18 (AIII).
- •
Se deben aplicar 2 dosis de vacuna conjugada de 4valencias antigénicas contra N. meningitidis MCV4 entre el mes 6 y 12 después del trasplante cuando el paciente adolescente es menor de 18 años, y luego una dosis adicional si estas se aplicaron antes de los 16 años de edad (AIII).
- •
Se recomienda administrar 3 dosis de vacuna de polio inactivada entre el mes 6 y 12 después del trasplante, en especial en personas con riesgo de infección, y aplicar una dosis de refuerzo a los 18 meses (AII). No existe polio salvaje en América continental, pero algunos países del continente aún vacunan con cepa atenuada, lo cual pondría en riesgo al paciente trasplantado.
- •
Se recomienda inmunizar contra la influenza con una dosis de vacuna inactivada a todos los pacientes trasplantados, empezando en el sexto mes (AII) o adelantarlo al 4 mes si hay brote en la comunidad (BIII).
- •
Se recomienda dar preferencia al uso de la vacuna inactivada contra influenza que incluye 4 cepas contra los virus circulantes (BIII).
- •
Se recomienda la aplicación de 3 dosis de la vacuna contra la hepatitis B en los pacientes trasplantados 6 a 12 meses después de este (BII).
- •
Si la concentración de anticuerpos contra el antígeno de superficie del virus de la hepatitis B (HBsAc) no alcanza a ser mayor que 10 mIU/mL, medida después de un mes de administración de 2a 3dosis de la vacuna, se recomienda realizar otra serie de 3 dosis de vacuna (BIII) o, alternativamente, inmunizar con 40 μg por dosis por 3dosis (CIII).
- •
Se debe considerar, según el esquema usual de inmunización del adulto, la administración de 3 dosis de vacuna de HPV 6-12 meses después del trasplante para mujeres según las indicaciones de edad dadas en el inserto (CIII).
- •
Se recomienda administrar 2dosis de la vacuna contra el sarampión, paperas y rubéola a pacientes no inmunes (AIII) 24 meses después del trasplante en pacientes sin enfermedad injerto contra hospedero crónica. Se puede considerar hacerlo antes (8-11 meses) cuando hay importante riesgo de infección.
- •
Si después del trasplante la persona no tiene inmunidad contra varicela, se recomienda vacunar después del mes 24 con 2dosis, mientras no tenga alto grado de inmunosupresión o enfermedad injerto contra hospedero (BIII).
- •
Los familiares cercanos deben estar apropiadamente inmunizados contra la varicela o demostrar protección por medición de títulos IgG (AIII).
- •
Se debe inmunizar contra zóster al adulto mayor de 60 años con la vacuna disponible (atenuada) en el individuo que sufrió la exposición natural al virus de VZ (AIII).
- •
En pacientes entre 50 y 59 años de edad se puede aplicar la vacuna contra zóster en aquellos con serología positiva para varicela zóster y que no fueron inmunizados contra varicela anteriormente (CIII).
- •
El paciente que ha sido inmunizado contra varicela no debe recibir la vacuna contra zóster (DII).
- •
La vacuna no se debe aplicar a pacientes con alto grado de inmunocompromiso (EIII).
Este capítulo dedica los conceptos de vacunación a aquellos con trastornos hematooncológicos en los que la administración de agentes quimioterapéuticos se hace de forma periódica y en los que estos causan leucocitopenias de corta o larga duración cuando se trata de inducción o reducción de masa tumoral mediante agentes más potentes, que eventualmente extienden el periodo y la severidad de la neutropenia14,65–69.
- •
Las vacunas vivas atenuadas no deben ser administradas durante la quimioterapia (AII/III).
- •
En caso de ser necesario, la administración de vacunas vivas atenuadas se debe aplicar 30 días antes de quimioterapia, o bien al tercer mes de haber recibido quimioterapéuticos (BIII).
- •
Si se administran vacunas inactivadas durante la quimioterapia, se debe considerar una pobre efectividad y se recomienda readministrar una vez se haya acabado la quimioterapia (AIII).
- •
Pacientes tratados mediante regímenes que incluyan anticuerpos contra células CD20 o aquellos agentes causantes de depleción linfocitaria importante o depleción de CD4 deben considerarse pacientes con inmunosupresión severa y la inmunización con agentes vivos no se debe hacer antes de 6 meses (DIII).
- •
Todos los pacientes con neoplasias, se encuentren o no en tratamiento con agentes alquilantes, antimetabolitos o en radioterapia, deben ser inmunizados anualmente contra la influenza con la vacuna inactivada (AII).
- •
Se recomienda administrar la vacuna contra influenza en lo posible 2o 3semanas antes de iniciar quimioterapia, o bien a los 3 meses de terminar el ciclo. En caso necesario se puede administrar entre los ciclos de quimioterapia: a pesar de obtener títulos de menor cuantía, la efectividad clínica puede ser adecuada (CIII).
- •
Se prefiere la vacuna tetravalente disponible en el mercado para evitar influenza por cualquiera de las 4 cepas circulantes (BIII).
- •
Se recomienda que todos los pacientes con enfermedad hematooncológica o tumor sólido sean vacunados contra enfermedad invasiva y neumonía por S. pneumoniæ con PCV13 (AII) y 8 semanas después la administración de PSV23 (AIII).
- •
Se recomienda que todo paciente que recibió una dosis de PPSV23 reciba una nueva dosis 5 años después de la administración de esta (AIII).
- •
Se recomienda en aquellos que recibieron PPSV23 con anterioridad, sin antes haber recibido PCV13, que esta última sea administrada, en el adolescente, por lo menos 8 semanas después de la última dosis de PPSV23 (AII) y, en el adulto, un año después (AIII).
- •
Se sugiere administrar la vacuna disponible (atenuada) contra zóster al adulto mayor de 60 años que anteriormente sufrió de varicela, mas no al anteriormente vacunado contra esta (AIII).
- •
En pacientes entre 50 y 59 años de edad se sugiere aplicar la vacuna contra zóster en aquellos con serología positiva por infección previa por la enfermedad (CIII).
- •
Se recomienda que el paciente que ha sido inmunizado contra varicela no reciba la vacuna contra zóster (DII).
- •
Se recomienda no vacunar contra zóster a pacientes con alto grado de inmunocompromiso (EIII).
- •
Los pacientes que han recibido quimioterapia deben ser vacunados con biológicos inactivados según el esquema anual de la CDC que el adulto exige, y hacerlo 3meses después de finalizado el ciclo de quimioterapia (AII/III).
- •
La vacuna triple viral debe administrarse en estos pacientes 3meses después de la quimioterapia (BIII) y la vacuna contra varicela, si es necesario, también (CIII).
En este capítulo, debido a la dificultad en diferenciar unas de otras enfermedades relacionadas con inmunosupresión y autoinmunidad, se prefiere describir de manera amplia el significado de lo que es y no es inmunocompromiso severo, en donde se deja a la discreción del especialista en muchos casos, la toma de decisiones en cuanto a la administración de la vacuna. Como regla general, las vacunas vivas atenuadas deben ser reconocidas por un sistema inmune para luego generar una respuesta de anticuerpos y, eventualmente, podrían generar un evento adverso tan severo como la misma enfermedad que se pretende evitar. Por otro lado, los inmunógenos basados únicamente en antígenos bacterianos o virales aislados y vacunas recombinadas, que pueden no ser tan efectivos en la generación de una respuesta inmune, se pueden usar más liberalmente esperando la protección del individuo, pero ciertos de no generar un evento adverso severo68,70–75.
Recomendaciones generales (ver definición de inmunosupresión alta o inmunocompromiso de alto grado en glosario)- •
Se sugiere vacunar a todos los pacientes candidatos a recibir medicinas antiinflamatorias para enfermedad autoinmunitaria, según indicación de acuerdo con la edad, con las vacunas inactivadas, hasta 14 días antes de inicio de inmunosupresión (BII).
- •
Se recomienda, antes de iniciar el tratamiento inmunosupresor en los pacientes con enfermedad autoinmunitaria, revisar el esquema de vacunación y completarlo según las recomendaciones para la población general (BII).
- •
Se sugiere evitar, por regla general, el uso de vacunas vivas o atenuadas si se considera que hay alto compromiso inmunitario, acorde con parámetros establecidos internacionalmente (DIII).
- •
Se recomienda, en pacientes con enfermedad autoinmunitaria, administrar idealmente la vacunación durante los estadios clínicos de inactividad (CIII).
- •
En todos los pacientes con enfermedad autoinmunitaria, se recomienda aplicar la vacuna contra influenza con el compuesto inactivado en pacientes tratados o que van a iniciar tratamiento inmunosupresor, teniendo en cuenta que en pacientes que reciben azatioprina, infliximab o rituximab se puede disminuir la inmunogenicidad (BII).
- •
Se sugiere administrar idealmente la vacuna tetravalente contra influenza para evitar la posible discordancia entre cepas vacunales y salvajes circulantes (BIII).
- •
Se recomienda que la PCV13 sea administrada en adultos con enfermedad inflamatoria crónica que reciben inmunosupresores (BII).
- •
Se recomienda que la PPSV23 se administre a todo paciente adulto que ha recibido PCV13 a las 8 semanas después de la aplicación de esta. Idealmente se debe inmunizar antes de la inmunosupresión o con cualquier grado de inmunosupresión (BII, CIII).
- •
Se sugiere que los pacientes con enfermedad autoinmunitaria reciban la vacuna con toxoide tetánico, de acuerdo con las recomendaciones para la población general. En caso de requerirlo, los que hayan recibido rituximab lo deben hacer solo 6meses después (BII).
- •
Se recomienda que los pacientes con enfermedad autoinmunitaria sean vacunados contra varicela si no hay evidencia de inmunidad y no han iniciado inmunosupresión. La segunda dosis contra la varicela debe administrarse al menos 30 días antes del inicio de inmunosupresión (AII) o administrarse con bajo grado de inmunosupresores (CIII).
- •
Se sugiere administrar con 4 semanas de anticipación la vacuna contra zóster a pacientes mayores de 50 años de edad que han tenido varicela en el pasado y que van a estar inmunosuprimidos de forma severa (AIII).
- •
Se recomienda la inmunización contra zóster en mayores de 60 años de edad, que tienen bajo grado de inmunosupresión y que presentaron varicela previamente. Se considera bajo nivel de inmunosupresión el recibir un ciclo corto de esteroides (no mayor a 14 días) y con dosis bajas a moderadas (menores de 20mg/día); recibir corticoides intraarticulares y estar en tratamiento inmunomodulador a dosis bajas, como menos de 0,4mg/kg semanales de metotrexato o menos de 3,0mg/kg diarios de azatioprina (BIII).
- •
Se recomienda no administrar la vacuna contra zóster a personas altamente inmunocomprometidas (ver definición en glosario) (DIII).
- •
Se sugiere la vacunación contra el virus del papiloma humano según las indicaciones para el adulto a pacientes con lupus eritematoso sistémico (CIII).
- •
Se recomienda no administrar vacunas vivas a pacientes con enfermedad crónica inflamatoria con inmunosupresión de mantenimiento con dosis altas o bajas de inmunosupresores (DIII).
- •
En pacientes con enfermedad autoinmunitaria, la vacunación contra la hepatitis A o B se recomienda solo cuando existan factores de riesgo, como viaje o residencia en zonas endémicas, profesiones con riesgo de infección o familiares infectados (CIII).
- •
La vacunación contra tuberculosis (BCG) está contraindicada en pacientes con enfermedad autoinmunitaria (EII).
- •
La vacunación contra la fiebre amarilla está contraindicada en pacientes con enfermedad autoinmunitaria y alta inmunosupresión (EIII).
- •
Está contraindicado el uso de la vacuna oral contra la poliomielitis en pacientes con enfermedad autoinmunitaria, y en quienes conviven con ellos (EIII).
- •
Se sugiere usar la vacuna inactivada contra la poliomielitis en pacientes con lupus eritematoso sistémico con enfermedad no activa (BII).
En este capítulo se hacen comentarios acerca de todas las vacunas necesarias para estos pacientes según edad o estadio de su enfermedad e, igualmente, según la cantidad de células CD4. En particular se anotan la necesidad de vacunar contra enfermedad respiratoria, hepatitis A y B y la vacuna contra el virus de papiloma humano.
Recomendaciones generales- •
Quienes cohabitan con enfermos por VIH no pueden recibir vacuna oral contra la poliomielitis o vacuna intranasal contra la influenza (DIII).
- •
Las personas con VIH sin síntomas y con más de 500 células CD4 por mm3 son suficientemente inmunocompetentes para poder recibir cualquier vacuna necesaria e indicada (AII).
- •
Aquellos con células CD4 entre 200 y 500 por mm3 deben considerarse con algún grado de inmunodeficiencia, y aquellos con menos de 200 células CD4 por mm3 no deben recibir vacunas atenuadas, en especial si tienen síntomas agregados (DIII).
- •
En individuos con VIH, se debe indicar la vacunación contra tétanos, difteria y tosferina, como a cualquier otro individuo inmunocompetente (AII).
- •
Se debe aplicar un refuerzo de la vacuna Td cada 10 años, y en una ocasión por lo menos una dosis de TdaP para incluir inmunización contra la tosferina (AII).
- •
Para iniciar la inmunización contra la difteria y el tétanos, se puede usar el esquema de 3dosis, como en cualquier adulto inmunocompetente, y continuar con los refuerzos según la indicación en el adulto (BIII).
- •
En un paciente con VIH, preferentemente si tiene más de 200 células CD4 por mm3, se debe aplicar la vacuna conjugada 13-valente (PCV13), seguida a las 8 semanas de la vacuna de 23 serotipos polisacáridos PPSV23 (BII).
- •
Se recomienda realizar un refuerzo con PPSV23 a los 5años de la primera dosis de esta vacuna (BIII).
- •
Si un paciente adolescente con VIH ha recibido previamente PPSV23 contra S. pneumoniæ, pero no ha recibido PCV13, se sugiere vacunar con la última cuando hayan pasado por lo menos 8 semanas de la inmunización con PPSV23 (AII).
- •
En el caso anterior para un paciente adulto con VIH, la espera para aplicar PCV13 después de haberse aplicado PPSV23 en el pasado debe ser de un año (AII).
- •
A un paciente que tiene infección por el VIH y se le ha aplicado PCV13+PPSV23, debe aplicársele otra dosis de PPSV23 a los 5 años de la última (BIII).
- •
Se debe inmunizar con la triple viral según las normativas del inmunocompetente en el paciente con VIH si hay más de 200 células CD4 por mm3 y si no hay síntomas asociados. Para la inmunización efectiva se requiere completar 2dosis separadas por al menos 28 días (BIII).
- •
Se puede usar la serología para rubéola y sarampión, para tomar decisiones en cuanto a la necesidad de vacunación en estos pacientes (CIII).
- •
No se deben ordenar exámenes para determinar la carga viral de VIH en las semanas siguientes a la vacunación, ante la posibilidad de un aumento transitorio de ella (DIII).
- •
La vacuna contra sarampión, rubéola y paperas se debe aplicar por lo menos 14 días antes o 3 meses después de la administración de inmunoglobulinas para no interferir con la creación de anticuerpos por la vacuna (BII).
- •
Los contactos y convivientes de la persona con VIH deben estar apropiadamente inmunizados contra el sarampión, la rubéola, varicela y las paperas (CIII).
- •
Se debe aplicar la vacuna inactivada contra la influenza a todas las personas infectadas por VIH, independientemente del recuento de CD4 o carga viral, aunque es preferible con CD4 mayor a 100 células×mm (AII).
- •
El paciente con VIH se debe inmunizar con la vacuna disponible en el mercado, sin importar la época del año (CIII).
- •
Idealmente, se prefiere administrar la vacuna tetravalente para evitar la posible discordancia entre cepas vacunales y salvajes circulantes (BIII).
- •
Se puede usar la vacuna como coadyuvante, en pacientes que reciben tratamiento antirretroviral altamente efectivo (BIII).
- •
No se debe usar la vacuna viva intranasal (EIII).
- •
No se debe ordenar la determinación de la carga viral para VIH en las semanas posteriores a la inmunización contra influenza (DIII).
- •
Se debe inmunizar con la vacuna inactivada contra la influenza a los cuidadores de pacientes con VIH y a sus familiares (AII).
- •
No existe recomendación alguna para la administración de la vacuna contra H. influenzae en pacientes con VIH, a menos que tengan otras condiciones agregadas, como esplenectomía quirúrgica o funcional (DIII). La vacunación para H. influenzae es poco inmunogénica y se recomienda aplicarla con valores altos de CD4 (>200 cel/mL) o en terapia ARV (CIII).
- •
Toda persona con VIH debe ser valorada para hepatitis B activa y determinar la necesidad de inmunización, pues es una enfermedad de transmisión sexual (CIII).
- •
Se debe vacunar al individuo contra la hepatitis B si no se demuestra inmunidad (anticuerpos contra antígeno de superficie mayores a 10mUI/ml). Dosis de 20μg cada una de las 3dosis colocadas en los meses 0, 1 y 6 (BII).
- •
Se debe reiniciar la inmunización con dosis doble si al final de la tercera dosis de la primovacunación no se demuestran títulos de anticuerpos por encima de 10 mUI/ml, idealmente con un recuento de CD4 superior a 200 células por mm3 y carga viral indetectable (BII).
- •
Se debe evaluar la generación de anticuerpos después de cualquier esquema completo, para valorar la inmunización (BII).
- •
En los pacientes en quienes, por algún motivo, se necesite actualizar el esquema de vacunación contra la poliomielitis, se debe hacer únicamente con la administración de vacuna inactivada (AIII).
- •
La administración de vacuna oral contra la poliomielitis está contraindicada en pacientes adolescentes y adultos, o en sus contactos (EIII).
- •
Se debe vacunar a la persona con VIH contra hepatitis A si carece de anticuerpos totales IgG, usando 2dosis espaciadas por 6-12 meses. Es una enfermedad que puede ser de transmisión sexual (BII).
- •
La vacunación se debe aplicar idealmente cuando haya más de 200 células CD4 por mm3 (BII).
- •
Si la vacunación se hace con menos de 200 células por mm3, se deben determinar los anticuerpos después de la primera dosis y, si no hay respuesta, se debe reiniciar el esquema una vez aumente el número de dichas células (BIII).
- •
Se recomienda vacunar contra hepatitis A a todos los pacientes con hepatopatía crónica por virus de hepatitis B, C o de otro origen (CIII).
- •
Se debe vacunar al paciente contra varicela cuando no ha sido anteriormente expuesto, solo si tiene más de 200 células CD4 por mm3 y se encuentra sin síntomas que sugieran sida (BIII).
- •
Se puede vacunar contra zóster a los individuos mayores de 50 años de edad quienes hayan sufrido de varicela anteriormente, cuyo recuento de linfocitos CD4 sea superior a 200 células por mm3 y se encuentren sin síntomas que sugieran sida (BIII).
- •
El paciente con VIH que ha sido inmunizado previamente contra varicela (2 dosis) no debe ser vacunado contra HZ (DII).
- •
Se debe vacunar contra la varicela (si previamente no se demuestra inmunidad) a quienes conviven con un paciente con VIH, especialmente si en este último está contraindicada la vacuna (CIII).
- •
La vacuna contra la fiebre amarilla puede aplicarse al paciente asintomático, solo si su conteo de células CD4 es mayor de 200 por mm3 (BIII).
- •
La vacuna contra la fiebre amarilla no se debe aplicar al paciente mayor de 60 años de edad o si aquel es sintomático o severamente inmunocomprometido (EII).
- •
Los enfermos con VIH se pueden vacunar con la vacuna conjugada MCV4 contra meningococo, en la adolescencia y hasta los 55 años de edad, según las recomendaciones de dosificación según la edad y si se consideran en riesgo de exposición (AII).
- •
Se recomienda la vacunación contra la rabia previa a la exposición, siempre y cuando se considere necesario según el posible riesgo de exposición. Se usan 3dosis intramusculares en los días 0, 7 y 28 (CIII).
- •
Quienes tengan menos de 200 células CD4 por mm3 o síntomas previos, pueden no responder apropiadamente a la vacunación contra la rabia; se pueden determinar los anticuerpos y, si no hay respuesta serológica, se debe aplicar una dosis extra (BIII).
- •
Las dosis después de la exposición se deben administrar cuanto antes, pero como la incubación puede ser prolongada, se debe iniciar el esquema, aun si han pasado varios días después de la exposición (CIII).
- •
En los pacientes que hayan respondido a las dosis de vacuna antirrábica (niveles de 40,5 IU/ml), se pueden medir los niveles entre los 6 meses y los 2años, para determinar la dosis de apoyo (CIII).
- •
Es posible vacunar a pacientes con infección por VIH con la vacuna de fiebre tifoidea oral si su recuento de linfocitos CD4 es superior a 200 células por mm3 y se encuentran sin síntomas de sida (CIII).
- •
Se recomienda vacunar con la vacuna tetravalente o bivalente en mujeres desde los 9 años hasta los 45 años de edad y en hombres hasta los 26 años con la vacuna tetravalente (BII).
- •
La vacuna HPV 9 (nonavalente) puede también ser usada en hombres acorde a las edades sugeridas en el inserto del producto (AII)76.
En este capítulo dedicamos especial atención a la mujer, esté o no embarazada. En la previa edición se explicó la importancia de la prevención de las enfermedades exantemáticas, entre otras y, en esta, particularmente, las muy importantes vacunas contra influenza y pertusis para así inmunizar a madre e hijo.
Vacuna contra el virus de papiloma humano- •
Se recomienda inmunizar a la mujer contra el virus del papiloma humano. La vacuna bivalente y la tetravalente están indicadas para la prevención de cáncer de cuello uterino, vulvar, vaginal y anal causado por VPH tipos 16 y 18; la vacuna tetravalente previene las verrugas genitales (condiloma acuminado) causadas por VPH tipos 6 y 11 y lesiones precancerosas o displásicas causadas por VPH tipos 6, 11, 16 y 18. Se recomienda aplicar el esquema de vacunación con 3 dosis, de acuerdo con el inserto de cada producto, a todas las niñas desde los 9 años de edad o durante la adolescencia temprana antes del inicio de la actividad sexual hasta los 45 años (AII).
- •
Se recomienda vacunar también a las mujeres que han tenido enfermedad anogenital por otras cepas virales no contenidas en las vacunas disponibles y documentada por citología vaginal (BII).
- •
La vacuna nonavalente, que incluye los serotipos 6, 11, 16, 18, 31, 33, 45, 52 y 58 se puede usar (cuando esté disponible) en mujeres desde los 9 años hasta los 45 años (AI).
- •
El esquema de 2dosis de vacuna contra el virus del papiloma está sugerido y aprobado por el Ministerio Nacional de Salud para las niñas entre 9 y 14 años como una medida de salud pública, y el Instituto Nacional de Salud y el Instituto Nacional de Cancerología apoyan la medida para su aplicación en el mes cero y una segunda dosis a los 6 meses. Se propone un refuerzo a los 5 años (BIII).
- •
Se puede vacunar contra el virus del papiloma humano a todas las mujeres que deseen protegerse contra este virus (CIII), sin embargo, el mayor costo-beneficio se obtiene antes del inicio de las relaciones sexuales (AII).
- •
La vacuna nonavalente se puede usar (cuando disponible) en mujeres desde los 9 años hasta los 45 años (AI) y en hombres desde los 9 años hasta los 16 años (AII).
- •
Está contraindicada la vacunación en el embarazo; sin embargo, no existe ninguna indicación para interrumpir el embarazo en caso de que una embarazada reciba alguna dosis accidentalmente, ya que es una vacuna que no contiene el ADN viral. El esquema se continuaría en el posparto, con las dosis faltantes (DII).
- •
Se recomienda aplicar la vacuna de la influenza (vacuna inactivada) en cualquier etapa del embarazo. La OMS recomienda desde etapa temprana. El hecho de que una mujer embarazada presente influenza conlleva un mayor riesgo de morbilidad, hospitalización e incluso muerte. Se prefiere la aplicación de la vacuna inactivada de 4valencias (AII). Los estudios que incluyeron la inmunización con el beneficio de proteger al recién nacido vacunaron a la gestante después de la semana 20 (AII).
- •
Se recomienda aplicarla a todas las mujeres en edad fértil durante picos circulantes de influenza o en el embarazo, con la vacuna inactivada contra esta enfermedad y, de preferencia, con aquella que posea las 4 cepas circulantes (BIII).
- •
Se recomienda no vacunar con la vacuna intranasal (LAIV, FluMist; MedInmune, Gaithersburg, MD) porque es una vacuna viva atenuada y no debe usarse durante el embarazo (DIII).
- •
Se recomienda indagar de manera preconcepcional si la mujer ha recibido el esquema primario de TdaP o el refuerzo de Td en los últimos 10 años, para tomar decisiones sobre refuerzo de la vacuna (AII).
- •
Si la mujer no ha recibido ningún esquema de vacunación contra tétanos, difteria o tosferina, se recomienda aplicar el esquema primario de 3dosis de TdaP: 2dosis con intervalo de 4semanas y la tercera dosis a los 6 o 12 meses. Posteriormente, debe recibir un refuerzo cada 10 años para Td y por lo menos una de esas dosis debe contener el componente de tosferina en el adulto (AII).
- •
En cada gestación se recomienda administrar una dosis de la vacuna que incluye tosferina TdaP para proteger al recién nacido, que está con mayor riesgo de enfermedad y complicaciones graves por pertussis (AII). En su defecto, la mujer se debe vacunar en el posparto inmediato con una dosis de TdaP (BIII).
La Asociación Colombiana de Infectología (ACIN) agradece a las casas farmacéuticas de Glaxo Smithkline, Pfizer Vacunas, Sanofi Pasteur Vacunas y MSD, y a sus representantes, quienes colaboraron con el desarrollo de estas guías en lo relacionado con la aportación de dineros destinados a estipendios, transportes, mensajería, publicación y reuniones relacionadas con la socialización de estas. Se agradece particularmente a la Sra. Liliana Villamizar, asistente del Dr. J.M.Gómez, a la Sra. Margoth Coba Herrera y a la Sra. Sonia J. Guerrero Lozano, gerente de la ACIN, por su diligencia.