La enfermedad tromboembólica (ETE) venosa en el paciente avanzado es una complicación seria no siempre bien documentada. El objetivo principal es determinar la frecuencia de ETE en el paciente avanzado que ingresa en la Unidad de Agudos de Cuidados Paliativos. Los objetivos secundarios son analizar la frecuencia de tromboprofilaxis (TP) realizada durante la hospitalización, complicaciones asociadas y aceptación por parte del paciente.
Material y métodosEstudio descriptivo prospectivo donde se recogieron datos sociodemográficos de los pacientes incluidos, factores de riesgo asociados a ETE, incidencia de la misma durante la hospitalización y a los 15 días postalta, y complicaciones asociadas con el tratamiento con heparina de bajo peso molecular (HBPM). El conocimiento de los pacientes sobre la TP y la satisfacción fueron evaluados mediante una escala simple ordinal.
ResultadosEntre marzo y junio de 2010 fueron incluidos 140 pacientes que ingresaron de forma consecutiva en la Unidad de Agudos de Cuidados Paliativos. Episodios de ETE ocurrieron en 10 pacientes (7,1%); en 4 de ellos (2,9%) fue la causa del ingreso y en 6 (4,3%) ocurrió durante la hospitalización o en los 15 días postalta. El tromboembolismo pulmonar fue más frecuente que la trombosis venosa profunda de miembros inferiores. Las complicaciones asociadas a la TP fueron menores (6% de sangrado y ningún caso de trombocitopenia). Se observó una mayor estancia media en el grupo de pacientes que desarrollaron ETE o fue la causa de ingreso (17,6 vs. 11,4 días; p<0,05). Los objetivos de la TP primaria eran bien conocidos para el 30% de los pacientes. La mayoría (92%) afirmaron que la administración subcutánea de HBPM no ocasionó malestar.
ConclusionesLa frecuencia de ETE durante la hospitalización es relativamente baja pero asociada a mayor número de complicaciones y estancia prolongada. Los efectos secundarios asociados al empleo de HBPM fueron poco frecuentes y leves. La aceptación de la profilaxis fue muy buena (92%) a pesar de que el conocimiento preciso de su indicación fue bajo (30%).
Son necesarios estudios controlados, aleatorizados para evitar factores de confusión y poder extraer conclusiones definitivas.
Venous thromboembolic (VTD) disease in advanced cancer patients is a serious, not always well documented, complication. Primary aim: to determine the frequency of VTD in advanced cancer patients admitted to an Acute Palliative Care Unit. Secondary aim: to assess the thromboprophylaxis (TP) used during hospitalisation, the associated complications, and patient acceptance of TP.
MethodsThe following variables were recorded in this descriptive prospective study of advanced cancer patients: socio-demographic data, risk factors of VTD, occurrence of VTD on/during hospitalisation and at 15 days post-discharge from hospital, and complications associated with the use of low molecular weight heparin (LMWH). Patient awareness and satisfaction with primary TP was evaluated using an ordinal scale questionnaire.
ResultsBetween March and June 2010, 140 consecutive patients were enrolled. VTD was noted in 10 patients (7.1%); in 4 (2.9%) it was the reason for admission, and in 6 (4.3%) it occurred during admission or 15 days after discharge. Pulmonary thromboembolism was more frequent than deep vein thrombosis. Complications associated with TP were minor (6% bleeding and no thrombocytopenia). A higher mean stay (17.6 vs. 11.4 days; P<.05) was observed in the VTD group. The aims of TP were well known to 30% of patients. The majority of patients (92%) noted that subcutaneous LMWH administration did not cause discomfort.
ConclusionsThe frequency of VTD in advanced cancer patients admitted to a Palliative Care Unit is low, but associated to a longer stay and complications. Adverse effects related to the use of heparin were few, and mild. There was very good patient acceptance (92%) of subcutaneous LMWH use, despite the low awareness of TP (30%).
Further randomised studies are necessary to avoid confounding factors and to draw a definitive conclusion.
La enfermedad tromboembólica (ETE) en el paciente oncológico es una complicación grave. Su frecuencia oscila entre un 4-20%1. Sin embargo estas cifras pueden estar subestimadas, ya que series de necropsias la sitúan alrededor de un 50%2.
En los últimos años, la epidemiología de la ETE, sus factores de riesgo así como sus opciones terapéuticas han atraído el interés de los investigadores3,4. Desafortunadamente, no son muy abundantes los estudios centrados en el paciente con cáncer avanzado por lo que los datos específicos, en esta población, sobre frecuencia, prevención y tratamiento son escasos5. La ausencia de guías y recomendaciones sobre tromboprofilaxis (TP) primaria puede ser la causa de su bajo cumplimiento en las unidades de cuidados paliativos6; estudios epidemiológicos que aporten información sobre la magnitud del problema servirán para mejorar el conocimiento y la práctica de los profesionales que nos dedicamos a la atención del paciente avanzado.
El objetivo principal de este estudio es estimar la incidencia de ETE sintomática (tanto tromboembolismo pulmonar [TEP] como trombosis venosa profunda [TVP]) tanto en los pacientes que ingresan en nuestra Unidad de Agudos de Cuidados Paliativos (UCP), como las ocurridas dentro de los 15 días postalta; distinguiéndose entre las que fueron causa de ingreso, las que se desarrollaron durante el mismo y las que ocurrieron postalta.
Los objetivos secundarios son analizar la práctica de la TP primaria en la unidad, los efectos secundarios derivados de su empleo (primaria o secundaria) y el conocimiento sobre la prevención y grado de aceptación de los pacientes.
Material y MétodosSe incluyeron 140 pacientes que ingresaron de manera consecutiva en la UCP entre marzo y junio de 2010. El consentimiento informado se obtuvo antes de su inclusión. Si el paciente por situación cognitiva o estado general no era capaz de otorgarlo, el familiar responsable era el encargado de hacerlo y en estos casos (n=33) no fue posible la recogida de información referente al conocimiento y grado de aceptación.
En las primeras 48h desde su ingreso se recogieron las variables demográficas sobre el sexo, edad, tipo de cáncer y extensión, estado general empleando el Palliative Performance Scale7 y la estimación de supervivencia empleando el Palliative Prognostic Score8. Los factores de riesgo recogidos para el desarrollo de ETE al margen del tumor primario, fueron: estar en curso de quimioterapia (Qt) o haberla recibido en los 3 meses previos, hormonoterapia, recuento plaquetario, colocación reciente de reservorio venoso, enfermedad tumoral pélvica (primaria o metastásica), enfermedad tumoral en sistema nervioso central (primaria o metastásica) e historia previa de ETE.
Se usó un cuestionario con respuesta ordinal (de 0 a 3) para valorar el conocimiento que tenían los pacientes sobre el objetivo de la TP primaria. El valor 0=«no conocimiento en absoluto»; 1=«escasa información y poco concreta» (p. ej., relacionado con la circulación); 2=«información concreta pero parcial» (p. ej., prevención de TVP) y 3=«información concreta y completa» (p. ej., prevención de TVP/TEP como complicación potencialmente grave).
Del mismo modo, se empleó una respuesta ordinal (de 0 a 2) para evaluar el grado de molestia percibida con la TP primaria en los pacientes: 0=«no me molesta en absoluto»; 1=«es causa de molestia leve»; 2=«es causa de mucho malestar».
Otros datos recogidos fueron la práctica de la TP primaria en la unidad según el criterio del médico tratante (no disponíamos de protocolo específico) y los efectos secundarios derivados de la administración de heparina de bajo peso molecular (HBPM) tanto a dosis profilácticas como terapéuticas (trombocitopenia, sangrado y molestias locales como hematoma o dolor).
El sangrado como complicación se clasificó según criterios de Doyle et al.9. Se consideró sangrado mayor aquel clínicamente manifiesto con un descenso de la Hb≥2,0g/dL, o necesidad de transfusión de ≥2 concentrados de hematíes, sangrado retroperitoneal o intracraneal. El sangrado se consideró menor si a pesar de ser clínicamente manifiesto no cumplía los criterios de mayor.
El recuento plaquetario se obtuvo en los días +7 y +14 del ingreso para descartar trombocitopenia inducida por heparina.
Diariamente se exploraba la aparición de signos compatibles con desarrollo de ETE (disnea súbita, edema unilateral de miembros inferiores [MMII]) y en el caso de tener la sospecha clínica a los pacientes se les realizaba una ecografía doppler de MMII y/o TAC torácica helicoidal que confirmara el diagnóstico. No se utilizó el D-dímero como screening inicial. Si el paciente fallecía durante la hospitalización el médico tratante comunicaba al investigador la probabilidad alta o baja de que la causa estuviera relacionada con ETE.
Una vez el paciente era alta hospitalaria (a los 15 días de la misma) recibía una llamada telefónica o una visita en el área de consulta externa de la unidad para valorar la incidencia de ETE postalta. Esta valoración tras el alta es congruente con estudios, tanto en el paciente quirúrgico como en el paciente médico, que describen mayor porcentaje de desarrollo de ETE en las primeras semanas tras el alta hospitalaria10.
El estudio tuvo la aprobación del comité de ética de referencia.
El tamaño muestral se calculó teniendo en cuenta la frecuencia media de ETE durante la hospitalización en la población oncológica general (5-10%). Para un intervalo de confianza del 95% y una precisión del 0,05 se estimó que 140 pacientes necesitarían ser incluidos. La descripción de las variables se realizó con medidas de centralización y dispersión; las categóricas con números absolutos y porcentaje, y las cuantitativas con media y desviación estándar. La relación entre las variables categóricas se analizó mediante el estadístico Chi cuadrado y entre las variables continuas con el estadístico t de Student. Se empleó el paquete estadístico SPSS v17.
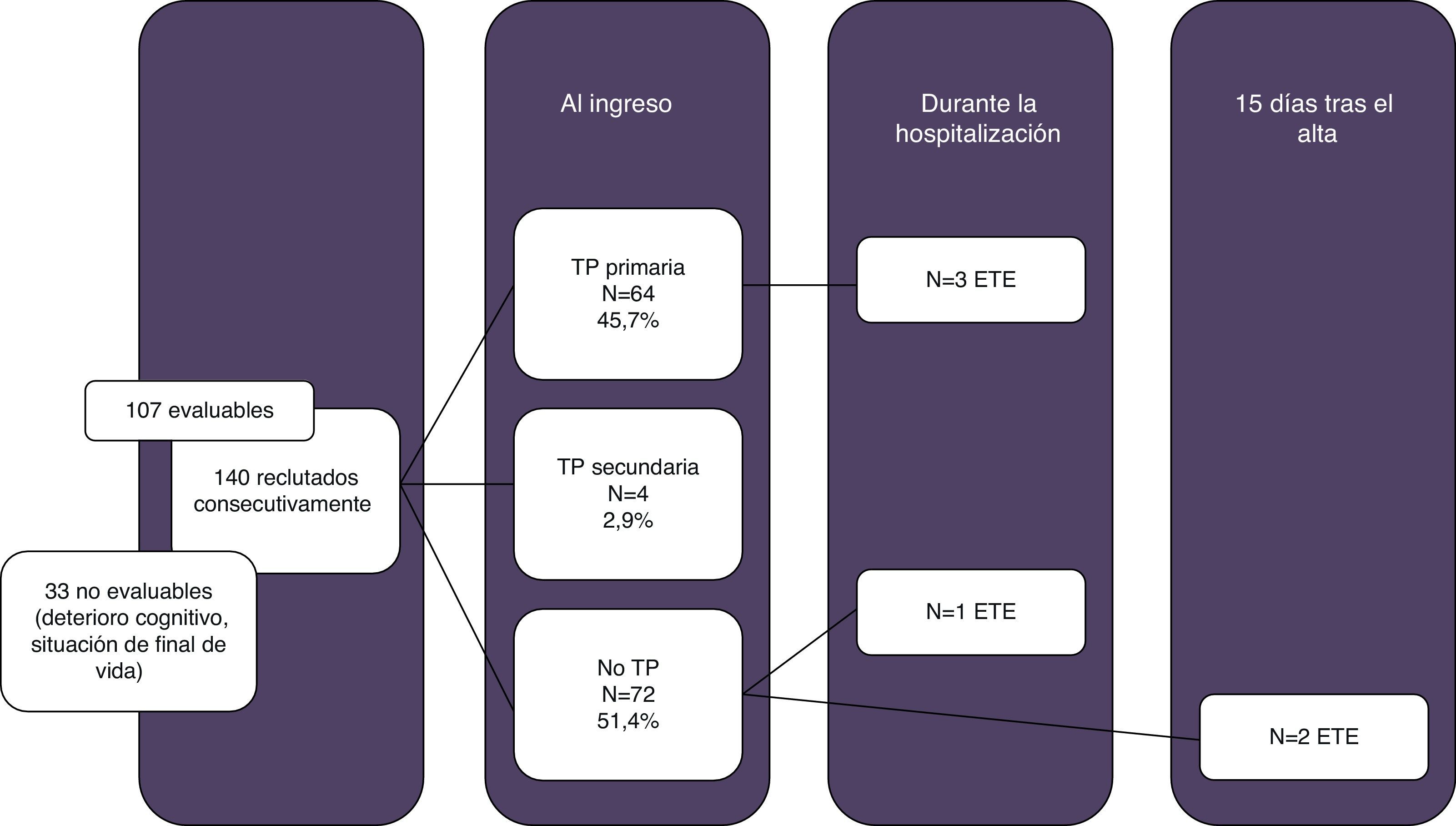
ResultadosSe reclutaron 140 pacientes que ingresaron de forma consecutiva en el cuatrimestre de marzo a junio de 2010, de los cuales 107 (76%) fueron evaluables para conocimiento y satisfacción sobre TP (ver diagrama de flujo en la figura 1). Las características demográficas y factores de riesgo para ETE se resumen en la tabla 1. La TP primaria (dalteparina 5.000U sc/día) se administró al 45,7% de la muestra.
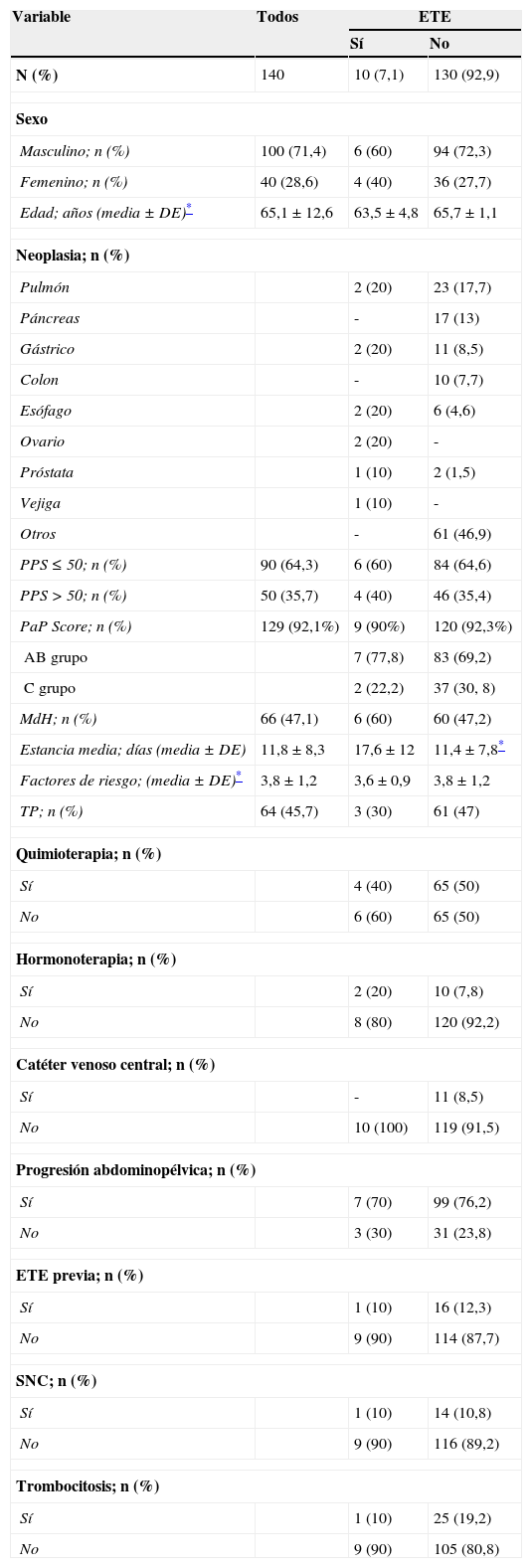
Variables demográficas agrupadas según evento de ETE
| Variable | Todos | ETE | |
|---|---|---|---|
| Sí | No | ||
| N (%) | 140 | 10 (7,1) | 130 (92,9) |
| Sexo | |||
| Masculino; n (%) | 100 (71,4) | 6 (60) | 94 (72,3) |
| Femenino; n (%) | 40 (28,6) | 4 (40) | 36 (27,7) |
| Edad; años (media±DE)* | 65,1±12,6 | 63,5±4,8 | 65,7±1,1 |
| Neoplasia; n (%) | |||
| Pulmón | 2 (20) | 23 (17,7) | |
| Páncreas | - | 17 (13) | |
| Gástrico | 2 (20) | 11 (8,5) | |
| Colon | - | 10 (7,7) | |
| Esófago | 2 (20) | 6 (4,6) | |
| Ovario | 2 (20) | - | |
| Próstata | 1 (10) | 2 (1,5) | |
| Vejiga | 1 (10) | - | |
| Otros | - | 61 (46,9) | |
| PPS≤50; n (%) | 90 (64,3) | 6 (60) | 84 (64,6) |
| PPS>50; n (%) | 50 (35,7) | 4 (40) | 46 (35,4) |
| PaP Score; n (%) | 129 (92,1%) | 9 (90%) | 120 (92,3%) |
| AB grupo | 7 (77,8) | 83 (69,2) | |
| C grupo | 2 (22,2) | 37 (30, 8) | |
| MdH; n (%) | 66 (47,1) | 6 (60) | 60 (47,2) |
| Estancia media; días (media±DE) | 11,8±8,3 | 17,6±12 | 11,4±7,8* |
| Factores de riesgo; (media±DE)* | 3,8±1,2 | 3,6±0,9 | 3,8±1,2 |
| TP; n (%) | 64 (45,7) | 3 (30) | 61 (47) |
| Quimioterapia; n (%) | |||
| Sí | 4 (40) | 65 (50) | |
| No | 6 (60) | 65 (50) | |
| Hormonoterapia; n (%) | |||
| Sí | 2 (20) | 10 (7,8) | |
| No | 8 (80) | 120 (92,2) | |
| Catéter venoso central; n (%) | |||
| Sí | - | 11 (8,5) | |
| No | 10 (100) | 119 (91,5) | |
| Progresión abdominopélvica; n (%) | |||
| Sí | 7 (70) | 99 (76,2) | |
| No | 3 (30) | 31 (23,8) | |
| ETE previa; n (%) | |||
| Sí | 1 (10) | 16 (12,3) | |
| No | 9 (90) | 114 (87,7) | |
| SNC; n (%) | |||
| Sí | 1 (10) | 14 (10,8) | |
| No | 9 (90) | 116 (89,2) | |
| Trombocitosis; n (%) | |||
| Sí | 1 (10) | 25 (19,2) | |
| No | 9 (90) | 105 (80,8) | |
DE: desviación estándar; ETE: enfermedad tromboembólica; MdH: mortalidad durante la hospitalización; PaP Score: Palliative Prognostic Score; PPS: Palliative Performance Scale; SNC: sistema nervioso central; TP: tromboprofilaxis.
En 4 pacientes la ETE fue el motivo de ingreso, en 4 ocurrió durante la hospitalización y en 2 ocurrió dentro de los 15 días postalta. Respecto al tipo de evento: 6 pacientes sufrieron TEP, 3 TVP y uno sufrió ambos. De los 4 pacientes que sufrieron ETE durante la hospitalización, 3 estaban recibiendo TP primaria.
No hubo diferencias respecto al número de factores de riesgo entre los 2 grupos (3,6 grupo ETE vs. 3,8 grupo no ETE).
Pocos efectos secundarios se recogieron con el empleo de la TP (primaria o secundaria). De los pacientes que la recibieron, el 42% no reportó efecto alguno, el 55% desarrolló hematoma no doloroso en el sitio de punción y solo el 3% refirió que el hematoma pospunción generaba dolor. No se observó trombocitopenia atribuible al tratamiento con HBPM en ningún paciente. Tres sufrieron hemorragia menor (hematuria, paracentesis hemática y sangrado periestoma) y un paciente hemorragia mayor (hematuria) con necesidad de transfusión de 2 concentrados y reducción de la dosis de heparina que estaba de forma terapéutica (dalteparina 200U/kg) y no profiláctica.
De los 10 pacientes con ETE, 6 murieron durante la hospitalización siendo la causa de muerte muy probablemente relacionada con la ETE en el 50% de los casos según criterio del médico tratante. El grupo de ETE tuvo una estancia media hospitalaria mayor que el grupo que no sufrió dicha complicación (17,6 días vs. 11,4; p<0,05). La mortalidad fue mayor también en el grupo de ETE (60 vs. 47,2%) pero sin alcanzar significación estadística (p=0,52)
Respecto al conocimiento que tenían los pacientes sobre la TP primaria, el 35% tenían desconocimiento absoluto, el 35% información escasa (algo relacionado con la circulación), el 23% sabía su relación con la TVP y el 7% restante era consciente además de la prevención de TEP como complicación grave durante la hospitalización.
Respecto al malestar relacionado con la administración de TP, al 92% de los pacientes no les generaba ninguno, el 6% lo consideraba una molestia leve y el 2% no pudieron opinar porque nunca habían sido tratados ni preventivamente con HBPM.
DiscusiónLa frecuencia total de ETE observada en nuestro estudio fue un 7,1%; en un 4,3% (n=6) ocurrió durante la hospitalización o en los 15 días postalta y en un 2,9% (n=4) fue la causa de ingreso. Son cifras similares a las recogidas en la literatura11. Esta frecuencia está basada en la sospecha clínica y su posterior confirmación con pruebas de imagen. En ninguno de los casos se inició tratamiento con HBPM sin confirmación previa por imagen. La frecuencia, por tanto, podría verse incrementada si se realizaran pruebas de imagen de screening a todos los pacientes hospitalizados tal y como demostraron Johnson et al.12 observando cómo esta pasaba de un 9 a un 50% respectivamente.
En el caso de los pacientes con cáncer avanzado, también en muchas ocasiones, la sospecha clínica puede verse enmascarada por el contexto clínico: disnea preexistente, dolor torácico o edemas en MMII.
Los factores de riesgo relacionados con la ETE se pueden clasificar en 3 categorías: los relacionados con el propio paciente como edad, comorbilidad, ETE previa, estado protrombótico13–15; los relacionados con el propio cáncer como la localización, periodo que sucede al diagnóstico y la enfermedad metastásica16–18; y los factores relacionados con el tratamiento como el ingreso hospitalario, cirugía, tratamiento quimioterápico, hormonoterapia, tratamiento angiogénico, agentes estimulantes de la eritropoyesis y la colocación de catéteres venosos centrales19–22. Estos factores de riesgo han servido para crear modelos predictivos especialmente en los pacientes en curso de Qt23. En nuestro estudio, se recogió la existencia de dichos factores y se observó que no había diferencia significativa entre el número de factores que tenía el grupo de ETE respecto al que no (3,6 vs. 3,8 respectivamente); ninguna tendencia se observó en ninguno de los factores cuando se analizaron siguiendo un modelo de regresión.
En nuestra serie, los tipos de tumor más frecuentes en el grupo de ETE son concordantes con lo descrito en otros estudios (tracto digestivo [páncreas y estómago] y tracto genitourinario16,17,24); sin embargo, estos datos deben interpretarse con cautela debido al pequeño porcentaje resultante en nuestra muestra.
La ocurrencia de ETE tras el alta hospitalaria está bien documentada, especialmente tras la cirugía oncológica, ya que el riesgo elevado se prolonga debido a la persistencia, incluso más allá de 4 semanas, de factores de coagulación activados. La evidencia sugiere que la TP prolongada tras la cirugía es más eficaz, reduciendo la aparición de ETE25. No hay evidencia sin embargo que apoye la decisión de TP extendida más allá del alta hospitalaria en el paciente médico26.
En el paciente avanzado muchos factores de riesgo persisten tras el alta hospitalaria especialmente los relacionados con comorbilidad, enfermedad metastásica y funcionalidad disminuida13. Si bien aún no existe consenso sobre qué subgrupo de pacientes se beneficia de la TP primaria en el contexto de los cuidados paliativos y la hospitalización, intentar hacerlo referente a la idoneidad de la profilaxis extendida después del alta aún es más difícil26–28. En nuestro caso, no se mantuvo la TP primaria tras el alta en ningún paciente. En los 2 en los que ocurrió ETE dentro de los 15 días postalta, tampoco se administró durante su ingreso hospitalario; ambos habían recibido recientemente tratamiento Qt y uno de ellos además estaba con funcionalidad bastante limitada.
En nuestro estudio 3 de 64 pacientes que estaban recibiendo TP primaria desarrollaron ETE, lo que podría de entrada hacer pensar que tampoco su administración evita con seguridad su aparición. Esta misma observación la describen Weber et al.29 en un estudio prospectivo abierto y aleatorizado en el cual 20 pacientes con cáncer avanzado y una esperanza de vida <6 meses fueron aleatorizados a recibir durante su ingreso o nadroparina (2.850/3.800U<70/>70kg) o no profilaxis; ocurriendo un episodio de ETE y un sangrado mayor en el grupo de nadroparina mientras que hubo 2 sangrados menores en el grupo control.
De los 4 pacientes que sufrieron ETE en nuestro estudio, tres estaban recibiendo HBPM profiláctica, pero en 2 la dosis era menor que la recomendaba para pacientes de alto riesgo. Algunos estudios han demostrado que la dosis de HBPM es de crucial importancia para determinar la eficacia de la terapia. En un estudio prospectivo aleatorizado en pacientes con cáncer que eran intervenidos, Bergqvist30 mostró que la profilaxis con dalteparina 5.000U diaria era más eficaz que dalteparina 2.500U en reducir la incidencia de ETE (8,5 vs. 14,9%; p<0,001) y que la dosis mayor no se asociaba a mayor sangrado.
De acuerdo con la literatura, la frecuencia de efectos adversos relacionados con la terapia con HBPM es baja y de carácter leve31,32. Monreal et al.32, en un trabajo prospectivo para evaluar la eficacia y seguridad a largo plazo de la dalteparina, incluyeron a 203 pacientes con enfermedad metastásica, observando un 5,4% de sangrado mayor y un 7,9% de sangrado menor, siendo la hematuria y el sangrado gastrointestinal los más frecuentes. Tampoco el sangrado fue más frecuente entre los pacientes con enfermedad hepática o a nivel de sistema nervioso central. En nuestro caso, el sangrado ocurrió en el 6% de los pacientes tratados; el único paciente con sangrado mayor fue por hematuria, estaba a dosis terapéuticas de HBPM y sufría como enfermedad de base una neoplasia de vejiga, por lo que la propia enfermedad en sí también hubiera podido contribuir al sangrado. No encontramos ningún caso de trombocitopenia inducida por heparina. Monreal et al.32 describen una frecuencia del 27% aunque los propios autores la atribuyen más al tratamiento con Qt concomitante que a la propia heparina en sí.
Algunos especialistas en cuidados paliativos están en desacuerdo con la TP primaria en el paciente avanzado, justificándose en que es una fuente de malestar. Esos fueron los hallazgos de un estudio cualitativo llevado a cabo en Gran Bretaña e Irlanda entre los directores de centros hospice que opinaban que la TP primaria era una intervención encaminada a prolongar la supervivencia, más que a mejorar la calidad de vida. Sin embargo también reconocían estar receptivos a cambiar esta política si hubiese evidencia que les hiciera pensar lo contrario33.
En nuestra muestra se confirma también, al igual que en otras experiencias, que las inyecciones de heparina son bien aceptadas por los pacientes. Noble et al.34 con metodología cualitativa preguntaron a 28 pacientes ingresados con enfermedad metastásica cómo afectaba dicha terapia en su percepción de la calidad de vida. La respuesta fue que, más que resultar molesta la administración de HBPM, significaba una actitud proactiva en la prevención de síntomas potencialmente molestos. Las medias de compresión sin embargo, a pesar de su amplio uso en cuidados paliativos, son una medida menos aceptada por parte de los pacientes.
Estos resultados contrastan con los reportados por Legault et al.35 que, en un intento de mejorar su protocolo de administración de TP primaria a los pacientes admitidos en la UCP, observaron que su retirada, cuando los pacientes estaban recibiéndola a dosis profilácticas, era relativamente fácil al argumentárselo al paciente y familia. Observaron que 41 (32,3% de la muestra) pacientes la tenían prescrita a su ingreso en su unidad; de ellos, 36 (87,8%) consintieron de manera consensuada su retirada y solo uno desarrolló ETE durante la hospitalización. En los 5 casos en los que no se retiró fue debido a fibrilación auricular crónica en un paciente y en los 4 restantes por negativa del paciente o la familia. De los 71 pacientes (56%) que no la estaban recibiendo al ingreso, a ninguno se le inició durante la hospitalización y 6 desarrollaron ETE. El restante 11,7% estaba con TP secundaria al ingreso.
En nuestro estudio, la estancia media de los pacientes del grupo de ETE fue significativamente mayor y asociada a un mayor índice de complicaciones y mortalidad. Estos resultados, a pesar de no poder ser concluyentes por la existencia de factores de confusión, pueden hacernos pensar que un episodio de ETE en el paciente avanzado podría asociarse a mal pronóstico sirviendo como un factor más para añadir a la ecuación de factores predictores. Sucedieron 3 ETE tanto en la cohorte que recibió TP como en la que no. No hubo más sangrados en la que recibió HBPM pero tampoco se previno más ETE.
En nuestra opinión la TP en el paciente avanzado no puede tratarse en términos categóricos. Una profilaxis indiscriminada, independientemente de la situación pronóstica, ni sería coste-eficaz ni estaría basada en las necesidades del paciente36. Aún está por dilucidar qué subgrupo de pacientes son los verdaderamente beneficiados de estas medidas, y lo que es más difícil aún, si existe un grupo de pacientes que se beneficiaría de la TP extendida o incluso tras el alta hospitalaria26. Por otro lado, se debe considerar que la decisión de iniciar la TP al ingreso en la UCP no significa que tenga que mantenerse a toda costa durante todo el proceso de hospitalización; forma parte del plan terapéutico y como tal debe reevaluarse a diario al igual que se hace con el resto del plan de cuidados y tratamiento. Es de gran importancia también involucrar al paciente y a la familia en esta toma de decisión (iniciar o continuar con la TP al ingreso en unidades de paliativos) tal y como proponen en su trabajo Legault et al.35 ante la falta de una clara evidencia que apoye la TP de forma rutinaria.
Este estudio presenta varias limitaciones: es un estudio no controlado, basado en la práctica clínica de nuestra unidad de hospitalización en la que no existía ningún protocolo específico con relación a la TP. Aunque en los resultados se observa que el porcentaje que recibió TP primaria y el que no fueron similares, la inclusión de los pacientes en un grupo o en otro no fue aleatorizada, sino por decisión del médico tratante, por lo que no podemos definir exactamente el criterio seguido para su indicación. La puesta en marcha del estudio podría haber contribuido a una mayor «toma de conciencia» sobre el problema, lo cual pudo influir en la cantidad de pacientes que recibieron TP. Finalmente se tuvieron en cuenta únicamente los episodios de ETE sintomática, lo cual puede infravalorar la magnitud real del problema. La valoración a los 15 días postalta para detectar el desarrollo de ETE tras la hospitalización se realizó en algunos pacientes de forma telefónica, aspecto que podía haber minimizado el grado de detección, que hubiera sido mayor con una entrevista presencial a todos.
Se precisan estudios controlados aleatorizados que faciliten la implementación de guías de actuación en TP en unidades de paliativos en las que se tengan en cuenta tanto la evidencia disponible como las preferencias del paciente y la relación coste-eficacia de la profilaxis, antes de poder extraer conclusiones definitivas. Podría ser aceptable iniciar una terapia profiláctica si la calidad de vida es lo suficientemente buena como para comenzar un tratamiento anticoagulante en el caso de ser necesario por la aparición de ETE y el paciente presentara un incremento potencialmente transitorio de riesgo que es el que motiva la hospitalización (insuficiencia cardiaca, proceso infeccioso intercurrente, limitación funcional por dolor, fractura, compresión, entre otros).
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos a la Dra. Eugenia López, al Dr. Christian Villavicencio y al Dr. Jesús González su ayuda y colaboración al ser los médicos tratantes de los pacientes incluidos; a Daniel Cuadras por su ayuda con el análisis estadístico y al Profesor Eduardo Bruera por sus consejos y lectura crítica del manuscrito.