Los tumores hipofisarios primarios son clasificados por la Organización Mundial de la Salud como adenoma típico, adenoma atípico y carcinoma. Existen datos limitados sobre la incidencia y la prevalencia de tumores hipofisarios, siendo en Portugal escasos, obsoletos o inexistentes. Presentamos un estudio que evalúa los adenomas hipofisarios (AH) basado en la población de Lisboa, cuyo objetivo es describir la prevalencia de todos los subgrupos, revisando la incidencia de este tipo histopatológico «atípico» y su correlación con el subtipo de tumor, invasión y recurrencia.
Pacientes y métodosSe realizó un análisis descriptivo retrospectivo de pacientes diagnosticados de AH entre 2004 y 2013, en el Hospital Universitario de Santa Maria (Lisboa), un centro de referencia nacional.
ResultadosDe 220 AH diagnosticados, 28 (12,7%) cumplían criterios de lesiones atípicas, 23 de los cuales (82,1%) fueron macroadenomas y 13 (46,4%) mostraron radiológicamente evidencia de invasión. La edad osciló entre 29-81 años (media 53,4 años). Once pacientes (39,3%) tenían tumores funcionantes. Dieciséis (57,1%) de los 28 pacientes presentaron tumores recurrentes; en 100 de los adenomas diagnosticados, con seguimiento superior a 5 años, se observó una tasa de recurrencia en AH atípicos hasta 7 veces superior. En estudios inmunohistoquímicos destacaron los positivos a ACTH (28,6%), a gonadotrofinas (25%) y a prolactina (17,9%). El índice proliferativo (Ki67) varió entre el 3 y el 25% (media 6,4%).
ConclusionesLos AH atípicos corresponden al 12,7% de los AH resecados, tendiendo a ser macroadenomas, invasivos y recurrentes. No encontramos diferencias entre AH típicos y atípicos en cuanto al potencial metastásico.
Primary pituitary tumours are classified by the World Health Organization as typical adenoma, atypical adenoma, or carcinoma. Information on the incidence and prevalence of these pituitary tumours is limited, and these data in Portugal are scarce, obsolete, or non-existent. Our study evaluates pituitary adenomas (PA) in the population of Lisbon, and it aims to describe the prevalence of all subgroups in order to revise the incidence of the ‘atypical’ histological type and its correlation to tumour subtype, invasion, and recurrence.
Patients and methodsA retrospective, descriptive analysis of patients with PA diagnosed between 2004 and 2013 was performed at Santa Maria University Hospital, a national reference centre.
ResultsOf the 220 PA cases diagnosed, 28 (12.7%) fulfilled criteria for atypical lesions, and within that group, 23 were macroadenomas (82.1%) and 13 showed radiological evidence of invasion (46.4%). Ages ranged from 29 and 81 years (mean, 53.4 years). Eleven patients (39.3%) had functional tumours. Sixteen of the 28 patients (57.1%) experienced tumour recurrences; in the 100 adenomas monitored for more than 5 years, the recurrence rate in atypical PA was 7 times higher than in typical PA. Immunohistochemically, 28.6% of the tumours stained positively for ACTH, 25% for gonadotrophins, and 17.9% for prolactin. The proliferation index (Ki67) ranged from 3% and 25% (mean, 6.4%).
ConclusionsAtypical PAs make up 12.7% of all surgically treated PA cases, and they tend to be invasive and recurrent macroadenomas. We found no differences in metastatic potential between typical and atypical PA.
Los tumores de la hipófisis representan 10 a 15% de los tumores cerebrales1. El adenoma hipofisario (AH) es la neoplasia selar más común2, representando el tercer tumor intracraneal primario más frecuente en neurocirugía, superado por gliomas y meningiomas1. Estudios recientes demuestran un aumento en la prevalencia de los AH hasta 4 veces superior a lo que se pensaba3,4. Los datos sobre incidencia de AH son escasos, y las series basadas en resonancia magnética (RM) y en autopsias son discordantes con las series quirúrgicas de centros terciarios.
Los AH corresponden a una proliferación monoclonal de células adenohipofisarias, más frecuentes en mujeres, especialmente entre la 3.ª y 6.ª década, aunque puede afectar a cualquier grupo etario1,5. Los AH no son homogéneos; cada subtipo tiene su propia presentación clínica, secreción hormonal, tendencia para la invasividad, características histopatológicas, pronóstico y tratamiento6.
Desde la primera clasificación morfológica propuesta por Cushing en 1912, se han realizado numerosos intentos para clasificar histológicamente los AH. Esta clasificación se basa en: a) criterios histológicos, aunque esta clasificación tintorial con hematoxilina-eosina (HE) no se correlaciona con el estado funcional de los tumores; sin embargo, la información que aporta continúa siendo valiosa, al permitir el diagnóstico diferencial con otras patologías, la evaluación de atipia celular o actividad mitótica, así como la presencia de hemorragia o necrosis; b) criterios inmunohistoquímicos, considerado el gold standard del diagnóstico, para el estudio de las principales hormonas hipofisarias —PRL, GH, ACTH, FSH, LH y TSH—, al que se puede añadir alfa-subunidad de las glucoproteínas (FSH, LH y TSH); c) criterios ultraestructurales, aunque la microscopia electrónica, una técnica costosa y larga, no se realiza de rutina7; d) criterios clínicos y bioquímicos, como la presentación clínica y la función hipofisaria para conocer si es o no funcionante; e) criterios de imagen, para definir el tamaño tumoral y su extensión selar y extraselar, y e) los hallazgos quirúrgicos.
El aspecto más controvertido de la última clasificación de la Organización Mundial de la Salud (OMS, 2004)8 es la introducción de un sistema para graduar los tumores endocrinos primarios de la hipófisis. Estos tumores se clasifican como adenoma típico (ICD 8272/0), adenoma atípico (ICD 8272/1) y carcinoma hipofisario (ICD 8272/3)8. La mayoría de los AH son típicos, con características histológicas «blandas», figuras de mitosis infrecuentes y un índice proliferativo (Ki67) inferior al 3%. Los AH atípicos muestran un comportamiento borderline o incierto, con características morfológicas atípicas indicativas de comportamiento agresivo (como crecimiento invasivo), un índice mitótico elevado, un índice de proliferación celular (Ki67) superior al 3% y extensa inmunopositividad para la proteína p53. Sin embargo, las diferencias entre adenomas «típicos» y «atípicos» no están claramente definidas. No existen criterios morfológicos para distinguir los AH atípicos localmente agresivos de los carcinomas cuando el tumor está limitado a la silla turca9. Las características morfológicas estándar asociadas a malignidad (hipercelularidad, pleomorfismo nuclear y celular, actividad mitótica aumentada, necrosis e invasión dural/ósea) suelen estar presentes en el carcinoma hipofisario, pero no son necesariamente diagnósticas. El mecanismo de progresión de los AH a tumores más agresivos e invasivos no está totalmente dilucidado; no se ha demostrado un continuum desde adenoma «típico» a adenoma «atípico» y carcinoma. El desarrollo de un carcinoma hipofisario a partir de un adenoma (transformación maligna) es excepcional y en la actualidad se carece de datos sobre esa secuencia10,11.
Desde 2004 algunos estudios han aportado su experiencia clínica con esta nueva clasificación, y pocos determinan la incidencia, el subtipo de tumor y las características clinicopatológicas de los AH «atípicos»5,12,13.
El objetivo del presente estudio es identificar la incidencia, las características clínico-histopatológicas, las recurrencias clínicas, la invasión local y el seguimiento postoperatorio de los AH diagnosticados en un centro de referencia de Portugal en los últimos 10 años, sobre todo de aquellos que histopatológicamente satisfacen los criterios para ser llamados «atípicos»8.
Pacientes y métodosEste estudio retrospectivo se ha realizado en el Hospital Universitario de Santa Maria en Lisboa, un centro de referencia en Portugal, con larga tradición neuroquirúrgica. La población de referencia de Lisboa es de 545.245 habitantes con un área metropolitana de 2.250.533 habitantes14, en una superficie de 2.957,4km2, y corresponde al 27% de la población del país. Se incluyó a los pacientes diagnosticados y tratados quirúrgicamente por vía endonasal transesfenoidal con confirmación histológica desde el 1 de enero del 2004 hasta el 31 de diciembre del 2013. Los criterios generales para intervenir los AH en nuestro centro fueron: aquellos tumores que generaban acromegalia o enfermedad de Cushing, macroadenomas clínicamente no funcionantes, sobre todo aquellos que ocasionaban alteraciones compresivas sobre estructuras vecinas (afectación del campo visual, afectación de pares craneales, cefalea, etc.) y los prolactinomas con clínica compresiva que no respondieron rápidamente al tratamiento médico, o con intolerancia a la medicación dopaminérgica.
Se revisaron retrospectivamente un total de 235 pacientes, de los cuales se excluyó a 15 pacientes con tumores no endocrinos, otras lesiones de la región selar no adenomatosas y procesos inflamatorios, quedando un total de 220 pacientes con AH, de los que se revisaron los expedientes clínicos, datos de laboratorio, radiológicos y patológicos. Los AH se clasificaron según la versión de 2004 de la OMS sobre tumores de órganos endocrinos8. De los 220 adenomas, 28 casos presentaban rasgos morfológicos sugestivos de mayor agresividad biológica (como pleomorfismo nuclear), actividad mitótica elevada, índices de proliferación celular (Ki67) superiores al 3% y extensa inmunopositividad para la proteína p53, cumpliendo los criterios de adenoma «atípico» según esta clasificación. Se han propuesto otros parámetros como la catepsina B o la MMP-9 (metaloproteasa-9)15, evaluación de la actividad proliferativa usando marcadores antiapoptóticos como el bcl-2, análisis de índices de DNA topoisomerasa ii-alfa, expresión de ciclo-oxigenasa ii, detección de la expresión de telomerasa o, estudios con galectina-3. Pero, desafortunadamente, ninguno ha mostrado mayor utilidad como marcador del comportamiento biológico que el subtipo histológico basado en el contenido hormonal y la estructura celular, que continúan siendo los mejores marcadores predictivos independientes del comportamiento agresivo16,17. La ausencia del gen p53, la disminución en la expresión del gen nm23 y las anomalías de la p27, el análisis de vascular endotelial growth factor (VEGF), fibroblast growth factor receptor 4 (FGFR4), pituitary tumor transforming gene (PTTG), deleciones en el cromosoma 11 y perfil de micro-RNAs también se han propuesto para valorar la agresividad de estos tumores, pero no se han contemplado hasta ahora dentro de los criterios para la clasificación de los AH15–18.
El tamaño del tumor se determinó por RM, clasificándolos como microadenomas (≤ 1cm), macroadenomas (>1 y ≤ 4cm) o adenomas gigantes (> 4cm). Se definió la invasión tumoral por las características de la RM preoperatoria. En esta se evaluó la invasión del seno cavernoso de acuerdo con la clasificación de Knosp et al.19. Esta clasificación se define por la relación de las líneas carótidas con los límites de la invasión. Estos autores proponen la clasificación de los tumores en cinco grados (de 0 a 4) de acuerdo con los siguientes criterios: grado 0, el tumor no invade el seno cavernoso, estando preservadas todas las estructuras anatómicas intracavernosas; grado 1, el tumor sobrepasa la tangente medial (definida como la tangente que une los dos bordes mediales de la carótida supra e intracavernosa) pero no sobrepasa la línea tangencial que une los 2 centros de la carótida supra e intracavernosa; grado 2, el tumor se extiende por fuera de la línea intercarotídea, pero no sobrepasa la tangente lateral de la carótida intrasupracavernosa; grado 3, el tumor se extiende lateralmente a la línea tangencial lateral que une la porción carotídea supracavernosa con la intracavernosa, y grado 4, el tumor envuelve totalmente la carótida intracavernosa, estando todos los compartimientos venosos obliterados. Se evaluaron los niveles hormonales previos y posteriores a la cirugía, antecedentes de cirugía hipofisaria previa, tratamiento adicional y recurrencias postoperatorias durante el seguimiento, definidas por la reaparición del tumor en RM para adenomas no funcionantes y por la hipersecreción hormonal para los funcionantes.
El estudio histoquímico (HE y reticulina) e inmunohistoquímico (PRL, GH, ACTH, FSH, LH, alfa-subunidad, TSH, Ki67 y p53) se realizó en secciones fijadas con formalina y embebidas en parafina. Se realizaron secciones de 2 micras (para HE), 4 micras (para coloración de reticulina) y 2 micras (para estudio inmunohistoquímico), que fueron desparafinadas. Para la inmunohistoquímica fueron sometidas a recuperación antigénica e incubadas con anticuerpos individuales dirigidos contra hormonas hipofisarias específicas o proteínas celulares (tabla 1). El índice de proliferación celular (Ki67) se calculó como el porcentaje de núcleos positivos en 500 a 2000 células tumorales en las áreas de mayor inmunopositividad, analizados en microscopio óptico con aumento de 400×. En casos equívocos, se calculó también con la ayuda de un software procesador de imagen de análisis inmunohistoquímico, método que comparado con el porcentaje calculado por un patólogo con experiencia es coincidente en el 89,7% de los casos20. Debido a la detección a veces equívoca de p53 y a la ausencia de un valor pronóstico de corte validado, se consideró como positivo hallar más de 10 núcleos con positividad fuerte por 10 campos de grande ampliación (CGA) analizados en microscopio óptico con aumento de 400×, en concordancia con la propuesta anteriormente realizada de «células dispersas positivas aisladas»21.
Anticuerpos utilizados, procedencia, dilución y clon
| Anticuerpo frente a | Procedencia | Dilución | Clon |
|---|---|---|---|
| PRL | Dako | 1:300 | Policlonal |
| GH | Dako | 1:400 | Policlonal |
| ACTH | Dako | 1:100 | O2A3 |
| FSH | Novocastra | 1:25 | INN-HFSH-60 |
| LH | Dako | 1:100 | Policlonal |
| Alfa-subunidad | Novocastra | 1:200 | 4E12 |
| TSH | Serotec | 1:50 | AHP523 |
| Ki67 | Dako | 1:150 | MIB-1 |
| p53 | Novocastra | 1:70 | D07 |
El análisis estadístico se realizó con el software científico GraphPad Prism versión 6.05 (GraphPad Software, Inc. California, EE. UU.). Para comparar los datos categóricos se utilizó un test de Fisher exacto de 2 colas (bilateral), mientras que se utilizó una prueba t de Student no apareada para comparar subgrupos. La significación estadística se definió como un valor de p<0,05.
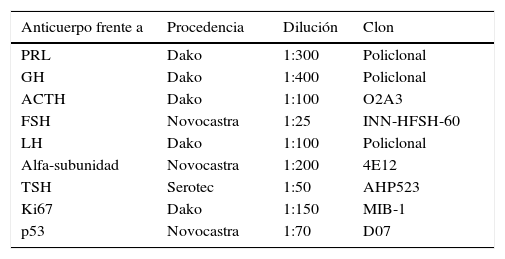
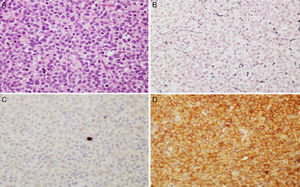
ResultadosLos 220 AH operados por vía endonasal transesfenoidal supondría una prevalencia del 9,8% y una incidencia en 2013 de 1,24 casos por 100.000 habitantes. La edad media al diagnóstico fue de 54±10.5 años (rango 13 a 104 años), con 124 mujeres y 96 varones. Siguiendo la clasificación de la OMS8, 192 tumores (87,3%) fueron clasificados como AH típicos (fig. 1) y 28 (12,7%) como AH atípicos (fig. 2). No se detectó ningún carcinoma primario hipofisario.
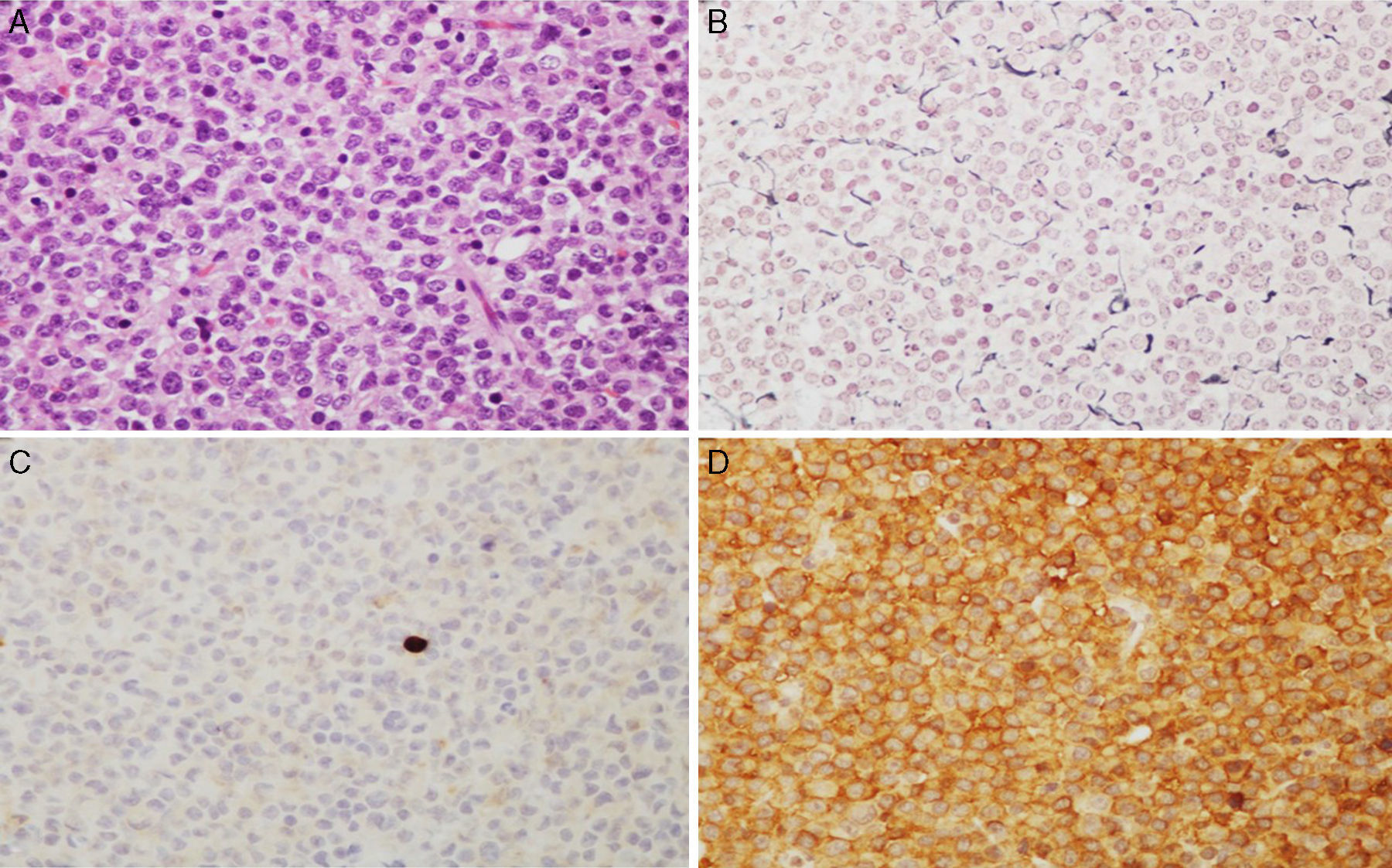
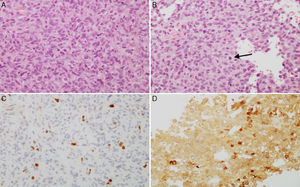
Imágenes microscópicas de un adenoma hipofisario típico positivo para GH. A) Se observa una proliferación en sábana de células monomórficas, con núcleos redondos u ovalados y moderada cantidad de citoplasma eosinófilo (hematoxilina-eosina 200×). B) La técnica histoquímica de reticulina demuestra apagamiento de la arquitectura acinar adenohipofisaria habitual (Gomori reticulina 200×). C) El índice de proliferación celular es bajo (< 1%, Ki67 200×). D) El adenoma muestra fuerte inmunorreactividad citoplasmática para GH (GH 200×).
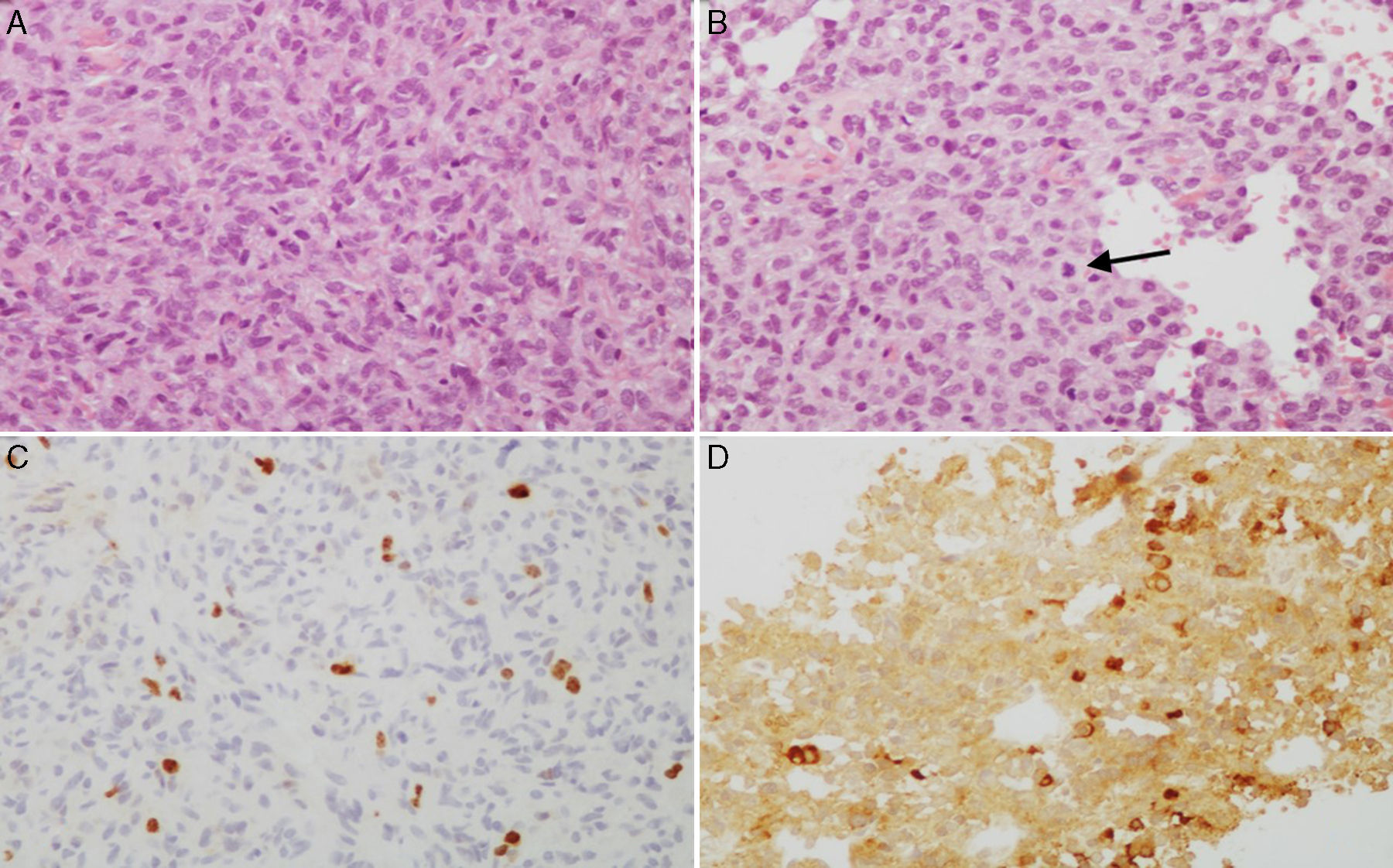
A y B) Imágenes microscópicas de un adenoma hipofisario atípico productor de prolactina. Se trata de un tumor moderada a densamente celular, compuesto por células de núcleo grande y ocasionalmente pleomórfico, nucléolo prominente y moderada cantidad de citoplasma eosinófilo pálido. Se observan figuras mitóticas dispersas (flecha) (hematoxilina-eosina 200×). El adenoma muestra elevado índice de proliferación celular (4%) (C, Ki67 200×) e inmunorreactividad citoplasmática en algunas células para prolactina (D, PRL 200×).
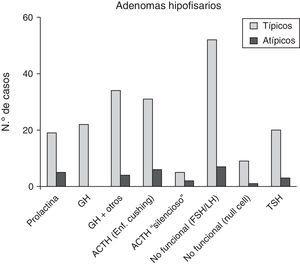
De los 28 pacientes con AH atípicos, 14 (50%) eran mujeres. El rango de edad fue entre 29 y 81 años (media 53,4±9,9 años). Veintitrés pacientes (82,1%) tenían macroadenomas, con invasión del tejido circundante en estudios neurorradiológicos preoperatorios en 13 casos (46,4%). Once (39,3%) eran tumores funcionantes (4 casos de acromegalia, 6 con enfermedad de Cushing y uno secretor de TSH con hipertiroidismo). Un caso se presentó como apoplejía hipofisaria. El análisis inmunohistoquímico mostró positividad a ACTH en 8 (28,6%), de los que 6 correspondían clínicamente a enfermedad de Cushing y 2 eran «silenciosos»; en 7 AH clínicamente no secretores se comprobó positividad para gonadotrofinas (25%) y 5 casos fueron inmunohistoquímicamente positivos a prolactina (17,9%) (fig. 3 y tabla 2). El índice de proliferación celular (Ki67) fue entre el 3 y el 25% de las células tumorales, con un valor promedio de 6,4% (osciló entre el 3 y el 5% en 17, el 5 y el 10% en 10 y entre el 20 y el 25% en un paciente).
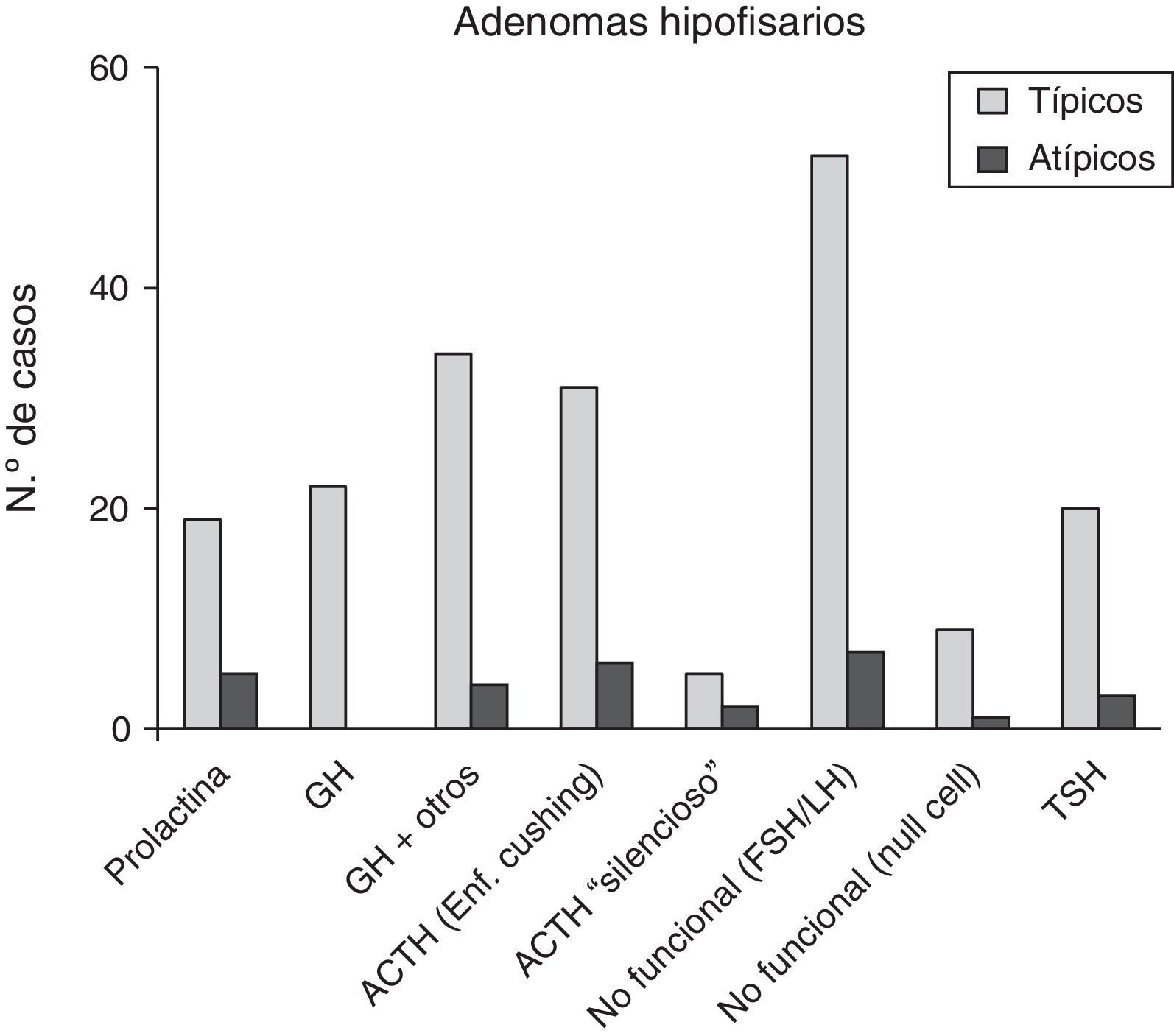
Características clínicas e histopatológicas de los 220 pacientes sometidos a cirugía transesfenoidal por un adenoma hipofisario
| N.° pacientes (%) | ||||
|---|---|---|---|---|
| Características | Pacientes | Adenoma típico | Adenoma atípico | Valor p |
| N.° total de pacientes | 220 (100) | 192 (87,3) | 28 (12,7) | NA |
| Edad media en años +/- DE (rango) | 54±10,5 (13-104) | 53,9±10,5 (13-104) | 53,4±9,9 (29-81) | |
| Sexo | 0,5422 | |||
| Femenino | 124 (56,4) | 110 (57,3) | 14 (50) | |
| Masculino | 96 (43,6) | 82 (42,7) | 14 (50) | |
| Tamaño del tumor | 0,0010 | |||
| Microadenoma | 103 (46,8) | 98 (51) | 5 (17,9) | |
| Macroadenoma | 117 (53,2) | 94 (49) | 23 (82,1) | |
| Extensión/invasión en RM | 38 (17,3) | 25 (13) | 13 (46,4) | 0,0001 |
| Recurrencia | 36 (16,4) | 20 (10,4) | 16 (57,1) | 0,0001 |
| Adenomas funcionales | 139 (63,2) | 128 (66,7) | 11 (39,3) | 0,0065 |
| Apoplejía | 9 (4,1) | 8 (4,2) | 1 (3,6) | 1,0000 |
| Subtipo histopatológico | ||||
| PRL | 24 (10,9) | 19 (9,9) | 5 (17,9) | 0,2024 |
| GH | 22 (10) | 22 (11,5) | 0 (0) | 0,0853 |
| GH+otra positividad | 38 (17,3) | 34 (17,7) | 4 (14,3) | 0,7933 |
| ACTH (enfermedad de Cushing) | 37 (16,8) | 31 (16,1) | 6 (21,4) | 0,5874 |
| ACTH «silencioso» | 7 (3,2) | 5 (2,6) | 2 (7,1) | 0,2192 |
| FSH/LH | 59 (26,8) | 52 (27,1) | 7 (25) | 1,0000 |
| Null-cell adenoma | 10 (4,6) | 9 (4,7) | 1 (3,6) | 1,0000 |
| TSH | 23 (10,5) | 20 (10,4) | 3 (10,7) | 1,0000 |
Significación estadística p<0,05.
ACTH: adrenocorticotropic hormone; FSH: follicle-stimulating hormone; GH: growth hormone; LH: luteinizing hormone; NA: no atribuible; PRL: prolactina; RM: resonancia magnética; TSH: thyroid-stimulating hormone.
Se presentaron recurrencias en 36 de los 220 AH (16,4%) tras un plazo medio de 56,2±31,4 meses (con rango de 3 a 312 meses); 20 correspondían a AH típicos (20/192, 10,4%), de los que 2 correspondían a macroadenomas clínicamente no funcionantes pero positivos para prolactina, 2 de acromegalia por macroadenomas positivos a GH, 4 microadenomas causantes de enfermedad de Cushing y un macroadenoma clínicamente «silencioso» positivos a ACTH, 6 macroadenomas clínicamente no secretores con positividad inmunohistoquímica para gonadotrofinas y otros 5 macroadenomas clínicamente no secretores con positividad para TSH, uno de los cuales se presentó como apoplejía hipofisaria.
Dieciséis de los 28 AH atípicos (16/28, 57,1%) presentaron recurrencias; de estos, 12 eran clínicamente no secretores (75%), en los que la inmunohistoquímica fue positiva para prolactina en 3 (todos macroadenomas), para ACTH en 2 macroadenomas («silenciosos»), para gonadotrofinas en 5 macroadenomas, un macroadenoma con positividad para TSH y 1 macroadenoma calificado de null-cell adenoma (que son aquellos caracterizados por la ausencia de inmunorreactividad a todos los marcadores hormonales específicos de diferenciación de células de la adenohipófisis); 3 casos (2 microadenomas y un macroadenoma con apoplejía hipofisaria) se presentaron clínicamente como enfermedad de Cushing positivos a ACTH, y hubo un macroadenoma secretor de TSH con hipertiroidismo (tabla 3).
Perfil clínico e inmunohistoquímico de los 36 pacientes que presentaron recurrencia tumoral
| N.° de pacientes | |||
|---|---|---|---|
| Características | Pacientes | AH típico | AH atípico |
| N.° total de pacientes | 36 | 20 | 16 |
| Tamaño del tumor | |||
| Microadenoma | 6 | 4 | 2 |
| Macroadenoma | 30 | 16 | 14 |
| Clínica | |||
| Acromegalia Enfermedad de Cushing Hipertiroidismo No funcionantes | 2 7 1 26 | 2 4 0 14 | 0 3 1 12 |
| Subtipo inmunohistoquímico | |||
| PRL | 5 | 2 | 3 |
| GH | 2 | 2 | 0 |
| ACTH | 10 | 5 | 5 |
| FSH/LH | 11 | 6 | 5 |
| Null-cell adenoma | 1 | 0 | 1 |
| TSH | 7 | 5 | 2 |
ACTH: adrenocorticotropic hormone; AH: adenoma hipofisario; FSH: follicle-stimulating hormone; GH: growth hormone; LH: luteinizing hormone; PRL: prolactina; TSH: thyroid-stimulating hormone.
En los 100 AH que fueron seguidos más de 5 años, también se comprobaron más recidivas en los AH atípicos (8/13; 61,5%) que en los AH típicos (7/87; 8%; p<0,0001).
Los factores preoperatorios que se correlacionaron con mayor probabilidad de AH atípico fueron el tamaño tumoral (49% de macroadenomas en los AH típicos vs. 82,1% en los atípicos, p=0,0010), la evidencia de invasión en estudios de neuroimagen (13% para los típicos vs. 46,4% para los atípicos, p=0,0001) y el ser clínicamente secretores (66,7% para los típicos vs. 39,3% para los atípicos, p=0,0065). No se observaron diferencias en la edad, el sexo, la presentación como apoplejía hipofisaria y el subtipo histológico entre AH típicos y atípicos.
En cuanto a la invasión local, un 12% de los AH típicos (3/25) mostraron invasión infraselar (2 con acromegalia con positividad para GH y un macroadenoma no secretor con positividad inmunohistoquímica para prolactina); un 88% (22/25) presentó invasión supraselar (un con acromegalia con positividad para GH y 21 macroadenomas no secretores: 4 con positividad inmunohistoquímica para prolactina, uno positivo para ACTH, 12 positivos para gonadotrofinas y 4 para TSH).
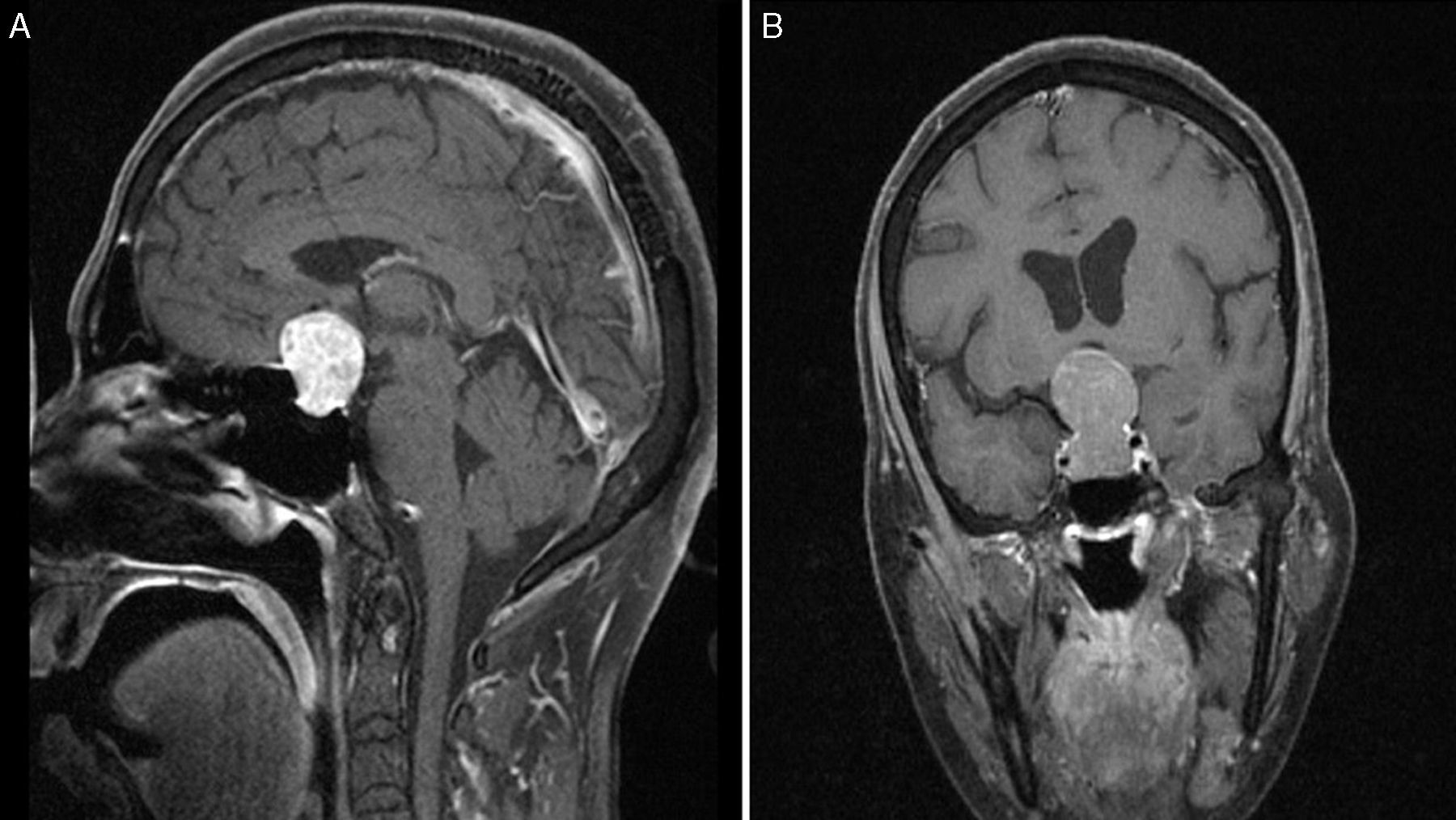
En cuanto a la invasión local de los AH atípicos, de los 13 que la presentaron, 12 (92,3%) eran macroadenomas y un microadenoma (positivo a prolactina); un 23,1% (3/13) mostró invasión infraselar con erosión del suelo de la silla turca (uno acromegalia con positividad a GH y TSH, uno enfermedad de Cushing con positividad a ACTH y uno null-cell adenoma); el 69,2% (9/13) presentó invasión supraselar (uno correspondía a una acromegalia con positividad a GH, PRL y TSH, y 8 eran clínicamente no funcionantes, de los que 2 eran positivos a prolactina, 2 eran positivos a ACTH clínicamente «silenciosos», 3 a gonadotrofinas y uno a TSH); un macroadenoma no secretor positivo a prolactina (7,7%) invadía el seno cavernoso derecho (fig. 4).
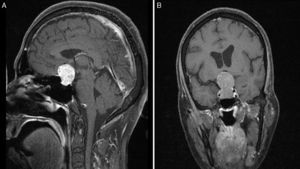
Imágenes preoperatorias de resonancia magnética poscontraste en T1 sagital (A) y coronal (B), obtenidas en un paciente con macroadenoma atípico, grado 4 según la clasificación de Knosp. Nótese la alta propensión a la extensión supraselar y bilateral al seno cavernoso, la erosión del dorso de la silla turca y la presencia de hidrocefalia secundaria tumoral.
Aunque la mayoría de los AH presentan un fenotipo benigno22, un pequeño subgrupo exhibe una presentación intermedia, entre actividad biológica benigna y maligna, con más crecimiento localmente agresivo, capacidad de invadir el seno esfenoidal o cavernoso, crecimiento supraselar y recidivas.
En esta serie de AH diagnosticados en un centro de referencia en Portugal en los últimos 10 años, hemos observado una incidencia de AH atípicos en el 12,7% (28/220) de los pacientes operados, de los cuales el 39,3% eran hormonalmente funcionantes (4 casos de acromegalia, 6 con enfermedad de Cushing y uno secretor de TSH con hipertiroidismo), el 82,1% macroadenomas y el 46,4% mostraba evidencia de invasión a estructuras adyacentes. Scheithauer et al. (2006) identificaron 6 casos de AH atípico de un total de 78 AH (14,7%), Zada et al. (2011) identificaron 18 casos de un total de 121 AH (14,8%) y Yildirim et al. (2013) identificaron 13 casos de AH atípico de un total de 146 AH (8,9%)5,12,13. Nuestro estudio reveló 28 casos de AH atípico de un total de 220 AH (12,7%), un porcentaje en concordancia con estos datos de la literatura, confirmando que los AH atípicos no son tan infrecuentes como previamente se pensaba23.
En cuanto al subtipo, los AH atípicos más frecuentes a nivel clínico fueron los secretores de ACTH (6 con enfermedad de Cushing), seguidos de los secretores de GH (4 casos de acromegalia). A nivel histopatológico, los AH atípicos más frecuentes también fueron los positivos a ACTH (28,6%), seguidos de los positivos a gonadotrofinas (25%) y a prolactina (17,9%), representando estos el 71,5% del total. Todos los adenomas positivos a GH correspondían a acromegalia y mostraron también inmunorreactividad para otras líneas celulares, sobre todo PRL y TSH. Los hallazgos de Zada et al. (2011) y de Saeger et al. (2007) muestran que los AH atípicos más comunes son los secretores de GH, los no secretores y los secretores de ACTH, siendo estos más del 70% de todos los casos12,23. En nuestra serie, estos adenomas suponen el 67,9% del total.
El Ki67, un antígeno de proliferación, podría contribuir a delimitar un grupo de adenomas de comportamiento localmente más agresivo. Su positividad suele ser baja (< 3%)25. Para algunos autores, una elevación de este antígeno se correlaciona con mayor velocidad de crecimiento, invasión y recurrencia tumoral12, aunque otros estudios no lo han demostrado24,25. Tres publicaciones recientes11,22,26 apoyan el concepto de que solo un alto índice proliferativo Ki67 de más del 20-30%, independientemente del tamaño del tumor y la presencia o ausencia de invasión local, indica la presencia de un carcinoma in situ27, o un carcinoma hipofisario premetastásico en «fase selar»5.
El nuevo sistema para graduar los tumores endocrinos hipofisarios primarios introducido por la OMS en 2004 no establece claramente las diferencias entre tumores típicos y atípicos; parámetros como el recuento del número de mitosis y la lectura de la positividad inmunohistoquímica para p53 carecen de valores de corte validados. Por ello, algunos laboratorios no analizan rutinariamente el Ki67 y p53, ya que no siempre existe paralelismo entre estos resultados y la evolución clínica de los tumores. De todas formas, según esta clasificación de la OMS es imprescindible su determinación para catalogar un AH como atípico. Cabe preguntarse sobre la influencia que estos marcadores tienen en la actitud terapéutica, ya que el clínico podría tener una actitud más conservadora ante un paciente con un tumor secretor activo poscirugía, invasivo, no curable quirúrgicamente, con raras figuras de mitosis e índices bajos del Ki67 y p53, que ante un paciente con un tumor resecado completamente según la evaluación neurorradiológica postoperatoria, en el que el estudio histopatológico informa de un elevado número de mitosis y un índice proliferativo Ki67 alto con inmunorreactividad intensa para p53. Es obvio que el diagnóstico diferencial entre un tumor benigno agresivo y un tumor maligno en estadio inicial puede ser difícil, como ocurre en casi toda la patología endocrina.
El estudio de Thapar et al. de 1996 puso de manifiesto que el aumento del Ki67 por encima del 3% era significativo para diferenciar AH invasivos de no invasivos y fue aceptado por la OMS; reportó un umbral promedio para el índice proliferativo Ki67 en adenomas invasivos del 4,66%28. Zada et al. describieron un índice Ki67 entre un 3 y un 20% con un valor medio de 7%12 y Yildirim et al. un índice Ki67 entre un 3 y un 10% con un valor medio del 4,7%13. Nuestros hallazgos son consistentes con los estudios previos, una vez que el índice proliferativo Ki67 varió entre el 3 y el 25%, con un valor medio del 6,4%.
En nuestro estudio se presentaron recurrencias en 36 de los 220 AH (16,4%) de las cuales 20 correspondían a AH típicos (20/192, 10,4%) y 16 a AH atípicos (16/28, 57,1%). En 100 de los AH diagnosticados con seguimiento superior a 5 años se observó una tasa de recurrencia en AH atípicos hasta 7,6 veces superior (AH atípicos 8/13; 61,5% vs. AH típicos 7/87; 8%).
Como en otros estudios, los factores preoperatorios que se correlacionaron con mayor probabilidad de AH atípico fueron el mayor tamaño tumoral, la evidencia de invasión en estudios de neuroimagen y ser clínicamente no secretores12,13.
Hasta donde sabemos, este es el primer estudio actualizado y amplio en la estimación de la prevalencia de los AH realizado en Portugal, constituyendo la primera serie de AH atípicos en este país. También es una de las más largas a nivel mundial, proporcionando una clasificación de los subtipos histológicos, el grado de invasividad y la recurrencia en estos tumores. Se demuestra que los AH atípicos presentan tasas más altas de recurrencia, aunque no hay evidencia de que sean más propensos a presentar transformación maligna o que posean mayor potencial metastásico.
FinanciaciónNinguna.
Conflicto de interesesNinguno declarado.
Agradecemos a la profesora Dra. Yasmin Fernandes, por la cortesía en la interpretación y cesión de las imágenes de RM.