Conocer la prevalencia de adenocarcinoma de endometrio en pacientes con diagnóstico de hiperplasia endometrial atípica tras biopsia endometrial.
Pacientes y métodosVeinte pacientes con diagnóstico de hiperplasia endometrial atípica tras biopsia endometrial histeroscópica en consulta y/o tras resección endometrial histeroscópica en quirófano.
ResultadosSe realizó una histerectomía a 15 pacientes y se encontraron 8 casos de adenocarcinoma de endometrio. Dos pacientes fueron reintervenidas mediante laparoscopia para realizar una linfadenectomía.
To determine the prevalence of endometrial adenocarcinoma in patients with a diagnosis of atypical endometrial hyperplasia after endometrial biopsy.
Patients and methodsTwenty patients with a diagnosis of atypical endometrial hyperplasia after endometrial biopsy by means of office hysteroscopy and/or after endometrial resection by means of operative hysteroscopy.
ResultsHysterectomy was performed in 15 patients and eight cases of endometrial adenocarcinoma were found. Reintervention was required in two patients, who underwent laparoscopic lymphadenectomy.
La hiperplasia endometrial atípica (HEA) es una entidad histopatológica que entraña dificultades diagnósticas y terapéuticas dada la frecuencia con que los pacientes con ese diagnóstico presentan finalmente un adenocarcinoma de endometrio (AE) en la pieza de histerectomía. Ambos hechos representan un reto, tanto para el patólogo como para el ginecólogo.
Existen dos categorías de hiperplasia: a) simple y compleja, en función de las anomalías arquitecturales, y b) con/sin atipias en función de la presencia o ausencia de atipia citológica. La HEA requiere un tratamiento radical con histerectomía, aunque el tratamiento conservador en pacientes jóvenes con deseo genésico representa una opción razonable.
Tal y como acabamos de mencionar, el diagnóstico anatomopatológico endometrial es difícil, con manifiestas discordancias intra e interobservador que llevan a una infraestimación o sobreestimación de la gravedad de una alteración determinada. En 1999 se publicaron los resultados de un estudio multicéntrico europeo1 designado para analizar el grado de acuerdo de 5 expertos patólogos ginecológicos en la evaluación de 56 muestras de endometrio. A pesar de agrupar los diagnósticos en 3 categorías (1: hiperplasia; 2: neoplasia endometrioide + hiperplasia atípica y 3: endometrio cíclico [proliferativo, secretor y otros]), las tasas de acuerdo fueron del 80-89% para intraobservador y del 70-82% para interobservador. Según estos autores, el único rasgo útil para distinguir entre hiperplasia atípica y adenocarcinoma bien diferenciado es la alteración estromal, en donde hubo un mayor acuerdo intra e interobservador. Zaino et al2 concluyen que el grado de reproducibilidad entre especialistas para el diagnóstico de HEA es pobre y que se necesitan mejores criterios y buenos especímenes de tejido para mejorar el diagnóstico2. Según Mazur y Kurman3, con fines prácticos, se han definido cuadros específicos de alteraciones estromales y epiteliales que reflejan la «invasión estromal endometrial» y, por ende, identifican al carcinoma. Se observan tres características separadas, cualquiera de las cuales es indicativa de invasión estromal en el contexto de proliferación glandular de bajo grado:
- 1.
Cuadro glandular confluente en el que se fusionan las glándulas, que dejan de estar separadas por estroma y crean un aspecto cribiforme.
- 2.
Infiltración irregular de las glándulas asociada a alteración del estroma fibroblástico (reacción desmoplásica).
- 3.
Cuadro papilar extenso.
Dadas las dificultades existentes para la categorización de la HEA o el adenocarcinoma, los patólogos han creado el concepto de neoplasia endometrial intraepitelial (NEI), que clasifica eficazmente a las pacientes de riesgo de cáncer alto y bajo y con mejor reproducibilidad que la HEA4.
La HEA es un precursor de AE y se ha comunicado tasas de progresión de hasta el 52%5. Además, un importante número de pacientes con el diagnóstico de HEA tras biopsia endometrial presenta un AE en el espécimen uterino tras la histerectomía.
El mejor tratamiento para el AE es quirúrgico y debe realizarse una estadificación completo con lavado peritoneal y linfadenectomía pélvica y paraaórtica, según normas de clasificación de la FIGO de 1988. A pesar de que no existe consenso en lo referente a la linfadenectomía, una reciente publicación6 informa de que su realización de manera extensa mejora la supervivencia de los casos de riesgo intermedio-alto, por lo que algunas pacientes, tras el diagnóstico de AE posthisterectomía, deberán ser reintervenidas para completar la estadificación quirúrgica, o en su defecto, recibir tratamiento radioterápico complementario.
MATERIAL Y MÉTODOSEn el período comprendido entre enero de 2005 y diciembre de 2006 hemos asistido a 20 pacientes con diagnóstico de HEA tras una biopsia endometrial. De la historia clínica hemos obtenido datos relativos a la edad, el estado menopáusico y la ingesta de tamoxifeno, así como los informes de biopsias endometriales para comparar retrospectivamente la histología final en las pacientes histerectomizadas.
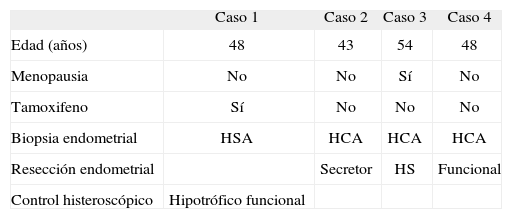
Once de 20 pacientes eran menopáusicas y 5 habían recibido tratamiento con tamoxifeno por cáncer de mama. Una paciente posmenopáusica con imagen histeroscópica sugestiva de neoplasia y microbiopsia endometrial de hiperplasia compleja atípica no ha vuelto a consulta por encontrarse en progresión de su cáncer de mama. En 4 casos no se realizó histerectomía ya que, tras la electrorresección endometrial, se comprobó la inexistencia de proliferación atípica (tabla 1).
Pacientes no sometidas a histerectomía
| Caso 1 | Caso 2 | Caso 3 | Caso 4 | |
| Edad (años) | 48 | 43 | 54 | 48 |
| Menopausia | No | No | Sí | No |
| Tamoxifeno | Sí | No | No | No |
| Biopsia endometrial | HSA | HCA | HCA | HCA |
| Resección endometrial | Secretor | HS | Funcional | |
| Control histeroscópico | Hipotrófico funcional |
HAS: hiperplasia simple atípica; HCA: hiperplasia compleja atípica; HS: hiperplasia simple sin atipia.
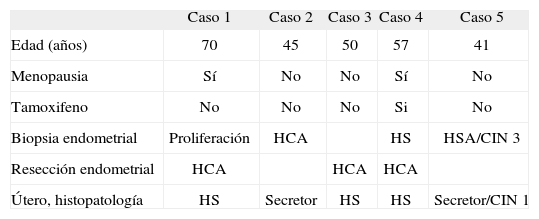
Hemos realizado una histerectomía a 15 pacientes. En 5 casos no se evidenció una hiperplasia atípica en el útero extirpado. Una paciente había presentado con anterioridad una conización fría por un carcinoma in situ de cérvix y restaba un foco lesional de bajo grado en el espécimen uterino (tabla 2).
Pacientes histerectomizadas con histología menor que hiperplasia atípica en útero
| Caso 1 | Caso 2 | Caso 3 | Caso 4 | Caso 5 | |
| Edad (años) | 70 | 45 | 50 | 57 | 41 |
| Menopausia | Sí | No | No | Sí | No |
| Tamoxifeno | No | No | No | Si | No |
| Biopsia endometrial | Proliferación | HCA | HS | HSA/CIN 3 | |
| Resección endometrial | HCA | HCA | HCA | ||
| Útero, histopatología | HS | Secretor | HS | HS | Secretor/CIN 1 |
CIN: neoplasia intraepitelial de cuello uterino; HCA: hiperplasia compleja atípica; HSA: hiperplasia simple atípica; HS: hiperplasia simple sin atipia.
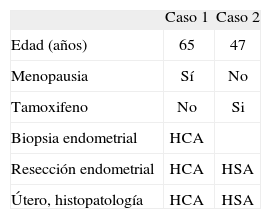
Sólo 2 pacientes mostraron una HEA en las biopsias previa y tras la histerectomía (tabla 3).
Pacientes histerectomizadas con histología de hiperplasia atípica en útero
| Caso 1 | Caso 2 | |
| Edad (años) | 65 | 47 |
| Menopausia | Sí | No |
| Tamoxifeno | No | Si |
| Biopsia endometrial | HCA | |
| Resección endometrial | HCA | HSA |
| Útero, histopatología | HCA | HSA |
HCA: hiperplasia compleja atípica; HSA: hiperplasia simple atípica; HS: hiperplasia simple sin atipia.
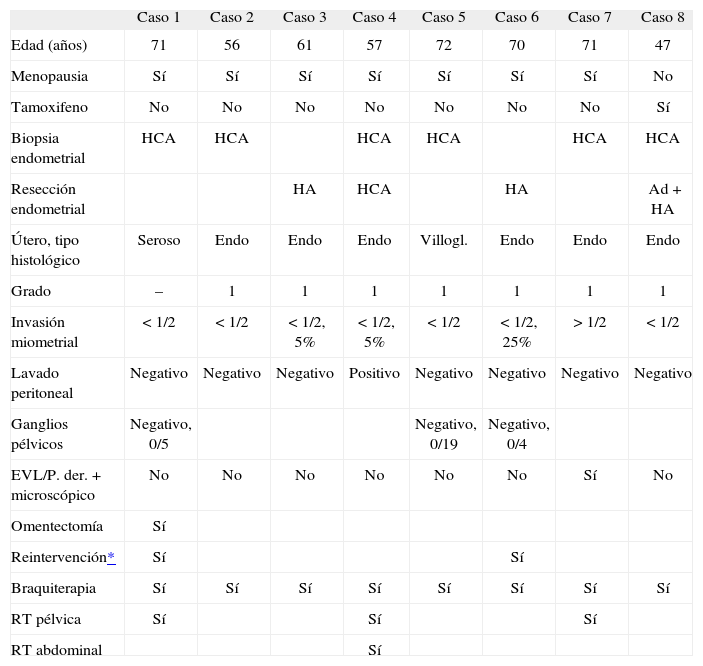
Finalmente, 8 de 15 pacientes sometidas a histerectomía presentaron un AE. En 6/8 casos se trataba de adenocarcinoma endometrioide bien diferenciado. Los 2 casos restantes correspondieron a un adenocarcinoma villoglandular y a un caso de alto grado, con histología de seroso. Un tumor infiltraba más de la mitad del miometrio, así como el parametrio. En los casos restantes la invasión miometrial fue inferior al 50%. En una paciente la citología de lavado peritoneal resultó positiva. Dos pacientes fueron reintervenidas mediante laparoscopia para realizar biopsia ganglionar, asociada a omentectomía en la paciente con tumor de alto grado (casos 1 y 6; tabla 4).
Pacientes histerectomizadas con histología de adenocarcinoma en útero
| Caso 1 | Caso 2 | Caso 3 | Caso 4 | Caso 5 | Caso 6 | Caso 7 | Caso 8 | |
| Edad (años) | 71 | 56 | 61 | 57 | 72 | 70 | 71 | 47 |
| Menopausia | Sí | Sí | Sí | Sí | Sí | Sí | Sí | No |
| Tamoxifeno | No | No | No | No | No | No | No | Sí |
| Biopsia endometrial | HCA | HCA | HCA | HCA | HCA | HCA | ||
| Resección endometrial | HA | HCA | HA | Ad + HA | ||||
| Útero, tipo histológico | Seroso | Endo | Endo | Endo | Villogl. | Endo | Endo | Endo |
| Grado | – | 1 | 1 | 1 | 1 | 1 | 1 | 1 |
| Invasión miometrial | < 1/2 | < 1/2 | < 1/2, 5% | < 1/2, 5% | < 1/2 | < 1/2, 25% | > 1/2 | <1/2 |
| Lavado peritoneal | Negativo | Negativo | Negativo | Positivo | Negativo | Negativo | Negativo | Negativo |
| Ganglios pélvicos | Negativo, 0/5 | Negativo, 0/19 | Negativo, 0/4 | |||||
| EVL/P. der. + microscópico | No | No | No | No | No | No | Sí | No |
| Omentectomía | Sí | |||||||
| Reintervención* | Sí | Sí | ||||||
| Braquiterapia | Sí | Sí | Sí | Sí | Sí | Sí | Sí | Sí |
| RT pélvica | Sí | Sí | Sí | |||||
| RT abdominal | Sí |
Ad: adenocarcinoma; endo: endometrioide; villogl.: villoglandular; EVL/P. der +: embolización vasculolinfática/parametrio derecho positivo; HCA: hiperplasia compleja atípica; HS: hiperplasia simple sin atipia; HSA: hiperplasia simple atípica.
Varios autores han comunicado recientemente la frecuencia de presentación de AE posthisterectomía en pacientes previamente diagnosticadas de HEA tras una biopsia endometrial. Bilgin et al7 encontraron 11 (23,9%) casos en 46 pacientes; realizaron una biopsia extemporánea a 30 pacientes y ocurrieron 2 falsos negativos. Garuti et al8 tienen 11 (44%) casos en 25 pacientes y afirman que la histeroscopia es sensible y específica para identificar un carcinoma concurrente en pacientes con HEA. Schutter y Wright9 informan de 29 casos en 60 pacientes (48%) y refieren que la ni la edad ni el procedimiento por el que se obtiene la muestra endometrial influyen significativamente en la prevalencia del cáncer endometrial. Nuestros resultados parecen indicar lo contrario respecto a la edad, ya que mientras las pacientes con cáncer tienen una edad media de 63 años, las pacientes con hiperplasia son sensiblemente más jóvenes (hiperplasia sin atipia 52 años; HEA 56 años). Precisamente, el hecho de que la hiperplasia se presente varios años antes que la neoplasia apoya la hipótesis de la evolución de un proceso a otro en el tiempo. Respecto a la obtención de la muestra, 4 de 8 pacientes presentaron una electrorresección endometrial en quirófano y en sólo un caso se estableció el diagnóstico de adenocarcinoma antes de la histerectomía. A pesar de que los 3 casos restantes han correspondido a tumores con mínima infiltración miometrial, creemos que, efectivamente, el tipo de biopsia no es esencial para llegar al diagnóstico prehisterectomía y que éste debe lograrse atendiendo a criterios histopatológicos. No obstante, Zaino et al2 consideran que es un problema de las muestras obtenidas por biopsia o legrado. Creemos que, tras la resección endometrial, el volumen y la calidad de material proporcionado al patólogo son óptimos para el diagnóstico. Recientemente, Trimble et al10, en un estudio prospectivo, obtienen una prevalencia de carcinoma concurrente con hiperplasia atípica del 42,6% (123/289), el 30,9% mioinvasivos y sólo el 10,6% con afectación de más de la mitad del miometrio. Nuestros resultados, referidos a tan sólo 8 casos, son similares (12%; 1/8 con invasión > 1/2). Nuestra prevalencia es alta (8/15; 53%), prácticamente idéntica a la obtenida por Valenzuela et al11 en un estudio con 23 pacientes (12/23; 52%). La explicación a tan alta prevalencia quizá resida en la recomendación que Mazur y Kurman hacen en su obra y que reproducimos literalmente: «Cuando el diagnóstico diferencial se debate entre HEA y AE lo más conveniente es informar el de HEA e indicar que los hallazgos son muy representativos de la presencia de adenocarcinoma bien diferenciado, pero que no es posible brindar un diagnóstico definitivo a partir de la muestra recibida en el laboratorio».
Resumiendo, nos encontramos ante un problema de alta prevalencia y de difícil diagnóstico anatomopatológico, que nos provoca incertidumbre en el momento de la cirugía, dado que un número no despreciable de pacientes diagnosticadas de HEA tras una biopsia endometrial presentan, en realidad, un AE que requiere, en muchas ocasiones, la realización de una linfadenectomía. Para adecuar el tratamiento es imprescindible un diagnóstico exacto y para ello es necesario un buen estudio patológico. Desde el punto de vista clínico, el ginecólogo debe analizar minuciosamente cada caso, prestar atención a la edad de la paciente y sus antecedentes y obtener el máximo rendimiento tanto de la imagen histeroscópica como de las imágenes de ecografía transvaginal o resonancia magnética12 para lograr el adecuado tratamiento quirúrgico.
CONCLUSIONESAproximadamente, la mitad de las pacientes con diagnóstico de HEA tras biopsia presentarán un diagnóstico final de AE tras la histerectomía. La mayoría de las veces se trata de tumores de bajo grado, bien diferenciados, que invaden superficialmente el miometrio. Algunas pacientes requieren una posterior reintervención para linfadenectomía. Identificarlas no parece tarea fácil. Es necesario mejorar los criterios de diagnóstico anatomopatológico y obtener el máximo rendimiento de las pruebas complementarias a nuestro alcance, antes de la cirugía, con la finalidad de evitar reintervenciones.