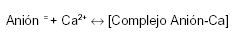INTRODUCCIÓN
La osteoporosis, definida como una baja masa ósea y alteraciones de la microarquitectura del hueso que predisponen a las fracturas, es una enfermedad que asume características de pandemia y cuya prevalencia crecerá notoriamente en las próximas décadas en todo el mundo, pero sobre todo en Asia y América Latina. Si bien el desarrollo y el mantenimiento de una masa ósea normal dependen en un 70% de factores genéticos, los factores ambientales (como el ejercicio y la nutrición) son de gran importancia, y pueden modificarse favorablemente a nivel poblacional con apropiadas medidas educativas y culturales. Esta revisión se propone pasar revista al metabolismo del calcio y presentar la evidencia disponible sobre el papel que este nutriente (y la vitamina D, crucial para su correcta disponibilidad) tiene en el desarrollo y mantenimiento de un esqueleto sano; sobre la importancia fisiopatológica de la carencia crónica de calcio en el desarrollo de osteopenia en niños, jóvenes, adultos y viejos; y sobre el efecto beneficioso de la suplementación con calcio (y, a veces, de vitamina D) en la prevención y el tratamiento de la osteoporosis.
METABOLISMO GENERAL DEL CALCIO
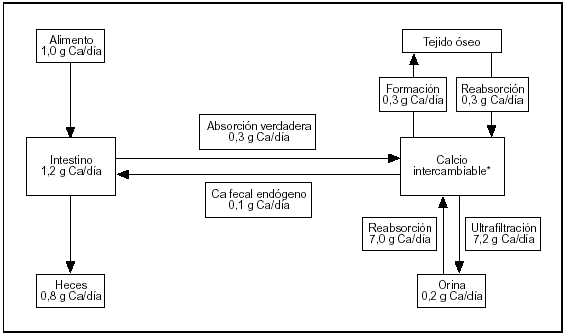
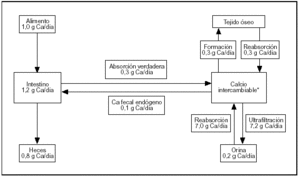
El esquema del metabolismo cálcico resumido en la figura 1 contiene cifras estimadas para un sujeto normal de 70 kg de peso al término de su desarrollo esquelético, en balance cálcico (el calcio ingerido es igual a lo excretado por heces y orina). El esquema involucra tres órganos (riñón, huesos e intestino) conectados por la masa (pool) de calcio intercambiable.
Fig. 1. Metabolismo del calcio. Flujos entre los distintos compartimientos.
El riñón efectúa el ajuste fino de la calcemia, que es una parte del pool de calcio intercambiable. La excreción urinaria de calcio implica la ultrafiltración de 100 ml de plasma por minuto. La concentración de calcio en el ultrafiltrado es aproximadamente 5 mg/dl. Diariamente se ultrafiltran 7.200 mg de los cuales se reabsorben 7.050 mg (98% de lo ultrafiltrado) produciendo una calciuria de 150 mg/d.
El esqueleto es el depósito del ion: acumula el 99% del calcio corporal. Dos flujos de calcio involucrados en la formación y en la resorción del tejido son muy importantes para la homeostasis. En ausencia de enfermedades del metabolismo óseo estos procesos están acoplados en relación 1:1.
El intestino es el gran perturbador del sistema (su contenido en calcio oscila entre 150 mg en sujetos ayunados a 1.200 mg después de una ingesta rica en calcio) con sólo ligeras modificaciones de la calciuria. También permite excretar el excedente sin utilizar el riñón.
La ubicación física del compartimiento de calcio intercambiable es el espacio extracelular, el recientemente depositado sobre los cristales de apatita ósea más el depósito intracelular de calcio (fig. 1).
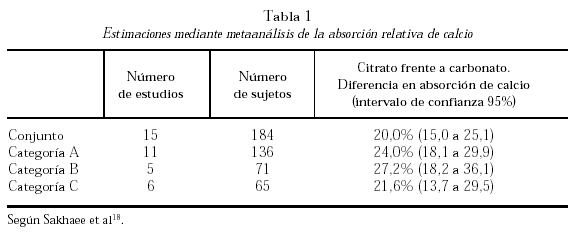
La absorción neta de calcio se define como la diferencia entre el calcio ingerido y el excretado por vía fecal. La absorción neta de calcio está relacionada con la ingesta. En sujetos normales la absorción neta es de 20% a 25% de la ingesta cuando ésta se encuentra en el rango de 300 a 2.000 mg por día. Con ingestas de calcio inferiores a 300 mg/d la absorción neta suele ser negativa en razón del flujo de calcio al interior del intestino llamado calcio fecal endógeno.
El calcio fecal endógeno es el calcio de los jugos digestivos (succus entericus). Estos jugos son el resultado del equilibrio de la secreción y reabsorción de fluidos. Mediante la perfusión de segmentos de intestino delgado se ha comprobado que las concentraciones de Na+ y K+ no discrepan de las del suero; la concentración de bicarbonato es baja en el yeyuno y alta en el íleon y lo contrario ocurre con la de cloruro1. Aunque no ha sido comprobado con certeza para el hombre, en algunas especies se ha establecido que el calcio es secretado también por el colon2.
La masa de calcio que puede excretarse como calcio fecal endógeno puede ser muy importante. En celíacos adultos, en los que su mala absorción restringiría la reabsorción, Melvin midió 324 mg/d, más del doble que en sujetos normales (136 mg/d)3.
La diferencia entre la absorción neta de calcio y el calcio fecal endógeno se llama absorción verdadera. Esta fracción depende del estatus de las células del intestino y de los niveles de vitamina D. Con una dieta pobre en calcio (< 350 mg/d) su valor es superado por el de calcio fecal endógeno, lo que conduce a balances cálcicos negativos. El lector debe estar atento a las unidades asociadas a los vectores. Con una dieta pobre en calcio la absorción verdadera será pequeña o muy pequeña, si se la expresa en mg/d. La adaptación del intestino a tales dietas se manifiesta con un aumento de la eficiencia absortiva, que puede llegar a 60% del calcio ingerido.
EFECTOS DE LA VITAMINA D SOBRE EL INTESTINO
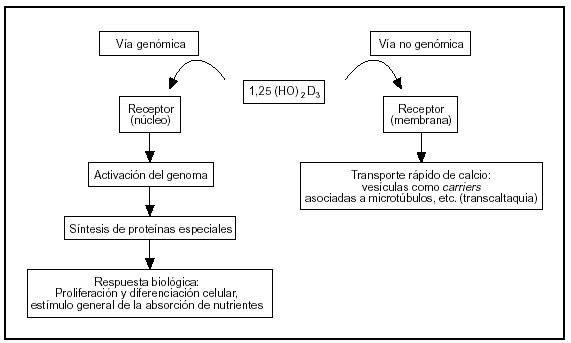
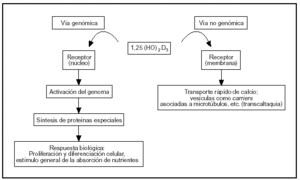
El sistema endocrino del calciferol tiene como actor principal al 1α,25-dihidroxivitamina D, una hormona esteroide. Este esteroide actúa sobre el intestino por vía genómica y no genómica (fig. 2).
Fig. 2. Vías de acción de la 1,25-dihidroxivitamina D sobre las células del intestino.
La vía genómica sigue un mecanismo muy bien caracterizado, semejante al de otros esteroides. La hormona se liga a un receptor: una proteína intracelular de alta afinidad presente en el núcleo, que se activa por este fenómeno. El complejo hormona-receptor se liga a secuencias reguladoras del ADN nuclear y controla la transcripción de ARN mensajeros específicos que a su vez controlan la síntesis de proteínas específicas (osteocalcina, fosfatasa alcalina, colágeno, calbindina-D, etc.). La calbindina-D promueve la absorción de calcio por difusión facilitada: ligamiento del calcio en el borde en cepillo o superficie luminal (que se incorpora por canales de calcio o por transportadores) y traslado del complejo calbindina-Ca a la membrana basal donde transfiere el ion a una bomba Ca-ATPasa que lo vuelca a la circulación.
Mediante la modulación de la concentración citosólica de calcio y la síntesis de proto-oncogenes se regula, además, la proliferación y diferenciación celular. Los efectos sobre la proliferación y diferenciación celular son evidentes 1-2 horas después del ligamiento de la hormona al receptor. El proceso de proliferación y diferenciación celular se manifiesta en el aumento del número y en el perfeccionamiento de las funciones de las células de las microvellosidades4.
La vía no genómica modula un transporte rápido de calcio llamado «transcaltaquia»5 que involucra la apertura de canales de calcio operados por el voltaje a través de la membrana6, transporte vesicular de calcio asociado a la polimerización de microtúbulos7 que marcan el camino tráfico entre membranas. El receptor de membrana de la vía no genómica es peculiar porque es afín con el del citosol (ligan el mismo esteroide: 1,25-dihidroxivitamina D), pero con diferente dominio proteico para el ligamiento8.
Los procesos que participan en la absorción intestinal de calcio representan el primer paso para el ingreso del calcio de la dieta en los procesos fisiológicos que contribuyen tanto al crecimiento del esqueleto como a la homeostasis cálcica (intra y extracelular).
Existe una gran variación en la ingesta cálcica del hombre (300-1.500 mg/d) y en las necesidades fisiológicas a través de la vida (crecimiento, pubertad, gestación, lactancia y menopausia). Para asegurar la recuperación del calcio de la dieta diaria es necesario que el intestino se adapte simultáneamente a las modificaciones fisiológicas y a la dieta. Estos procesos son perfeccionados por el sistema endocrino del colecalciferol.
MÉTODOS PARA MEDIR LA ABSORCION INTESTINAL DE CALCIO
Técnicas específicas
Balance de calcio. Requiere la existencia de una unidad metabólica con personal entrenado. Los sujetos reciben dietas de composición constante durante una semana (si su dieta habitual difiere de la de la prueba) lo que permite obtener el equilibrio del sujeto con la dieta. El balance se mide durante el siguiente período de siete días con el objeto de reducir la variancia diaria. Un duplicado de la dieta se analiza diariamente para conocer su contenido mineral. Como la defecación ocurre a intervalos irregulares, los sujetos reciben continuamente cápsulas con una sustancia trazadora no absorbible (carmín, polietilenglicol de peso molecular 4.000, sesquióxido de cromo) que permite comprobar cuán completa fue la recolección y definir el intervalo de tiempo después de haber finalizado la recolección de orina, para concluir la recolección de las heces. Éstas se pesan y homogeneizan. Los análisis se realizan sobre una alícuota, cuyo residuo (después de llevarla a sequedad e incinerarla) se disuelve en solución ácida. La diferencia entre la ingesta y las excretas (heces + orina) define el balance.
Absorción neta. Esta técnica es más sencilla que la anterior. Después de un ayuno de 12 horas, los sujetos son sometidos a un lavado intestinal con una solución iso-osmótica cuya composición no afecta la absorción o excreción de iones. Cuatro horas después del lavado los sujetos ingieren una dieta con una cantidad conocida de trazador no absorbible. Doce horas después de la ingesta se repite el lavado, recogiendo el efluente. La diferencia entre el contenido mineral de la dieta y la excreción fecal define la absorción neta. El estudio puede repetirse en otro día, cuando se ingiere sólo el trazador, con el objetivo de medir la excreción fecal en ayunas.
Absorción verdadera de calcio. Se administra una cantidad de 47Ca (emisor gamma) por vía oral y otra dosis de 45Ca (emisor beta) por vía intravenosa. Los laboratorios que disponen de un espectrómetro de masas de ionización térmica pueden usar dos isótopos no radiactivos: 42Ca y 44Ca9. El isótopo administrado por vía oral sirve para trazar la curva de radiactividad en el plasma, consecuencia de la absorción. Como a corto plazo la altura y pendiente de esta curva dependen del recambio óseo y la excreción renal, el cálculo de la absorción intestinal requiere una corrección que se estima con el isótopo administrado por vía intravenosa y que (por la operación efectuada) se considera totalmente absorbido.
Si el paciente se encuentra en condiciones de balance y se obtienen muestras de sangre para medir radiactividad durante las 48 horas siguientes, se pueden determinar, mediante alguno de varios modelos matemáticos disponibles, todos los flujos de calcio y la magnitud del pool de calcio intercambiable, incluidos en la figura 1.
Absorción fraccional de calcio. Se administra por vía oral una dosis estándar de calcio no radiactivo (carrier, 1 gramo) junto con otra de 47Ca. La fracción (porcentaje) absorbida de la dosis puede determinarse por medición de la radiactividad de las heces.
Absorción en segmentos intestinales definidos. Esta técnica ha sido utilizada para investigar el succus entericus2. Después de 12 horas de ayuno, el sujeto se intuba con una sonda de triple lumen. La sonda es radio-opaca y la posición de su extremo distal se controla por radioscopía. El líquido de perfusión (que contiene un marcador no absorbible) se instila a tasa constante por el tubo proximal y se retira por el distal a la misma tasa. Se perfunde un tramo de 30 cm de intestino. La tasa de absorción se calcula a partir de la diferencia de concentración de calcio (u otros iones o moléculas) entre los líquidos de entrada y de salida.
Técnicas alométricas
El calificativo alométrico (allo = lo otro) indica que dichas técnicas no miden la absorción de calcio sino alguna variable relacionada con dicho fenómeno. Introducen algún factor de incertidumbre debido a la variancia de las respuestas individuales. Por ejemplo, el mismo aumento de la calcemia puede no producir el mismo aumento de la calciuria o la misma supresión de la secreción de PTH en una serie de individuos.
Técnicas farmacocinéticas. La complejidad de las técnicas descritas anteriormente ha inducido el empleo de recursos farmacocinéticos. Como consecuencia del ingreso de calcio a la circulación aumenta la calcemia total10 o la radiactividad si se administró un isótopo junto con la dosis de calcio11. El área bajo la curva de calcemia en función del tiempo es un criterio farmacocinético de la biodisponibilidad del elemento. Otros parámetros de la curva mencionada, como la máxima concentración medida (Cmax) y el tiempo al que ocurre dicho máximo (tmax), pueden utilizarse como criterios adicionales al comparar período basal frente al tratamiento, pacientes o sales entre sí10,11.
Aumento de la calciuria por cada 100 ml de filtrado glomerular. Después de una sobrecarga de calcio (1 g) se obtienen dos muestras de orina de 2 horas (0-2 y 2-4 horas). Se obtienen muestras de sangre 1 y 3 horas después de la sobrecarga. Aumentos de la calciuria que superen 0,2 mg/100 ml de filtrado glomerular es evidencia de aumento en la absorción de calcio12.
Se ha usado también otra técnica: la medición de la calciuria o de la radiactividad urinaria en las 5-6 horas siguientes a la administración de la dosis de calcio y el trazador radiactivo.
Como recurso de comparación entre sales de calcio y tratamientos se han usado las respuestas biológicas al aumento de la calcemia total o iónica (supresión de la secreción de PTH y modificaciones de la fosfatemia)10.
DIGESTION Y DISPONIBILIDAD DE CALCIO
La disolución y disociación in vitro de la mayoría de los complejos de calcio dependen del pH. Parece lógico, entonces, suponer que el proceso digestivo es muy importante para asegurar la absorción de calcio. Sin embargo, «aún no se ha acumulado suficiente evidencia convincente al respecto». Esta expresión fue publicada en 19701. Evidencias experimentales han aparecido recientemente e insisten en lo complejo del proceso digestivo9 y lo (aún) incompleto de nuestro conocimiento sobre el mismo.
Los aniones que acompañan al calcio (o las moléculas que lo acomplejan) se absorben independientemente del catión. Cuando el alimento (con su calcio disociado por la digestión gástrica) recibe la secreción pancreática, la mayor parte del calcio (no importa qué anión lo acompañaba inicialmente) se transforma en carbonato (por el bicarbonato y alto pH de la secreción pancreática) o en jabones de calcio (los ácidos grasos son aportados por las grasas hidrolizadas por la lipasa pancreática).
El equilibrio de la reacción indicada más abajo, a pH alcalino, se desplaza incompletamente hacia la derecha. Al pH de los jugos intestinales (fig. 2), sólo una fracción del calcio y del anión acompañante (ambos ionizados) están disponibles para su absorción.
A medida que el Ca2+ y el anión acompañante son absorbidos (de modo independiente uno del otro), el complejo se disocia renovando la disponibilidad del anión y el Ca2+ para su absorción. La eficiencia del intestino se completa por el peristaltismo y los movimientos de masa de su contenido, que exponen una porción de contenido intestinal, permanentemente renovado, a las células del epitelio.
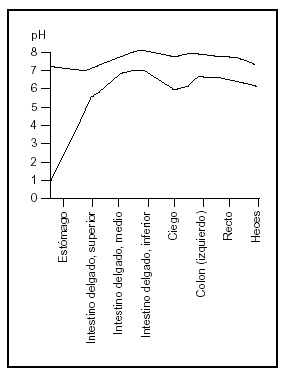
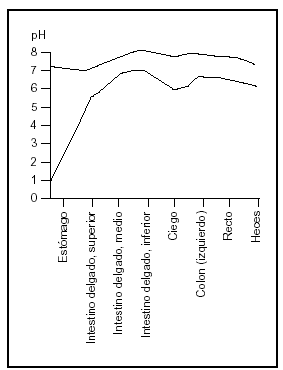
El duodeno es la porción de intestino más altamente desarrollada y frecuentemente se supone el lugar más importante de absorción. Sin embargo, la absorción no depende sólo de la eficiencia del sector considerado sino de la longitud del segmento, del tiempo de permanencia del alimento en ese segmento y la concentración de los nutrientes expuestos a las membranas de las células epiteliales (fig. 3).
Fig. 3. El pH de los jugos intestinales (redibujado de las Tablas Científicas Geigy, 198114).
Influencia de los aniones o moléculas acompañantes. Se conocen una serie de aniones (fitato, oxalato, fosfato, ácidos grasos) que afectan adversamente la disponibilidad de calcio en el intestino. Ingestas importantes de estos aniones disminuyen la absorción de calcio. Estos factores tienen efectos sensibles sólo en dietas no balanceadas. Un ejemplo habitual en nuestra sociedad es la dieta rica en carnes rojas que impone una sobrecarga de fosfato. Aparte de estos casos, es muy probable que los defectos graves en la absorción de calcio ocurran sólo en casos de desórdenes digestivos primarios o después de cirugía del tracto gastrointestinal superior. En estos casos será difícil estimar las contribuciones del efecto de la mala absorción de grasa y la concurrente deficiencia en vitamina D.
Desde que se advirtieron los beneficios de la suplementación cálcica, numerosas investigaciones han intentado identificar las sales más eficaces como suplemento dietario.
En ayunas o con una colación ligera, la comparación entre carbonato y citrato favoreció al citrato10,15. En un experimento realizado con el objeto de demostrar la eficacia en aumentar la concentración de calcio ionizado en plasma, los suplementos se ordenaron en el siguiente orden decreciente: leche en polvo enriquecida con citrato de calcio > yogur = carbonato de calcio > leche > leche de soja16.
En personas de edad con gastritis atrófica, los suplementos que se toman en ayunas, como el citrato de calcio o la leche, son absorbidos normalmente. El carbonato de calcio se absorbe normalmente cuando se suministra con una comida11,17.
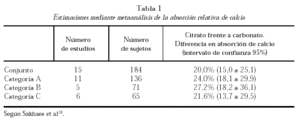
La comparación entre citrato y carbonato ha sido objeto de un metaanálisis realizado sobre 15 estudios publicados y cuyos resultados se resumen en la tabla 1. La categoría A fue segregada por tratarse de trabajos «con problemas». La B incluyó cinco trabajos en los que la comparación se efectuó en sujetos en ayunas. La C, seis trabajos en los que la comparación se efectuó agregando los suplementos a las comidas. La absorción del calcio a partir del citrato cálcico resultó ser significativamente mayor (25%, en el conjunto de trabajos)18.
Investigaciones relativamente recientes han demostrado que las proteínas de la dieta no tienen un efecto notorio sobre la absorción de calcio19. Algunos aminoácidos como la L-arginina o la L-lisina, en cambio, la aumentan. Lo mismo ocurre con la lactosa (y varios otros azúcares y polialcoholes). Aún no ha sido explicado el mecanismo, pero debe destacarse que los aminoácidos y la lactosa actúan de manera instantánea incluso en animales raquíticos20.
METABOLISMO INTRACELULAR DEL CALCIO
Por su afinidad por el fosfato y la estabilidad del producto (fosfato de calcio) este ion es responsable de la rigidez de los huesos. Sus funciones en el mantenimiento de la homeostasis que hace posible la vida superan largamente en importancia a dicho papel.
En las células en reposo la concentración del calcio en el citoplasma es muy baja = 0,1 μmol/l. Es 15.000 veces más baja que en el exterior (1,5 mmol/l). Como la membrana plasmática es algo permeable al calcio, el intenso gradiente entre el interior y el exterior provoca una entrada evaluada en 4 nmol/minuto, que es compensada por completo por la bomba calcio-magnesio-ATPasa independiente.
El calcio en las células está almacenado en la membrana celular, el retículo endoplásmico liso y las mitocondrias. Sale de sus lugares de reserva por influencia de ciertos estímulos y su concentración en el citoplasma puede aumentar bruscamente hasta 100 veces por encima de los niveles basales. En estas circunstancias ejerce las funciones de segundo mensajero que se describirán más abajo.
Algunas zonas de la membrana plasmática están directamente expuestas al aporte de calcio extracelular y a los estímulos exteriores. En particular a las modificaciones de polarización de la membrana mediante las cuales el efecto de movilización de calcio podría ser directo. El calcio parece fijado en la zona rica del glucoproteínas (glicocálix) situadas en el exterior celular. La naturaleza de las moléculas del glicocálix que fijan calcio es aún desconocida. Existen canales específicos que permiten el pasaje del calcio de estas reservas hasta el citoplasma cuando se activan las células.
Otro lugar de reserva es el retículo endoplásmico liso. Estas vesículas están situadas a distancia del exterior celular: es necesario un medio de transmisión entre los estímulos extracelulares y las vesículas. En algunos casos es el inositol-trifosfato (IP3) que se fija sobre los receptores específicos de estas membranas y permite la salida de calcio. La concentración en el líquido de las vesículas es 25 mM (250.000 veces más alta que la del citosol). La función de estas reservas de calcio en las células musculares es bien conocida.
El tercer lugar de reserva de calcio está constituido por las mitocondrias. Su función como reserva que sirva de segundo mensajero es más controvertida. Una función que tiene consenso es la de participar en la regulación de la concentración de calcio en el citosol.
El mantenimiento de la homeostasis celular del calcio es un fenómeno notable porque la concentración en el citosol es de 100 a 200 nM mientras que en el fluido extracelular es de 1.000.000 nM. La diferencia de concentración a través de la membrana tiene una relación de 5.000 a 10.000!!!21. Este gradiente se mantiene por la naturalmente baja permeabilidad de la membrana plasmática al calcio y por dos mecanismos ATP-dependientes que bombean el calcio en contra de este gradiente. La primera bomba es la de Ca2+/H+-ATPasa, o bomba de calcio. La segunda es el intercambiador 3Na+/Ca2+ operado por el gradiente de sodio, que a su vez es mantenido por la bomba de sodio o Na+/K+-ATPasa22.
En muchas células operan ambos mecanismos pero sus contribuciones relativas son aún desconocidas. En general, el mecanismo de 3 Na+/Ca2+ es de alta capacidad y baja afinidad para el calcio, lo que le permite movilizar grandes cantidades del ion por unidad de tiempo23. En contraste, la bomba de calcio es de alta afinidad para el calcio y baja capacidad, por lo que se la imagina como responsable del ajuste fino de la concentración de calcio celular.
La propiedad destacable de cada una de estas bombas es que sus actividades están reguladas por cambios en la concentración de calcio. Cuando ésta aumenta, cada una de estas bombas se hace más eficiente en expulsar calcio. Esto ocurre por un sistema de retroalimentación en cada una de ellas. El calcio se liga a la calmodulina y el complejo calmodulina-Ca se liga a la bomba de calcio lo que aumenta su capacidad y eficiencia para bombear calcio al espacio extracelular. Además de este mecanismo de retroalimentación, se conoce otro que utiliza AMPc y que activa la fosforilación de las proteínas de la bomba, lo que aumenta su eficiencia y capacidad. Un efecto semejante parece tener la fosforilación de las proteínas de la bomba a cargo de la proteín-kinasa C.
EL CALCIO COMO SEGUNDO MENSAJERO
El ion calcio es un segundo mensajero. Es curioso que un ion sin detalle estructural particular pueda servir como mensajero intracelular capaz de activar sistemas enzimáticos específicos, lo que efectúa fijándose a algunas proteínas como la calmodulina, y provocando modificaciones en su conformación.
Según Rassmussen el calcio tiene cuatro propiedades principales de segundo mensajero:
1. Es un mensajero universal en las células animales.
2. Es tóxico en alta concentración en el citoplasma y provoca la muerte celular.
3. Transmite un mensaje breve. El aumento de calcio en el citoplasma tras de una estimulación no perdura.
4. Actúa en forma armónica con otro segundo mensajero: AMP cíclico.
Este sistema tiene un papel central en la contracción de todos los tipos de fibras musculares, la secreción de productos endocrinos, exocrinos, neurocrinos, los procesos metabólicos de la glucogenolisis y gluconeogénesis, el transporte y secreción de fluidos y electrólitos y el crecimiento celular.
El sistema del calcio como segundo mensajero es prácticamente universal. Es un medio por el cual los mensajeros extracelulares (hormonas, citocinas, neurotransmisores) regulan funciones celulares. Dichos mensajeros tienen en común el aumento del recambio (turnover) de fosfatidil-inositol de las membranas como consecuencia del ligamiento de los mensajeros extracelulares a sus receptores. La hidrólisis del fosfatidil-inositol da lugar a la aparición intracelular de IP3 y diacilglicerol, que movilizan el calcio de los depósitos celulares.
Este sistema tiene dos ramas con diferentes papeles temporales. Una rama se caracteriza por la presencia de calmodulina y es responsable de respuestas metabólicas breves o de la fase inicial de respuestas metabólicas sostenidas. La otra rama se caracteriza por la enzima quinasa C, responsable de las respuestas celulares con respuestas metabólicas sostenidas en el tiempo.
Los efectos fisiológicos se dan sobre la multiplicación celular, la organización celular, los fenómenos de contracción y motilidad, la conducción nerviosa, las respuestas secretorias o metabólicas a diversos estímulos. Los mecanismos que desencadenan la acción del calcio como segundo mensajero son modificaciones de polarización de membrana y de permeabilidad a los iones minerales desencadenadas por la trasmisión de un impulso nervioso y el sistema de inositol-trifosfato. El sistema del AMPc modula la acción del calcio como segundo mensajero.
LA IMPORTANCIA DEL CALCIO Y DE LA VITAMINA D EN LA SALUD ÓSEA A LO LARGO DE LA VIDA
Las recomendaciones dietéticas de calcio y vitamina D durante el embarazo y la lactancia deben considerar además las necesidades del crecimiento fetal y más tarde las de producción láctea. Si bien anteriormente se recomendaba una ingesta de calcio mayor durante dichos períodos, en la actualidad se sugiere que existen alteraciones en la absorción y excreción de calcio, mediadas por cambios en el metabolismo materno, que compensarían eficientemente las necesidades extras de calcio sin necesidad de aumentar su ingesta. Así pues las recomendaciones de ingesta diaria de 1.000 mg de calcio y de 200 UI de vitamina D durante el embarazo y la lactancia son similares a las de una población adulta normal24.
En Argentina no existen datos nacionales sobre el consumo de calcio; no obstante, estudios parciales demostraron un elevado porcentaje de la población de distintas edades y estados fisiológicos con deficiencia subclínica de calcio25. Encuestas dietéticas en un grupo de gestantes y en período de lactancia demostraron también alta prevalencia de deficiencia de calcio26. Estos hallazgos son consecuencia de hábitos comunes a una gran parte de la población argentina los cuales son independientes del nivel socioeconómico. En nuestro país la mayor parte del aporte de calcio se realiza mediante el consumo de productos lácteos que poseen mayor biodisponibilidad que los de origen vegetal.
La vitamina D se adquiere por síntesis, por exposición solar a partir de precursores en piel, o exógenamente por la ingesta de alimentos, en general fortificados; sólo en poblaciones con riesgo de deficiencia se recomienda el consumo de suplementos medicamentosos.
EMBARAZO
Durante el embarazo ocurren varias alteraciones endocrinológicas entre las que se encuentran cambios en el metabolismo óseo y mineral materno, que tienden, en el caso de estos últimos, a cubrir los requerimientos de calcio del feto en crecimiento. Un niño nacido a término contiene aproximadamente entre 20 y 30 g de calcio27, y si bien la máxima mineralización del esqueleto fetal ocurre durante el tercer trimestre, la transferencia de calcio materno a través de la placenta comienza durante el segundo trimestre.
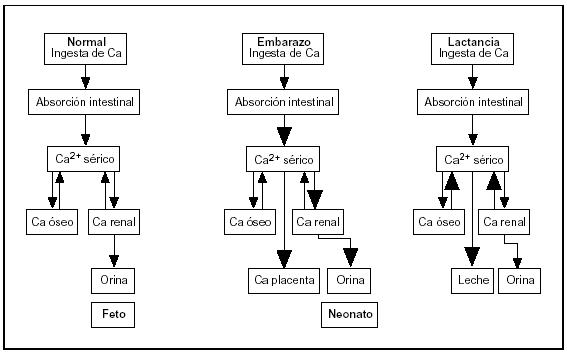
Para cubrir las demandas incrementadas de calcio se ponen en juego una serie de mecanismos fisiológicos. Sin embargo, la masa ósea materna podría disminuir si la ingesta de calcio es marginal, si aumenta la excreción urinaria y si los mecanismos hormonales que deben incrementar la absorción intestinal de calcio no se encuentran perfectamente regulados. La conservación renal no se produce debido a que es frecuente encontrar una hipercalciuria fisiológica en el embarazo, como consecuencia de dos factores: mayor absorción intestinal e incremento en la filtración glomerular28. El aumento en la absorción de calcio ocurre a partir del primer trimestre y las evidencias sugieren que es el principal mecanismo de adaptación durante el embarazo. Ciertos factores que se encuentran aumentados durante el embarazo como la proteína relacionada a la parathormona (PTHrp), estradiol, prolactina y lactógeno placentario estimulan la producción renal de 1,25-dihidroxivitamina D. Esta hormona, que participa activamente en la absorción intestinal de calcio, aumenta desde el primer trimestre, por lo que se le atribuye ser la causa principal del incremento en la absorción de calcio. Sin embargo, estudios experimentales realizados en ratas deficientes en vitamina D demostraron que durante el embarazo se duplica la absorción intestinal de calcio, sugiriendo que el aumento en la absorción de calcio no se debe exclusivamente al incremento en los niveles de calcitriol27.
En general la absorción neta se duplica, de 20%-25% a aproximadamente 40%; este incremento sugiere que si las madres consumen cantidades adecuadas de calcio, las necesidades del feto en crecimiento pueden cubrirse sin necesidad de recurrir al calcio del hueso materno. Contrariamente, mujeres embarazadas con muy bajas ingestas de calcio podrían llegar a perder hasta un 3% de su contenido esquelético durante el embarazo27.
Estudios histomorfométricos y la medición de marcadores bioquímicos del remodelamiento óseo sugieren que existe una gran actividad ósea durante el embarazo. En humanos aumentan tanto los marcadores de formación como de resorción ósea a partir del primer trimestre, con un mayor aumento durante el tercer trimestre de embarazo29.
Los estudios sobre cambios en la densidad mineral ósea son casi inexistentes, debido a que todos ellos utilizan radiaciones ionizantes, perjudiciales para el feto. Los pocos trabajos muestran resultados contradictorios: algunos no encuentran variaciones, otros determinan que existe pérdida de hueso trabecular sin cambios en el cortical y finalmente otros determinan que existe ganancia o pérdida de hueso de acuerdo al sitio estudiado. La ganancia en la masa ósea se explicaría debido a que durante el tercer trimestre de embarazo se incrementan notablemente los niveles estrogénicos. Esto, sumado a un incremento de la carga materna por aumento de peso corporal favorecería el incremento en el depósito esquelético de calcio en ciertos sitios, lo que prepararía a la madre para la posterior secreción láctea30. Estudios experimentales han demostrado que la deficiencia materna de vitamina D produce la pérdida de hueso al final del embarazo27.
Si bien la respuesta esquelética durante el embarazo dependerá de una gran variedad de factores como edad materna (por ejemplo embarazadas adolescentes), número de gestaciones, estado nutricional o endocrinológico, en la actualidad no existen evidencias de pérdida ósea en mujeres caucásicas embarazadas bien nutridas. Hay en la literatura casos señalados como osteoporosis del embarazo, que resultaría de una excesiva resorción ósea, inadecuada ingesta de calcio, bajo niveles de depósito de vitamina D o excesivo aumento de PTHrp en la circulación materna. Sin embargo, su incidencia es sumamente rara y en general se la considera como una forma de osteoporosis idiopática, o secundaria a otras intervenciones clínicas. Si bien dicha patología se relaciona con disturbios en el metabolismo cálcico, no existen evidencias acerca de la interrelación entre osteoporosis del embarazo e ingesta insuficiente de calcio. En la actualidad se sugiere que el embarazo podría desenmascarar, más que inducir, pérdida de masa ósea con el consiguiente riesgo de fracturas30.
La relación entre baja ingesta de calcio e hipertensión inducida por el embarazo fue postulada hace más de 50 años, cuando se observó mayor incidencia de eclampsia en países con bajas ingestas de calcio31. En este sentido, y de acuerdo a la OMS, la deficiencia de calcio implica un riesgo para la salud materno-fetal, constituyendo la interrelación entre preeclampsia y baja ingesta de calcio la primera causa de morbimortalidad perinatal. Tal interrelación fue comprobada mediante estudios clínicos los que concluyeron que la suplementación con 1-2 g de calcio por día durante la segunda mitad del embarazo sería de gran utilidad para la reducción de la incidencia de ciertos desórdenes hipertensivos en mujeres embarazadas de alto riesgo. Sin embargo, cuando se realizan las recomendaciones dietéticas se debe tener en cuenta tanto los efectos beneficiosos de un incremento en la ingesta de calcio como los efectos adversos que resultarían de dicho incremento para la salud materna. En este sentido, altas ingestas de calcio podrían incrementar el riesgo de desarrollar cálculos renales debido a un aumento en su excreción urinaria (se estima la prevalencia de nefrolitiasis en 1:1.500 embarazos), o el desarrollo de infecciones renales. Además, la interrelación entre los distintos nutrientes también se vería afectada, ya que altas ingestas de calcio se asocian a reducción en la absorción de otros minerales como hierro, cinc y magnesio30.
Se ha descrito riesgo de deficiencia de vitamina D al final del invierno en embarazadas que habitan a elevadas latitudes, en inmigrantes asiáticas en Inglaterra o en beduinas o sauditas por razones culturales32. En estos casos se recomiendan medidas preventivas de suplementación. A pesar de las posibles diferencias raciales, la exposición solar es el factor predominante en la concentración sanguínea de 25-hidroxivitamina D durante el embarazo. Es así que ante una buena exposición solar los niveles sanguíneos maternos de calcio, fósforo, PTH y 1,25-dihidroxivitamina D no se afectan por la suplementación durante el primer mes del embarazo con 1.000 UI/día de vitamina D27.
Respecto del feto en crecimiento, su esqueleto requiere una adecuada transferencia placentaria de calcio y vitamina D, especialmente durante el tercer trimestre. La desnutrición materna impacta sobre el crecimiento y el peso del niño al nacimiento y en consecuencia, sobre su masa esquelética; se puede observar, en ciertos casos, reducción en la densidad mineral ósea neonatal33. A pesar de que los niveles de calcio fetal o su mineralización esquelética no se ven afectados por deficiencia materna de vitamina D, en el período neonatal tal deficiencia puede manifestarse como raquitismo congénito y mayor incidencia de hipocalcemia neonatal tardía27,32.
LACTANCIA
Durante la lactancia el calcio pasa directamente del suero a la leche materna y la cantidad transferida al niño durante la lactancia dependerá de la concentración láctea de calcio y la cantidad de leche producida. Durante los dos o tres primeros meses de lactancia se secretan alrededor de 600 ml/d que equivalen a aproximadamente 200 mg de calcio/d y a los seis meses posteriores al parto la excreción de calcio alcanza aproximadamente 300 mg/d30. En consecuencia, la pérdida de calcio producida en la leche materna es mayor a la transferencia del mismo a través de la placenta durante todo el embarazo. Si bien el stress cálcico durante el embarazo es similar entre las distintas mujeres gestantes, la cantidad de calcio secretado durante la lactancia puede variar ampliamente alcanzando, en aquellas mujeres que alimentan al niño exclusivamente con leche materna, a 400 mg/d34.
La concentración de calcio tiende a ser menor en los países con baja ingesta de ese elemento, sin embargo sería el consumo en las etapas previas al embarazo la que influenciaría tal concentración láctea de calcio33. Anteriormente se suponía que la baja concentración de calcio de la leche podría estar influenciada por el status de vitamina D, sin embargo, actualmente este hecho se descarta totalmente35. Inversamente, la baja ingesta de calcio no incrementa el riesgo de desarrollar deficiencia de vitamina D, y más aún, la suplementación con calcio en condiciones de baja ingesta no tiene efecto sobre los niveles plasmáticos de 25-hidroxivitamina D36.
Respecto a los mecanismos implicados en la regulación del metabolismo óseo y mineral durante la lactancia, se observa que, a diferencia de la gestación, la absorción intestinal de calcio disminuye coincidiendo con una disminución en los niveles de 1,25-dihidroxivitamina D a valores prenatales. Los niveles de 25-hidroxivitamina D permanecen sin cambios, salvo los estacionales. La velocidad de filtración glomerular también disminuye, con lo cual se reduce la excreción renal de calcio en 24 h., dando lugar a un pequeño ahorro de calcio. Datos histomorfométricos experimentales determinan que existe un gran incremento del remodelamiento óseo con pérdida de 35% ó más de hueso durante la lactancia. En humanos los marcadores bioquímicos se encuentran sumamente aumentados alcanzando niveles 2-3 veces superiores a los del tercer trimestre de embarazo27.
Mediciones seriadas de densidad mineral ósea mostraron una caída entre 3% y 10% a nivel trabecular durante 2-6 meses de lactancia36. Estudios recientes sugieren que tal pérdida de hueso no puede prevenirse por aumento en la ingesta de calcio por encima de la ingesta adecuada. Sin embargo, la suplementación cálcica se debe considerar en aquellas mujeres que podrían presentar una mayor pérdida ósea comparada con la que ocurre en la mayoría de las lactantes (como en partos múltiples o en embarazos sucesivos), o en las que necesitarían una cantidad de calcio extra para alcanzar el pico de masa ósea (madres lactantes adolescentes)30.
La desmineralización temporaria del esqueleto, que se correlaciona con la cantidad de calcio secretado en la leche, parecería ser el principal mecanismo por el cual la mujer lactante cubre los requerimientos de este elemento. Este proceso no está mediado por PTH o calcitriol, pero podría estarlo parcialmente por el aumento en los niveles de PTHrp producidos por la glándula mamaria en respuesta al aumento de prolactina27,33. Otro factor importante implicado en el proceso, aunque no del todo esclarecido, sería la caída en los niveles estrogénicos. En este sentido, se ha observado una menor disminución de la densidad mineral cuando existe remisión temprana de la menstruación respecto de la amenorrea de larga duración37.
La pérdida en la masa ósea que ocurre durante la lactancia puede ser revertida dentro de los 3-6 meses de finalizada la misma. Este hecho se corresponde con una ganancia de masa ósea de 0,5% a 2% mensual, excediendo en gran medida aquella ganancia que ocurre durante el tratamiento de la osteoporosis36. El mecanismo implicado es incierto y ha sido poco explorado. Estudios experimentales demostraron que la repleción corporal en vitamina D es necesaria para la correcta remineralización esquelética27.
Como en el caso del embarazo, la osteoporosis asociada a la lactancia representa una coincidencia o puede estar relacionada a una baja densidad mineral antes de la concepción.
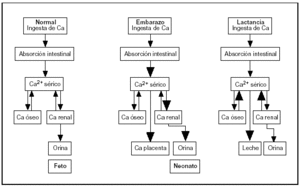
De las distintas observaciones se desprende que la adaptación materna durante el embarazo es diferente a la que ocurre durante la lactancia. En el primer caso, la mayor absorción de Ca es el mecanismo dominante, mientras que en la lactancia la transferencia temporal desde el esqueleto materno se convierte en el factor predominante (fig. 4).
Fig. 4. Cambios en el metabolismo del calcio durante el embarazo y la lactancia.
NIÑEZ
Un recién nacido tiene en su esqueleto aproximadamente 30 g de calcio, mientras que al llegar a la adultez una joven posee en su esqueleto aproximadamente 900 g de calcio y un joven 1.000 g. Esto implica una tasa de aposición ósea promedio durante la niñez de 100 mg/d, que aumenta durante la adolescencia a 150-200 mg/d en promedio, pudiendo llegar hasta 300-400 mg/d en el momento de mayor aposición ósea en la pubertad.
La masa ósea es el mayor determinante de las fracturas osteoporóticas38. La masa ósea pico representa la mayor densidad mineral ósea obtenida durante el crecimiento por la aposición mineral y se alcanza entre la segunda y tercera década de la vida dependiendo de los sectores esqueléticos estudiados39,40.
Cuanto mayor sea la masa ósea pico obtenida, mayor será el capital óseo con que un individuo enfrenta la pérdida postmenopáusica y por envejecimiento. Por esta razón cada vez es mayor el interés en optimizar la masa ósea pico como medida de prevención primaria de osteoporosis. La masa ósea pico está determinada genéticamente en un 80%41 y requiere un adecuado crecimiento y desarrollo puberal para su expresión42. Los factores extrínsecos que pueden ser estratégicamente modificados para maximizarla son la actividad física y la nutrición (calcio, proteínas, vitamina D). Dentro de los factores nutricionales el calcio ha sido el más ampliamente estudiado y controvertido.
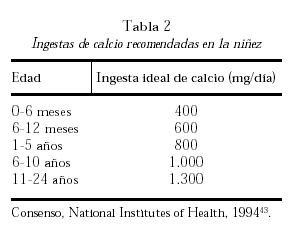
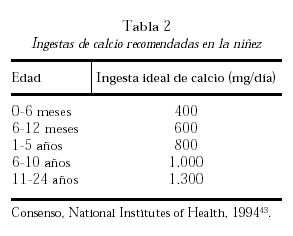
El aporte necesario de calcio se obtiene de la dieta y sus necesidades varían de acuerdo con las diferentes etapas de la vida. Considerando diferentes estudios de balance cálcico, el umbral de absorción de calcio y el análisis de estudios intervencionistas con calcio se han formulado recomendaciones de ingesta de este nutriente. La tabla 2 muestra los requerimientos óptimos diarios de calcio recomendados durante la infancia y la niñez43.
Relación entre la ingesta de calcio
y la masa ósea
Los primeros estudios fueron retrospectivos y analizaron la masa ósea y la tasa de fracturas osteoporóticas en poblaciones con diferentes ingestas de lácteos y de calcio. Uno de los grupos precursores fue el de Matkovic et al44 quienes estudiaron dos poblaciones en Yugoslavia con ingestas de calcio baja (400-500 mg/d) y alta (900-1.000 mg/d) a lo largo de su vida. Describieron una mayor masa ósea y menor incidencia de fracturas de fémur y muñeca en las poblaciones con mayor ingesta de calcio. Pero hay que destacar que esos individuos no sólo consumían una mayor cantidad de calcio sino también de proteínas y de calorías. Posteriormente, estudios en niños y adolescentes han investigado la relación de la ingesta de calcio con la masa ósea hallando correlaciones positivas algunos autores45,46 pero no otros47,48. Esta discrepancia puede ser causada parcialmente por la dificultad y heterogeneidad de los interrogatorios nutricionales y porque la mayor ingesta cálcica proviene de productos lácteos; por lo tanto, se evalúan también diferentes ingestas proteicas y calóricas.
Más demostrativos han sido los estudios de poblaciones infantiles con ingestas muy reducidas de calcio (inferiores a 300 mg/d) por razones socioecómicas y culturales como en China49 y África50 o por razones médicas, como los niños con alergia a la leche de vaca (con ingestas menores que 400 mg/d)51 que presentan tendencia a masa ósea menor. Incluso se ha descrito raquitismo (con alteraciones bioquímicas, radiológicas e histopatológicas) y deformidades óseas de miembros inferiores en algunos de estos niños provenientes de Sudáfrica, con ingestas entre 90 y 300 mg/d, a pesar de un adecuado nivel de vitamina D; y que han mejorado con adecuada ingesta de calcio50.
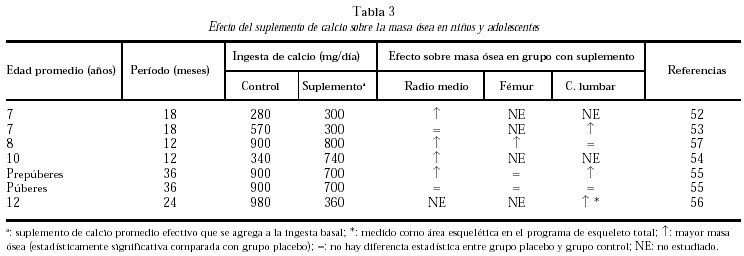
Se han realizado estudios intervencionistas con diferentes suplementos de calcio con el objeto de optimizar la masa ósea pico en grupos de niños con ingesta de calcio espontánea muy baja y en aquellos con ingestas de calcio alrededor de las ideales recomendadas (tabla 2).
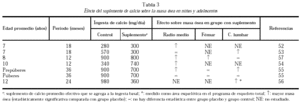
En los niños con ingestas basales muy bajas, entre 285 y 570 mg/d (como las poblaciones de China y Gambia)52-54, a los que se brindó un aporte extra de calcio de 300-740 mg/d, se obtuvo un mayor aumento de densidad mineral ósea que en los grupos control, a nivel de radio medio y de columna lumbar.
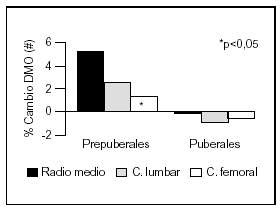
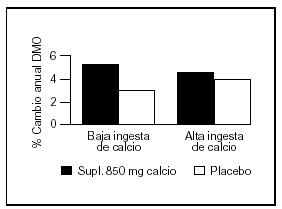
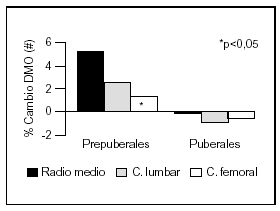
Otro estudio intervencionista fue realizado por Johnston et al55 en pares de mellizos caucásicos con una ingesta basal aproximada de 900 mg/d. A uno de los mellizos se le suplementó con 1 g de calcio y el otro siguió con su ingesta habitual como control. A los tres años se comprobó un incremento de la masa ósea superior en el grupo con suplemento, principalmente en las áreas apendiculares como radio medio y más leve en columna lumbar y fémur proximal. Estos cambios fueron significativos en los niños prepuberales, no observándose en los postpuberales (fig. 5). Sin embargo, Lloyd et al56 hallaron mayor densidad mineral ósea en esqueleto total en niñas con una edad promedio de 12 años que tenían una ingesta basal de 980 mg al suplementarlas con 500 mg/d de calcio, a pesar de encontrarse ya en desarrollo puberal.
Fig. 5. Suplementación cálcica y masa ósea. Diferente respuesta en pre y postpuberales. #: Expresa la diferencia del cambio de densidad mineral ósea del mellizo suplementado frente al no suplementado. Adaptado de Johnston et al55.
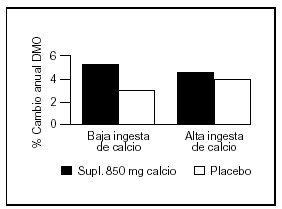
Bonjour et al57 estudiaron en un grupo de niñas caucásicas prepuberales (con una ingesta basal aproximada de 900 mg/d) la suplementación con alimentos enriquecidos con calcio en una cantidad de 850 mg/d, lo que resultó benéfico principalmente en radio medio y diáfisis femoral. También observaron que aquellas niñas con ingestas espontáneas bajas de calcio tuvieron la mejor respuesta tanto con aumento en el contenido mineral como con incremento del área vertebral y femoral (fig. 6).
Fig. 6. Suplementación cálcica. Efecto sobre la masa ósea de acuerdo a la ingesta espontánea de calcio. Adaptado de Bonjour et al57.
En general, al suspender el suplemento con calcio se ha observado que al cabo de períodos variables (12-18 meses) estos aumentos no se mantienen58,59, excepto en el grupo de niñas con ingesta basal espontáneamente baja, en las cuales todavía persiste el efecto positivo sobre la masa ósea al año de suspendida la suplementación.
Los mecanismos propuestos para un mayor aumento de la masa ósea con el suplemento de calcio en niños y adolescentes sería la disminución del remodelamiento óseo, demostrado incluso por la disminución de los marcadores del mismo55, y el estímulo de la producción y secreción del factor de crecimiento insulinosímil-1 (IGF-1)60.
Como conclusión general de estos estudios, el suplemento de calcio aumenta la masa ósea sobre todo en niños prepuberales, preferencialmente a nivel del esqueleto apendicular y en aquellos con ingestas espontáneas bajas de calcio, en los cuales incluso puede aumentar el tamaño óseo. Es todavía tema de investigación determinar si se alcanza una masa ósea pico mayor con el suplemento de calcio y si éste debe continuarse hasta la edad adulta ya que al suspenderse se observa en general pérdida del efecto benéfico.
Vitamina D
La deficiencia de vitamina D en el esqueleto en crecimiento ocasiona raquitismo carencial61. Los grupos con mayor riesgo de sufrir déficit de vitamina D son aquellos con disminuida exposición a la radiación UV por:
1. Razones geográficas (la radiación UV disminuye a medida que aumenta la latitud)62.
2. Razones socioeconómicas, culturales y religiosas que impiden que niños pequeños y mujeres embarazadas se expongan al sol63.
3. Aumento de la pigmentación de piel (cuanto mayor es la concentración de melanina en piel, menor es la síntesis de vitamina D)64.
4. Por edad: en prematuros y durante el primer año de vida65.
El estado nutricional de vitamina D se evalúa por los niveles circulantes de 25-hidroxivitamina D. Los niveles de riesgo a partir de los cuales aumenta significativamente la posibilidad de tener raquitismo varían entre 8 y 12 ng/ml según las diferentes series66,67.
La suplementación con vitamina D para prevenir raquitismo puede realizarse con68:
1. Dosis diarias de vitamina D (400-2.000 UI/d).
2. Alimentos fortificados con vitamina D.
3. Una dosis única de vitamina D (entre 50.000 y 200.000 UI dadas entre una y tres veces al año).
Estudios en Argentina. En Argentina la incidencia de raquitismo carencial desde el nacimiento hasta los 14 años es mayor en el área patagónica que en el resto del país, y va aumentando a medida que aumenta la latitud69.
Estudios efectuados en Ushuaia (Tierra del Fuego), a 55° Sur, mostraron que aproximadamente el 50% de los niños clínicamente sanos, de edad promedio 7 años, tenían niveles séricos invernales disminuidos de 25-hidroxivitamina D, menores a 8 ng/ml69. En esta misma población infantil se describió una variación estacional de hormona paratiroidea, con niveles significativamente mayores en el invierno que en el verano70. Se evaluó la suplementación con una dosis única de vitamina D (dosis oral al principio del otoño de 150.000 UI), que aumentó los niveles de 25-hidroxivitamina D al final del invierno de forma significativa en comparación con los niños sin suplementación; ningún niño presentó niveles menores a 8 ng/ml. Esta suplementación logró disminuir los niveles de PTH71.
Efecto sobre la masa ósea pico. El efecto de la deficiencia de vitamina D sobre la masa ósea ha sido escasamente investigado. Con el objeto de estudiar el efecto de los bajos niveles invernales de vitamina D sobre la masa ósea pico, se estudió un grupo de adultos jóvenes (18-30 años) de ambos sexos, que habían vivido en Ushuaia (55° S) durante su infancia, adolescencia y juventud, y que nunca habían recibido suplementos de vitamina D (excepto algunos en el primer año de vida). Ushuaia se caracteriza por poseer radiación UV baja, incluso nula durante el invierno. Esta población se comparó con un grupo similar en edad y sexo de residentes habituales de Buenos Aires (34° S), ciudad que posee todo el año una adecuada radiación UV). En ambas poblaciones se evaluó la densidad mineral ósea de radio distal y ultradistal y no se halló ninguna diferencia entre ambas poblaciones72. Sin embargo, se encontró una densidad mineral menor en radio distal en el subgrupo de mujeres de Ushuaia con ingesta habitual de calcio inferior a 800 mg/d que en aquellas con ingesta mayor.
Otras investigaciones en niñas adolescentes o jóvenes no han encontrado relación alguna entre los niveles de 25-hidroxivitamina D y la densidad mineral de esqueleto total, columna lumbar, fémur y radio73, o sólo una débil correlación entre dichos niveles y la densidad mineral de columna lumbar74.
También se analizó la influencia que podía tener la suplementación con vitamina D en el primer año de vida sobre la masa ósea: se concluyó que el grupo de niñas prepuberales suplementado en su primer año de vida presentaba mayor densidad mineral a nivel de cuello y trocánter femorales y metáfisis del radio que las no suplementadas, sin observarse diferencias a nivel de columna lumbar75.
Como conclusiones de esta sección, podemos mencionar:
1. Es fundamental la suplementación de los grupos de riesgo de deficiencia de vitamina D para evitar raquitismo.
2. Existe nula o débil asociación entre la densidad mineral ósea (evaluada en columna, radio, fémur y esqueleto total) y los niveles de vitamina D en niños, adolescentes y jóvenes.
3. La sumatoria de déficit de vitamina D e ingesta baja de calcio podría influir negativamente sobre la masa ósea pico.
4. La suplementación de vitamina D en el primer año de vida se asocia con mayor densidad ósea de fémur y radio, pero no de columna, en niñas prepuberales.
ADOLESCENCIA
Ya se ha observado que desde el nacimiento hasta el final del crecimiento los niños acumulan una gran cantidad de calcio y fosfato dentro del esqueleto. En los tres primeros años de vida se registra la mayor velocidad de crecimiento. Luego, hasta el inicio de la pubertad, se produce una desaceleración. En la pubertad, en ambos sexos existe un pico de crecimiento seguido por la fusión de las epífisis y cesación del crecimiento en longitud. En las niñas, la edad de inicio, el pico de crecimiento y las manifestaciones puberales se producen antes y son de menor magnitud que en los varones.
La acumulación de calcio en el esqueleto es muy acentuada en la pubertad. Varias hormonas participan en este cambio (hormona de crecimiento, IGF-1, esteroides sexuales, hormonas tiroideas, calcitriol) promoviendo el influjo y la retención de calcio76. Al final de la segunda década se alcanza el 90%-95% del pico de masa ósea. Ese pico está determinado por la combinación de factores endógenos (genéticos y hormonales) y exógenos (nutricionales y actividad física)77.
La adolescencia es un período importante para la ganancia ósea pero también es una etapa de gran vulnerabilidad porque la interrupción de los procesos fisiológicos normales, determinados por enfermedades o estilos de vida, puede causar un depósito óseo inapropiado para la constitución genética. Esto determinaría adultos con baja masa ósea y mayor riesgo de fracturas en el futuro aun perdiendo solamente modestas cantidades de hueso. Por lo tanto el óptimo desarrollo del esqueleto durante el crecimiento confiere beneficios en la vida adulta78.
Ese crecimiento activo se manifiesta bioquímicamente a través de los marcadores de formación y resorción que están muy elevados en la infancia, tales como fosfatasa alcalina, hidroxiprolina, osteocalcina, crosslinks y N-telopéptidos del colágeno76.
El incremento de la ingesta de calcio en las dietas generalmente como productos lácteos, o suplementos, se asocia con un balance cálcico positivo y tendencia a la mayor ganancia de densidad mineral44,78.
Ya se mencionó el trabajo de Johnston et al sobre la suplementación con citrato de calcio (cápsulas de 250 mg administradas cuatro veces por día) en gemelos entre 6 y 14 años. El grupo de intervención recibía en total 1.612 mg/d de calcio frente al control que recibía 908 mg. El citrato de calcio, bien tolerado, fue efectivo para aumentar la densidad mineral de varios sitios en niños prepuberales (4% en raquis y radio, y 3% en triángulo de Ward y trocánter en un año), siendo más marcada la diferencia respecto de los controles en el tejido cortical de radio (5,1% mayor) después de 3 años de estudio. Los niños mayores se beneficiaron poco con el aporte cálcico extra (719 mg más) (fig. 4). Es decir que el estado de madurez sexual modifica la acreción mineral haciéndola más dependiente de hormona de crecimiento y esteroides sexuales55.
En ese mismo estudio los niños con suplemento de calcio presentaban concentraciones séricas de osteocalcina significativamente menores. Ello indicaría menor recambio óseo en los tratados. Es de destacar que estos beneficios se pierden tras suspender el aporte58. Otros estudios observaron persistencia de los efectos hasta un año después57. Esto refleja la adaptación ósea a las bajas ingestas de calcio. No está establecido si estos aportes, durante corto tiempo, pueden determinar en niños con baja ingesta, una ganancia similar a la observada en individuos suplementados en forma prolongada79.
El estudio de Cadogan et al en 82 niñas adolescentes de 12 años, con aporte de 300 ml de leche diarios durante 18 meses demostró un incremento en la densidad mineral de cuerpo entero (9,6% frente a 8,5%)77. La ganancia fue más acentuada en piernas y pelvis. No existieron diferencias en la talla, el peso, ni la composición corporal (masas magra y grasa). Tampoco se verificaron cambios en el recambio óseo evaluado con osteocalcina, fosfatasa alcalina ósea, desoxipiridinolinas y N-telopéptidos. Existieron diferencias significativas en las concentraciones de IGF-1, probablemente relacionada con el mayor aporte proteico. El IGF-1 es un potente anabólico para el hueso en crecimiento: aumenta la proliferación de condrocitos del platillo de crecimiento; y estimula la proliferación y diferenciación de osteoblastos, la formación de la matriz (síntesis de colágeno tipo I y de otras proteínas), y la aposición perióstica.
La cantidad de hueso acumulado en el esqueleto durante el crecimiento es dependiente en cierta medida del calcio de la dieta, de modo que deficiencias de aporte del mismo durante la formación esquelética disminuyen la masa ósea pico79. Esto a menudo no trae consecuencias inmediatas pero puede asociarse con aumento del riesgo de fracturas aun en jóvenes. En general, el escaso aporte surge como consecuencia de que los adolescentes evitan los productos lácteos (que son la mayor fuente de calcio) por el temor a aumentar de peso y por lo tanto la ingesta es inferior a lo recomendado80. En las niñas de 9-13 años el consumo de calcio es aproximadamente el 69% de lo recomendado, en tanto baja a sólo 55% entre los 14 y los 18 años81. Otros autores comunican cifras alarmantes como que el 90% de las niñas de 9-18 años sólo consumen el 77% de lo recomendado79.
La adolescencia es un período crítico y complejo del desarrollo en el cual se producen cambios biológicos, sociales, psicológicos y cognoscitivos y donde la preocupación del estado nutricional ocupa el último lugar. Estudios recientes, tras 4 años de seguimiento y determinando la composición corporal demostraron que mujeres jóvenes, quienes consumían una cantidad adecuada de calcio a partir de productos lácteos, comparadas con las que recibían calcio suplemento no presentaron mayor ganancia de peso o masa grasa. Interesante fue el hallazgo de menor acumulación de grasa en las que consumían lácteos81. Estas observaciones coinciden con las de Jackman et al82 y enfatizan la seguridad y el efecto práctico de estimular el hábito de tomar lácteos desde la temprana infancia con constancia a través de toda la adolescencia79.
Varios estudios randomizados57,77,78 han demostrado incremento en la masa ósea y en la densidad mineral en niños y adolescentes con el aporte suplementario de calcio, sea como comidas «fortificadas», suplementos medicamentosos o productos lácteos. Todos estos trabajos fueron de corta duración (1-3 años). Las ganancias obtenidas se mantuvieron por escaso tiempo al suspender el aporte57 y podría inferirse que el consumo elevado debe mantenerse hasta alcanzar el pico de masa ósea.
En el estudio del grupo de Jackman82 sobre la retención máxima de calcio en niñas adolescentes de 12-14 años, se demostró que ingestas superiores a 1.300 mg/d no se acompañan de mayor retención. Esto indica que el calcio es un nutriente con umbral83, es decir, ingestas por debajo de un determinado valor condicionan la acumulación ósea, pero las superiores no la modifican más allá de un plateau. En las ingestas elevadas el depósito óseo depende del programa genético de crecimiento y de la carga mecánica. En las ingestas bajas la retención del calcio no es suficiente como para permitir la realización del potencial genético y por lo tanto la masa ósea alcanzada dependerá de la ingesta de calcio.
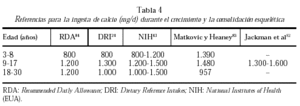
El umbral para la ingesta de calcio está bien establecido en animales. Varios autores han propuesto un umbral para humanos79. En la tabla 4 se muestran las
diferentes cifras de ingesta cálcica recomendadas durante el crecimiento del esqueleto.
El esqueleto crece en longitud, en anchura y en masa. En individuos de peso normal el pico de masa ósea se alcanza pocos años después de la fusión de las epífisis de los huesos largos. La edad exacta varía de acuerdo a cada hueso y a la forma de medición. La densidad mineral por área, medida con absorciometría dual de rayos X, alcanza un pico en fémur proximal antes de los 20 años, mientras que en esqueleto total lo hace 6-10 años después. El cráneo nunca alcanza su pico porque continúa aumentando a lo largo de la vida. Por su parte, cuerpos vertebrales y fémures aumentan su diámetro a medida que transcurren los años. Es decir, alcanzar el potencial genético total significa tener un esqueleto de forma y masa adecuado sin haber sufrido restricción de nutrientes o de cargas mecánicas. Para alcanzar el pico de masa ósea genéticamente determinado, la ingesta de calcio debe estar por encima del umbral desde la infancia hasta la vida adulta joven79, 85-87.
La retención de calcio durante la adolescencia está fuertemente influida por la cantidad de calcio en la dieta. Esa mayor retención ósea proviene de la combinación de mayor absorción intestinal y de menor resorción ósea, como fue demostrado en el estudio de Wastney et al. En él se estudiaron 35 niñas de 12,7 ± 1,2 años, con bajas y altas ingestas de calcio (856 y 1.896 mg/d respectivamente) y sólo se verificó una pequeña variación en la absorción fraccional (0,32 frente a 0,28); los marcadores de resorción disminuyeron entre 11% y 23%88. En este trabajo se minimizaron las variaciones dependientes del estado de madurez sexual por la corta duración (2 meses). El aporte extra de calcio se realizó a través de bebidas suplementadas con citrato-malato. Probablemente por ello no existieron diferencias en los niveles séricos de IGF-1, como en el estudio de Cadogan et al, donde el aporte se realizó con leche, alimento rico en proteínas77.
Molgaard et al estudiaron niños dinamarqueses y observaron que existe una relación directa entre el consumo de calcio y el contenido mineral óseo ajustado por tamaño89.
Un estudio reciente demostró que, en niñas de 14,5 años, la ingesta de calcio inferior a 800 mg/d en la dieta se acompañó de deficiencia de otros nutrientes: fósforo (95,2%), magnesio (84,8%), hierro (90,5%) y cinc (100%). Asimismo se encontró correlación negativa entre la edad de la menarca y el coeficiente pondo-estatural90.
Varios nutrientes pueden influir en la absorción y en la excreción obligatoria del calcio91. Además, éste puede afectar la absorción de otros nutrientes y tener efectos negativos en otros sistemas corporales. El fósforo, otro nutriente importante, se considera que tiene efectos adversos sobre el calcio. Esto ha sido demostrado en animales de laboratorio con elevada ingesta de fosfatos (con una relación 6:1 con respecto al calcio) en los que se desarrolla pérdida ósea. También existen relatos de niños con excesiva incidencia de fracturas o baja masa ósea quienes presentaron historia de alta ingesta de bebidas con cola, ricas en ácido fosfórico79. Algunos autores encontraron elevación de parathormona en adolescentes norteamericanas con dietas ricas en fósforo, y consideraron la posibilidad de resorción ósea elevada en estos casos. La alta ingesta de fósforo reduce la excreción renal de calcio pero aumenta la pérdida por materia fecal87.
La cafeína, en elevadas concentraciones, aumenta la excreción de calcio urinario, pero este efecto no fue observado en adultos con dosis habituales de cafeína (450 mg/d, equivalentes a 3-6 tacitas de café). Otros estudios encontraron un incremento de la pérdida ósea con menores dosis, pero esto probablemente se relacione con la menor ingestión concomitante de lácteos79. Un bajo consumo de cafeína (0-152 mg/d) no permitió observar efectos sobre la calciuria en adolescentes86.
Matkovich et al han demostrado que en adolescentes, igual que en adultos, el sodio es el mayor determinante de la excreción urinaria de calcio86. Este estudio se realizó en 381 niñas blancas de 8 a 13 años en estadio puberal 2. La baja ingesta de calcio y la relativamente alta pérdida de calcio urinario, potenciado por la ingesta de sodio durante el crecimiento rápido, puede reducir la retención de calcio esquelético con una concomitante reducción del pico de masa ósea. En este mismo estudio no se demostró relación positiva entre el consumo de proteínas y la calciuria, como está establecido en adultos. Esto podría explicarse por el fuerte balance nitrogenado positivo en la adolescencia.
El incremento en la ingesta de calcio puede interferir con el uso de otros nutrientes como magnesio, cinc y hierro, que son importantes para el crecimiento. En el estudio de Hoppe no se encontró asociación significativa de estos nutrientes con el contenido mineral óseo o el área ósea87.
Ilich et al, en su estudio de 354 niñas en estadio puberal 2, tras 4 años de seguimiento no encontraron efectos sobre el metabolismo del hierro en las que recibían suplemento de citrato-malato de calcio para alcanzar 1.500 mg/d. En cambio, el pico de crecimiento y el estado menstrual tenían efectos adversos sobre el hierro cuando el consumo del mismo era escaso92.
Tampoco se observó efecto sobre la utilización de cinc cuando se administraron elevadas dosis de calcio en forma de citrato-malato en niñas de 13,0 ± 0,5 años llegando a un consumo de 1.500 mg/d93.
El mismo grupo de investigadores no encontró alteraciones en la utilización del magnesio con la administración de altas dosis de calcio. Lo demostró estudiando durante 14 días a 26 niñas de 11,3 años. Fueron divididas en 2 grupos según el consumo de calcio (control: 667 mg/d, y tratadas: 1.664 mg/d). El aporte se realizó con 1.000 mg de citrato-malato94.
Recientemente, ha surgido una opinión en contra a raíz de un estudio longitudinal realizado en Pensilvania (EUA), que no encontró efectos beneficiosos de ingestas de calcio superiores a 500 mg/d entre los 12 y los 20 años de edad en mujeres sobre la densidad mineral ósea total o regional; por el contrario, el ejercicio físico tuvo un efecto positivo sobre dicho parámetro y sobre las propiedades geométricas del fémur95.
En resumen, la ingesta de calcio puede aumentar marcadamente el balance óseo especialmente al inicio de la menarca. Esto es atribuible a la combinación de una mayor absorción intestinal con menor resorción ósea. En este período de la vida de la mujer donde el recambio óseo es máximo, la resorción ósea y la absorción intestinal permanecen constantes, por lo tanto lo que no proviene de la dieta vendrá del hueso88.
La mayoría de los estudios coincide en la necesidad de mantener un aporte elevado de calcio en este período de la vida, como dieta láctea, o con alimentos enriquecidos o suplementos medicamentosos, debido a que los únicos determinantes modificables del pico de masa ósea son los exógenos (dieta y actividad física).
Quizás la comunidad médica, fundamentalmente la pediátrica, en conjunto con las autoridades de Salud Pública, debería intensificar los criterios de prevención tratando de estimular el consumo de productos lácteos y la actividad física regular (combatiendo además los modelos de delgadez extrema) para maximizar el pico de masa ósea y reducir la incidencia futura de fracturas.
ETAPA ADULTA, CON ÉNFASIS EN LA PREMENOPAUSIA
La osteoporosis es un problema creciente en el mundo desarrollado o en vías de desarrollo ya que la población presenta una mayor expectativa de vida.
Varios factores hormonales, genéticos y ambientales se interrelacionan y pueden afectar la acumulación de tejido óseo hasta la obtención del pico de masa ósea o su integridad durante la vida adulta79.
Dentro de los factores nutricionales la deficiencia de calcio y de vitamina D, como también de las proteínas, perturba el crecimiento esquelético o aceleran la pérdida ósea96.
Hay sólidas evidencias que sostienen la noción de que el calcio es un nutriente importante para la preservación de la masa ósea durante la adultez, y está también claro que sin un aporte apropiado de vitamina D, sea de fuente cutánea o exógena, la biodisponibilidad del calcio y su metabolismo están perturbados, conduciendo a una pérdida acelerada de hueso durante la vida adulta97.
Es conocida la importancia de la ingesta de calcio y de vitamina D durante la niñez para la obtención de un adecuado pico de masa ósea98, y también que la suplementación con los mismos durante la vejez reduce la pérdida ósea y la tasa de fracturas de cadera99,100.
La acción del aporte de calcio en la postmenopausia inmediata, es decir, durante los cinco primeros años posteriores a ella, es más controvertida. Varios autores coinciden en que el calcio no logra modular la pérdida ósea en los años inmediatos al cese de la función ovárica, pero sí disminuye la pérdida ósea de las mujeres en menopausia tardía, sobre todo si tienen una baja ingesta previa de este mineral100.
Ruml et al analizaron el efecto del citrato de calcio sobre la densidad mineral ósea en la postmenopausia temprana y media, en un estudio randomizado y controlado101. El grupo tratado con 800 mg de citrato de calcio en 2 tomas diarias no perdió masa ósea lumbar ni radial comparado con la declinación significativa del grupo placebo después de 2 años de tratamiento. La densidad mineral ósea femoral no se modificó en ninguno de los grupos. Por análisis de covariancia se constató que el efecto protector del citrato de calcio a nivel lumbar no fue significativo durante los 3 primeros años de postmenopausia, pero sí se manifestó a partir de ese límite. Los marcadores óseos del metabolismo del calcio evidenciaron la supresión de la PTH y la reducción del recambio óseo.
La vitamina D es sintetizada en la dermis a partir del 7-dehidrocolesterol por acción de los rayos ultravioletas. Luego es secuencialmente hidroxilada en el hígado y en el riñón constituyéndose el metabolito activo, el 1,25-dihidroxicolecalciferol o calcitriol. Los efectos de esta hormona están mediados por el receptor nuclear a la vitamina D (VDR). La unión de la vitamina D a su receptor forma un complejo con el receptor del ácido retinoico y otros factores transcripcionales regulando la expresión de los genes relacionados con la función de la vitamina D, que es mantener la homeostasis del calcio y del fósforo mediante la regulación de su absorción intestinal y la resorción ósea, además de contribuir a una adecuada función neuromuscular102.
La vitamina D es importante para el mantenimiento de la integridad ósea durante la etapa adulta. Su déficit severo y prolongado lleva a la osteomalacia, disminuyendo la integridad mecánica del hueso y por ende aumentando la susceptibilidad a las fracturas. Se expresa bioquímicamente por una disminución en el calcio y fósforo séricos o un eventual aumento de la fosfatasa alcalina. Sin embargo, deficiencias sutiles, moderadas o «subclínicas» en el adulto joven son mucho más frecuentes de lo estimado y pueden estar asociadas a un hiperparatirodismo relativo y a una densidad mineral ósea menor que en los grupos controles.
Otro grupo con potenciales carencias son los vegetarianos estrictos, quienes al tener un escaso aporte dietético deben cuidar la exposición solar durante el invierno103.
Peterson et al, en un estudio realizado con mujeres premenopáusicas jóvenes de 18 a 30 años con una ingesta de calcio baja mostraron que el aporte de calcio evita la pérdida de contenido mineral óseo comparada con un grupo control. Este hecho ha sido reafirmado por otros autores, quienes enfatizan la importancia de asegurar una adecuada ingesta de calcio en este grupo de mujeres, cuya dieta suele ser deficitaria en este elemento, con el objetivo de mantener la integridad del esqueleto104.
En cuanto a la vitamina D, Zitterman et al evaluaron el efecto de las diferencias estacionales de exposición solar sobre la absorción de calcio y el recambio óseo a un grupo de mujeres jóvenes, con el objetivo de determinar la necesidad de suplementar con vitamina D a este grupo etario durante la época invernal. Los autores concluyen que la disminución en las concentraciones séricas de calcio y fósforo se debe a la disminución de los niveles de 25-OHD. Teniendo en cuenta que los marcadores del recambio óseo no se modifican, no sería necesario suplementar con vitamina D a las mujeres que ya tienen una buena ingesta de calcio (1.200 mg diarios)105.
También Carnevale et al han demostrado una mayor prevalencia de hipovitaminosis D en el sur de Italia durante el invierno, más pronunciada en las mujeres jóvenes, con un mayor índice de remodelamiento óseo106.
El mayor determinante del balance de calcio es la absorción intestinal y un 50% de las mujeres postmenopáusicas con osteoporosis tienen malabsorción de calcio. Esto podría reflejar una disminución en la concentración de vitamina D, una disfunción renal y también una disminución de la sensibilidad gastrointestinal al calcitriol107.
La malabsorción de calcio y la disminución (con la edad) de la habilidad para adaptarse a una dieta baja en este elemento es uno de los factores que llevan al balance negativo de calcio y al hiperparatirodismo secundario que incrementa la pérdida de masa ósea tanto en mujeres premenopáusicas como postmenopáusicas108.
Wishart et al evaluaron la relación entre la ingesta de calcio, la 1,25-dihidroxivitamina D y el VDR en un grupo de mujeres premenopáusicas. Concluyeron que el calcitriol sérico y el aporte de calcio dietario son determinantes independientes de la absorción de calcio en las mujeres premenopáusicas y que los polimorfismos del gen de VDR tienen una influencia menor pero significativa en la absorción107.
Otros autores, tales como Kinyamu et al, en estudios comparando el efecto de los genotipos del receptor de vitamina D sobre la absorción de calcio, la concentración del receptor de vitamina D y los niveles de calcitriol en un grupo de mujeres jóvenes y ancianas normales, no hallaron diferencias significativas entre los diferentes grupos genotípicos de VDR109,110.
Pattanauguchi et al demostraron una clara diferencia en la relación entre la absorción fraccional de calcio y la 1,25-dihidroxivitamina D; había una fuerte correlación en los jóvenes mientras que no fue significativa en las mujeres ancianas. Los autores atribuyen este hallazgo a diferentes posibilidades que incluyen simplemente la variabilidad biológica de la absorción fraccional de calcio; también podría haber una predominancia de contribución de la absorción pasiva de calcio frente a la forma activa. Una tercera posibilidad sería una incapacidad de modular la absorción fraccional de calcio en respuesta a los cambios circulantes de la 1,25- dihidroxivitamina D. La conservación de esta relación en las mujeres premenopáusicas podría estar en relación con niveles adecuados de estrógenos de esta etapa de la vida111.
Las mujeres premenopáusicas conservan su integridad ovárica. Se han realizado varios estudios para interpretar la acción de los estrógenos en el metabolismo del calcio, y se acepta que contribuyen a una mayor sensibilidad a la acción de la vitamina D.
Varias evidencias sugieren que los estrógenos pueden aumentar la absorción intestinal de calcio. Gennari et al estudiaron a mujeres antes y 6 meses después de la ooforectomía demostrando una menor respuesta de la absorción de calcio al calcitriol durante el déficit de estrógenos. Esto sugiere un efecto directo de esta hormona sobre la respuesta intestinal a la 1,25-dihidroxivitamina D112.
Lied et al demostraron en ratas que los estrógenos aumentan directamente los niveles de VDR y la respuesta de los genes 1,25-dihidroxivitamina D al tratamiento con calcitriol113; Bolscher et al, por su parte, hallaron que los estrógenos pueden estimular directamente la absorción intestinal de calcio, independientemente de la acción de 1,25-dihidroxivitamina D114 y se ha demostrado la presencia de receptores intestinales a estrógenos115.
También se ha evaluado la diferencia en la absorción intestinal de 3 tipos de sales de calcio en mujeres jóvenes y ancianas. Praet et al evaluaron la biodisponibilidad del citrato de calcio (tanto soluble como sólido) y del gluconato de calcio. La respuesta fue similar para las mujeres pre y postmenopáusicas. Una carga de 1.000 mg de citrato de calcio soluble o gluconato de calcio fue más eficiente para aumentar la calcemia que la misma dosis de citrato de calcio en forma sólida116.
Wolf et al estudiaron diferentes factores asociados a la eficiencia de la absorción del calcio en las mujeres pre y postmenopáusicas117. Estudios epidemiológicos recientes relacionan a la baja ingesta de calcio no solamente con la osteoporosis sino también con la hipertensión arterial y el cáncer de colon. Los beneficios de este mineral dependen de la cantidad ingerida y también de factores que facilitan la eficiencia de su absorción, la cual puede variar entre el 10% y el 60% en mujeres sanas. Dichos factores ya fueron enumerados previamente e incluyen la edad, el nivel de estrógenos en circulación, la cantidad habitualmente ingerida, el polimorfismo del receptor de vitamina D (VDR), etc. Los autores examinaron más específicamente la variedad de los componentes de la dieta, factores de estilo de vida, las hormonas calciotrópicas y el polimorfismo del VDR en 2 grupos de mujeres pre o perimenopáusicas a las que les modificaron el aporte de grasa en la dieta. El rango de la absorción fraccional del calcio fue muy amplio en ambos grupos. La grasa dietética, la fibra, el nivel sérico de calcitriol y el consumo de alcohol fueron determinantes independientes de la eficiencia de la absorción de calcio, explicando aproximadamente un 21% del total de la variación en la absorción. En particular las mujeres que consumían dietas con una menor relación grasa/fibra tenían un 19% menos de absorción fraccional de calcio. Ellos hallaron que las mujeres con menor ingesta de grasa tenían una menor absorción fraccional de calcio. También aquellas con mayor ingesta de fibras tenían una pobre absorción de calcio. Los autores relacionan estos dos hechos al tránsito intestinal más rápido asociado a la mayor ingesta grasa y de fibras.
Los resultados en cuanto al calcitriol fueron coincidentes con los de otros autores que reportaron que el calcitriol sérico contribuye un 5% de la variación de la eficiencia en la absorción de calcio en mujeres perimenopáusicas, sin hallar significativas diferencias según las estaciones.
En cuanto a la contribución del polimorfismo del VDR en la eficiencia de la absorción de calcio los autores contradicen las conclusiones de otros estudios que le atribuyen un papel importante, siendo imposible constatar una interacción entre los genotipos de VDR (BB-bb) y bajos o altos niveles de ingesta cálcica. De todas maneras se requieren aún más estudios para evaluar los efectos funcionales del polimorfismo del VDR.
Está clara la importancia del calcio y de la vitamina D en la salud ósea para mantener la integridad del esqueleto durante la etapa de la premenopausia. Muchos son los factores que, según hemos analizado, intervienen en la biodisponibilidad del calcio ingerido y la acción de la vitamina D para mantener la integridad ósea durante la etapa adulta previa a la menopausia.
Los factores hormonales, genéticos y ambientales se expresan en esta interacción fundamental para conservar el potencial máximo del capital óseo adquirido hasta el pico de masa ósea.
NOTA: La segunda parte de este trabajo aparecerá publicada en el n.º 1 del volumen 12 de esta revista.
NOTICIAS
VI CONGRESO INTERNACIONAL DE LA SOCIEDAD IBEROAMERICANA DE OSTEOLOGIA Y METABOLISMO MINERAL (SIBOMM)
Marzo 23-26, 2003 Quito (Ecuador)
Presidente Comité Organizador Local. Dr. Raúl Jervis.
e-mail: simbomm@hmetro.med.ec. Web: www.sibomm.com
Secretaría Técnica Centro Médico Meditrópoli. Avda. Mariana de Jesús y Occidental, of. 619.
Quito (Ecuador)