Clasificación
Lista de abreviaturas
AAAAI = Academia Americana de Alergia, Asma e Inmunología (American Academy of Allergy, Asthma and Immunology)
ACAAI = Colegio Americano de Alergia, Asma e Inmunología (American College of Allergy, Asthma and Immunology)
ADN = Ácido desoxirribonucleico
ARIA = Rinitis alérgica y su impacto sobre el asma (Allergic rinitis and its impact on asthma)
BCG = Bacilo de Calmette y Guérin
BVRM = extractos bacterianos de las vías respiratorias mixtos
CMICA = Colegio Mexicano de Inmunología Clínica y Alergia
COMPEDIA = Colegio Mexicano de Pediatras Especializados en Inmunología y Alergia
EA = Eventos adversos
EAACI = European Academy of Allergy, Asthma and Immunology
EBM = Medicina basada en evidencia (Evidence Based Medicine)
EEUU = Estados Unidos
GA2LEN = Red global europea de alergia y asma (Global Allergy and Asthma European Network)
GRADE = Grading of Recommendations Assessment, Development and Evaluation IgG4 = inmunoglobulina G, subclase 4
IL = Interleucina
IM = Intramuscular
ISS = Secuencia inmunoestimulador (Immuno-stimulating sequence)
ITE =Inmunoterapia específica, esta incluye todas las formas de inmunoterapia con alergenos, sin importar su vía de administración
LPS = Lipopolisacárido
MPL = Monofosforil lípido A (Monophosphoryl Lipid A)
PCID = Prueba cutánea intradérmica
PCP = Prueba cutánea por punción (= PCP, Skin Prick Test)
PEF = Flujo pico espiratorio (peak expiratory flow)
QoL = Calidad de vida (Quality of Life)
RAE = Rinitis Alérgica Estacional
RAS = Reacción adversa sistémica
RAL = Reacciones adversas locales
RALext = Reacciones adversas locales extensas
RQOLQ = Cuestionario de Calidad de Vida en Rinoconjuntivitis (Rhinoconjunctivitis Quality of Life Questionnaire)
SC = Subcutánea
ITSC= Inmunoterapia subcutánea (subcutaneous immunotherapy)
ITSL = Inmunoterapia sublingual (sublingual immunotherapy)
SMS = Puntaje de síntomas y medicación (SymptomMedicationScore)
Th2 = Linfocito de la clase T ayudante tipo 2 (T helper = Th)
TLR = Receptores tipo Toll (Toll-Like Receptors)
Alergeno mayor: en una mezcla de proteínas alergénicas de cierto alergeno, aquella(s) proteína(s) a la cual/las cuales más de 50% de los pacientes —alérgicos al alergeno en cuestión— produce anticuerpos IgE específicos.
Fase de inducción de tolerancia: fase de la inmunoterapia que inicia con las dosis más bajas de extractos alergénicos toleradas por el paciente, las cuales se incrementan hasta llegar a las dosis de mantenimiento.
Fase de mantenimiento: fase durante la cual se aplicará siempre la dosis de mantenimiento, con eventuales ajustes según las circunstancias (p.ej. estación de ácaros o polinización, activación de alergia). En la ITSC además se espacian las aplicaciones durante esta fase a una a dos veces por mes.
Dosis programada de mantenimiento: dosis de extractos alergénicos que al aplicarse cada mes probablemente sea efectiva en reducir síntomas y necesidad de medicamentos. Se intentará llegar a esta dosis al final de la fase de inducción de tolerancia.
Dosis máxima terapéutica: dosis máxima alcanzada de extractos alergénicos, sin causar reacciones adversas alérgicas locales o sistémicas en el paciente, pero que reduce sus síntomas. Esta dosis puede ser la dosis programada de mantenimiento, pero en pacientes muy sensibles a veces es menor que ésta.
Guías internacionales: guías para la práctica clínica de pruebas cutáneas y/o inmunoterapia desarrolladas y publicadas en otros países.
Resumen Ejecutivo
Guía Mexicana de Práctica Clínica de Inmunoterapia 2011
Método recomendado para la detección de IgE específica
Se recomienda:
Demostrar la presencia de IgE específica mediante pruebas percutáneas (prick o punción).
Considerar que los resultados de pruebas in vitro realizados con diferentes técnicas no son equivalentes, cada método tiene su propio punto de corte.
Considerar que la sensibilidad y validez interna de las pruebas in vitro, varían según la técnica usada, las más recomendables son ImmunoCAP e Immulite.
Se sugiere:
Especialmente en ácaros: en el caso de un resultado negativo con la prueba de punción, considerar que el resultado positivo de una prueba intradérmica podría determinar si se incluirá el alergeno en la inmunoterapia, siempre y cuando la historia clínica sea congruente con este resultado.
Solamente cuando es imposible realizar las pruebas cutáneas, considerar el resultado positivo de una determinación de IgE específica in vitro para determinar cuáles alergenos se incluirán en la inmunoterapia, siempre y cuando la historia clínica sea congruente con este resultado.
En alergia a veneno de himenópteros: una PCP negativa y un resultado positivo en las pruebas in vitro aunado a un cuadro clínico altamente sugestivo es suficiente para iniciar inmunoterapia.
Alergenos a incluir en las pruebas cutáneas
Se recomienda:
Incluir en la prueba cutánea los alergenos relevantes en cada región.
Reducir el número de alergenos que se usa en la prueba cutánea, tomando en cuenta reacciones cruzadas y eliminando alergenos con poca presencia en cierta región. incluir en las pruebas cutáneas que se realicen en toda la República Mexicana a Dermatophagoides pteronyssinus, Dermatophagoides farinae o una combinación de los dos, Cynodon dactylon, cucaracha y gato ya que se ha demostrado buena correlación entre su presencia en el medio ambiente y la sensibilización en pacientes mexicanos con patología alérgica.
Se sugiere:
Incluir en las pruebas cutáneas que se realicen en la República Mexicana a Fraxinus americana, excepto para los estados del norte de la República, en donde se sugiere incluir mezquite (Prosopis sp) y el álamo (Populus sp).
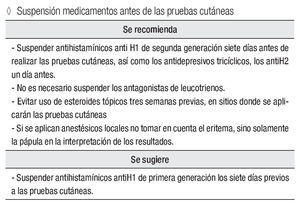
Suspender los medicamentos antes de las pruebas cutáneas
Se recomienda:
Suspender antihistamínicos anti H1 de segunda generación siete días antes de realizar las pruebas cutáneas; los antidepresivos tricíclicos y los antiH2, un día antes. No es necesario suspender los antagonistas de leucotrienos.
Evitar uso de esteroides tópicos tres semanas previas, en sitios donde se aplicarán las pruebas cutáneas.
Si se aplican anestésicos locales, no tomar en cuenta el eritema, únicamente la pápula en la interpretación de los resultados.
Se sugiere:
Suspender antihistamínicos antiH1 de primera generación los siete días previos a las pruebas cutáneas.
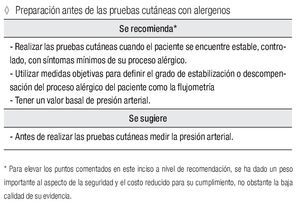
Preparación antes de las pruebas cutáneas con alergenos
Se recomienda:*
Realizar las pruebas cutáneas cuando el paciente se encuentre estable, controlado, con síntomas mínimos de su proceso alérgico. Utilizar medidas objetivas para definir el grado de estabilización o descompensación del proceso alérgico del paciente como la flujometría. Tener un valor basal de presión arterial.
Se sugiere:
Antes de realizar las pruebas cutáneas, medir la presión arterial.
Cómo registrar el resultado de las pruebas cutáneas
Se recomienda:
Registrar los resultados de las pruebas cutáneas midiendo en milímetros el diámetro mayor de la pápula o el diámetro promedio de la pápula: D (mm) + d (mm) /2 (diámetro mayor + diámetro perpendicular a éste, entre 2).
Se sugiere:
También tomar en cuenta el diámetro del eritema.
Interpretación de los resultados de las pruebas cutáneas por punción (PCP, prick).
Se recomienda:
No usar dispositivos o lancetas que causen una pápula mayor a 3 mm con el control negativo.
Considerar como resultado positivo una pápula con un diámetro mayor de 3 mm superior al del diámetro mayor o promedio del control negativo.
Considerar como falsa negativa una prueba sin respuesta, ni en la punción del control positivo.
Recomendaciones para indicar la inmunoterapia
Se recomienda utilizar ITSC en:
Pacientes con rinitis y rino-conjuntivitis alérgicas provocadas por gatos, pólenes de pastos, malezas y árboles y cucarachas, ya que se ha demostrado una disminución de síntomas nasales, uso de antihistamínicos y mejoría en la calidad de vida.
Niños de seis a 14 años de edad con asma persistente leve y en adultos con asma persistente moderada.
Reacciones sistémicas por alergia al veneno de abejas y avispas, asociadas a síntomas cardiovasculares y respiratorios, demostrada por la presencia de IgE específica, mediante pruebas cutáneas o estudios in vitro, especialmente en personas con riesgo elevado de sufrir nuevas picaduras (apicultores, residencia en zonas de riesgo).*
Se sugiere:
Niños asmáticos de dos a seis años de edad, en quienes reduce nuevas sensibilizaciones.**
Pacientes con rinitis alérgica con sensibilización a ácaros del polvo casero (evidencia insuficiente).
Pacientes con dermatitis atópica sensibilizados a ácaros del polvo casero (evidencia insuficiente).
En ciertos pacientes con urticaria probablemente inducida por un mecanismo IgE-dependiente (opinión consensada).
* En este caso el panel de expertos precisó hacer una recomendación a pesar de que la calidad de la evidencia es baja, debido a que los beneficios de la ITSC en estos pacientes son mayores que los probables riesgos.
** Debido a que la ITSL es más aceptada por los pacientes de esta edad, el grupo de expertos decidió proponer la ITSC sólo como "sugerencia".
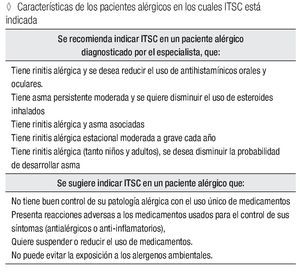
Características de los pacientes alérgicos en los cuales la ITSC está indicada.
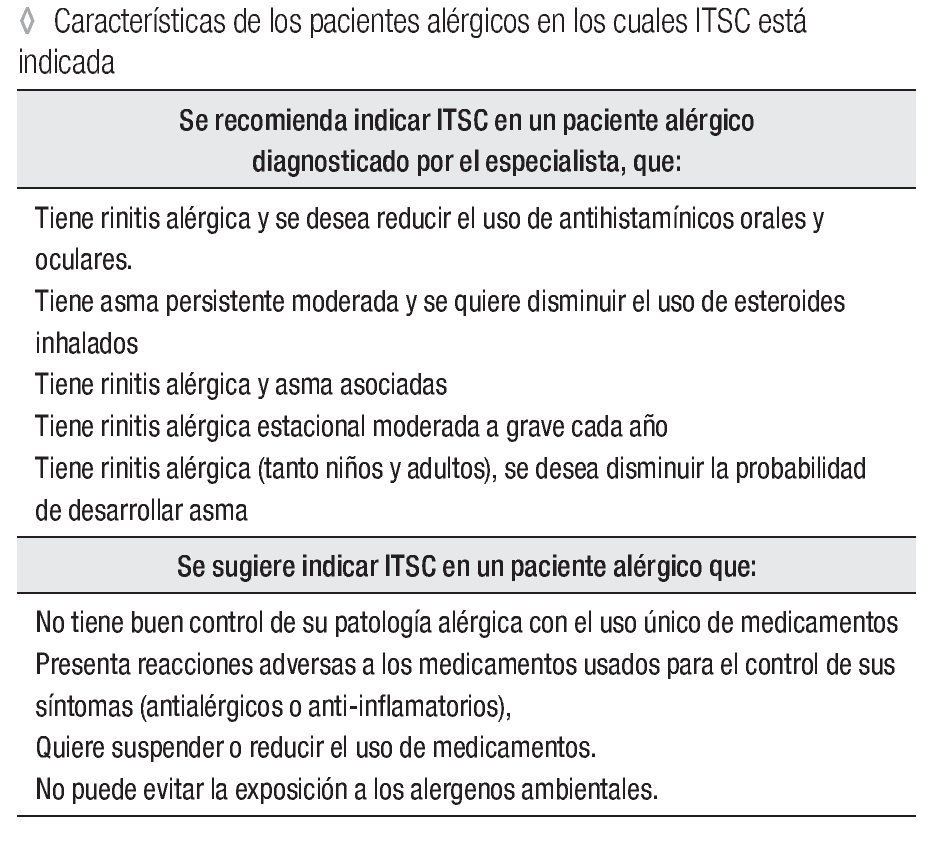
Se recomienda indicar ITSC en un paciente alérgico diagnosticado por el especialista, que tiene:
Rinitis alérgica y se desea reducir el uso de antihistamínicos orales y oculares.
Asma persistente moderada y se quiere disminuir el uso de esteroides inhalados. Concomitantemente rinitis alérgica y asma.
Rinitis alérgica estacional moderada a grave cada año.
Rinitis alérgica (tanto niños y adultos), se desea disminuir la probabilidad de desarrollar asma.
Se sugiere indicar ITSC en un paciente alérgico que:
No tiene buen control de su patología alérgica con el uso único de medicamentos.
Presenta reacciones adversas a los medicamentos usados para el control de sus síntomas (antialérgicos o anti-inflamatorios). Quiere suspender o reducir el uso de medicamentos.
No puede evitar la exposición a los alergenos ambientales.
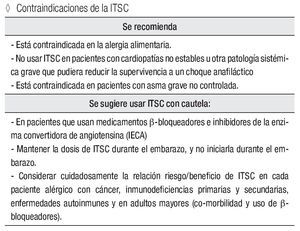
Contraindicaciones de la ITSC
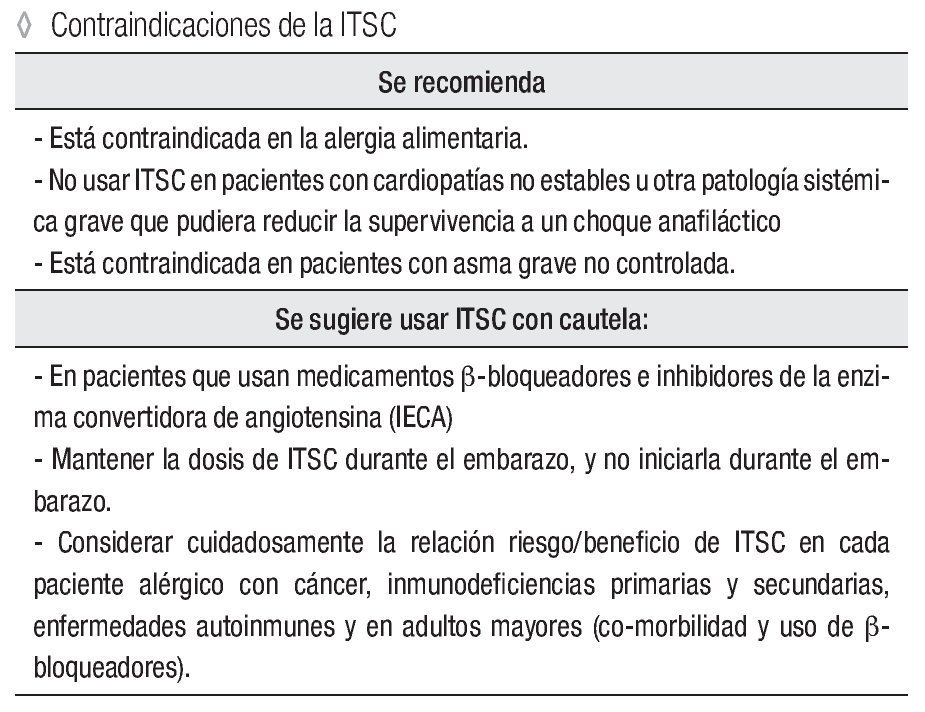
Se recomienda:
Está contraindicada en la alergia alimentaria.
No usar ITSC en pacientes con cardiopatías no estables u otra patología sistémica grave que pudiera reducir la supervivencia a un choque anafiláctico.
Está contraindicada en pacientes con asma grave no controlada.
Se sugiere usar ITSC con cautela:
En pacientes que usan medicamentos β-bloqueadores e inhibidores de la enzima convertidora de angiotensina (IECA).
Mantener la dosis de ITSC durante el embarazo, y no iniciarla durante el embarazo.
Considerar cuidadosamente la relación riesgo/beneficio de ITSC en cada paciente alérgico con cáncer, inmunodeficiencias primarias y secundarias, enfermedades autoinmunes y en adultos mayores (co-morbilidad y uso de β-bloqueadores).
A partir de qué edad se puede usar ITSC
Se recomienda:
Indicar ITSC a partir de los seis años de edad.
No indicar ITSC en menores de dos años de edad, debido a la falta de evidencia actual.
Se sugiere usar ITSC en pacientes:
Entre dos a seis años de edad.*
* No se considera recomendación, debido a que la evidencia actual es insuficiente y la vía de administración no es la preferida para niños.
Cuidados previos a la aplicación de ITSC
Es obligatorio:
Tener dos identificadores en el frasco de vacuna del paciente.
No aplicar la vacuna si el paciente cursa con asma no controlada o si tuvo una hospitalización/atención en urgencias la semana anterior. Tener firmada la hoja de consentimiento informado.
Se recomienda:
Tener un valor basal de la presión arterial del paciente antes de la aplicación de inmunoterapia.
Usar un cuestionario estándar para detectar problemas de salud que pueden aumentar el riesgo de anafilaxia por la vacuna (Anexo 3). Tener en observación al paciente mínimo 30 minutos después de la aplicación para detectar reacciones adversas.
Aplicar una flujometría al paciente asmático antes de la inyección de la vacuna.
Se sugiere:
Determinar la dosis de inmunoterapia que se aplica basándose en cinco puntos: Fase de inmunoterapia del paciente (inducción de tolerancia o mantenimiento). Estado de salud del paciente al momento de inyección.
Tolerancia de la dosis previa.
Intervalo desde la aplicación previa.
Estación del año con aumento en exposición a pólenes/ácaros/hongos.
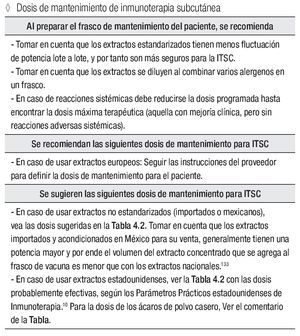
Dosis de mantenimiento de inmunoterapia subcutánea
Al preparar el frasco de mantenimiento del paciente, se recomienda:
Tomar en cuenta que los extractos estandarizados tienen menos fluctuación de potencia lote a lote, y por tanto son más seguros para la ITSC.
Tomar en cuenta que los extractos se diluyen al combinar varios alergenos en un frasco.
En caso de reacciones sistémicas debe reducirse la dosis programada hasta encontrar la dosis máxima terapéutica (aquella con mejoría clínica, pero sin reacciones adversas sistémicas).
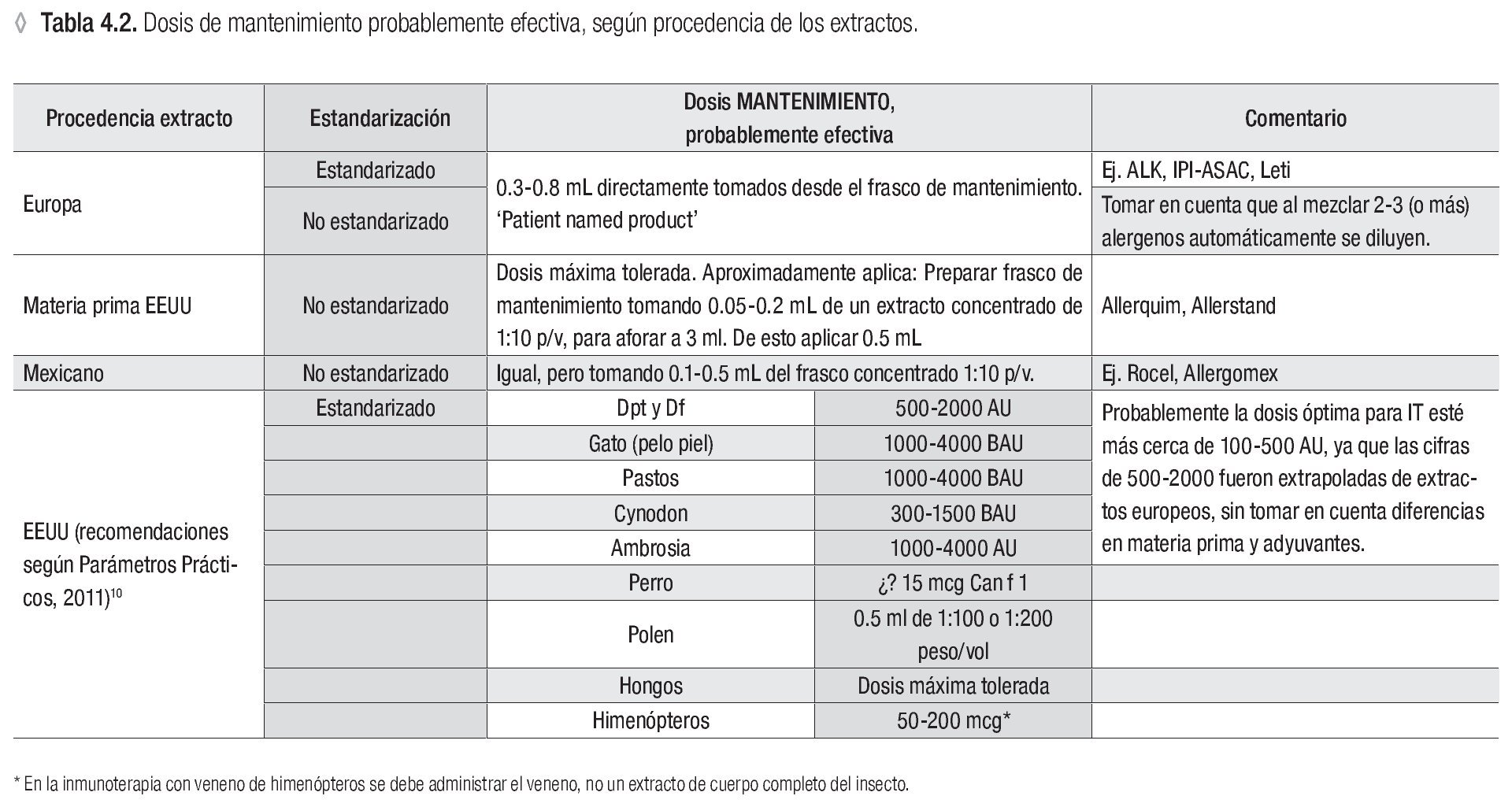
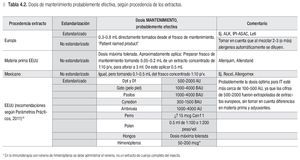
Se recomiendan las siguientes dosis de mantenimiento para ITSC:
En caso de usar extractos europeos: Seguir las instrucciones del proveedor para definir la dosis de mantenimiento para el paciente.
Se sugieren las siguientes dosis de mantenimiento para ITSC:
En caso de usar extractos no estandarizados, importados o mexicanos tomar en cuenta que los extractos importados y acondicionados en México para su venta, generalmente tienen una potencia mayor y por ende el volumen del extracto concentrado que se agrega al frasco de vacuna es menor que con los extractos nacionales.
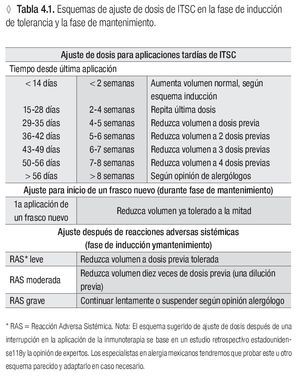
En caso de usar extractos estadounidenses, verla tabla 4.1 con las dosis probablemente efectivas, según los Parámetros Prácticos estadounidenses de Inmunoterapia. Para la dosis de los ácaros de polvo casero, tomen nota del comentario en la columna derecha de la tabla.
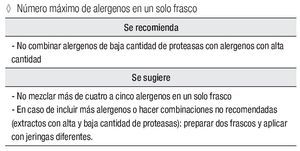
Número máximo de alergenos en un solo frasco
Se recomienda:
No combinar alergenos de baja cantidad de proteasas con alergenos con alta cantidad.
Se sugiere:
No mezclar más de cuatro a cinco alergenos en un solo frasco
En caso de incluir más alergenos o hacer combinaciones no recomendadas (extractos con alta y baja cantidad de proteasas): preparar dos frascos y aplicar con jeringas diferentes.
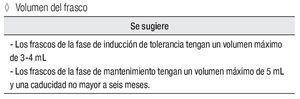
Volumen del frasco
Se sugiere:
los frascos de la fase de inducción de tolerancia tengan un volumen máximo de 3 mL a 4 mL
los frascos de la fase de mantenimiento tengan un volumen máximo de 5 mL y una caducidad no mayor a seis meses.
Diluyente a usar para preparar la vacuna de ITSC
Se sugiere:
Usar solución salina fenolada con albúmina humana 0.3% como diluyente, sobre todo para los frascos más diluidos de la fase de inducción a la tolerancia. (IMPORTANTE: no usar albúmina bovina, ya que puede sensibilizar).
Tener cuidado especial al iniciar un frasco nuevo, aún si su preparación fue idéntica al frasco previo.
Descartar los frascos de ITSC de mantenimiento con caducidad hasta seis a ocho meses después de preparados.
Esquemas de aplicación de ITSC
Se recomienda:
Iniciar con una dosis aproximadamente 10 000 veces más baja que la dosis de mantenimiento programada. Una duración de tres a seis meses.
Aplicar una a dos veces por semana.
Se sugiere:
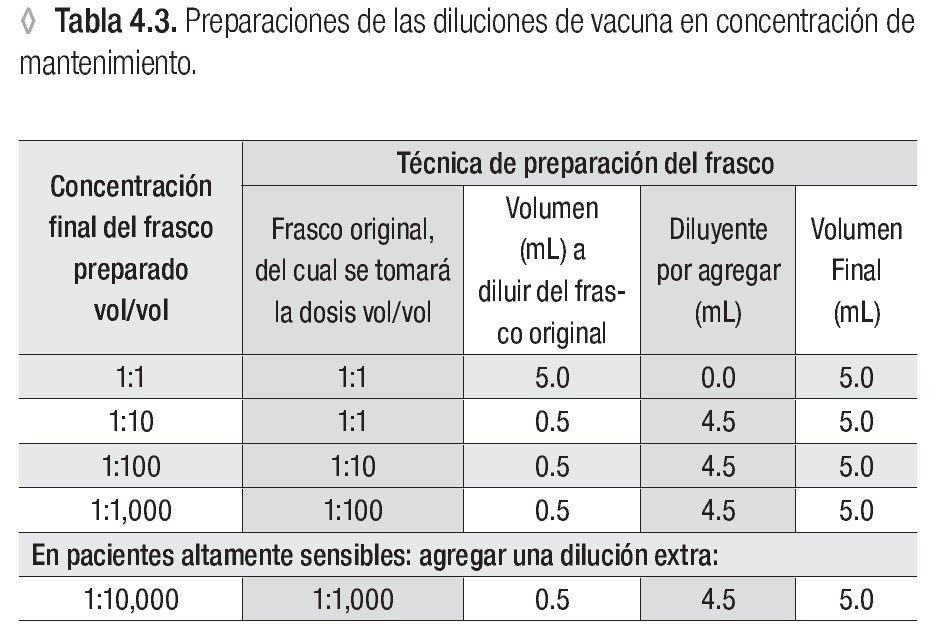
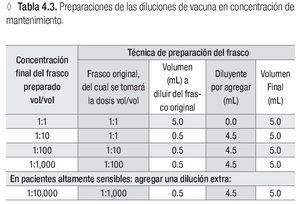
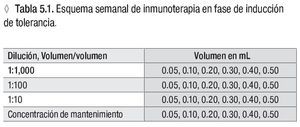
Usar una serie de cuatro diluciones seriadas de 1:10 a partir del frasco con la concentración de mantenimiento.*
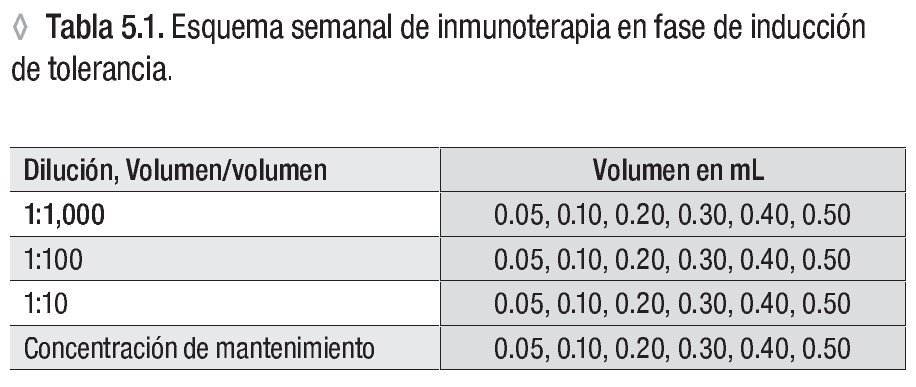
Aplicar de cada concentración cuatro a seis dosis, aumentando el volumen de aplicación**
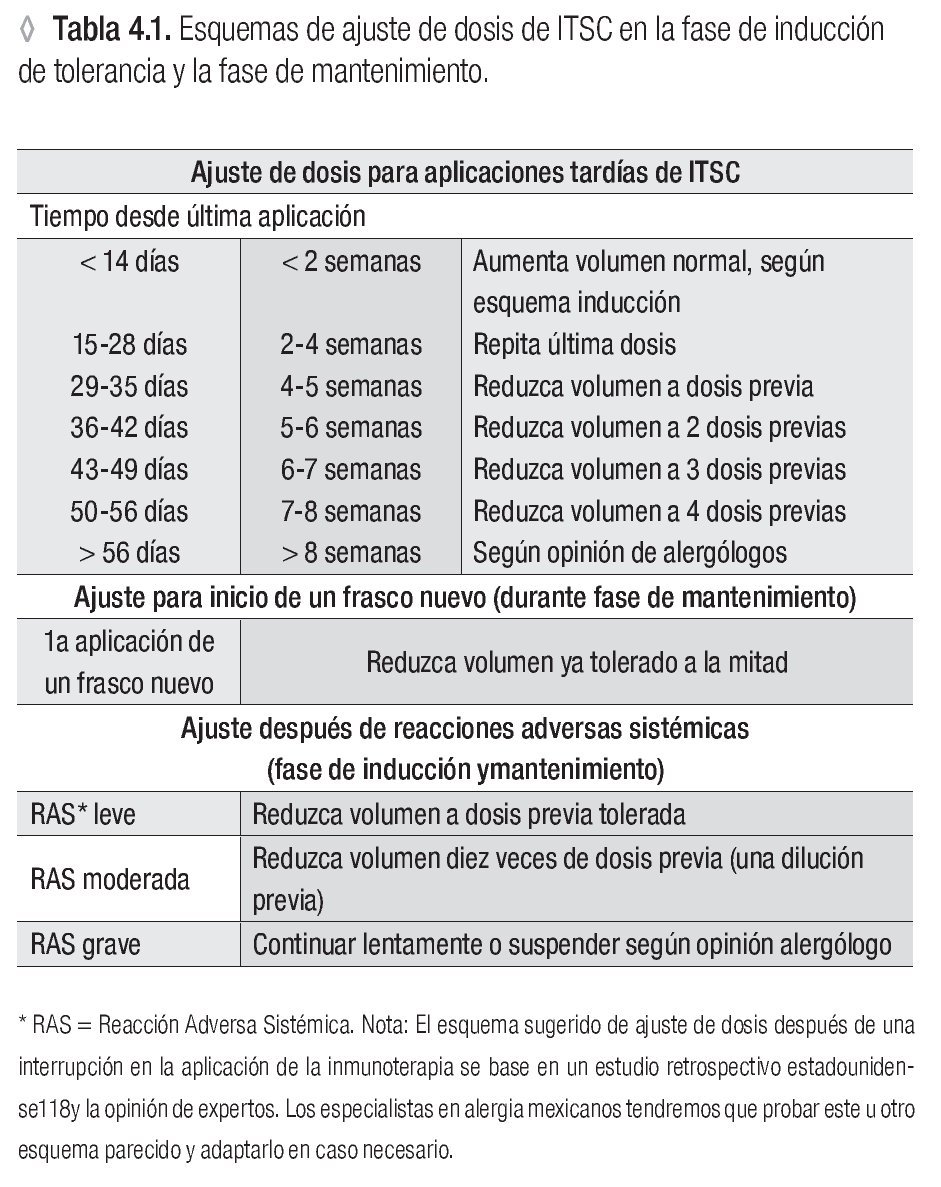
Un esquema de ajuste de dosis para aplicaciones tardías, frascos nuevos y después de reacciones adversas sistémicas***
* Ver la tabla 4.3
** Ver la tabla 5.1
*** Ver la tabla 4.1.
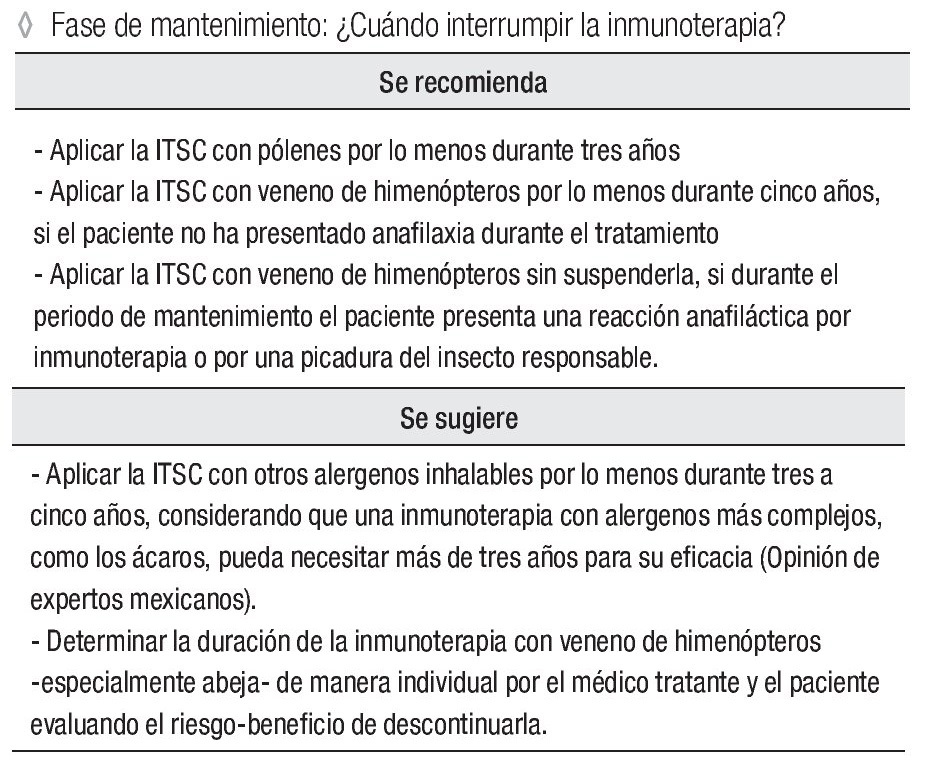
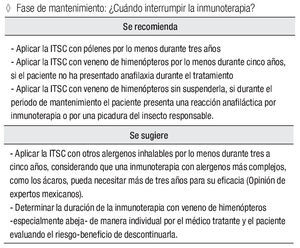
Fase de mantenimiento: ¿Cuándo suspender la inmunoterapia?
Se recomienda:
Aplicar la ITSC con pólenes por lo menos durante tres años.
Aplicar la ITSC con veneno de himenópteros por lo menos durante cinco años, si el paciente no ha presentado anafilaxia durante el tratamiento
Aplicar la ITSC con veneno de himenópteros sin suspenderla, si durante el periodo de mantenimiento el paciente presenta una reacción anafiláctica por inmunoterapia o por una picadura del insecto responsable.
Se sugiere:
Aplicar la ITSC con otros alergenos inhalables por lo menos durante tres a cinco años, considerando que una inmunoterapia con alergenos más complejos, como los ácaros, pueda necesitar más de tres años para su eficacia (opinión de expertos mexicanos).
Determinar la duración de la inmunoterapia con veneno de himenópteros -especialmente abeja- de manera individual por el médico tratante y el paciente evaluando el riesgo-beneficio de descontinuarla.
Uso de vacunas bacterianas en inmunoterapia específica con alergenos
Se recomienda:
Considerar el uso de productos bacterianos en pacientes con enfermedades alérgicas e infecciones recurrentes, para reducir la frecuencia de infecciones.
Se sugiere:
Considerar el uso de productos bacterianos en conjunto con alergenos en la inmunoterapia, para reducir sus efectos adversos y aumentar su impacto sobre el sistema inmune.
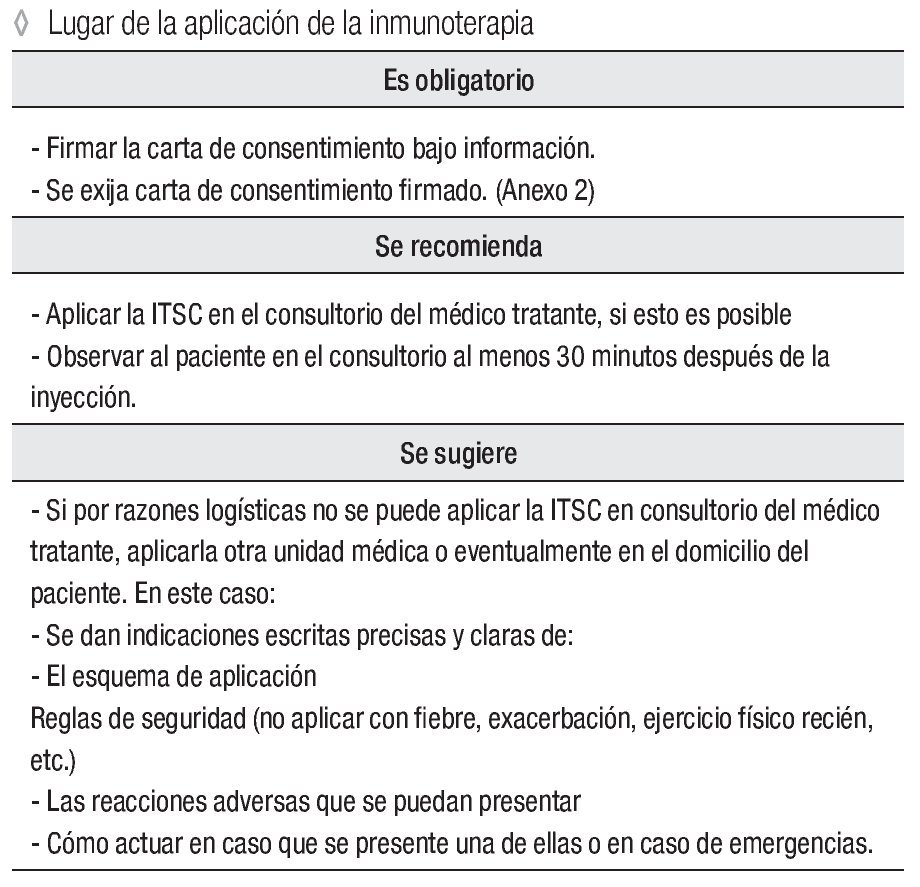
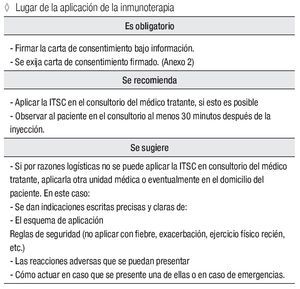
Lugar de la aplicación de la inmunoterapia
Es obligatorio:
Firmar la carta de consentimiento bajo información. Se exija carta de consentimiento firmado ( Anexo 3).
Se recomienda:
Aplicar la ITSC en el consultorio del médico tratante, si esto es posible
Observar al paciente en el consultorio al menos 30 minutos después de la inyección.
Se sugiere:
Si por razones logísticas no se puede aplicar la ITSC en consultorio del médico tratante, aplicarla otra unidad médica o eventualmente en el domicilio del paciente. En este caso:
Se dan indicaciones escritas precisas y claras de:
El esquema de aplicación
Reglas de seguridad (no aplicar con fiebre, exacerbación, ejercicio físico recién, etc.)
Las reacciones adversas que se puedan presentar.
Cómo actuar en caso que se presente una de ellas o en caso de emergencias.
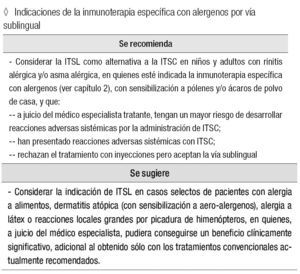
Indicaciones de la inmunoterapia específica con alergenos por vía sublingual
Se recomienda:
Considerar la ITSL como alternativa a la ITSC en niños y adultos con rinitis alérgica y/o asma alérgica, en quienes esté indicada la inmunoterapia específica con alergenos (ver capítulo 2), con sensibilización a pólenes y/o ácaros de polvo de casa, y que:
A juicio del médico especialista tratante, tengan un mayor riesgo de desarrollar reacciones adversas sistémicas por la administración de ITSC.
Han presentado reacciones adversas sistémicas con ITSC.
Rechazan el tratamiento con inyecciones pero aceptan la vía sublingual.
Se sugiere:
Considerar la indicación de ITSL en casos selectos de pacientes con alergia a alimentos, dermatitis atópica (con sensibilización a aero-alergenos), alergia a látex o reacciones locales grandes por picadura de himenópteros, en quienes, a juicio del médico especialista, pudiera conseguirse un beneficio clínicamente significativo, adicional al obtenido sólo con los tratamientos convencionales actualmente recomendados.
Uso de ITSL en relación a la edad de los pacientes
Se recomienda:
Considerar la indicación de ITSL a partir de los cuatro años, siempre y cuando el paciente reúna los criterios recomendados para su indicación (ver sección 6.1).
Se sugiere:
Considerar la indicación de ITSL en niños de dos a tres años de edad con rinitis alérgica y/o asma alérgica, si se reúnen los criterios recomendados para ITSL (ver sección 6.1). No indicar ITSL en pacientes con factores de riesgo que puedan complicar reacciones adversas sistémicas (hipertensión arterial de difícil control, enfermedad coronaria, enfermedad cerebro-vascular, arritmias cardiacas)
Evaluar si se indica ITSL en pacientes que toman medicamentos que pueden interferir con el tratamiento en caso de anafilaxia (uso de β-bloqueadores). Deberá intentar cambiar estos medicamentos no deseables por otros que no interfieren antes del inicio de la ITSL
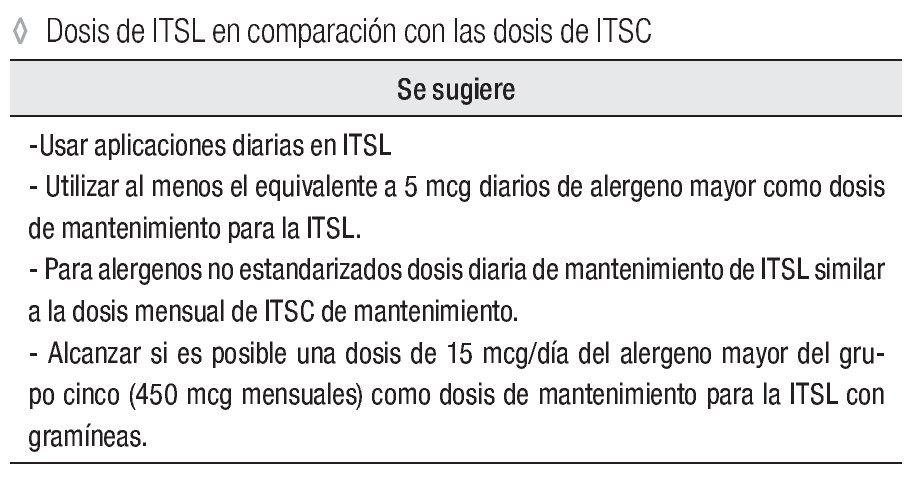
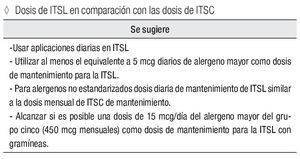
Dosis de ITSL en comparación con las dosis recomendadas para la ITSC
Se sugiere:
Usar aplicaciones diarias en ITSL.
Utilizar al menos el equivalente a 5 mcg diarios de alergeno mayor como dosis de mantenimiento para la ITSL.
Para alergenos no estandarizados dosis diaria de mantenimiento de ITSL similar a la dosis mensual de ITSC de mantenimiento.
Alcanzar si es posible una dosis de 15 mcg/día del alergeno mayor del grupo 5 (450 mcg mensuales) como dosis de mantenimiento para la ITSL con gramíneas.
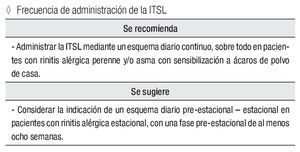
Frecuencia de administración de la ITSL
Se recomienda:
Administrar la ITSL mediante un esquema diario continuo, sobre todo en pacientes con rinitis alérgica perenne y/o asma con sensibilización a ácaros de polvo de casa.
Se sugiere:
Considerar la indicación de un esquema diario pre-estacional - estacional en pacientes con rinitis alérgica estacional, con una fase pre-estacional de al menos ocho semanas.
Duración del tratamiento con ITSL
Se recomienda:
Administrar la ITSL durante un periodo de por lo menos tres años.
Se sugiere:
Prolongar el tratamiento con ITSL hasta completar cuatro años siempre que sea posible.
Lugar recomendado para la administración de la inmunoterapia específica con alergenos por vía sublingual
Se recomienda:
Administrar la primera dosis de ITSL en el consultorio.
Esperar 30 minutos después de su administración para evaluar posibles reacciones adversas.
Es posible administrar dosis subsecuentes de la ITSL en domicilio del paciente.
Proporcionar información precisa sobre los cuidados y precauciones que deberá seguir el paciente para la administración de la ITSL en casa.
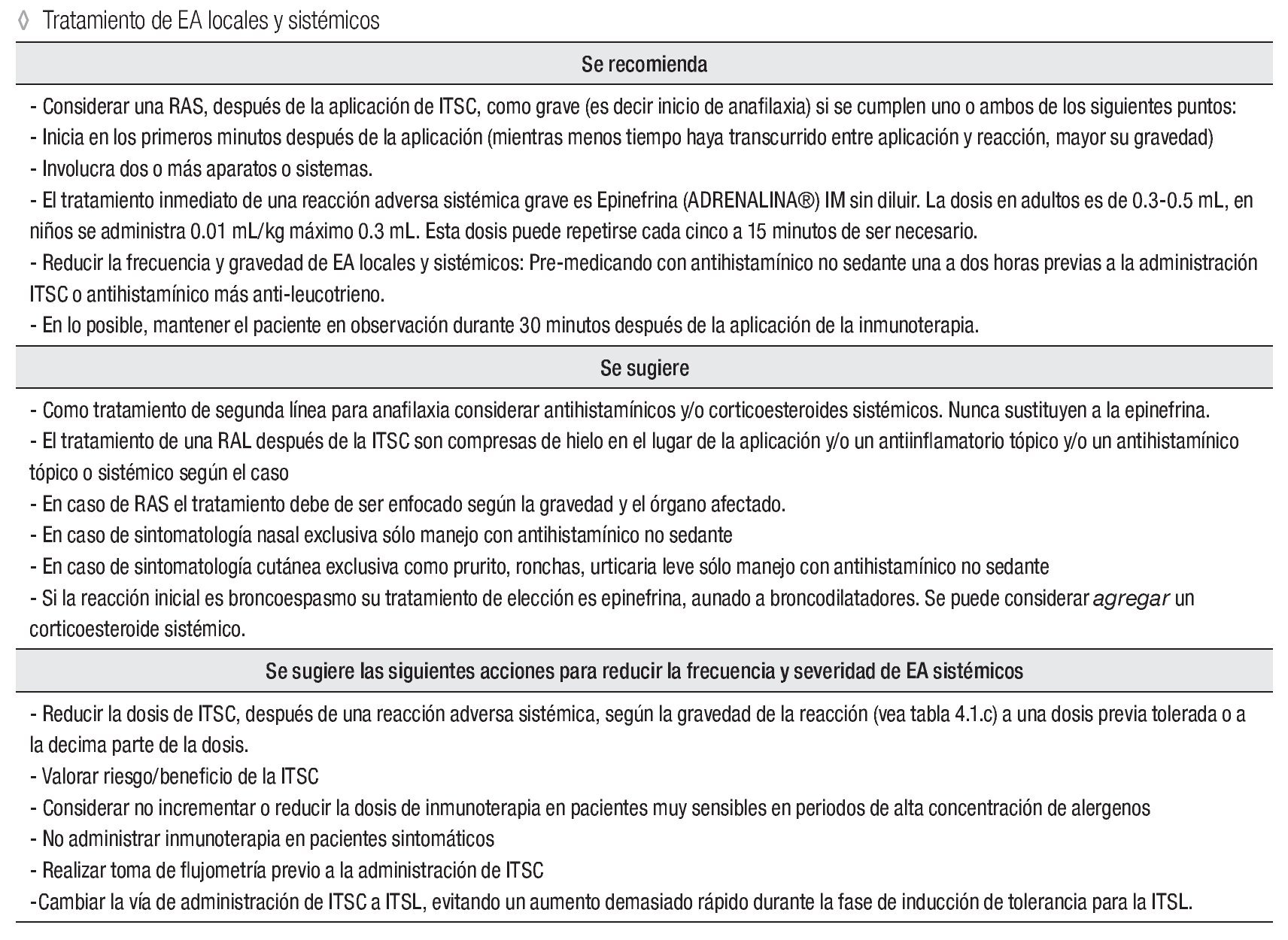
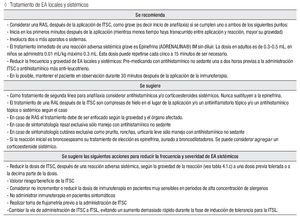
Tratamiento de EA locales y sistémicos
Se recomienda:
Considerar una RAS, después de la aplicación de ITSC, como grave (es decir inicio de anafilaxia) si se cumplen uno o ambos de los siguientes puntos:
Inicia en los primeros minutos después de la aplicación (mientras menos tiempo haya transcurrido entre aplicación y reacción, mayor su gravedad)
Involucra dos o más aparatos o sistemas.
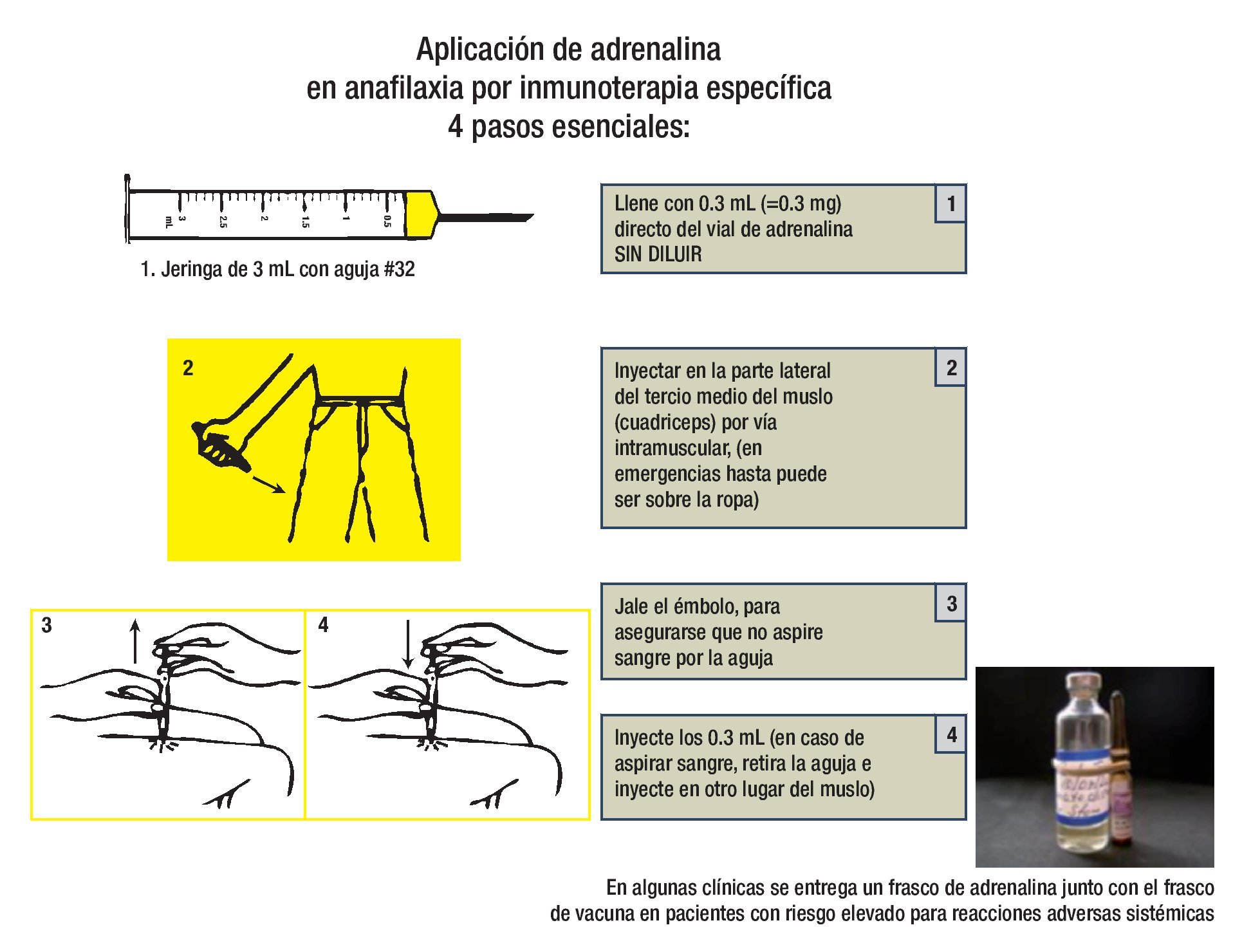
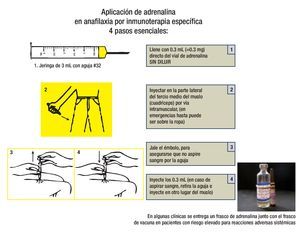
El tratamiento inmediato de una reacción adversa sistémica grave es epinefrina (ADRENALINA®) IM sin diluir. La dosis en adultos es de 0.3 mL a 0.5 mL, en niños se administra 0.01 mL/kg máximo 0.3 mL. Esta dosis puede repetirse cada cinco a 15 minutos, de ser necesario.
Reducir la frecuencia y gravedad de EA locales y sistémicos: Pre-medicando con antihistamínico no sedante una a dos horas previas a la administración ITSC o antihistamínico más anti-leucotrieno.
En lo posible, mantener el paciente en observación durante 30 minutos después de la aplicación de la inmunoterapia.
Se sugiere:
Como tratamiento de segunda línea para anafilaxia considerar antihistamínicos y/o corticoesteroides sistémicos.
Nunca sustituyen a la epinefrina.
El tratamiento de una RAL después de la ITSC son compresas de hielo en el lugar de la aplicación y/o un antiinflamatorio tópico y/o un antihistamínico tópico o sistémico, según el caso.
En caso de RAS el tratamiento debe de ser enfocado según la gravedad y el órgano afectado.
En caso de sintomatología nasal exclusiva sólo manejo con antihistamínico no sedante.
En caso de sintomatología cutánea exclusiva como prurito, ronchas, urticaria leve sólo manejo con antihistamínico no sedante.
Si la reacción inicial es broncoespasmo su tratamiento de elección es epinefrina, aunado a broncodilatadores. Se puede considerar agregar un corticoesteroide sistémico.
Se sugiere las siguientes acciones para reducir la frecuencia y severidad de EA sistémicos:
Reducir la dosis de ITSC, después de una reacción adversa sistémica, según la gravedad de la reacción (vea tabla 4.1.c) a una dosis previa tolerada o a la decima parte de la dosis. Valorar riesgo/beneficio de la ITSC.
Considerar no incrementar o reducir la dosis de inmunoterapia en pacientes muy sensibles en periodos de alta concentración de alergenos.
No administrar inmunoterapia en pacientes sintomáticos.
Realizar toma de flujometría previo a la administración de ITSC.
Cambiar la vía de administración de ITSC a ITSL, evitando un aumento demasiado rápido durante la fase de inducción de tolerancia para la ITSL.
Preguntas
1. ¿Cuáles son los métodos para identificar una respuesta de hipersensibilidad mediada por IgE?
2. ¿Cuántos y cuáles son los alergenos que deben aplicarse en las pruebas cutáneas en México?
3. ¿Cuáles medicamentos, y cuánto tiempo deben suspenderse antes de aplicar las pruebas cutáneas?
4. ¿Cómo debe prepararse a un paciente para aplicarle pruebas cutáneas?
5. ¿Cómo deben registrarse los resultados de las pruebas cutáneas?
6. ¿Cómo se interpretan los resultados de las pruebas cutáneas?
7. ¿Cuál es la eficacia de la ITSC?
8. ¿Cuáles son las indicaciones de la ITSC?
9. ¿Cuáles son las características de los pacientes alérgicos, en los cuales la ITSC estará indicada?
10. ¿Cuáles son las contraindicaciones de la ITSC y sugerencias para aumentar su seguridad?
11. ¿A partir de qué edad se podría usar la ITSC?
12. ¿Hasta qué edad es recomendable aplicar ITSC?
13. ¿Cuáles medidas deben tomarse antes de inyectar la ITSC al paciente?
14. ¿Cuáles son las dosis de mantenimiento de ITSC de acuerdo a la presentación de los extractos alergénicos?
15. ¿Cuántos alergenos deben incluirse en un frasco de vacuna?
16. ¿Cuál es el volumen total de un frasco de vacuna?
17. ¿Cuáles diluyentes se usan para preparar un frasco de vacuna?
18. ¿Cuánto dura la fase de inducción de tolerancia de ITSC?
19. ¿Cuál es el esquema de dosis de la fase de inducción?
20. ¿Cuál es la frecuencia de las dosis de mantenimiento?
21. ¿Cuánto tiempo dura la fase de mantenimiento?
22. ¿Es recomendable el uso de vacuna bacteriana?
23. ¿Dónde debe aplicarse la vacuna de ITSC?
24. ¿A partir de qué edad se aplica la ITSL?
25. ¿Cuál será la dosis de mantenimiento probablemente eficaz en relación con la dosis de la ITSC?
26. ¿Con qué frecuencia se aplica la ITSL?
27. ¿Cuál es la duración mínima recomendable para ITSL?
28. ¿Cuál es el tratamiento de primera línea para una reacción adversa sistémica de la ITE?
29. ¿Cuál es el tratamiento para una reacción adversa local de la ITE?
30. ¿Cuáles son las características de los tres fármacos más usados para el tratamiento de reacciones adversas a la ITE?
31. ¿Cuál es el tratamiento de primera línea para una reacción adversa sistémica de la ITE?
32. ¿Cuál es el tratamiento para una reacción adversa local de la ITE?
33. ¿Cuáles son las características de los tres fármacos más usados para el tratamiento de reacciones adversas a la ITE?
1. Introducción
En México, la prevalencia de rinitis y asma alérgicas ha aumentado considerablemente en las últimas décadas, hasta llegar en algunos estados de la República Mexicana a niveles cercanos al diez por ciento para asma y arriba del quince por ciento para rinitis alérgica.1,2 Esta tendencia se ha podido documentar a nivel mundial,3,4 posicionando a las patologías alérgicas entre las primeras causas de morbilidad con un gran impacto en la salud pública.5,6 Hasta la actualidad el único tratamiento causal de rinitis y asma alérgicas es la inmunoterapia específica con alergenos (ITE), tal como es reconocido por la Organización Mundial de la Salud desde la década pasada.7
1.1 Justificación
Últimamente se aumentado la necesidad de diseñar una guía nacional para la práctica clínica de ITE, debido a que la práctica de ITE en México varía en relación a otros países. Como consecuencia, los lineamientos estadounidenses y europeos para la práctica de inmunoterapia -de aquí en adelante indicadas como 'las guías internacionales'- aplican sólo parcialmente en México. Además los extractos alergénicos que se ocupan para las pruebas cutáneas y la ITE en México son diferentes a los usados en otras regiones.
1.2 Objetivo
Establecer recomendaciones y sugerencias para los aspectos básicos de la práctica clínica de las pruebas cutáneas con alergenos y de la ITE. Las recomendaciones y sugerencias tienen su fundamento en Medicina Basada en Evidencia y la opinión de alergólogos y expertos en el área, según el sistema GRADE (por sus siglas en Inglés Grading of Recommendations Assessment, Development and Evaluation). La implementación de esta guía contribuirá a disminuir la variabilidad de la práctica clínica en la aplicación de las pruebas cutáneas y la inmunoterapia con alergenos; estandarizar los procedimientos de pruebas cutáneas e inmunoterapia con alergenos; mejorar la atención de pacientes a quienes se aplican pruebas cutáneas e inmunoterapia; mejorar la eficiencia y efectividad de la atención médica que puede resultar en indicadores de resultado como son la disminución de la mortalidad y morbilidad de patologías alérgicas y en indicadores de proceso como son la disminución de ingresos hospitalarios y atención en urgencias por asma y mejoría en la calidad de vida del paciente alérgico.
1.3 Definición
La inmunoterapia específica con alergenos (ITE) está indicada en pacientes con alergia como causa de sus síntomas. Es el único tratamiento dirigido a la causa de las alergias, que consisten en una respuesta alterada del sistema inmune. La ITE, manejada de manera óptima, tiene la potencial de re-orientar a la respuesta inmunológica alérgica hacia una respuesta de protección, cambiando la producción de IgE específica por una síntesis de IgG4 específica. Además tiene un efecto inmunorregulador y en pacientes con rinitis alérgica puede reducir la probabilidad de una evolución hacia asma. El médico especialista seleccionará cuáles alergenos incluirá en la inmunoterapia. Para esto necesita identificar los alergenos causantes, basándose en la historia clínica de cada paciente y la presencia de inmunoglobulina E (IgE) específica. La técnica por excelencia para detección de IgE específica son las pruebas cutáneas con alergenos. Por tal motivo ambos temas, pruebas cutáneas e inmunoterapia específicas con alergenos son el objeto de esta Guía.
1.4 Metodología
Las primeras guías de atención clínica se basaban primordialmente en la opinión de un grupo de expertos. Así se estableció el primer Consenso de Inmunoterapia en México en 1998 por Pedroza y colaboradores.8 A partir de los años noventa las recomendaciones establecidas en las guías internacionales son basadas en evidencia, usando un sistema de letras A-D descrito por Shekelle y colaboradores,9 para indicar mayor (A) a menor (D) calidad de la evidencia clínica. En este método la calidad de la evidencia científica (EBM: medicina basada en evidencia) determina directamente la fuerza de la recomendación. Este método fue usado para establecer guías clínicas durante más de una década y aún sigue aplicándose hasta la fecha, no obstante sus restricciones. La tercera revisión de los Parámetros Prácticos de Inmunoterapia del Colegio y la Academia Americana de Alergia, Asma e Inmunología (ACAAI, AAAAI), fue basada en este método.10 Probablemente el mayor inconveniente de EBM es que al emitir una recomendación no se toman en cuenta factores relacionados con el paciente, como son conveniencia para el paciente, preferencias y creencias culturales ni otros factores en relación con el tratamiento como son seguridad, posibles efectos adversos y costo del manejo.
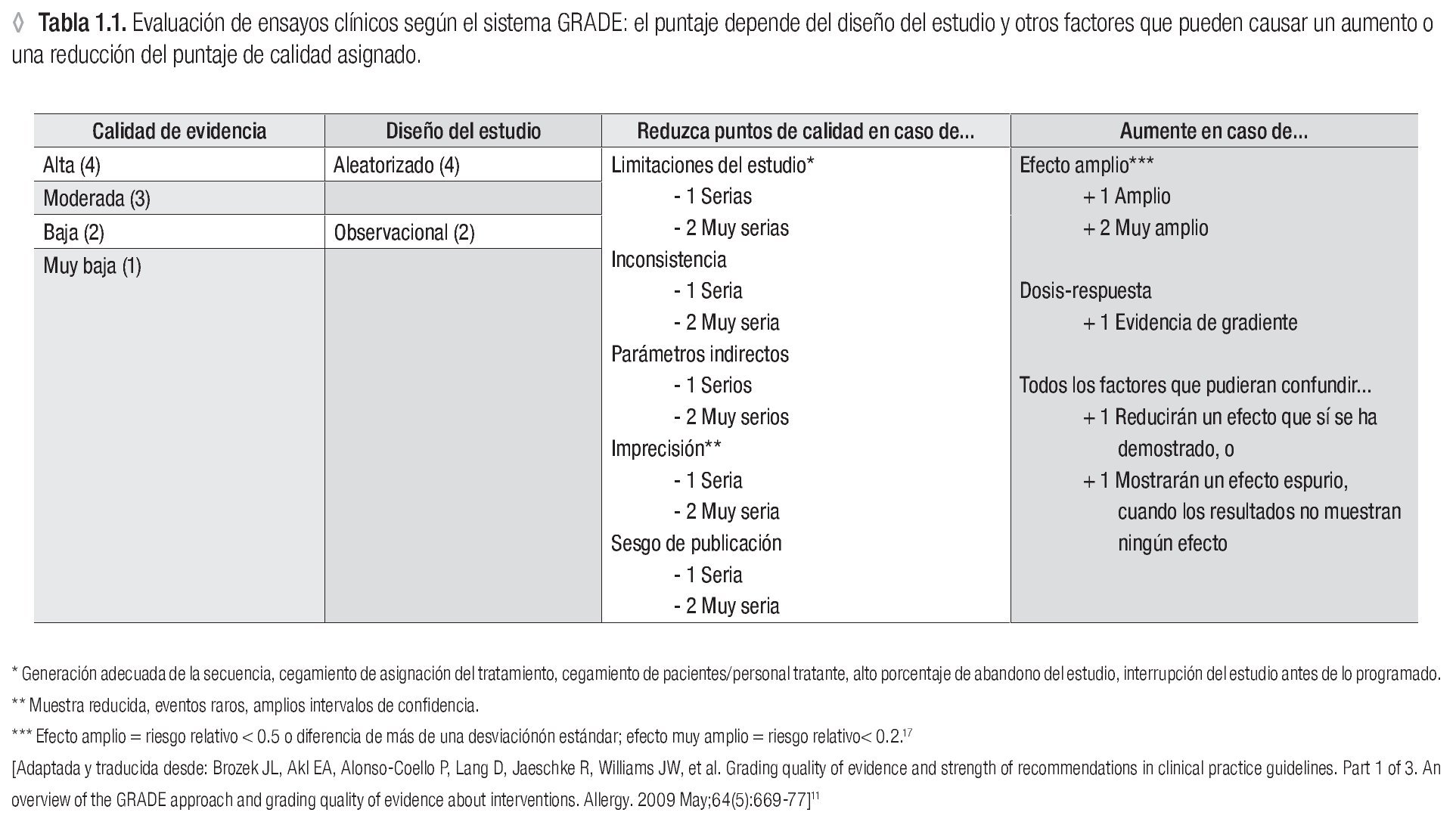
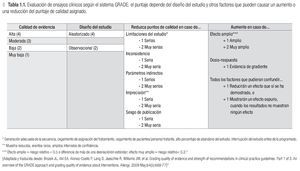
En 2004, un grupo de trabajo formuló la primera propuesta para evaluar el manejo de los pacientes según un nuevo sistema: GRADE. En el enfoque GRADE nuevamente se da cierto lugar a la opinión y el criterio del experto para la interpretación de los datos científicos en un marco más amplio cultural y económico.11 Primero se evalúa la calidad de la evidencia científica con un sistema transparente y bien estructurado que evolucionó a partir de los sistemas previos y aún guarda algunos de sus elementos (Tabla 1.1).12 En un segundo paso, se toman en cuenta otros factores para finalmente llegar a dar una recomendación (Figura 1.1). Desde 2004, el sistema GRADE ha evolucionado hacia el más utilizado a nivel mundial para la formulación de recomendaciones de manejo de pacientes.13 También en la recientemente publicada actualización de las guías internacionales para el tratamiento de la rinitis alérgica, Allergic Rhinitis and its Impact on Asthma 2010,14 se aplicó el sistema GRADE.15 A nivel nacional la guía del tratamiento del asma del Instituto Mexicano del Seguro Social ya en 2009 aplicó el sistema GRADE para llegar a sus recomendaciones del manejo del paciente asmático en el IMSS.16
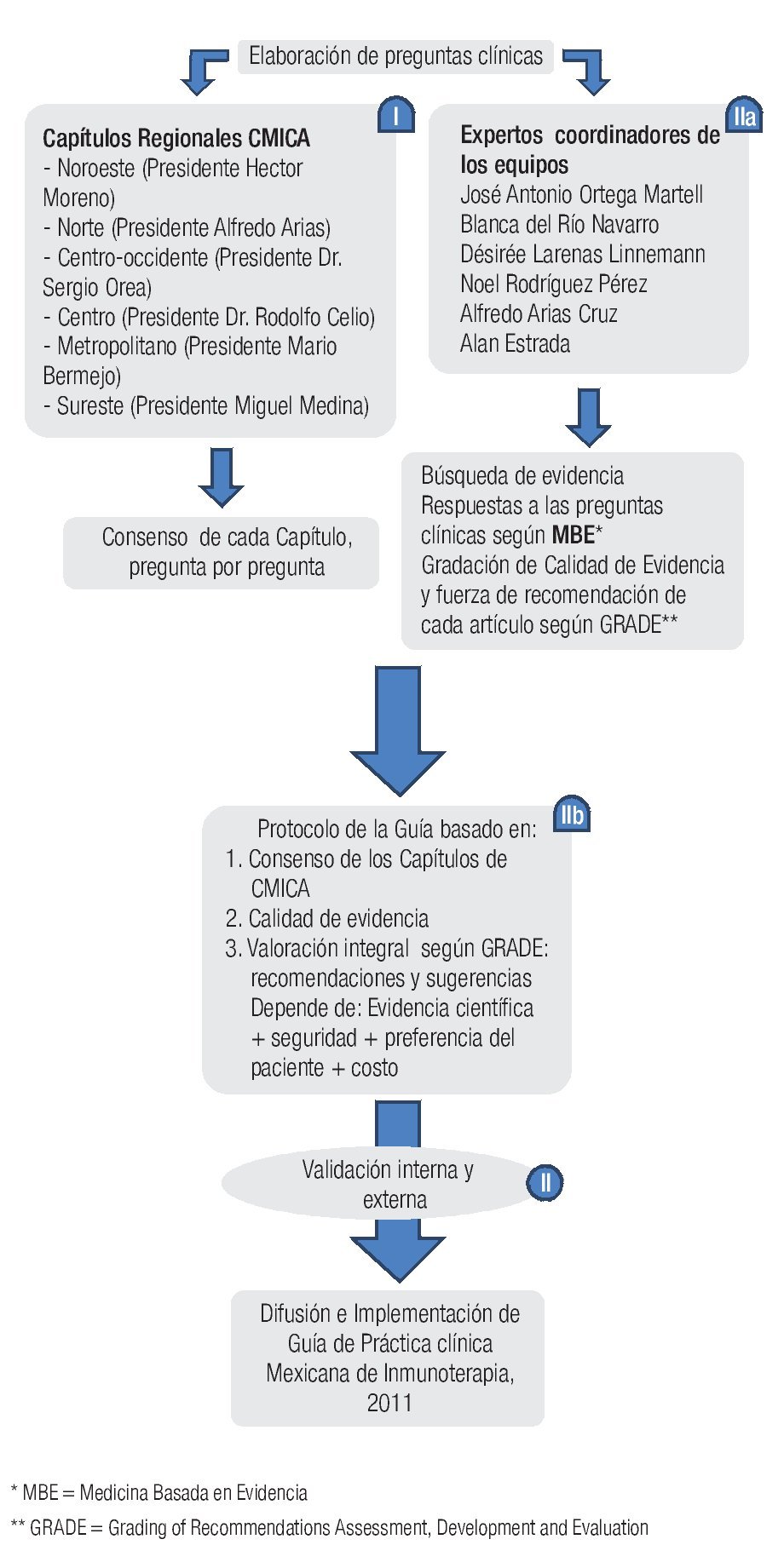
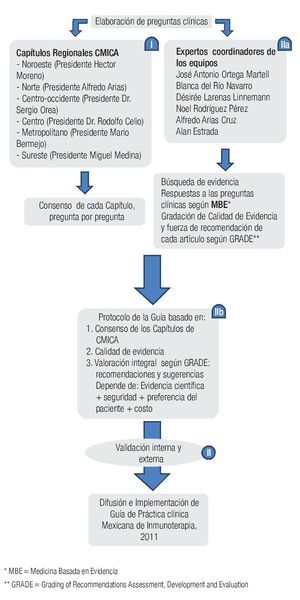
◊ Figura 1.1. Flujograma del desarrollo de la Guía Mexicana de Práctica Clínica de Inmunoterapia (GPCMIT).
La presente guía es el resultado de un esfuerzo entre alergólogos mexicanos a nivel nacional, que inició en septiembre de 2008 durante la Reunión Anual del Capítulo Noroeste del Colegio Mexicano de Inmunología Clínica y Alergia (CMICA) en Hermosillo, Sonora, con la finalidad de desarrollar una guía mexicana de practica clínica de inmunoterapía (GMPCIT).
El desarrollo de la aquí presentada GMPCIT se llevó a cabo en tres etapas (Figura1.1). En la primera etapa se averiguó la opinión de todos los alergólogos mexicanos acerca de ciertos aspectos primordiales en el área de pruebas cutáneas e inmunoterapia. Para este fin se formularon 33 preguntas clínicas, basándose en una encuesta nacional realizada unos dos años antes. Entre septiembre 2008 y febrero 2010 coordinadores de la Guía visitaron a los seis Capítulos de CMICA, para obtener la opinión de los alergólogos colegiados durante sus sesiones mensuales, que fue exclusivamente dedicada a la Guía. Previa a esta sesión el presidente de cada Capítulo envió una invitación a los miembros con las preguntas a discutir durante la reunión, para facilitar una adecuada preparación de los miembros. Se les pidió responder a las preguntas basándose en lo publicado y además tomando en cuenta los limitantes y las situaciones peculiares de la práctica de alergia en nuestro medio. Durante la sesión el coordinador de la Guía planteó una por una las preguntas clínicas para obtener la opinión de los miembros del Capítulo, después de una discusión entre los miembros, sin la intervención del coordinador. Una vez obtenidas las respuestas de los seis capítulos, se reunierón todas las opiniones consensadas en un solo documento (Figura 1.1, parte I).
La segunda etapa del desarrollo de GMPCIT consistió en la parte de Medicina Basada en Evidencia. Las preguntas fueron divididas en seis secciones y cada sección fue coordinada por expertos, miembros colegiados de CMICA y COMPEDIA, que han mostrado especial interés en el área de inmunoterapia y han participado en estudios clínicos con pruebas cutáneas y/o inmunoterapia. Cada experto a su vez integró un equipo de colaboradores, quienes (Figura 1.1, parte IIa) realizaron una búsqueda de la literatura relacionada con las preguntas de su sección, usando como fuentes de la búsqueda PubMed, Medline, Embase y guías internacionales en el área de pruebas cutáneas e inmunoterapia. Las palabras clave usadas fueron 'Allergen immunotherapy', 'hyposensitization', 'desensitization' aunadas a las palabras específicas en cada sección. Se seleccionaron especialmente los artículos de revisión de Cochrane y ensayos clínicos controlados. De cerca de mil artículos encontrados en la búsqueda, un total de siete fuentes documentales, cinco guías internacionales y 116 artículos de estudios primarios formaron la base de esta Guía. Los equipos de trabajo asignaron la calidad de evidencia científica a cada ensayo clínico, según los criterios del sistema GRADE (Tabla 1.1).
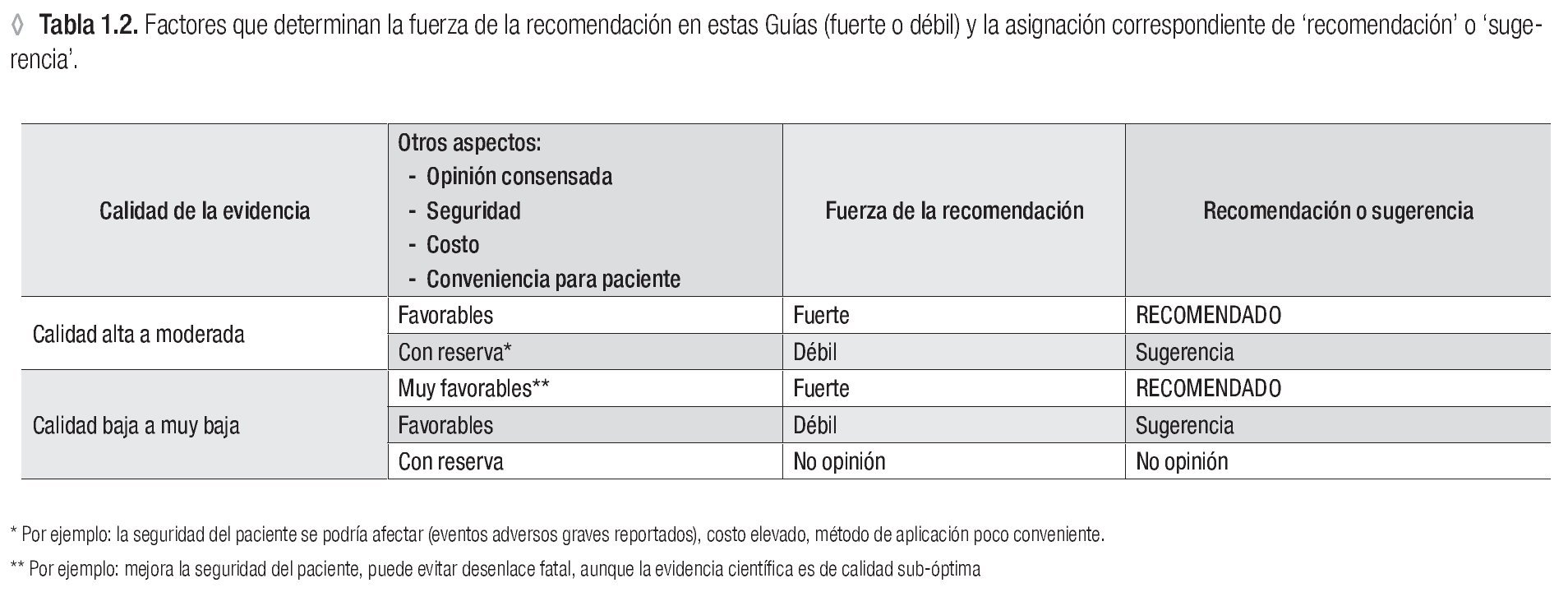
El siguiente paso fue ratificar la evidencia disponible que se pudiera encontrar para obtener la respuesta correcta a cada pregunta y el nivel de la calidad científica de esta evidencia. Finalmente cada uno de los seis grupos de trabajo entregó un capítulo para la Guía, conteniendo un breve resumen de la mejor evidencia que respondiera cada pregunta de su sección y ofreciera las recomendaciones y sugerencias correspondientes. Para recomendar o sugerir ciertas acciones los investigadores de GMPCIT se han basado en la evidencia científica, la opinión de consenso de los alergólogos mexicanos en la parte 1 y los otros parámetros del sistema GRADE (Figura 1.1, parte IIb y Tabla 1.2).
◊ Tabla 1.2. Factores que determinan la fuerza de la recomendación en estas Guías (fuerte o débil) y la asignación correspondiente de 'recomendación' o 'sugerencia'.
La tercera etapa fue el periodo de las revisiones. Después de integrar las seis secciones entregadas por los equipos expertos en el primer borrador, se convocó a una reunión de expertos en la cual se revisó y corrigió todo el documento, incluyendo las recomendaciones y sugerencias. En las siguientes semanas las correcciones sugeridas fueron realizadas por los equipos. El borrador final se envió a múltiples alergólogos prominentes del país para su revisión, y -en caso necesario- corrección.
No obstante las más de mil quinientas publicaciones registradas en PubMed en el área de inmunoterapia con alergenos y con ello la validación de su eficacia y seguridad -confirmada en varios meta-análisis Cochrane- que nos permite establecer recomendaciones y sugerencias, la inmunoterapia con alergenos sigue siendo una combinación de ciencia y arte. No es de sorprender que un tratamiento inmunomodulador, a base de sustancias biológicas, que será aplicado a pacientes pediátricos y adultos con diferente nivel de gravedad de alergia, patologías alérgicas variadas y con diferente complejidad será prescrito basándose en reglas básicas, pero adecuado de manera individual. El criterio del médico especialista en ajustar la inmunoterapia en cada paciente, dictará el éxito o fracaso de este procedimiento.
La GMPCIT, ha sido validada internamente por los Colegios Mexicanos CMICA y COMPEDIA y tiene la validación externa de miembros de la Academia Nacional de Medicina.
Dado que el campo de la inmunoterapia se encuentra en continuo desarrollo, la vigencia de esta guía será de tres años. Se da la bienvenida a comentarios y sugerencias para tomar en cuenta en la próxima edición de las Guía.
2. Pruebas cutáneas con extractos alergénicos
Coordina: José Antonio Ortega-Martell
Co-autores: Rosa Elena Huerta-Hernández, Enna Cossío-Ochoa
Preguntas :
1. ¿Cuáles son los métodos para identificar una respuesta de hipersensibilidad mediada por IgE?
2. ¿Cuántos y cuáles son los alergenos que deben aplicarse en las pruebas cutáneas en México?
3. ¿Cuáles medicamentos, y cuánto tiempo deben suspenderse antes de aplicar las pruebas cutáneas?
4. ¿Cómo debe prepararse a un paciente para aplicarle pruebas cutáneas?
5. ¿Cómo deben registrarse los resultados de las pruebas cutáneas?
6. ¿Cómo se interpretan los resultados de las pruebas cutáneas?
2.1 Métodos para la detección de IgE específica de alergenos
La ITE está indicada en pacientes con alergia como causa de sus síntomas y es el único tratamiento causal. La ITE genera una respuesta específica, mejorando los síntomas, causadas por los alergenos administrados en ella. El médico especialista seleccionará cuáles alergenos incluirá en la inmunoterapia. Para esto necesita identificar los alergenos causantes, basándose en la historia clínica de cada paciente y la presencia de inmunoglobulina E (IgE) específica, la cual puede ser mostrada por varias técnicas. A continuación se revisará la utilidad y el grado de recomendación de cada una de ellas.
a) La técnica recomendada para la detección de alergia es la prueba cutánea de punción (PCP). La prueba se realiza aplicando una pequeña cantidad de extracto alergénico glicerinado sobre la piel de los antebrazos o de la espalda del paciente. Mediante una pequeña punción con una aguja fina que atraviesa la gota hasta la parte superficial de la piel se logra la penetración de pequeñas cantidades de extracto alergénico justo debajo de la epidermis. Si existen células cebadas sensibilizadas con IgE específica en el tejido del paciente, la penetración del alergeno provocará la liberación de histamina, resultando en una respuesta de roncha y eritema. La lectura de los resultados de las PCP se hace quince o veinte minutos después, midiendo el promedio del tamaño de la roncha y del eritema. Es indispensable que el clínico encargado de realizar e interpretar las PCP, esté adecuadamente informado en relación a los factores que pueden alterar sus resultados; ver la sección 2.3. Las pruebas percutáneas de alergia son la técnica recomendada para demostrar una sensibilización alérgica, debido a un adecuado perfil de reproducibilidad, tiempo de realización, comodidad del paciente, seguridad y correlación con retos nasales y bronquiales18,19 (calidad de evidencia alta).
b) En un paciente con una fuerte sospecha clínica de enfermedad mediada por IgE y PCP negativas, se pueden aplicar en forma complementaria las PCID (calidad de evidencia muy baja).
Cuando se comparó la capacidad de predecir una respuesta positiva a una prueba de provocación nasal con polen de Phleum pratense-entre PCP (por método de punción múltiple) y las pruebas intradérmicas, la sensibilidad y especificidad de PCP fue de 87% y 86%, respectivamente (calidad de evidencia muy baja), mientras que la sensibilidad de las PCID fue de 93%; lo que aumentó en 6% la capacidad para predecir una prueba de provocación nasal positiva en el caso de PCID20. Sin embargo, no se describió si hubo diferencia significativa entre ambas técnicas. En otro estudio, Gungor y colaboradores, encontraron que las PCP tuvieron mayor sensibilidad que las PCID (85.3% vs. 79.4%) y especificidad (78.6% vs. 67.9%) para predecir una prueba de provocación nasal positiva para polen de Ambrosia21 (calidad de evidencia muy baja) (NS). Del Río y colaboradores, encontraron en un estudio comparativo de PCP vs. PCID para demostrar sensibilización alérgica a Dermatophagoides pt. en población pediátrica mexicana de seis a 15 años de edad con rinitis y/o asma, que la sensibilidad de PCID fue mayor que PCP (100% vs. 92.5%, respectivamente) (calidad de evidencia muy baja),22 con diferencia significativa entre ambas técnicas sólo para los ácaros del polvo doméstico y no para pólenes.
Para el diagnóstico de hipersensibilidad al veneno de himenópteros, la PCID y está indicada en caso de una PCP negativa.23,24 El uso de extractos dializados, disponibles en los Estados Unidos puede aumentar la sensibilidad de la prueba.23 Al probar los venenos de varios insectos, se tiene que tomar en cuenta la reactividad cruzada que existe por la presencia de IgE específica contra ciertos epítopos de carbohidrados.24
Así se puede concluir que la PCID es un recurso diagnóstico para la detección de hipersensibilidad al veneno de himenópteros. Sin embargo, para aero-alergenos únicamente en caso de que existiera una fuerte sospecha de alergia por historia clínica y una PCP con aeroalergenos negativa, una PCID podría aumentar la sensibilidad diagnóstica para este alergeno.
c) Considerar la medición de IgE sérica específica para alergenos (pruebas in vitro), como una metodología alternativa cuando no se pueda realizar un PCP, debido a que sus valores de especificidad son relativamente bajos. Por lo que se sugiere que los resultados de la medición de IgE sérica específica sean cuidadosamente valorados en función de los síntomas del paciente (2, nivel de evidencia bajo).
Se han desarrollado diversas técnicas in vitro para la medición de IgE específica: prueba radio-alergo-inmuno-adsorbente (RAST, radio allergo sorbent test), el ensayo por quimioluminiscencia (CLA, chemiluminescent assay) y el ensayo con polímero acarreador hidrofílico (CAP, capsulated hydrophilic carrier polymer). Al comparar la capacidad predictiva de CLA y CAP contra PCP en asma y/o rinoconjuntivitis alérgica (2, calidad de evidencia baja) diagnosticadas por historia clínica en adultos, la sensibilidad encontrada estuvo entre 67% y 100%, según el alergeno valorado; en tanto que la especificidad varió entre 36% y 81%, con una concordancia general entre PCP y CLA de 76% y entre PCP y CAP, de 67%; la concordancia entre ambas pruebas in vitro fue de 79%.25 En otro estudio comparativo de PCP vs. IgE específica por Immuno-CAP con 53 aero-alergenos en 250 adultos con rinitis crónica, la concordancia general fue de 80.6% entre ambas pruebas, lo cual se considera satisfactorio (1, calidad de evidencia muy baja); sin embargo, no se calculó la correlación entre dichas pruebas.26
En una comparación de precisión y exactitud analítica de RAST modificado, sistema CAP y método Alastat, para cuantificar IgE específica, efectuada en seis laboratorios diferentes, se encontró que sólo la técnica CAP usada en dos laboratorios diferentes se acercó a los parámetros ideales esperados -coeficiente estandarizado de asa y coeficiente de variabilidad- (calidad de evidencia alta) y otro estudio concluyó que ambas técnicas, ImmunoCAP e Immulite, tienen validez interna, pero que los resultados de ambos ensayos no son intercambiables.27
Lo antes descrito, aunado al deficiente control de calidad en nuestro medio, explican la amplia variabilidad reportada entre las técnicas de medición de IgE específica. Los procedimientos ImmunoCAP e Immulite parecen tener la mejor calidad, pero por la diferencia en técnica sus resultados no son intercambiables. Por ende los resultados de la IgE específica de las pruebas in vitro deben ser evaluados cuidadosamente y siempre en relación con las condiciones clínicas de los pacientes.
d) Se carece de estudios clínicos que midan la respuesta a los retos nasales o bronquiales específicos como parámetro de eficacia primaria de la inmunoterapia subcutánea con alergenos. Las pruebas o retos de provocación específicas de órgano (nasal, bronquial, conjuntival o cutáneo) con alergenos se han utilizado cuando existe una discrepancia entre la historia clínica del paciente y las pruebas primarias de confirmación diagnóstica de alergia (PCP, PCID o medición in vitro de IgE), para documentar un cambio en la fisiología del órgano expuesto al alergeno sospechoso.(opinión de expertos). Sin embargo, se ha demostrado la utilidad de los retos de provocación nasal alergeno-específicos para identificar sensibilización local en pacientes con sospecha clínica de alergia pero con PCP e PCID negativas. Debido a la diversidad en la metodología implementada en los estudios, no se pueden realizar recomendaciones concluyentes al respecto.28
2.2 Alergenos a incluir en las pruebas cutáneas
De acuerdo con los resultados de la encuesta nacional sobre pruebas cutáneas e inmunoterapia,29,30 (calidad de evidencia baja, según GRADE), los cinco alergenos a los que más frecuentemente positivos en la mayoría de los Servicios de Alergia encuestados en la república mexicana son: Dermatophagoides pteronyssinus (68%), Dermatophagoides farinae (66%), Fraxinus americana (70%), Cynodon dactylon (80%), Cucaracha (53% mezcla de Blatella germánica y Periplaneta americana) y Gato (70% Felis domes-ticus). Sin embargo, en los estados del Norte de nuestro país, el mezquite (Prosopis sp) y el álamo (Populus sp) fueron los pólenes con mayor alergenicidad. En las guías de ACAAI y AAAAI31 se sugiere que se seleccionen los alergenos relevantes en cada región de acuerdo a la presencia de ese alergeno en el medio ambiente, la positividad en las pruebas cutáneas y su correlación clínica.10 Un estudio paneuropeo de pruebas cutáneas, apoyado por GA2LEN, (calidad de evidencia alta, según GRADE), demostró que no es necesario incluir un número muy grande de alergenos en las pruebas cutáneas.32 Con un panel de siete alergenos se encontró una prueba cutánea positiva en 35% de los individuos. Agregando más alergenos este porcentaje sólo se aumentó hasta 37%.33
2.3 Suspensión de medicamentos antes de realizar las pruebas cutáneas
De acuerdo con las recomendaciones de las guías conjuntas de AAAAI y ACAAI, y otros autores,34,35 sobre el efecto supresor de pápula y eritema por antihistamínicos, se recomienda suspender clorfenamina, difenhidramina e hidroxizina, por lo menos siete días antes de realizar las pruebas cutáneas, para evitar interferencia con los resultados (nivel de evidencia III calidad de evidencia muy baja, según GRADE).31,34,35 La misma recomendación es para los antihistamínicos de segunda generación cetirizina, fexofenadina y loratadina, (nivel de evidencia Ib, calidad de evidencia moderada según GRADE).36
Para los antidepresivos con efecto antihistamínico, como la doxepina y otros antidepresivos tricíclicos, la recomendación es suspenderlos 6 días antes.37 (calidad de evidencia moderada, según GRADE). Respecto a los antihistamínicos antiH2 como la ranitidina, se recomienda suspenderlos un día antes, ya que el efecto supresor es menos intenso.38 (calidad de evidencia moderada, según GRADE) Los antagonistas de leucotrienos como el montelukast y el zafirlukast, pueden continuar usándose, ya que no se ha encontrado que supriman la respuesta inmediata durante las pruebas cutáneas. (calidad de evidencia alta39 y moderada,40 según GRADE)
En relación al uso de esteroides, debe tomarse en cuenta el tiempo de uso, el tipo de esteroide usado y la vía de administración, ya que de acuerdo al estudio de Des Roches et al,41 (calidad de evidencia moderada según GRADE), el uso de un ciclo corto de prednisona 30 mg por vía oral cada 24 horas durante una semana no afecta el resultado de las pruebas cutáneas; sin embargo el uso de esteroides por vía tópica cutánea sí puede suprimir hasta por tres semanas la reactividad de la piel en las pruebas42 (calidad de evidencia moderada, según GRADE). Finalmente en el caso de anestésicos locales la combinación de lidocaína y prilocaína (Emla®), no afectó la formación de la pápula, aunque sí se retrasó o inclusive inhibió la aparición del eritema.43 (calidad de evidencia moderada, según GRADE)
El antihistamínico doxepina, aplicado en forma tópica en la piel suprime la respuesta a histamina en las pruebas cutáneas durante menos de cinco horas44 (calidad de evidencia baja, según GRADE), pero gotas oftálmicas de olopatadina 0.2% durante siete a 10 días, no suprimieron las PCP,45 (calidad de evidencia moderada, según GRADE).
2.4 Preparación antes de las pruebas cutáneas
De acuerdo con las guías estadounidenses y otros estudios (calidad de evidencia moderada), es obligatorio estabilizar sintomáticamente al paciente antes de aplicar las pruebas cutáneas, ya que la mayoría de los casos reportados de anafilaxia o descompensación grave ocurren en pacientes que no se encuentran estables en su enfermedad alérgica, especialmente asma31,46,47Aunque la evidencia no es de certeza, es recomendable practicar una flujometría en los asmáticos y la medición de la presión arterial en todos los pacientes que se pueda, para saber si el paciente se encuentra realmente estable. Además, tener un valor basal de presión arterial antes de las pruebas cutáneas puede ayudar a compararla con una cifra más baja en caso de presentar una reacción anafiláctica durante el procedimiento.
2.5 Cómo registrar el resultado de las pruebas cutáneas
El reporte y la evaluación de las PCP a través de cruces (+, ++, +++, ++++) ha sido abandonado por la gran variabilidad que se ha encontrado entre diferentes revisores de la misma prueba,48 (calidad de evidencia baja). La recomendación es medir en milímetros (mm) el diámetro mayor de la pápula y del eritema, o el diámetro promedio obtenido con la fórmula D + d /2 (diámetro mayor + diámetro perpendicular a éste entre 2).49
2.6 Cómo interpretar el resultado de una prueba cutánea por punción
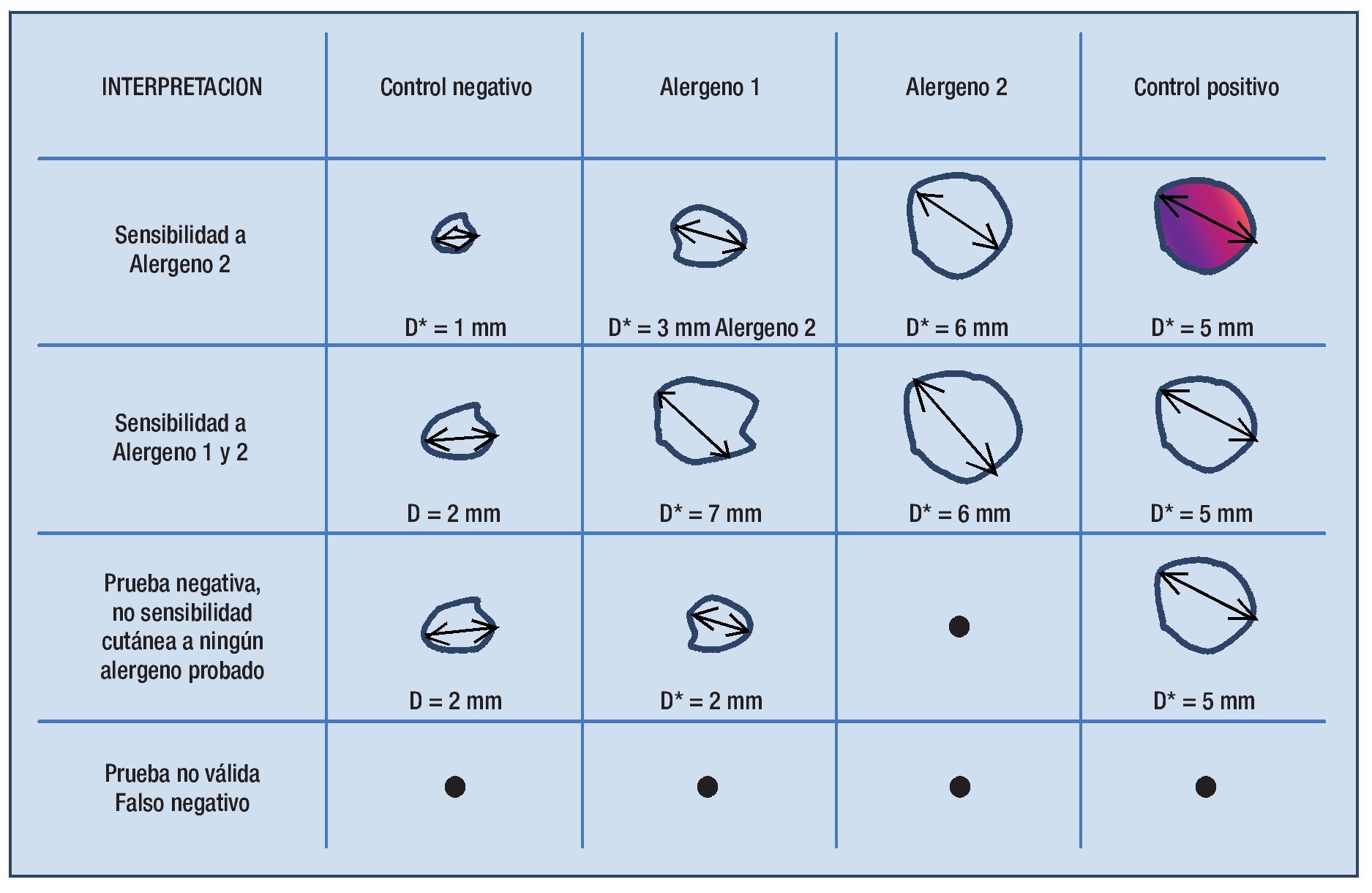
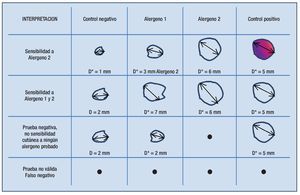
En las pruebas cutáneas el resultado del control negativo muestra el tamaño de pápula generado por la punción de una solución con el diluyente (en pruebas cutáneas generalmente es glicerina al 50%). Para considerar un resultado como positivo la pápula resultante de la punción del extracto alergénico debe ser por lo menos 3 mm superior al diámetro mayor (D) de la pápula del control negativo (Figura 2.1).
◊ Figura 2.1. Interpretación del resultado de la prueba cutánea en diferentes escenarios. Sólo si el alergeno genera una pápula con diámetro mayor 3 mm superior al control negativo se considera el resultado positivo y se puede concluir que el paciente tiene sensibilidad cutánea a este alergeno.
Los dispositivos que produzcan una pápula de 3 mm o más en el control negativo, deben evitarse, o interpretarse con cautela para evitar falsos positivos.50 Debido a que los estudios, que demuestran la eficacia de ITSC o ITSL, aplicaron como criterio de inclusión un diámetro de pápula ≥ 3 mm superior al control negativo, se recomienda usar este valor para considerar el resultado de una prueba positiva.31, 51-54 Sin embargo cuando se utilizan extractos muy potentes, como son los pólenes de proveedores estadounidenses de 100 000 BAU/mL, 5 mm podría ser un valor más adecuado. En algunos estudios se ha demostrado que un diámetro mayor (D) superior de 5 mm a 6 mm correlaciona mejor con alergia clínica.55,56
El control positivo con histamina sirve para evitar pruebas falsas negativas y es de utilidad en caso que no se produzcan pápulas por cualquiera de los extractos alergénicos. Una prueba cutánea se considerará negativa cuando no se produzcan pápulas con un diámetro mayor de ≥ 3 mm superior al control negativo con alguno de los extractos alergénicos, pero sí con el control positivo. Sin embargo, una prueba no será válida cuando ni los extractos ni el control positivo generaron una pápula. La causa más frecuente de una prueba falsamente negativa es la ingesta de algún medicamento que inhibe la liberación de histamina.
2.7 Conclusiones
Las pruebas cutáneas son una herramienta útil para demostrar la presencia de anticuerpos IgE alergeno-específicos en la superficie de las células cebadas cutáneas de un paciente alérgico. De las pruebas al alcance del médico para la práctica diaria, las pruebas cutáneas se consideran el estándar de oro. El médico especialista en Alergia debe conocer muy bien los alergenos de mayor prevalencia en México e incluir los de su área geográfica en las pruebas cutáneas que aplique. Además, decidirá el momento adecuado para realizarlas, suspendiendo los medicamentos que puedan causar resultados falsos negativos, tener la dermatitis atópica bajo control y evaluar si el paciente se encuentra en condiciones estables para no aumentar el riesgo de descompensación durante el procedimiento. Finalmente debe hacer un análisis interpretativo del resultado de cada prueba en base a la historia clínica del paciente y los resultados de los controles positivo y negativo.
3. Indicaciones para la inmunoterapia específica con alergenos por vía subcutánea (ITSC)
Coordina: Blanca del Río-Navarro.
Co-autores: Dino R. Pietropalo-C, Emilia María Hidalgo-Castro, Hector Stone-Aguilar
Preguntas:
1. ¿Cuál es la eficacia de la ITSC?
2. ¿Cuáles son las indicaciones de la ITSC?
3. ¿Cuáles son las características de los pacientes alérgicos, en que la ITSC estará indicada?
4. ¿Cuáles son las contraindicaciones de la ITSC y sugerencias para aumentar su seguridad?
5. ¿A partir de qué edad se podría usar la ITSC?
6. ¿Hasta que edad es recomendable aplicar ITSC?
3.1 Eficacia de la Inmunoterapia con alergenos
Desde la descripción original de Noon y Freeman57 en Europa en 1911 sobre una nueva forma de terapia con alergenos inyectados en pacientes con rinitis alérgica estacional (RAE) inducida por pólenes de pastos, hasta el presente la ITE, ha permanecido como la única terapia etiológica para las enfermedades alérgicas utilizada en todo el mundo, debido a la evidencia de su eficacia clínica acumulada hasta el momento.
Un aspecto que ha dificultado la evaluación de la eficacia clínica de la ITE es la alta heterogeneidad de los ensayos clínicos realizados para tal fin, haciendo difícil la extrapolación de los resultados en todas las situaciones clínicas.
Se han publicado varias guías sobre el uso de ITE en enfermedades alérgicas respiratorias por grupos de expertos de diferentes organizaciones internacionales.7, 32, 58-62 Estas guías se basan en revisiones de la bibliografía publicada sobre el uso de ITE en rinitis alérgica y asma alérgica y se enfocan principalmente en su eficacia y seguridad.
También se han publicado al menos 2 meta-análisis respecto a ITSC: el primero por Abramson y colaboradores63 en 2003, cuya actualización se publicó en 2010 y que confirma su eficacia en asma alérgica.64 El segundo meta-análisis de Calderón y colaboradores,65 en 2007, documentó su eficacia en RAE. Este meta-análisis fue actualizado en 2011 de forma más completa, pero sin cambiar sus conclusiones finales. Ambos meta-análisis utilizaron la metodología Cochrane.
Sin embargo, dos revisiones recientes hacen notar la falta de uniformidad y sobre todo el bajo número de pacientes incluidos en la mayoría de las series que fueron analizadas en estos meta-análisis.66,67 Por esta razón los resultados de estas publicaciones iniciales deben tomarse con precaución.
El documento publicado por la iniciativa ARIA (Allergic Rhinitis and its impact on Asthma) en 2008,68 en colaboración con la Organización Mundial de la Salud (OMS), le ha dado a la ITE el nivel I-A, el nivel más alto de evidencia de acuerdo al sistema de graduación de evidencia de Shekelle y colaboradores.9
Uno de los parámetros que más influyen en la eficacia de la ITSC en la práctica clínica es la dosis de los alergenos utilizados. La inmunoterapia con dosis bajas de alergenos ha demostrado ser inefectiva (calidad de evidencia alta).69,70 Asimismo, dosis demasiado altas inducen frecuentemente reacciones adversas graves que imposibilitan su mantenimiento, siendo por tanto también inefectivas. Se ha podido establecer el rango de dosis óptima efectiva para la mayoría de los alergenos mayores responsables de las reacciones alérgicas respiratorias, basados en diversos estudios.51,71-73 (variando de calidad de evidencia muy baja a alta) Se ha demostrado eficacia clínica con dosis que varían entre cinco a 20 mcg del alergeno mayor, por inyección aplicada en intervalos de cuatro a seis semanas. Son pocos los estudios en que ha podido demostrarse claramente que el efecto clínico de la ITSC es totalmente dependiente de la dosis: El extracto estandarizado de polen de Phleum pratense, en preparación de depósito, aplicado en dosis de dos y 20 mcg de Phl-p-5 en 347 pacientes, mostró reducción de los síntomas de RAE y del uso de medicamentos, que fue significativamente mayor con la dosis de 20 mcg (calidad de evidencia alta).51 Con alergenos estandarizados de polen de Ambrosía artemisiifolia se obtuvo mejoría significativa con el uso de 7.2 mcg del alergeno mayor Amb-a-1 en pacientes adultos con rinoconjuntivitis y/o asma alérgicas72 (calidad de evidencia baja). Al aplicar inmunoterapia específica con tres dosis de alergeno de gato, conteniendo 0.6, tres y 15 mcg Fel-d-1 en pacientes con alergia a gato (rinitis con o sin asma), se demostró claramente que la mejor respuesta fue con la dosis de 15 mcg valorada mediante reto nasal, IgG4 alergeno-específica y pruebas cutáneas (calidad de evidencia moderada).73 Se ha cuestionado que en este estudio no se usó un parámetro clínico como el puntaje de síntomas a la exposición, pero previamente se había demostrado que la dosis de 15 mcg de Fel-d-1reducía de manera significativa el puntaje de síntomas con la exposición controlada del paciente en un cuarto de gatos (calidad de evidencia alta).74
Se ha demostrado eficacia clínica (reducción de escala de síntomas y reducción del uso de medicamentos) en general para la ITSC con extractos de pólenes de pastos, abedul, ambrosía y parietaria; ácaro del polvo casero; y epitelio de gato (calidad de evidencia de los estudios variando de baja a alta). Ver Anexo 1.
En los últimos años, los instrumentos de evaluación de calidad de vida, generales o específicos de enfermedades, han cobrado mayor importancia como medida final de eficacia para diversas intervenciones terapéuticas. Varios estudios han mostrado una mejoría significativa en los índices de calidad de vida con el uso de ITSC en enfermedades alérgicas respiratorias: En el estudio ya mencionado de Frew,51 se aplicó el Cuestionario de Calidad de Vida para Rinoconjuntivitis (RQoLQ) de Juniper, demostrando una reducción de hasta 29% y de 32% del promedio de síntomas y del uso de medicamento, respectivamente, en el grupo de mejor respuesta. En 154 pacientes con rinitis alérgica con o sin asma, tratados con un extracto estandarizado alergoide de seis tipos de pólenes de pasto, se demostró una disminución de síntomas y medicamentos de 26.6% (p < 0.026) y 48.4% (p < 0.018) y mejoría de la calidad de vida al final del primer y segundo año del tratamiento, respectivamente (calidad de evidencia baja).75
En cuanto a la duración de la inmunoterapia, se debe de mantener el tiempo suficiente para obtener eficacia clínica a largo plazo, aún después de haber interrumpido el tratamiento. Un estudio retrospectivo en pacientes con alergia a ácaros demostró un efecto benéfico persistente en 45% de los pacientes a pesar de la suspensión de la inmunoterapia, relacionado a la duración total de la inmunoterapia (p < 0.04, calidad de evidencia moderada).76 Durham confirmó el efecto sostenido a largo plazo de la ITSC en pacientes con alergia a pólenes de pasto (calidad de evidencia alta).77 El estudio PAT78 (Tratamiento Preventivo de la Alergia) en niños asmáticos que recibieron ITSC con pólenes de pastos o abedul por tres años, con seguimiento a los tres, cinco y diez años demostró una reducción significativa de síntomas oculares (p < 0.05) y nasales (p < 0.05) en el grupo de pacientes tratados vs. el grupo control hasta siete años después de la terminación de la ITSC (calidad de evidencia moderada).78
El mismo estudio PAT demostró el efecto preventivo de la inmunoterapia en el desarrollo de asma en niños con rinitis, alérgicos a pólenes (p < 0.0075) con un OR (Odds ratio) para no-asma de 4.6 con un intervalo de confidencialidad (CI 95% 1.5-13.7) a favor de la inmunoterapia específica.
Se han explorado nuevas formas de ITSC como alergenos obtenidos artificialmente con técnicas de ADN recombinante, llamados precisamente alergenos "recombinantes". La ITSC durante dieciocho meses con una mezcla de alergenos recombinantes de cinco pólenes de pasto, en pacientes con rinitis alérgica disminuyó de manera significativa los registros de síntomas (p < 0.015) y las respuestas in vitro (inducción de anticuerpos IgG1 e IgG4 específicas de alergenos). Sin embargo, un análisis final combinado del registro de síntomas y el uso de medicamentos, no alcanzó una diferencia estadística significativa, aunque hubo una diferencia evidente a favor de la inmunoterapia (p < 0.051).79 En otro estudio de ITSC durante dos años con 134 pacientes alérgicos al polen de abedul, que comparó el alergeno mayor recombinante del abedul, Bet-v-1a, con un extracto comercial regular y otro extracto natural purificado de abedul, encontró respuestas favorables y significativas para las tres formas de IT comparadas con placebo, pero el mayor efecto benéfico fue con el alergeno recombinante, al menos por las dos temporadas siguientes de polinización (calidad de evidencia alta).80
Otro tipo de ITSC que se ha ensayado en los últimos años, consiste en el uso de alergoides combinados con nuevos tipo de adyuvantes, como el monofosforil lípido A (MPL). Al menos dos estudios con tres años de seguimiento pos-comercialización, uno con productos comerciales de alergoides, en esquemas ultra-cortos pre-estacionales en adultos y otro en 434 niños, mostraron una reducción significativa en el uso de medicamentos de 83% vs. 24% (p < 0.0001) a favor del grupo con tratamiento, sin reacciones adversas significativas (calidad de evidencia baja).81,82
Un estudio reciente de ITSC con un alergeno derivado de Ambrosía combinado con una molécula con secuencias inmuno-estimulatorias de oligo-DNA (ODN) con efecto agonista del Receptor Tipo Toll 9 (TLR-9), en un grupo de 25 pacientes adultos con rinitis alérgica estacional por Ambrosía y seguimiento por dos años mostró buenos resultados en todos los desenlaces finales(calidad de evidencia alta).83 Otra forma de inmunoterapia subcutánea novedosa es el uso de alergenos combinados con un adyuvante formado por motivos CpG de oligo-DNA tipo A, que obtuvo resultados promisorios en un estudio abierto de Fase I/IIa en pacientes sensibles al ácaro.84 Son necesarios estudios de Fase III para conocer la eficacia real de esta nueva forma de ITSC.
Finalmente también se han reportado resultados prometedores con una nueva vía de aplicación que permite reducir la dosis del alergeno marcadamente: la inmunoterapia intra-linfática, que en este momento aún se encuentra en fase de desarrollo (calidad de evidencia alta).85
3.2 Indicaciones de la inmunoterapia
a) La inmunoterapia subcutánea está indicada en pacientes con rinitis/rino-conjuntivitis alérgica a gato donde ha demostrado disminución en los síntomas nasales e incremento en los niveles de IgG4 alergeno específicos (calidad de evidencia moderada).73,86 En pacientes con rinitis alérgica a pólenes de pastos la inmunoterapia subcutánea ha demostrado efectividad mejorando su calidad de vida (calidad evidencia moderada), al disminuir los síntomas nasales e incrementar los niveles de IgG4 alergeno específicos.60 En pacientes con rino-conjuntivitis alérgica a pólenes de árboles se ha demostrado efectividad de la ITE subcutánea en la reducción de síntomas nasales y el uso de antihistamínicos antiH187 (calidad de evidencia moderada). Cuando un paciente con rinitis alérgica, es alérgico a los ácaros de polvo casero y se confirma que estos son la causa de su alergia, la inmunoterapia pueda estar indicada, pero sólo podemos sugerirla, ya que la calidad de evidencia es baja y los estudios con ITSC rara vez estudian pacientes únicamente con rinitis alérgica.
b) La inmunoterapia subcutánea está indicada en pacientes de seis a 14 años con asma leve88 (calidad de evidencia alta) y en asmáticos de dos a seis años (calidad de evidencia baja). En este grupo de edad además se ha demostrado una disminución en el desarrollo de nuevas sensibilizaciones.89 También se ha utilizado con éxito en adultos con asma moderada, logrando una reducción en la dosis de corticoesteroides inhalados de 90% a los tres años, contra 42% con placebo (p = 0.04)90 (calidad de evidencia alta).
c) Veneno de himenópteros: La inmunoterapia específica es la medida terapéutica más eficaz para prevenir futuras reacciones sistémicas a la picadura de abejas y/o avispas, especialmente si dicha reacción fue asociada a síntomas cardiovasculares o respiratorios y se demostró la presencia de IgE específica (por medio de pruebas cutáneas o estudios in vitro) (calidad de evidencia baja, ver Anexo 1). En los Estados Unidos, también son candidatos a inmunoterapia los pacientes mayores de 16 años de edad con una reacción sistémica limitada a la piel.91 No obstante que la mayoría de los estudios de eficacia presentan diferencias significativas a favor de la inmunoterapia, medidos, en la frecuencia de de reacciones sistémicas recurrentes, y en la calidad de vida,92-98 éstos presentan entre sus limitaciones metodológicas, la escasa cantidad de pacientes, falta de cegamiento y aleatorización, y escasa definición de dosis de mantenimiento.
La dosis de mantenimiento sugerida es de 100 mcg de veneno (calidad de evidencia muy baja),99 con aplicaciones cada uno a tres meses, ya que la efectividad de dosis cada seis meses se ha visto disminuida100 (calidad de evidencia muy baja). En caso de recurrencia de reacciones sistémicas a la picadura de insectos en pacientes con inmunoterapia en fase de mantenimiento, podría considerase el incremento de la dosis para alcanzar protección (calidad de evidencia muy baja).101
Se ha observado que la inmunoterapia reduce las reacciones locales extensas a la picadura de insectos, particularmente en aquellos pacientes con riesgo alto (calidad de evidencia muy baja).102 En cuanto al tiempo total de tratamiento con inmunoterapia, no existe un acuerdo absoluto. Sin embargo, debido al riesgo alto de recurrencia, se considera que no se debe suspender la inmunoterapia en los siguientes casos91(recomendación de expertos mexicanos):
Pacientes con historia de reacción casi fatal,
Aquellos que presentaron una reacción sistémica a picadura durante el curso de la inmunoterapia,
Aquellos que presentaron una reacción sistémica por la inmunoterapia,
Sujetos con anafilaxia al veneno de abeja.
En cuanto a la duración de la protección inducida por la inmunoterapia, se ha descrito que en pacientes vacunados por al menos tres años, la mayoría presentó un riesgo disminuido de reacciones sistémicas, luego de un seguimiento promedio de 18.5 años.103
d) La ITE subcutánea ha sido utilizada en pacientes con dermatitis atópica, sensibilización a ácaros y concomitantemente rinitis y asma alérgicas. En estos casos sí se mostró efectividad, (dos estudios, uno con calidad de evidencia alta104 y otro con calidad de evidencia baja),105 pero un alto porcentaje abandonó el estudio por activación de la dermatitis. Por lo anterior se puede sugerir mantener su uso reservado, para únicamente casos muy seleccionados.
e) En los casos de alergia alimentaria, mediada por IgE, no es recomendable utilizar ITSC, debido a que puede causar reacciones anafilácticas (calidad de evidencia muy baja).106 Sin embargo, en algunos pacientes se ha usado la inmunoterapia con Bet-v-1 para tratar el síndrome de alergia oral, lo que ha resultado en cierta tolerancia alimentaria (calidad de evidencia moderada). Varios estudios en adultos han evaluado la eficacia de la ITSC con Bet-v-1 y encontraron que en 87% de los pacientes se incrementó la tolerancia a la ingesta de manzana. Sin embargo, los resultados deben tomarse con cautela, debido a la variabilidad metodológica en el cegamiento, las dosis utilizadas y los tipos de reto en los estudios.107-109 Además, parece ser que la tolerancia inducida es de menor duración que con la ITSC con aeroalergenos (calidad de evidencia muy baja).110
f) El uso de ITSC para urticaria es controvertido. No existe evidencia que respalde su uso en esta patología que puede tener múltiples mecanismos fisiopatológicos. La urticaria crónica habitualmente tiene un fondo autoinmune con la producción de auto-anticuerpos contra el receptor de alta afinidad de IgE o contra la región Fc de la IgE. En estos casos la ITE con alergenos no está indicada.111 Sin embargo, existen casos anecdóticos exitosos del uso de ITSC en urticaria crónica alérgica, particularmente cuando hay otras enfermedades alérgicas en el mismo paciente. Al respecto, todos los colaboradores de esta guía unánimemente sugieren que el uso de ITSC en urticaria es 'a considerar'. Se requieren estudios clínicos para respaldar esta opinión consensada.
3.3 Características de los pacientes, en quienes la ITSC está indicada, una vez identificados los alergenos causales.
Existen varias indicaciones para la inmunoterapia específica con alergenos. Aunque antes sólo se prescribía en pacientes con enfermedades alérgicas graves y falla al tratamiento farmacológico,112 en los últimos años hay una tendencia a usar la ITE más tempranamente.61
Enseguida se dan las características clínicas para considerar la indicación de ITSC y su grado de evidencia:
a. En pacientes sin buen control de síntomas alérgicos con el uso único de medicamentos (Opinión consensada de expertos mexicanos).
b. En pacientes que presentan reacciones adversas a los medicamentos antialérgicos y antiinflamatorios usados para controlar sus alergias y que desean suspender su uso. (Opinión consensada de expertos mexicanos).
c. En pacientes con rinitis alérgica, para reducir el uso de antihistamínicos orales y oculares. (Calidad de evidencia alta).113
d. En pacientes con asma persistente moderada para favorecer la disminución del uso de esteroides inhalados. (Calidad de evidencia alta).90
e. En pacientes con rinitis alérgica y asma concomitante. (Calidad de evidencia moderada).114
f. En pacientes con rinitis alérgica estacional quienes presentan síntomas moderados a graves estacionales cada año. (Calidad de evidencia moderada).115
g. En niños con rinitis alérgica para prevenir el desarrollo de asma. (Calidad de evidencia moderada).78,116 Estudios realizados en adultos con rinitis alérgica han demostrado también la efectividad de la ITE subcutánea para prevenir el desarrollo de asma. (Calidad de evidencia moderada).117
h. Cuando no se puede evitar la exposición a alergenos ambientales (Opinión de alergólogos Mexicanos y expertos).
3.4 Contraindicaciones para ITSC y sugerencias de seguridad
Se consideran como contraindicaciones relativas de la ITSC aquellas condiciones médicas que reducen la capacidad del paciente a sobrevivir a una reacción anafiláctica, como el embarazo, cardiopatías graves o asma grave mal controlada, o que dificultan la reversión de la anafilaxia (uso de β-bloqueadores). También se incluyen condiciones aún sin evidencia científica pero que posiblemente la ITSC alteraría el curso de la enfermedad de base: cáncer, inmunodeficiencias primarias o secundarias (incluyendo SIDA) y enfermedades autoinmunes.49 Sin embargo, mediante el razonamiento médico se debe ponderar la relación riesgo/beneficio del uso de la ITSC en cada caso.
En el embarazo la ITSC puede ser continuada, pero usualmente no se recomienda iniciarla, ya que el riesgo de eventos adversos sistémicos es mayor cuando se aumenta la dosis118 y por razones obvias debe evitarse el riesgo de inducir una reacción sistémica en una mujer embarazada (opinión de Consenso de Alergólogos y expertos Mexicanos).
En pacientes con asma grave no controlada, se deberá esperar a la estabilización clínica mediante medicamentos, para considerar el inicio de la ITSC.
Los adultos mayores frecuentemente tienen co-morbilidades o emplean medicamentos que pueden incrementar el riesgo de reacciones adversas con la ITSC, por lo cual se debe considerar el riesgo/beneficio en forma individual y evitar losβ-bloqueadores antes de iniciar la ITE.
Sólo hay evidencia casuística del uso de ITSC en pacientes que toman β-bloqueadores.119 Aunque no aumenta la frecuencia de eventos adversos, puede dificultar la respuesta al tratamiento de anafilaxia. La casuística publicada es acerca de reacciones adversas sistémicas con veneno de himenópteros.120 Se sugiere en lo posible cambiar de anti-hipertensivo b-bloqueador antes de iniciar la ITE. Además se reporta un caso en México de un choque anafiláctico casi fatal en un paciente con una reacción adversa a ITE, posterior al cambio de anti-hipertensivo por su cardiólogo, sin aviso al médico tratante (comunicación personal, Álvaro Pedroza M.).
Referente al uso de inhibidores de la enzima convertidora de angiotensina (IECA), existe poca evidencia. Algunos reportes de casos no muestran mayor incidencia de reacciones adversas serias con el uso de IECA,121 en otros casos se ha observado que los IECA pueden exacerbar las reacciones adversas a la ITSC.122
3.5 ¿A partir de qué edad se puede usar ITSC?
Referente a la edad de inicio de ITSC, hay pocos estudios con calidad de la evidencia moderada y baja de ITSC en niños a partir de los dos años de edad,89 la mayoría de estudios con calidad de evidencia alta son en mayores de seis años.78,88,116
4. Técnicas de aplicación de la ITSC y preparación del frasco de mantenimiento
Coordina: Désirée Larenas Linnemann
Preguntas:
1. ¿Cuáles medidas deben tomarse antes de inyectar la ITSC al paciente?
2. ¿Cuáles son las dosis de mantenimiento de ITSC de acuerdo a la presentación de los extractos alergénicos?
3. ¿Cuántos alergenos deben incluirse en un frasco de vacuna?
4. ¿Cuál es el volumen total de un frasco de vacuna?
5. ¿Cuáles diluyentes se usan para preparar un frasco de vacuna?
4.1 Cuidados previos a la aplicación de ITSC
Antes de aplicar la ITSC se deben atender dos puntos de seguridad importantes. Primero, se debe identificar adecuadamente el frasco o frascos de vacuna del paciente y, segundo, determinar la dosis correspondiente a administrar. Este último punto se relaciona directamente con la detección de eventuales factores del paciente que podrían influir en el riesgo de una reacción adversa.
Para la identificación correcta de cualquier sustancia que se aplicará a seres humanos, en este caso vacuna con alergenos, se necesitan dos identificadores, por ejemplo, el nombre del paciente y fecha nacimiento o el número de expediente.123
Diversas circunstancias pueden aumentar la frecuencia de reacciones adversas sistémicas por la inmunoterapia.47,124 En caso de identificar un factor de riesgo de anafilaxia se debe reducir la dosis de la inmunoterapia o posponer su aplicación. La dosis de vacuna que se aplicará depende de algunos de los siguientes factores:
Posponer aplicación de IT:
1. Si el paciente cursa con asma no controlada o tuvo una hospitalización/atención en urgencias la semana anterior (Moderada calidad de evidencia -grado 3-, recomendación fuerte). Pacientes con asma no controlada tienen mayor riesgo de sufrir una reacción adversa fatal, según estudios con muestras grandes de pacientes con ITE.46-47 Un procedimiento ambulatorio para evaluar la función respiratoria del paciente es la flujometría. Se recomienda aplicar la flujometría antes de la inyectar la vacuna y posponer la inyección si el PEF es menor de 80% del valor predicho o del mejor valor del paciente (opinión de Consenso de Alergólogos y expertos Mexicanos).
2. Si el paciente tiene una enfermedad febril o invalidante los últimos tres días (opinión de Consenso de Alergólogos y expertos Mexicanos: obligatorio).
3. Si el paciente recibirá una dosis del esquema de inmunización oficial el mismo día de la ITSC (opinión de Consenso de Alergólogos y expertos Mexicanos).
4. En caso de ITSL, si el paciente se sometió a un procedimiento dental o tiene lesiones abrasivas de la mucosa oral.
Se sugiere evaluar una reducción de la dosis programada:
1. Si durante la fase de inducción de tolerancia existe un intervalo mayor a 15 días (calidad de evidencia baja, sugerencia); (Tabla 4.1).
2. Si durante la fase de mantenimiento la aplicación previa fue hace más de ocho semanas (Baja calidad de evidencia, sugerencia); (Tabla 4.1).
3. Si el paciente cursa con una exacerbación leve-moderada de sus síntomas alérgicos.(Opinión de Consenso de Alergólogos y expertos Mexicanos: obligatorio).
4. Si el paciente ha tenido una reacción adversa sistémica con la aplicación previa. (Moderada calidad de evidencia, recomendación).
5. Si el paciente ha tenido varias reacciones adversas locales grandes (tamaño de la palma de la mano del paciente). Una reacción local grande única, no aumenta el riesgo de reacciones adversas sistémicas.(Moderada calidad de evidencia, recomendación).
6. Ajustar la dosis durante la época del año de exposición elevada a los alergenos a los que el paciente está sensibilizado (p.ej. la estación de ácaros al final de la temporada de lluvias o de pólenes, que varía según el polen). (Baja calidad de evidencia, sugerencia). Antes de aplicar una inyección de inmunoterapia se recomienda tomar la presión arterial o por lo menos haber registrado un valor basal. En caso de anafilaxia, uno de los parámetros claves para el diagnóstico y para la evaluación de la gravedad es la reducción en la presión arterial. Esto sólo se puede documentar si se conoce la presión arterial que normalmente maneja el paciente.
Las reacciones adversas más graves a ITSC se presentan en la mayoría de los casos dentro de 30 minutos de aplicación, especialmente con los extractos acuosos.125 (Moderada calidad de evidencia). Después de la aplicación de la inmunoterapia es recomendable que el paciente permanezca en la sala de espera al menos 30 minutos, para atender oportunamente reacciones adversas sistémicas (recomendado).
4.2 Dosis de mantenimiento
Aunque la inmunoterapia es un tratamiento personalizado, en el cual la combinación de los alergenos a administrar y su dosis se ajustan a los síntomas y al grado de sensibilización del paciente, la eficacia de la inmunoterapia se aumenta con las dosis altas (calidad de evidencia alta);126 lo cual ha sido confirmado en una revisión reciente de estudios de dosis-respuesta. (Calderon M y colaboradores, EAACI Task Force Report on Dosing of Immunotherapy, Allergy 2011, en prensa), Sin embargo, esta revisión concluye que cada producto debe demostrar su propia dosis óptima, ya que no se pueden extrapolar dosis del producto de un fabricante a otro. La recomendación de la dosis de mantenimiento, depende del extracto utilizado.51,71,73,86,127-129 Otro hallazgo del estudio es que las dosis bajas de alergenos, no muestran mayor mejoría que el efecto placebo (que es alrededor del 30%). (Calidad de evidencia alta).
4.2.1 Extractos alergénicos en México
En México existen oficialmente tres diferentes grupos de proveedores de alergenos. Además se llegan a usar productos de un cuarto grupo 130. Según su procedencia, cada grupo de alergenos tiene sus esquemas de dosificación y es importante respetar esto para alcanzar dosis más eficaces (Tabla 4.2)
Los extractos disponibles en México son los siguientes:
1. Extractos europeos estandarizados y no estandarizados
2. Extractos nacionales, importados como liofilizados desde Estados Unidos y acondicionados para su venta localmente, sin estandarización.
3. Extractos nacionales, fabricados con materia prima local, sin estandarización.
4. Extractos de proveedores estadounidenses: estandarizados y no estandarizados.
4.2.2 Dosis programada de mantenimiento para los extractos alergénicos
Para una adecuada dosificación es importante tomar en cuenta que los extractos alergénicos europeos son comercializados como 'patient named product', que significa que la dosis de mantenimiento se administra al paciente, sin diluir, desde el frasco de mantenimiento.131
Los extractos de los otros tres grupos, se venden como concentrados. En este caso deben diluirse para preparar el frasco de mantenimiento del paciente. La potencia de los frascos de los concentrados se expresa como (Bioequivalent) Allergy unit = (B)AU) por mililitro, como Protein Nitrogen Units (PNU) por mililitro o como gramo de liofilizado por 100 mL de diluyente (= peso/volumen, p/v, o por sus siglas en inglés w/v). Los extractos no estandarizados se comercializan como productos muy concentrados, 1:10 p/v, o medianamente concentrados, 1:100 p/v, indicando respectivamente la presencia de un gramo del extracto alergénico liofilizado aforado con disolvente hasta un total de 10 mL o 100 mL de volumen.
Frecuentemente se confunden estas expresiones de potencia, con diluciones que se hacen posteriormente desde el frasco concentrado, como son 1:10 volumen/volumen para indicar una dilución de 0.5 mL del concentrado en 4.5 mL del diluyente, 1:100 v/v para indicar una dilución de 0.05 mL del concentrado en 4.95 mL del diluyente, etc. Las indicaciones para dosis en la Tabla de los extractos no estandarizados son en p/v (Tabla 4.3), para las recomendaciones de las dosis de mantenimiento programadas.
En inmunoterapia, lo ideal es utilizar alergenos estandarizados para asegurar la concentración del alergeno mayor.132 Con estos extractos la mejoría clínica con la ITE está ampliamente documentada (ver sección 3.1 y 3.2); el efecto a largo plazo se consigue con mayor probabilidad con dosis y un tiempo de administración adecuados. Algunos proveedores estadounidenses y europeos específican la cantidad del alergeno mayor en microgramos por mililitro en su correspondencia con el cliente. Debido a la variedad en métodos para determinar la cantidad de alergeno mayor, estos datos no se pueden usar para comparar dosis entre diferentes proveedores.131
4.2.3 Dosis programada de mantenimiento y dosis máxima terapéutica
La dosis de mantenimiento programada es aquella que ha mostrado eficacia clínica en estudios controlados (Tabla 4.2). Sin embargo, no todos los pacientes toleran las dosis programadas. Así la dosis de mantenimiento debe ser la dosis máxima terapéutica de cada alergeno para obtener mejoría clínica del paciente, sin que presente reacciones adversas sistémicas; ésta debe ser personalizada, indicada y supervisada por médicos alergólogos. Las dosis máximas terapéuticas frecuentemente causan reacciones adversas locales leves.
En los pacientes con reacciones locales y/o sistémicas es más difícil alcanzar concentraciones altas. En aquellos pacientes con reacciones adversas sistémicas (RAS) frecuentes con dosis menores a la terapéutica, debemos alcanzar la máxima dosis tolerada.
4.3 Número máximo de alergenos en un frasco
Una inmunoterapia eficaz necesita que una cantidad adecuada de alergeno sea administrada al paciente. Al mezclar 10 alergenos en un solo frasco, se diluyen entre ellos. Esto se puede evitar al usar frascos muy concentrados desde los cuales se prepara la vacuna (es decir frascos 1:10 p/v). (Calidad de evidencia alta). Existe controversia en cuanto al uso de mezclas de alergenos de un mismo grupo, como mezcla de pastos, mezcla de árboles, etc., tanto para pruebas cutáneas como para inmunoterapia. Generalmente se prefiere probar los alergenos individualmente después de un resultado positivo en la PCP con una mezcla, para dar una inmunoterapia dirigida. Con ello se evitarán la administración de alergenos a los cuales el paciente no haya presentado sensibilidad y también el aumento innecesario del número de determinantes alergénicos en la ITE (comentario sin recomendación específica, no consenso).
Hay otro factor que limita el número de alergenos que se deben incluir en un frasco de vacuna. Un alergeno único en un frasco de mantenimiento genera una buena respuesta inmunológica y reduce la reactividad en pruebas de reto postratamiento. Sin embargo, la misma cantidad del alergeno junto con otros nueve alergenos, sólo logra cambiar ligeramente los parámetros inmunológicos y no mejora la prueba de reto.134 (Calidad de evidencia moderada). Una posible explicación es que las células dendríticas tienen una capacidad limitada de procesamiento de alergenos. Generalmente se reduce el número de alergenos a administrar en la inmunoterapia, al tomar en cuenta los cruces alergénicos entre los extractos.135
Finalmente, existe una última regla para la mezcla adecuada de los alergenos: extractos con alto contenido de proteasas, como la cucaracha y los hongos, degradan alergenos con pocas proteasas, especialmente las gramíneas. (Calidad de evidencia alta).136
En conclusión, se sugiere que no se mezclan más de cuatro a cinco alergenos en un frasco de mantenimiento. Además no es recomendable combinar extractos con alta y baja cantidad de proteasas. Si se necesita administrar más alergenos o alergenos de alta y baja cantidad de proteasas, se prepararán en dos frascos y se aplicarán en jeringas diferentes, en lugares separados.
4.4 Volumen total de un frasco
Los frascos de la fase de inducción de tolerancia generalmente no deben tener más de 3 a 4 mL de volumen. Con una a dos aplicaciones semanales de dosis en incrementos de 0.05 mL, 0.1 mL, 0.2 mL, etc., hasta 0.5 mL el volumen que se ocupará es de sólo 1.55 mL. Para no prolongar innecesariamente esta fase, después de llegar a 0.5 mL se puede seguir con el próximo frasco más concentrado. Por razones prácticas y logísticas en clínicas del sector salud el médico, se puede ver obligado a modificar este concepto.
Los frascos de la fase de mantenimiento podrían tener un volumen mayor, porque durante el mantenimiento no se pasa al siguiente frasco más potente, porque se aplican dosis de la misma concentración. Sin embargo, aquí la limitante es la estabilidad del extracto de mantenimiento. Después de varias semanas o meses ciertos alergenos se fijan al cristal del frasco, lo que reduce su concentración en la mezcla,137 (Esch R, Plunkett G, datos no publicados). En consecuencia, es preferible preparar frascos de ITSC que duren máximo seis meses. En la Tabla 4.3 se presenta un ejemplo para preparar los frascos.
4.5 ¿Cuál diluyente usar para preparar el frasco de vacuna del paciente?
Existen datos en ensayos de laboratorio que muestran que extractos muy diluidos se adhieren al cristal del frasco, eliminándoles casi por completo de la solución. Esto se observa desde la dilución 1:100, pero es más marcado desde 1:1000 v/v, en adelante.137 Esta reducción de la potencia se puede inhibir casi por completo agregando una proteína a la mezcla, como la albúmina humana. Sin embargo, en México, aún es difícil conseguirla.
Estas son observaciones en ensayos en laboratorio, que falta confirmar en pruebas biológicas en humanos, pero podrían explicar el por qué un frasco nuevo tiene más probabilidad de causar reacciones adversas.
5. Dosificación y esquemas de aplicación de la Inmunoterapia Subcutánea
Coordina: Noel Rodríguez Pérez
Co-autores: Maria de Jesús Ambriz Moreno, Joel Oyoqui Flores, Carlos Baez Loyola
Preguntas:
1. ¿Cuánto dura la fase de inducción de tolerancia de ITSC?
2. ¿Cuál es el esquema de dosis de la fase de inducción?
3. ¿Cuál es la frecuencia de las dosis de mantenimiento?
4. ¿Cuánto tiempo dura la fase de mantenimiento?
5. ¿Es recomendable el uso de vacuna bacteriana?
6. ¿Dónde debe aplicarse la vacuna de ITSC?
5.1 Esquemas de aplicación y sus modificaciones en inmunoterapia subcutánea.
No existe un esquema único para la aplicación de la inmunoterapia subcutánea. Los esquemas usados en los ensayos clínicos tienen diferencias. Con base en los estudios publicados y la experiencia de sus miembros, los Parámetros Prácticos para Inmunoterapia, publicados por AAAAI, ACAAI, European Academy of Allergy and Clinical Immunology (EAACI) y la British Society for Allergy and Clinical Immunology (BSACI), sugieren esquemas de ITSC similares.10,62,138
5.1.1 Fase de inducción de tolerancia: duración
La inmunoterapia subcutánea clásica tiene dos fases de aplicación: la fase de inducción de tolerancia (tres a seis meses) y la de mantenimiento (tres a seis años). La duración de la fase de inducción de tolerancia debe ser suficiente para permitir el desarrollo de tolerancia del paciente, sin reacciones adversas sistémicas (RAS), pero dentro de un periodo aceptable para no posponer innecesariamente la llegada hasta la dosis máxima terapéutica y con ello la eficacia de la ITSC. Debido a que las manifestaciones inmunológicas de la tolerancia inducida se pueden observar a las dos a cuatro semanas de haber iniciado la ITSC,139 se recomienda que la fase de inducción dure entre tres a seis meses, dependiendo de la sensibilidad del paciente. Ver la sección 5.2, para la duración de la fase de mantenimiento. (Por consenso de expertos mexicanos).
5.1.2 Fase de inducción de tolerancia: esquema de aumento de dosis
La fase de inducción de tolerancia sirve para aplicar dosis gradualmente mayores del alergeno hasta alcanzar la dosis programada -o en su defecto la dosis máxima terapéutica-. Es recomendable que la dosis inicial de la inmunoterapia sea 10 000 (diez mil) veces menor a la dosis de mantenimiento programada. (Por consenso de expertos mexicanos). Así la concentración del frasco de inicio en la fase de inducción de tolerancia debe ser aproximadamente 1:1000 v/v a partir de la concentración de mantenimiento programada, aplicando 0.05 mL como volumen inicial y 0.5 mL como volumen final (Tabla 4.3).
La frecuencia de aplicación durante la fase de inducción es de una a dos veces por semana, con diferencia mínima de dos días. Se aplicarán de cuatro a seis dosis por cada concentración, incrementando el volumen de la aplicación desde 0.05 mL hasta 0.5 mL con incrementos de 0.05-0.1 mL por dosis, de acuerdo a la sensibilidad y tolerancia del paciente. En pacientes altamente sensibles se puede reducir diez veces la dosis inicial. La Tabla 5.1, muestra una propuesta de esquema de aplicación.
5.1.3 Modificaciones en las dosis
No se cuenta con lineamientos para la reducción de la dosis posterior a una RAS . En la práctica generalmente se reduce a la dosis previa tolerada, después de una reacción sistémica leve o a una concentración previa -es decir reducir la dosis 10 veces después de una RAS moderada. Después de una RAS grave se debe descontinuar la ITSC o continuarla con mucha cautela, ya que el riesgo de una nueva RS es mayor.47
Cuando el intervalo de administración de la ITSC ha sido prolongado -sobre todo en la fase de inducción - es recomendable disminuir la concentración particularmente en los pacientes con riesgo alto de RAS (Tabla 4.1).49,118
En algunas clínicas se recomienda que en pacientes altamente sensibles, se disminuya la dosis en la ITSC cuando estén expuestos a un ambiente con concentraciones altas del alergeno administrado, cursen con asma no controlada o tengan exacerbaciones de sus síntomas alérgicos y/o asmáticos.
Consideramos conveniente realizar estudios en México que corroboren las recomendaciones hechas en esta Guía.
5.2 Fase de mantenimiento: ¿Cuándo suspender la Inmunoterapia?
Un aspecto de la inmunoterapia específica sin evidencia clara para todos los alergenos es la referente a su duración óptima, es decir, cuándo debemos suspenderla en los pacientes que han tenido una respuesta favorable al tratamiento.
Los lineamientos y revisiones que se han publicado del tema7,60,112,126,140,141 todos proponen un
término de tres a cinco años de duración, con una mayor tendencia hacia los cinco años. Las conclusiones están basadas en pocas publicaciones directamente relacionadas con este aspecto a partir de estudios de eficacia y seguimiento de ITSC (calidad de evidencia alta). El primer punto a considerar es la evaluación de la eficacia, dado que se trata de un procedimiento terapéutico con beneficios clínicos a corto y largo plazo. Actualmente sólo contamos con marcadores indirectos (surrogate markers), varios de ellos subjetivos, acerca de la eficacia del tratamiento durante su aplicación y su efecto benéfico después de suspenderlo.
Aunque algunos parámetros como los niveles séricos de IgG4, IgE total y específica y la reactividad cutánea alergeno-específica se asocian con la respuesta favorable a la inmunoterapia,142 la correlación no es absoluta ni constante. Por ahora el mejor marcador indirecto es un ensayo que mide la función de la IgG4 específica, el análisis FAB (Facilitated Antigen Binding),139,143,144 pero aún no es un ensayo comercial. La monitorización de la eficacia se basa en la evaluación clínica individualizada, tomando en cuenta que existe el efecto placebo, que en estudios clínicos es alrededor de 35%.
Además de considerar los beneficios clínicos de la ITSC se debe dar mayor objetividad a la valoración de cada caso con el uso de escalas de síntomas, consumo de medicamentos o pruebas de función respiratoria.71,145,146
La eficacia a largo plazo de la inmunoterapia específica se ha documentado con estudios aleatorizados, doble ciego y controlados con placebo en anafilaxia por himenópteros, rinitis alérgica y asma alérgica, en niños y adultos y para diversos tipos de aeroalergenos.77,78,89,147-151 Sin embargo, casi todos estos estudios se han diseñado para documentar la eficacia terapéutica del procedimiento y no para determinar el momento de suspender el tratamiento. Por otra parte, si además de los efectos terapéuticos de corto y mediano plazo, consideramos la prevención del asma en pacientes con rinitis alérgica, la disminución de nuevas sensibilizaciones y la persistencia del efecto terapéutico aún después de la discontinuación,78 resulta aún más difícil asegurar de manera categórica en qué momento debe suspenderse la inmunoterapia.152
En un ensayo clínico controlado con ITSC con Phleum pratense durante tres a cuatro años, Durham y colaboradores no observaron diferencia en la escala de síntomas, en el uso de medicamentos y en las pruebas de reto entre el grupo que continuó tres años más con ITSC y el grupo que la había suspendido.77A un grupo de pacientes con buena respuesta a la ITSC con Dermatophagoides pteronys-sinus por uno a cuatro años se les siguió por tres años más evaluando los síntomas y pruebas de función pulmonar, se observó que 45% de los pacientes no recayeron y a mayor tiempo de inmunoterapia fue menor la frecuencia de recaídas.89 Una inmunoterapia con alergenos más complejos, como los ácaros, puede necesitar más de tres años para lograr su eficacia. (Opinión de expertos mexicanos).
En la ITSC por alergia a veneno de himenópteros hay una mayor cantidad de estudios controlados,153-159 quizás porque la condición clínica de estos pacientes es diferente a la de enfermos con alergia de las vías respiratorias y se vuelve un modelo más reproducible aunque sea una entidad menos frecuente: se administra como monoterapia, se dispone de alergenos estandarizados aplicados en dosis precisas, es más accesible el seguimiento clínico y para-clínico y no hay patología inflamatoria subyacente porque no hay exposición frecuente, como con los aero-alergenos.
La mayoría de los estudios con veneno de himenópteros muestran que un periodo de cinco años de tratamiento podría ser suficiente para la mayoría de los pacientes. Se ha descrito que hasta 15% de los pacientes pueden recaer en un plazo de 10 años luego de suspender la inmunoterapia y en dos de los estudios153,156 no se demuestra que cinco años sean mejor que tres; sin embargo en los pacientes que reciben inmunoterapia por más tiempo, las recaídas suelen ser leves, rara vez graves y los pacientes que siguen presentando reacción ante la re-exposición son con mayor frecuencia, los que tuvieron menos tiempo de tratamiento.153-156
Por otra parte las pruebas cutáneas no han sido útiles para predecir la persistencia de la protección, pues algunos pacientes con reactividad cutánea negativa volvían a experimentar reacciones sistémicas con la re-exposición. Más bien la IgE específica podría ser de mayor utilidad, pues no se han observado recaídas en pacientes con niveles no detectables.156,158 Recientemente se ha descrito que la relación de IgE específica/IgE sérica total tiene una mejor correlación con la mejoría clínica por ITE,142 pero se desconoce su utilidad para valorar el momento adecuado de suspensión del tratamiento. Finalmente, se ha descrito que la frecuencia de recaídas y reacciones sistémicas son más frecuentes en los pacientes con historia de reacciones graves antes del tratamiento, en quienes tuvieron alguna reacción sistémica durante la inmunoterapia, en los alérgicos a abejas y en quienes estuvieron menos de cinco años en tratamiento.
En conclusión, no es posible proponer un tiempo fijo para la administración de la ITSC. Un periodo de tres a cinco años, probablemente entre más prolongado mejor, parece brindar el máximo de los beneficios terapéuticos documentados para la inmunoterapia y el momento de su suspensión debe ser individualizado de acuerdo a parámetros clínicos y para-clínicos.
5.3 Uso de Inmunoterapia con vacuna bacteriana
Los resultados de varios estudios muestran que la inmunoterapia a base de lisados bacterianos tiene un efecto inmuno-modulador que se ha relacionado a una reducción del número y severidad de infecciones respiratorias y un aumento en la eficacia de la inmunoterapia específica con Dermatophagoides (2B) y pólenes cuando se utiliza conjuntamente con productos derivados de bacterias (2A).
5.3.1 Antecedentes del uso de la vacuna bacteriana
Hace varias décadas, la inmunoterapia con productos bacterianos, mezcla de bacterias muertas, fue una práctica generalizada, basada en referencias de experiencia personal de eficacia.160
Actualmente este procedimiento es poco aceptado y utilizado, especialmente en países del hemisferio norte. No se recomienda su uso en las guías de inmunoterapia estadounidenses, debido a la falta de evidencia de su eficacia.161 Sin embargo, varios alergólogos experimentados sí la siguen usando (comunicación personal de proveedor de alergenos en EEUU). Además, en los últimos años se ha renovado el interés por la inmunoterapia con productos bacterianos, especialmente por vía oral.
La inflamación persistente de las vías respiratorias tiene una alta morbilidad e incluso puede conducir a la incapacidad, especialmente en asma y rinosinusitis crónica. En estas patologías los linfocitos Th2, cuya estimulación resulta en una respuesta alérgica, y las enterotoxinas de S. aureus, que funcionan como super-antígenos, juegan un papel importante.162,163
Un área de investigación actualmente activa y muy productiva es la utilidad de bacterias y productos bacterianos para la modulación de la inflamación alérgica y en asma. Estas estrategias utilizan como blanco a los receptores tipo Toll (Toll-Like Receptors, TLR), que al estimularse con sus ligandos emiten una señal que induce una respuesta Th1, diferente de la respuesta alérgica Th2.
Los ligandos de los TLR son productos bacterianos, como por ejemplo el ADN y los ribosomas. Se está estudiando la utilidad de los ligandos TLR solos o unidos a alergenos, en varios ensayos con resultados alentadores.164,165 En Europa se comercializa un producto para inmunoterapia que combina alergenos con Mono-fosforil Lípido A (MPL, Pollinex Quattro®, Allergy Therapeutics).
El sistema inmune inmaduro del recién nacido esta prediseñado para una respuesta dominada por un fenotipo Th2.166 La estimulación natural adecuada con productos microbianos, especialmente durante el primer año de vida favorece la maduración de la respuesta inmune con predominio de respuestas dependientes de células Th1.167 Los TLR desempeñan un papel fundamental en la respuesta inmune innata, donde el sistema inmunológico inmaduro del recién nacido no tiene memoria para su defensa. Los TLR reconocen una gran variedad de microbios. Los componentes microbianos estimulan diferentes TLR localizados en la mayoría de las células involucradas con la respuesta inmune inmediata como neutrófilos, linfocitos T efectores, células Natural Killer y células dendríticas que son presentadoras de antígenos.168 Estas células incrementan su número de acuerdo a la maduración del sistema inmune en los primeros años de vida.169
5.3.2 Estudios clínicos con productos bacterianos como adyuvante de inmunoterapia con alergenos
En estudios clínicos, el uso de BCG como adyuvante de inmunoterapia específica sólo resultó en un aumento en la producción de IL-12, sin beneficio clínico.170,171 Sin embargo, en los últimos años se han utilizado con éxito vacunas que contienen moléculas inmuno-estimulantes, derivadas del ADN bacteriano (CpG, ISS, LPS, MPL) y que son los ligandos de TLR4 (LPS) o TLR9 (CpG, ISS). El uso de inmunoterapia específica con alergenos en combinación con estas sustancias o fusionada a ellas aumenta su eficacia,83,172-173 (calidad de evidencia alta) sin causar problemas de seguridad174 (calidad de evidencia moderada).
Recientemente, se demostró en un ensayo clínico controlado durante un año con 73 pacientes entre seis a 50 años de edad, una reducción en la frecuencia de los eventos adversos y en los niveles de IgE-Dpt específica en los pacientes que recibieron vacuna bacteriana (extractos bacterianos de vías respiratorias mixtos = BVRM) (p = 0.005) y Dpt + BVRM (p = 0.001). Sin embargo, no se observó diferencia significativa en la mejoría de síntomas entre los grupos, ya que también el grupo placebo demostró una reducción similar de síntomas, (calidad de evidencia baja).175
Los estudios analizados para esta Guía documentan que los lisados bacterianos son fuertes inductores de una respuesta inmune específica contra infecciones bacterianas.176 En estudios clínicos de tratamiento con productos bacterianos, en niños y adultos, se ha observado una tendencia a la reducción de la frecuencia y duración de infecciones, reducción del uso de antibióticos, mejoría de síntomas y en la calidad de vida de los pacientes con diversas enfermedades, incluyendo rinitis alérgica y asma. Con el fin de contar con información confiable de la inmunoterapia con productos bacterianos, es necesario desarrollar estudios con mejor diseño en términos de cegamiento y asignación aleatoria, tamaño de la muestra y adecuada selección de los pacientes.32
5.4 Lugar de la aplicación de ITSC
5.4.1 Reacciones adversas de la ITSC a nivel internacional
Se encuentra bien documentada la eficacia de la inmunoterapia, sin embargo puede causar reacciones adversas locales y sistémicas de grado variable. La aplicación de la ITSC se relaciona con una mortalidad muy baja por anafilaxia. Con base en lo anterior, se recomienda que la ITSC se aplique en el consultorio del médico. En algunos casos no habrá otra opción que aplicarla en el domicilio del paciente, con indicaciones claras y la firma de carta de consentimiento bajo información.
La prevalencia de reacciones adversas locales extensas (RALext) por ITSC está entre 26% y 86%.177 (Calidad de evidencia baja). Los primeros informes mostraron que las RALext no son predictivas de una reacción sistémica.178 (Calidad de evidencia baja). Sin embargo, RALext repetidas, sí parecen aumentar el riesgo de una reacción adversa sistémica. En un estudio retrospectivo se encontró una frecuencia de reacciones sistémicas cuatro veces mayor en pacientes con RALext repetidas, que los controles pareados sin RALext.179 (Calidad de evidencia moderada).
5.4.2 Eventos adversos con inmunoterapia: Datos mexicanos
En un estudio retrospectivo en México en mayores de cinco años se señalaron reacciones sistémicas por inmunoterapia y pruebas cutáneas en uno de cada 57 pacientes,180 (calidad de evidencia moderada) y una reacción sistémica leve en 254 pacientes181 (calidad de evidencia moderada). En todos estos casos, las reacciones sistémicas se presentaron los primeros 30 minutos posteriores a la aplicación de los alergenos. Con los resultados de una encuesta nacional se estimó una frecuencia de casos casi fatales en México de 0.005 por consultorio, que se estima en 1.5 casos al año en todo el país.182
5.4.3 Seguridad de ITSC en consultorio de otro médico o domicilio del paciente
En una serie muy extensa, se aplicaron 748 431 dosis en el consultorio del alergólogo tratante, 789 837 dosis en el consultorio de otros médicos y 2 006 335 dosis por el paciente o un familiar en su domicilio. Del total de 3 554 603 dosis aplicadas, hubo un caso fatal en el consultorio de un médico general, sin describir la aplicación de epinefrina. Los autores no informan de la frecuencia de reacciones sistémicas no fatales.183 En este reporte hubo una muerte por cada 2 900 000 dosis aplicadas en la casa de los pacientes, que resulta menor a otros estudios donde aplicaron la vacuna en el consultorio del médico.46,184
Si un paciente se refiere a otro alergólogo no debería implicar un aumento en el riesgo de reacciones anafilácticas, siempre y cuando se notifique en forma clara y completa el esquema de ITE utilizado. Lo anterior difícilmente sucede en la práctica, y el especialista debe decidir si continuar la inmunoterapia sin cambios o verificar la sensibilidad del paciente y aplicar un nuevo esquema de inmunoterapia (opinión de expertos).
6. Inmunoterapia específica con alergenos por vía sublingual (ITSL)
Coordina: Alfredo Arias-Cruz
Co-autores: Sandra Nora González-Díaz, Alejandra Macías-Weinmann, María del Carmen Zárate-Hernández, Marisol Belinda Treviño-Salinas
Preguntas:
Indicaciones para la ITSL
1. ¿A partir de qué edad se aplica la ITSL?
2. ¿Cuál será la dosis de mantenimiento probablemente eficaz en relación con la dosis de la ITSC?
3. ¿Con qué frecuencia se aplica la ITSL?
4. ¿Cuál es la duración mínima recomendable para ITSL?
5. ¿Dónde se aplica la ITSL?
6.1 Indicaciones para la inmunoterapia sublingual con alergenos
En forma similar a lo que ocurre con la inmunoterapia subcutánea con alergenos, la inmunoterapia sublingual puede ser considerada como una opción terapéutica en pacientes con síntomas de enfermedad alérgica en quienes se demuestre la existencia de sensibilización a alergenos clínicamente relevantes.
Las guías de tratamiento propuestas por ARIA (siglas en inglés de Rinitis Alérgica y su Impacto en el Asma), aceptan a la ITSL como una alternativa a la ITSC para el tratamiento de la rinitis alérgica tanto en niños como en adultos.68 Por otro lado, aunque en la actualidad los parámetros para la práctica de la inmunoterapia con alergenos en los Estados Unidos de América establecen que en ese país, la eficacia y seguridad de la ITSL se considera aún en estudio, reconocen también que existe evidencia científica sobre su eficacia en el tratamiento de la rinitis alérgica y el asma alérgica en niños y adultos.49
Si bien la eficacia terapéutica de la ITSL ha sido evaluada principalmente en pacientes con manifestaciones alérgicas respiratorias (rinitis o asma), existen diversos estudios clínicos en los que se ha investigado su posible utilidad en el tratamiento de otros padecimientos alérgicos.61
Al igual que lo que ocurre en la indicación de la ITSC, la ITSL deberá ser considerada sólo si existe una evidencia clara de relación entre la aparición de síntomas y la exposición a alergenos a los cuales el paciente esté sensibilizado.61
La mayor parte de los estudios clínicos en los que ha sido evaluada la eficacia de la ITSL en padecimientos alérgicos respiratorios han sido realizados utilizando extractos alergénicos de pólenes (principalmente de pastos) y de ácaros de polvo de casa (Dermatophagoides pteronyssinus).49,61
6.1.1 ITSL en el tratamiento de la rinitis alérgica
La mayoría de los estudios clínicos publicados en los que se ha evaluado la eficacia de la ITSL han sido conducidos en pacientes con rinitis o rinitis y asma, tanto en niños como en adultos.61 En 2005 se publicó el primer meta-análisis sobre el uso de ITSL en rinitis alérgica, en el cual incluyeron 22 estudios con 979 pacientes y se observó que la ITSL fue significativamente más efectiva que el placebo.185 En 2010, el mismo grupo de trabajo publicó una actualización del meta-análisis, con un aumento considerable del número de pacientes, y se confirmó la eficacia de la ITSL.186 Otro meta-análisis realizado en el sub-grupo de niños de cuatro a ocho años de edad, con rinitis, en el cual se incluyeron 10 estudios (484 pacientes), demostró eficacia significativa de la ITSL comparada con placebo, evaluada mediante puntaje de síntomas y uso de medicamentos de rescate.187 En un meta-análisis más reciente, realizado con la finalidad de evaluar la eficacia de la ITSL con alergenos de pastos en pacientes con rinitis alérgica estacional, se analizaron 19 ensayos clínicos con un total de 2971 pacientes, niños y adultos, y encontraron que la ITSL fue superior al placebo en el control de síntomas y en la reducción del uso de medicamentos, con un mayor beneficio clínico en adultos.188 Aunque los meta-análisis comentados incluyeron ensayos clínicos metodológicamente buenos, en general los estudios analizados fueron muy heterogéneos, por lo que sólo proveen evidencia sugestiva.67 Al evaluar la respuesta a la ITSL en pacientes con rinitis alérgica, se ha encontrado que su eficacia es dependiente de la dosis.52,189-190 Por otro lado, algunos estudios han sugerido que la ITSL puede prevenir el riesgo de nuevas sensibilizaciones y reducir el desarrollo de asma en niños con rinitis alérgica.191-194
6.1.2 ITSL en el tratamiento del asma
Diversos estudios han mostrado que la ITSL es eficaz en el tratamiento del asma alérgica. En un meta-análisis en el que se evaluó la eficacia de la ITSL en niños asmáticos, se encontró que en nueve estudios que incluyeron 441 niños, se reportó una reducción en el puntaje de síntomas y en el uso de medicamento de rescate en los niños que recibieron ITSL, la mayoría con extracto de ácaros de polvo casero, en comparación con los que recibieron placebo.195 En otro meta-análisis, se evaluaron 25 estudios, algunos de ellos abiertos, en adultos y en niños asmáticos. En este meta-análisis se demostró que la ITSL tuvo un efecto estadísticamente significativo en la reducción del uso de medicamentos de rescate, función pulmonar y mejoría global del asma,196 aunque también este meta-análisis tiene sus debilidades.197
6.1.3 ITSL en el tratamiento de otras enfermedades alérgicas
Algunos estudios han sugerido que la ITSL podría ser de utilidad en el tratamiento de la dermatitis atópica (leve a moderada),198 alergia a alimentos,199 alergia a látex200,201 y reacciones locales grandes por veneno de himenópteros.202 Los ensayos clínicos que se han realizado con estas indicaciones tienen buen diseño, pero considerando que aún son pocos, actualmente todavía se considera el uso de la ITSL en el tratamiento de estas enfermedades como experimental.61
6.1.4 Consideraciones especiales
Antes de la indicación de la ITSL, deberá evaluarse la capacidad del paciente para la adecuada administración de las dosis de los extractos alergénicos.
Mucho se ha discutido acerca de la necesidad de mantener las gotas en el lecho sublingual durante dos minutos. Esto será difícil de cumplir para preescolares. Allam y colaboradores, comprobaron con biopsias de diversos lugares de la cavidad oral, que la relación células dendríticas/células cebadas (relacionadas con eficacia y eventos adversos, respectivamente) es aún mejor en otras localidades intra-orales y óptimo en el vestíbulo (calidad de evidencia moderada). Esto aunado al hecho de que la ITSL es espesa, dado que su diluyente contiene 50% glicerina y la eficacia demostrado a partir de dos,203 tres204 y cuatro años,205(calidad de evidencia desde baja a moderada) el 'no deglutir por dos minutos' no parece ser una indicación rígida. Es recomendable no beber, comer o lavarse los dientes durante los diez minutos siguientes a la aplicación, para facilitar la permanencia de los alergenos in situ.
Tomando en cuenta que tanto la ITSC como la ITSL han mostrado ser eficaces en el tratamiento de la rinitis y el asma alérgicas, ambas formas de inmunoterapia pueden ser consideradas dentro del plan de tratamiento para los pacientes pediátricos o adultos que sufren de estos padecimientos. La elección de una u otra forma de inmunoterapia deberá realizarse en el contexto de cada caso en particular, analizando en conjunto con el paciente (y los padres del paciente en los casos de menores de edad), factores tales como la forma de administración, el lugar recomendado para la administración, el riesgo de reacciones adversas, los costos y la factibilidad de apego al tratamiento.138
La ITSL puede ser considerada como alternativa de tratamiento en pacientes que han presentado reacciones sistémicas con la administración de ITSC o cuando el paciente rechaza recibir las inyecciones de extractos alergénicos de la ITSC.
6.2 Uso de ITSL en relación a la edad de los pacientes
Debido principalmente a que las inyecciones repetidas de la ITSC suelen ser una experiencia traumática en los primeros años de vida, además de la dificultad de los niños pre-escolares para expresar claramente síntomas relacionados con reacciones adversas sistémicas, la ITSC no es comúnmente recomendada para los menores de cinco años. Debido a que la ITSL ha mostrado ser eficaz y segura en niños de mayor edad y adolescentes con rinitis alérgica y/o asma, se ha sugerido a la ITSL como una alternativa para el tratamiento específico de enfermedades alérgicas en menores de cinco años.206
Si bien la mayoría de los estudios clínicos sobre ITSL se han llevado a cabo en mayores de cinco años de edad, otros estudios han evaluado la seguridad y la eficacia de ITSL en niños a partir de los dos años de edad, con extractos de pólenes y ácaros del polvo casero.203,204, 207,208 Por lo tanto, la evidencia actual considera a la ITSL como un tratamiento seguro en niños de dos a cinco años. Se estima que 5% a 15% de los niños tratados con ITSL llegan a presentar alguna reacción adversa durante su tratamiento, la mayoría de las cuales son auto-limitantes y de intensidad leve a moderada, manifestadas principalmente como reacciones locales (prurito y/o edema oral). Se ha reportado una frecuencia de reacciones adversas de entre 0.08 a 1.8 por cada 1000 dosis de ITSL. Hasta ahora no se han documentado muertes relacionadas con la administración de ITSL en ningún grupo etario.49,61,209
Por otro lado, la ITSL ha mostrado ser segura en adultos. No parece haber diferencia en la frecuencia de reacciones adversas entre niños y adultos.210 Asimismo, la mayoría de las reacciones adversas en adultos son también de intensidad leve a moderada. Aunque se han publicado reportado algunos casos de anafilaxia, en ninguno de ellos ha sido fatal.211-213 La anafilaxia inducida por ITSL parece ser más común en pacientes que no toleran la ITSC.214,215
Considerando la eficacia observada en el tratamiento de la rinitis alérgica y el asma, así como su perfil de seguridad en adultos, la ITSL, podría ser indicada sin un límite superior de edad en pacientes adultos que tengan indicación de inmunoterapia específica, siempre y cuando no coexista algún factor de riesgo significativo (por ejemplo: uso de β-bloqueadores, hipertensión arterial, enfermedad coronaria, enfermedad cerebro-vascular y/o arritmias cardiacas).61
6.3 Dosis de la ITSL en comparación con las dosis recomendadas para la inmunoterapia subcutánea
La eficacia y seguridad de la inmunoterapia específica están estrechamente relacionadas con la cantidad de alergeno que se administra en los pacientes que reciben este tipo de tratamiento. En el caso de la ITSC, la experiencia clínica y el gran número de estudios desarrollados a lo largo de sus cien años de historia, han permitido establecer las dosis de mantenimiento que probablemente sean eficaces para los alergenos más relevantes (ver capítulo 3). Para los primeros estudios con ITSL, por lo general las dosis fueron elegidas en forma empírica.216 No ha sido hasta recientemente que el reporte de la dosis exacta sea requerido por los editores de las revistas indizadas, lo que obliga a los investigadores a establecer la cantidad de microgramos del alergeno principal aplicado en cada dosis.
Existe una gran variabilidad entre las dosis empleadas en los diferentes estudios en los que se han evaluado los efectos de la ITSL.188,190,206 Aunque parece ser que la eficacia de la ITSL depende directamente de la dosis, se desconoce si esta relación es igual para todos los alergenos.189,216
En general, se acepta que la dosis de alergeno para la ITSL debe ser bastante mayor que para la ITSC. Además se ha demostrado que la aplicación diaria es más eficaz para inducir cambios inmunológicos, que las aplicaciones dos o tres veces por semana (calidad de evidencia moderada),217 ver la sección 6.4. Los estudios en búsqueda de la dosis de ITSL con gramíneas concluyeron que la dosis óptima diaria para ITSL era semejante a la dosis mensual de mantenimiento de ITSC.52,218 Resulta muy difícil hacer una comparación absoluta para todos los alergenos entre las dosis de la ITSL y las de la ITSC, debido a las diferencias entre las preparaciones de los extractos alergénicos usadas para una y otra forma de inmunoterapia.61,131,219 En los primeros estudios de hace diez años, en los que se ha evaluado la ITSL de manera aleatoria, doble ciego y controlada con placebo, la dosis de alergeno empleada ha variado de tres a 375 veces la dosis mensual correspondiente de ITSC.209
El primer estudio dosis-efecto de ITSL en niños se realizó con dos dosis de extracto de polen de abedul. En este estudio, los niños que recibieron menor dosis (1.6 mcg) mostraron mejoría en sus síntomas, pero en los que recibieron mayor dosis (13 mcg), no sólo se redujeron los síntomas sino también la necesidad de medicamento220 (calidad de evidencia moderada).
En su meta-análisis sobre la eficacia de la ITSL con alergenos de pastos en rinitis alérgica, se encontró que las dosis mensuales de alergeno mayor utilizadas en los 19 estudios analizados, varió de 3 mcg a 1200 mcg, mientras que la dosis mensual promedio para el alergeno mayor de Phleum pratense (Phl-p-5) fue de 450 mcg. La mejor respuesta clínica al tratamiento con ITSL se presentó en pacientes que recibieron una dosis mensual >276 mcg de alergeno, y no hubo diferencia entre la dosis de 450 mcg y las dosis >600 mcg, lo que sugiere que la mejor dosis costo-efectiva podría ser de 450 mcg al mes, exactamente treinta veces su dosis mensual recomendada para ITSC.188
En estudios recientes (uno en niños y adolescentes y el otro en adultos), se determinó que la dosis diaria óptima de mantenimiento para el alergeno mayor, Phl-p-5, administrado en tabletas, es de cinco a 25 mcg, lo que representa cerca de 30 veces la dosis mensual de ITSC 221,222 (ambos con calidad de evidencia alta).
Se ha sugerido por consenso de expertos que la dosis mínima diaria de alergeno mayor para ITSL debe ser de 5 mcg 216(opinión de expertos no mexicanos). Se requiere de un mayor número de ensayos clínicos controlados (en niños y adultos) para determinar en forma más precisa la dosis eficaz para otros alergenos relevantes utilizados en la ITSL.
6.4 Frecuencia de administración de la ITSL
El régimen de administración de la ITSL puede variar de una vez al día a una vez a la semana, en los primeros estudios publicados de ITSL. En cerca de 50% de los estudios publicados, se ha utilizado un esquema de administración diaria. En los ensayos publicados los últimos años, la tendencia es de una aplicación diaria o al menos cinco días por semana. Sin embargo, hay muy pocos estudios223,224 que comparan la eficacia de los diferentes esquemas de la ITSL (calidad de evidencia baja).
Algunos estudios han sugerido que podría prescindirse de la fase de inducción de tolerancia en la ITSL, de modo que desde el inicio del tratamiento se administraría la dosis de mantenimiento correspondiente. Esta forma de administración de la ITSL aumenta la frecuencia de reacciones adversas locales las primeras semanas, pero no parece incrementar el riesgo de reacciones adversas sistémicas (calidad de evidencia alta).221,222,225-227
Para la ITSL con extractos de pólenes se han propuesto los esquemas de administración continuo, pre-estacional, estacional y pre-estacional - estacional. El esquema más utilizado en ensayos clínicos ha sido el pre-estacional - estacional. Aunque en otros estudios se ha documentado la eficacia para los distintos esquemas de ITSL con extractos de pólenes, éstos no han sido comparados directamente entre sí.216
La ITSL pre-estacional - estacional con administración diaria de dosis altas de polen de gramíneas en tabletas, es eficaz en el tratamiento de la rinitis alérgica estacional en los niños, de acuerdo a dos estudios con más de 200 pacientes cada uno, (calidad de evidencia alta).205,228 Los resultados mostraron una reducción significativa en los síntomas y en el uso de medicamentos durante la temporada de polen, con un efecto aún mayor durante la temporada pico de polen.
La eficacia clínica de la ITSL pre-estacional - estacional parece relacionarse con la duración de la administración pre-estacional y se sugiere un periodo mínimo de ocho semanas de tratamiento pre-estacional para obtener una buena eficacia, (calidad de evidencia moderada).229
Por otro lado, en un ensayo clínico de ITSL con extractos de pólenes de árboles a dosis intermedia, en gotas cinco veces a la semana, se encontró que este esquema de ITSL fue eficaz para la reducción de los síntomas y del uso de medicamentos en niños con rinitis alérgica. En este estudio la eficacia estuvo relacionada con la dosis administrada, (calidad de evidencia moderada).220
Durante la última década hay pocos estudios para evaluar la eficacia de la ITSL en rinitis alérgica perenne con sensibilización a ácaros de polvo casero. En un estudio aleatorizado de ITSL o ITSC con extractos de ácaros de polvo casero en adolescentes y adultos durante tres años, con seguimiento y evaluación de síntomas y pruebas cutáneas tres años después de suspender la inmunoterapia, la ITSL a dosis baja administrada tres veces a la semana, causó una mejoría significativa en el puntaje de síntomas al final del periodo de observación. Sin embargo, la medicación no pudo ser evaluada, ya que a los pacientes se les permitió tomar antihistamínicos, (calidad de evidencia baja).230
Por otra parte, en un estudio que evaluó la eficacia de la ITSL con ácaros del polvo casero dos veces por semana durante tres años en niños asmáticos se observó que la ITSL se asoció a una reducción importante en el uso de corticoesteroides inhalados. Sin embargo, el estudio tuvo un grupo control abierto y una alta deserción en el grupo activo durante el tercer año debido a los costos, (calidad de evidencia muy baja).231
Aunque se requiere un mayor número de estudios que evalúen y comparen los diferentes esquemas de ITSL, de acuerdo a la evidencia actual, consideramos recomendable la administración diaria continua de ITSL en pacientes con rinitis alérgica perenne y/o asma alérgicos a los ácaros del polvo casero, y que puede valorarse la indicación de un esquema pre-estacional - estacional en pacientes con rinitis alérgica estacional.
6.5 Duración del tratamiento con ITSL
Aunque la ITSL ha sido utilizada cada vez con mayor frecuencia en la práctica clínica durante las últimas dos décadas y en algunos países en Europa ya es la vía de administración más frecuente de inmunoterapia, existen pocos estudios acerca de los efectos a largo plazo. La duración óptima del tratamiento aún es un tema de controversia.
El análisis de los diferentes estudios de ITSL revela una amplia variedad en la duración del tratamiento, tanto para la dosis acumulativa como para la de mantenimiento. La heterogeneidad en el diseño de los estudios, de los extractos alergénicos empleados y de las mediciones de los resultados, representa una gran dificultad para obtener un meta-análisis adecuado de la eficacia de la ITSL de acuerdo a la duración del tratamiento.232 En un meta-análisis y revisión sistemática acerca del uso de ITSL en pacientes con rinitis alérgica y asma, se encontró que en cuatro de los 15 estudios analizados se emplearon esquemas interrumpidos de administración de la ITSL. Aunque existió una gran variación en la duración de los tratamientos, el mejor efecto se demostró cuando el tratamiento incluyó al menos un año de administración continua.196
En uno de los ensayos clínicos más grandes de rino-conjuntivitis alérgica, tratada con tabletas de extractos estandarizados de pastos se logró una mejoría clínica con cambios inmunológicos significativos y persistentes un año después del tratamiento,233 (calidad de evidencia alta).
Otro de los efectos observados con la ITSL es la disminución de la hiperreactividad bronquial a la metacolina, en niños asmáticos alérgicos a ácaros del polvo casero y pólenes tres años después de suspender el tratamiento,234 (calidad de evidencia moderada).
En niños con rinitis alérgica a pólenes de pastos, que recibieron tratamiento médico el riesgo de desarrollar asma fue 3.8 veces mayor que los niños que fueron tratados con ITSL por tres años.193
Yuta y colaboradores sugieren que la duración del tratamiento con ITSL debe ser de tres a cuatro años dependiendo de la respuesta clínica de cada paciente. En su estudio analizaron la eficacia clínica de la ITSL en pacientes japoneses con alergia al polen del cedro, administrada por uno, dos o cuatro años. Compararon también la respuesta en los pacientes que recibieron el tratamiento sólo por tres años con la observada en los que lo recibieron por los cuatro años. Encontraron que tanto la reducción en los síntomas, como el uso de medicamentos fueron significativamente mejores durante el cuarto año de tratamiento con ITSL.235
Existen pocos estudios de seguimiento a largo plazo después de la suspensión de la ITSL. Uno de los primeros estudios a este respecto realizado por Di Rienzo y colaboradores demostraron una reducción en los síntomas de asma después de cinco años de tratamiento con ITSL con ácaros.236
En un estudio retrospectivo en el que se evaluó el efecto de la ITSL en 65 pacientes con rinitis alérgica, alérgicos a ácaros de polvo de casa, se encontró que un tratamiento de cuatro años tiene un efecto prolongado de eficacia clínica de hasta siete a ocho años después de haberlo concluido.237 Marogna y colaboradores también publicaron recientemente un estudio prospectivo, abierto, de seguimiento a quince años en 78 pacientes con alergia respiratoria mono-sensibilizados a ácaros de polvo de casa, en el que evaluaron la eficacia del tratamiento con ITSL por tres, cuatro o cinco años, en comparación con tratamiento farmacológico solo. Únicamente los pacientes que recibieron ITSL mostraron una mejoría clínica significativa, así como una reducción en la hiperreactividad bronquial y en la cuenta de eosinófilos nasales. El beneficio clínico persistió por siete años en los pacientes que recibieron tres años de ITSL y por ocho años en los que la recibieron por cuatro o cinco años. Mientras todos los pacientes en el grupo control presentaron nuevas sensibilizaciones, esto ocurrió sólo en menos del 25% de los que recibieron ITSL, lo cual fue menos frecuente en los que la recibieron por cuatro o cinco años. Estos resultados sugieren que, en cuanto a la duración del tratamiento con ITSL, un periodo de cuatro años parece ser la mejor opción,238 (calidad de evidencia baja a moderada). Por lo tanto, aún cuando la evidencia actual no es del todo clara con respecto a la duración del tratamiento con ITSL, la información derivada de los estudios de seguimiento a largo plazo sugiere que el tratamiento debería administrarse por un periodo no menor de tres años. A esta misma conclusión llegó la opinión consensada de los alergólogos mexicanos. Además se podría sugerir prolongar la ITSL hasta un total de cuatro años, siempre que sea posible.
6.6 Lugar recomendado para la administración de la ITSL
El principal riesgo relacionado con la administración de inmunoterapia con alergenos es la posibilidad de reacciones adversas, incluyendo anafilaxia. Debido a que este riesgo es mayor en pacientes que reciben ITSC, la administración de ésta debe ser supervisada por un médico, motivo por el cual se recomienda que la aplicación de la ITSC se realice preferentemente en una clínica o consultorio médico.138,239
Debido a su menor riesgo de anafilaxia, en comparación con la ITSC, la ITSL ha sido considerada como un tratamiento que puede ser administrado en el hogar del paciente. Sin embargo, teniendo en cuenta que la mayoría de los casos de anafilaxia por ITSL han ocurrido después de la primera dosis, se recomienda que en todos los casos la primera dosis de ITSL sea administrada en el consultorio del médico tratante.138
Si además consideramos que la mayor parte de las reacciones adversas por ITSL ocurren en el curso de los primeros treinta minutos posteriores a la administración de los extractos alergénicos, se recomienda que después de la administración de la ITSL en el consultorio médico, el paciente espere al menos media hora antes de retirarse para continuar con el tratamiento en su casa.134,196,240
Para cualquier tratamiento ambulatorio, el apego por parte del paciente es fundamental para poder alcanzar resultados óptimos. A diferencia de lo que ocurre con la ITSC, el hecho de que por su perfil de seguridad la ITSL pueda ser auto-administrada en el hogar, facilita un mejor apego al tratamiento en pacientes con indicación de inmunoterapia.241
En un estudio sobre el impacto económico de la ITSL vs. el tratamiento farmacológico en el asma, Ariano y colaboradores encontraron que al administrarse la ITSL en casa, se reducen los costos de atención del paciente.242
Al indicar la administración de la ITSL en el hogar del paciente, deberá proporcionarse al paciente (o a los padres del paciente en caso de menores de edad), información precisa en relación a la técnica de administración, cómo identificar y tratar reacciones adversas, qué hacer en caso de interrupciones no planeadas, cuándo y cómo reportar al médico eventos relacionados con el tratamiento y en cuáles situaciones deberá evitarse la administración de la ITSL (por ejemplo: infección orofaríngea, úlceras orales, gastroenteritis aguda, exacerbaciones del asma, etc.).61
7. Eventos adversos (EA) con inmunoterapia subcutánea
Coordina: Alan Estrada
Co-autores: María de Jesús Ambriz Moreno
Preguntas:
1. ¿Cuál es el tratamiento de primera línea para una reacción adversa sistémica de la ITE?
2. ¿Cuál es el tratamiento para una reacción adversa local de la ITE?
3. ¿Cuáles son las características de los tres fármacos más usados para el tratamiento de reacciones adversas a la ITE?
Los eventos adversos (EA) provocados por la inmunoterapia subcutánea específica se clasifican en 2 categorías: reacciones adversas locales (RAL) y reacciones adversas sistémicas (RAS), anafilaxia. Las RAL pueden manifestarse como eritema, edema, calor, prurito y dolor en el sitio de aplicación. Las RAS pueden variar en severidad de leve a muy grave, que en ocasiones ponen en riesgo la vida. En México en un estudio realizado en el 2006 por Larenas y colaboradores, acerca de EA relacionados con inmunoterapia específica subcutánea, 59% de 421 alergólogos encuestados, informó algún EA grave relacionado.182
Los EA locales generalmente se tratan con la aplicación tópica de hielo o un antiinflamatorio o eventualmente con un antihistamínico sistémico. Para reducir la frecuencia de EA locales con aplicaciones posteriores de inmunoterapia, se puede pre-medicar al paciente con un antihistamínico una o dos hora antes de la aplicación y/o con un anti-leucotrieno. Esto reduce la frecuencia de los EA sistémicos, al igual que su severidad.243
Dado que no se puede saber en qué momento una reacción adversa sistémica leve puede evolucionar hacia anafilaxia, el reconocimiento temprano de sus primeros síntomas es primordial para iniciar el tratamiento oportunamente. Una RAS que inicia minutos después de la aplicación del alergeno o que involucra dos o más sistemas orgánicos, se debe considerar como anafilaxia.125
El tratamiento inicial de elección es epinefrina (Adrenalina®, 1:1000 o 1 mg/mL) IM en cara externa del muslo, eventualmente acompañado por un broncodilatador inhalado en caso de síntomas de broncoconstricción. Los antihistamínicos y los corticoesteroides sistémicos son medicamentos de segunda línea respectivamente, dado su efecto mucho más limitado o retardado.
El riesgo de anafilaxia generalmente se manifiesta dentro de los primeros 30 minutos después de la aplicación de la ITSC.125
7.1 Epinefrina (Adrenalina®)
Es un agonista alfa y beta adrenérgico con efecto farmacológico bidireccional mediado a través de la adenosina-monofosfato en los órganos blanco. Esto da como resultado vasoconstricción, incremento de la resistencia vascular periférica, disminución del edema de mucosa y de la liberación de mediadores de las células cebadas. Tiene un efecto inotrópico, cronotrópico positivo y causa broncodilatación, además de que probablemente disminuye la absorción del antígeno, aunque este último punto no ha sido sistemáticamente estudiado.244
La adrenalina es el fármaco de elección recomendado en todas las guías internacionales de anafilaxia.245-248 La primera dosis de adrenalina es de 0.01 mL/kg (= 0.01 mg/kg) sin diluir, dosis de 0.3 mL a 0.5 mL (= 0.3-0.5 mg) en adultos y de 0.3 mL (= 0.3 mg) en niños. Para el tratamiento de anafilaxia se debe administrar de forma intramuscular, de preferencia en la cara antero-lateral externa (vasto externo) del muslo (Figura 7.1)
◊ Figura 7.1. Instructivo para la aplicación de adrenalina en anafilaxia por inmunoterapia específica.
Esta dosis puede ser repetida cada cinco a 15 minutos si es necesario. En un estudio retrospectivo realizado en el Hospital Pediátrico de Massachusetts, en niños con antecedente de alergia a alimentos la necesidad de administración de más de una dosis se relacionó con el acceso limitado a los servicios de emergencia y el retraso de la administración de la primera dosis.249 La adrenalina aplicada en bajas concentraciones (0.001 mg/kg) puede condicionar paradójicamente vasodilatación e hipotensión e incremento de la liberación de mediadores inflamatorios.250
La eficacia en cuanto a la vía de administración subcutánea (SC) o intramuscular (IM), no ha sido evaluada en el evento agudo de la anafilaxia, sin embargo la absorción es completa y más rápida en la forma IM.251,252 El retraso en la administración de adrenalina durante la anafilaxia es relacionada con anafilaxia fatal, así como el incremento del riesgo de la respuesta bifásica de anafilaxia.253,254 En un estudio prospectivo se administró un total de 10 932 inyecciones de alergenos a un total de 330 individuos. Se informó 0.31% de RAS por inyección, de las cuales 85% requirió de administración de adrenalina. En 23% de los casos ocurrieron reacciones bifásicas. Los autores concluyeron que el principal factor relacionado es el retraso de la administración de adrenalina.255 Por esto se recomienda que los pacientes con riesgo de presentar una RAS porten un aplicador portátil de epinefrina (Epipen®). Para países como el nuestro, donde aún no existe este dispositivo en el mercado, recientemente se ha demostrado que una dosis de 0.3 mL de epinefrina se mantiene estable durante tres a cuatro meses en jeringas no selladas de insulina, aún a temperatura ambiental (hasta 38°C).256
7.2 Antihistamínicos H1
Durante las reacciones de hipersensibilidad inmediata un gran número de mediadores inflamatorios son liberados desde las células cebadas y los basófilos. La histamina juega un papel principal en la fase aguda de la inflamación alérgica, que involucra otros mediadores y vías de señalización, incluyendo la triptasa, carboxipeptidasa, factor activador de plaquetas, prostaglandinas, leucotrienos y citocinas. Por ende, durante la evolución de una RAS se puede llegar a presentar una amplificación de la reacción, de tal manera que ésta ya no responda a un solo antagonista.257
Para minimizar los efectos clínicos de la liberación de histamina, los antihistamínicos H1 son frecuentemente utilizados. Estos medicamentos actúan como agonistas inversos: se combinan y estabilizan la forma inactiva del receptor H1, impidiendo la unión de este con la histamina liberada. Sin embargo, no inhiben la liberación de mediadores a partir de las células cebadas y basófilos. Existen dos clases funcionales de antihistamínicos H1: antihistamínicos de primera generación, los cuales poseen efecto sedante, y los de segunda generación.
Los antihistamínicos son efectivos para las reacciones alérgicas localizadas y los EA sistémicos menos graves: con los síntomas de rinitis ayudan a disminuir la rinorrea el prurito y discretamente la congestión; en la conjuntivitis alérgica ayudan a disminuir el prurito, la epifora y el eritema; y en urticaria ayudan a disminuir la roncha y el eritema, de aparición no inmediata después de la aplicación de la ITSC.258-259 No se ha logrado encontrar alta calidad de evidencia de su uso en la anafilaxia a pesar de que en algunas guías internacionales como en la Británica de anafilaxia los antihistamínicos forman parte del manejo después de la adrenalina259 Los antihistamínicos son de utilidad para mejorar los síntomas cutáneos y la rinorrea, pero no para el alivio de la obstrucción bronquial o para el alivio de síntomas gastrointestinales. Después de la administración oral de antihistamínicos el tiempo aproximado desde su absorción hasta el inicio de su acción es de aproximadamente una a dos horas.257
Los antihistamínicos nunca sustituyen el papel de la adrenalina en eventos de reacciones alérgicas agudas graves (anafilaxia). Sin embargo, la administración concomitante de éstos como parte del tratamiento de los EA - eventualmente en combinación con antihistamínicos H2- puede ayudar a disminuir la sintomatología nasal y cutánea, aunque no de forma completa por la existencia de otros mediadores participantes como los leucotrienos.260,261
Los antihistamínicos H1 más recomendados son los de segunda generación, porque son relativamente libres de efectos secundarios y han mostrado pocos efectos tóxicos en escenarios de sobredosis.262-266 Algunos antihistamínicos orales, incluyendo la loratadina, la cetirizina y la levocetirizina son considerados relativamente seguros aún para uso prolongado en la edad pediátrica266,267 y su uso durante el embarazo y la lactancia (Food and Drug Administration) está clasificado como categoría B.268
7.3 Glucocorticoides
Los glucocorticoides son importantes para el tratamiento de las enfermedades alérgicas como el asma y la dermatitis atópica. Está bien establecido que durante la fase latente de la respuesta inflamatoria son requeridos por su acción anti-inflamatoria mediada a través de la unión con su receptor intracelular, los cambios en la acción del factor nuclear kappa B en el citosol y la inducción de la síntesis de proteínas funcionales. La Lipocortina es una de estas proteínas, la cual es capaz de inhibir la actividad de la fosfolipasa A2, resultando en la disminución de la producción de mediadores lipídicos, incluyendo leucotrienos, tromboxano A2, prostaglandinas y el factor activador de plaquetas.269,270 Esto se confirma en el estudio de Schleimer y colaboradores, llevado a cabo en cultivos de células cebadas extraídas de tejido pulmonar humano en donde se observa la poca utilidad de los glucocorticoides en la fase aguda de la inflamación alérgica mostrando nulo efecto sobre la liberación de histamina.271 También otros ensayos previos habían ya indicado claramente que el efecto del corticoesteroide en enfermedades alérgicas consiste en una potente modulación de la fase tardía de la inflamación alérgica, pero sólo tiene un efecto débil en la fase temprana de la reacción alérgica.272,273
Es alarmante que en recientes estudios multi-céntricos, que retrospectivamente investigan el perfil de práctica de los médicos en los servicios de urgencias estadounidenses, se demostró que los glucocorticoides forman parte de la resucitación inicial del paciente con anafilaxia.274-276 También en una encuesta realizada en México, el medicamento que se administra con mayor frecuencia para contrarrestar un EA sistémico grave post-inmunoterapia fue el corticoesteroide IM.182 Sin embargo, un reciente meta-análisis mostró que no existe evidencia que justifique el uso de glucocorticoides en el tratamiento de un evento agudo de anafilaxia,277 en contraste con su papel importante en la prevención y el tratamiento de la inflamación crónica del asma y de otros trastornos alérgicos.
Correspondencia. Puente de Piedra 150, Torre 2, cons. 602. Col. Toriello Guerra. Del. Tlalpan C.P. 14050. México D.F.
Correo electrónico.marlar1@prodigy.net.mx