En los últimos 4 años se han publicado al menos 3 guías internacionales acerca del manejo de la enfermedad tiroidea en el embarazo: 2 americanas (American Thyroid Association en 2011 y Endocrine Society en 2012) y una europea (European Thyroid Association en 2014).¿Cuál es el objetivo de que la Federación Argentina de Sociedades de Endocrinología (FASEN) convocara a elaborar una guía argentina luego de que el tema fuera tan ampliamente tratado? Por un lado, enfocar la atención en aspectos insuficientemente desarrollados en las guías anteriores o en los que existiera disenso y, por otro, tener la oportunidad de mostrar la experiencia y la postura argentina en varios de los puntos considerados.
Se reunió a un comité de expertos de distintos puntos del país (Buenos Aires, Córdoba, Tucumán, San Juan y Jujuy) con experiencia en el manejo de las enfermedades tiroideas en el embarazo.
Se convino en formular 10 preguntas clave, resumir la evidencia actualizada para responderlas y formular las recomendaciones cuya fuerza guarda relación con el nivel de evidencia. Tres de las preguntas corresponden al manejo previo a la búsqueda de embarazo, de fundamental importancia a la hora de emitir un consejo preconcepcional. Las 7 restantes se refieren a los conflictos en el diagnóstico y en la terapéutica de la enfermedad tiroidea en el embarazo, y a la repercusión que la disfunción tiroidea materna y su tratamiento pueden tener sobre el recién nacido.
Creemos estar aportando un material útil para la práctica de endocrinólogos generales y pediátricos, obstetras, neonatólogos, bioquímicos con orientación endocrinológica, y para todos aquellos interesados en los problemas de la salud materno-fetal.
PreconcepciónPregunta 1. ¿Cómo debe ser el manejo de la mujer hipotiroidea que busca embarazo?Dado que existe una clara asociación entre hipotiroidismo y riesgo de infertilidad1, es necesario que las mujeres con hipotiroidismo que buscan embarazo se hallen adecuadamente tratadas. Se ha recomendado un nivel de TSH <2,5mUI/l para garantizar el eutiroidismo2,3. Sin embargo, del 24 al 43% de las mujeres medicadas con levotiroxina (LT4) pueden presentar TSH elevada en la primera consulta durante el embarazo4,5, con los riesgos que ello implica6. Se propuso, por lo tanto, incrementar con 2 comprimidos más por semana (aproximadamente 30%) la dosis que recibían, apenas se tome conocimiento del embarazo7,8. No obstante, ello puede no ser suficiente9,10 y el eutiroidismo alcanzarse tarde, en el tercer trimestre9. Por esto, se ha sugerido anticipar el incremento de LT4, realizándolo previo a la concepción11,12. Alcanzando un nivel de TSH menor a 1,2mUI/l, el 83% de las pacientes no tendrá que incrementar la dosis durante el embarazo, evitando los riesgos de un tratamiento inadecuado12.
- 1.
Se recomienda alcanzar una TSH menor de 2,5mUI/l para garantizar el eutiroidismo previo a la concepción, en las pacientes hipotiroideas tratadas con LT43 (recomendación C).
- 2.
Para evitar, en la mayoría de ellas, aumentar la dosis de LT4 durante el embarazo, se recomienda alcanzar TSH preconcepción entre 0,5 y 1,2mUI/l11,12 (recomendación B).
El hipertiroidismo (H+) clínico no impide la concepción, pero puede condicionar severas consecuencias materno-fetales y neonatales13-18. Esto no ocurre con el H+ subclínico. Por lo tanto es prioritario normalizar los niveles de T4 y T3 preembarazo (E)19. Los antitiroideos (AT) constituyen el tratamiento de elección. Son más empleados en mujeres con H+ leve a moderado, TRAb discretamente elevados y bocio pequeño. Metimazol (MMI) y propiltiouracilo (PTU) son igualmente eficaces en el control del H+20,21. Si bien infrecuentes, se reportaron malformaciones específicas asociadas al uso de MMI22-24 y, recientemente, otras menos severas, asociadas a PTU25 en el primer trimestre y hepatitis fulminante/insuficiencia hepática severa de aparición atemporal vinculadas a PTU26 (ver pregunta 7). La situación ideal, aunque no siempre posible, sería lograr el eutiroidismo preconcepción suspendidos los AT. En mujeres con gran bocio, T4, T3 y TRAb muy elevados, incumplidoras o refractarias a los AT estaría indicado un tratamiento ablativo. Aunque la cirugía tiene riesgo de hipoparatiroidismo, los TRAb se normalizan más rápidamente tras tiroidectomía total que tras 131I (70% vs. 25% negativos a los 18 meses)27.
- 1.
El embarazo debe ser fuertemente desaconsejado hasta lograr la normalización de las hormonas tiroideas13-18 (recomendación «Aceptada por consenso general»).
- 2.
En pacientes con H+ leve a moderado que buscan embarazo a la brevedad, sugerimos iniciar tratamiento con MMI hasta normalizar T3 y T4, y considerar pasar a PTU cuando el acceso al mismo sea posible21-24. En este caso tener en cuenta la equivalencia MMI/PTU21 (ver pregunta 7) (recomendación D).
- 3.
Considerar el tratamiento quirúrgico en mujeres con H+ severo y altos niveles de TRAb que deseen embarazo en un futuro cercano27, garantizando el eutiroidismo prequirúrgico y la preconcepción (recomendación «Aceptada por consenso general»).
Mujeres en edad fértil con TSH >2,5 y <4,2mUI/l son en su mayoría eutiroideas28,29; en aquellas con aTPO+, el riesgo de aborto puede duplicarse30-32. En un subgrupo de dichas mujeres, con valores de TSH en el rango mencionado y factores de riesgo (tabla 1), podría existir hipotiroidismo subclínico (HSC)33, a tal punto que guías recientes3 han sugerido tratamiento con LT4, que podrá suspenderse si no se logra el embarazo o luego del parto. Para definir el tratamiento, además de confirmar el valor de TSH y medir aTPO, puede ser útil la realización de la prueba de TRH, en caso de contar con la normatización de la misma1. Se observó mayor porcentaje de recién nacidos vivos34 y menor frecuencia de abortos y partos prematuros35 en mujeres eutiroideas aTPO+ tratadas con LT4, aunque otros estudios no mostraron resultados concluyentes36. Pacientes eutiroideas aTPO+ en plan de fertilización asistida mostraron el doble de riesgo de aborto que las aTPO–37,38. Estudios recientes retrospectivos30,39observaron mayor tasa de embarazos exitosos cuando el procedimiento fue realizado con TSH < de 2,5mUI/l, sugiriendo lo conveniente del tratamiento con LT4, mientras que otros no encontraron diferencia en la tasa de embarazos con TSH en rango de 2,5 a 4,2mUI/l33,40.
- 1.
En mujeres con TSH entre 2,5 y 4,2mUI/l que buscan fertilidad, confirmar ese valor repitiendo el análisis, solicitar aTPO30-32 (en caso de ser negativo pedir aTg) e investigar factores de riesgo3,33 (recomendación D).
- 2.
Si tienen anticuerpos + u otros factores de riesgo se podría tratar con LT4 buscando alcanzar una TSH <2,5mUI/l, especialmente en mujeres que irán a fertilización asistida3, aunque la evidencia es contradictoria (recomendación D).
- 3.
La realización de la prueba de TRH podría ayudar a definir las pacientes que van a ser tratadas1 (recomendación D).
Pacientes con riesgo de disfunción tiroidea
| • Con antecedentes familiares de enfermedad tiroidea u otra autoinmune |
| • Con bocio |
| • Con anticuerpos antitiroideos |
| • Con síntomas de disfunción tiroidea |
| • Con DBT 1 u otra enfermedad autoinmune |
| • Con historia de aborto o parto prematuro |
| • Con infertilidad |
| • Con historia de radioterapia en cabeza o cuello |
| • Con IMC >40 |
| • Tratadas con amiodarona, litio, interferón |
| • Expuestas a agentes radiográficos de contraste en los últimos 2 meses |
| • Provenientes de área deficitaria de yodo |
| • Mayores de 30 años |
La evaluación de la función tiroidea durante el embarazo requiere rangos de referencia (RR) específicos para cada trimestre41, para cada método42, aplicables a poblaciones yodo-suficientes, sin autoinmunidad tiroidea y acordes a la etnia43. Guías internacionales3,44 basadas en diversos trabajos45-48(tabla 2) recomiendan que si no existieran rangos propios disponibles para TSH deberían usarse los siguientes RR: primer trimestre: 0,1-2,5mIU/l; segundo trimestre: 0,2-3,0mIU/l, y tercer trimestre: 0,3-3,0mIU/l. Sin embargo, publicaciones recientes42,43,49-55 han encontrado que el percentil 97,5 para el límite superior de TSH durante el embarazo podría ser más alto que el descrito en las guías (tabla 3) y, por lo tanto, si se aplicaran los criterios anteriormente mencionados, un porcentaje no despreciable de pacientes podría ser tratado innecesariamente52,53,56 (tabla 4). En Argentina, la información es limitada al respecto, aunque presentaciones en congresos nacionales e internacionales avalan esa tendencia57-59 (tablas 5 y 6). En cuanto a T4L, la variación metodológica usando inmunoensayos es aún mayor que para TSH60, pudiendo sus niveles ser menores que los de la no embarazada en el segundo y tercer trimestres. La medición de T4T puede usarse —de manera alternativa o complementaria— cuando se cuente con RR para el embarazo58-61 o se aplique el factor de conversión de 1,5 por cambios en TBG2,3,44,60.
- 1.
Es deseable contar con RR trimestre-específicos y métodos específicos para TSH y para T4L41 (recomendación D).
- 2.
La T4T, ya sea ajustada o con valores de referencia específicos para embarazo, podría reemplazar o complementar a la T4L2,3,44,60,62 (recomendación C).
- 3.
De no contar con RR trimestre-específicos podrían usarse los RR de las guías internacionales3,44 (recomendación D).
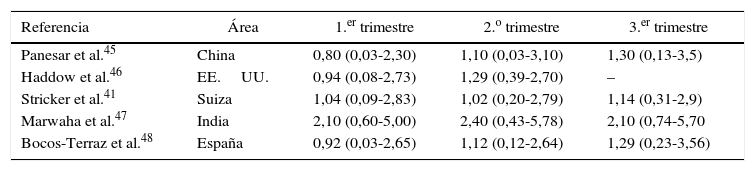
Mediana de TSH (mUI/l) y percentiles 5 y 95 o 97,5 en estudios de cohorte de mujeres embarazadas aTPO negativas incluidos en las guías de la American Thyroid Association (ATA) de 2011
| Referencia | Área | 1.er trimestre | 2.o trimestre | 3.er trimestre |
|---|---|---|---|---|
| Panesar et al.45 | China | 0,80 (0,03-2,30) | 1,10 (0,03-3,10) | 1,30 (0,13-3,5) |
| Haddow et al.46 | EE.UU. | 0,94 (0,08-2,73) | 1,29 (0,39-2,70) | – |
| Stricker et al.41 | Suiza | 1,04 (0,09-2,83) | 1,02 (0,20-2,79) | 1,14 (0,31-2,9) |
| Marwaha et al.47 | India | 2,10 (0,60-5,00) | 2,40 (0,43-5,78) | 2,10 (0,74-5,70 |
| Bocos-Terraz et al.48 | España | 0,92 (0,03-2,65) | 1,12 (0,12-2,64) | 1,29 (0,23-3,56) |
Fuente: Stagnaro-Green et al.44.
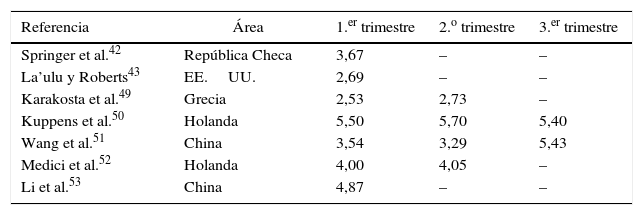
Percentil 97,5 de TSH (mUI/l) en estudios de cohorte en mujeres embarazadas aTPO negativas
| Referencia | Área | 1.er trimestre | 2.o trimestre | 3.er trimestre |
|---|---|---|---|---|
| Springer et al.42 | República Checa | 3,67 | – | – |
| La’ulu y Roberts43 | EE.UU. | 2,69 | – | – |
| Karakosta et al.49 | Grecia | 2,53 | 2,73 | – |
| Kuppens et al.50 | Holanda | 5,50 | 5,70 | 5,40 |
| Wang et al.51 | China | 3,54 | 3,29 | 5,43 |
| Medici et al.52 | Holanda | 4,00 | 4,05 | – |
| Li et al.53 | China | 4,87 | – | – |
Referencias posteriores o no incluidas en guías de ATA 201144.
Intervalos de referencia de TSH (mUI/l) (mediana y percentiles 2,5 y 97,5) en embarazadas normales aTPO negativas en Argentina
| Referencia | Región | Yodo-suficiencia | 1.er trimestre | 2.o trimestre | 3.er trimestre |
|---|---|---|---|---|---|
| Bergoglio et al.57 | Córdoba | Borderline | 1,75 (0,09-3,41) | 2,19 (0,56-3,82) | 2,14 (0,14-4,13) |
| Rodríguez et al.58 | Buenos Aires | Sí | 1,00 (0,3-3,5) | 1,6 (0,3-4,9) | 1,6 (0,3-4,5) |
| Fabbro et al.59 | Buenos Aires | Sí | 1,52 (0,11-3,5) | 1,93 (0,41-5,30) | 2,10 (0,25-5,20) |
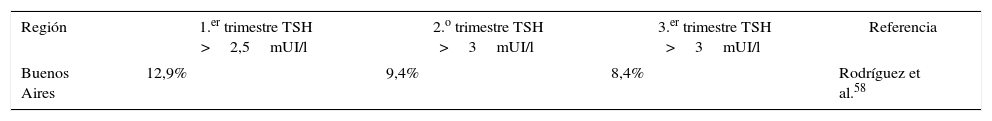
Estudios de cohorte en embarazadas normales en Argentina, aTPO negativas
| Región | 1.er trimestre TSH >2,5mUI/l | 2.o trimestre TSH >3mUI/l | 3.er trimestre TSH >3mUI/l | Referencia |
|---|---|---|---|---|
| Buenos Aires | 12,9% | 9,4% | 8,4% | Rodríguez et al.58 |
El hipotiroidismo puede originar eventos adversos en el embarazo: aborto, prematuridad, hipertensión gestacional, etc.63-65. Ello se observa más frecuentemente en el hipotiroidismo clínico (HC) (T4L o T4T baja para el trimestre con TSH elevada o TSH mayor de 10 independientemente de la T4)44. Aunque existen controversias66, se admite que también el HSC (T4L o T4T normal para el trimestre con TSH mayor del percentil 97,5) puede producir eventos adversos63,67,68, más frecuentemente en mujeres con aTPO positivos35,69. A pesar que la evidencia es escasa70, el tratamiento con LT4 debería lograr el eutiroidismo lo antes posible durante el embarazo para prevenir dichas complicaciones63,68,71. Las dosis recomendadas no son precisas y están basadas en la opinión de expertos9,72,73. En un reciente trabajo se sugiere emplear 1,2 a 1,4μg/kg/día de LT4 para pacientes con HSC, dependiendo de la TSH basal, y 2,3μg/kg/día para pacientes con HC. El 89% de los HSC y el 77% de los HC alcanzaron el eutiroidismo con esas dosis sin movimientos adicionales74. Otro trabajo similar ha confirmado estas observaciones75.
- 1.
Se recomienda tratamiento con LT4 en mujeres embarazadas con HC44,63-65—recomendación «Aceptada por consenso general»— o con HSC, aun en aquellas aTPO negativas, para prevenir complicaciones obstétricas63,68 (recomendación C).
- 2.
Se sugieren las siguientes dosis: 1,2μg/kg/día con TSH hasta 4,2mUI/l, 1,4μg/kg/día con TSH hasta 10mUI/l, y 2,3μg/kg/día con TSH mayor de 1074 (recomendación C).
La hipotiroxinemia aislada se define con T4L o T4T por debajo del percentil 2,5 (o del 10 de acuerdo a otros autores) con TSH dentro del rango de referencia76. La T4L puede ser más baja que el límite inferior de la no embarazada en el segundo y tercer trimestres, y ello puede llevar a errores diagnósticos en ese período (ver pregunta 4). La hipotiroxinemia es más frecuente en áreas yodo-deficientes77 y, además, las embarazadas no siempre mantienen la ingesta de yodo recomendada por la OMS (250mcg/día)78. Un estudio realizado en el noroeste argentino (NOA) en 627 gestantes sin patología tiroidea, durante el primer trimestre, mostró que el 79% de ellas no llegaba a cubrir los requerimientos de ingesta de yodo79. La hipotiroxinemia materna al inicio de la gestación no parece ocasionar alteraciones obstétricas80, pero ha sido relacionada con alteraciones psiconeurointelectuales del niño: disminución del coeficiente intelectual, defectos motores y del lenguaje, etc.81-84. En relación con el tratamiento, 2 trabajos realizados en España han demostrado el efecto beneficioso en los test psicométricos de los hijos de madres hipotiroxinémicas que recibieron yodo en el embarazo temprano vs. los niños del grupo control85,86. En cuanto al uso de LT4, un estudio doble ciego demostró que tanto el tratamiento del hipotiroidismo como el de la hipotiroxinemia aislada no mejoraron la función cognitiva en los niños evaluados a los 3 años de edad87, aunque el tratamiento pudo haber comenzado demasiado tarde, luego de la semana 12. Una reciente guía de la ETA sugiere, aún sin evidencia firme, la posibilidad de tratamiento con LT4 en la hipotiroxinemia aislada descubierta en el primer trimestre, no así en caso que el diagnóstico sea más tardío88.
- 1.
Se sugiere un aporte suplementario de yodo (tabletas de 150 a 200mcg de yodo, especialmente en la forma de yoduro de K, solas o asociadas a vitaminas)44,78, preferentemente desde antes de la concepción85,86 para prevenir (o tratar) la hipotiroxinemia (recomendación C).
- 2.
No existe evidencia sólida para avalar el empleo de LT4 en la hipotiroxinemia aislada44,88 (recomendación D).
Conocidas las severas consecuencias para la salud materno-fetal (F) / neonatal (NN) del H+ clínico 13-14, los AT deben indicarse de inmediato para normalizar las hormonas tiroideas. La vinculación de MMI con embriopatía específica22,23 (atresia coanas/esófago: OR 1823-2289; malformaciones mayores asociadas a MMI 4%, en controles 2%90,91) y de PTU con hepatotoxicidad severa/letal (1/10.000 población general, al menos 5 casos durante embarazo)26,89,9 determinaron que las últimas guías3,44 recomienden iniciar PTU o cambiar MMI por PTU durante el primer trimestre, volviendo a MMI finalizado el mismo. Publicaciones recientes no demostraron disminución de la tasa global de malformaciones con este cambio89, y evidenciaron que también el PTU puede provocarlas, aunque menos severas que con MMI25. La mayoría de estas malformaciones se observaron cuando los AT se administraron hasta la semana 6-10 de gestación25,93. Por otra parte, la imprecisión en la equivalencia MMI/PTU21(1/10, 1/15 o quizás más) podría desequilibrar la función tiroidea.
Las dosis iniciales de MMI son variables (usualmente 10-30mg/día), dependiendo de la severidad del H+. Para lograr el objetivo terapéutico (T4L cercana al límite superior del RR de la no embarazada con TSH que puede permanecer suprimida94), la dosis de AT a emplear dependerá de los niveles de T4L y de los de TRAb medidos a partir de la semana 18-20. Valores normales o ligeramente elevados de TRAb en madres que requieren AT hasta el parto, se asocian con más frecuencia a TSH F/NN elevada, evidenciando que la dosis de AT materna fue excesiva para el feto95,96. Por el contrario, TRAb muy elevados y altos requerimientos de AT97 maternos permiten inferir que dichos TRAb pueden condicionar H+ F. Los parámetros ecográficos fetales98 (ver pregunta 8) contribuirán a decidir la dosis de AT a emplear.
- 1.
Si el acceso a PTU fuera factible, este mismo sería el AT de elección en el primer trimestre, y el MMI a posteriori3,22,23,26,44,89-92 (recomendación C).
- 2.
En mujeres que se embarazan bajo MMI, consideramos infructuoso el cambio rutinario de MMI a PTU durante el primer trimestre por la improbabilidad que sea lo suficientemente precoz como para minimizar el riesgo de embriopatía por MMI89,91,93, y por el posible desbalance del eutiroidismo materno21 (recomendación D).
- 3.
Se recomienda ajustar las dosis de MMI o PTU para lograr el objetivo terapéutico94 teniendo en cuenta los niveles maternos de TRAb (medición imprescindible)96-97 y los parámetros ecográficos fetales98 (recomendación C).
- 4.
Solo en casos leves, cuando el embarazo se diagnostique al comienzo del primer trimestre, podría intentarse posponer el inicio, o suspender el AT si estaba previamente tratada, y evaluar con análisis semanales si la paciente puede cursar sin AT al menos hasta el fin de la semana 1093 (recomendación D).
El H+ F debe sospecharse cuando existan niveles elevados de TRAb (habitualmente >3-5 veces3,44,99 el límite superior del rango de referencia) a partir de la semana 20 en madres con H+ activo o en remisión, antecedentes de pérdidas F/NN e H+ NN previo. Como predictor de H+ F, un nivel de corte de TRAb de 50% medido por ensayo de primera generación (equivalente a 10UI/l utilizando ensayo de segunda generación con receptor de TSH humano100) tiene un VPN >99%97,101, mientras que el VPP es solo de 40-55%97,101 porque algunas madres con TRAb muy elevados no tienen hijos H+. Además de los TRAb, una FCF >160 latidos por minuto (lat × min) sostenida98 y datos ecográficos a partir de la semana 20: bocio (signo precoz)98, RCIU, aceleración de la maduración ósea (núcleo femoral distal visible antes de la semana 31)98 e insuficiencia cardíaca avalarían el diagnóstico. Debido a su pasaje placentario, la administración materna de MMI constituye el tratamiento del H+ F. Madres eutiroideas o bajo LT4 postablación con sospecha de H+ F deberán recibir MMI 10-25mg/día, con el agregado o ajuste de LT4 para evitar el hipotiroidismo materno (única situación de tratamiento conjunto de MMI y LT4 durante el E). El H+ NN puede presentarse desde el nacimiento (taquicardia, bocio, exoftalmos, irritabilidad, no ganancia de peso, etc.) o posteriormente si recibió AT prenatal. Los rangos de referencia neonatales102 figuran en la tabla 7. El H+ NN se trata con MMI 0,5-1mg/kg/día y propranolol 0,5-1mg/kg/día ajustando las dosis hasta la depuración de los TRAb, habitualmente antes de los 4 meses103.
- 1.
Debe sospecharse H+ F con al menos 2 determinaciones de TRAb maternos >50% (1-3), FCF >160 lat × min y parámetros ecográficos compatibles a partir de la semana 2098, independientemente del estado funcional tiroideo materno (H+, eutiroidismo o hipotiroidismo) (recomendación C).
- 2.
Debe medirse de rutina T4/T4L,TSH y TRAb en cordón, a los 3-5 días104,105 y posteriormente, según necesidad, en hijos de madres con TRAb positivos, en remisión o bajo AT (recomendación C).
- 3.
El H+ F y NN se tratan con MMI administrados a la madre y al bebé, respectivamente. En este último, hasta que se negativicen los TRAb103,104 (recomendación C).
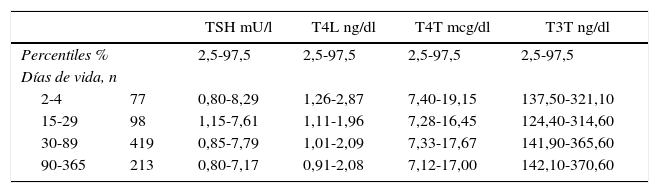
Rangos de referencia de TSH, T4L, T4T y T3T medidos por ECLIA en neonatos e infantes (n=807)
| TSH mU/l | T4L ng/dl | T4T mcg/dl | T3T ng/dl | ||
|---|---|---|---|---|---|
| Percentiles % | 2,5-97,5 | 2,5-97,5 | 2,5-97,5 | 2,5-97,5 | |
| Días de vida, n | |||||
| 2-4 | 77 | 0,80-8,29 | 1,26-2,87 | 7,40-19,15 | 137,50-321,10 |
| 15-29 | 98 | 1,15-7,61 | 1,11-1,96 | 7,28-16,45 | 124,40-314,60 |
| 30-89 | 419 | 0,85-7,79 | 1,01-2,09 | 7,33-17,67 | 141,90-365,60 |
| 90-365 | 213 | 0,80-7,17 | 0,91-2,08 | 7,12-17,00 | 142,10-370,60 |
Fuente: Lescurat et al.102
El hipotiroidismo central neonatal (HCEN) podría afectar a hijos de madres H+ con tratamiento insuficiente o nulo106-108 en magnitud similar al H+ NN107. El exceso de hormonas tiroideas maternas (y/o fetales, en caso de existir H+ F) a partir de la segunda mitad del embarazo impediría la maduración del eje hipotálamo-hipófiso-tiroideo-fetal, condicionando una supresión prolongada y reversible de la TSH F106,107,109. Se diagnostica por niveles neonatales de T4L<0,9ng/dl, T4 <8mcg/dl con TSH inapropiadamente normal (generalmente <8mUI/l)106,107,110 o suprimida, patrón precedido por una fase de eutiroidismo o H+ en el 40-50% de los casos107,110. La abolición del pico de TSH a las 24h110 y la prueba de TRH hiporrespondiente (en casos dudosos) confirmarían el diagnóstico. Los RR de las hormonas tiroideas y TSH en infantes y neonatos102 se muestran en la tabla 7. Confirmado el diagnóstico, se requiere tratamiento con LT4 en dosis de 5-6μg/kg/día o 25-50μg/día, en ocasiones por tiempo prolongado para minimizar el riesgo de daño neurológico. El HCEN no se detecta en la pesquisa NN que solo mide TSH, por lo cual su frecuencia puede estar subestimada. Para prevenirlo se requiere del diagnóstico temprano y adecuado tratamiento del H+ materno, lo que aboga en favor de la pesquisa universal en el embarazo.
- 1.
Debe sospecharse HCEN en hijos de madres con H+ sin tratamiento adecuado106-108 (recomendación C).
- 2.
Para diagnosticarlo, debe medirse T4L además de TSH en sangre de cordón/periférica106,107 (a ser posible a las 24h posnatales)110 y realizar monitorización seriada durante las primeras semanas, aun con determinaciones normales en cordón (recomendación C).
- 3.
Una vez confirmado el HCEN debe iniciarse tratamiento con LT4107 (recomendación B).
Diversas sociedades de endocrinología3,44,111 han recomendado la pesquisa de disfunción tiroidea con TSH en mujeres con factores de riesgo de presentar tiroideopatía (tabla 1), aunque algunos de sus integrantes se inclinaban por la pesquisa universal3. Aun aceptando evaluar grupos de riesgo, la edad mayor de 30 años ha sido cuestionada112,113 y se admite que un 30-80% de las disfunciones podrían no ser detectadas114-116. Algunos estudios costo-efectivos117-119 avalarían la pesquisa universal; otros trabajos que no analizan dichos aspectos, no la justifican68. En nuestro medio, no se han realizado aún trabajos de costo-efectividad probablemente por la complejidad que ello implica120. Recientemente se ha considerado que la pesquisa universal estaría justificada para la detección de HC88 por su impacto adverso indiscutido y una frecuencia (2 a 3 por 1.000) que supera en mucho a la del hipotiroidismo congénito121. Existen en nuestro país resultados aún no publicados acerca de la prevalencia de disfunción tiroidea clínica y subclínica detectada por pesquisa universal122. Si la TSH se hallara por encima de valores de corte (ver pregunta 4), o inhibida, podría solicitarse T4 libre (o total) para determinar si la disfunción es clínica o subclínica. La determinación de aTPO cuando la TSH es elevada no sería imprescindible, ya que está recomendado el tratamiento del hipotiroidismo aun con aTPO negativos (ver recomendación 1 de la pregunta 5). Si la TSH resulta inhibida y la T4 libre o (total) elevada, solicitar determinación de TRAb.
El panel se inclina por recomendar la pesquisa universal con medición de TSH, especialmente para la detección de disfunción tiroidea clínica88,114-119,121,122 (recomendación D).
Siguiendo recomendaciones editoriales ampliamente aceptadas123, en la preparación de la presente guía de práctica clínica se han tenido en consideración los aspectos, y se han seguido los procedimientos, que se mencionan a continuación:
- 1.
Los objetivos de la guía han sido claramente establecidos.
- 2.
Las preguntas de salud cubiertas por la guía son descritas específicamente. La guía está estructurada de modo que las preguntas consideradas clínicamente relevantes son seguidas de respuestas que derivan en recomendaciones fundadas en evidencia. Las preguntas fueron redactadas luego de la selección por un comité específico de numerosas cuestiones planteadas por miembros de la FASEN.
- 3.
La población a la que se dirige la guía son las pacientes portadoras de alteraciones tiroideas, embarazadas o en búsqueda de fertilidad.
- 4.
El desarrollo de la guía incluyó a todas las profesiones y especialidades relevantes a las cuales se requirió opinión.
- 5.
Los usuarios de la guía están claramente descritos. Se dirigió específicamente a endocrinólogos generales y pediátricos, obstetras, neonatólogos y bioquímicos con orientación endocrinológica.
- 6.
Se emplearon métodos sistemáticos para la búsqueda de la evidencia.
- 7.
Los criterios para seleccionar la evidencia se establecieron previamente. Se dio prelación a la información proveniente de ensayos clínicos controlados o metaanálisis de ensayos clínicos controlados. También se incluyó información de naturaleza observacional cuando fuera atinado a la respuesta, estableciendo claramente su calidad.
- 8.
Los métodos para formular las recomendaciones fueron acordadas en varias reuniones de las que participaron los correspondientes comités metodológicos y clínicos.
- 9.
Los beneficios, efectos adversos y riesgos para la salud han sido considerados (cuando correspondiere) en la preparación de la guía.
- 10.
La guía ha sido revisada por expertos externos a la comisión especializada en el tema en elaboración.
- 11.
Se ha determinado que esta temática deberá actualizarse en el término de 2 o 3 años, de no mediar alguna situación emergente que recomiende su previa revisión.
- 12.
Las recomendaciones están basadas en evidencias cuya valoración en términos de relevancia se describe como sigue:
- •
A: fundada en metaanálisis de ensayos clínicos de alta calidad, o ensayo/s clínicos no metaanalizados de potencia suficiente para responder a la pregunta principal formulada por los investigadores.
- •
B: fundada en ensayos clínicos o metaanálisis no incluidos en A.
- •
C: fundada en cohortes o casos y controles de alta calidad, metaanalizados o no.
- •
D: otras fuentes (observacionales no incluidas en C, otras recomendaciones de expertos con las que el grupo que elabora las guías concuerda, series de casos, controles históricos, etc.).
- •
«Aceptada por consenso general»: independientemente de lo establecido por otras guías, los autores de la presente recomendación de práctica clínica aceptan como válida la proposición considerada.
- •
- 13.
La guía fue desarrollada con absoluta independencia de financiadores externos a FASEN, institución que subvino los gastos implicados en reuniones y desplazamientos de los especialistas convocados.
- 14.
La difusión de esta guía cuenta con la aprobación de la Comisión Directiva de FASEN.