El término crioglobulinemia define la presencia en la sangre de proteínas, que precipitan in vitro a bajas temperaturas y se disuelven a 37°C. Sin embargo, no todas las crioglobulinas precipitan, algunas pueden formar geles, otras cristales y, rara vez, se separan en dos fases líquidas como le sucede a los aceites y el agua2.
Desde que fueron descritas por primera vez por Wintrobe y Buell3 en una paciente con mieloma múltiple, y Meltzer et al.4,5 describieran el síndrome de crioglobulinemia mixta esencial, caracterizado por la presencia de astenia, artralgias, púrpura y ocasionalmente glomerulopatía, se han asociado con neoplasias de células B maduras, procesos autoinmunes e infecciosos6–8. Aunque un elevado número de pacientes con crioglobulinemia pueden permanecer asintomáticos, cerca de la mitad presentan manifestaciones clínicas de vasculitis sistémica9.
Hasta el momento, ningún organismo internacional ha llevado a cabo la normalización de los procedimientos para el estudio de las crioglobulinas. No existe un método de referencia y como consecuencia se observa una gran disparidad entre los distintos estudios publicados sobre la detección y caracterización de las crioglobulinemias, atribuible a la diferencia de métodos entre laboratorios10–12. De ahí el interés que pueda tener la elaboración de un documento relativo a la validación o verificación de los procedimientos analíticos para el estudio de las crioglobulinas en el laboratorio clínico.
Objeto y campo de aplicaciónLos objetivos de este documento son revisar y actualizar la etiopatogenia de las crioglobulinemias y proporcionar recomendaciones metodológicas para su estudio en el laboratorio clínico. Se establecen normas para la correcta extracción y manipulación de las muestras de sangre, así como los procedimientos de detección y medida necesarios para tipificar los diferentes tipos de crioglobulinas. El campo de aplicación es todo tipo de laboratorio clínico que asegure unos requisitos mínimos en cuanto a la obtención, transporte y manipulación de la muestra de sangre, con la finalidad de favorecer la estandarización de los procedimientos de estudio de las crioglobulinas y contribuir así a minimizar los errores preanalíticos y obtener resultados transferibles entre diferentes laboratorios.
Clasificación y características de las crioglobulinasLa clasificación actual de las crioglobulinemias se debe a Brouet et al.13. En base a sus características y composición inmunoquímica, se han establecido tres tipos:
Tipo I (crioglobulinemias monoclonales)Representan el 10-15% de todas las crioglobulinemias. Están constituidas por un solo isotipo de inmunoglobulina (Ig) monoclonal, habitualmente IgM, con menor frecuencia IgG y rara vez IgA. Los volúmenes de los crioprecipitados son elevados (30-80% del suero), precipitan generalmente en 24 h, pueden producir síntomas de hiperviscosidad, trombosis10 y suelen ir asociadas con neoplasias de células B maduras (mieloma múltiple, macroglobulinemia de Waldenström, leucemia linfoide crónica y otras).
Tipo II (crioglobulinemias mixtas monoclonales)Constituyen el 50-60% de los casos. Están compuestas generalmente por dos isotipos diferentes de inmunoglobulinas. Una de ellas es monoclonal, generalmente IgM - cadena ligera Kappa, con actividad de factor reumatoide, que se une específicamente a la porción Fc del otro isotipo (IgG) de inmunoglobulina policlonal. Los volúmenes de los crioprecipitados son intermedios con relación a los otros dos tipos (1,5-30%). Suelen ir asociadas con neoplasias de células B maduras, enfermedades infecciosas (bacterianas o víricas) y autoinmunes. Dentro del grupo de enfermedades infecciosas están incluidas la mayoría de las consideradas anteriormente como «esenciales», sin enfermedad asociada, y que desde hace ya algunos años sabemos que son secundarias a la infección por el virus de la hepatitis C14–16. De las enfermedades autoinmunes, predomina el síndrome de Sjögren, al que se considera una manifestación extrahepática de la infección por el virus de la hepatitis C17.
Tipo III (crioglobulinemias mixtas policlonales)Incluyen del 25 al 30% de las crioglobulinemias y están constituidas por dos o más isotipos de inmunoglobulinas de carácter policlonal, usualmente IgM o IgG, pudiendo encontrarse además otras moléculas como factores del complemento y lipoproteínas. Como en las de tipo II, se ha detectado también en uno de los componentes del inmunocomplejo actividad de factor reumatoide. Los crioprecipitados suelen ser pequeños (0,5-1,5%) y se asocian con enfermedades infecciosas, entre las que cabe destacar las producidas por los virus hepatotropos A, B y C6,10,14–16 y enfermedades autoinmunes (síndrome de Sjogrëm, lupus eritematoso sistémico, artritis reumatoide)10. Las enfermedades asociadas a cada uno de los tres tipos de crioglobulinas y su composición se indican en la tabla 111.
Clasificación de las crioglobulinas
| Tipo de crioglobulina | Composición | Enfermedad asociada | Volumen del precipitado (%) |
|---|---|---|---|
| Tipo I (monoclonal) | Inmunoglobulinas monoclonales (habitualmente M, menos frecuente G y rara vez A) o proteína de Bence Jones | Macroglobulinemia de Waldeström, mieloma múltiple, gammapatía monoclonal asociada a enfermedad linfoproliferativa, enfermedad de cadenas ligeras | 30- 80 |
| Tipo II (mixta) | Inmunoglobulinas monoclonales (G, A, M, generalmente M)+inmunoglobulina policlonal, mayoritariamente G | Hepatitis C, síndrome de Sjögren, artritis reumatoide, leucemia linfocítica crónica, linfoma no Hodgkin | 1,5-30 |
| Tipo III (mixta) | Inmunoglobulinas policlonales de todos los isotipos | Síndrome de Sjögren, lupus eritematoso sistémico, cirrosis biliar infecciones virales (virus hepatitis C, virus hepatitis B, cytomegalovirus, virus inmunodeficiencia humana, virus Epstein-Barr), endocarditis, otras infecciones bacterianas | 0,5- 1,5 |
Modificado de Motyckova et al.11.
En el estudio de los crioprecipitados de algunas crioglobulinemias de tipo III, se han detectado IgM oligoclonales y trazas de inmunoglobulinas policlonales, lo que sugiere que pudiera tratarse de un estadio intermedio en transición de crioglobulinemia tipo III a tipo Il, que incluso se han descrito como un nuevo tipo de crioglobulinemias6,10. Esta evolución o transformación de policlonal a oligoclonal y en algunos casos de oligoclonal a monoclonal, ya que entre un 5 a un 10% de pacientes con una vasculitis crioglobulinemica pueden finalmente desarrollar una neoplasia de células B, refleja la continua expansión clonal de las células B18.
EtiopatogeniaLas crioglobulinas se producen como consecuencia de una expansión clonal de las células B, atribuible a una neoplasia de células B maduras o bien a una inmunoestimulación persistente desencadenada por una infección crónica o una enfermedad autoinmune8,19,20.
No se conocen con exactitud los mecanismos que causan la precipitación reversible de las proteínas a bajas temperaturas y según el tipo de crioglobulinemia, el mecanismo es diferente. En las de tipo I, como resultado de una expansión monoclonal de las células B maduras, se considera que la precipitación se debe probablemente a características intrínsecas de las proteínas monoclonales producidas. Entre estas características se incluyen cambios conformacionales de las moléculas que las componen, una elevada concentración de la inmunoglobulina monoclonal con formación de agregados que producen un aumento de la viscosidad, la hidrofobicidad relativa de las moléculas, tamaño y carga; un número insuficiente de residuos de tirosina, una concentración baja de ácido siálico y de galactosa en la región Fc de las inmunoglobulinas también pueden causar precipitación a bajas temperaturas6,20,21.
En las de tipo mixto, sin embargo, las crioglobulinas se producen como consecuencia de una inmunoestimulación persistente desencadenada por procesos inflamatorios crónicos (infecciosos, autoinmunes) y que da lugar a una hiperactivación y/o hiperproliferación de las células B. Este proceso se vería favorecido por una depuración deficiente por el sistema mononuclear fagocítico de los inmunocomplejos formados22,23.
La infección por el virus de la hepatitis C es la causa más frecuente que desencadena la producción de una crioglobulinemia mixta. La expansión clonal de las células B se realiza vía CD81, que es una proteína de la superficie celular expresada por los hepatocitos y linfocitos. Se ha demostrado la existencia de clones de células B tanto en tejido hepático como en sangre periférica y médula ósea de pacientes con crioglobulinemias tipo II asociadas a una infección por el virus de la hepatitis C. Esos clones producen inmunoglobulinas monoclonales isotipo M, con actividad de factor reumatoide y presentan la especificidad cruzada denominada «idiotipo WA» (esta denominación se debe a que primero se aisló en el suero de un paciente con macroglobulinemia de Waldenström), que dirige o controla la unión de las inmunoglobulinas con la proteína «core» del virus de la hepatitis C24–26. Los crioprecipitados contienen ácido ribonucleico y proteínas «core» virales, lo que sugiere que la formación de crioglobulinas es consecuencia de la respuesta inmune del huésped frente a la infección crónica por el virus de la hepatitis C25–27.
En las crioglobulinemias mixtas tipo II habría que considerar además los factores derivados de la proliferación linfoide: el hallazgo de agregados linfoides en la médula ósea, el hígado y el bazo parece indicar una linfoproliferación crónica de células con un bajo grado de malignidad, responsables de la presencia en los crioprecipitados del componente monoclonal. Estas crioglobulinemias pueden evolucionar a enfermedades linfoproliferalivas malignas, siendo la neoplasia de células B maduras la principal complicación en estos pacientes, por lo que debe realizarse seguimiento de los pacientes afectados. Algunos grupos de trabajo consideran actualmente a la crioglobulinemia mixta tipo II como un síndrome linfoproliferativo con entidad propia19,28,29.
La patogénesis del daño tisular es principalmente de dos tipos: por precipitación de crioglobulinas en la microcirculación o por inflamación de los vasos sanguíneos mediada por inmunocomplejos. La oclusión vascular es más frecuente en las crioglobulinemias de tipo I, con volúmenes de crioprecipitado elevado y pueden estar asociadas con un síndrome de hiperviscosidad y necrosis acral inducida por el frío. La vasculitis mediada por inmunocomplejos es más frecuente en las crioglobulinemias mixtas, particularmente en las de tipo II, en las que se generan grandes complejos de IgM monoclonal con IgG y componentes del complemento, particularmente C1q. El componente C1q puede unirse a los receptores de las células endoteliales, facilitando el depósito de los inmunocomplejos y por ende la subsiguiente inflamación vascular26,30,31.
En la mayoría de los pacientes, la enfermedad crioglobulinémica se diagnostica mediante la afectación de órganos diana (principalmente piel, riñón o nervios periféricos) y la presencia de crioglobulinas circulantes25. En la tabla 2 se especifican aquellas condiciones clínicas y hallazgos de laboratorio en las que es aconsejable realizar un estudio de crioglobulinas21.
Indicaciones para realizar un estudio de crioglobulinas
| Condiciones clínicas | Hallazgos de laboratorio |
|---|---|
| ✓ Síndrome de Raynaud ✓ Isquemia periférica en ausencia de enfermedad vascular periférica ✓ Acrocianosis inducida por frío ✓ Púrpura en adultos ✓ Púrpura, artralgias y astenia (tríada de Meltzer) ✓ Vasculitis cutánea ✓ Vasculitis de pequeño vaso ✓ Glomerulonefritis membrano proliferativa ✓ Neuropatía periférica no diagnosticada ✓ Síndrome de Sjögren ✓ Infección por virus hepatitis C y hepatitis B | ✓ Gammapatías monoclonales, principalmente de isotipo IgM o con presencia de hiperviscosidad ✓ Déficit de componentes del complemento no justificado (principalmente C4) ✓ Concentración elevada de factor reumatoide no justificada ✓ Pseudotrombocitosis ✓ Visualización de hematíes en pila de monedas (rouleaux) en el frotis de sangre periférica ✓ Alteraciones en la migración de las proteínas en el trazado electroforético, necesitando tratamiento con agentes reductores |
Fuente: Sargur et al.21.
Existen determinados aspectos en el estudio de las crioglobulinas que deben respetar todos los laboratorios, sobre todo los relacionados con la fase preanalítica, ya que una de las causas más frecuentes que da lugar a resultados falsos negativos es la inadecuada recolección y transporte de las muestras11,21. Las etapas del estudio son:
Fase preanalíticaExtracción y procesamiento de las muestrasEn el estudio de crioglobulinas, es de gran importancia que la muestra de sangre sea manejada bajo unas condiciones determinadas de temperatura, ya que algunas crioglobulinas precipitan rápidamente a temperaturas inferiores a 37°C, por lo que todo el material de extracción (jeringas, tubos con gel separador, sin anticoagulante) deberá atemperarse previamente a 37° C32.
Se deben extraer dos tubos de 10mL de sangre venosa, siempre que las condiciones del paciente lo permitan, con el fin de conseguir suficiente crioprecipitado para su estudio (sobre todo en las crioglobulinemias de tipo III, que cursan con escaso precipitado). Durante el transporte al laboratorio, las muestras deben permanecer en un recipiente isotérmico con agua o arena, asegurando que la temperatura se encuentre entre 37 y 40°C33,34.
En el laboratorio, se mantendrán los tubos a 37°C en un baño María durante 1h hasta que se produzca la retracción del coágulo y a continuación se centrifugan a 37°C, a 1.000xg durante 10min. Si el laboratorio no dispone de una centrífuga a 37°C, se puede realizar la separación del suero después de 1 hora a 37°C, sin centrifugar y con ayuda de una pipeta Pasteur, evitando la aspiración de hematíes o restos de fibrina11.
El suero obtenido se alicuota en tres tubos de vidrio de fondo cónico; uno de ellos debe ser graduado o en su defecto, también se puede usar el denominado tubo de Wintrobe para hematocrito. Dos de los tubos (I y II), se utilizan para confirmar la solubilidad del crioprecipitado y realizar el estudio de las crioglobulinas, respectivamente. El tubo III graduado o el de Wintrobe se emplea para la medida del crioprecipitado. Se deben mantener todos los tubos en nevera (2–8°C) un mínimo de 3 días para los crioprecipitados medios o elevados, fácilmente visibles y hasta 7 días para los más pequeños11,20.
Antes de su conservación en frío, se debe llevar a cabo una inspección visual de la muestra de suero, pues la presencia de hemólisis o lipidemia puede interferir en el estudio de las crioglobulinas11.
Fase analíticaDetecciónLas crioglobulinas tipo I pueden precipitar y ser visibles en 24 h, mientras que las crioglobulinemias mixtas, principalmente tipo III, pueden necesitar hasta 7 días. Es aconsejable observar los tubos diariamente, buscando cambios en la transparencia del suero o la aparición de un precipitado o turbidez.
Transcurridos 7 días en nevera, si no hay cambios en el aspecto del suero, se considera que la muestra está exenta de crioglobulinas. Ante un resultado negativo, el estudio se deberá repetir al menos 3 veces siempre que exista una sospecha clínica fundada21. Si hay cambios que hagan sospechar la presencia de una crioglobulinemia, se debe comprobar el carácter reversible o no de la crioprecipitación, con el fin de descartar precipitados inespecíficos por contaminación o fibrina. Para ello, poner uno de los tubos no graduados (tubo I) a 37°C durante 30-60min y comparar el aspecto de este tubo con el que permanece en nevera. Se confirma la presencia de crioglobulinas cuando se produce la redisolución del crioprecipitado. En este caso, se procede a centrifugar a 1.000xg durante 10min y 4°C el tubo II que permanece en nevera, junto con el tubo III graduado11,21,35.
Lectura de Ia fracción de volumen del crioprecipitadoLa concentración de la crioglobulina puede ser medida como crioprecipitado. Después de centrifugar en frío (4°C) el tubo III graduado o el de Wintrobe, se lee en la escala la altura del crioprecipitado y se expresa como un porcentaje en relación con el volumen total de suero en el tubo. Aunque en el suero de individuos sanos pueden encontrarse pequeñas cantidades de crioglobulinemias, un crioprecipitado ≥ 1% indicará la existencia de crioglobulinemia11,36.
La medida del crioprecipitado requiere un volumen de suero elevado, está influenciado por proteínas contaminantes, es un procedimiento cómodo, rápido y barato, pero de reproducibilidad no muy adecuada. Es una valoración aproximada por lo que no se debería recomendar como única determinación para estimar la concentración de crioglobulina21.
Preparación del crioprecipitadoUna vez centrifugado el tubo II que se va a utilizar para el estudio de las crioglobulinas, se aspira el suero sobrenadante y se conserva en nevera (para realizar posteriormente una electroforesis con el objetivo de verificar el procesado correcto de obtención del crioprecipitado). Se lava el crioprecipitado tres veces con una solución de lavado (tampón salino de fosfatos 0,138mmol/L, pH-7,4 o cloruro de sodio 0,15mmol/L) a 4°C. En cada lavado, tras aspirar el sobrenadante y evitando tocar el precipitado con la pipeta de aspiración, se añade solución de lavado hasta completar el mismo volumen del inicio. Se debe conseguir una completa resuspensión del crioprecipitado, mezclando por inversión, antes de proceder a centrifugar cada vez a 4°C durante 10min a 1.000xg. Después de los tres lavados sucesivos, se vuelve a resuspender el crioprecipitado con solución salina hasta recuperar el volumen inicial, e incubamos durante una hora a 37°C antes de proceder a su estudio21,35.
Una vez obtenido y preparado el crioprecipitado, se debe comprobar que se ha efectuado correctamente su aislamiento mediante la realización de una electroforesis, en gel de agarosa de alta resolución o capilar de zona, del crioprecipitado resuspendido y calentado a 37°C y del sobrenadante del suero tras la precipitación. Si el aislamiento se ha realizado de forma adecuada, en el precipitado no se observará la banda de albúmina ni en el sobrenadante las correspondientes al crioprecipitado11,21.
Medida de la concentración de proteína en el crioprecipitadoLos métodos que pueden utilizarse para la medida de la concentración de proteína en el precipitado son los métodos de Lowry o la lectura de la absorbancia a 280nm de una alícuota del crioprecipitado aislado. En los dos métodos, se debe utilizar una preparación de gammaglobulina humana purificada para realizar la curva de calibración Otros métodos colorimétricos propuestos han tenido escasa implantación32. Además de los colorimétricos, se pueden utilizar también métodos basados en la difusión en gel de agarosa. El procedimiento consiste en escanear la imagen digital del anillo de precipitación formado en una placa de gel de agarosa refrigerada donde ha tenido lugar la difusión. El área integrada a partir de la imagen, se corresponde con una concentración de proteína37.
Identificación del crioprecipitadoDependiendo de los requisitos clínicos o de investigación y de la disponibilidad de cada laboratorio, pueden emplearse distintos procedimientos para identificar las proteínas presentes en el crioprecipitado y para diferenciar su carácter monoclonal o policlonal:
- -
Electroforesis en gel de agarosa de alta resolución y posterior inmunofijación son los métodos recomendados en la práctica diaria, aunque en casos de crioprecipitados muy pequeños carece de suficiente capacidad de detección11,20.
- -
Electroforesis en gel de poliacrilamida e inmunotransferencia. Esta última ofrece mayor sensibilidad analítica que la inmunofijación, y tiene la ventaja de que necesita muy poca cantidad del crioprecipitado6,38.
- -
Electroforesis bidimensional en gel de poliacrilamida. Presenta mejor capacidad de detección que la electroforesis en gel de agarosa de alta resolución y la inmunofijación39.
- -
Electroforesis capilar10,21,35, método relativamente reciente que presenta la ventaja de su rapidez al estar automatizado. Permite además la posterior identificación del componente monoclonal por inmunosustracción, inmunotipado o inmunodesplazamiento. Se han descrito una serie de ventajas e inconvenientes con respecto a los métodos anteriormente mencionados, pero se aconseja acumular más experiencia antes de recomendar su empleo para esta aplicación.
- -
En los últimos años se ha propuesto también la citometría de flujo, principalmente por su utilidad en la detección de pequeñas cantidades de crioprecipitado40.
Tras la detección de una crioglobulina, se precisa realizar en otra muestra de suero del paciente un estudio que incluya una electroforesis de proteínas e identificación del componente monoclonal (crioglobulinemias de los tipos I y II) con caracterización del isotipo, mediante métodos inmunoquímicos (inmunofijación). El estudio se puede completar con la medida de la concentración de las inmunoglobulinas, componentes C3 y C4 del complemento y factores reumatoides6,21,35.
En todos estos procesos deberá tenerse en cuenta la temperatura del suero, para evitar pérdidas de proteínas por crioprecipitación, que podrían dar lugar a resultados falsos negativos11,21,33,34.
Dada la asociación de crioglobulinemia con procesos linfoproliferativos, autoinmunes e infecciosos, se debe descartar la existencia o no de alguna de estas patologías asociadas. A su vez, en los pacientes con crioglobulinemia mixta es preciso estudiar siempre los marcadores de infección para el virus de la hepatitis C, tanto los anticuerpos en la sangre del paciente como la detección de la carga viral y el genotipo y subtipo. También es recomendable realizar un estudio de los marcadores de infección para otros virus (virus de la hepatitis B, virus de la inmunodeficiencia humana), así como una serología autoinmune que incluya los siguientes anticuerpos: antinucleares, anti-dsNA, anti-Ro/la y antipéptidos citrulinados, incluso en aquellos pacientes ya diagnosticados de una enfermedad infecciosa por el virus de la hepatitis C21,25.
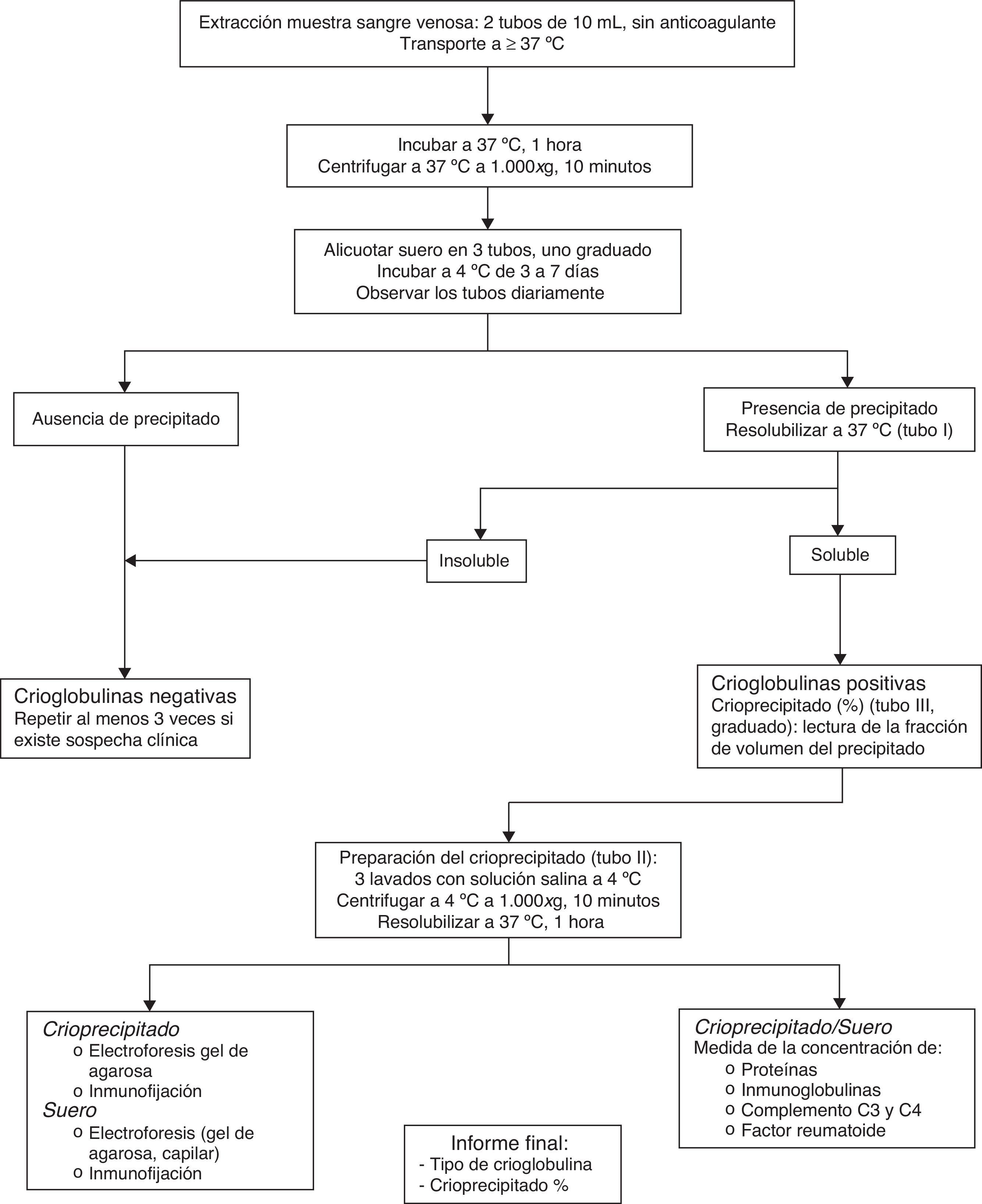
En la figura 1 (algoritmo de trabajo) se resume la metodología de estudio de las crioglobulinas21.
Algoritmo para el estudio de crioglobulinas.
Modificado de Sargur et al.21.
- 1.
La mayor variabilidad de los resultados en el estudio de las crioglobulinas se produce en la fase preanalítica, por lo que deben establecerse unas instrucciones muy estrictas con respecto a la temperatura durante la obtención, transporte y manipulación de las muestras hasta tener aislado el crioprecipitado11,21.
- 2.
Los métodos colorimétricos para medir la concentración de proteína en el crioprecipitado deben emplear gammaglobulina humana purificada para realizar la curva de calibración. En el estudio de la composición de una crioglobulina, los métodos a utilizar deben ser la inmunofijación en gel de agarosa o la inmunotransferencia, dependiendo de la disponibilidad de cada laboratorio11,20,32,38.
- 3.
Se debe realizar la electroforésis del crioprecipitado resuspendido y calentado a 37°C y del sobrenadante del suero tras la precipitación, para confirmar que el aislamiento del precipitado se ha llevado a cabo adecuadamente10,21.
- 4.
Un resultado negativo no debe excluir la presencia de crioglobulinemia, debido a la posibilidad de un falso negativo causada por una inadecuada recolección o técnicas de laboratorio no adecuadas. Por ello, ante un resultado negativo se debe repetir de forma seriada el estudio de crioglobulinas si clínicamente está indicado21,41.
- 5.
Una vez caracterizado el crioprecipitado, se precisa realizar en otra muestra de suero del paciente una electroforesis de proteínas e identificación del componente monoclonal por inmunofijación. Dependiendo de las condiciones clínicas y del tipo de crioglobulinemia (tipos I y II), puede estar indicado además completar el estudio con la medida de la concentración de las inmunoglobulinas, componentes C3 y C4 del complemento y factores reumatoides6,21,35.
- 6.
En las crioglobulinemias mixtas es preciso realizar siempre un estudio de los marcadores de infección para el virus de la hepatitis C. Además, es conveniente estudiar los marcadores de infección para otros virus como el de la hepatitis B y el de la inmunodeficiencia humana, así como realizar una serología autoinmune que incluya los anticuerpos antinucleares, anti-dsDNA, anti-Ro/la y antipéptidos citrulinados2,21.
Los autores declaran no tener ningún conflicto de intereses.
Composición de la Comisión de Proteínas: M.C. Cárdenas Fernández, C. Castillo Pérez, M. Fernández García, A. Gella Concustell, J. Jiménez Jiménez, G. Marcaida Benito, D. Pérez Surribas (Presidente), E. Pitters Pérez, T. Rodríguez González, C. Valldecabres Ortiz, E. Zapico Muñiz.
Este documento tiene la conformidad de las tres Sociedades como Recomendación profesional en el ámbito del Laboratorio Clínico.
Este documento es una revisión del elaborado en 2001 por parte de la Comisión de Proteínas de la Sociedad Española de Bioquímica Clínica y Patología Molecular1 (ver anexo). Entre las modificaciones introducidas están la descripción de las diferentes causas implicadas en la patogénesis del daño tisular, los criterios de transporte de las muestras, las nuevas metodologías para detección e identificación del crioprecipitado, así como las indicaciones para realizar un estudio de crioglobulinas en ciertas condiciones clínicas o en base a determinados hallazgos de laboratorio.