Para la moderna cirugía reconstructiva, hoy día, sigue siendo un desafío la reconstrucción de defectos óseos como consecuencia de traumatismos, tumores, infecciones, malformaciones, etc. La necesidad de iniciar la regeneración del hueso para restaurar esas deficiencias ha llevado, en estas últimas décadas, al desarrollo de diferentes métodos y materiales biocompatibles (metales1-3, cerámicas4,5, polímeros6 y compuestos7,8).
Es en el campo de la Cirugía Ortopédica y Traumatología, Neurocirugía, Cirugía Oral y Maxilofacial en donde biomateriales bioactivos de síntesis tal como la hidroxiapatita (HA), β-fosfato tricálcico (β-FTC) y compuestos de ambos (HA + β-FTC) han sido utilizados para la reparación del tejido óseo9 aprovechando sus propiedades relacionadas con la biocompatibilidad, osteoconducción, osteointegración, en ocasiones osteoinducción y diversos grados de biodegradación10,11.
Estos aspectos han sido estudiados principalmente in vivo12 examinando materiales de recubrimiento semanas y meses después de su implantación, con el inconveniente de que no es posible observar los fenómenos precoces que pueden tener lugar en la intercara implante-lecho receptor. Por otra parte, mientras que el uso de modelos animales resulta esencial para obtener información acerca de la respuesta biológica a estos implantes, sus resultados son difíciles de interpretar a nivel celular debido a los numerosos y complejos procesos que se ponen en marcha después de la implantación de un material extraño.
Es obvio que modelos de estudio in vitro basados en técnicas de cultivo de células específicas son fundamentales en el estudio de la respuesta temprana del tejido receptor al material implantado cuando pretendemos evaluar un material para su potencial uso como relleno, recubrimiento o matriz, y sin los inconvenientes mencionados de los modelos in vivo.
El objetivo de este trabajo ha sido estudiar in vitro el comportamiento de células osteoblásticas de origen humano (OH) y su respuesta en presencia de una cerámica porosa de HA por medio de técnicas de cultivo de tejidos utilizando métodos de cuantificación y determinación de las propiedades características de estas células.
MATERIAL Y MÉTODO
Material
El biomaterial empleado en nuestro estudio fue una cerámica de fosfato cálcico (FC) macroporosa de porosidad abierta de HA [Ca10(PO4)6(OH)2]. La porosidad global fue del 60%, de la que el 20% correspondía a macroporos de entre 100 y 400 µm de diámetro y el 40% restante lo constituían microporos de 5 µm que interconectaban los macroporos. Se construyeron piezas en forma de disco de 6 mm de diámetro y 1 mm de altura y esterilizadas por medio de radiación gamma a dosis de 2,5 Mrad.
El material fue caracterizado mediante difracción de rayos-X (XRD) y se obtuvo el espectro (FTIR) por medio de un espectrómetro Nicolet Nexos. El tamaño del poro fue determinado por intrusión de mercurio mediante un porosímetro Micromeritics. La determinación de la concentración de elementos químicos se realizó con un sistema de dispersión de energía (MEB-EDX).
Previamente a la siembra las muestras del material fueron incubadas en medio de cultivo durante dos horas a 37 °C.
Aislamiento y cultivo de osteoblastos humanos
El diseño experimental fue aprobado por el Comité de Bioética de nuestro centro y todos los pacientes firmaron un consentimiento informado.
Se obtuvieron fragmentos de tejido óseo esponjoso de cabezas femorales de pacientes de ambos sexos seleccionados de modo aleatorio (rango de edad: 65-70 años) sometidos a cirugía electiva para sustitución articular, diagnosticados de osteoartrosis primaria y sin antecedentes de enfermedades sistémicas relacionadas con el tejido óseo.
Pequeñas muestras óseas de 1-2 mm sin tejidos blandos adheridos ni cortical se lavaron en buffer fosfato (PBS) con penicilina (100 u/ml), estreptomicina (100 µg/ml) y anfotericina B (2,5 µg/ml) e incubadas con colagenasa tipo XI (1,25 mg/ml en PBS) durante 15 minutos a 37 °C. El producto de la digestión se filtró (malla de 100 µm), se centrifugó durante 10 minutos a 200 xg y seguidamente se sembró. Otra parte del sedimento fue resuspendido en medio de cultivo y se estimó la viabilidad e integridad de la membrana celular mediante tinción vital con azul tripán (0,5% en solución salina) y solución salina en proporción 1:1. Las células fueron contadas en una cámara de Neubauer.
El medio de cultivo utilizado fue una mezcla 1/1 de DMEM (Dulbecco's Modified Eagle Medium, Gibco) y Ham's F12 (Gibco) suplementado con un 10% de suero fetal de ternera (FCS, Gibco) y antibióticos de rutina (penicilina, 100 u/ml y estreptomicina, 100 µg/ml).
El medio se renovó a las 24 horas después de la siembra y posteriormente cada tres días. La incubación se realizó a 37 °C en atmósfera de 10% CO2 y humedad relativa del 95%.
El primer subcultivo se realizó a los 7 días en frascos de 25 cm2. Las células fueron separadas del frasco de cultivo mediante incubación con tripsina-EDTA (0,1 mg/ml-0,2 mg/ml) durante 6 minutos.
Identificación y caracterización de las células aisladas
Las células fueron identificadas y caracterizadas como osteoblastos por medio de: a) criterios morfológicos mediante microscopía de contraste de fases (MCF) y microscopía electrónica de barrido (MEB) y b) expresión de marcadores osteoblásticos tales como la producción de fosfatasas alcalinas (FA), osteocalcina (OC), colágeno tipo I y mineralización in vitro.
La producción de FA fue determinada utilizando el test 86-R (Sigma) y su cuantificación con el Kit 104 (Sigma). La OC fue detectada por inmunoensayo mediante el kit osteocalcina humana (Nichols Institute Diagnostics). El colágeno tipo I fue determinado con técnica inmunocitoquímica específica (Sigma Aldrich) y la mineralización in vitro fue detectada con la tinción de von Kossa.
El fenotipo osteoblástico fue comprobado en los cultivos primarios, en el primer subcultivo, y regularmente en los subcultivos sucesivos para controlar el mantenimiento de las propiedades específicas de estas células en cultivo.
Proliferación celular sobre la cerámica de hidroxiapatita
Se realizó una curva de crecimiento sobre la HA y en el plástico (control) en placas de cultivo de 96 pocillos. Las medidas obtenidas en todos los pocillos (HA y control) se realizaron por triplicado.
Para evitar la adhesión de las células a los pequeños espacios entre el disco y las paredes de los pocillos, éstos fueron cubiertos con agarosa al 0,6%. Una vez que el gel solidificó se depositó el disco de cerámica sobre el mismo con el fin de que al cuantificar el número de células únicamente se valorasen las células adheridas a la cerámica y no sobrevalorar su crecimiento. Seguidamente, se preparó una suspensión de células en medio de cultivo sin rojo fenol y se sembraron 5.000 células (15.600 células/cm2) en cada pocillo (cerámica y control). Las células fueron incubadas en las condiciones estándar descritas.
Para comparar la tasa de crecimiento sobre ambos materiales y obtener el tiempo de duplicación celular (doubling time) de las células que crecían sobre la cerámica se aplicó la técnica de reducción de las sales de tetrazolio (XTT), según el método de Jost et al13. El crecimiento de las células control se estimó diariamente y el de las células que crecieron sobre la cerámica cada 2-3 días durante 28 días.
Para comprobar si las células que crecían sobre la cerámica mantenían sus características morfológicas y funcionales, se tomaron muestras periódicamente para estudio con MEB y se determinó la actividad FA y la producción de OC.
En tres pocillos, con y sin cerámica, se utilizó medio de cultivo con rojo fenol para controlar las variaciones del pH.
Caracterización de las células sobre los discos de HA
Microscopía electrónica de barrido
Las células cultivadas sobre los discos fueron fijadas con glutaraldehído al 3% en tampón cacodilato 0,1M durante 30 minutos a 4 °C. Seguidamente, fueron lavadas y post-fijadas en tetraóxido de osmio durante 1 hora y deshidratadas a través de concentraciones crecientes de etanol. Las muestras fueron secadas mediante el método de punto crítico, recubiertas con oro y observadas con un microscopio electrónico de barrido Jeol T-6100.
Producción de fosfatasa alcalina
El ensayo se realizó sobre los discos sembrados con 5.000 células a los 15 y 30 días. Brevemente, se obtuvieron extractos de células resuspendiéndolos en agua destilada con Tritón X-100 al 1% y agitación durante 5 minutos. Seguidamente, se centrifugó a 8.945 xg durante 5 minutos y se tomaron 100 µl del sobrenadante para medir la actividad de la FA. El test fue realizado por triplicado incluyendo un control negativo, en el cual la enzima había sido inactivada mediante calor.
Producción de osteocalcina
Se utilizaron discos sembrados con 5.000 células. Para ello, añadimos 200 µl de medio de cultivo sin suero y con albúmina al 1%, 1,25-dihidroxivitamina D3 (Roche) (10-8M) y vitamina K (Konakion®) (10-8M). Para disolver la vitamina D3 se usó etanol, por lo que un pocillo control con la misma concentración de etanol se añadió también al estudio.
Los cultivos fueron incubados durante 48 horas. Seguidamente el medio fue recogido y almacenado a 80 °C hasta que se llevó a cabo el ensayo.
Estudio estadístico
Para la comparación de las curvas de crecimiento de los OH sobre la cerámica y en el plástico se realizaron ajustes logarítmicos rectificables minimocuadráticos aplicando:
Absorbancia = ao + a1 ln (días);
donde a1 refleja la velocidad de crecimiento de los cultivos (absorbancia por unidad de día).
Todas las pruebas fueron hechas por triplicado, calculando el coeficiente de correlación de cada uno de los ajustes y los tiempos de duplicación de los cultivos.
La comparación de las tasas de crecimiento fueron realizadas utilizando la «t» de Student.
RESULTADOS
Caracterización del material
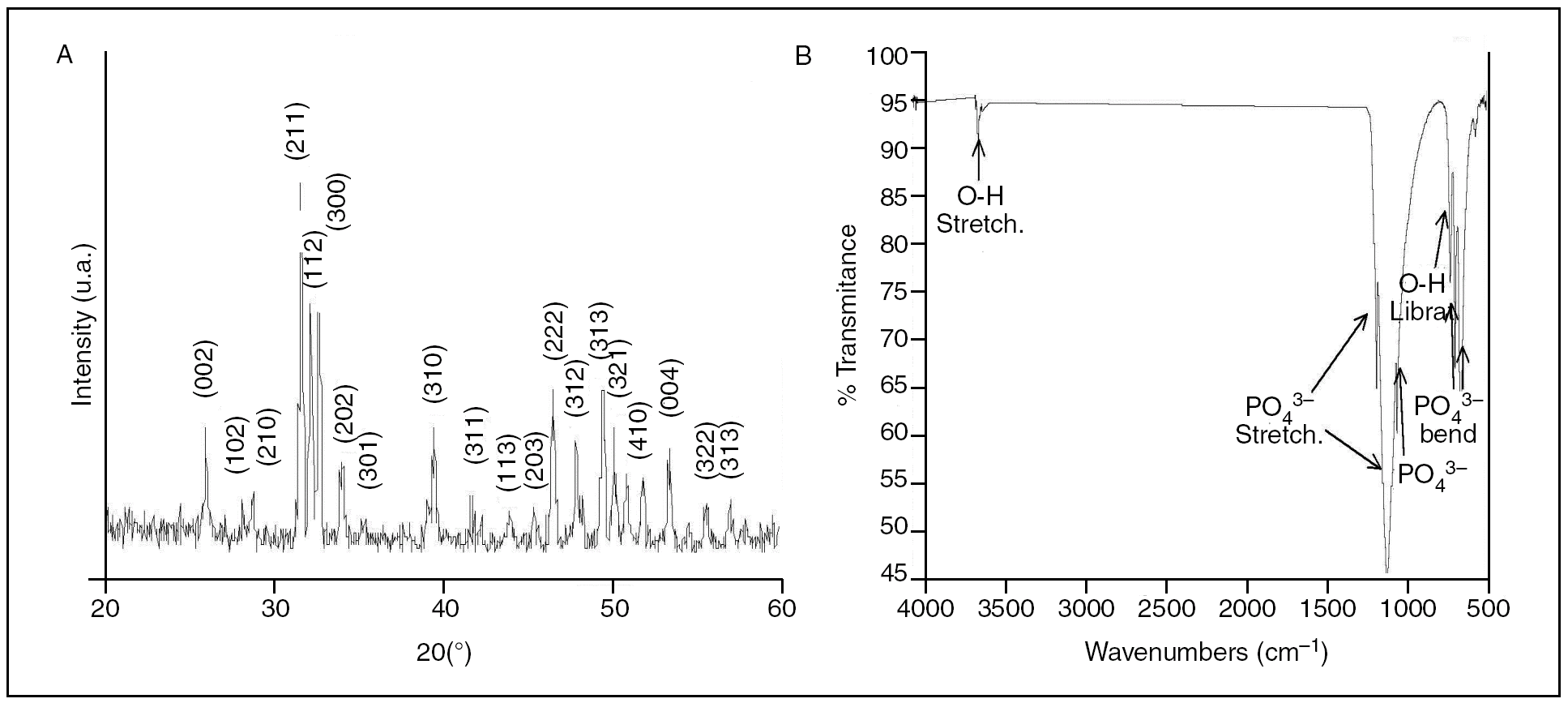
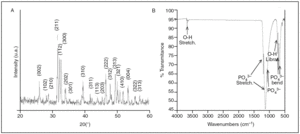
La figura 1A muestra las características de la cerámica utilizada en el estudio, obtenidas mediante difracción de rayos X. Todos los picos máximos son ocasionados por la fase apatítica cristalizada. No se observaron fases secundarias del tipo fosfato tricálcico u óxido de calcio. La figura 1B muestra el espectro obtenido por FITR del material cerámico con bandas de absorción características de la HA.
Figura 1. (A) Gráfico XRD y (B) espectro obtenido por FTIR de la cerámica estudiada. Los índices de Miller de la fase apatítica están indicados en el gráfico XRD.
El espectro mediante EDX mostró una composición química que corresponde a fosfato cálcico con una relación Ca/P próxima a 1,66, muy similar estequiométricamente a la HA. Mediante MEB se observaron numerosos macroporos de tamaño entre 100-400 µm dispersos sobre la superficie de la cerámica e interconectados entre ellos a través de microporos.
Identificación y caracterización de las células aisladas
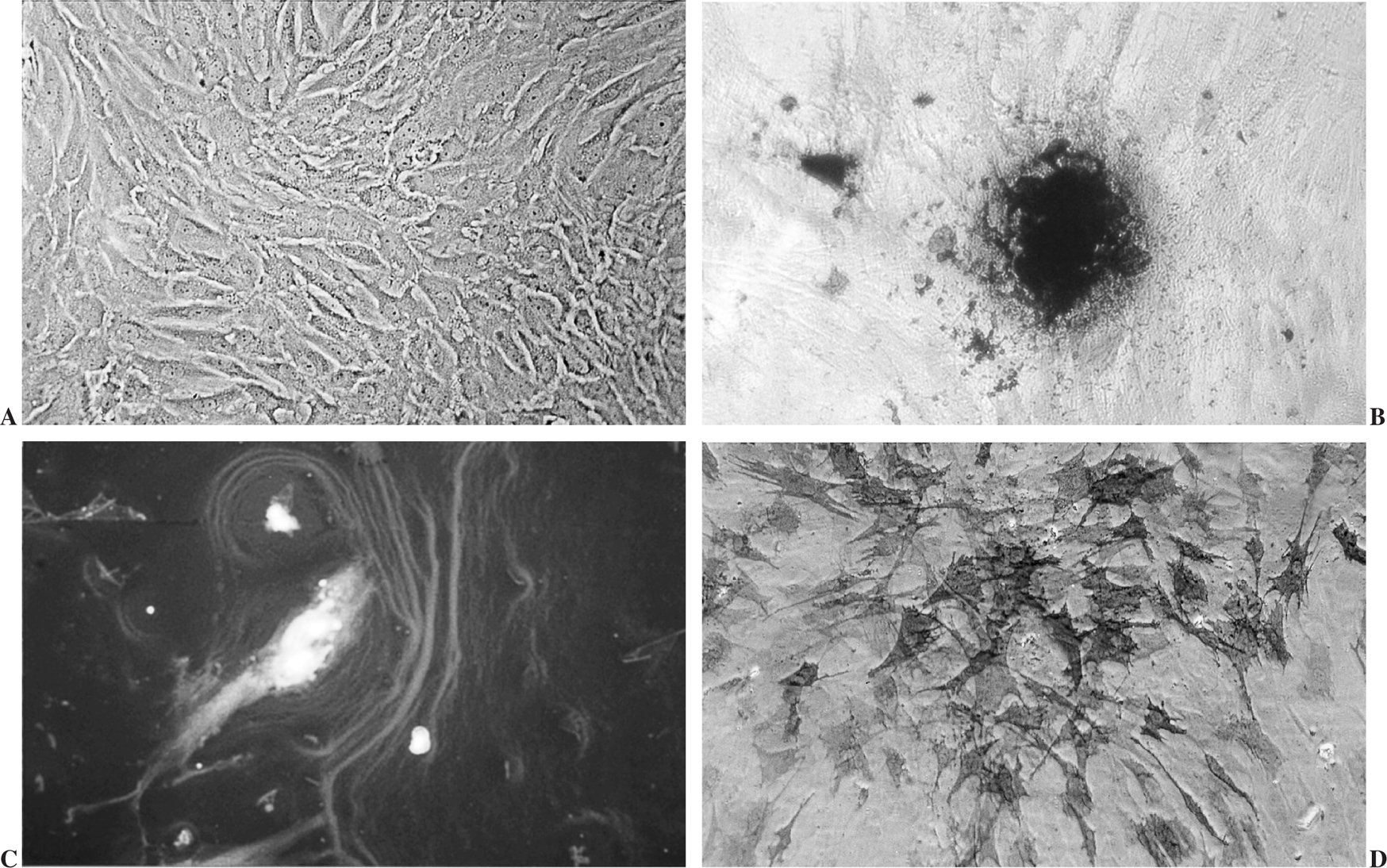
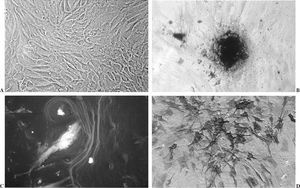
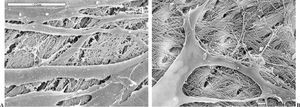
Las células aisladas presentaban al MCF la morfología y crecimiento característico de las células de estirpe osteoblástica, crecimiento en multicapas y formación de nódulos en los que se acumulaba material refringente que se teñía de color marrón oscuro con la técnica de von Kossa (fig. 2 A y B).
Figura 2.(A) Cultivo confluente, crecimiento multicapa; (B) nódulo de mineralización. Tinción Von Kossa; (C) célula y matriz extracelular marcada por inmunofluorescencia; (D) células teñidas fosfatasas alcalinas positivas.
Mediante las pruebas bioquímicas e inmunocitoquímicas aplicadas y descritas se comprobó la producción de colágeno tipo I, FA y OC, por lo que las células aisladas se identificaron como osteoblastos (fig. 2 C y D).
Proliferación celular sobre la cerámica de hidroxiapatita
Se realizaron tres curvas de crecimiento de dos líneas celulares diferentes sembradas sobre cerámica y en plástico.
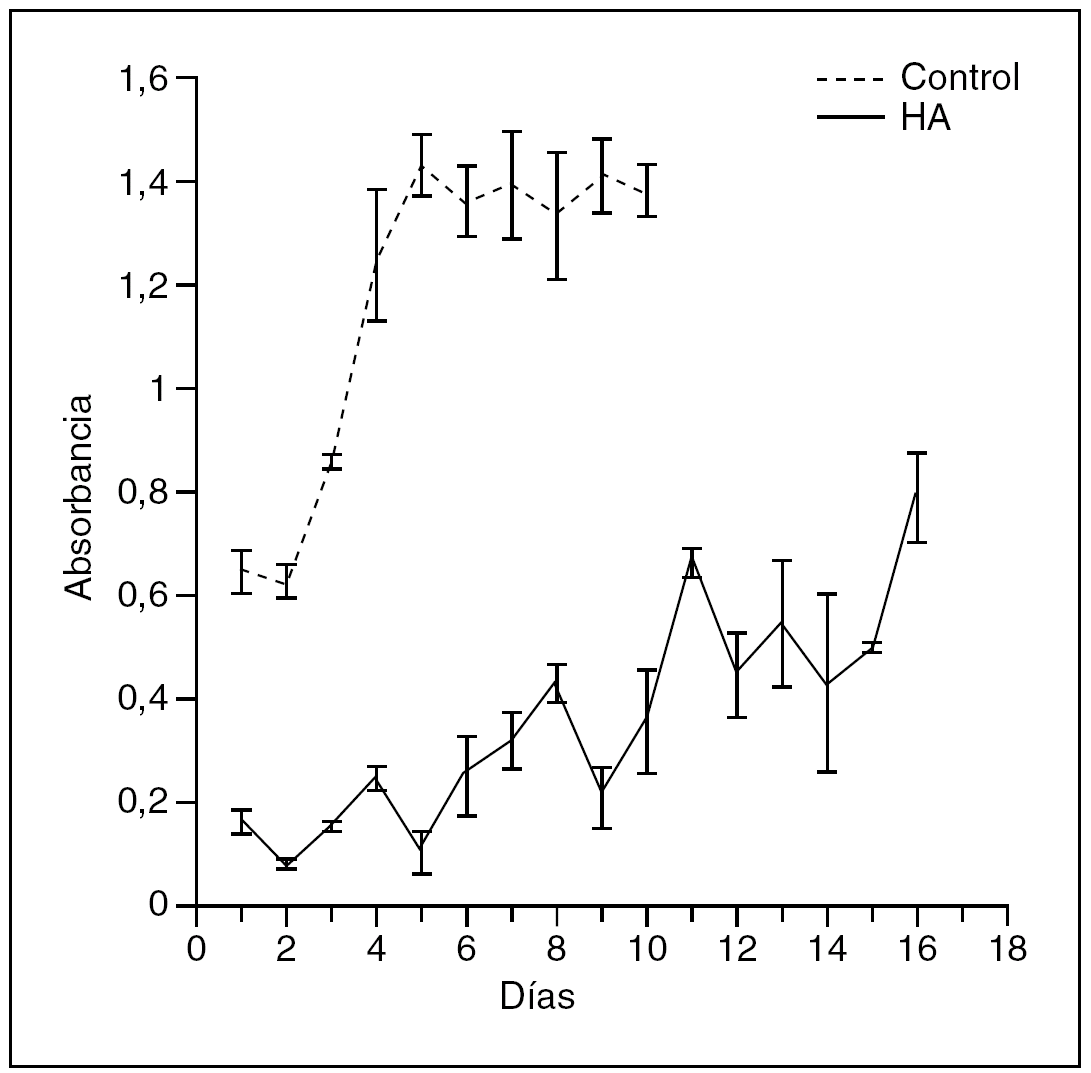
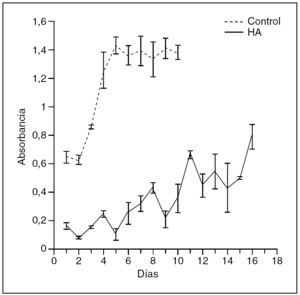
En la figura 3 mostramos una de ellas. En las primeras 24 horas, en el cultivo control, de las 5.000 células sembradas el 95% se adhirieron al plástico, comenzando un rápido crecimiento exponencial entre las 24 y las 48 horas, alcanzando la fase estacionaria al cuarto día. La misma línea celular creció sobre la HA reflejando inicialmente unos valores de absorbancia claramente inferiores al control (20%), lo que significa que el cultivo se inició probablemente con un número inferior de células. Como se observa en la curva, las células necesitaron de 4 a 5 días para adaptarse a la cerámica, y aunque el crecimiento en diferentes discos fue bastante irregular, es claro que aumentó el número de células que crecieron sobre los discos, aunque el día 18 del estudio no alcanzaron la fase estacionaria.
Figura 3. Curvas de crecimiento obtenidas en el plástico (control) y cerámica de hidroxiapatita.
Estudio morfológico ultraestructural
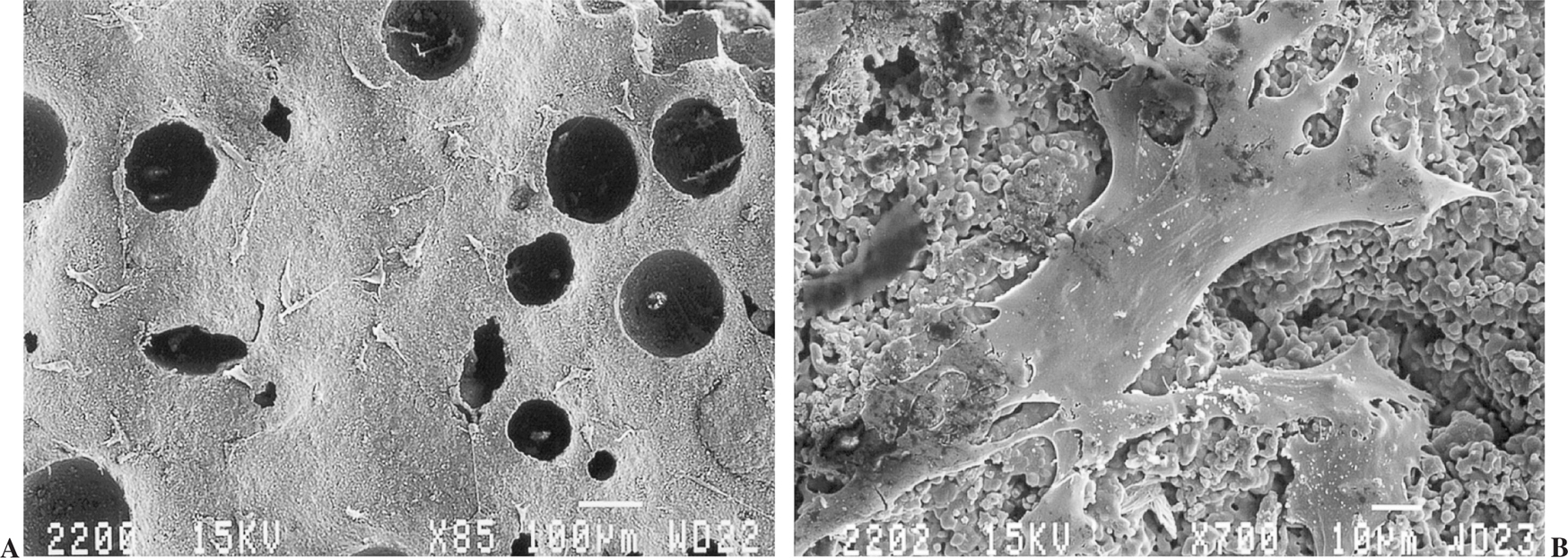
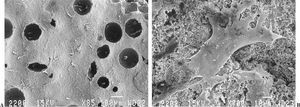
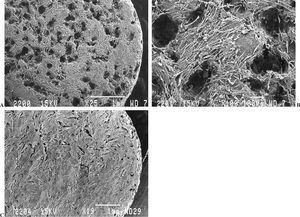
En las primeras 24 horas (fig. 4 A y B) unas pocas células se adhirieron a la superficie de la cerámica de forma aislada o en pequeños grupos dispersos, y presentaban la morfología característica de las células osteoblásticas: largas y aplanadas con múltiples y extensas prolongaciones citoplasmáticas que se extendían sobre la superficie de la cerámica incrementando el área de contacto con ella.
Figura 4.(A) Cerámica con algunas células adheridas a la superficie a las 24 horas, sin evidencia de matriz colágena extracelular (microscopio electrónico de barrido, barra 100 µm); (B) detalle de célula adherida con múltiples prolongaciones citoplasmáticas que incrementan el área de contacto (microscopio electrónico de barrido, barra 10 µm).
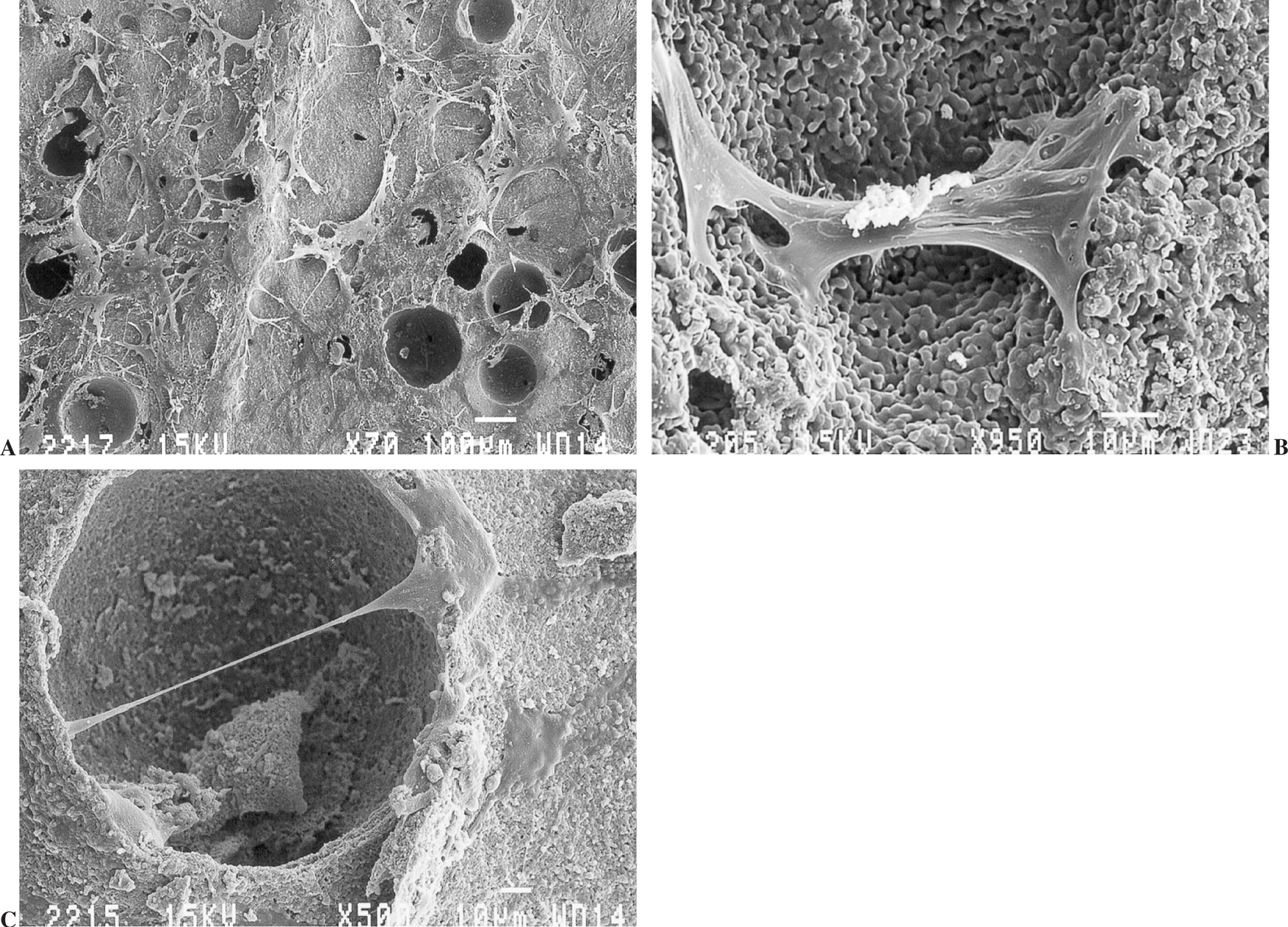
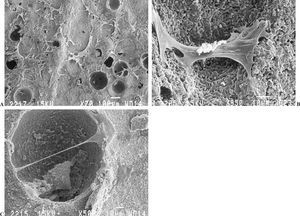
A los 7 días (fig. 5 A, B y C) se observó un gran número de cúmulos de células sobre el sustrato, así como un incremento de las interconexiones celulares. Algunas de éstas invadieron el fondo de los macroporos, mientras que otras extendieron filopodios por los bordes. La adhesión celular fue firme y directa. Durante este período fue posible observar sobre la superficie de la cerámica algunas fibras aisladas de colágeno dispersas y sin orientación definida.
Figura 5.(A) Crecimiento de osteoblastos sobre la cerámica a los 7 días en cultivo (microscopio electrónico de barrido, barra 100 µm); (B y C) algunas células con filopodios extendidos en los límites de los macroporos (microscopio electrónico de barrido, barra 10 µm).
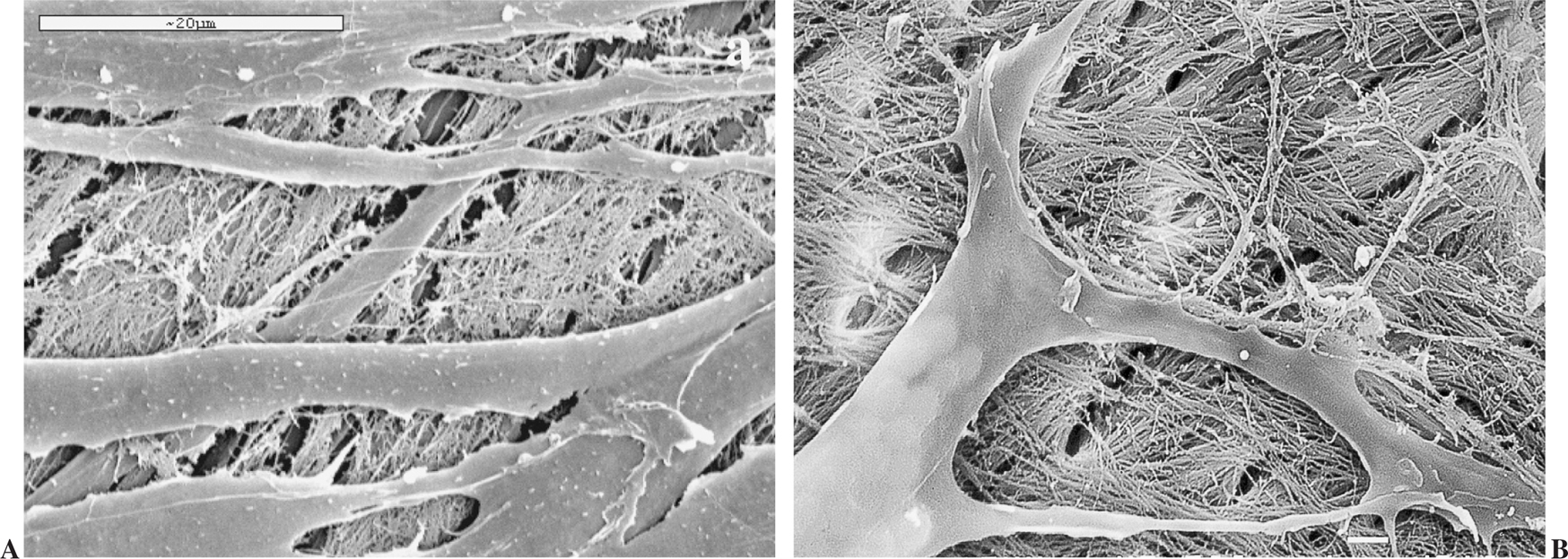
A los 14 días (fig. 6 A y B) las células cubrieron la cerámica en extensas zonas con abundante síntesis de fibras de colágeno en los espacios intercelulares y depositadas directamente sobre la superficie de la cerámica.
Figura 6.(A) Cerámica a los 14 días en cultivo cubierta por osteoblastos y con abundante síntesis de fibras de colágeno (microscopio electrónico de barrido, barra 20 µm); (B) detalle de la figura anterior (barra 1 µm).
Entre los días 21 y 28 (fig. 7 A, B y C) la proliferación celular dio lugar a la formación de una capa continua sobre la superficie de la cerámica haciendo difícil reconocer las células de forma individualizada. Además, se observó un mayor número de fibras de colágeno, esta vez con una disposición más organizada. Al final de este período, día 28, es evidente la mayor densidad celular que llega a recubrir completamente la superficie de la cerámica, siendo imposible distinguir espacios libres del material.
Figura 7.(A) Proliferación celular a los 21 días (microscopio electrónico de barrido, barra 1 mm); (B) detalle ampliado (barra 100 µm); (C) cerámica a los 28 días en cultivo con superficie completamente cubierta por células (microscopio electrónico de barrido, barra 1 mm).
Estudio funcional
La determinación de FA y OC de las células que crecieron sobre la cerámica de HA, a los 15 y 30 días, mostraron actividad FA positiva y niveles de OC de rango similar a las obtenidas en las determinaciones realizadas en los cultivos confluentes de los controles (tabla 1).
Análisis estadístico
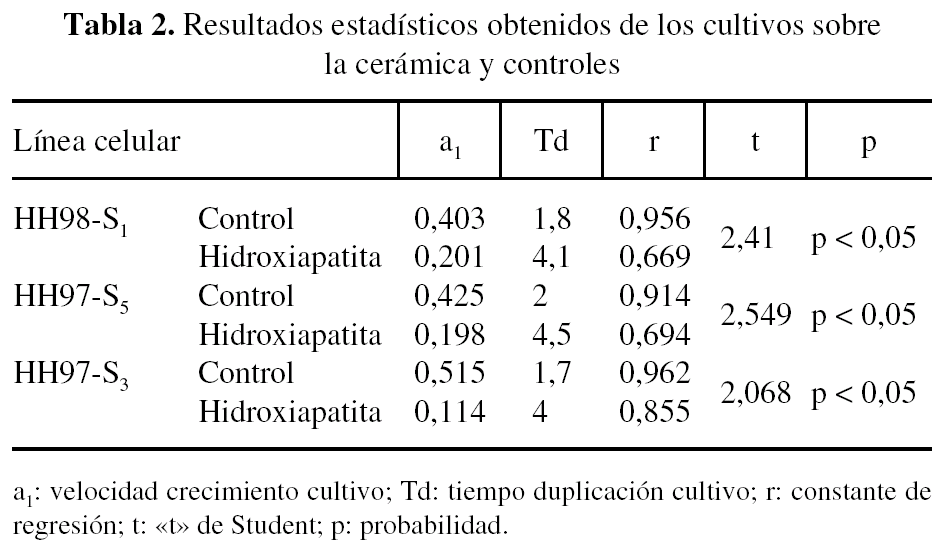
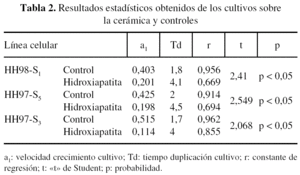
Del estudio estadístico (tabla 2) se desprenden diferencias cualitativas entre los osteoblastos que crecieron sobre la cerámica y los controles, como una mayor dispersión en los datos obtenidos de los cultivos sobre las cerámicas, lo que disminuyó la potencia de los contrastes estadísticos, aunque los coeficientes de correlación de los ajustes fueron significativos.
Comparando las velocidades de crecimiento, en los tres casos estudiados, observamos que los contrastes de igualdad de las pendientes de los ajustes logarítmicos permite apuntar diferencias entre el crecimiento sobre las cerámicas y controles, en el sentido de que los controles crecieron a mayor velocidad.
DISCUSIÓN
Hasta la fecha se han utilizado diversas fuentes de células óseas de origen animal y humano para el estudio del tipo de respuesta a diferentes biomateriales, aunque la bibliografía se centra más en osteoblastos especialmente de origen humano14-16 en líneas osteogénicas establecidas MC3T3-E117 y más recientemente, en células precursoras multipotenciales procedentes de la médula ósea (Mesenchymal Stem Cells), capaces de diferenciarse en células osteogénicas, adipogénicas, fibroblásticas y reticulares para su aplicación en el campo de la ingeniería tisular18-20.
En nuestro estudio referido al comportamiento de OH frente a una cerámica porosa de HA, hemos intentado obtener un modelo in vitro por medio de un cultivo de células específicas y diferenciadas, directamente implicadas en la formación de la intercara biomaterial-hueso huésped cuando se lleva a cabo un implante in vivo. El modelo nos ha permitido desarrollar un estudio de biocompatibilidad a través de la evaluación cualitativa y cuantitativa de la citocompatibilidad del material con los OH aislados, al mismo tiempo que nos posibilita comprobar su eficiencia para evaluar el comportamiento de los OH y su respuesta a la HA estudiando su crecimiento sobre la cerámica y sus características morfológicas y funcionales.
En lo que respecta al crecimiento celular coincidimos con diversos autores21,22 en que la principal dificultad es cuantificar la proliferación celular sobre el sustrato o matriz. En este ensayo para realizar el recuento de las células, tanto en el plástico como sobre la HA, hemos utilizado el método de reducción del XTT, un método cuantitativo que ha demostrado ser sensible para la medida de la viabilidad celular, proliferación y activación en otros sistemas celulares13,21,22. Sin embargo, y a pesar de todas estas ventajas, hasta ahora no ha sido aplicado en el estudio de proliferación celular sobre biomateriales. Aunque se trata de un procedimiento más caro e inestable que otras sales de tetrazolio (MTT, MTS, etc.), el uso del XTT tiene otras ventajas, como que los productos resultantes de su reducción son solubles en agua, lo que significa que su liberación al medio de cultivo fue sencillo y particularmente útil en el caso de las células que crecieron sobre la HA al simplificar el proceso. Aunque esta técnica es generalmente considerada menos eficiente que el método MTT, Stevens y Olsen22 demostraron que los resultados son similares utilizando XTT en presencia de menadiona (vitamina K3), modificación que ha sido incluida en nuestra metodología.
Un aspecto a tener en consideración es que en la mayoría de los estudios in vitro publicados el material se utiliza en forma de microgránulos13,14,16,23 o en discos de diversos tamaños que no ocupan completamente la superficie del frasco de cultivo en ningún caso5,24. Esto hace que la proliferación celular sea a menudo sobreestimada, puesto que se contabilizan células, que aunque expuestas al material, no crecen sobre él, sino sobre el plástico. Para evitar esta circunstancia y asegurarnos de que el total de las células contadas correspondían al número de células que estaban adheridas y crecieron en la cerámica y no en los pequeños espacios entre el disco y las paredes de los pocillos, cubrimos éstos con gel de agarosa, capaz de inhibir la adhesión celular sobre el mismo. Con este detalle la medida realizada correspondió a las células que crecieron exclusivamente sobre la cerámica.
En el estudio de la curva de crecimiento representada en la figura 3 podemos observar cómo las células proliferaron sobre la cerámica, aunque mostraron un crecimiento más lento cuando lo comparamos con el control. Esto probablemente fue debido a que la proliferación celular comenzó con un número inferior de células adheridas a la cerámica a las 24 horas en comparación con el control, por lo que el crecimiento sobre la cerámica se mantuvo en valores inferiores. De hecho, el número de células que se adhirieron a la HA en las primeras 24 horas osciló entre un 17 y 23% respecto del control, observaciones similares a las descritas por Cheung y Haak24, que comprobaron que no todas las células sembradas se adhirieron a la cerámica y, como consecuencia, para sus mediciones tomaron como número inicial de células adheridas el que obtuvieron de la liberación de la cerámica a los dos días.
En nuestro estudio quizás el mayor inconveniente que tuvimos en el recuento del número de células adheridas a la cerámica fue el que no se adhiriera un número homogéneo de éstas, lo que provocó la dispersión de los datos de las mediciones. Esta situación ha dificultado el cálculo de las pendientes de las curvas de crecimiento sobre la cerámica, si bien el buen coeficiente de correlación del ajuste logarítmico permitió compararlas respecto a los controles.
Por consiguiente, aunque es evidente que existen diferencias en las pendientes (velocidad de crecimiento) al observar ambas curvas, cerámica y control, el método estadístico nos ha llevado a apoyar lo que en realidad estamos observando, y es que si bien los controles crecen a mayor velocidad, también se produce crecimiento celular sobre la cerámica. Estos hallazgos han sido contrastados mediante los estudios con MEB de la adhesión, extensión y proliferación de los OH sobre los discos de HA. En este sentido, coincidimos con Courteney-Harris et al25 en que los OH mostraron la misma morfología sobre la HA que la observada sobre el plástico. Éstos se adhirieron y multiplicaron, siendo capaces de colonizar el interior de los poros, al mismo tiempo que formaron una matriz colágena depositada directamente cubriendo la superficie de la cerámica, constituyendo la intercara célula-sustrato. De igual modo, observamos que la síntesis de matriz extracelular se incrementó con el tiempo en cultivo y se disponía de forma organizada en algunas áreas de la superficie, en contraposición con los hallazgos de Serre et al15, que observaron que la matriz extracelular formada sobre cerámicas de HA nunca mostró una organización precisa.
En este estudio hemos podido comprobar que la cerámica utilizada no mostró signos de toxicidad sobre las células adheridas, al no observarse, tras el primer cambio de medio, pérdida de adherencia espontánea o la presencia de células muertas suspendidas en el medio de cultivo, así como alteración de los parámetros bioquímicos (FA y OC).
Por tanto, con la metodología empleada en este trabajo hemos podido verificar que las células osteoblásticas humanas fueron capaces de colonizar la cerámica de HA, mantuvieron su fenotipo y produjeron matriz colágena extracelular, por lo que el material objeto del estudio podría ser considerado, en el campo de la ingeniería tisular, como un sustrato adecuado para soportar el crecimiento de osteoblastos humanos, constituyendo un material híbrido con capacidad osteogénica y osteoinductiva. Incipientes estudios que estamos desarrollando nos permitirán conocer el potencial regenerativo de estas estructuras híbridas en la reconstrucción de defectos óseos críticos segmentarios en modelo animal.
Conflicto de intereses. Los autores no hemos recibido ayuda económica alguna para la realización de este trabajo. Tampoco hemos firmado ningún acuerdo por el que vayamos a recibir beneficios u honorarios por parte de alguna entidad comercial. Por otra parte, ninguna entidad comercial ha pagado ni pagará a fundaciones, instituciones educativas u otras organizaciones sin ánimo de lucro a las que estemos afiliados.
Correspondencia:
L. Meseguer-Olmo.
Puerta Nueva, 18-2A.
30008 Murcia. España.
Correo electrónico: meseguer@arrakis.es
Recibido: febrero de 2005.
Aceptado: noviembre de 2005.