La epifisiolisis de la cabeza femoral (ECF) se describe como el desplazamiento de la epífisis (cabeza femoral) respecto a la metáfisis (cuello) a través de la fisis. El término es confuso ya que es la metáfisis la que se desplaza en dirección anterosuperior mientras que la epífisis no se mueve y mantiene su posición respecto al acetábulo. La ECF se considera estable cuando el paciente es capaz de caminar e inestable cuando no puede hacerlo ni siquiera con ayuda de bastones. Los pacientes con ECF son adolescentes que presentan dolor en la región inguinal y/o en la rodilla asociado a cojera. El tratamiento de elección en las estables es la fijación in situ con un tornillo.
Slipped capital femoral epiphysis (SCFE) is characterized by displacement of the capital femoral epiphysis from the metaphysis through the physis. The term is confusing, because the metaphysis moves upward and outward while the epiphysis remains in the acetabulum. The SCFE is considered stable when the child is able to walk with or without crutches, and it is considered unstable when the child cannot walk with or without crutches. Patients with SCFE present with pain in the groin, knee and limp. The current treatment of stable SCFE is in situ stabilization with a single screw.
La epifisiolisis de la cabeza femoral (ECF) es la patología de cadera más frecuente en adolescentes. Típicamente afecta a pacientes con sobrepeso que acuden por cojera y dolor en la región de la cadera y/o la rodilla. En la ECF se produce un desplazamiento anterosuperior de la metáfisis respecto a la epífisis debido a una falta de contención en la fisis de crecimiento1. En raras ocasiones puede producirse un desplazamiento de la metáfisis en dirección posteroinferior y se denomina ECF en valgo2.
EpidemiologíaLa incidencia de ECF oscila según zonas geográficas, y es muy variable, desde el 0,2 por 100.000 habitantes en Japón hasta el 10 por 100.000 habitantes en Estados Unidos1. La incidencia de ECF varía significativamente entre las diferentes razas y es más frecuente en aquellos grupos con mayor índice de masa corporal. Se ha visto que en caucasianos la frecuencia es menor, de alrededor del 1 por 100.000, mientras que llega al 4,5 en habitantes de las islas del Pacífico, o del 2,2 en los que tienen antecedentes africanos3,4.
La obesidad es un factor presente en el 51-77% de los pacientes5,6. Aproximadamente el 50% de los pacientes se encuentran por encima del percentil 90 de peso5 y aproximadamente el 70% están por encima del percentil 807.
Es más frecuente en el periodo peripuberal. Loder et al.5 demostraron en un estudio observacional con más de 1.600 pacientes, que se producía a los 12 +/- 1,5 años en las niñas y los 13 +/- 1,7 años en los niños. En el momento del diagnóstico, aproximadamente el 80% de los niños tienen una edad comprendida entre los 12 y los 15 años en los niños y los 10 y 13 años en las niñas8.
También existe un alto índice de bilateralidad. La mayoría de las series reflejan una incidencia de entre el 18 y el 50%. Estudios recientes con seguimientos a largo plazo describen incidencias de hasta el 63% de los casos9. La variabilidad de cifras puede depender del método radiográfico elegido para el diagnóstico, la raza e incluso del método de tratamiento de la primera cadera afecta. Así, Hurley et al.10 demostraron que la prevalencia de afectación bilateral llegaba al 36% de los pacientes tratados con fijación in situ mediante agujas y solo del 7% en los casos tratados de forma ortopédica con inmovilización enyesada.
Clínicamente solo la mitad de los pacientes con una ECF bilateral muestran inicialmente una afectación bilateral. El mayor riesgo de desarrollar una afectación de la cadera contralateral inicialmente sana ocurre en los 18 primeros meses tras el primer desplazamiento5.
La edad de presentación es menor en los niños que inicialmente sufren una ECF unilateral y luego desarrollan una ECF bilateral que en los que no desarrollan una ECF bilateral. Diversos estudios han valorado los factores de riesgo asociados a la bilateralidad. Herrera-Soto et al.11 concluyeron que la madurez esquelética no era un factor de riesgo para la bilateralidad y recomendó la fijación contralateral en aquellos pacientes con ECF inestable grave. Riad et al.12 observaron que la edad cronológica es un factor predictivo para el desarrollo de ECF contralateral recomendando que todas las niñas por debajo de 10 años y los niños por debajo de 12 años con ECF unilateral debería considerarse la fijación contralateral. En los niños mayores de esta edad, el tratamiento debe valorarse en función de las condiciones personales (endocrinopatías…). Asimismo recomendaron la fijación contralateral de la cadera no afecta en aquellos pacientes con ECF inestable severa.
EtiopatogeniaEn la mayoría de los pacientes se desconoce la etiología. Se han descrito 3 factores etiopatogénicos: factores biomecánicos, factores bioquímicos y factores genéticos. Estos factores se combinan entre sí causando una fisis debilitada, que finalmente fracasa en el mantenimiento de la estructura de la cadera. Los factores mecánicos y traumáticos estarían relacionados con las formas agudas o inestables. Los factores hormonales estarían asociados con determinados rasgos morfológicos articulares y con una patología intrínseca degenerativa presente en las formas crónicas. También se han descrito casos de herencia genética relacionada con alteraciones en el colágeno tipo ii. La combinación de estos factores provoca una debilidad en la región fisaria y un aumento de las fuerzas de estrés a través de la fisis13. La disrupción fisaria se produce en la capa proliferativa e hipertrófica de la fisis de crecimiento14. Histopatológicamente se observa una disminución en el número de células y una pérdida de la disposición columnar característica de los condrocitos que se disponen de manera desorganizada en la fisis de crecimiento. También se describen alteraciones en la matriz extracelular14.
Entre los factores biomecánicos destaca la obesidad5-7,15. La mayoría de los pacientes presentan sobrepeso y este favorece un aumento de las fuerzas de cizallamiento sobre la fisis. Además se ha observado que la obesidad se asocia a menor anteversión femoral (la anteversión de la cabeza femoral normal en un adolescente es de unos 10,6°, mientras que en adolescentes obesos solo llega al 0,4°), que disminuye la eficacia biomecánica de la cadera15.
Otro factor mecánico que influye en la ECF es la mayor oblicuidad fisaria. Los pacientes con ECF presentan un aumento de 8° a 11° en la orientación vertical de la fisis en la cadera afecta mientras que en el cadera sana es de 4° a 5°.
Asimismo, el exceso de cobertura acetabular aumenta las fuerzas de estrés sobre la fisis y favorece su desplazamiento.
Los traumatismos podrían aumentar la facilidad del desplazamiento, aunque este último es un factor muy controvertido.
Existen también factores bioquímicos y hormonales implicados en el desarrollo de ECF. Es típica la aparición de ECF durante el periodo peripuberal5,8. En este periodo se produce un aumento de los niveles de hormona de crecimiento provocando un aumento de la tasa de proliferación condrocítica y un aumento de la altura de la zona hipertrófica. Estos cambios estructurales disminuyen la resistencia fisaria y favorecen el desplazamiento15. Entre las alteraciones hormonales destacan el hipotiroidismo, el panhipopituitarismo, alteraciones en la hormona de crecimiento y el hipogonadismo. Los estrógenos reducen la altura fisaria y aumentan su resistencia, mientras que la testosterona reduce la resistencia fisaria y permite el desplazamiento. Esto explicaría el predominio en varones, en pacientes tratados con GH y aquellos con alteraciones endocrinas de la relación testosterona/estrógenos.
Entre los factores genéticos encontramos las alteraciones en el colágeno tipo ii. Se ha confirmado una disminución en la expresión de colágeno tipo ii y proteoglicanos que afecta a la cantidad, la distribución y la organización de los componentes de la placa de crecimiento. La histología y la microscopía electrónica muestran deficiencias y anomalías en la red de soporte del colágeno y los proteoglicanos de la fisis. También existe una disminución del número de células en relación con la cantidad de matriz y los condrocitos son más pequeños que los de la población control. Estos cambios pueden ser causa o estar asociados con ECF16.
ClasificaciónLa clasificación tradicional de la ECF incluye el predeslizamiento, el deslizamiento agudo, el crónico y el agudo sobre crónico. Esta clasificación se basa en la historia clínica, la duración de los síntomas, la exploración física y las radiografías.
Consta de varias fases:
- 1.
Predeslizamiento. Clínicamente se caracteriza por debilidad, cojera y dolor en el muslo o la rodilla que aumenta con la actividad deportiva. Existe una disminución de la rotación interna de la cadera y del apoyo de la cadera afecta. Radiográficamente puede observarse osteopenia en fémur proximal o hemipelvis, rarefacción fisaria, ensanchamiento e irregularidad en la fisis proximal del fémur.
- 2.
Deslizamiento agudo (10-15%). Se caracteriza por un desplazamiento brusco a través de la fisis y una evolución clínica menor de 3 semanas. Los pacientes acuden por dolor agudo en la cadera, la cara medial del muslo o la rodilla afecta. El dolor puede ser tan intenso que impide la carga de peso. Clínicamente se presenta con un acortamiento, rotación externa del miembro y limitación de la movilidad, especialmente la rotación interna. Pueden presentar un antecedente traumático de baja energía. En el 90% de los pacientes con ECF aguda aparece una historia de un mes a 3 meses de duración, con síntomas prodrómicos moderados (dolor de cadera, muslo o rodilla, cojera) antes de que se produzca el episodio agudo17,18.
- 3.
Deslizamiento crónico (85%). Es el tipo de ECF más común y se caracteriza por la presencia de más de 3 semanas de síntomas, por lo que no es infrecuente el retraso en el diagnóstico. Los pacientes presentan dolor intermitente en la región inguinal, en la cara medial del muslo, la pantorrilla y la rodilla asociado a cojera. En la mitad de los casos el síntoma inicial es dolor en la rodilla19 con marcha antiálgica, pérdida de rotación interna, la abducción y la flexión de la cadera20. En esta etapa hay que buscar el signo de Drehmann: a medida que se flexiona la cadera, se produce de forma espontánea una rotación externa y abducción del miembro.
- 4.
ECF aguda sobre crónica. Son pacientes con síntomas crónicos en los que la cojera y el dolor se agravan de forma brusca impidiendo la marcha y la bipedestación.
La clasificación tradicional está basada en la memoria del niño y los padres y puede ser poco precisa. Por ese motivo, surgieron otras clasificaciones basadas en la estabilidad fisaria.
La clasificación clínica se basa en la capacidad de deambulación y la estabilidad fisaria. Se considera ECF estable cuando el paciente es capaz de caminar, con o sin muletas e inestable si el paciente es incapaz de deambular, con o sin muletas. Esta clasificación tiene valor pronóstico para el desarrollo de osteonecrosis; apareciendo hasta un 50% de osteonecrosis en las ECF inestables. Esto se debe al daño vascular causado en el desplazamiento inicial, en comparación con las ECF estables donde la necrosis es inexistente.
También existe una clasificación relacionada con la presencia o ausencia de derrame articular en la ecografía denominándose inestable si existe derrame articular y estable cuando este no está presente.
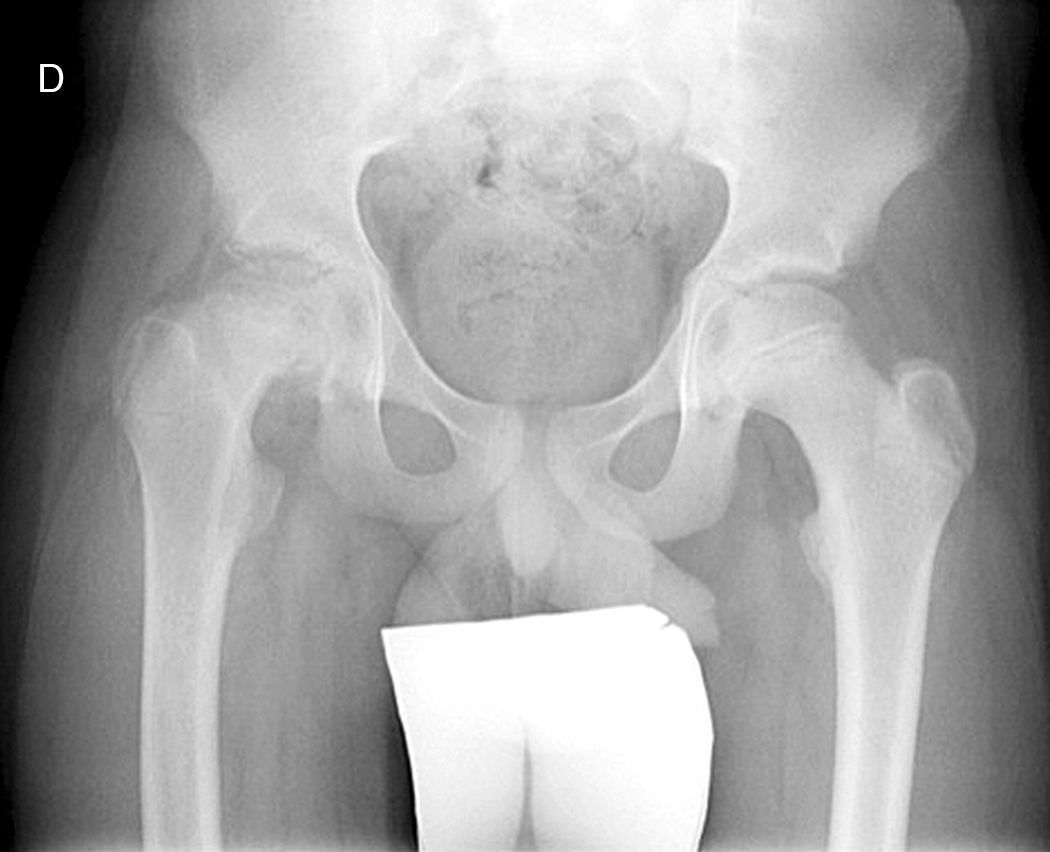
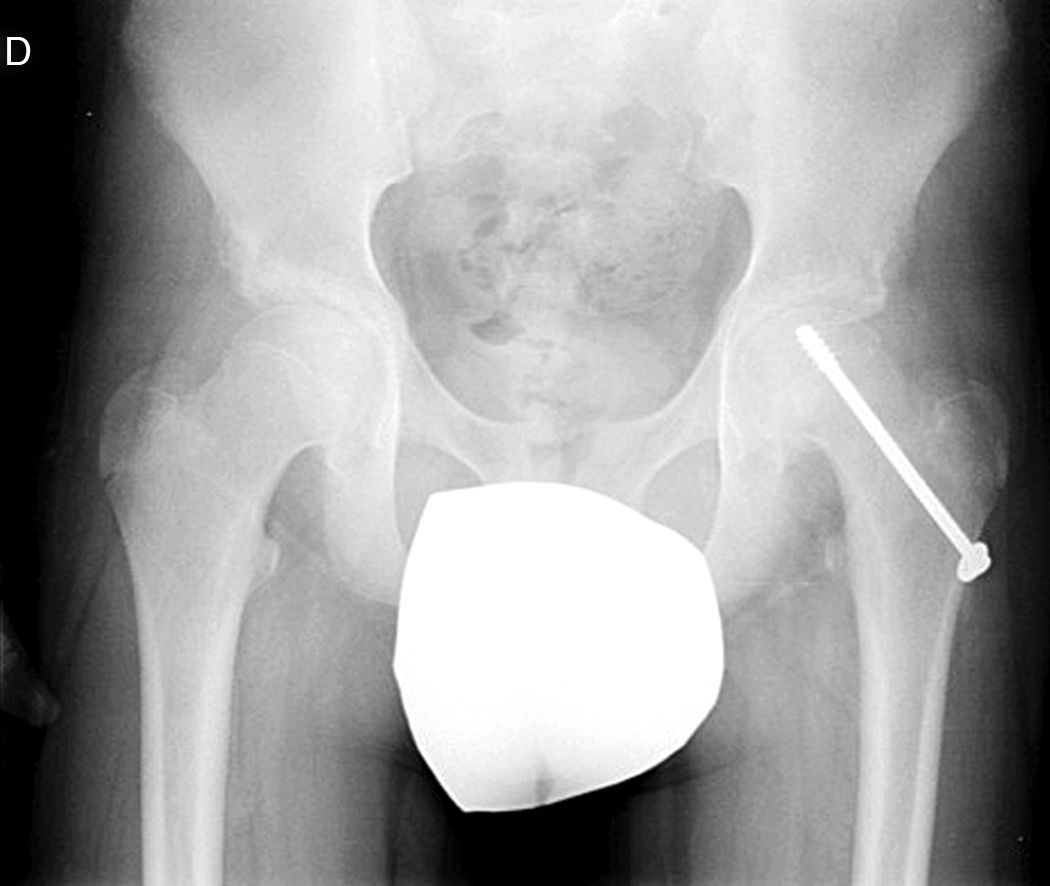
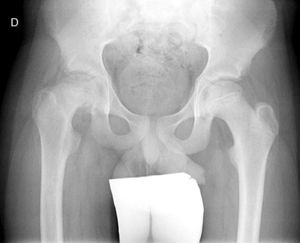
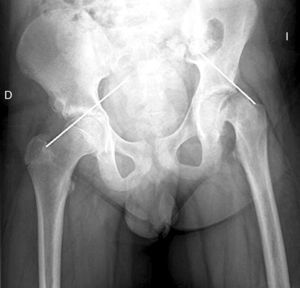
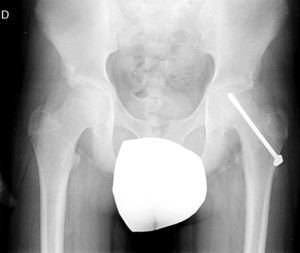
Diagnóstico por la imagenLas radiografías anteroposterior y axial de ambas caderas nos permitirán confirmar el diagnóstico. Es importante obtener la radiografía de ambas caderas por la alta incidencia de bilateralidad. En la radiografía antero-posterior y axial de ambas caderas podemos observar un desplazamiento antero-superior de la metáfisis proximal del fémur (cuello femoral) respecto a la epífisis (cabeza femoral). Denominamos signo de Steel, a la doble densidad radiográfica creada por la epífisis que se desplaza posteriormente y se superpone a la parte medial de la metáfisis (fig. 1). La línea de Klein, es una línea que se traza en la parte antero-superior del cuello femoral en la radiografía antero-posterior y que corta la epífisis. En los casos de ECF, la epífisis femoral queda por debajo de esta línea (fig. 2).
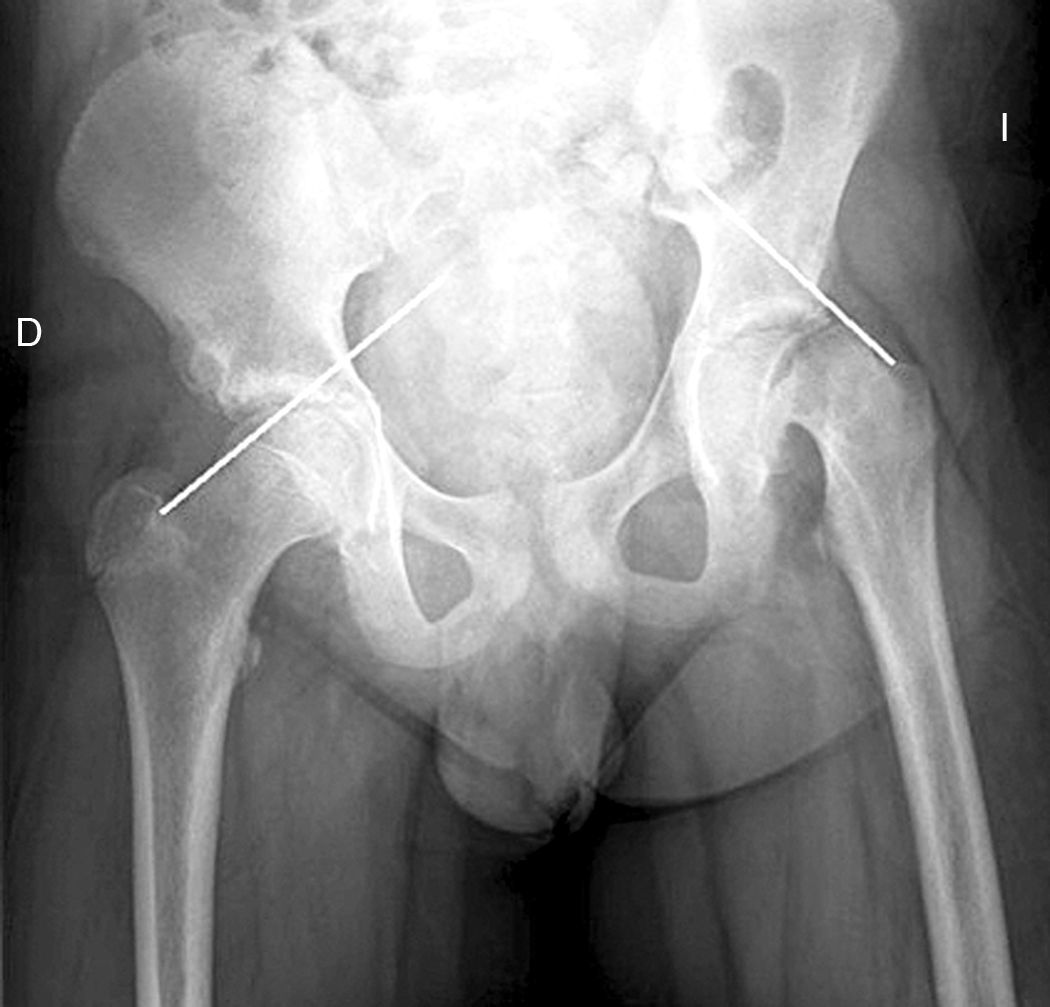
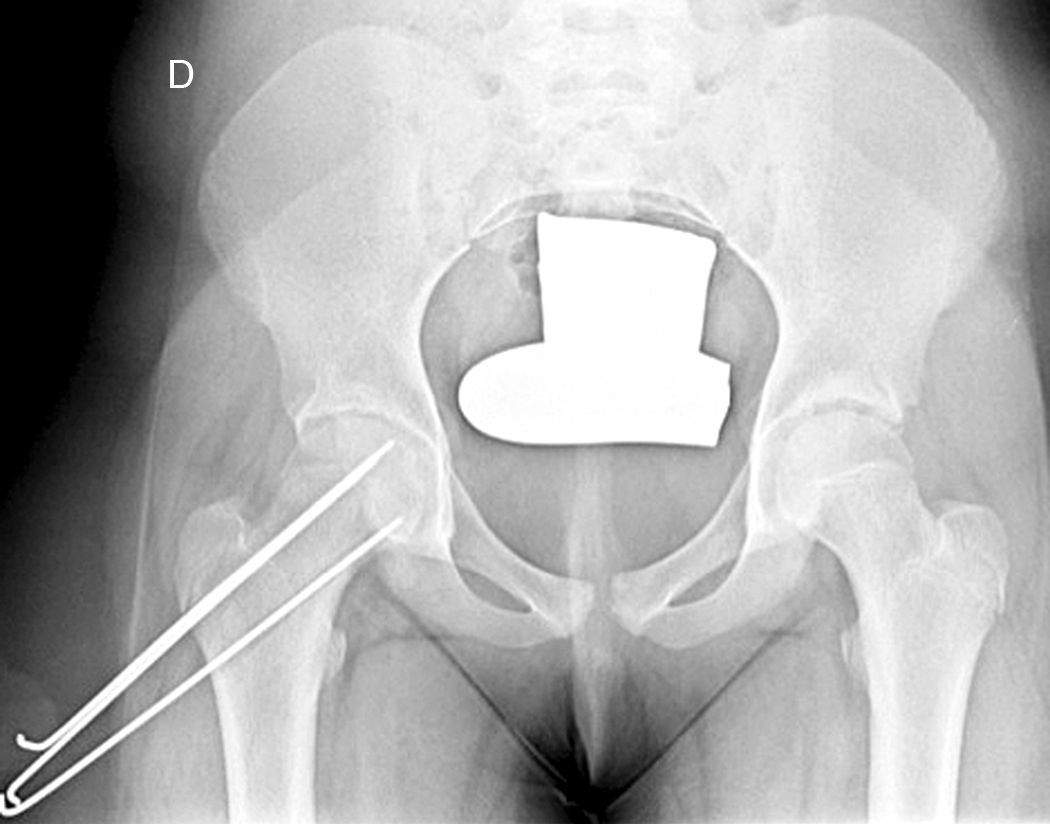
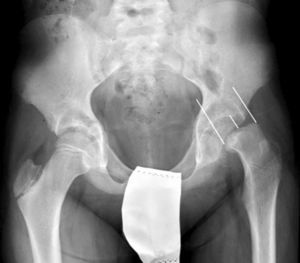
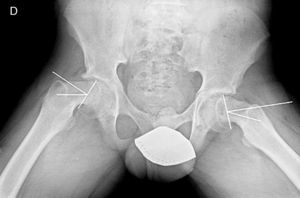
La gravedad de la ECF se mide de 2 maneras. El desplazamiento de la epífisis respecto a la metáfisis es el porcentaje de desplazamiento de la cabeza femoral respecto al cuello. Este desplazamiento puede ser leve (<33%), moderado (33–50%) y grave (>50%) (fig. 3). Aunque se utiliza de forma frecuente, presenta una gran variabilidad inter-intraobservador, además de estar influenciado por la posición del paciente. Southwick describió el ángulo epífisis-diáfisis en la radiografía anteroposterior y axial de ambas caderas. Se traza una línea a través de la superficie fisaria de la epífisis y se dibuja un ángulo recto a partir de esa línea. A continuación, se traza una línea paralela a la diáfisis del fémur. El ángulo formado por estas dos últimas líneas es la medida del desplazamiento posterior. Se resta el ángulo obtenido en la cadera sana del ángulo en la ECF, obteniendo así el grado de desplazamiento. El grado de deslizamiento se clasifica como leve (<30%), moderado (30–50%) y grave (>50%) (fig. 4).
También podemos observar cambios en la región metafisaria (remodelación, reabsorción de la parte anterosuperior de la metáfisis, neoformación ósea en la zona postero-inferior de la metáfisis…). Loder et al.21 realizaron un estudio valorando la correlación entre los cambios radiográficos observados en la metáfisis, la gravedad de la enfermedad, la duración de los síntomas y otros parámetros demográficos. Observaron que los cambios metafisarios ocurrían en la zona superior (76%), inferior (56%), anterior (80%) y posterior (84%). Estos cambios eran más evidentes en los pacientes de mayor edad, con mayor índice de masa corporal (BMI) y cuando los síntomas tenían mayor duración.
TratamientoLos objetivos del tratamiento son prevenir la progresión del deslizamiento y evitar las posibles complicaciones. La gravedad de la ECF está relacionada con la duración de los síntomas y está indicado el tratamiento precoz para evitar la progresión del desplazamiento.
Epifisiolisis establesEl tratamiento inicial de un paciente con ECF estable se realiza fijando con tornillos o agujas, utilizando injerto óseo o mediante la luxación y osteoplastia de remodelación del cuello femoral.
La fijación con tornillo sobre una mesa de tracción radiolucente es el método más aceptado de tratamiento22,23. Entre las ventajas destacan la colocación de forma percutánea, una alta tasa de éxitos y bajo índice de complicaciones. Existen discrepancias en la literatura acerca de la utilización de uno o 2 tornillos para la estabilización. Karol et al.24 realizaron un estudio en corderos, demostrando que la estabilidad con 2 tornillos incrementaba un 33% la rigidez de la síntesis respecto al tornillo simple. Asimismo concluyeron que la estabilidad con un solo tornillo era suficiente para evitar la progresión de la deformidad. La posición ideal del tornillo es en el centro de la epífisis, perpendicular a la fisis en las proyecciones antero-posterior y lateral. Miyanji et al.25, en un trabajo realizado con cerdos, concluyeron que no existían diferencias estadísticamente significativas entre la utilización de tornillos de rosca parcial o total y que los tornillos de rosca completa no aportaban ningún beneficio biomecánico. Otros autores26 han publicado recientemente que el uso de tornillos de rosca completa o rosca de 32mm aportan mayor estabilidad mecánica a nivel del cuello femoral y aconsejan su uso en las ECF.
Para evitar introducir de forma voluntaria el tornillo en la articulación, se realiza el «fenómeno retirada-abordaje»27,28. Consiste en rotar la extremidad desde la máxima rotación interna a la máxima rotación externa y observar que el tornillo no protruye en las imágenes de escopia. Durante la primera parte de la rotación, la punta del tornillo parece moverse más cerca del hueso subcondral (abordaje), para después parecer que se aleja de él (retirada). El momento del cambio muestra la verdadera posición del tornillo (fig. 5).
La epifisiodesis con injerto óseo no es una técnica tan utilizada como la síntesis con tornillos. Consiste en la introducción de múltiples láminas de injerto óseo córtico-esponjoso a través del cuello, alcanzando la epífisis hasta conseguir la epifisiodesis. Adamczyk et al.29 publicaron sus resultados tras 50 años de experiencia obteniendo elevadas tasas de deslizamiento progresivo (13% en ECF inestables y 6% en ECF estables), mayor pérdida hemática, mayor duración de la anestesia y una cicatriz quirúrgica mayor.
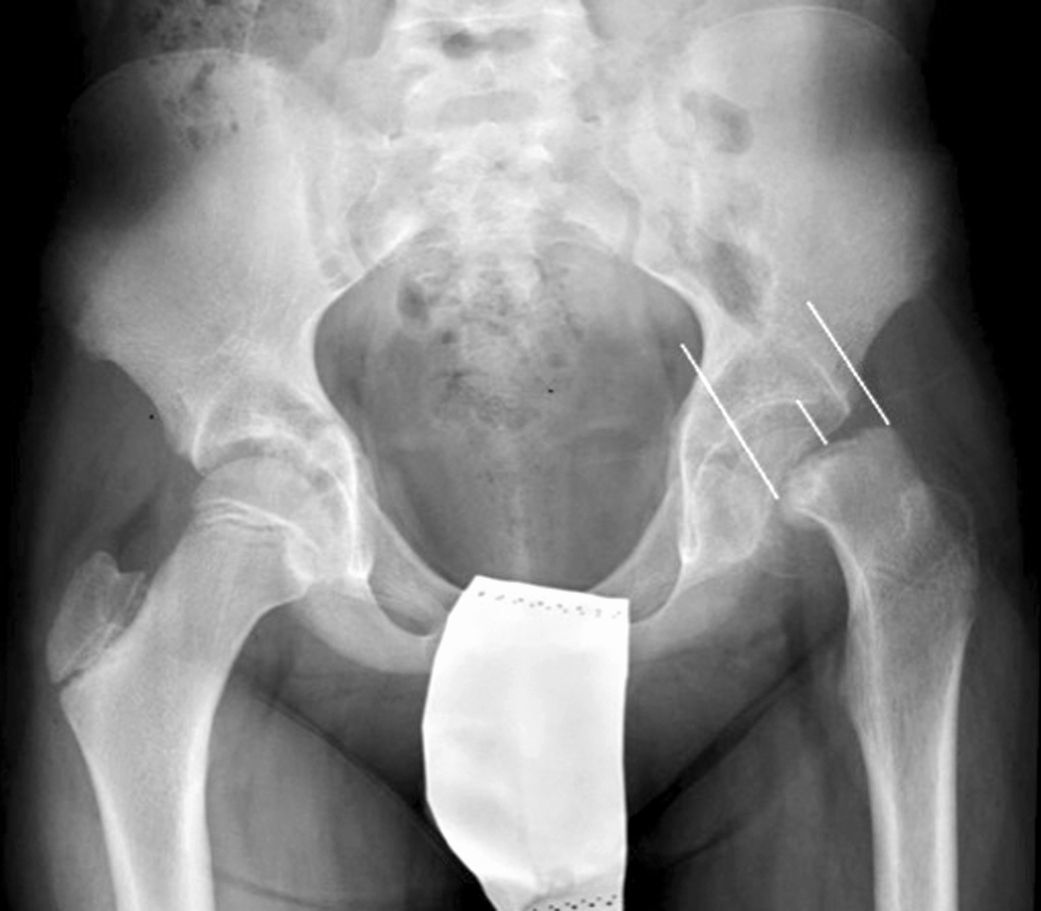
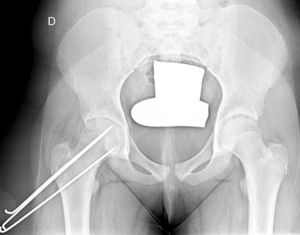
La fijación in situ con múltiples agujas (fig. 7), es una alternativa a la fijación con tornillo. O’Brien et al.30 observaron que existía un potencial de remodelación de la parte proximal del fémur en aquellos pacientes con ECF intervenidos mediante múltiples agujas. Este potencial de remodelación tiene interés en los pacientes más jóvenes, ya que mejora la movilidad y disminuye la discrepancia de longitud de miembros asociado a la epifisiodesis. Entre las desventajas destacan la fijación inadecuada, el daño de los vasos epifisarios laterales, la protrusión involuntaria y la condrolisis por penetración. Seller et al.31 valoraron la estabilización profiláctica con agujas de Kirschner de ECF inestables y las consecuencias en cuanto a disrupción del crecimiento y potencial de remodelación de la cabeza femoral; concluyendo que la fijación con agujas produce una menor alteración del crecimiento fisario y la remodelación en la cadera contralateral no afecta. Sibinski et al.32 en un estudio retrospectivo de 61 caderas tratadas mediante agujas de Kirschner obtuvieron buenos resultados sin encontrar necrosis avascular, por lo que recomendaron este tratamiento en pacientes jóvenes, esqueléticamente inmaduros y con potencial de crecimiento de la cabeza femoral. Otros autores33 recomiendan la síntesis bilateral con agujas de Kirschner. Parsch et al.34 describieron en las ECF inestables, el tratamiento mediante reducción abierta, evacuación del hematoma previa identificación mediante ultrasonografía y estabilización posterior con agujas de Kirschner. Obtuvieron buenos resultados y una baja tasa de necrosis avascular de la cabeza femoral (4,7%) (fig. 6).
Desde que Ganz et al.35 publicasen buenos resultados mediante la luxación articular en pacientes adultos con choque fémoro-acetabular, ha surgido un interés creciente en el tratamiento abierto de las ECF. La luxación quirúrgica con osteoplastia de remodelación del cuello femoral permite corregir la deformidad articular, la retroversión femoral y el choque fémoro-acetabular anterior36. De esta forma, se mejora la morfología en la unión cabeza-cuello, devolviendo el contorno cóncavo del cuello femoral. Beck et al.37 evaluaron 19 pacientes con un seguimiento mínimo de 4 años observando mejoría clínica en 13 caderas.
Numerosas osteotomías han sido descritas para el tratamiento tardío de la retroversión femoral.
La osteotomía intertrocantérica, preconizada por Southwick38, corrige la deformidad en retroversión, mejora la movilidad y disminuye la incidencia de artrosis. La osteotomía más realizada es la descrita por Imhäuser39, en la que se realiza una flexión, rotación interna y abducción del fragmento distal del fémur; sin embargo, es una técnica difícil que no está exenta de complicaciones. Esto explica que se haya modificado en numerosas ocasiones siendo la más conocida la modificación de Sugioka-Hungria-Kramer40. La osteotomía cuneiforme, propuesta por Dunn41 está indicada en pacientes con ECF moderada o grave (>30%) y, mediante un abordaje externo, se extrae una cuña de base anterior metafiso-diafisaria que se estabiliza mediante 3 agujas aunque se asocia a un alto índice de complicaciones, especialmente osteonecrosis y condrolisis.
El desarrollo de nuevas técnicas quirúrgicas y los avances en los métodos diagnósticos permiten aconsejar la cirugía urgente frente a la cirugía reconstructiva tardía, aunque carecemos de momento de resultados comparativos a largo plazo42.
Epifisiolisis inestableEl tratamiento es similar al presentado para la ECF estable aunque el manejo es más controvertido entre los diferentes autores (momento de la cirugía: urgente o electiva, necesidad de reducción, evacuación del derrame intra-articular…).
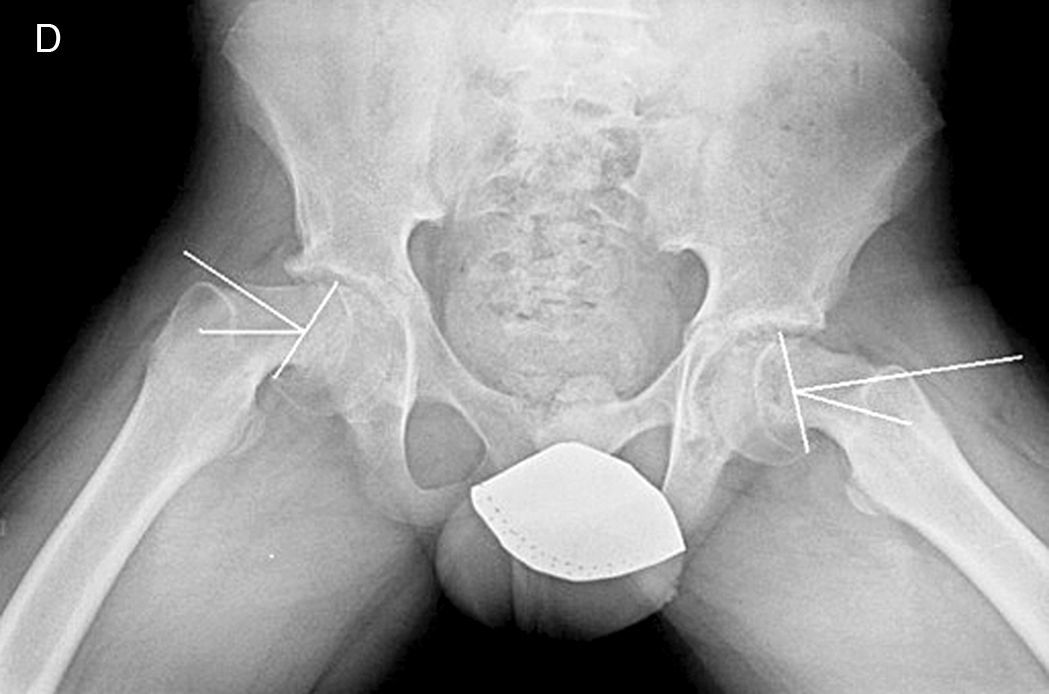
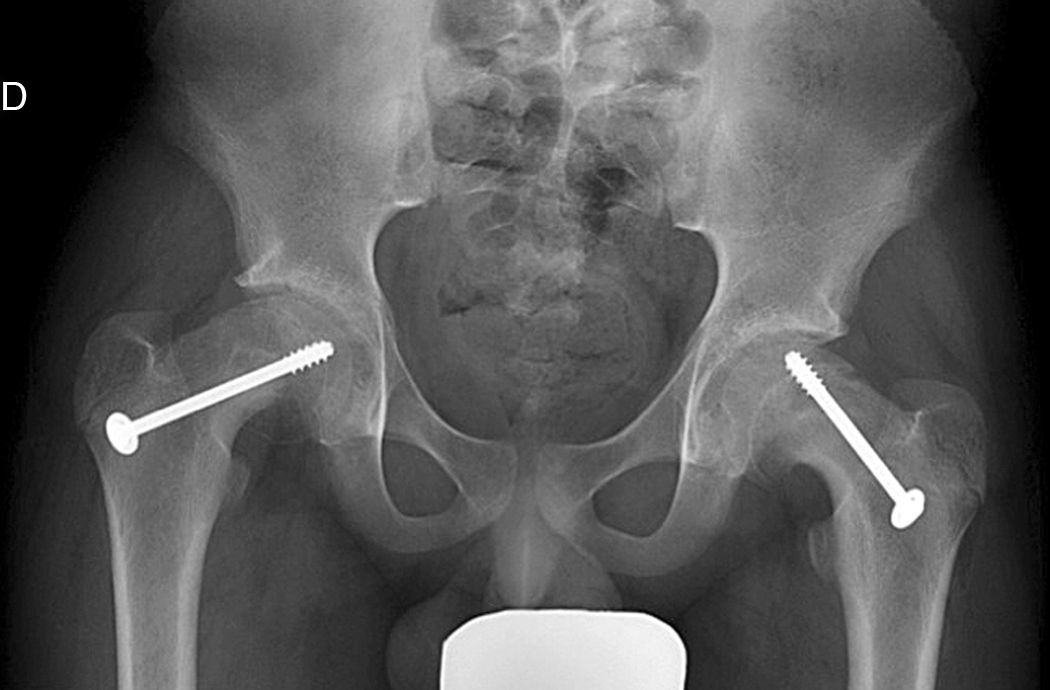
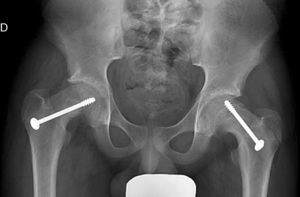
Mooney et al.43 realizaron una encuesta entre los miembros POSNA para valorar el manejo de la ECF. El 57% de los encuestados aconsejaban un tratamiento urgente (menor de 8 h), el 31% un tratamiento preferente y un 12% una reducción electiva. La reducción incidental era el método preferido por el 84% de los encuestados, mientras que el 11,8% preferían la reducción manipulativa formal (completa). El 64,6% desaconsejaba la descompresión capsular como parte del tratamiento de las ECF inestables y la fijación con un tornillo fue utilizada por el 57,4% de los encuestados, mientras que la fijación con 2 tornillos lo fue para el 40,3%. El riesgo de desarrollar una ECF contralateral en un paciente con ECF unilateral es de 2,335 veces mayor que el riesgo de una ECF inicial44, por lo que algunos autores aconsejan la fijación profiláctica contralateral considerando otros parámetros (edad, sexo, estado endocrino, preferencias del enfermo-familia…). A pesar de la evidencia científica de la fijación profiláctica contralateral, la mayoría de cirujanos que respondieron a la encuesta no optaron por este tratamiento43 (figs. 7 y 8).
También se ha publicado una encuesta sobre el manejo de la EFP entre los miembros de European Pediatric Orthopaedic Society (EPOS)45. El tratamiento preferido por la mayoría de cirujanos es la fijación in situ con un tornillo. La reducción abierta y la fijación con tornillo fue utilizada en un 5-10% de las EPF con desplazamientos graves. La mayoría de los cirujanos confían en la seguridad de la carga en aquellos casos de EFP estables, permitiendo la carga total sin evidencia de complicaciones. Así mismo afirman que existen controversias en otros aspectos que precisan de estudios multicéntricos para obtener un consenso.
Peterson et al.46 en 91 pacientes con ECF inestable, observaron que la reducción cerrada en las primeras 24 h se asociaba a un 7% de necrosis y cuando la reducción se demoraba más de 24 h, la tasa ascendía al 20%. Estos resultados apoyan la reducción completa urgente mediante manipulación sin tracción preoperatoria. Posteriormente, González Morán et al.47 sugirieron que la disminución de las tasas de osteonecrosis observadas en su trabajo podrían estar relacionadas con la tracción 2 semanas previas a la cirugía.
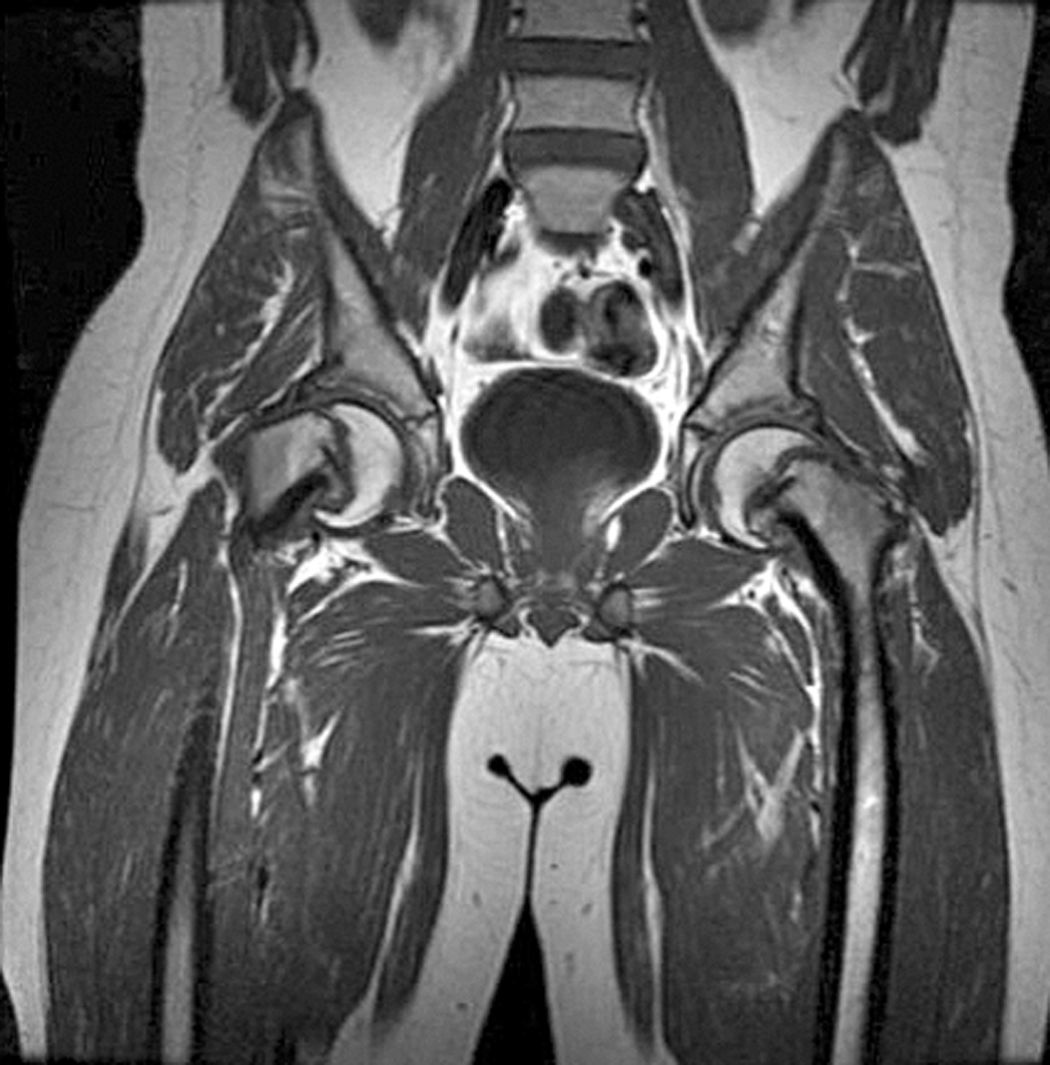
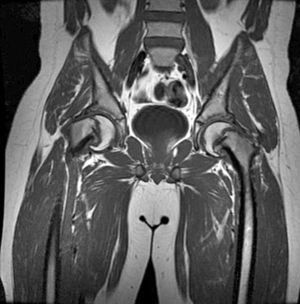
Beck et al.48 valoraron los efectos del aumento de la presión intra-articular sobre la cabeza femoral. Para ello, inyectaron suero salino intra-articular en 11 pacientes a los que realizaron una luxación quirúrgica para tratamiento de un choque fémoro-acetabular. Posteriormente valoraron el flujo sanguíneo de la cabeza femoral mediante flujometría de laser Doppler y observaron que tras la inyección intracapsular de 20ml de suero salino se producía una pérdida de señal en el flujo sanguíneo y que la aspiración de la articulación mejoraba la perfusión. Concluyeron que la descompresión urgente del hematoma intracapsular podría mejorar la perfusión de la cabeza femoral.
Kibiloski et al.49 realizaron un estudio para valorar el efecto de la carga precoz en el tratamiento de la ECF recomendando evitar la carga en el postoperatorio inmediato independientemente del método de síntesis elegido. Respecto a la utilización de uno o 2 tornillos, existe controversia respecto al método más adecuado. La fijación con 2 tornillos puede aumentar el riesgo de necrosis y condrolisis, sin proporcionar una estabilidad mayor que al poner un solo tornillo24. Kishan et al.50 realizaron un trabajo experimental con cerdos comparando entre la utilización de uno y 2 tornillos así como la diferente disposición espacial de estos, concluyendo que la estabilidad con 2 tornillos es mejor en aquellos casos de ECF inestable respecto a la utilización de un solo tornillo aunque se asocia a mayor riesgo de penetración articular involuntaria. Asimismo destacó que la diferente disposición tridimensional de los tornillos no influía en la evolución.
Trabajos recientes como el realizado por Zide et al.51 y Popejoy et al.52 han tratado de estimar el riesgo de desplazamiento de la cadera contralateral y la necesidad de fijación profiláctica. Se basa en la aplicación de la modificación de la escala Oxford descrita por Stasikelis53 que valora radiológicamente la maduración esquelética en 5 zonas: cartílago triradiado, iliaco, epifisis femoral proximal, trocánter mayor y trocánter menor. Aquellos pacientes con valores comprendidos entre 0 y 2 (más inmaduros esqueléticamente) tienen mayor riesgo de desplazamiento de la cadera contralateral. El 89% de los pacientes que presentaban un triradiado abierto desarrollaron un desplazamiento de la cadera contralateral. Esta escala proporciona una buena correlación intra-interobservador y facilita la decisión de la fijación profiláctica de la cadera contralateral cuando presentan un cartílago triradiado abierto.
ComplicacionesOsteonecrosisSin lugar a dudas es la complicación más grave y suele estar asociada a ECF inestable. Entre las causas destacan los intentos de reducción bruscos, la colocación de agujas en el cuadrante postero-superior de la epífisis y las osteotomías cuneiformes. Tokmakova et al.54 describieron osteonecrosis en 21 de 36 caderas (58%) en pacientes con ECF inestable y ningún caso en 204 caderas con ECF estable; concluyendo que la osteonecrosis se asocia a ECF inestables, desplazamientos intensos y mayor número de agujas utilizados en la síntesis.
Debemos sospechar de osteonecrosis en aquellos pacientes que presentan dolor inguinal, en el muslo o la rodilla. A la exploración se aprecia una pérdida del rango de movilidad, sobre todo de la rotación interna y dolor en la cadera. Radiográficamente se observa un colapso de la cabeza femoral. El tratamiento de la osteonecrosis incluye la descarga de peso con bastones, los ejercicios de fisioterapia para aumentar el arco de movilidad, la medicación analgésica y, en el caso de tener implantes, su retirada.
CondrolisisLa etiología de la condrolisis puede ser secundaria a una penetración involuntaria de los implantes (agujas, tornillos) en la cabeza femoral, aunque también se piensa en la existencia de algún factor autoinmune que podría contribuir a la condrolisis. Dentro de los factores asociados a condrolisis destacan la penetración involuntaria de agujas, el tratamiento con yeso pelvipédico, la osteotomía intertrocantérica y la ECF avanzada. La incidencia de condrolisis va desde el 1,8 al 55% según las series, con una incidencia global del 7%55.
El paciente suele consultar por cojera y dolor en la región inguinal, en el muslo o la rodilla. Clínicamente presentan una disminución en el rango de movilidad, afectando sobre todo la rotación interna. La radiografía simple confirma el diagnóstico observándose una disminución (> 50%) del espacio articular respecto al lado no afectado, o cuando la afectación sea bilateral, un espacio articular menor de 3mm. Los pacientes que desarrollan una condrolisis tienen mejor pronóstico a largo plazo que los que desarrollan una osteonecrosis56.
Choque fémoro-acetabularRab et al.4 describieron el concepto «impingement» en su estudio sobre la movilidad de las caderas con ECF. Se caracteriza por una deformidad en la región del cuello y la cabeza debido al desplazamiento fisario y a la retroversión de la cabeza femoral. Esta deformidad anterior produce un efecto leva que lesiona el cartílago articular y el labrum de forma progresiva, provocando un dolor intenso con la flexión y rotación interna de la cadera35,57. Numerosos autores han descrito los cambios producidos en el cartílago articular en los pacientes con ECF. Beck et al.37 establecieron una clasificación de daño en el cartílago articular y el labrum que varían desde la condromalacia hasta el defecto condral de espesor completo. Sink et al.58 intervinieron 39 caderas, con ECF estable sintomática, mediante luxación quirúrgica y observaron cambios en el labrum en 34 de las caderas y cambios en el cartílago en 32, concluyendo que existe condromalacia y lesión del cartílago articular en las caderas afectas de ECF. La luxación articular permite el diagnóstico de dichas lesiones. El tratamiento del choque femoro-acetabular es la osteoplastia de remodelación del cuello femoral37, que consiste en una luxación quirúrgica de la cabeza femoral y la resección del fragmento óseo metafisario que provoca el choque.
Evolución natural sin tratamientoEl riesgo de progresión es difícil de determinar y la evolución natural es impredecible. En el trabajo realizado en Suecia por Orderberg et al.59 se estudió la evolución de pacientes entre 20 y 60 años tras el diagnóstico de ECF, observando que apenas existía repercusión de tipo social o laboral pero existía un riesgo de progresión de la deformidad en pacientes con fisis abiertas. Posteriormente Carney et al.60 valoraron los resultados de 36 caderas tratadas de forma sintomática con reposo en cama, bastones o sin realizar ningún tratamiento. Tras el diagnóstico inicial, en 6 caderas (17%) se observó un desplazamiento adicional; en 5 de estas el desplazamiento fue grave. Once caderas tuvieron una ECF aguda sobre crónica y todas progresaron hacia un desplazamiento acusado que precisó estabilización quirúrgica.
En cuanto al riesgo de desarrollar artrosis, la gravedad de la ECF no tratada se correlaciona con el pronóstico a largo plazo. En los estudios de Oram et al.61 y Carney et al.62 observaron que las caderas con una ECF moderada o grave, tienen mayor riesgo de desarrollar una artrosis con repercusión funcional. Las caderas con ECF estable tienen una evolución favorable siempre que el desplazamiento sea mínimo.
Evolución natural con tratamientoLa mayoría de los pacientes que presentan ECF leve-moderada no desarrollan necrosis ni condrolisis y los resultados a largo plazo con la fijación in situ suelen ser buenos y excelentes. Los pacientes con ECF grave y aquellos que presentan osteonecrosis desarrollan una artrosis a edades tempranas. La osteonecrosis que aparece en pacientes con ECF difiere de la que se presenta en otros problemas pediátricos de la cadera ya que la ECF ocurre a una edad a la que la mayor parte del desarrollo acetabular está completo y no es posible una adaptación a la deformidad de la cabeza femoral63.
Nivel de evidenciaNivel de evidencia v.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.