La Sociedad Española de Neumología y Cirugía Torácica (SEPAR) ha elaborado este documento de recomendaciones sobre la vacuna para la COVID-19 en las enfermedades respiratorias, con el objetivo de ayudar al personal sanitario en la toma de decisiones sobre cómo actuar en la vacunación de estos pacientes.
Las recomendaciones han sido elaboradas por un grupo de expertos en la materia, tras la revisión de la literatura recopilada hasta el 7 de marzo del 2021, y de la información aportada por distintas sociedades científicas, agencias del medicamento y estrategias de organismos gubernamentales hasta esa fecha.
Podemos concluir que las vacunas para la COVID-19 no solo son seguras y eficaces, sino que, en aquellos pacientes vulnerables con enfermedades respiratorias crónicas, son prioritarias. Además, la implicación activa de los profesionales sanitarios que manejan estas patologías en la estrategia de vacunación es clave para lograr una buena adherencia y coberturas vacunales elevadas.
The Spanish Society of Pneumonology and Thoracic Surgery (SEPAR) has elaborated this document of recommendations for COVID-19 vaccination in patients with respiratory diseases aimed to help healthcare personnel make decisions about how to act in case of COVID-19 vaccination in these patients.
The recommendations have been developed by a group of experts in this field after reviewing the materials published up to March 7, 2021, the information provided by different scientific societies, drug agencies and the strategies of the governmental bodies up to this date.
We can conclude that COVID-19 vaccines are not only safe and effective, but also prior in vulnerable patients with chronic respiratory diseases. In addition, an active involvement of healthcare professionals, who manage these diseases, in the vaccination strategy is the key to achieve good adherence and high vaccination coverage.
Las vacunas se han convertido, con el paso de los años, en una herramienta fundamental para disminuir la incidencia, la mortalidad e incluso conseguir la erradicación de un gran número de enfermedades infecciosas1. Desde que, en 1796, Edward Jenner descubrió la vacuna de la viruela, han sido múltiples las que han surgido para proteger a la población mundial de enfermedades como la varicela, el sarampión, la gripe, la neumonía, la tuberculosis, la tosferina, la difteria, el tétanos o la poliomielitis.
El coronavirus SARS-CoV-2 surgió en 2019 en Wuhan (China), extendiéndose al resto del mundo. En la actualidad, sigue provocando millones de muertes y demostrando la vulnerabilidad de nuestro sistema inmune2. La comunidad científica postuló la vacuna como una de las soluciones a esta pandemia e inició rápidamente el camino para conseguirla. Son muchos los grupos de investigación y compañías farmacéuticas que buscan fabricar la vacuna y alcanzar la mayor eficacia posible. En febrero del 2021, había 240 candidatas, y aunque son varias las que ya se están administrando en el mundo, las admitidas para su uso después de la aprobación de la Food and Drug Administration (FDA) y la European Medicines Agency (EMA) son pocas3.
Dentro del amplio espectro clínico que sufren los pacientes con infección por SARS-CoV-2, parece claro que los síntomas respiratorios son los más prevalentes. La enfermedad puede presentarse como leves síntomas en la vía aérea superior hasta la aparición de una neumonía o síndrome de distrés respiratorio agudo (SDRA), que requieran de técnicas diagnósticas y terapéuticas específicas como son la broncoscopia, la ecografía pulmonar o las terapias de soporte respiratorio no invasivo4–8. Pero no es importante solo el momento agudo, ya que cada vez son más conocidas las complicaciones y secuelas respiratorias a medio y largo plazo9. El tabaquismo ha sido reconocido como un factor de riesgo importante que produce una forma clínica más grave de la COVID-19 y que lleva a que, con mayor frecuencia, estos pacientes ingresen en Unidades de Cuidados Intensivos (UCI), sean intubados y fallezcan10. Dado que los efectos del SARS-CoV-2 son más graves en personas con historial de tabaquismo y de algunas enfermedades respiratorias crónicas, en estas es más importante llevar a cabo una adecuada y pronta vacunación.
La Sociedad Española de Neumología y Cirugía Torácica (SEPAR) tiene como uno de sus fines colaborar en la prevención de las enfermedades respiratorias y torácicas y contribuir a mejorar la atención médica y de enfermería de estos pacientes. Es por ello, que el objetivo de este documento es elaborar una serie de recomendaciones que ayuden al personal sanitario en la toma de decisiones sobre cómo actuar en la vacunación por COVID-19 en los pacientes respiratorios y que además reduzcan el impacto de la infección por SARS-CoV-2 para garantizar, en la medida de lo posible, la salud de los mismos.
MetodologíaEl documento ha sido realizado por un grupo multidisciplinar de expertos en neumología, cirugía torácica, enfermería, microbiología, inmunología, medicina preventiva, epidemiología y salud pública, a propuesta del Área de Tuberculosis e Infecciones Respiratorias (TIR) de SEPAR.
Las recomendaciones se han elaborado tras la revisión de la literatura recopilada hasta el 7 de marzo del 2021 y con la información aportada por distintas sociedades científicas, agencias del medicamento y estrategias de organismos gubernamentales hasta esa fecha.
En un primer momento, se expusieron recomendaciones generales sobre los tipos de vacunas existentes, la eficacia, la seguridad, la estrategia de vacunación y las formas de administración, almacenamiento y manipulación de las mismas. Posteriormente, se postularon recomendaciones sobre cómo actuar en la vacunación por COVID-19 en pacientes con distintas patologías respiratorias vulnerables al virus SARS-CoV-2, y que abarcan desde procesos agudos hasta enfermedades crónicas o aquellas que requieren de fármacos que pueden debilitar el sistema inmune. Cada tema fue desarrollado por, al menos, un experto en la materia del grupo de autores. Tras la elaboración de las recomendaciones, se formularon unas conclusiones finales. Por último, todos los autores realizaron una revisión crítica del documento y aprobaron su contenido.
Tipos de vacunasLa diana principal de casi todas las vacunas para la prevención de la COVID-19 es la proteína de la espícula (spike, en inglés) o glicoproteína trimérica S, y dentro de esta, en la fracción S1, está la región dominio de unión al receptor celular denominado Receptor Binding Domain (RBD), la cual es más externa e immunodominante y es la estructura que permite al virus unirse a las células del epitelio respiratorio a través del receptor de la enzima convertidora de angiotensina 2 (ECA-2)11. La mayoría de estas vacunas persiguen la inducción tanto de una respuesta de inmunidad humoral, con producción de anticuerpos neutralizantes, como de inmunidad celular, basada en la activación de linfocitos T CD4+ helper y CD8+ citotóxicos, estos últimos responsables de acabar con la infección viral en el lugar de entrada del virus, impidiendo su diseminación.
A la fecha del 3 de marzo del 2021 existen registradas por la Organización Mundial de la Salud (OMS) 240 vacunas candidatas, 63 actualmente están en fase de evaluación clínica y 177 en fase preclínica3. De ellas, 11 están, al menos, autorizadas en un país del mundo y otras 22 en ensayos de fase III. Los diseños de vacunas existentes, más avanzadas en cuanto a su desarrollo, son los siguientes:
- -
Vacunas basadas en la tecnología de ácido ribonucleico mensajero (ARNm) (por ejemplo, Pfizer/BioNTech BNT162b2 y Moderna Therapeutics mRNA1273). Son vacunas constituidas por solo una parte del ARNm del virus, purificado y modificado para restarle reactogenicidad, el cual codifica para la producción de la proteína S. Estos ARNm se introducen en nanopartículas lipídicas que facilitan su estabilidad y la entrada en las células diana12; pueden ser no replicantes y autorreplicantes.
- -
Vacunas vectorizadas. Principalmente, se basan en la introducción del gen codificante para la proteína S en virus que son inocuos para la especie humana (algunos adenovirus humanos, de chimpancé o el virus vaccinia Ankara, entre otros)13. Estos vectores virales pueden ser replicativos (se han usado para hacer la vacuna del ébola, usando como vector el virus de la estomatitis vesicular), o no replicativos, como las vacunas basadas en adenovirus de chimpancé ChAdOx1-S (Universidad de Oxford/AstraZeneca) o adenovirus humanos (vacuna americana de Janssen). También, y al igual que la vacuna rusa Sputnik, se puede usar un vector viral basado en dos adenovirus diferentes para cada dosis. El objetivo de esta vacuna es que los anticuerpos producidos frente al vector adenoviral administrado en la primera dosis, no puedan interferir con el segundo vector administrado en la segunda dosis.
- -
Vacunas de virus completos inactivados, es decir virus completos de SARS-CoV-2 que han sido inactivados y no pueden replicarse14 (por ejemplo, la vacuna china CoronaVac). Esta aproximación es la más clásica; en el calendario de vacunación de España hay algunas basadas en este diseño. Como toda vacuna inactivada, en general son menos inmunogénicas, pero su antigenicidad es más amplia, frente a más dianas víricas (proteínas).
- -
Vacunas de subunidades recombinantes en las llamadas Virus Like-Particles (VLP)15. Se trata de partículas que imitan una partícula viral, pero «vacías» de material genético, por lo que no pueden replicarse, y en la que se depositan los antígenos víricos seleccionados como dianas. Son tan seguras como las inactivadas, fraccionadas o no, pero tienen el inconveniente de necesitar adyuvantes o amplificadores de la respuesta inmunitaria16. Pueden requerir varias dosis para inducir una respuesta adecuada frente al virus SARS-CoV-2 (por ejemplo, la vacuna americana Novavax), dependiendo de su inmunogenicidad y de la cantidad de antígeno empleada en cada dosis.
- -
Las vacunas candidatas genéticas en «formato» ADN17 y otras aproximaciones basadas en utilizar ARNm autorreplicantes y virus atenuados. Hay alguna candidata diseñada con coronavirus deleccionados en ciertos genes como el gen E, esencial para la replicación intracelular y su patogenicidad.
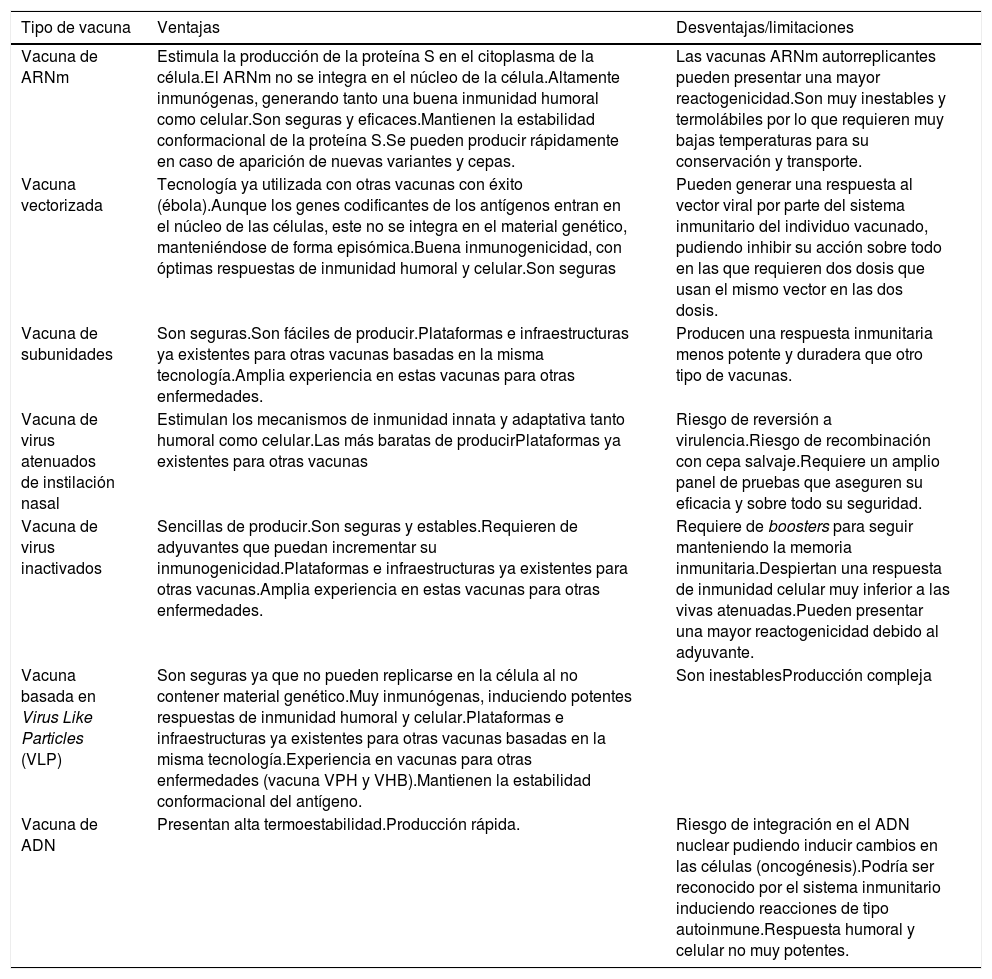
Todas estas vacunas presentan ventajas y también limitaciones en relación con su inmunogenicidad, seguridad y facilidad de producción, entre otras (tabla 1).
Ventajas y limitaciones de los distintos tipos de vacunas frente a la COVID-19
| Tipo de vacuna | Ventajas | Desventajas/limitaciones |
|---|---|---|
| Vacuna de ARNm | Estimula la producción de la proteína S en el citoplasma de la célula.El ARNm no se integra en el núcleo de la célula.Altamente inmunógenas, generando tanto una buena inmunidad humoral como celular.Son seguras y eficaces.Mantienen la estabilidad conformacional de la proteína S.Se pueden producir rápidamente en caso de aparición de nuevas variantes y cepas. | Las vacunas ARNm autorreplicantes pueden presentar una mayor reactogenicidad.Son muy inestables y termolábiles por lo que requieren muy bajas temperaturas para su conservación y transporte. |
| Vacuna vectorizada | Tecnología ya utilizada con otras vacunas con éxito (ébola).Aunque los genes codificantes de los antígenos entran en el núcleo de las células, este no se integra en el material genético, manteniéndose de forma episómica.Buena inmunogenicidad, con óptimas respuestas de inmunidad humoral y celular.Son seguras | Pueden generar una respuesta al vector viral por parte del sistema inmunitario del individuo vacunado, pudiendo inhibir su acción sobre todo en las que requieren dos dosis que usan el mismo vector en las dos dosis. |
| Vacuna de subunidades | Son seguras.Son fáciles de producir.Plataformas e infraestructuras ya existentes para otras vacunas basadas en la misma tecnología.Amplia experiencia en estas vacunas para otras enfermedades. | Producen una respuesta inmunitaria menos potente y duradera que otro tipo de vacunas. |
| Vacuna de virus atenuados de instilación nasal | Estimulan los mecanismos de inmunidad innata y adaptativa tanto humoral como celular.Las más baratas de producirPlataformas ya existentes para otras vacunas | Riesgo de reversión a virulencia.Riesgo de recombinación con cepa salvaje.Requiere un amplio panel de pruebas que aseguren su eficacia y sobre todo su seguridad. |
| Vacuna de virus inactivados | Sencillas de producir.Son seguras y estables.Requieren de adyuvantes que puedan incrementar su inmunogenicidad.Plataformas e infraestructuras ya existentes para otras vacunas.Amplia experiencia en estas vacunas para otras enfermedades. | Requiere de boosters para seguir manteniendo la memoria inmunitaria.Despiertan una respuesta de inmunidad celular muy inferior a las vivas atenuadas.Pueden presentar una mayor reactogenicidad debido al adyuvante. |
| Vacuna basada en Virus Like Particles (VLP) | Son seguras ya que no pueden replicarse en la célula al no contener material genético.Muy inmunógenas, induciendo potentes respuestas de inmunidad humoral y celular.Plataformas e infraestructuras ya existentes para otras vacunas basadas en la misma tecnología.Experiencia en vacunas para otras enfermedades (vacuna VPH y VHB).Mantienen la estabilidad conformacional del antígeno. | Son inestablesProducción compleja |
| Vacuna de ADN | Presentan alta termoestabilidad.Producción rápida. | Riesgo de integración en el ADN nuclear pudiendo inducir cambios en las células (oncogénesis).Podría ser reconocido por el sistema inmunitario induciendo reacciones de tipo autoinmune.Respuesta humoral y celular no muy potentes. |
VHP: virus papiloma humano; VHB: virus hepatitis B.
- -
En personas con factores de riesgo para presentar COVID-19 grave (enfermedad pulmonar obstructiva crónica grave [EPOC], enfermedad pulmonar intersticial difusa [EPID], diabetes mellitus, obesidad, hipertensión arterial, tabaquismo, enfermedades cardiovasculares y vejez), las vacunas ARNm no han mostrado efectos adversos significativos ni diferentes a personas sin estos factores de riesgo.
- -
En personas inmunodeprimidas, aún no se dispone de suficientes datos sobre eficacia, inmunogenicidad o seguridad específicos de este grupo. Aunque no hay razones para creer que la inmunosupresión promoverá la aparición de efectos adversos, el problema es, más bien, que la vacuna puede ser menos eficaz. Por lo tanto, las personas inmunodeprimidas pueden recibir vacunas de ARNm si no tienen contraindicaciones a la vacunación. Según el Comité Asesor de Prácticas de Inmunización de los Centros para el Control y Prevención de Enfermedades (CDC) (ACIP; EE. UU.) y el Comité Conjunto de Vacunación e Inmunización (JCVI; Reino Unido), se debe asesorar a los pacientes sobre la seguridad y la eficacia desconocida de la vacuna. Se recomienda que estos continúen con las medidas preventivas rutinarias frente a infecciones, ya que el nivel de protección después de la vacunación es desconocido por ser un individuo inmunodeficiente.
- -
Dada la falta de estudios de coadministración de vacunas, se recomienda evitar la vacunación concomitante dentro de los siete días posteriores a la dosis de la vacuna COVID-19.
- -
Para los pacientes que podrían someterse a un trasplante de células madre hematopoyéticas (TCMH), el tiempo mínimo entre la administración de la vacuna y el trasplante debe ser de, al menos, 15 a 30 días.
Los datos de eficacia y seguridad de las distintas vacunas frente a la COVID-19 autorizadas por la EMA para su uso en la Unión Europea (UE) derivan de los ensayos clínicos publicados y la documentación presentada a la EMA. Todas las vacunas autorizadas, y las que lo serán en un futuro, son evaluadas empleando los mismos estándares de referencia que cualquier otra. La EMA ha basado su aprobación en la mejor evidencia científica disponible y siempre considerando el balance riesgo-beneficio. Se recomienda consultar siempre la ficha técnica de cada vacuna (seguridad en el embarazo, lactancia y otras situaciones). También, se lleva a cabo un seguimiento activo (farmacovigilancia) de todas estas vacunas.
Los datos (aún no publicados) referidos a la efectividad y seguridad de estas vacunas tras su uso poblacional en millones de personas en varios países del mundo desde el inicio del 2021 (Israel, Reino Unido, EE. UU., España y varios países de la UE) corroboran los datos originales comunicados en los ensayos clínicos, observándose, en general, una reducción especialmente significativa de la incidencia de casos graves de COVID-19 en la población vacunada.
Eficacia- -
Vacuna Pfizer/BioNTech: eficacia calculada en más de 36.000 personas de más de 16 años (incluyendo mayores de 75 años) sin signos de infección: 95% de reducción del número de casos sintomáticos de la COVID-19 en los individuos que recibieron la vacuna (dos dosis) frente a los que recibieron placebo. La misma eficacia (95%) se observó en pacientes con mayor riesgo de sufrir formas graves de la COVID-19. No se ha determinado si la vacuna reduce la transmisión del coronavirus18,19. Datos preliminares sugieren que esta vacuna es efectiva frente a la variante «británica» (B.1.1.7) del coronavirus.
- -
Vacuna Moderna Therapeutics: eficacia calculada en más de 28.000 personas de más de 18 años (incluyendo mayores de 75 años) sin signos de infección: 94% de reducción del número de casos sintomáticos de la COVID-19 en los que recibieron la vacuna (dos dosis) frente a los que recibieron placebo. La eficacia observada en pacientes con mayor riesgo de sufrir formas graves de la COVID-19 fue del 90%. No se ha determinado si la vacuna reduce la transmisión del coronavirus20,21. Datos preliminares sugieren que esta vacuna es efectiva frente a la variante «británica» (B.1.1.7) del coronavirus.
- -
Vacuna Universidad de Oxford/AstraZeneca: eficacia calculada en más de 10.000 personas de más de 18 años sin signos de infección: 60% de reducción del número de casos sintomáticos de COVID-19 en los que recibieron la vacuna (dos dosis) frente a los que recibieron placebo. Los ensayos incluyeron muy pocas personas de más de 55 años de edad, por lo que no se pudo determinar la eficacia en este grupo. No se ha determinado si la vacuna reduce la transmisión del coronavirus22,23. Datos preliminares sugieren que esta vacuna es efectiva frente a la variante «británica» (B.1.1.7) del coronavirus.
- -
Vacuna Pfizer/BioNTech: los efectos adversos más comunes son leves o moderados y de corta duración (tabla 2). Suelen ser algo más intensos en la segunda dosis, en personas jóvenes y quienes han padecido la COVID-19. Las reacciones alérgicas (frecuencia estimada actual: 5/1.000.000 personas vacunadas) son leves, aparecen rápidamente (15 min) y responden bien al tratamiento sintomático18,19. Se cree que pueden ser debidas al polietilenglicol (PEG) que forma parte de la envoltura de las nanopartículas lipídicas que contienen el ARNm.
Tabla 2.Efectos adversos más comunes con las primeras vacunas para la COVID-19
Vacuna 1/10 vacunados 1/100 vacunados Reacciones alérgicas* Pfizer/BioNTech (ARNm) Dolor localHinchazónCansancioCefaleaMialgiasArtralgiasFiebre Dolor en la extremidadAdenopatías localesMal estado general 5/1.000.000 vacunados Moderna Therapeutics (ARNm) Dolor localHinchazónAdenopatías localesCansancioCefaleaMialgiasNauseasFiebre Enrojecimiento zona de inyecciónLesiones vesiculares 3/1.000.000 vacunados Universidad de Oxford/AstraZeneca (DNA recombinante) Dolor localHinchazónCansancioMialgiasArtralgiasMal estado generalNauseasFiebre MareoSudoraciónDolor abdominalErupción cutánea 10/1.000.000 vacunados - -
Vacuna Moderna Therapeutics: los efectos adversos más comunes son leves o moderados y de corta duración (tabla 2). Suelen ser algo más intensos tras la segunda dosis, en personas jóvenes y en personas que han padecido la COVID-19. En algunos casos se ha observado una reacción local algo más tardía (siete días) con enrojecimiento y lesiones vesiculares en la zona de inyección. Las reacciones alérgicas (frecuencia estimada actual: 3/1.000.000 personas vacunadas) son leves, aparecen rápidamente (15 min) y responden bien al tratamiento sintomático20,21. Se cree que pueden ser debidas al PEG que forma parte de la envoltura de las nanopartículas lipídicas que contienen el ARNm.
- -
Vacuna Universidad de Oxford/AstraZeneca: los efectos adversos más comunes son leves o moderados y de corta duración: dolor e hinchazón local, cansancio, mialgias, artralgias, mal estado general, náuseas y fiebre (1/10 vacunados). Puede presentarse mareo, sudoración, dolor abdominal y erupción cutánea (1/100 vacunados). Se recomienda el uso preventivo de paracetamol (0,5 a 1 g/ 6 h, 24 a 48 h) para reducir la incidencia de estos efectos adversos. Se han descrito también reacciones alérgicas con esta vacuna, con una frecuencia estimada actual de 10/1.000.000 personas vacunadas22,23.
Además de estas tres vacunas, irán surgiendo otras muchas más cuyos datos de eficacia y seguridad serán profundamente evaluados por la EMA y otros organismos con la mejor evidencia disponible y con modificaciones en su autorización según los datos de farmacovigilancia.
Recomendaciones- -
Las vacunas autorizadas por la EMA hasta el momento presente (febrero del 2021) (Pfizer/BioNTech, Moderna Therapeutics y Universidad de Oxford/AstraZeneca) son seguras y efectivas, especialmente para reducir la incidencia de casos graves de COVID-19, en personas de más de 16 a 18 años de edad.
- -
Estas vacunas no han sido ensayadas todavía en población pediátrica ni en embarazadas, por lo que no se dispone de datos al respecto de su seguridad y efectividad en estas poblaciones.
La pandemia COVID-19 representa, hoy por hoy, el reto más importante para la salud pública mundial. El diseño y fabricación de vacunas frente al SARS-CoV-2 ha sido el principal objetivo para muchos investigadores en el último año dado que, como se ha comprobado en otras ocasiones, las vacunas representan la estrategia preventiva más importante para la resolución de las pandemias.
Si bien, se ha conseguido alcanzar dicho objetivo en tiempo récord, el ritmo de producción y distribución de este recurso es más lento de lo deseado. Por ello, y ante la necesidad de dar respuesta a la demanda de vacunación poblacional, desde el Ministerio de Sanidad, Consumo y Bienestar Social (MSCBS), se han publicado unas líneas maestras para la priorización de la vacunación COVID-19 en España24.
En este sentido, y para la elaboración de este documento, se han tenido en cuenta las diferentes etapas de disponibilidad de vacunas (suministro inicial limitado/incremento progresivo/aumento sustancial del número de dosis), así como criterios técnicos de aplicación habitual en la valoración de vacunas (riesgo de morbilidad grave y mortalidad, riesgo de exposición, impacto socioeconómico, factibilidad y aceptación, entre otros). Por último, y de manera transversal, estas líneas maestras contemplan un marco ético sólido en el que se incluyen los principios de igualdad y dignidad de derechos, necesidad, equidad, protección a la discapacidad y al menor de edad, beneficio social y reciprocidad24.
Al igual que ocurre con otras enfermedades infecciosas, la variabilidad clínica se explica, en gran medida, en función de las características intrínsecas del huésped25. Así pues, desde el inicio de la pandemia, se han postulado diferentes comorbilidades o factores de riesgo que se han asociado con espectros de mayor gravedad y mortalidad. En general, todo apunta a que este virus afecta, de manera prioritaria, a poblaciones envejecidas y pluripatológicas26, registrándose una mayor letalidad para el grupo de 80 años y mayores, y aquellas personas con comorbilidades tales como enfermedad cardiovascular, diabetes mellitus, enfermedad respiratoria crónica, hipertensión arterial, obesidad, tabaquismo y cáncer, principalmente27,28.
En el caso de las enfermedades respiratorias, concretamente, se ha visto que la representación de personas con EPOC o asma con COVID-19 en relación con la prevalencia poblacional es llamativamente baja, sin embargo, la EPOC se asocia con un peor curso clínico y con una mayor mortalidad por COVID-19, así como con mayor riesgo de ingreso en UCI29–31.
Por otro lado, el tabaquismo podría ser también un factor de vulnerabilidad para la COVID-19. Se ha comprobado que los fumadores tienen una mayor sobreexpresión de la ECA-2, lo que sugiere que este hábito podría estar en relación con un mayor riesgo de esta infección32.
Hoy por hoy, la estrategia vigente de vacunación COVID-19 del MSCBS publicada el 26 de febrero del 202133 prioriza según la vulnerabilidad y el riesgo de exposición, habiéndose ya desarrollado la vacunación en las personas que residen en centros socio-sanitarios y sus trabajadores, profesionales del ámbito de la salud y grandes dependientes no institucionalizados; estando en activo la vacunación en mayores de 80 años no institucionalizados; y teniendo programada la vacunación del resto de grupos hasta junio del 2021 (trabajadores con una función social esencial menores de 56 años, personas entre 45 y 79 años y menores de 60 años con condiciones de riesgo, entre las que se encuentran las enfermedades crónicas sin inmunodepresión, entre otras).
Por último, merece la pena destacar el papel de los neumólogos dentro de la estrategia global de vacunación frente a la COVID-19 en España, ya que la promoción activa de la vacunación en sus pacientes favorecerá la prevención de esta infección y el control de la patología de base. Las elevadas coberturas de vacunación en la población general, y en las personas con enfermedades respiratorias en particular, reducirá la carga de enfermedad, la hospitalización convencional y en UCI de estos individuos, así como su mortalidad.
Recomendaciones- -
Las vacunas COVID-19 son la herramienta preventiva más eficaz para el control de la pandemia.
- -
La estrategia de vacunación COVID-19 en España combina la disponibilidad de vacunas, los criterios técnicos y los aspectos éticos.
- -
La implicación activa de los neumólogos en la estrategia de vacunación COVID-19 resulta clave para lograr una buena adherencia y elevadas coberturas vacunales en los pacientes con enfermedades respiratorias.
La UE ha autorizado tres vacunas frente a la COVID-19; la de Pfizer/BioNTech34 el día 22 de diciembre del 2020, la de ModernaTherapeutics35 el día 8 de enero del 2021 y la de la Universidad de Oxford/AstraZeneca36 el primero de febrero del mismo año.
Hasta el día 24 de marzo de 2021 se han distribuido 8.508.445 dosis en todo el territorio español, habiendo administrado 6.620.093 de dosis y completando la pauta de vacunación a 2.276.233 personas, según datos del Ministerio de Sanidad37.
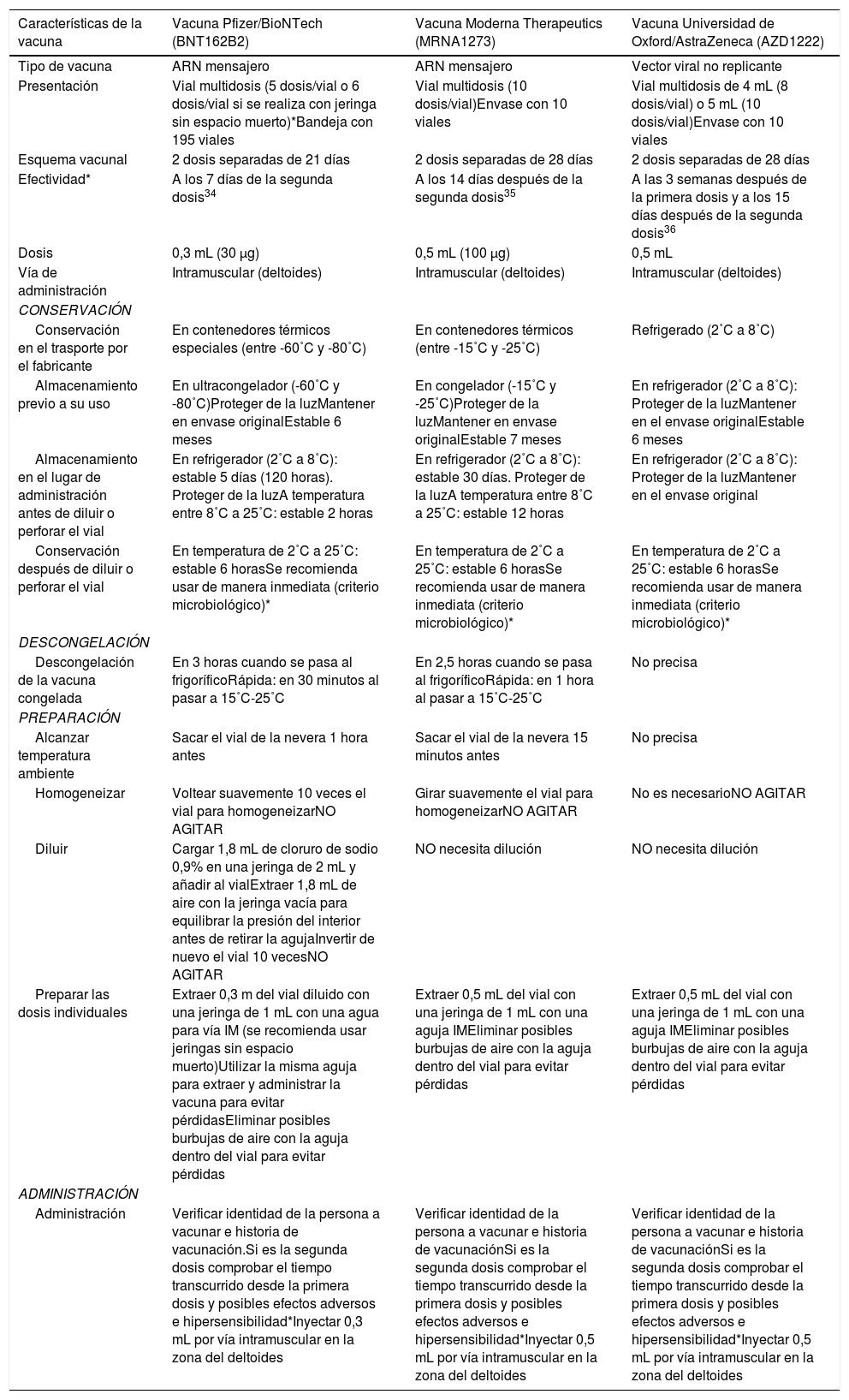
En este contexto, son varias las cuestiones que se deben conocer para maximizar la disponibilidad de las vacunas a la población: el almacenamiento, la manipulación y la administración de las diferentes vacunas (tabla 3).
Características principales de las primeras vacunas disponibles en Europa (febrero 2021)37
| Características de la vacuna | Vacuna Pfizer/BioNTech (BNT162B2) | Vacuna Moderna Therapeutics (MRNA1273) | Vacuna Universidad de Oxford/AstraZeneca (AZD1222) |
|---|---|---|---|
| Tipo de vacuna | ARN mensajero | ARN mensajero | Vector viral no replicante |
| Presentación | Vial multidosis (5 dosis/vial o 6 dosis/vial si se realiza con jeringa sin espacio muerto)*Bandeja con 195 viales | Vial multidosis (10 dosis/vial)Envase con 10 viales | Vial multidosis de 4 mL (8 dosis/vial) o 5 mL (10 dosis/vial)Envase con 10 viales |
| Esquema vacunal | 2 dosis separadas de 21 días | 2 dosis separadas de 28 días | 2 dosis separadas de 28 días |
| Efectividad* | A los 7 días de la segunda dosis34 | A los 14 días después de la segunda dosis35 | A las 3 semanas después de la primera dosis y a los 15 días después de la segunda dosis36 |
| Dosis | 0,3 mL (30 μg) | 0,5 mL (100 μg) | 0,5 mL |
| Vía de administración | Intramuscular (deltoides) | Intramuscular (deltoides) | Intramuscular (deltoides) |
| CONSERVACIÓN | |||
| Conservación en el trasporte por el fabricante | En contenedores térmicos especiales (entre -60˚C y -80˚C) | En contenedores térmicos (entre -15˚C y -25˚C) | Refrigerado (2˚C a 8˚C) |
| Almacenamiento previo a su uso | En ultracongelador (-60˚C y -80˚C)Proteger de la luzMantener en envase originalEstable 6 meses | En congelador (-15˚C y -25˚C)Proteger de la luzMantener en envase originalEstable 7 meses | En refrigerador (2˚C a 8˚C): Proteger de la luzMantener en el envase originalEstable 6 meses |
| Almacenamiento en el lugar de administración antes de diluir o perforar el vial | En refrigerador (2˚C a 8˚C): estable 5 días (120 horas). Proteger de la luzA temperatura entre 8˚C a 25˚C: estable 2 horas | En refrigerador (2˚C a 8˚C): estable 30 días. Proteger de la luzA temperatura entre 8˚C a 25˚C: estable 12 horas | En refrigerador (2˚C a 8˚C): Proteger de la luzMantener en el envase original |
| Conservación después de diluir o perforar el vial | En temperatura de 2˚C a 25˚C: estable 6 horasSe recomienda usar de manera inmediata (criterio microbiológico)* | En temperatura de 2˚C a 25˚C: estable 6 horasSe recomienda usar de manera inmediata (criterio microbiológico)* | En temperatura de 2˚C a 25˚C: estable 6 horasSe recomienda usar de manera inmediata (criterio microbiológico)* |
| DESCONGELACIÓN | |||
| Descongelación de la vacuna congelada | En 3 horas cuando se pasa al frigoríficoRápida: en 30 minutos al pasar a 15˚C-25˚C | En 2,5 horas cuando se pasa al frigoríficoRápida: en 1 hora al pasar a 15˚C-25˚C | No precisa |
| PREPARACIÓN | |||
| Alcanzar temperatura ambiente | Sacar el vial de la nevera 1 hora antes | Sacar el vial de la nevera 15 minutos antes | No precisa |
| Homogeneizar | Voltear suavemente 10 veces el vial para homogeneizarNO AGITAR | Girar suavemente el vial para homogeneizarNO AGITAR | No es necesarioNO AGITAR |
| Diluir | Cargar 1,8 mL de cloruro de sodio 0,9% en una jeringa de 2 mL y añadir al vialExtraer 1,8 mL de aire con la jeringa vacía para equilibrar la presión del interior antes de retirar la agujaInvertir de nuevo el vial 10 vecesNO AGITAR | NO necesita dilución | NO necesita dilución |
| Preparar las dosis individuales | Extraer 0,3 m del vial diluido con una jeringa de 1 mL con una agua para vía IM (se recomienda usar jeringas sin espacio muerto)Utilizar la misma aguja para extraer y administrar la vacuna para evitar pérdidasEliminar posibles burbujas de aire con la aguja dentro del vial para evitar pérdidas | Extraer 0,5 mL del vial con una jeringa de 1 mL con una aguja IMEliminar posibles burbujas de aire con la aguja dentro del vial para evitar pérdidas | Extraer 0,5 mL del vial con una jeringa de 1 mL con una aguja IMEliminar posibles burbujas de aire con la aguja dentro del vial para evitar pérdidas |
| ADMINISTRACIÓN | |||
| Administración | Verificar identidad de la persona a vacunar e historia de vacunación.Si es la segunda dosis comprobar el tiempo transcurrido desde la primera dosis y posibles efectos adversos e hipersensibilidad*Inyectar 0,3 mL por vía intramuscular en la zona del deltoides | Verificar identidad de la persona a vacunar e historia de vacunaciónSi es la segunda dosis comprobar el tiempo transcurrido desde la primera dosis y posibles efectos adversos e hipersensibilidad*Inyectar 0,5 mL por vía intramuscular en la zona del deltoides | Verificar identidad de la persona a vacunar e historia de vacunaciónSi es la segunda dosis comprobar el tiempo transcurrido desde la primera dosis y posibles efectos adversos e hipersensibilidad*Inyectar 0,5 mL por vía intramuscular en la zona del deltoides |
IM: intramuscular.
La preocupación sobre los acontecimientos adversos y la seguridad de las vacunas se presentan como una barrera para que la población general se vacune38, a pesar de que, hasta el 24 de enero del 2021, del 1.131.805 dosis de vacunas administradas solo se notificaron 1.555 acontecimientos adversos39. Los efectos adversos más frecuentes fueron los trastornos generales: fiebre y dolor en la zona de inyección; efectos en el sistema nervioso central: mareos y cefalea, y en el aparato digestivo: náuseas y diarrea. Los acontecimientos adversos más graves como la anafilaxia fueron infrecuentes en nuestro país, con ocho casos con la vacuna de Pfizer/BioNTech39 con un promedio de 7,2 casos por cada 1.000.000 de dosis administradas. No se han comunicado datos en España sobre anafilaxia con la vacuna Moderna Therapeutics39.
Aunque son infrecuentes, las estrategias de vacunación deben recoger elementos de máxima seguridad y, por este motivo, está justificado un período de observación postvacunal de 15 y hasta 30 min37 ya que, tal y como se ha documentado39, el inicio de los síntomas aparecen antes de este período, teniendo el 63% de las personas afectadas historia de urticaria y alergia a alimentos o medicamentos. Estos entornos deben contar con el material adecuado y personal capacitado para el manejo de estas situaciones de manera inmediata40.
Las percepciones hacia la vacunación frente a la COVID-19 plantean un reto mayúsculo para la vacunación voluntaria de la población. Son varios los estudios que ponen en relieve la necesidad de establecer estrategias que disminuyan las falsas percepciones contra la vacunación y la enfermedad por el SARS-CoV-2, de manera que hay elementos que actúan como barreras: la desconfianza a las indicaciones del gobierno o el pensamiento que la COVID-19 fue creada por el humano38,41 y elementos facilitadores: mayor conocimiento respecto a los síntomas, vías de transmisión y medidas de prevención y control del SARS-CoV-241.
Las estrategias de vacunación se han dividido en varias fases, priorizando a los profesionales sanitarios y a los residentes en centros socio-sanitarios y de larga estancia, obteniendo tasas de vacunación que superan el 85% en ambos grupos37. De esta manera, se consigue proteger a las personas más vulnerables y aquellas que cuidan de estas y, además, los profesionales sanitarios son una fuente confiable de información sobre las vacunas, indicando e interviniendo de manera temprana en las percepciones sobre la vacunación de la población general. Sin olvidar el papel de las instituciones sanitarias, que deben comprender las preocupaciones de la población, para así identificar las estrategias más eficaces38,42, persiguiendo la implicación de las personas en la vacuna y proporcionarles la información adecuada, explicando tal y como apunta el Ministerio de Sanidad: «los beneficios y riesgos de la vacunación como de la no vacunación».
Recomendaciones- -
Se deben establecer estrategias que garanticen la cobertura vacunal de manera equitativa a todos los grupos de población, de manera que se pueda prevenir la propagación de la COVID-19 y mitigar así el impacto de la pandemia.
- -
Si se garantizan fuentes de información fiables que mejoren el conocimiento sobre la COVID-19 en la población general, y los profesionales sanitarios asumen su papel como interlocutores válidos y confiables que recomienden la vacunación, se podrán disminuir las percepciones erróneas y el rechazo de estas y, por lo tanto, aumentar las cifras de personas vacunadas.
A continuación, se exponen distintas condiciones clínicas pertenecientes a enfermedades respiratorias y torácicas, tanto agudas como crónicas, que suponen una situación de especial vulnerabilidad ante la infección por SARS-CoV-2, y se dan recomendaciones del manejo de la vacuna COVID-19 en cada una de ellas (tabla 5). Esto no excluye que, en otras patologías respiratorias y torácicas, con características fisiopatológicas, clínicas o terapéuticas similares a las siguientes, también pudieran aplicarse. Por ello, se han elaborado unas recomendaciones generales (tabla 6).
Recomendaciones principales del uso de la vacuna COVID-19 según las patologías respiratorias
| Infección previa por SARS-CoV-2 | -Los pacientes con antecedentes de infección previa por SARS-CoV-2 confirmada deben vacunarse de acuerdo a la recomendación vigente.-El momento de vacunación en pacientes previamente infectados podría retrasarse hasta los seis meses y realizarse con una sola dosis.-Advertir de la posible intensidad de la reacción postvacunal en los sujetos con infección pasada hace menos de seis meses. |
| Infección respiratoria actual | -La vacunación se debe posponer en personas que presenten una enfermedad febril aguda grave (≥ 38°C) o una infección aguda.-La presencia de una infección leve y/o de fiebre de baja intensidad no debe posponer la vacunación. |
| Asma grave | -Se aconseja la administración de la vacuna del SARS-CoV-2 en los pacientes con asma alérgica con sensibilización a alérgenos inhalados (ácaros, pólenes, epitelio de animales, hongos), ya que no existe evidencia en contra.-Los pacientes con asma grave en tratamiento con fármacos biológicos pueden recibir la vacuna del SARS-CoV-2, siendo aconsejable retrasar 5-7 días la administración del biológico, fundamentalmente como vigilancia por la posible aparición de efectos adversos tras la vacuna.-Los pacientes con asma grave tratados con biológicos podría ser un grupo prioritario para la vacuna, ya que los últimos estudios han observado peor evolución de la enfermedad COVID-19 en este subgrupo.-No se debe administrar la vacuna SARS-COV-2 en pacientes con antecedente de reacción anafiláctica a fármacos biológicos. |
| EPOC estable y agudizado | -Los pacientes con EPOC deben ser un colectivo prioritario en recibir la vacunación frente al SARS-CoV-2.-Los pacientes con DAAT deben ser un colectivo prioritario en recibir la vacunación frente al SARS-CoV-2.-Ni el tabaquismo, ni los tratamientos para la EPOC ni el tratamiento de reposición para el DAAT constituyen una contraindicación para la vacunación frente al SARS-CoV-2.-Parece de sentido común no recomendar esta vacunación durante los episodios de exacerbación independientemente de la gravedad de la misma. |
| Bronquiectasias e infección bronquial crónica | -Los pacientes con bronquiectasias con/sin infección bronquial crónica deben de vacunarse frente al SARS-COV-2.-No es necesario el tratamiento previo con antibióticos, esteroides u otros de forma preventiva antes de la vacunación.-No debe de modificarse la pauta de ningún tratamiento de base como consecuencia de la vacunación-En el momento de una agudización es razonable esperar a la estabilización del proceso para proceder a la vacunación. |
| Hipertensión pulmonar | -Se recomienda la vacunación frente a la COVID-19 en los pacientes con hipertensión pulmonar.-Se recomienda no administrar la vacuna frente a la COVID-19 durante episodios de descompensación de la hipertensión pulmonar.-Los pacientes con hipertensión pulmonar que reciban tratamiento anticoagulante no deben interrumpir el tratamiento anticoagulante, pero sí tomar precauciones. |
| Tromboembolia pulmonar y tratamiento anticoagulantes | -El tratamiento anticoagulante no contraindica la vacunación frente a COVID-19.-Se recomienda no administrar la vacuna frente a COVID-19 en la fase aguda de la tromboembolia de pulmón. |
| Cáncer con tratamiento activo | -Se recomienda la vacunación de pacientes con cáncer avanzado, en especial aquellos con diagnóstico de cáncer de pulmón en tratamiento activo.-En pacientes con antecedentes de cáncer no hay datos que respalden su priorización a la hora de vacunar. Se deberán tener en cuenta otros factores de riesgo.-No existe contraindicación para la vacunación durante el tiempo que se esta recibiendo tratamiento oncológico, pero se recomienda la vacunación antes de iniciar el tratamiento. |
| EPID y tratamiento antifibrótico o inmunosupresor | -Los pacientes con EPID, especialmente aquellos con EPID fibrosantes, presentan un alto riesgo de infección severa y deben tener prioridad para vacunarse frente al SARS-CoV-2.-No existe evidencia de interacción con la medicación antifibrótica, por lo que no se debe modificar las pautas de tratamiento habitual, ni previa ni posteriormente a la vacunación frente al SARS-CoV-2, al igual que ocurre con la vacunación antigripal o antineumocócica en estos pacientes.-En el momento de una agudización de EPID es razonable esperar a la estabilización del proceso para proceder a la vacunación del SARS-CoV-2.-En los pacientes con EPID asociadas a enfermedades autoinmunes sistémicas y con tratamiento inmunomodulador se recomienda la vacunación contra SARS-CoV-2, con atención en aquellos pacientes en tratamiento con anticuerpos que deplecionan las células B, cuya administración será preferiblemente antes de la inmunosupresión planificada o lejos de la infusión. |
| Trasplante pulmonar | -Se recomienda la vacunación frente a COVID-19 en receptores de trasplante pulmonar y candidatos en lista de espera.-La vacunación ha de realizarse en un momento en que la enfermedad de base este estable sin necesidad de modificar las pautas de tratamiento inmunosupresor de base. |
| Cirugía torácica | -Las cirugías urgentes deben realizarse independientemente del estado vacunal.-Se recomienda agendar el proceso de vacunación y el procedimiento quirúrgico electivo para no demorar ninguno de los dos, separándolos máximo una semana, respetando los intervalos de dosis e individualizando en el caso de presentar inmunodeficiencias. |
DAAT: déficit de alfa 1 antitripsina; EPOC: enfermedad pulmonar obstructiva crónica; EPID: enfermedad pulmonar intersticial difusa.
Recomendaciones generales de uso de la vacuna COVID-19 en pacientes con enfermedades respiratorias crónicas
| Los pacientes con enfermedades respiratorias crónicas deben vacunarse frente a la COVID-19, dada la eficacia y seguridad de las vacunas actualmente aprobadas. |
| En pacientes con enfermedades respiratorias no se debe retrasar la vacunación ni suspender el tratamiento habitual, salvo infección activa o agudización. |
| La vacunación frente al SARS-CoV-2 no interfiere con la vacunación antigripal ni antineumocócica, por lo que éstas deben de seguir administrándose. |
| Los pacientes con antecedentes de infección previa por SARS-CoV-2 confirmada deben vacunarse de acuerdo a las normativas vigentes. |
| La recomendación del uso preventivo de paracetamol u otros fármacos, para reducir la incidencia de efectos adversos viene dada por las características clínicas del paciente y las normativas vigentes. |
Desde los primeros casos de la COVID-19 se planteó la duración y persistencia de la inmunidad frente al SARS-CoV-2. La demostración de algunas reinfecciones plantea una cuestión que ahora solo tiene una respuesta parcial. Hay personas cuyos niveles de anticuerpos han descendido desde los niveles postinfección al cabo de un año, pero todavía se desconoce cómo es realmente su inmunidad protectora frente a ella. Distintos trabajos han puesto de manifiesto la importancia de la respuesta de base celular para una protección más prolongada más allá de los niveles de anticuerpos detectados meses después de la infección43.
Esos aspectos son importantes para futuras recomendaciones. Si una infección confiere inmunidad de por vida, la recomendación debería ser no vacunar, y menos en un momento en el que la urgencia de tener el mayor número de personas vulnerables o con riesgo incrementado de muerte por la COVID-19 protegidas es crucial para eliminar la presión sanitaria en estos momentos de la pandemia.
Esas cuestiones solo podrán ser respondidas con precisión cuando se tenga mayor evidencia sobre correlatos subrogados de protección humoral y celular que ahora solo se conocen a través de las medidas basales de anticuerpos postinfección y su evanescencia; siendo más rápida para las inmunoglobulinas (Ig)M e IgA (41d-70d) y menor para las IgG. Sin saber cuáles son los correlatos de protección, es decir; los niveles que confieren protección y cuánto el tiempo medio para su evanescencia44.
Por tanto, las personas con infección previa deben vacunarse, puesto que desconocemos el cuánto y el cuándo de la inmunidad tras la infección y las vacunas pretenden proporcionar una inmunidad, si es posible, mayor que la de la infección natural. Sin embargo, es importante acotar el momento en el que deben vacunarse dichos individuos ante una posible escasez. Dado que en sanitarios con anticuerpos anti S, y por extensión en otras personas, no hay prácticamente riesgo de infección en los seis meses siguientes a la enfermedad45 dar prioridad vacunal a los sujetos naive del mismo rango poblacional y clínico que los ya infectados, puede ser una estrategia de vacunación en el momento actual de la pandemia. El Consejo Interterritorial (CIT) también se hace eco de esto en su cuarta actualización33. Más aún, se ha demostrado recientemente que los individuos que han pasado la infección tienen mayor proporción de efectos secundarios y de mayor intensidad y duración que los naive46. También, se ha observado que en los sujetos que han tenido una infección previa meses antes, se alcanzan niveles similares e incluso superiores de anticuerpos a los de personas naive tras la primera dosis de vacuna46,47.
Por tanto, parece que a la luz de la evidencia actual cabría no solo retrasar la vacunación en aquellas personas que hubieran pasado la infección sino también la posibilidad de administrarles una sola dosis en aquellos menores de 55 años, advirtiéndoles de la posible intensidad de la reacción postvacunal.
Recomendaciones- -
Los pacientes con antecedentes de infección previa por SARS-CoV-2 confirmada deben vacunarse de acuerdo con la recomendación vigente.
- -
El momento de vacunación en pacientes previamente infectados podría retrasarse hasta los seis meses y realizarse con una sola dosis en menores de 55 años.
- -
Advertir de la posible intensidad de la reacción postvacunal en los sujetos con infección pasada hace menos de seis meses.
En los ensayos clínicos realizados para comprobar la eficacia de las vacunas frente al SARS-CoV-2, se incluyeron adultos sanos o con enfermedades preexistentes que estuvieran estables (sin cambios en el tratamiento de base o sin hospitalizaciones por empeoramiento de la enfermedad durante las seis semanas anteriores a la inclusión)19. Uno de los criterios de exclusión era la fiebre (≥ 38,0°C) en las 48 a 72 horas previas, o en el momento de la inclusión. Los participantes que cumplieran este criterio debían ser reprogramados dentro de los períodos de ventana correspondientes. Los participantes afebriles con enfermedades leves podían ser inscritos a criterio del investigador19,21.
Por lo tanto, aunque no hay evidencia definitiva acerca de los riesgos de administrar la vacuna en pacientes con procesos infecciosos activos, en las fichas técnicas de las vacunas comercializadas solo se desaconseja posponerla en aquellos con fiebre alta, pudiendo ser vacunados los individuos con procesos infecciones leves. Por otro lado, no se debe suspender si una persona está tomando antibióticos debido a una infección que ya está en proceso de recuperación48.
En personas de elevado riesgo de contagio (sanitarios, trabajadores o residentes en centros socio-sanitarios) y que presenten síntomas que podrían ser debidos a COVID-19, sería recomendable descartar infección por SARS-CoV-2 mediante alguna de las técnicas diagnósticas aprobadas49. Al tratarse de pacientes sintomáticos, la más eficiente sería un test rápido de detección de antígenos.
Recomendaciones- -
La vacunación se debe posponer en personas que presenten una enfermedad febril aguda grave (≥ 38°C) o una infección aguda.
- -
La presencia de una infección leve y/o de fiebre de baja intensidad no debe posponer la vacunación.
Desde el inicio de la pandemia, ha habido mucho debate sobre si el asma es un factor de riesgo para mayor susceptibilidad al virus SARS-CoV-2 o progresión a formas graves de la COVID-19. Metaanálisis recientes sugieren que no es factor de riesgo50–53, e incluso se ha especulado sobre la posibilidad de un efecto protector51, a través de la disminución de los receptores ACE-253,54.
Sin embargo, hay pocos estudios publicados en pacientes con asma grave (AG). Muchos de estos con inflamación T2 reciben tratamiento con fármacos biológicos dirigidos a la Ig E, IL-5, IL-5Rα y IL-4Rα55 y también existe poca evidencia sobre la implicación de estos tratamientos en la infección por SARS-CoV-2. El mayor estudio incluye 634 pacientes con AG tratada con biológicos de los cuales nueve (1,4%) se diagnosticaron con COVID-19 y presentaron un curso más grave que la población general56 si bien se desconoce si la causa, fueron las comorbilidades asociadas (obesidad, diabetes mellitus e hipertensión arterial), la gravedad del asma o los propios fármacos biológicos57. En el momento actual, el papel de la respuesta inmune tipo 2, en particular de los eosinófilos, en la defensa antiviral frente al SARS-CoV-2 no ha sido elucidado58.
Los pocos casos clínicos descritos59–61 no han observado ninguna reacción clínica adversa con la administración de los fármacos biológicos en pacientes con infección por el virus SARS-CoV-2, aunque se desconoce su efecto en la respuesta inmune al virus y si puede prolongar el tiempo para la recuperación de la infección62.
En cuanto a la administración de la vacuna frente al SARS-CoV-2 en pacientes asmáticos con alergias no existe evidencia de que presenten reacciones más graves que la población general. La alergia a fármacos, alimentos, veneno de himenópteros o alérgenos inhalados (ácaros, pólenes, epitelio de animales y hongos) no es en general contraindicación para ninguna vacuna, incluyendo la del SARS-CoV-263. La única contraindicación absoluta es la constancia de reacción alérgica a cualquier componente de la vacuna.
Con respecto a las posibles interacciones entre la vacuna SARS-CoV-2 y los fármacos biológicos, es poco probable ya que la respuesta inmunológica frente a la vacuna está mediada por las células Th164,65 mientras que los fármacos biológicos disponibles actualmente para asma actúan sobre el mecanismo inflamatorio Th2. El PEG, probable implicado en la reacción alérgica grave a la vacuna, puede tener reacción cruzada con el polisorbato-80 que se ha observado como inductor de anafilaxia después de la administración de algunos biológicos utilizados en el asma66.
Recomendaciones- -
Se recomienda continuar el tratamiento de mantenimiento habitual del asma y/o rinitis para no perder el control de la enfermedad.
- -
Se recomienda mantener los tratamientos biológicos indicados para el AG en pacientes no infectados por SARS-CoV-2 a ser posible en autoadministración para evitar riesgo de transmisión del virus.
- -
En caso de infección por SARS-CoV-2 se aconseja demorar la administración del biológico hasta la resolución clínica (aproximadamente 10 a 14 días), ya que se desconoce su efecto en la respuesta inmune al virus.
- -
En casos de infección por SARS-CoV-2 y asma agudizada, se debe individualizar la administración del biológico, ya que no se han observado reacciones adversas en los escasos casos administrados durante la infección.
- -
Se aconseja la administración de la vacuna del SARS-CoV-2 en los pacientes con asma alérgica con sensibilización a alérgenos inhalados (ácaros, pólenes, epitelio de animales y hongos) ya que no existe evidencia en contra.
- -
Los pacientes con AG en tratamiento con fármacos biológicos pueden recibir la vacuna del SARS-CoV-2, siendo aconsejable retrasar cinco a siete días la administración del biológico, fundamentalmente como vigilancia por la posible aparición de efectos adversos tras la vacuna.
- -
En el caso de las vacunas vía sublingual, se recomienda que el paciente no tome la dosis el día de la administración de la vacuna contra la COVID-19 ni en los siguientes siete días.
- -
Los pacientes con AG tratados con biológicos podrían ser un grupo prioritario para la vacuna, ya que los últimos estudios han observado peor evolución de la enfermedad COVID-19 en este subgrupo.
- -
No se debe administrar la vacuna SARS-COV-2 a pacientes con antecedentes de reacción anafiláctica a fármacos biológicos.
- -
Se aconseja realizar una valoración del riesgo de reacciones graves a la vacuna a través de un interrogatorio previo a la administración (tabla 4) y en caso de respuesta afirmativa, derivar a Alergología para realizar un estudio y la administración con precauciones especiales (medicación de emergencia, personal entrenado y vigilancia postvacuna).
Tabla 4.Valoración del riesgo de reacciones alérgicas graves
Valoración del riesgo de reacciones alérgicas graves Reacciones alérgicas graves a medicamentos, vacunas, PEG o polisorbatos* Reacciones alérgicas graves a un desencadenante desconocido Anafilaxia previa Mastocitosis** Reacción después de la primera dosis de la vacuna *La alergia grave a medicamentos no contraindica la vacuna pero es aconsejable un periodo de observación de 45 minutos. Muchas vacunas comparten excipientes por lo que no se aconseja la administración sin estudio previo en estos casos ni en los casos de anafilaxia previa no estudiada.
**En el caso de mastocitosis, síndrome de activación mastocitaria o alfa-triptasemia hereditaria deberán tomar un antihistamínico tipo 1 por vía oral una hora antes de la administración de la vacuna. En caso de que no tome ningún antihistamínico se recomienda loratadina (10 mg), bilastina (20 mg) o rupatadina (10 mg).
Actualmente, existen diversas controversias sobre la vacunación contra el SARS-CoV-2 y la EPOC. Desafortunadamente, no existe evidencia disponible en pacientes con EPOC sobre la que poder basar algunas recomendaciones. Consecuentemente, a pesar de que el nuevo documento de la Global Initiative for Chronic Obstructive Lung Disease (GOLD) aborda esta infección, no incluye recomendaciones específicas sobre la vacunación67. La relación entre la vacunación y la EPOC se puede resumir en tres controversias.
En primer lugar, podemos afirmar que la EPOC no es un factor de riesgo para adquirir la infección, pero sí para desarrollar una forma más grave68. Igualmente, los pacientes con déficit de alfa 1 antitripsina (DAAT) tienen un sustrato adverso frente a esta infección69. Por tanto, tanto los pacientes con EPOC como aquellos con DAAT no solo deben recibir la vacunación completa, sino que deben ser un colectivo prioritario en obtenerla.
En segundo lugar, se podría plantear si el tabaquismo activo o algunos tratamientos podrían influir en la eficacia de la vacunación. Los ensayos clínicos disponibles no analizan estos subgupos de pacientes ni se describen el tabaquismo o los tratamientos en las descripciones de la muestra. No obstante, por el momento, no hay razones para pensar que pudiera existir alguna interacción de suficiente relevancia como para comprometer su eficacia o seguridad19,23. Análogamente, el tratamiento de reposición para el DAAT no es una contraindicación para recibir la vacuna. Más bien al contrario, existe evidencia que este tratamiento podría beneficiar a los pacientes con la COVID-1970.
Finalmente, otro debate es sobre su administración durante una agudización. Igualmente, no disponemos de estudios sobre este escenario clínico. No obstante, debido a que la vacunación puede dar síntomas sistémicos, probablemente sea prudente no vacunar durante un proceso respiratorio agudo como es una agudización independientemente del grado de gravedad de la misma.
Recomendaciones- -
Los pacientes con EPOC deben ser un colectivo prioritario en recibir la vacunación frente al SARS-CoV-2.
- -
Los pacientes con DAAT deben ser un colectivo prioritario en recibir la vacunación frente al SARS-CoV-2.
- -
Ni el tabaquismo, ni los tratamientos para la EPOC ni la terapia de reposición para el DAAT constituyen una contraindicación para la vacunación frente al SARS-CoV-2.
- -
No se recomienda esta vacunación durante los episodios de exacerbación independientemente de la gravedad de la misma.
No existe información en la literatura sobre la prevalencia o impacto en el riesgo, gravedad de la enfermedad o respuesta al tratamiento de la infección por SARS-CoV-2 en individuos que padecen bronquiectasias con o sin infección bronquial crónica (IBC) por microorganismos potencialmente patógenos (MPP) previa a la infección vírica. Sin embargo, una vez aparecida la neumonía por SARS-CoV-2, la evolución de aquellos pacientes que padecen enfermedades inflamatorias crónicas de las vías aéreas parece que es peor68.
En los últimos meses, sin embargo, se ha ido acumulando cierta evidencia sobre la aparición tanto en fase aguda como, sobre todo como secuela, de bronquiectasias habitualmente por tracción en el contexto de fibrosis pulmonares permanentes en pacientes que han sufrido una neumonía grave por SARS-CoV-271,72. No ha pasado el tiempo suficiente como para evaluar el impacto que estas bronquiectasias puedan tener en el futuro o si van a suponer un incremento en la incidencia de IBC posterior.
Los ensayos clínicos hasta ahora realizados sobre las diferentes vacunas disponibles o en fase de estudio para la infección por SARS-CoV-2 han incluido a pacientes que no padecieran enfermedades graves o inestables, aunque no se detalla con detalle qué tipo, gravedad o inestabilidad se ha establecido para cada una de estas patologías19,21,23. Ello hace que, si bien, los pacientes con bronquiectasias con o sin IBC en fase estable sí estarían incluidos en los ensayos y por lo tanto formarían parte del grupo de individuos con enfermedades crónicas, a la hora de proceder a la vacunación, no existe evidencia sobre aquellos individuos con bronquiectasias o IBC inestables o en fase de agudización.
Recomendaciones- -
En términos generales, los pacientes con bronquiectasias con o sin IBC deben de proceder a la vacunación contra SARS-CoV-2. Estos individuos quedarían encuadrados dentro del grupo de aquellos con enfermedades crónicas.
- -
No es necesario el tratamiento previo con antibióticos, esteroides u otros de forma preventiva antes de la vacunación.
- -
No debe de modificarse la pauta de ningún tratamiento de base como consecuencia de la vacunación.
- -
En fase de agudización infecciosa (sea por infección por COVID-19 o no) es recomendable que se espere a la vacunación una vez que el paciente se haya estabilizado, dado que algunos de los efectos adversos podrían recrudecer los síntomas de la propia agudización.
- -
En aquellos pacientes con bronquiectasias o IBC que ya hayan pasado la infección por SARS-CoV-2, se seguirán las mismas recomendaciones que se explican en el apartado correspondiente.
Las neumonías son causantes del 7 al 9% de las muertes de los pacientes con hipertensión pulmonar (HP), lo que justifica la recomendación de vacunación frente a determinados microorganismos respiratorios, que incluye la vacunación antigripal anual y frente al neumococo, aún en ausencia de ensayos clínicos que lo hayan evaluado73.
A pesar de que los pacientes con enfermedades cardiovasculares parecen ser una población de mayor riesgo de desarrollo de formas más graves de COVID-19, actualmente existe muy escasa información sobre el curso clínico en los pacientes con HP74.
El objetivo de la vacunación es obtener la inmunidad frente al SARS-CoV-2 y aunque los pacientes con HP (en situación de estabilidad) no fueron excluidos de los ensayos clínicos de las vacunas actualmente disponibles, no se han publicado datos de eficacia y seguridad en este subgrupo especial de pacientes19,21.
Recomendaciones- -
En términos generales, se recomienda la vacunación frente a la COVID-19 en los pacientes con HP75.
- -
No es necesario modificar la pauta del tratamiento específico para la HP como consecuencia de la vacunación para la COVID-19.
- -
Se recomienda evitar la vacunación frente a la COVID-19 durante un episodio agudo de descompensación (cardiológica y/o respiratoria) de la HP, por el riesgo de aparición de reacciones adversas asociadas a la vacuna (fatiga, fiebre, cefalea y artromialgias) que conlleven un manejo más complejo del episodio19,21. En estos casos, se recomienda retrasar la vacunación hasta la estabilidad clínica del paciente.
- -
En los pacientes con HP que reciben tratamiento anticoagulante, la vía de administración intramuscular de las vacunas contra la COVID-19 no supone una contraindicación, pero sí deben tomar precauciones, siguiendo las mismas recomendaciones y consideraciones para la administración de la vacuna que los que reciben tratamiento anticoagulante sin HP (apartado de vacunación en pacientes con tromboembolia de pulmón [TEP] y tratamiento anticoagulante)76.
- -
Los pacientes con HP en tratamiento con fármacos inmunosupresores se deben vacunar frente a la COVID-1977.
Las vacunas frente a la COVID-19 se administran por vía intramuscular33. Aunque ninguno de los ensayos clínicos publicados hasta la fecha que han evaluado la eficacia y seguridad de las vacunas contra esta enfermedad ha excluido a los pacientes que recibían tratamiento anticoagulante19,21, no se han comunicado los datos de seguridad en este subgrupo de individuos.
Las fichas de autorización de las vacunas frente a COVID-19 indican que la única contraindicación para su uso es la hipersensibilidad al producto y aceptan su empleo si los beneficios superan los riesgos33. La ausencia de contraindicación para su uso en pacientes anticoagulados se basa en: la extrapolación de los datos de seguridad relativos a otras vacunas, como la de la gripe78 y en su mecanismo de acción, que no implica interacciones aparentes con los fármacos anticoagulantes.
Recomendaciones- -
No se debe suspender el tratamiento anticoagulante previo a la administración de la vacuna.
- -
Los pacientes anticoagulados con antagonistas de la vitamina K (acenocumarol o warfarina) deben tener un índice internacional normalizado (INR) dentro del rango terapéutico (INR < 3) en un control reciente.
- -
La vacunación en los pacientes tratados con anticoagulantes orales de acción directa o heparinas de bajo peso molecular debe realizarse en las horas previas (por ejemplo, dos horas previas) a la administración del anticoagulante.
- -
Se recomienda la administración de la vacuna con aguja fina (no más de 23G) y presionar la zona de punción (sin frotar) al menos dos minutos. Se debe informar al paciente de la posibilidad de aparición de un hematoma en el lugar de la punción.
- -
Se recomienda no vacunar en la fase aguda (por ejemplo, en las tres primeras semanas después del diagnóstico) de la TEP. La posible aparición de efectos adversos asociados a la vacunación podría dificultar el manejo de la TEP en el período de mayor riesgo de recurrencia trombótica y de sangrado79.
Tras la aprobación de la vacuna y la estrategia de vacunación frente al SARS-CoV-2 no se han desarrollado unas recomendaciones específicas paras los pacientes afectados por cáncer o que se encuentren en tratamiento activo. Paralelamente, sí que se han publicado recomendaciones sobre la vacunación en pacientes con cáncer realizadas por sociedades internacionales de referencia como la Sociedad Española de Oncología Médica (SEOM), la European Society for Medical Oncology (ESMO), la American Association for Cancer Research (AACR) y la Federación de Asociaciones Científico Médicas Españolas (FACME)80–82.
Los pacientes con cáncer deben ser considerados dentro del grupo de personas de riesgo debido a que tienen una mayor probabilidad de enfermedad grave y mortalidad elevada en caso de contraer la infección por el virus. Dentro de este grupo, los individuos afectados por cáncer de pulmón se consideran los de mayor riesgo.
Las vacunas aprobadas por la EMA son seguras excepto aquellas con virus vivos o atenuados que están contraindicadas en estos pacientes.
No disponemos de información específica sobre la eficacia de la vacuna en pacientes con cáncer ya que esta población no se incluyó en los ensayos clínicos desarrollados.
Los datos sobre la inmunidad generada son escasos, pero se supone inferior en aquellos sujetos en terapia con quimioterapia intensiva, de ahí que se recomiende la vacunación previa al inicio del tratamiento.
No hay datos suficientes para evaluar las interacciones entre los tratamientos oncológicos con la vacunación.
La vacuna no está contraindicada en pacientes en terapia con inmunoterapia ya que no se ha demostrado que aumente las complicaciones.
Recomendaciones- -
Se recomienda la vacunación de pacientes con cáncer avanzado, en especial aquellos con diagnóstico de cáncer de pulmón en tratamiento activo.
- -
En pacientes con antecedentes de cáncer no hay datos que respalden su priorización a la hora de vacunar. Se deberán tener en cuenta otros factores de riesgo.
- -
-No existe contraindicación para la vacunación durante el tiempo que se está recibiendo tratamiento oncológico, pero se recomienda la vacunación antes de iniciar la terapia.
Las EPID son un grupo heterogéneo de enfermedades caracterizadas por infiltración de las paredes alveolares de una combinación de células inflamatorias y fibrosis debido a un proceso de cicatrización anormal desencadenado por daño del epitelio alveolar83.
En los pacientes con EPID preexistente, las infecciones virales pueden desencadenar exacerbaciones agudas, una complicación asociada con una alta mortalidad84.
Varios estudios encontraron que los pacientes con EPID tenían mayor riesgo de muerte en comparación con los sujetos control emparejados por edad, sexo, comorbilidades y/o raza85,86. Especialmente aquellos con EPID fibrótica, en contraste con aquellos con otro tipo, y también atribuible a la edad, sexo masculino y la gravedad de la EPID subyacente reflejada por el uso de oxígeno suplementario87.
Los pacientes con EPID asociadas a enfermedades autoinmunes sistémicas (EAS), con tratamientos inmunomoduladores no parecen tener un mayor riesgo de infección por SARS-CoV-2 o complicaciones en comparación con la población general88.
Para la mayoría de los pacientes con enfermedades reumatológicas, la European Alliance of Associations for Rheumatology (EULAR) recomienda las mismas inmunizaciones estándar que para la población general, así como la inmunización no rutinaria contra la influenza y los neumococos89.
Las vacunas deben administrarse preferiblemente antes de la inmunosupresión planificada, en particular, la terapia de anticuerpos que deplecionan las células B89.
Las vacunas no vivas pueden administrarse a pacientes con EAS, incluso mientras estén tratados con glucocorticoides sistémicos y fármacos antirreumáticos modificadores de la enfermedad (FARME)89. Las vacunas para SARS-COV-2 de Pfizer/BioNTech y la vacuna Moderna Therapeutics (vacunas de ARNm) no están contraindicadas en enfermedades autoinmunes y en terapia inmunosupresora34,35.
En la vacuna de la Universidad de Oxford/AstraZeneca la proteína S es vehiculizada en un vector de adenovirus de chimpancé sin capacidad replicativa, por lo que al día de hoy en personas inmunodeprimidas o en tratamiento inmunosupresor, se recomienda valorar la utilización de otras vacunas36.
Recomendaciones- -
Los pacientes con EPID, especialmente aquellos con EPID fibrosantes, presentan un alto riesgo de infección severa y deben tener prioridad para vacunarse frente al SARS-CoV-2.
- -
No existe evidencia de interacción con la medicación antifibrótica, por lo que no se debe modificar las pautas de tratamiento habitual, ni previa ni posteriormente a la vacunación frente al SARS-CoV-2, al igual que ocurre con la vacunación antigripal o antineumocócica en estos pacientes.
- -
En el momento de una agudización de EPID es razonable esperar a la estabilización del proceso para proceder a la vacunación del SARS-CoV-2.
- -
En los pacientes con EPID asociadas a EAS y con tratamiento inmunomodulador, se recomienda la vacunación contra SARS-CoV-2, con atención en aquellos sujetos en tratamiento con anticuerpos que deplecionan las células B, cuya administración será preferiblemente antes de la inmunosupresión planificada o lejos de la infusión.
La infección por la COVID-19 presenta mayor incidencia y gravedad en el receptor de trasplante pulmonar90. Por ello, estos pacientes y los candidatos en lista de espera deben ser considerados grupo prioritario para la vacunación frente a SARS-CoV-2.
La vacunación de pacientes trasplantados ha de realizarse con vacunas que no estén basadas en virus vivos atenuados, ni en vectores virales replicativos. Aunque no existen estudios específicos realizados en individuos inmunocomprometidos, es esperable que el perfil de seguridad de las vacunas disponibles (basadas en ARNm, que es rápidamente degradado en el interior celular, y no tiene capacidad de inserción ni de replicación) sea similar en pacientes inmunodeprimidos que el observado en la población general. Dado que no son vacunas adyuvadas, el riesgo de desencadenar fenómenos de alorreactividad (rechazo agudo del injerto) no debería ser mayor, aunque se necesitan más estudios en esta población al respecto91.
Tampoco existe información sobre la eficacia de las vacunas frente al virus SARS-CoV-2 en pacientes inmunocomprometidos, pero la experiencia con otras vacunas (por ejemplo, la de la gripe) apunta a que puede lograrse un apropiado nivel de inmunización en esta población de pacientes. No obstante, una vez vacunados, los sujetos han de continuar respetando las medidas generales de autoprotección91–93.
No se conoce con exactitud el momento ideal para la vacunación. Se recomienda que se realice a partir del primer mes después del trasplante, en un momento en el que la enfermedad de base sea estable o sus complicaciones las menores posibles. No se recomienda modificar las pautas de tratamiento basal para recibir la inmunización77,93.
Los individuos trasplantados y en lista de espera deben ser informados sobre la ausencia de datos relativos a la eficacia y la seguridad de las vacunas en estos grupos de pacientes.
Recomendaciones- -
Se recomienda la vacunación frente a COVID-19 en receptores de trasplante pulmonar y candidatos en lista de espera.
- -
La vacunación ha de realizarse en un momento en que la enfermedad de base esté estable sin necesidad de modificar las pautas de tratamiento inmunosupresor de base.
La novedosa estrategia de vacunación desplegada en España94, a día de hoy, no ha desarrollado recomendaciones para la vacunación de pacientes a los que se deba practicar un procedimiento quirúrgico, si bien existen ciertas pautas ya referenciadas95,96 y que podemos aplicar al ámbito de la cirugía torácica.
En cuanto a las cirugías urgentes, se deben de llevar a cabo independientemente del estado de vacunación.
Es recomendable separar la fecha de cirugía con respecto a la vacunación, máximo una semana, para que los síntomas puedan atribuirse a la vacuna o al procedimiento quirúrgico en sí.
No existe en la actualidad una actitud para priorizar la vacunación de los pacientes programados para procedimientos electivos antes de la fecha de operación prevista.
Sería conveniente una valorización multidisciplinar en el caso de pacientes inmunodeprimidos que puedan ser candidatos a una cirugía electiva como en el caso de haber recibido un tratamiento quimioterápico previo a la cirugía.
Actualmente, no existen interferencias entre las vacunas disponibles y la necesidad de administración de hemoderivados.
Cuando coincida la vacunación con una cirugía electiva, esta podrá realizarse siete días después de la primera dosis recibida, de tal modo, que la segunda dosis podría suministrarse con un intervalo de dos semanas tras el procedimiento quirúrgico.
Otra alternativa es realizar el proceso completo de vacunación antes o después de la intervención quirúrgica, evitando la posible interacción con el proceso quirúrgico y sus efectos.
Es conveniente respetar los intervalos entre dosis según la ficha técnica de las vacunas disponibles, teniendo los períodos ventana de efectividad aprobados por las Agencias Europea y Española del Medicamento.
En definitiva, se debe facilitar el agendar el proceso quirúrgico con el calendario vacunal de los pacientes, individualizando los casos, con el fin de que ninguna de las dos actividades sea demorada.
Recomendaciones- -
Las cirugías urgentes deben realizarse independientemente del estado vacunal.
- -
Se recomienda agendar el proceso de vacunación y el procedimiento quirúrgico electivo para no demorar ninguno de los dos, separándolos máximo una semana, respetando los intervalos de dosis e individualizando en el caso de presentar inmunodeficiencias.
La utilidad principal de este documento es que las recomendaciones dadas pueden ayudar al personal sanitario en la toma de decisiones sobre cómo actuar en la vacunación por COVID-19 en los pacientes con enfermedad respiratoria. Esto lo convierte en un instrumento eficaz para reducir el impacto de la infección del SARS-CoV-2 y mejorar la salud de estos enfermos.
Una de las dificultades en la elaboración del documento era dar recomendaciones que tengan validez a medio-largo plazo, dado que la evidencia actual es escasa y aumentará tras la publicación de este documento, con aparición de nuevas vacunas y cambios en la autorización de algunas de ellas, según los datos de farmacovigilancia. Esto también limitó la posibilidad de utilizar una metodología propia, como GRADE. Además, el número creciente de artículos que aparecerán en las próximas fechas sobre la vacunación por COVID-19 dejaría obsoleta esta clasificación, al estar en continuo cambio.
Teniendo en cuenta los datos aportados y las principales recomendaciones dadas, podemos concluir que las vacunas para la COVID-19 no solo son seguras y eficaces, sino que actualmente son la herramienta preventiva más útil para el control de la pandemia. Si la infección por el SARS-CoV-2 puede provocar lesiones graves del sistema respiratorio, especialmente en aquellos pacientes vulnerables con enfermedades respiratorias crónicas, la vacunación en estos es prioritaria, aunando el bien colectivo con el individual y siempre que resulte compatible con una administración eficiente de las vacunas. Además, la implicación activa de los profesionales sanitarios que manejan estas patologías en la estrategia de vacunación es clave para lograr una buena adherencia y coberturas elevadas. Por último, en general y salvo infección activa o agudización, en las enfermedades respiratorias no se debe retrasar la vacunación ni suspender el tratamiento habitual.
Contribución de los autoresTodos los autores han contribuido en el análisis de las recomendaciones, en la revisión crítica del contenido, en la redacción del artículo y en la aprobación definitiva de la versión que se presenta.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesRosario Menéndez declara honorarios de conferencias de Pfizer y GSK Advisory Board. El resto de los autores declaran no tener ningún conflicto de intereses.
Felipe Villar-Álvarez y Miguel Ángel Martínez-García forman parte del Comité Editorial de Open Respiratory Archives y declaran que se han mantenido al margen del proceso de evaluación y de la toma de decisiones en relación a este artículo.
Al Área de TIR de SEPAR por la iniciativa y el apoyo en la coordinación y realización del documento, al Comité Científico de SEPAR por sus recomendaciones de mejora en la metodología del documento y a la presidencia de SEPAR por su aval y apoyo en el establecimiento de las recomendaciones. Además, queremos agradecer el esfuerzo de todos los sanitarios qua han trabajado para el control de la pandemia por COVID-19 y esperamos que este documento les sirva de gran ayuda.