La recaída de la púrpura trombótica trombocitopénica (PTT) se define como recurrencia de un episodio después de 30 o más días de haber conseguido la remisión completa, que a su vez se define como la obtención de una cifra de plaquetas superior a 150 × 109/l de forma mantenida y ausencia de hemólisis. Aunque las recaídas pueden ocurrir en el 20-50% de los casos, rara vez son múltiples. El riesgo es mayor durante el primer y segundo año. Se presenta un caso de una paciente con PTT que presentó múltiples recaídas. Se realiza revisión de la etiopatogenia de la PTT, manejo terapéutico y seguimiento clínico.
Relapse of thrombotic thrombocytopenic purpura (TTP) is defined as the recurrence of an episode 30 days or more after achieving complete remission, which in turn is defined as a sustained platelet count greater than 150 × 109/l and absence of haemolysis. Although relapses may occur in 20%-50% of cases, they are rarely multiple. The risk is greater during the first and second year. We present the case of a patient with TTP with multiple relapses. A review of the aetiopathogenesis of TTP, therapeutic management and clinical follow-up is performed.
La recaída de la púrpura trombótica trombocitopénica (PTT) se define como recurrencia de un episodio después de 30 o más días de haber conseguido la remisión completa (RC), que a su vez se define como la obtención de una cifra de plaquetas superior a 150 × 109/l de forma mantenida y ausencia de hemólisis. Aunque las recaídas pueden ocurrir en el 20-50% de los casos, rara vez son múltiples. El riesgo es mayor durante el primer y segundo año. Se presenta un caso de una paciente con PTT que presentó múltiples recaídas.
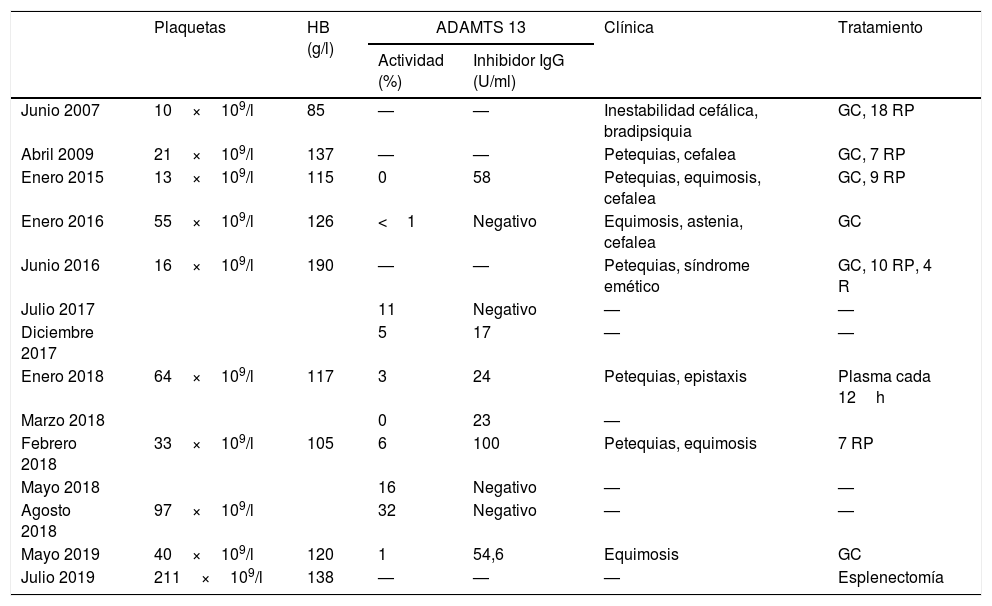
Mujer de 65 años con alergia a cobalto, látex y anisakis. Acudió en 2007 por clínica de somnolencia, bradipsiquia e inestabilidad cefálica. En la analítica destacaba: hemoglobina 85 g/l y plaquetas de 10 × 109/l. En el examen del frotis de sangre periférica se observaban abundantes esquistocitos. La prueba de la anti-globulina directa fue negativa y las pruebas de función renal fueron normales. Se estableció el diagnóstico de PTT y se inició tratamiento con glucocorticoides (1mg/kg/día, p.o.) y recambios plasmáticos (RP) diarios con infusión de plasma fresco como solución de reposición. Tras 18 sesiones de RP consiguió la RC. Desde entonces ha presentado 8 recaídas (tabla 1), con clínica predominantemente neurológica y diátesis hemorrágica cutánea, que se han controlado con RP y glucocorticoides. En una de las recaídas recibió además tratamiento con 4 dosis de rituximab semanal. La monitorización de la actividad de ADAMTS13 y de la presencia de inhibidor de ADAMTS13 (anticuerpo anti-ADAMTS13 tipo IgG) evidenció actividad ADAMTS13<5% y presencia de inhibidores, incluso en los periodos de RC (tabla 1). Se completó el estudio con determinación de HLA-DR (alelos DRB1*03 y DRB1*04), y de mutaciones del gen ADAMTS13, que fue negativo. Tras el último episodio se realizó esplenectomía. Actualmente se encuentra en RC tras 10 meses del último episodio tratado con glucocorticoides y tras 8 meses de la esplenectomía.
Tratamiento y evolución de las recaídas, la actividad de ADAMTS13 y su inhibidor
| Plaquetas | HB (g/l) | ADAMTS 13 | Clínica | Tratamiento | ||
|---|---|---|---|---|---|---|
| Actividad (%) | Inhibidor IgG (U/ml) | |||||
| Junio 2007 | 10×109/l | 85 | — | — | Inestabilidad cefálica, bradipsiquia | GC, 18 RP |
| Abril 2009 | 21×109/l | 137 | — | — | Petequias, cefalea | GC, 7 RP |
| Enero 2015 | 13×109/l | 115 | 0 | 58 | Petequias, equimosis, cefalea | GC, 9 RP |
| Enero 2016 | 55×109/l | 126 | <1 | Negativo | Equimosis, astenia, cefalea | GC |
| Junio 2016 | 16×109/l | 190 | — | — | Petequias, síndrome emético | GC, 10 RP, 4 R |
| Julio 2017 | 11 | Negativo | — | — | ||
| Diciembre 2017 | 5 | 17 | — | — | ||
| Enero 2018 | 64×109/l | 117 | 3 | 24 | Petequias, epistaxis | Plasma cada 12h |
| Marzo 2018 | 0 | 23 | — | |||
| Febrero 2018 | 33×109/l | 105 | 6 | 100 | Petequias, equimosis | 7 RP |
| Mayo 2018 | 16 | Negativo | — | — | ||
| Agosto 2018 | 97×109/l | 32 | Negativo | — | — | |
| Mayo 2019 | 40×109/l | 120 | 1 | 54,6 | Equimosis | GC |
| Julio 2019 | 211×109/l | 138 | — | — | — | Esplenectomía |
GC: glucocorticoides; R: rituximab; RP: recambio plasmático.
La presentación más común de la PTT es en forma de un solo episodio, aunque más de un tercio de los pacientes presentan una o más recaídas1. La mortalidad de cada episodio puede llegar al 10-20% y cada recaída expone al paciente a complicaciones relacionadas con la enfermedad y/o el tratamiento. A largo plazo, puede disminuir la calidad de vida, con aparición de déficits neurocognitivos, hipertensión arterial y depresión mayor, así como enfermedades relacionadas con el tejido conectivo (lupus eritematoso sistémico y síndrome de Sjögren, entre otras)2.
El único marcador biológico específico para predecir una recaída en los pacientes con PTT adquirida en RC es la actividad de ADAMTS132. Los pacientes con niveles de actividad de ADAMTS13<10% y/o con presencia de inhibidor de ADAMTS13 tras conseguir la RC tienen aproximadamente 3 veces más riesgo de presentar una recaída3,4. Además, se han descrito otros factores de riesgo, como el sexo femenino, la obesidad, la etnia negra, ciertos fármacos y la presencia de ciertos alelos HLA-DR, principalmente el B1*11, porque pueden facilitar el desarrollo de autoinmunidad frente a ADAMTS134.
El rituximab es eficaz en la inhibición de la producción de los inhibidores de ADAMTS13 y disminuye la incidencia de recaída en el 50% de los casos, por lo que se ha utilizado como tratamiento preventivo en pacientes con persistencia de actividad muy baja de ADAMTS13, o cuando en el seguimiento esta disminuye por debajo del 10%. Aun así, un 30% de los pacientes pierden la respuesta y precisan reinfusiones de rituximab2. La esplenectomía puede prevenir recaídas (recaídas a los 10 años alrededor del 30%), aunque con una morbimortalidad asociadas al procedimiento considerable, por lo que su uso se restringe a casos muy seleccionados1.
Otras opciones para casos refractarios son el tratamiento inmunodepresor, el bortezomib, N-acetilcisteína o el ADAMTS13 recombinante1,2. Además, caplacizumab, un nanoanticuerpo bivalente humanizado, evita la aglutinación de las plaquetas en la microvasculatura. Su mecanismo de acción no va dirigido a la respuesta inmune, por lo que pueden observarse recaídas tras la suspensión del tratamiento en pacientes con persistencia del déficit marcado de ADAMTS13, por lo que su uso se restringe al momento del brote hasta recuperación de niveles de ADAMTS135.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.