La exposición crónica a bajas dosis de ozono causa un estado de estrés oxidativo y pérdida de la regulación de la respuesta inflamatoria, lo cual lleva a un proceso de neurodegeneración progresiva.
ObjetivoEstudiar el efecto de la exposición crónica a bajas dosis de ozono sobre la concentración de IL-17A y su expresión en neuronas, microglía, astrocitos y células T en hipocampo de ratas.
MétodosSe utilizaron 72 ratas Wistar, divididas en 6 grupos (n=12): control (sin ozono) y expuestos a ozono (0,25ppm, 4h diarias) durante 7, 15, 30, 60 y 90 días, respectivamente. Seis sujetos de cada grupo fueron procesados para cuantificar IL-17A por ELISA y los 6 restantes para inmunohistoquímica (frente a IL-17A y GFAP, Iba1, NeuN o CD3).
ResultadosLos datos obtenidos por el ELISA mostraron un incremento significativo en las concentraciones de IL-17A en los grupos de 7, 15, 30 y 60 días de exposición, comparados con el control (p<0,05). Los resultados muestran que las neuronas del hipocampo son las células con una mayor inmunorreactividad frente a IL-17A entre los 60 y 90 días de exposición a ozono; además, se observó un aumento de astrocitos activados en los grupos de 30 y 60 días de exposición.
ConclusiónLa exposición a ozono induce un incremento en la expresión de la IL-17A, principalmente en las neuronas hipocampales, acompañado de una activación de astrocitos en el hipocampo de ratas durante el proceso de neurodegeneración progresiva, similar a lo que ocurre en la enfermedad de Alzheimer en humanos.
Chronic exposure to low doses of ozone causes oxidative stress and loss of regulation of the inflammatory response, leading to progressive neurodegeneration.
ObjectiveWe studied the effect of chronic exposure to low doses of ozone on IL-17A concentration and expression in neurons, microglia, astrocytes, and T cells in the rat hippocampus.
MethodsWe used 72 Wistar rats, divided into 6 groups (n=12): a control group (no ozone exposure) and 5 groups exposed to ozone (0.25ppm, 4h daily) for 7, 15, 30, 60, and 90 days. We processed 6 rats from each group to quantify IL-17A by ELISA; the remaining 6 were processed for immunohistochemistry (against IL-17A and GFAP, Iba1, NeuN, and CD3).
ResultsThe ELISA study data showed a significant increase in IL-17A concentrations in the 7-, 15-, 30-, and 60-day exposure groups, with regard to the control group (P<.05). Furthermore, they indicate that hippocampal neurons were the cells showing greatest immunoreactivity against IL-17A between 60 and 90 days of exposure to ozone; we also observed an increase in activated astrocytes in the 30- and 60-day exposure groups.
ConclusionExposure to ozone in rats induces an increase in IL-17A expression, mainly in hippocampal neurons, accompanied by hippocampal astrocyte activation during chronic neurodegeneration, similar to that observed in Alzheimer disease in humans.
En las ciudades densamente pobladas la contaminación atmosférica es uno de los principales factores de riesgo para la aparición de diversos problemas crónicos de salud1. El ozono es el contaminante del aire más importante por su abundancia y toxicidad. Dicho gas se forma en la troposfera, por la oxidación de compuestos orgánicos volátiles y monóxido de carbono en presencia de óxidos de nitrógeno y luz solar2. La inhalación crónica de bajas dosis de ozono está asociada con el desarrollo de enfermedades crónico-degenerativas; asimismo, se ha probado que desempeña un papel muy importante en las enfermedades neurodegenerativas3,4, tales como la enfermedad de Parkinson y la enfermedad de Alzheimer. En modelos animales está ampliamente demostrado que la exposición crónica a bajas dosis de ozono causa un estado de estrés oxidativo y neurodegeneración progresiva irreversible5. Este proceso va acompañado de la pérdida de la regulación de la respuesta inflamatoria3,5,6.
Tanto el estado crónico de estrés oxidativo como la pérdida de la regulación de la respuesta inflamatoria son factores críticos para el desarrollo y la progresión del proceso neurodegenerativo7. Ante un daño agudo del SNC, los leucocitos periféricos se seleccionan en el SNC y participan en la resolución de la respuesta inflamatoria innata8. Sin embargo, cuando el daño es crónico y dicha respuesta no se resuelve, puede conducir a una neuroinflamación asociada con muerte neuronal8. Tanto el estrés oxidativo como la pérdida de la regulación de la respuesta inflamatoria inducen una producción anormal de citocinas proinflamatorias, quimiocinas, factores de crecimiento y especies reactivas de oxígeno, así como la activación de la microglía, astrocitos y las células del sistema inmunológico, formando un círculo vicioso que impide que esta respuesta se autolimite6,9.
La interleucina 17A (IL-17A) ha sido fuertemente asociada con la progresión y el desarrollo de varias enfermedades neurodegenerativas6,10. La IL-17A induce la disrupción de las uniones estrechas de la barrera hematoencefálica; además, es un mediador de la respuesta proinflamatoria, ya que induce en varias poblaciones celulares la expresión de otras citocinas (IL-6, el factor de crecimiento transformante beta y el factor de necrosis tumoral) y quimiocinas (como la IL-8)11. Clásicamente se han identificado las células Th17 como las principales células productoras de la IL-17A; no obstante, se ha reportado que una gran variedad de poblaciones celulares también la expresan, por ejemplo, las células T γδ y las células citotóxicas naturales (natural killer), además de las células gliales11.
Recientemente, en un modelo murino de la enfermedad de Alzheimer, nuestro grupo de trabajo reportó un efecto inflamatorio sistémico de tipo Th17/IL-17A a corto plazo; este se observó durante las primeras etapas de exposición a bajas dosis de ozono, cuando el daño ocasionado por este gas es reversible. Sin embargo, la respuesta Th17/IL-17A disminuyó notablemente a medida que la exposición a ozono siguió avanzando y el proceso neurodegenerativo se volvió irreversible; en estas condiciones, la inmunorreactividad frente a IL-17A se localizó en el hipocampo6. Este estudio demuestra que el estrés oxidativo causado por ozono primero induce una respuesta inflamatoria sistémica y posteriormente se presenta una respuesta inflamatoria localizada en el hipocampo durante el proceso de neurodegeneración progresiva irreversible. A pesar de los estudios anteriores, aún no está claro cuál es la principal población celular del hipocampo que secreta la IL-17A.
El objetivo de este trabajo fue cuantificar el incremento en la concentración de IL-17A, así como determinar la inmunorreactividad de dicha citocina en diferentes poblaciones celulares en el hipocampo de ratas expuestas crónicamente a bajas dosis de ozono.
Método generalAnimalesSe utilizaron 72 ratas Wistar macho de 250-300g provenientes del Bioterio de la Facultad de Medicina de la Universidad Nacional Autónoma de México, las cuales fueron alojadas en cajas de acrílico individuales con libre acceso a agua y alimento (NutriCubo, Purina, EE. UU.). Los animales se mantuvieron en un bioterio con condiciones de temperatura y humedad controladas. El cuidado y manejo de los animales se realizaron de acuerdo con el National Institute of Health Guidelines for Animal Treatment y siguiendo la Norma Oficial Mexicana NOM-062-SSA-2-2002. Este estudio fue aprobado por el Comité de Ética de la Facultad de Medicina de la Universidad Nacional Autónoma de México6.
Procedimiento generalLas ratas fueron separadas aleatoriamente en 6 grupos experimentales (n=12 por grupo). El grupo control fue expuesto 30 días durante 4h a un flujo de aire libre de ozono; por otro lado, los grupos 2, 3, 4, 5 y 6 fueron expuestos a ozono (0,25ppm) durante 4h diarias durante 7, 15, 30, 60 y 90 días, respectivamente6.
Exposición a ozonoLos animales fueron colocados dentro de una cámara con un difusor conectado a un generador de ozono de flujo variable (5L/s). La concentración de ozono producido por el generador fue proporcional a la intensidad y el flujo del aire. Para cuantificar la concentración de ozono dentro de la cámara se utilizó el monitor PCI Ozone and Control System (EE. UU.). Para exponer a aire libre de ozono a los animales control se utilizó la misma cámara, conectada a un flujo de aire libre de ozono.
Después de completar el periodo de exposición a aire u ozono, los 12 animales de cada grupo fueron anestesiados profundamente con pentobarbital sódico (50mg/kg); 6 animales de cada grupo fueron perfundidos con paraformaldehído al 4%. Se extrajeron los cerebros y se colocaron en la misma solución fijadora durante 24h a 4°C. Posteriormente, se realizaron técnicas histológicas estándar para obtener tejido incrustado en parafina. Se cortaron secciones sagitales de 5μm de espesor y las que contenían el hipocampo se usaron para inmunofluorescencia. Por otro lado, las 6 ratas restantes fueron utilizadas para la obtención de sobrenadante, se criopreservó el tejido del hipocampo a −70°C y se utilizó para la cuantificación de IL-17A6 por ELISA.
Procesamiento del hipocampo para la cuantificación de interleucina 17ALas muestras de hipocampo previamente criopreservadas fueron descongeladas en hielo. Posteriormente se llevó a cabo una homogenización mecánica de las muestras en una solución de extracción constituida por PBS 50mM, NaCl 0,15M, pH 7,4 y una mezcla de inhibidores de proteasas. El homogenado se centrifugó a 11.000rpm durante 20min y a una temperatura de 4°C; a continuación se retiró el sobrenadante. La concentración total de proteínas de todos los sobrenadantes se midió con un kit comercial por el método de BCA (Thermo Scientific, Rockford, IL, EE. UU.).
Análisis cuantitativo de los niveles de interleucina 17A en el hipocampoSe usaron cantidades equivalentes de proteínas para la cuantificación de la IL-17A por la técnica de ELISA con el kit comercial Rat IL-17A ELISA MAX™ Deluxe (Biolegend, San Diego, CA, EE. UU.). Se analizaron 6 muestras por cada grupo de exposición y se incluyó un duplicado por cada una de estas. Las curvas estándar se elaboraron con patrones premezclados que estaban incluidos en el kit. La absorbancia de cada muestra fue obtenida automáticamente a través del espectrofotómetro Epoch (BioTek, Winooski, VT, EE. UU.) a una longitud de onda de 450nm.
Doble inmunohistoquímica de interleucina 17A en neuronas, microglía, astrocitos y linfocitos T en hipocampoTodas las inmunohistoquímicas de doble marcaje fueron realizadas en cortes de hipocampo utilizando un anticuerpo policlonal frente a IL-17A hecho en conejo, y diferentes anticuerpos monoclonales (frente a Iba1, GFAP, NeuN o CD3) hechos en ratón para identificar diferentes poblaciones celulares. Para dicho fin las laminillas de tejido de hipocampo se desparafinaron con xileno y se rehidrataron. Después, las secciones se lavaron con solución de PBS 50mM, NaCl 0,15M, pH 7,4 y se incubaron con 2% de albúmina de suero bovino libre de ácidos grasos (fracción v, MP Biomedicals, LLC, Darmstadt, Alemania) durante 30min. Las muestras se impregnaron con Triton™ X-100 al 0,2% en PBS durante 10min y después se incubaron con el anticuerpo anti-IL-17A (eBioscience, EE. UU.) durante la noche a 4°C6. Posteriormente se realizaron 3 lavados con Triton™ X-100 al 0,2% en PBS durante 10min y se añadió el segundo anticuerpo: anti-Iba1 (GeneTex, EE. UU.) para identificar las células de la microglía, anti-GFAP (GeneTex, EE. UU.) para identificar los astrocitos, anti-NeuN (GeneTex, EE. UU.) para identificar las neuronas maduras, o anti-CD3 (BD Biosciences, EE. UU.) para identificar los linfocitos T, y se repitió el mismo procedimiento. Después de lavar los portaobjetos, para visualizar la inmunorreactividad frente a IL-17A, las muestras fueron incubadas con los anticuerpos de cabra IgG anticonejo acoplados al fluorocromo Alexa Fluor 594 (Life Technologies, EE. UU.), el cual se observó en color rojo. Para distinguir el segundo anticuerpo, que identifica las poblaciones celulares, se utilizó el anticuerpo secundario de cabra IgG antirratón acoplado al fluorocromo Alexa Fluor 488 (Life Technologies, EE. UU.), que se observó en color verde.
Las muestras se montaron sobre un portaobjetos de vidrio usando el medio Vectashield (Vector Laboratories, EE. UU.). Las secciones representativas del cerebro de cada grupo se examinaron con el microscopio Olympus BX41 (EE. UU.) y se fotografiaron con una cámara Evolution VF (Media Cybernetics, EE. UU.). El empalme de canales de fluorescencia se llevó a cabo con el programa Image J para Mac (NIH, EE. UU.).
Análisis estadísticoEl análisis estadístico se realizó con el paquete R 3.3.2 para Mac. Se aplicó la prueba de normalidad Shapiro-Wilk para los datos correspondientes a la población estudiada.
Una vez confirmada la normalidad de los datos de los distintos grupos analizados, se realizó la prueba paramétrica ANOVA para identificar diferencias entre grupos y un análisis post hoc mediante la prueba de t de Student. Los datos se muestran como media y error estándar de la media. La p<0,05 se considera como estadísticamente significativa.
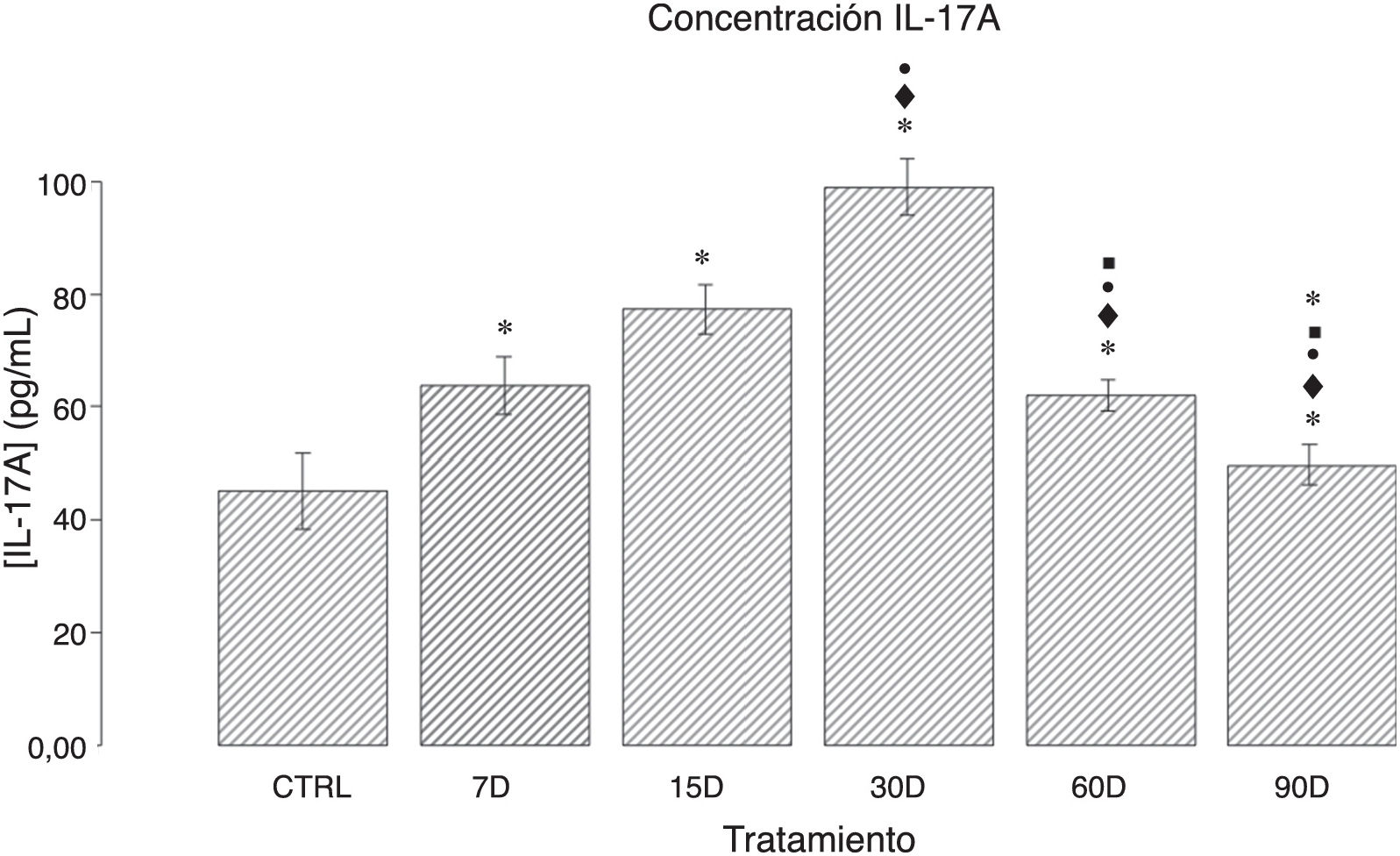
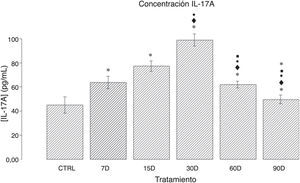
ResultadosConcentración de IL-17A en el tejido hipocampal de ratas crónicamente expuestas a bajas dosis de ozonoEl análisis cuantitativo de la concentración de IL-17A en los distintos grupos de estudio se muestra en la figura 1. Observamos que los grupos de 7, 15, 30 y 60 días de exposición a ozono presentan un aumento significativo de la citocina al compararse con los controles (p<0,50). Asimismo, los resultados muestran un incremento en la expresión de IL-17A que va de los 7 a los 30 días de exposición; este último grupo presenta la mayor expresión de IL-17A, y un aumento significativo con respecto a todos los demás grupos (p<0,50). Por otra parte, se observa una disminución gradual de la concentración de IL-17A en los grupos de 60 y 90 días.
Efecto de la exposición crónica a bajas dosis de ozono sobre la concentración de IL-17A en el hipocampo de ratas. El eje de las abscisas muestra los tratamientos: control (CTRL; ratas expuestas durante 30 días al flujo de aire libre de ozono) y de exposición a ozono (7, 15, 30, 60 y 90 días). El eje de las ordenadas muestra la concentración de IL-17A (pg/mL). Las barras representan la media de la concentración por grupo y el error estándar de la media. Nótese que los grupos de exposición a ozono presentan diferencias significativas con respecto el grupo control (p<0,05). *: grupo de estudio vs. control con p<0,05; ♦: grupo de estudio vs. grupo de 7 días de exposición al ozono (7D) con p<0,05; •: grupo de estudio vs. grupo de 15 días de exposición al ozono (15D) con p<0,05; ■: grupo de estudio vs. grupo de 30 días de exposición al ozono (30D) con p<0,05; ★: grupo de estudio vs. grupo de 60 días de exposición al ozono (60D) con p<0,05. Las diferencias significativas tuvieron una p<0,05.
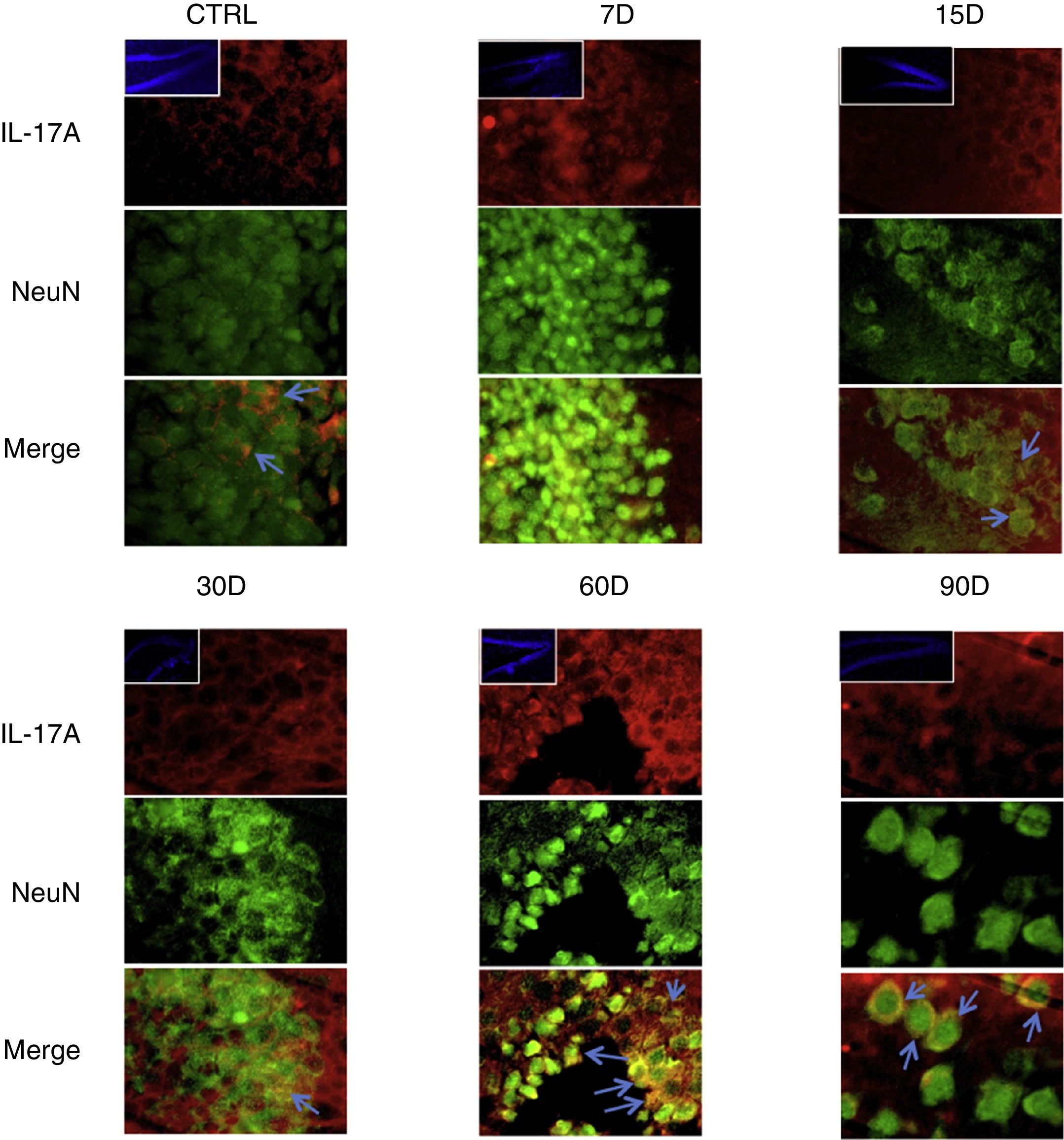
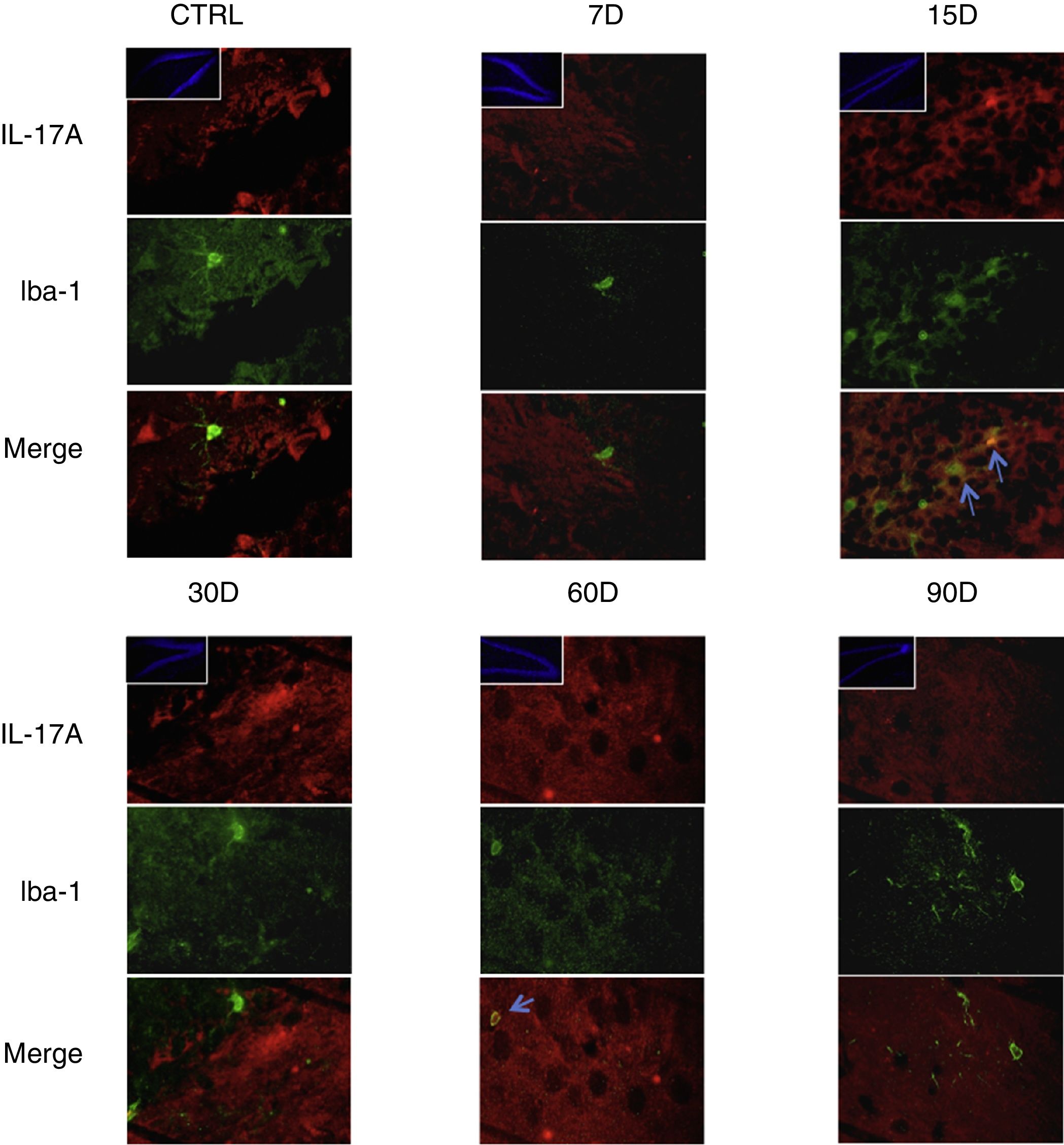
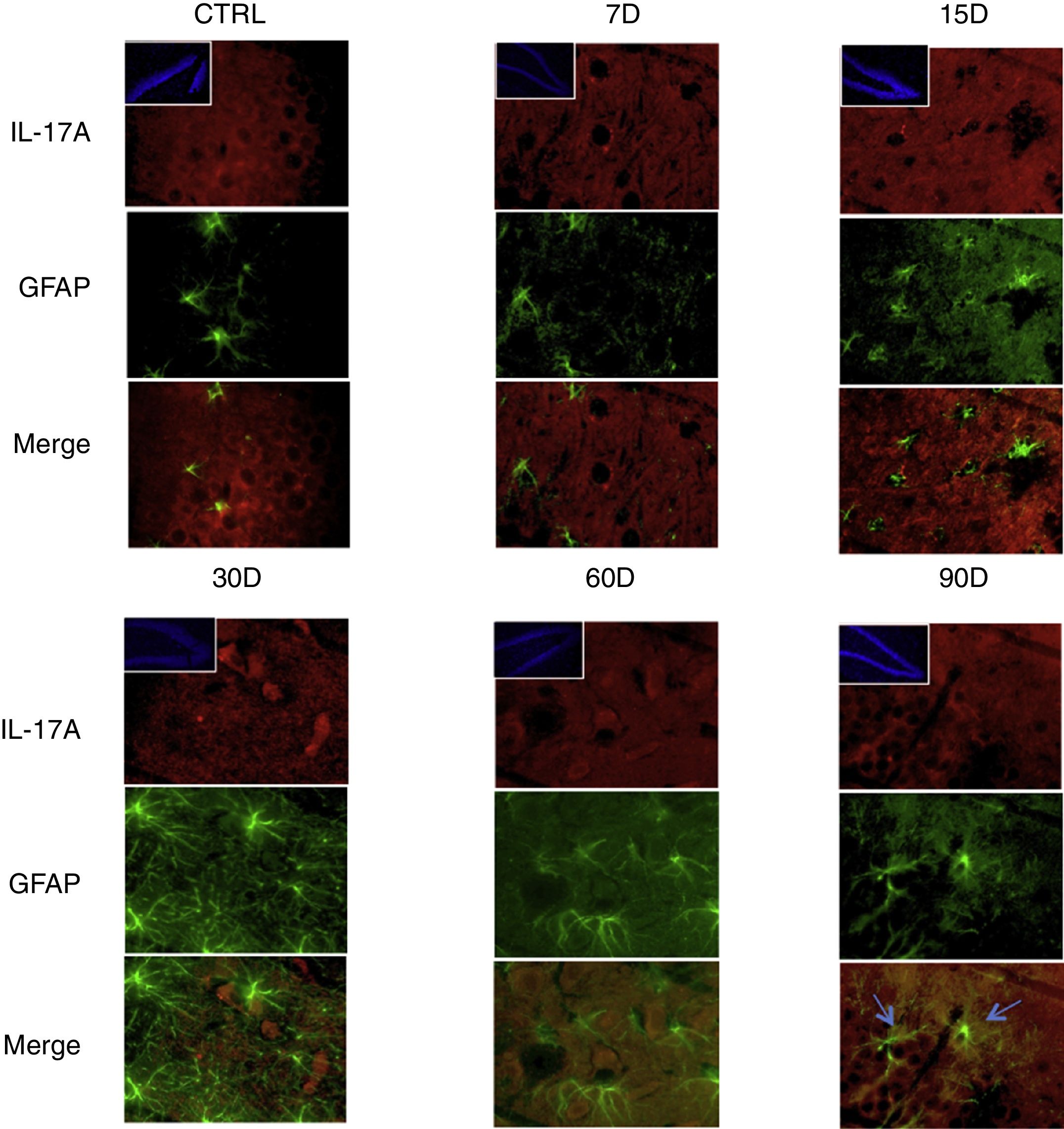
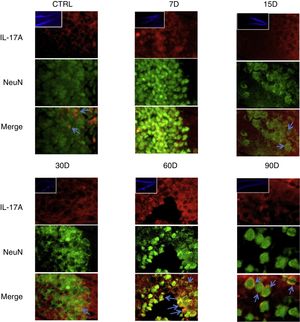
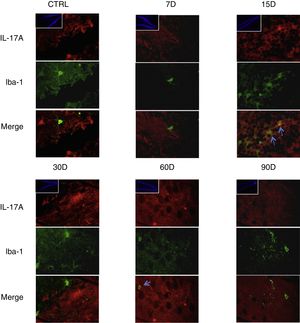
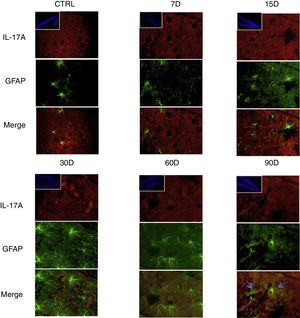
Los resultados de la inmunorreactividad que presenta doble marca fluorescente para la IL-17A en neuronas, microglía, astrocitos y linfocitos T en el hipocampo de ratas expuestas a bajas dosis de ozono muestran que la inmunorreactividad a IL-17A predomina en distintas poblaciones celulares dependiendo del tiempo de exposición: las neuronas (fig. 2) a los 60 y 90 días, los astrocitos (fig. 3) a los 90 días y la microglía (fig. 4) a los 15 días. Las imágenes de las inmunofluorescencias que involucran a las células T (CD3+) no se muestran debido a que encontramos un flujo muy bajo o nulo de linfocitos T en el giro dentado, independientemente del periodo de exposición a ozono; tampoco encontramos que estas células tuvieran relación con la expresión de la IL-17A en dicha estructura hipocampal. Por otro lado, las imágenes de inmunofluorescencia concuerdan con el análisis cuantitativo de la IL-17A, ya que muestran que existe una mayor expresión de la citocina en los grupos de 15, 30 y 60 días de exposición a ozono.
Efecto de la exposición crónica a bajas dosis de ozono sobre la expresión de IL-17A en neuronas. Doble marca de fluorescencia en el hipotálamo de ratas expuestas a bajas dosis de ozono durante 7, 15, 30, 60 y 90 días. Las neuronas están marcadas en color verde y la IL-17A en rojo. Las imágenes muestran el giro dentado a un aumento de 100×, mientras que los recuadros muestran la misma estructura a una magnificación de 10×. Las flechas azules indican una doble expresión de marcadores. Obsérvese que a los 60 y 90 días de exposición se presenta mayor inmunorreactividad a IL-17A por las neuronas del giro dentado. Barra de escala=20μm.
Efecto de la exposición crónica a bajas dosis de ozono sobre la expresión de IL-17A en astrocitos. Doble marca de fluorescencia en el hipotálamo de ratas expuestas a bajas dosis de ozono durante 7, 15, 30, 60 y 90 días. Los astrocitos están marcados en color verde y la IL-17A en rojo. Las imágenes muestran el giro dentado a un aumento de 100×, mientras que los recuadros muestran la misma estructura a una magnificación de 10×. Las flechas azules indican una doble expresión de marcador. Obsérvese que a los 90 días de exposición se presenta mayor inmunorreactividad a IL-17A por los astrocitos del giro dentado. Además, nótese el aumento en el número de astrocitos y la longitud de las prolongaciones de los 15 a los 90 días de exposición. Barra de escala=20μm.
Efecto de la exposición crónica a bajas dosis de ozono sobre la expresión de IL-17A en microglía. Doble marca de fluorescencia en el hipotálamo de ratas expuestas a bajas dosis de ozono durante 7, 15, 30, 60 y 90 días. Las células microgliales están marcadas en color verde y la IL-17A en rojo. Las imágenes muestran el giro dentado a un aumento de 100×, mientras que los recuadros muestran la misma estructura a una magnificación de 10×. Las flechas azules indican una doble expresión de marcadores. Obsérvese que a los 15 días de exposición se presenta mayor inmunorreactividad a IL-17A por la microglía del giro dentado. Barra de escala=20μm.
Por otra parte, en la figura 3 es posible observar que a los 15 días de exposición a ozono hay un mayor número de células que expresan Iba1 (microglía). Además, se observa que existe un incremento en el número de astrocitos (fig. 4) en los grupos de 15, 30 y 60 días de exposición. Por otra parte, se logra apreciar que los procesos filamentosos de los astrocitos son más extensos en los grupos antes mencionados.
DiscusiónEn este estudio se cuantificó la concentración de IL-17A en el hipocampo de ratas crónicamente expuestas a bajas dosis de ozono. Los resultados muestran un aumento gradual de la IL-17A hasta los 30 días de exposición; en este grupo es en el que se identifica la máxima concentración de la citocina, y de acuerdo con nuestras observaciones de trabajos anteriores5, es cuando el proceso neurodegenerativo se vuelve irreversible. El hecho de que el proceso neurodegenerativo se desarrolle de forma paralela al aumento de la IL-17A en el hipocampo apunta a que esta citocina es un factor que está presente durante el desarrollo de dicho proceso. En ese sentido, el grupo de trabajo de Sun et al.12 reportó que tras un reto con LPS aumenta la IL-17A, la activación microglial y el daño cognitivo en el hipocampo de ratas de edad avanzada. No obstante, aún no está claro si la IL-17A es un factor o una consecuencia del proceso neurodegenerativo.
Con respecto a lo observado en las inmunofluorescencias de doble marca, corroboramos que las células T no son el linaje celular que más secreta la IL-17A en el hipocampo de las ratas expuesta a ozono, además de que no hay un flujo significativo de dichas células al hipocampo. En un estudio de nuestro grupo de trabajo se encontró una correlación débil entre la secreción sistémica de la IL-17A y las células tipo Th176, por lo que se puede plantear la hipótesis de que otras células, además de las Th17, pueden estar implicadas en la secreción de la citocina. Por tal motivo, en este estudio buscamos elucidar qué células son la principal fuente de IL-17A en el giro dentado de ratas expuestas crónicamente a bajas dosis de ozono. En ese sentido, nuestros datos evidencian que hay expresión de la IL-17A en las neuronas, los astrocitos y la microglía del giro dentado de ratas crónicamente expuestas a bajas dosis de ozono; no obstante, dicha expresión está en función del tiempo de exposición o el grado de avance del proceso neurodegenerativo del animal. Uno de los hallazgos más importantes de este trabajo es que los datos muestran una coexpresión de NeuN e IL-17A, particularmente en los grupos de 60 y 90 días de exposición a ozono. Previamente nuestro grupo de trabajo reportó que en etapas iniciales de exposición a bajas dosis de ozono, la IL-17A aumenta a nivel plasmático; no obstante, en etapas avanzadas de la exposición, y tras el desarrollo del proceso de neurodegeneración progresiva irreversible, la IL-17A disminuye significativamente en el plasma, pero aumenta en el hipocampo de las ratas expuestas6. Lo anterior demuestra que durante el proceso de neurodegeneración progresiva irreversible, en donde la respuesta inflamatoria es específica de órgano, las neuronas son la fuente principal de la IL-17A presente en el hipocampo. A pesar de que las neuronas no han sido clásicamente caracterizadas como células secretoras de citocinas, existen algunos grupos que no descartan tal posibilidad13,14. En ese sentido, en un estudio de Schubert et al., en el cual se caracterizó el perfil secretor de las neuronas y los precursores neuronales, se encontró que el número y la variedad de proteínas secretadas por dichas células es mayor que el de las células gliales14. Por otra parte, reportaron que varias de las moléculas secretadas por las neuronas pertenecen a la familia de proteínas de respuesta al estrés que se asocian con el plegamiento de las proteínas, la señalización y la citoprotección del medio intracelular14. A pesar de que en este estudio se evaluó la expresión de una gran cantidad de moléculas, no se incluyó ninguna citocina; no obstante, nos demuestra que las neuronas tienen un perfil secretor que va más allá de lo clásicamente descrito. Por lo tanto, no se debe descartar la posibilidad de que las neuronas, en un estado crónico de estrés oxidativo, sean capaces de secretar de forma paracrina citocinas tales como la IL-17A, y, de esa manera, retroalimentar la respuesta inflamatoria en el SNC.
Finalmente, observamos que el incremento gradual de la concentración de IL-17A coincide con un mayor número de astrocitos, así como con el aumento del tamaño de los filamentos intermedios de estas células. Lo anterior concuerda con el trabajo de You et al.15, en el cual demostraron que la IL-17 es capaz de inducir la reactividad astrocítica, la cual se caracteriza por la hipertrofia de estas células y una alta expresión de GFAP16.
ConclusionesLos resultados de este trabajo muestran que la exposición de ratas a bajas dosis de ozono aumenta gradualmente la expresión de la IL-17A en el hipocampo, a medida que se establece un proceso de neurodegeneración progresiva irreversible. Los cambios tisulares de IL-17A en el giro dentado forman parte de la pérdida de la regulación de la respuesta inflamatoria que acompaña al proceso de neurodegeneración progresiva.
Por otra parte, la principal fuente de IL-17A va modificándose de acuerdo con el tiempo de exposición; sin embargo, nuestro hallazgo más importante es que observamos que las neuronas son las células que más expresan la IL-17A cuando el proceso neurodegenerativo avanzado es irreversible. Además, los datos apuntan a que la IL-17A puede estar relacionada con un aumento en la reactividad de los astrocitos, lo cual favorece el desarrollo del proceso neurodegenerativo.
FinanciaciónEste proyecto de investigación fue financiado por la Dirección General de Asuntos de Personal Académico (IN221417 a SR-A).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos a Gabino Borgonio-Pérez su ayuda en el manejo de animales de laboratorio y la toma de muestras.