El tiempo de actuación médica es uno de los factores pronósticos modificables más importantes en el estatus epiléptico. La epilepsia parcial continua (EPC) es un tipo de estatus epiléptico con duración muy variable, en ocasiones prolongada. Nuestro objetivo fue analizar la relación entre el tiempo de evolución de la EPC y su pronóstico.
MétodosEstudio observacional prospectivo de todos los pacientes con EPC que ingresaron en un hospital terciario en el periodo comprendido del 01/09/2017 al 01/09/2018.
ResultadosSe incluyeron 10 pacientes con EPC, 9 mujeres, con una mediana de edad de 74 años. La etiología más frecuente fue la enfermedad cerebrovascular (n=6). El inicio de la EPC fue extrahospitalario en 5 pacientes, siendo la mediana del tiempo hasta el ingreso hospitalario 4h. En la serie global, la mediana del tiempo hasta el inicio del tratamiento fue 12,3h. La mediana del tiempo hasta el control desde el inicio del tratamiento fue 30h, y presentó una correlación positiva alta con el tiempo hasta el inicio del tratamiento (rho Spearman 0,88). Seis pacientes presentaban hiperglucemia al inicio del episodio, y ésta asoció una correlación positiva con el tiempo hasta el control desde el inicio del tratamiento (rho Spearman: 0,71). Los 6 pacientes con hiperglucemia tenían una lesión cerebral que justificaba el origen de la EPC.
ConclusionesIdentificamos un retraso en diferentes fases del manejo de la EPC, lo que se relacionó con una mayor duración del episodio. La glucemia también se relacionó con la duración del episodio, con un papel probablemente más desencadenante que etiológico.
Timing is one of the most important modifiable prognostic factors in the management of status epilepticus. Epilepsia partialis continua (EPC) is a status epilepticus subtype of highly variable, occasionally prolonged, duration. The aim of this study was to analyze the relationship between EPC duration and outcomes.
MethodsWe performed an observational prospective study of all patients with EPC admitted to our tertiary hospital between 1 September 2017 and 1 September 2018.
ResultsThe sample included 10 patients, of whom 9 were women; median age was 74 years. The most frequent aetiology was cerebrovascular disease (n=6). EPC onset occurred outside the hospital in 5 patients, with a median time to hospital admission of 4hours. The median time to treatment onset for all patients was 12.3hours. The median time from treatment onset to EPC control was 30hours; time from treatment onset to EPC control showed a strong positive correlation with TT (Spearman's rho=0.88). Six patients presented hyperglycaemia at onset; this was positively correlated with time from treatment onset to EPC control (rho=0.71). All 6 patients with hyperglycaemia presented a brain injury explaining the EPC episode.
ConclusionsDelays were observed in different phases of EPC management, which was related to longer duration of the episode. Glycaemia was also related to episode duration, probably acting as a triggering factor rather than as the aetiology.
La epilepsia parcial continua (EPC) es un tipo de estatus epiléptico (EE) focal descrito por primera vez en 1894 por el neuropsiquiatra ruso Aleksei Yakovlevich Kozhevnikov, bajo el nombre de «forma especial de epilepsia cortical» o epilepsia partialis continua1. Inicialmente la EPC fue definida como un cuadro clínico consistente en sacudidas o movimientos rítmicos ininterrumpidos y limitados a una región corporal. En los primeros años tras su descripción, y posteriormente durante el siglo xx, se ha propuesto ampliar la definición a otras formas de EE focal sin alteración de conciencia que cursan con sintomatología continua (aura), ya sea somatosensitiva, visual, olfatoria, auditiva o cognitiva2–4. Sin embargo, actualmente no existe una definición universalmente aceptada.
Tras el I Simposio en Estatus Epiléptico de Londres, en el año 20075 se formó un grupo europeo multicéntrico para el estudio de la EPC, que propuso la siguiente definición: «EPC es aquel cuadro clínico caracterizado por la repetición continua de crisis epilépticas focales (motoras, somatosensitivas, o sensoriales), con nivel de conciencia preservado, con una duración≥1h, y causadas por actividad epileptiforme restringida localmente»6. Además, propusieron una clasificación de la enfermedad atendiendo a su curso clínico (ver tabla 1). Posteriormente, en 2015, la Liga Internacional Contra la Epilepsia (ILAE) publicó la última definición y clasificación del EE7, en la que la EPC está clasificada como EE focal motor. En dicha publicación, la ILAE hizo especial énfasis en el posible desarrollo de daño cerebral irreversible asociado a crisis epilépticas prolongadas. Sin embargo, no hay estudios que analicen la relación entre el tiempo de evolución de la EPC y su pronóstico.
Clasificación de la EPC propuesta por el grupo europeo de estudio de EPC
| Tipo 1: episodio único de EPC |
| a. En paciente con epilepsia previa |
| b. EPC de novo, sintomática, en paciente sin epilepsia previa |
| Tipo 2: EPC crónica recurrente no progresiva |
| a. Con episodios breves (<24h) y frecuentes (más de un episodio al mes) |
| b. Con episodios prolongados (>24h) e infrecuentes (un episodio al mes o menos) |
| Tipo 3: EPC crónica persistente no progresiva |
| a. Como evolución de una EPC tipo 2 |
| b. EPC primaria persistente |
| Tipo 4: EPC crónica progresiva |
EPC: epilepsia parcial continua.
Fuente: Mameniškienè et al.6.
Aunque no existen datos epidemiológicos con base poblacional, se estimó una prevalencia menor a 1/1.000.000 habitantes en Reino Unido a partir de una serie clínica8, no existiendo estimaciones acerca de su incidencia.
Entre las posibles causas de la EPC se encuentran el infarto cerebral, los tumores del sistema nervioso central, las malformaciones del desarrollo cortical, las encefalitis autoinmunes, o las infecciones del sistema nervioso central9,10. La hiperglucemia hiperosmolar no complicada se considera una posible etiología de la EPC, aunque su relación precisa con la enfermedad no se conoce y hay autores que la consideran más bien un factor desencadenante6,11. En cualquier caso, la corrección de la hiperglucemia en el contexto de un episodio de EPC es el tratamiento de elección, ya que además la EPC suele ser refractaria a los fármacos antiepilépticos (FAE)12.
Nuestro objetivo principal fue describir las características clínico-evolutivas de una serie de pacientes con EPC, prestando especial atención a la relación entre el tiempo de evolución del episodio y la respuesta al tratamiento. Asimismo, analizamos la presencia de hiperglucemia y su relación con el origen del episodio y su evolución.
MétodosSe trata de un estudio observacional prospectivo de una cohorte de pacientes con EPC ingresados en el Hospital Clínico San Carlos (HCSC) durante un periodo de tiempo de un año, del 1 de septiembre de 2017 al 1 de septiembre de 2018. Nuestro centro médico es un hospital terciario universitario ubicado en la ciudad de Madrid, con un área de población asignada en 2017 de 370.501 pacientes, y que cuenta con un registro prospectivo de todos los EE que ingresan en el hospital. El protocolo del estudio fue aprobado por el Comité Ético de Investigación Clínica del HCSC con código 18-407E, y todos los pacientes o sus familiares firmaron el consentimiento informado por escrito antes de ser incluidos en el estudio.
Fueron reclutados todos los pacientes≥18 años con diagnóstico de EPC que ingresaron en cualquier servicio del HCSC en el periodo de un año mencionado. Para el diagnóstico utilizamos la última definición de EPC propuesta por el grupo de estudio europeo: repetición continua de crisis epilépticas focales (motoras, somatosensitivas o sensoriales), con nivel de conciencia preservado, con una duración≥1h6.
De cada episodio se obtuvieron: datos demográficos del paciente (edad, sexo); historia previa de epilepsia; situación basal medida con la escala de Rankin modificada (ERm)13; antecedente de diabetes mellitus (DM) y cifra de glucemia al inicio del episodio; etiología, tipo de EPC según la clasificación propuesta por el grupo europeo, y semiología de la EPC; gravedad del episodio con la puntuación STESS (Status Epilepticus Severity Score)14 y lugar de inicio (extra- vs. intrahospitalario). La información de tiempo se recogió en horas y se trató como una variable cuantitativa continua, en un marco de trabajo similar al Código Ictus. El inicio de los síntomas (si no fue presenciado, la última situación basal conocida del paciente) fue considerado como punto temporal de referencia. Así, se obtuvo el tiempo hasta el ingreso en el hospital (TH), el tiempo hasta la evaluación por Neurología (TN), el tiempo hasta el inicio del tratamiento (TT), y el tiempo desde el inicio del tratamiento hasta el control del episodio (TC), definido como la resolución de los síntomas de forma mantenida durante al menos 24h.
Se registró la secuencia de tratamientos administrados y su dosis. Se realizó al menos un electroencefalograma (EEG) en todos los casos, que pudo ser de rutina o con monitorización vídeo-EEG (VEEG) prolongada. Todos los casos y los registros EEG fueron revisados por, al menos, 2 neurólogos especializados en epilepsia con acreditación para la interpretación de EEG por parte de la Sociedad Española de Neurología.
Como variables evolutivas o de resultado se incluyeron el TC, y la morbimortalidad en el ingreso y a los 3 meses del alta. Para evaluar la morbilidad se usó la ERm y la aparición de nuevos déficits neurológicos (secuelas cognitivas o motoras).
Análisis estadísticoEl análisis estadístico se realizó con el programa IBM SPSS Statistics 23. Se estableció la significación estadística en p<0,05.
Inicialmente, se realizó un análisis descriptivo de la muestra. Dado el tamaño de la muestra, se asumió una distribución no normal de las variables. Las variables cualitativas se presentaron mediante su distribución de frecuencias y las cuantitativas con la mediana como medida de tendencia central y el rango intercuartílico (RIC) como medida de dispersión.
Se evaluó la asociación entre variables cualitativas con el test de chi-cuadrado o prueba exacta de Fisher, en el caso de que más de un 25% de los esperados fueran menores de 5. Las comparaciones de variables cuantitativas se realizaron con el test no paramétrico U de Mann-Whitney en caso de 2 grupos, o el test H de Kruskal-Wallis en caso de más de 2 grupos. El test no paramétrico rho de Spearman se usó para evaluar la correlación entre 2 variables cuantitativas. No se realizó análisis multivariable debido al tamaño de la muestra.
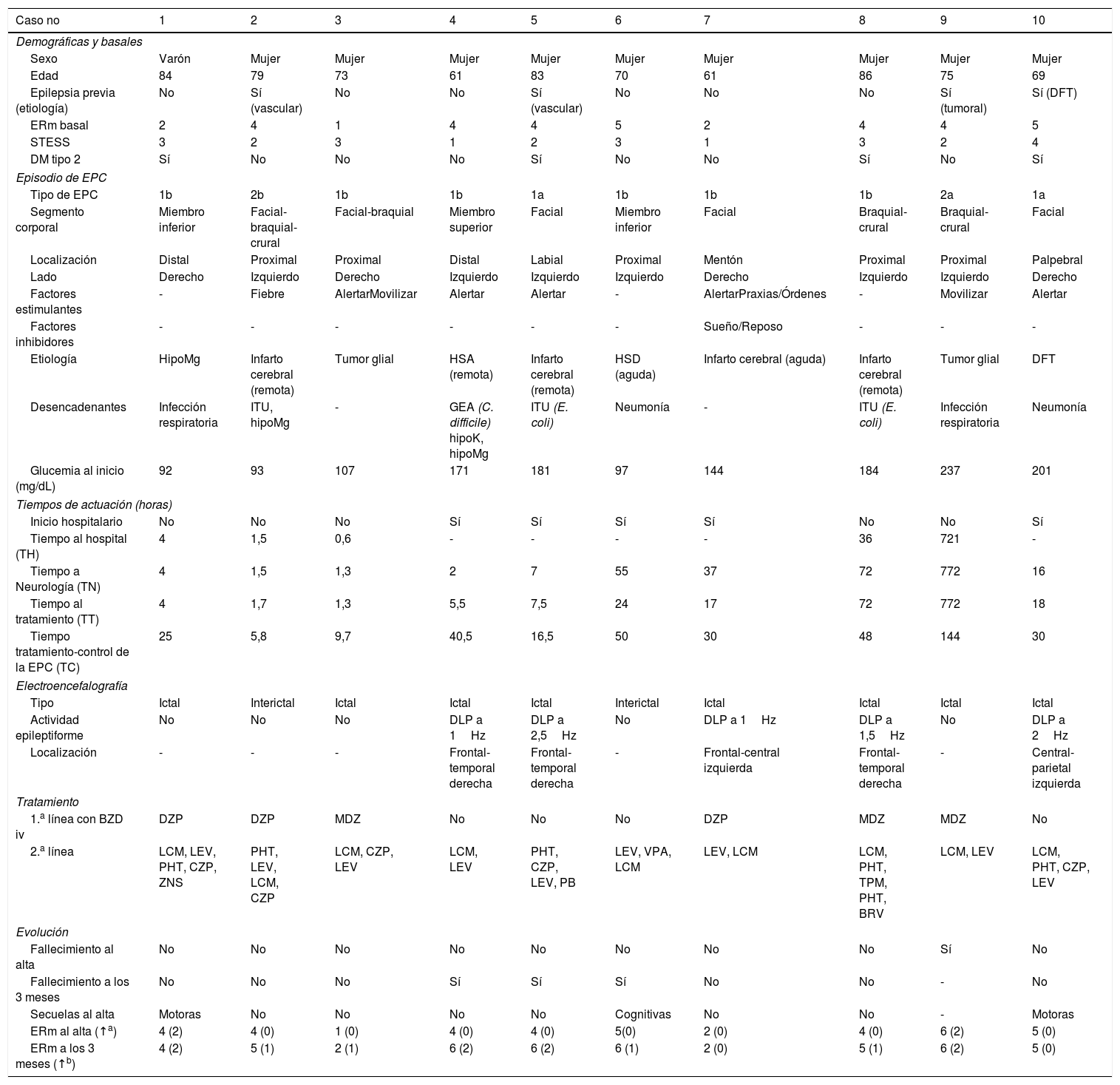
ResultadosEn el periodo comprendido entre el 1 de septiembre de 2017 y el 1 de septiembre de 2018, un total de 51 pacientes ingresaron en el HCSC con diagnóstico de EE, de los cuales 10 pacientes presentaron una EPC. Los resultados descriptivos de la serie están recogidos en la tabla 2.
Resultados descriptivos de la serie
| Caso no | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
|---|---|---|---|---|---|---|---|---|---|---|
| Demográficas y basales | ||||||||||
| Sexo | Varón | Mujer | Mujer | Mujer | Mujer | Mujer | Mujer | Mujer | Mujer | Mujer |
| Edad | 84 | 79 | 73 | 61 | 83 | 70 | 61 | 86 | 75 | 69 |
| Epilepsia previa (etiología) | No | Sí (vascular) | No | No | Sí (vascular) | No | No | No | Sí (tumoral) | Sí (DFT) |
| ERm basal | 2 | 4 | 1 | 4 | 4 | 5 | 2 | 4 | 4 | 5 |
| STESS | 3 | 2 | 3 | 1 | 2 | 3 | 1 | 3 | 2 | 4 |
| DM tipo 2 | Sí | No | No | No | Sí | No | No | Sí | No | Sí |
| Episodio de EPC | ||||||||||
| Tipo de EPC | 1b | 2b | 1b | 1b | 1a | 1b | 1b | 1b | 2a | 1a |
| Segmento corporal | Miembro inferior | Facial-braquial-crural | Facial-braquial | Miembro superior | Facial | Miembro inferior | Facial | Braquial-crural | Braquial-crural | Facial |
| Localización | Distal | Proximal | Proximal | Distal | Labial | Proximal | Mentón | Proximal | Proximal | Palpebral |
| Lado | Derecho | Izquierdo | Derecho | Izquierdo | Izquierdo | Izquierdo | Derecho | Izquierdo | Izquierdo | Derecho |
| Factores estimulantes | - | Fiebre | AlertarMovilizar | Alertar | Alertar | - | AlertarPraxias/Órdenes | - | Movilizar | Alertar |
| Factores inhibidores | - | - | - | - | - | - | Sueño/Reposo | - | - | - |
| Etiología | HipoMg | Infarto cerebral (remota) | Tumor glial | HSA (remota) | Infarto cerebral (remota) | HSD (aguda) | Infarto cerebral (aguda) | Infarto cerebral (remota) | Tumor glial | DFT |
| Desencadenantes | Infección respiratoria | ITU, hipoMg | - | GEA (C. difficile) hipoK, hipoMg | ITU (E. coli) | Neumonía | - | ITU (E. coli) | Infección respiratoria | Neumonía |
| Glucemia al inicio (mg/dL) | 92 | 93 | 107 | 171 | 181 | 97 | 144 | 184 | 237 | 201 |
| Tiempos de actuación (horas) | ||||||||||
| Inicio hospitalario | No | No | No | Sí | Sí | Sí | Sí | No | No | Sí |
| Tiempo al hospital (TH) | 4 | 1,5 | 0,6 | - | - | - | - | 36 | 721 | - |
| Tiempo a Neurología (TN) | 4 | 1,5 | 1,3 | 2 | 7 | 55 | 37 | 72 | 772 | 16 |
| Tiempo al tratamiento (TT) | 4 | 1,7 | 1,3 | 5,5 | 7,5 | 24 | 17 | 72 | 772 | 18 |
| Tiempo tratamiento-control de la EPC (TC) | 25 | 5,8 | 9,7 | 40,5 | 16,5 | 50 | 30 | 48 | 144 | 30 |
| Electroencefalografía | ||||||||||
| Tipo | Ictal | Interictal | Ictal | Ictal | Ictal | Interictal | Ictal | Ictal | Ictal | Ictal |
| Actividad epileptiforme | No | No | No | DLP a 1Hz | DLP a 2,5Hz | No | DLP a 1Hz | DLP a 1,5Hz | No | DLP a 2Hz |
| Localización | - | - | - | Frontal-temporal derecha | Frontal-temporal derecha | - | Frontal-central izquierda | Frontal-temporal derecha | - | Central-parietal izquierda |
| Tratamiento | ||||||||||
| 1.a línea con BZD iv | DZP | DZP | MDZ | No | No | No | DZP | MDZ | MDZ | No |
| 2.a línea | LCM, LEV, PHT, CZP, ZNS | PHT, LEV, LCM, CZP | LCM, CZP, LEV | LCM, LEV | PHT, CZP, LEV, PB | LEV, VPA, LCM | LEV, LCM | LCM, PHT, TPM, PHT, BRV | LCM, LEV | LCM, PHT, CZP, LEV |
| Evolución | ||||||||||
| Fallecimiento al alta | No | No | No | No | No | No | No | No | Sí | No |
| Fallecimiento a los 3 meses | No | No | No | Sí | Sí | Sí | No | No | - | No |
| Secuelas al alta | Motoras | No | No | No | No | Cognitivas | No | No | - | Motoras |
| ERm al alta (↑a) | 4 (2) | 4 (0) | 1 (0) | 4 (0) | 4 (0) | 5(0) | 2 (0) | 4 (0) | 6 (2) | 5 (0) |
| ERm a los 3 meses (↑b) | 4 (2) | 5 (1) | 2 (1) | 6 (2) | 6 (2) | 6 (1) | 2 (0) | 5 (1) | 6 (2) | 5 (0) |
BRV: brivaracetam; BZD: benzodiacepinas; CZP: clonazepam; DFT: demencia frontotemporal; DLP: descargas lateralizadas periódicas; DZP: diazepam; EPC: epilepsia parcial continua; ERm: escala de Rankin modificada; FAE: fármaco antiepiléptico; GEA: gastroenteritis aguda; HipoK: hipopotasemia; HipoMg: hipomagnesemia; HSA: hemorragia subaracnoidea; HSD: hematoma subdural; ITU: infección del tracto urinario; LCM: lacosamida; LEV: levetiracetam; MDZ: midazolam; PB: fenobarbital; PHT: fenitoína; STESS: Status Epilepticus Severity Score; TPM: topiramato; VPA: ácido valproico; ZNS:zonisamida.
La mediana de edad fue 74 años (RIC 69-82) y 9 pacientes fueron mujeres. La puntuación mediana en la ERm basal fue 4 (RIC 2,5-4) y en el STESS fue 2,5 (RIC 2-3). Cuatro pacientes tenían antecedente de epilepsia, ninguno refractaria, y la mediana del número de FAE por paciente como tratamiento ambulatorio fue 1 (RIC 1-2).
Atendiendo al tipo de EPC según la nueva clasificación propuesta por el grupo de estudio europeo, todos los casos cursaron con síntomas motores, y el tipo más frecuente fue el 1b (EPC de novo, sintomática, en paciente sin epilepsia previa, n=6). El segmento corporal involucrado con mayor frecuencia fue la región facial, en 3 pacientes. La etiología más frecuente fue la enfermedad cerebrovascular (n=6), con una patocronia remota en 4 pacientes y aguda en 2. En 2 casos la etiología fue progresiva secundaria a glioblastoma multiforme, en un caso la EPC ocurrió en el contexto de una demencia frontotemporal, y en el último caso no se encontró causa estructural y se atribuyó a una hipomagnesemia grave (0,7mg/dL).
La mitad de los episodios (n=5) comenzaron en el hospital, en pacientes ingresados por otra indicación médica. La mediana del TH en los episodios con inicio extrahospitalario fue 4h (RIC 1,5-36). En el global de la serie, la mediana del TN fue 11,5h (RIC 2,5-50,5) y la del TT fue 12,3h (RIC 4,4-22,5).
En todos los pacientes se obtuvo al menos un registro EEG, en 8 con monitorización VEEG prolongada. La duración mediana de la monitorización VEEG fue 4h (RIC 1-6,5). En 8 casos el registro EEG se obtuvo durante el episodio de EPC: 5 presentaron descargas epileptiformes lateralizadas periódicas con una frecuencia mediana de 1,5Hz (RIC 1-2,3), mientras que en 3 no se registró patrón de EE (en 2 se obtuvo un enlentecimiento focal de localización armónica al origen de la EPC, y en uno fue normal). En los 2 pacientes restantes, el EEG se realizó tras la resolución del episodio, y no se registró actividad epileptiforme. En los 5 casos sin patrón EEG de EE, el cuadro clínico era característico de EPC y no existieron dudas diagnósticas.
En todos los casos la medición de glucemia al inicio de la EPC se consideró en ayunas, pues habían transcurrido>4h desde la última ingesta. Seis pacientes presentaron hiperglucemia hiperosmolar no cetósica (glucemia≥126mg/dL) al inicio del episodio, con una mediana de glucemia de 182,5mg/dL (RIC 164,3-210). De estos 6 pacientes, 3 tenían antecedente de DM tipo 2, 2 presentaron hiperglucemia aguda secundaria a neumonía, y una paciente recibió diagnóstico de DM tipo 2 durante el ingreso.
El tratamiento comenzó con la administración de benzodiacepinas por vía intravenosa como primera línea en 6 pacientes, diazepam en 3 y midazolam en otros 3. La mediana del número de FAE utilizados como segunda línea fue 3,5 y el más utilizado como primer fármaco de segunda línea fue lacosamida (n=6) con una mediana de dosis de 450mg/día (RIC 300-600). Los 2 FAE más usados fueron lacosamida y levetiracetam; ambos se administraron en 9 casos. En ningún paciente se administró tratamiento de tercera línea con anestésicos; tampoco requirió ninguno ingreso en la Unidad de Cuidados Intensivos.
En cuanto a la evolución, la EPC se controló en todos los casos con un TC desde el inicio del tratamiento de 30h (RIC 14,8-48,5). Siete pacientes tuvieron alguna complicación (mediana de complicaciones por paciente: 3,5) y la complicación más frecuente fue la neumonía (n=5), seguida por las alteraciones metabólicas (n=4), y la encefalopatía (n=3, en 2 pacientes debida a fenitoína, y en una paciente debida al uso conjunto de clonazepam y brivaracetam).
Únicamente falleció una paciente en el ingreso, y ocurrió tras el control del episodio debido a complicaciones (neumonía broncoaspirativa basal derecha y desnutrición mixta grave). De los 9 supervivientes, 6 se recuperaron íntegramente y 3 lo hicieron con secuelas, 2 con secuelas motoras atribuibles a la etiología de la EPC, y una paciente con secuelas cognitivas. Las secuelas condicionaron en una paciente un empeoramiento de 2 puntos en la ERm. La mediana de la ERm al alta fue 4 (RIC 3,5-5).
A los 3 meses del alta, la mortalidad ascendió a 4 pacientes. De los restantes 6, 4 pacientes empeoraron en la ERm una mediana de 1 punto (RIC 1-1,8) respecto a la puntuación basal, y 2 pacientes permanecieron en situación basal. La mediana de la ERm a los 3 meses fue 5 (RIC 3,5-6).
Relación entre el tiempo hasta el control y otras variablesEl TC presentó una correlación positiva alta con el TH en los episodios de inicio extrahospitalario, con un coeficiente de correlación rho de Spearman de 0,90 (p=0,037). En la serie global hubo una correlación positiva alta del TC con el TN (rho de Spearman 0,84, p=0,002) y con el TT (rho de Spearman 0,88, p<0,001). El TC también mostró una correlación positiva moderada con la glucemia al inicio del episodio (rho de Spearman 0,71, p=0,11).
Asimismo, en la regresión lineal hubo una asociación significativa del TC con el resto de variables de tiempo (TH, TN y TT): el TC se prolongó 0,2h por cada hora de retraso en la llegada al hospital (p=0,007), 0,2h por cada hora de más hasta la valoración por Neurología (p<0,001), y 0,2h por cada hora de demora hasta el inicio del tratamiento (p<0,001).
El TC no se relacionó con ninguna otra variable cuantitativa (edad, ERm basal, número de FAE administrados, o puntuación en STESS) ni cualitativa (sexo, DM, antecedente de epilepsia, tipo de EPC, lugar de inicio del episodio, retraso en la identificación del episodio, benzodiacepinas como tratamiento de primera línea, mortalidad o secuelas).
Relación entre mortalidad y otras variablesLa mortalidad en el ingreso se asoció en la única paciente que falleció a los tiempos más prolongados de la serie: el TH fue 721h frente a un tiempo mediana de 2,8h en los supervivientes (RIC 0,8-28), el TT fue 772h frente a un TT mediana de 7,5h en los supervivientes (RIC 2,9-21) y el TC fue 144h frente a un TC mediana de 30 horas en los supervivientes (RIC 13,1-44,3). No se pudo analizar esta relación con ningún test estadístico, pues fue esta la única paciente que falleció en el ingreso.
La mortalidad a los 3 meses fue significativamente mayor en aquellos pacientes que no fueron tratados con benzodiacepinas como tratamiento de primera línea (p=0,018), y presentó una tendencia a ser mayor en aquellos casos con inicio hospitalario (p=0,071).
Ni la mortalidad al alta ni la mortalidad a los 3 meses se relacionaron con otras variables.
Relación entre morbilidad y otras variablesLa aparición de secuelas al alta presentó una tendencia a relacionarse con mayor puntuación STESS (p=0,057). Por otro lado, el sexo femenino se asoció a una mayor probabilidad de empeorar en la ERm al alta (p=0,046).
No hubo relación de la morbilidad al alta, ni a los 3 meses, con otras variables cuantitativas ni cualitativas.
DiscusiónEste estudio prospectivo muestra la existencia de un retraso en diferentes fases del manejo de una serie de casos con EPC respecto a los tiempos recomendados por las guías internacionales de tratamiento del EE7,15–17, ya que no existe una guía específica de EPC debido a la escasez de datos publicados al respecto. Además, la demora en los tiempos de actuación (hasta la llegada al hospital, la valoración por Neurología y el inicio del tratamiento) se ha relacionado con una mayor duración de la EPC.
Hay estudios previos en los que se ha analizado la relación precisa entre el tiempo de evolución del EE y su pronóstico. En 1994, Towne et al. encontraron una mayor mortalidad asociada a crisis epilépticas con duración mayor de una hora18, umbral que fue reducido a 30min por Eriksson et al. en un estudio con crisis epilépticas en edad pediátrica en 200519, y reproducido por Cheng en 2016 en pacientes adultos20. En 2018, nuestro grupo de investigación publicó el primer estudio prospectivo en el que las variables de tiempo se recogieron de forma cuantitativa continua21. En dicho estudio se encontró un importante retraso diagnóstico-terapéutico en el manejo de una serie de pacientes adultos con EE no convulsivo, de manera que la demora en la llegada al hospital y en el inicio del tratamiento presentó una correlación alta con la duración del EE. El presente estudio refuerza la asociación entre el retraso terapéutico y la duración del EE, específicamente en la EPC.
Teniendo en cuenta esta relación, lo esperable habría sido que la demora en el control del episodio se hubiera asociado también a una mayor mortalidad. Sin embargo, debido al pequeño tamaño de la muestra y a que únicamente se produjo un fallecimiento, dicha circunstancia no se ha podido analizar. Sí consideramos relevante que el único caso de fallecimiento durante el ingreso haya ocurrido en la paciente con los tiempos de atención más prolongados del estudio, aunque esto podría haberse debido al azar. En el seguimiento posterior la mortalidad a los 3 meses ha sido considerable. Esto, unido a la relevancia de los tiempos de actuación encontrada en nuestra serie, asemeja la potencial gravedad y necesidad de tratamiento precoz de la EPC a otros tipos de EE.
En nuestra serie la etiología más frecuente fue la enfermedad cerebrovascular, tanto en su forma isquémica como hemorrágica, y con un inicio de la EPC tanto agudo como remoto respecto al evento cerebrovascular. Esto difiere de otras publicaciones en las que la etiología cerebrovascular es muy infrecuente9, o claramente menor que en nuestra serie10,22. Por otro lado, hemos encontrado una elevada proporción de pacientes con hiperglucemia hiperosmolar no complicada al inicio de la EPC, y la glucemia ha presentado una correlación positiva con el tiempo hasta el control del episodio. Sin embargo, la mediana de glucemia en nuestro estudio fue inferior a la de otros estudios, y la cifra más alta no superó los 250mg/dL. Además todos los pacientes de nuestra serie con hiperglucemia al inicio del episodio tenían una lesión cerebral estructural en la prueba de imagen que justificaba el origen de la EPC. Por todo ello, consideramos que en nuestra serie la hiperglucemia podría haber tenido un papel más desencadenante que etiológico, a diferencia de otros estudios en los que la hiperglucemia fue la etiología más frecuente, o de las más frecuentes9,10.
Aunque este estudio no fue diseñado para analizar aspectos epidemiológicos de la EPC, sí hemos podido calcular su prevalencia relativa sobre el total de EE, a partir de los datos del registro prospectivo de EE de nuestro centro. Durante el periodo de inclusión de un año ingresaron en nuestro centro un total de 51 EE, de lo que se obtiene una prevalencia relativa de EPC del 19,6%. Aunque es un dato indirecto, ha sido una proporción alta respecto al total de EE, lo que contrasta con la baja prevalencia estimada de la enfermedad encontrada en otros estudios8. Esto podría deberse a que se trata de una enfermedad infradiagnosticada, como han indicado otros autores previamente12,23, y a que nuestro centro es un hospital terciario con Unidad de Ictus de referencia para otros hospitales, lo que aumenta la prevalencia de enfermedad cerebrovascular en nuestro centro.
Los resultados del estudio pueden estar limitados por el tamaño de la muestra. Junto con el diseño unicéntrico, el tamaño muestral puede reducir la posibilidad de generalizar los resultados. Además, el análisis estadístico se ha visto limitado por dicha circunstancia y por el bajo número de eventos de evolución. Por otra parte, la recogida de variables de evolución al alta puede suponer un sesgo de información, ya que el momento del alta puede ser heterogéneo y verse influenciado por factores asociados a la estancia hospitalaria y a otras circunstancias del paciente. La imprecisión inherente a la recogida de variables de tiempo se ha intentado subsanar con el diseño prospectivo del estudio.
ConclusionesLa EPC es un tipo de EE con una prevalencia relativa considerable, y cuya etiología más frecuente en nuestra serie fue la enfermedad cerebrovascular. Se encontró una proporción alta de pacientes con hiperglucemia al inicio del episodio, y la glucemia se correlacionó positivamente con el TC. Sin embargo, en todos los casos con hiperglucemia al inicio se encontró una lesión estructural que justificaba el origen de la EPC, lo que podría apuntar a un papel más desencadenante que etiológico de la hiperglucemia. Por último, encontramos un retraso en los tiempos de manejo de la enfermedad, lo que ha repercutido en una mayor duración del EE.
FinanciaciónNinguna.
Conflicto de interesesNinguno.
El Dr. ÿlvaro Gutiérrez Viedma es beneficiario del Contrato Fernando de Castro para jóvenes investigadores post-MIR de la Universidad Complutense de Madrid.