Na avaliação do carcinoma da próstata são habitualmente utilizados nomogramas clínicos para prever a probabilidade de disseminação linfática e extra ganglionar. Esses nomogramas podem sugerir a presença e a extensão desta neoplasia, mas não permitem a distinção clara entre doença loco regional e à distância. Pretendeu‐se, com este trabalho, avaliar a utilidade da tomografia por emissão de positrões/tomografia computorizada (PET/CT) com Fluorocolina‐F18 (FCH‐F18) na orientação de doentes com o diagnóstico inicial de carcinoma da próstata e estadiados por esta técnica imagiológica.
Material e métodosForam revistos os processos clínicos de 39 doentes com carcinoma da próstata que realizaram PET/CT com FCH‐F18 para estadiamento inicial, entre novembro de 2010 e abril de 2015. Destes, 20 doentes foram excluídos por terem iniciado hormonoterapia. Nos restantes 19 doentes, foi avaliado o desempenho da PET/CT com FCH‐F18 para deteção de metastização ganglionar através do cálculo dos valores de sensibilidade, especificidade, valor preditivo positivo, valor preditivo negativo e acuidade diagnóstica. Seis doentes realizaram linfadenectomia pélvica (total de 69 gânglios), permitindo confirmação histológica. Quando não existia confirmação histológica, os achados da PET/CT com FCH‐F18 (total de 30 gânglios e 3 casos de metastização óssea) foram correlacionados com os valores do antigénio prostático específico (PSA) e com as informações de várias modalidades imagiológicas, como CT, cintigrafia óssea, ressonância magnética (RM), PET/CT com Fluoreto de Sódio‐F18 (FNa‐F18) e PET/CT com FCH‐F18 de controlo.
ResultadosOs valores de sensibilidade, especificidade, valor preditivo positivo, valor preditivo negativo e acuidade diagnóstica para deteção de metastização ganglionar foram, respetivamente, 96,8%, 80,9%, 69,8%, 98,2% e 85,8%. Na nossa amostra, esta técnica identificou metástases, ganglionares extrapélvicas ou ósseas em 5 doentes (26,3%) com implicações na abordagem terapêutica. Mostrou captação sugestiva de metastização óssea, corroborada por outros meios de diagnóstico e pelo seguimento, em 3 doentes, estes com PSA de 9,5±2,9ng/mL.
ConclusõesA PET/CT com FCH‐F18 é uma modalidade imagiológica de corpo inteiro e multiorgão que permite identificar, de modo global, os locais de doença, em doentes com carcinoma da próstata. Neste estudo, a PET/CT com FCH‐F18 apresentou bons resultados quando utilizada no processo de estadiamento inicial destes doentes. Salienta‐se a sua capacidade para deteção de doença à distância, nomeadamente óssea, mesmo com PSA<20ng/mL.
In the evaluation of prostate cancer, clinical nomograms are commonly used to predict the probability of lymphatic and extra‐nodal spread. Those nomograms may suggest the presence and the extension of this cancer but do not allow a clear distinction between loco‐regional and distant disease. In this study, it was intended to evaluate the usefulness of 18F‐Fluorocoline positron emission tomography/computed tomography (18F‐FCH‐PET/CT) in the workup of patients with the initial diagnosis of prostate cancer and staged by this imaging technique.
Material and methodsThe medical records of 39 patients with prostate cancer who underwent 18F‐FCH PET/CT for initial staging, between November 2010 and April 2015, were reviewed. Of these, 20 patients were excluded because they had already started hormonotherapy. In the other 19 patients, the performance of 18F‐FCH PET/CT for the detection of lymph node metastasis was evaluated by calculating the sensitivity, specificity, positive predictive value, negative predictive value and diagnostic accuracy. Six patients had performed pelvic lymphadenectomy (total of 69 lymph nodes), allowing histological confirmation. When there was no histological confirmation (total of 30 lymph nodes and 3 cases of bone metastasis), the findings of 18F‐FCH PET/CT were correlated with the values of PSA and the information from multiple imaging modalities such as CT, bone scan, magnetic resonance (MRI), 18F‐Sodium Fluoride (18F‐NaF) PET/CT of control.
ResultsThe sensitivity, specificity, positive predictive value, negative predictive value and diagnostic accuracy for lymph node metastasis detection were, respectively, 96.8%, 80.9%, 69.8%, 98.2% and 85.8%. In our sample, this technique also allowed the identification of nodal extra pelvic or bone metastasis in 5 patients (26.3%) with implications in the treatment. It showed uptake suggestive of bone metastasis, corroborated by other diagnostic technics or by the follow‐up, in 3 patients, those with prostate specific antigen (PSA) of 9.5±2.9 ng/mL.
Conclusion18F‐FCH PET/CT is an entire body and multi organ imaging modality that allows the identification, globally, of the sites of disease in patients with prostate cancer. In this study, 18F‐FCH PET/CT showed good results when used in the initial staging of these patients. It is highlighted the ability to detect distant disease, in particular bone metastasis, even with PSA<20ng/mL.
No carcinoma da próstata (CaP), embora se utilizem nomogramas clínicos, baseados no valor do antigénio prostático específico (PSA), score de Gleason e outras variáveis, para prever a probabilidade de disseminação linfática e de metastização extraganglionar, a imagiologia médica pode ser uma mais‐valia. Valores aumentados do PSA podem sugerir a presença e a extensão do carcinoma mas não permitem, de forma inequívoca, afirmar se existe apenas doença loco regional ou, também, metastização à distância. A tomografia por emissão de positrões/tomografia computorizada (PET/CT) com Fluorocolina‐F18 (FCH‐F18) é uma técnica de imagiologia anatomofuncional, de corpo inteiro e multiorgão, com capacidade para fazer esta distinção, contribuindo, assim, para a otimização de estratégias terapêuticas individualizadas1.
A colina é um percursor na biossíntese dos fosfolípidos da membrana celular. É incorporada no meio intracelular através de um transportador específico e é utlizada para sintetizar fosfatidilcolina. O primeiro passo desta via metabólica consiste na fosforilação da colina em fosfocolina, processo catalisado pela enzima colina quinase. No CaP há uma sobre‐expressão desta enzima, resultando no aumento da produção de fosfocolina. Existe, por isso, maior produção endógena de colina e maior captação intracelular2. A colina marcada com carbono‐11 (C11) ou flúor‐18 (F18) pode, assim, ser utilizada como biomarcador desta neoplasia maligna. Ambos os radiofármacos (colina‐C11 e FCH‐F18) fornecem informações semelhantes. No entanto, a FCH‐F18 apresenta como vantagem o maior tempo de semivida físico do F‐18 (110 minutos vs. 20 minutos para o C11), o que possibilita o seu uso mais generalizado e em centros afastados dos locais de produção (ciclotrões)3.
Atualmente é reconhecido o valor da PET/CT com FCH‐F18 na recidiva bioquímica do CaP4. Há evidência científica crescente a suportar a utilização desta técnica, também, no estadiamento inicial, bem como na avaliação da resposta à terapêutica e avaliação prognóstica em doentes com CaP1.
O papel da PET/CT com FCH‐F18 na deteção do tumor primário é limitado, apresentando especificidade (ESP) reduzida, não sendo o método ideal para distinguir doença tumoral de hiperplasia prostática ou mesmo de tecido prostático normal5. Contudo, em doentes de alto risco, com elevado grau de suspeição de CaP e com biópsias prostáticas repetidamente negativas, esta técnica pode, ainda assim, ter utilidade na identificação do local a biopsar, ao detetar a área com maior intensidade de captação do radiofármaco, que teoricamente corresponderá ao local com maior probabilidade de doença6. É, ainda, previsível que a utilização conjunta deste radiofármaco PET com a ressonância magnética (RM), em imagiologia híbrida de PET/RM, possa permitir, a nível prostático, a identificação e localização de lesões malignas de um modo mais preciso e numa fase muito precoce da doença. A RM permite acrescentar um excelente contraste e uma melhor resolução espacial7.
Após o diagnóstico, a PET/CT com FCH‐F18 pode ser útil na estratificação dos doentes, podendo ser usada como método imagiológico eficaz para o seu estadiamento, nomeadamente para a avaliação da extensão da doença, identificando os doentes que têm apenas doença prostática, os que têm doença ganglionar loco‐regional e os que apresentam metastização à distância6. Estas informações são importantes para estabelecer a correta estratégia terapêutica, diferenciando os doentes que podem beneficiar de uma abordagem com fins curativos, nomeadamente cirurgia ou radioterapia, daqueles que devem, desde o início, ser submetidos a terapêuticas sistémicas8. Estas informações têm, ainda, elevado valor prognóstico, relacionando‐se com a probabilidade de recidiva bioquímica e com a mortalidade9.
O correto estadiamento ganglionar pré‐operatório é, também, importante para a orientação da decisão cirúrgica no que diz respeito à realização da linfadenectomia, confirmando a sua indicação e orientando a sua extensão, permitindo fazê‐lo de modo individualizado para cada doente10.
Comparativamente com outras modalidades imagiológicas, como a CT e a RM, a PET/CT com FCH‐F18 apresenta‐se como uma técnica capaz de identificar lesões ativas, independentemente de critérios dimensionais, o que, na prática clínica, se traduz em maiores precocidade e sensibilidade (SEN) na deteção de lesões11,12. Estima‐se que, no CaP, a grande maioria das metástases ganglionares (cerca de 70‐80%) seja de pequenas dimensões, apresentando um eixo axial curto<8mm, e por isso sem critérios dimensionais de adenopatias13,14. Para além de ser considerada a técnica imagiológica com melhores resultados na identificação de metástases ganglionares15, a PET/CT com FCH‐F18 é apontada, também, como o melhor método para a deteção de metástases esqueléticas intramedulares16.
O CaP metastiza frequentemente para o esqueleto17, aspeto que influencia muito a abordagem terapêutica destes doentes. Uma elevada percentagem de doentes desenvolve metástases ósseas, ensombrando o seu prognóstico. A deteção precoce destas metástases é fundamental para a otimização da estratégia terapêutica e a prevenção de complicações, como fraturas e compressões medulares18. Um número crescente de trabalhos salienta o grande impacto que a PET/CT, com fluoreto de sódio‐F18 (FNa‐F18) ou com FCH‐F18, tem na abordagem destes doentes, atendendo às suas elevadas SEN e ESP, significativamente superiores em relação à cintigrafia óssea (CO)19. As guidelines atuais continuam a indicar a CO como o método imagiológico a utilizar para a deteção de metastização óssea no CaP, mas a literatura mais recente enfatiza a superior capacidade de deteção da PET/CT, sugerindo a sua inclusão em guidelines futuras como alternativa à CO20. Embora a PET/CT com FCH‐F18 pareça ter SEN ligeiramente inferior à PET/CT óssea com FNa‐F18, apresenta valores de ESP mais elevados. Além disso, tem a capacidade de detetar, num único exame, não só metástases ósseas, mas também, localizações extraósseas21.
ObjetivoPretendeu‐se com este trabalho avaliar a utilidade e o impacto que a PET/CT com FCH‐F18 teve na orientação dos primeiros doentes da nossa instituição que foram estadiados por esta técnica após o diagnóstico inicial de CaP. Procurou‐se determinar a sua capacidade para o correto estadiamento desta neoplasia, através da distinção entre doença local, loco‐regional e à distância, bem como o impacto que estas informações tiveram na otimização da abordagem terapêutica destes doentes.
Material e métodosPopulação estudadaForam revistos os processos clínicos de 39 doentes com CaP, confirmado histologicamente, que realizaram PET/CT com FCH‐F18 para estadiamento inicial, entre novembro de 2010 e abril de 2015. Verificou‐se que 20 doentes se encontravam sob tratamento hormonal à data da realização do exame. Embora esta terapêutica tivesse sido muito recentemente iniciada, decidiu‐se pela não inclusão destes doentes neste estudo. Para cada um dos 19 doentes restantes foi registado o grau, o score de Gleason e o valor do PSA no estadiamento. Os doentes foram classificados, segundo os critérios da Associação Europeia de Urologia (EAU), como de risco baixo, intermédio ou alto, para metastização à distância. A caracterização demográfica e tumoral da população incluída no estudo encontra‐se resumida na tabela 1.
Características demográficas e tumorais da população estudada
| N.° de doentes | 19 |
| Idade | anos |
| Média±DP | 65,1±8,0 |
| Intervalo | 46‐77 |
| PSA no estadiamento | ng/mL |
| Média±DP | 36,1±39,3 |
| Intervalo | 5,7‐164 |
| Gleason (soma) | n (%) |
| 5 | 1 (5,6) |
| 6 | 1 (5,6) |
| 7 | 10 (55,6) |
| 8 | 5 (27,8) |
| 9 | 1 (5,6) |
| Categoria de riscoEAU | n (%) |
| Risco baixo | 0 (0) |
| Risco intermédio | 6 (31,6) |
| Risco elevado | 12 (63,1) |
| Desconhecido | 1 (5,3) |
DP: desvio‐padrão; EAU: Associação Europeia de Urologia; PSA: antigénio prostático específico.
O tempo médio de seguimento dos doentes foi de 23,2±13,3 meses e incluiu a realização de consultas de rotina, doseamentos do PSA e estudos de imagem.
Protocolo de realização da tomografia por emissão de positrões/tomografia computorizada com Fluorocolina‐18 com FCH‐F18Todos os doentes propostos para a realização da PET/CT com FCH‐F18 foram informados sobre os objetivos e procedimentos do exame, tendo concordado com a sua realização e assinado um termo de consentimento informado.
O protocolo de aquisição do exame implicou a administração endovenosa de 3MBq/kg de FCH‐F18, com obtenção imediata de uma aquisição dinâmica da pélvis durante 5 minutos. Esta aquisição inicial teve por objetivo permitir o estudo pélvico antes da chegada do radiofármaco à bexiga, resultante da sua normal eliminação urinária, o que dificultaria, pela sua proximidade, a avaliação da região prostática e periprostática. Posteriormente, 30 minutos após a administração do radiofármaco, procedeu‐se à aquisição de um estudo de corpo inteiro para pesquisa de metástases loco‐regionais e à distância. Os doentes foram posicionados em decúbito dorsal, com os braços acima da cabeça, num tomógrafo PET/CT GE Discovery ST. Os parâmetros de aquisição da CT para correção de atenuação e mapeamento anatómico foram os seguintes: 120kV, smart mA: noise índex de 35, com valores de corrente compreendidos entre 10‐200mA, pitch 1,5:1, rotação de 0,5s e uma espessura de corte de 3,75mm. O estudo de emissão PET foi obtido em modo 3D, com um diâmetro de field of view (FOV) de 70cm e duração de 3 minutos de emissão por cada posição de mesa. Os dados foram recolhidos em list mode e reconstruídos usando um algoritmo de reconstrução iterativo 3D ordered subset expectation maximization (OSEM), com 20 subsets por 2 iterações, matriz de 128x128 e um filtro pós‐reconstrução de 5mm full width at half maximum (FWHM).
Interpretação das imagensAs imagens de PET/CT com FCH‐F18 foram interpretadas, à data de realização do exame, por 2 especialistas em medicina nuclear, por consenso, havendo conhecimento da história clínica do doente e acesso aos estudos analíticos e imagiológicos disponíveis.
Foi realizada análise semiquantitativa calculando, para cada lesão, o valor de maximum standardized uptake value (SUVmax). A determinação do SUVmax baseou‐se na criação de um volume de interesse que envolvia completamente e apenas a lesão, e serviu como indicador da intensidade de captação do radiofármaco pelas lesões detetadas.
A presença de captação, na próstata, de FCH‐F18, de intensidade superior ao fundo, foi relacionada com a informação clínica de doença prostática.
O diagnóstico de metástases ganglionares baseou‐se, de acordo com outros autores22–24, na intensidade de captação de FCH‐F18. Gânglios linfáticos com captação aumentada de FCH‐F18, superior à atividade de fundo, foram considerados como positivos, mesmo que não respeitassem os critérios anatómicos de adenopatias. Gânglios com critérios anatómicos de adenopatias, mas sem captação de FCH‐F18, não foram considerados metástases ganglionares. Formações ganglionares inguinais com captação discreta de FCH‐F18, sem critérios morfológicos suspeitos, foram consideradas de natureza reativa ou inflamatória.
Locais de captação aumentada de FCH‐F18 em estruturas ósseas foram considerados como metástases de acordo com a sua intensidade de captação, localização anatómica e características morfológicas (tomodensitométricas). Estes achados foram, ainda, correlacionados com as informações dos estudos imagiológicos adicionais disponíveis, como a PET/CT óssea com FNa‐F18, a CO ou a RM.
Padrão de referênciaSeis doentes, 31,6% (6/19), foram submetidos a linfadenectomia. Destes, 5 foram submetidos a linfadenectomia pélvica bilateral alargada, abrangendo as cadeias obturadoras, ilíacas externas, ilíacas internas, ilíacas comuns e pré‐sagrada. Um doente foi submetido a linfadenectomia pélvica bilateral alargada e, ainda, inguinal bilateral.
Nos restantes 68,4% dos doentes (13/19), os achados da PET/CT com FCH‐F18 foram valorizados por correlação com os valores do PSA e com os achados de várias modalidades imagiológicas, como CT, CO, RM, PET/CT com FNa‐F18 e PET/CT com FCH‐F18 de controlo, realizadas durante o seguimento, de modo a aferir a acuidade diagnóstica (ACD) da técnica.
Avaliação do teste diagnósticoCom base na comparação com os padrões de referência, os achados da PET/CT com FCH‐F18 foram classificados em verdadeiros positivos (VP), verdadeiros negativos (VN), falsos positivos (FP) e falsos negativos (FN). Estes valores foram utilizados para o cálculo da SEN, ESP, valor preditivo positivo (VPP), valor preditivo negativo (VPN) ACD, de acordo com as seguintes fórmulas: SEN=VP/VP+FN; ESP=VN/VN+FP; VPP=VP/VP+FP; VPN=VN/VN+FN; ACD=VP+VN/VP+VN+FP+FN.
ResultadosRegistou‐se, em todos os doentes, captação de FCH‐F18 na próstata, quer no estudo dinâmico inicial quer no estudo adquirido aos 30 minutos, compatível com doença prostática em atividade (SUVmax=7,0±3,8; 2,3‐17,6).
Onze doentes, 57,9% (11/19), apresentavam apenas captação prostática de FCH‐F18, sem alterações funcionais suspeitas de metastização ganglionar ou extralinfática.
Sete doentes, 36,8% (7/19), apresentavam captação de FCH‐F18 sugestiva de metastização ganglionar, 5 metastização ganglionar pélvica, 26,3% (5/19), e 2 metastização ganglionar pélvica e extrapélvica, 10,5% (2/19).
Três doentes, 15,8% (3/19) apresentavam captação de FCH‐F18 sugestiva de metastização óssea, dois, 10,5% (2/19), também com metastização ganglionar pélvica, e um, 5,3% (1/19), com metastização óssea apenas.
O PSA de estadiamento dos doentes com doença prostática apenas (n=11), doença prostática e ganglionar pélvica (n=3), doença prostática e ganglionar pélvica e extrapélvica (n=2), e com doença prostática, ganglionar e óssea (n=2), foi de 42,0±48,2ng/mL, 36,0±20,0ng/mL, 44,0±5,6ng/mL e 11,1±1,3ng/mL, respetivamente. O PSA de estadiamento do doente com doença prostática e metastização óssea foi de 6,4ng/mL. O PSA de estadiamento dos doentes com doença óssea (n=3) foi de 9,5±2,9ng/mL (tabela 2).
Valores do PSA de estadiamento da população estudada
| Padrão da doença na PET/CT com FCH‐F18 | PSA no estadiamento (ng/mL) |
|---|---|
| Prostática apenas (n=11) | |
| Média±DP | 42,0±48,2 |
| Intervalo | 5,7‐164,0 |
| Prostática+ganglionar pélvica apenas (n=3) | |
| Média±DP | 36,0±20,0 |
| Intervalo | 22,0‐50,0 |
| Prostática+ganglionar pélvica e extrapélvica (n=2) | |
| Média±DP | 44,0±5,6 |
| Intervalo | 40,0‐48,0 |
| Prostática+ganglionar e óssea (n=2) | |
| Média±DP | 11,1±1,3 |
| Intervalo | 10,2‐12,0 |
| Prostática+óssea (n=1) | 6,4 |
DP: desvio‐padrão; PSA: antigénio prostático específico.
Nos doentes submetidos a linfadenectomia foi removido um total de 69 gânglios. Cinco casos, num total de 56 gânglios, corresponderam a doentes em que a PET/CT com FCH‐F18 não mostrou metastização, ganglionar ou de outra natureza. Da análise histológica destes gânglios, 55 foram negativos para metastização, pelo que foram considerados VN e um foi positivo, pelo que foi considerado FN. O sexto caso, num total de 13 gânglios, correspondeu a um doente em que a PET/CT com FCH‐F18 sugeriu metastização ganglionar pélvica e inguinal. Na análise histológica, os 13 gânglios foram negativos para metastização, pelo que foram considerados FP.
A PET/CT com FCH‐F18 detetou, em 7 doentes, um total de 47 gânglios com critérios de metástases ganglionares. Destes, 6 doentes não foram submetidos a esvaziamento ganglionar, pelo que não se dispõe de confirmação histológica. Num doente, com extensa metastização ganglionar pélvica e extrapélvica, num total de 25 adenopatias, registou‐se boa resposta do PSA e desaparecimento da metastização ganglionar em PET/CT com FCH‐F18 após iniciar hormonoterapia. Estas 25 adenopatias foram consideradas como VP. Outro doente realizou RM, dias antes da PET/CT com FCH‐F18, que corroborou a presença de uma metástase ganglionar obturadora esquerda (VP=1). Finalmente, um doente realizou CT e PET/CT com FCH‐F18 de estadiamento, tendo ambos os exames mostrado 4 metástases ganglionares pélvicas (VP=4). Nos restantes 3 doentes, correspondendo a um total de 4 adenopatias identificadas na PET/CT com FCH‐F18, não foi possível afirmar a sua natureza maligna. No total, considerou‐se existir 30 VP.
Assim, a ACD da PET/CT com FCH‐F18 na deteção de metastização ganglionar foi de 85,8% (30+55/30+55+13+1), com SEN=96,8% (30/30+1); ESP=80,9% (55/55+13); VPP=69,8% (30/30+13) e VPN=98,2% (55/55+1).
A PET/CT com FCH‐F18 mostrou captação de FCH‐F18 sugestiva de metastização óssea em 15,8% dos doentes (3/19). Em 2 doentes a metastização óssea foi também afirmada recorrendo a outros estudos realizados durante o estadiamento (CT e CO em um deles, RM e PET/CT com FNa‐F18 noutro). O terceiro doente repetiu PET/CT com FCH‐F18 9 meses depois, após o início de hormonoterapia, mostrando persistência de elevação do PSA e manutenção da captação aumentada de FCH‐F18 na mesma localização, sugerindo persistir a lesão óssea secundária.
Segundo os critérios da EAU, 6 doentes foram classificados como de risco intermédio e 12 como de alto risco, não existindo doentes de baixo risco (não foi possível, por falta de informação, classificar um doente quanto ao risco). A intensidade de captação prostática de FCH‐F18, quando avaliada pelo SUVmax, foi de 4,2±1,4 nos doentes de risco intermédio e de 8,8±3,8 nos doentes de alto risco. A frequência de metastização ganglionar nos doentes de risco intermédio foi de 16,7% (1/6) e nos doentes de alto risco foi de 41,7% (5/12). Finalmente, registou‐se metastização óssea em 33,3% (2/6) doentes de risco intermédio e em 8,3% (1/12) doentes de alto risco.
Como opção terapêutica após a realização da PET/CT com FCH‐F18, 31,6% (5/19) doentes foram submetidos a prostatectomia, 31,6% (5/19) foram orientados para realização de radioterapia externa, 10,5% (2/19) foram submetidos a prostatectomia e hormonoterapia, 5,2% (1/19) realizaram radioterapia externa e hormonoterapia, e 26,3% (4/19) realizaram hormonoterapia. Em 2 doentes não foi possível obter informação quanto à terapêutica realizada.
No seguimento clínico destes doentes, constatou‐se, em todos eles, com exceção de um em que se manteve doença óssea, boa resposta bioquímica, com normalização dos valores do PSA após a terapêutica seleccionada de acordo com o estadiamento efectuado por PET/CT com FCH‐F18.
DiscussãoA maioria dos casos de CaP é detetada, atualmente, numa fase precoce da doença em que pode, ainda, ser considerada curável e as técnicas imagiológicas podem contribuir para a otimização da sua abordagem terapêutica25.
Desenvolvimentos promissores na imagiologia deste tumor estão constantemente a surgir, e espera‐se que a imagiologia funcional e molecular assuma um papel importante na estratificação dos doentes e permita estabelecer estratégias terapêuticas personalizadas como esta neoplasia exige26. A PET/CT com FCH‐F18 tem sido utilizada principalmente no restadiamento em contexto de recidiva bioquímica, mas começa, também, a ser utilizada no estadiamento inicial, momento em que pode acrescentar informações adicionais valiosas21.
Para a deteção da doença prostática, a PET/CT com FCH‐F18 tem um papel limitado e não substitui a RM, que se mantém como a melhor técnica de imagem para a avaliação das características do tumor primitivo, como a presença de invasão das vesículas seminais7. É previsível que a PET/RM com FCH‐F18 possa vir a representar, a este nível, um papel importante27.
O estadiamento ganglionar do CaP é fundamental para estabelecer a estratégia terapêutica. O gold standard para o diagnóstico de envolvimento metastático ganglionar é a histologia após linfadenectomia, técnica invasiva com morbilidade associada. A PET/CT com FCH‐F18 apresenta‐se como uma técnica imagiológica, não invasiva, capaz de contribuir para a identificação da doença ganglionar28.
Na identificação da metastização óssea, a PET/CT com FCH‐F18 é considerada, atualmente, mais sensível e específica do que a CO29. Está demonstrado que a PET/CT com FCH‐F18 suplanta quer a CO quer a CT na deteção da disseminação óssea nos doentes de alto risco com CaP30.
Num trabalho recente, Evangelista et al. compararam a PET/CT com FCH‐F18 com técnicas imagiológicas convencionais, como a CT abdominopélvica e a CO, no estadiamento de doentes com CaP de intermédio e alto risco. Os autores concluíram que a PET/CT com FCH‐F18 é superior para a deteção da metastização, quer ganglionar quer óssea, no estadiamento inicial do CaP31.
Habitualmente, é assumido que os valores do PSA se correlacionam com o risco de extensão extraprostática da doença. Contudo, estes não conseguem afirmar, de forma inequívoca, o padrão individual de doença. Na nossa amostra, os valores do PSA no grupo de doentes com doença prostática apenas, doença ganglionar loco‐regional e doença ganglionar loco‐regional e à distância são bastante sobreponíveis. Não é recomendado, por rotina, a investigação de metastização óssea no estadiamento dos doentes com CaP, sem queixas ósseas e com valores do PSA iguais ou inferiores a 20ng/mL. Contudo, trabalhos publicados, como o de Abuzallouf et al., reportam a deteção de metástases ósseas em doentes com valores do PSA inferiores a 20ng/mL32. Pudemos constatar esta situação em 3 doentes com doença óssea e com valores do PSA de 9,5±2,9ng/mL.
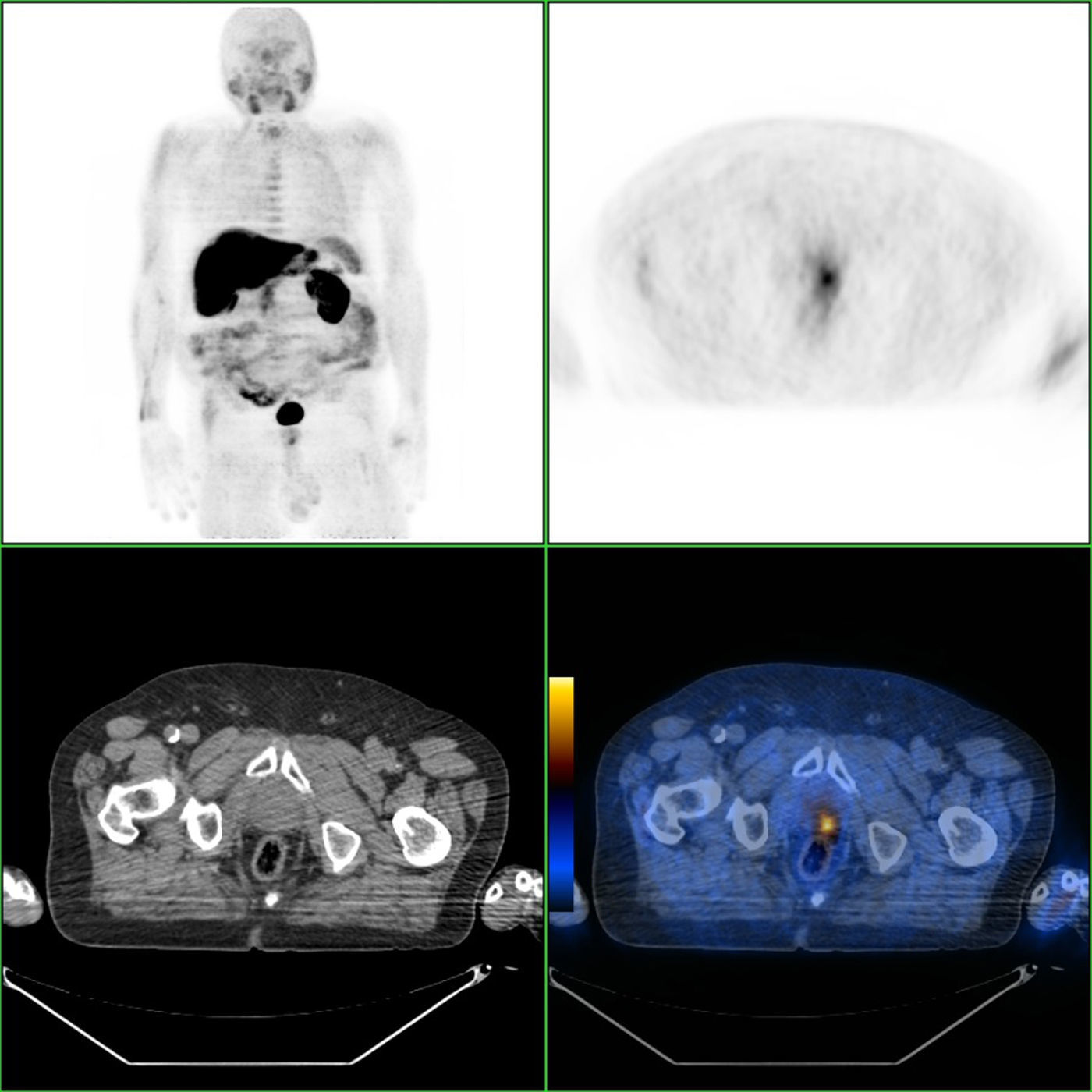
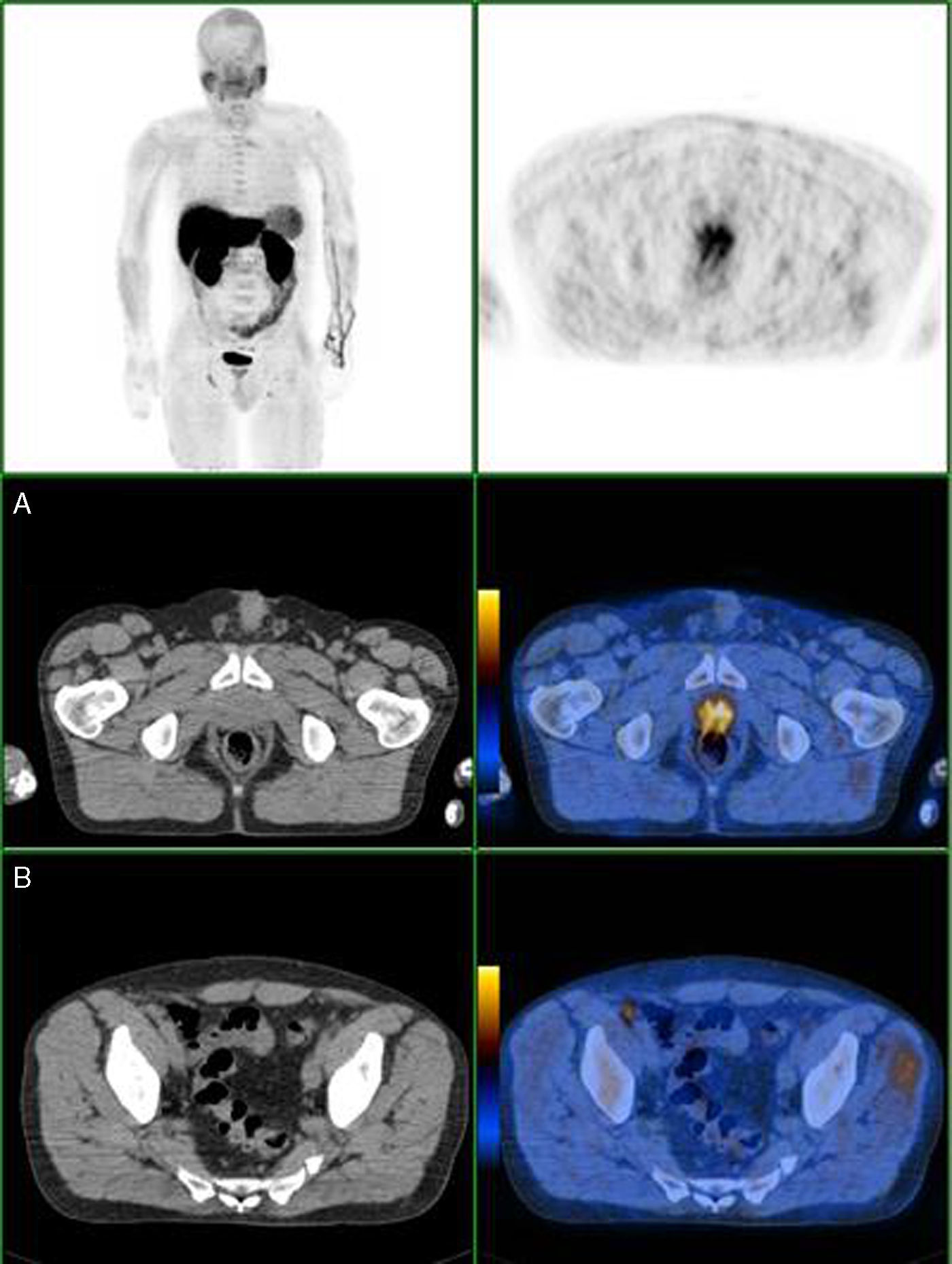
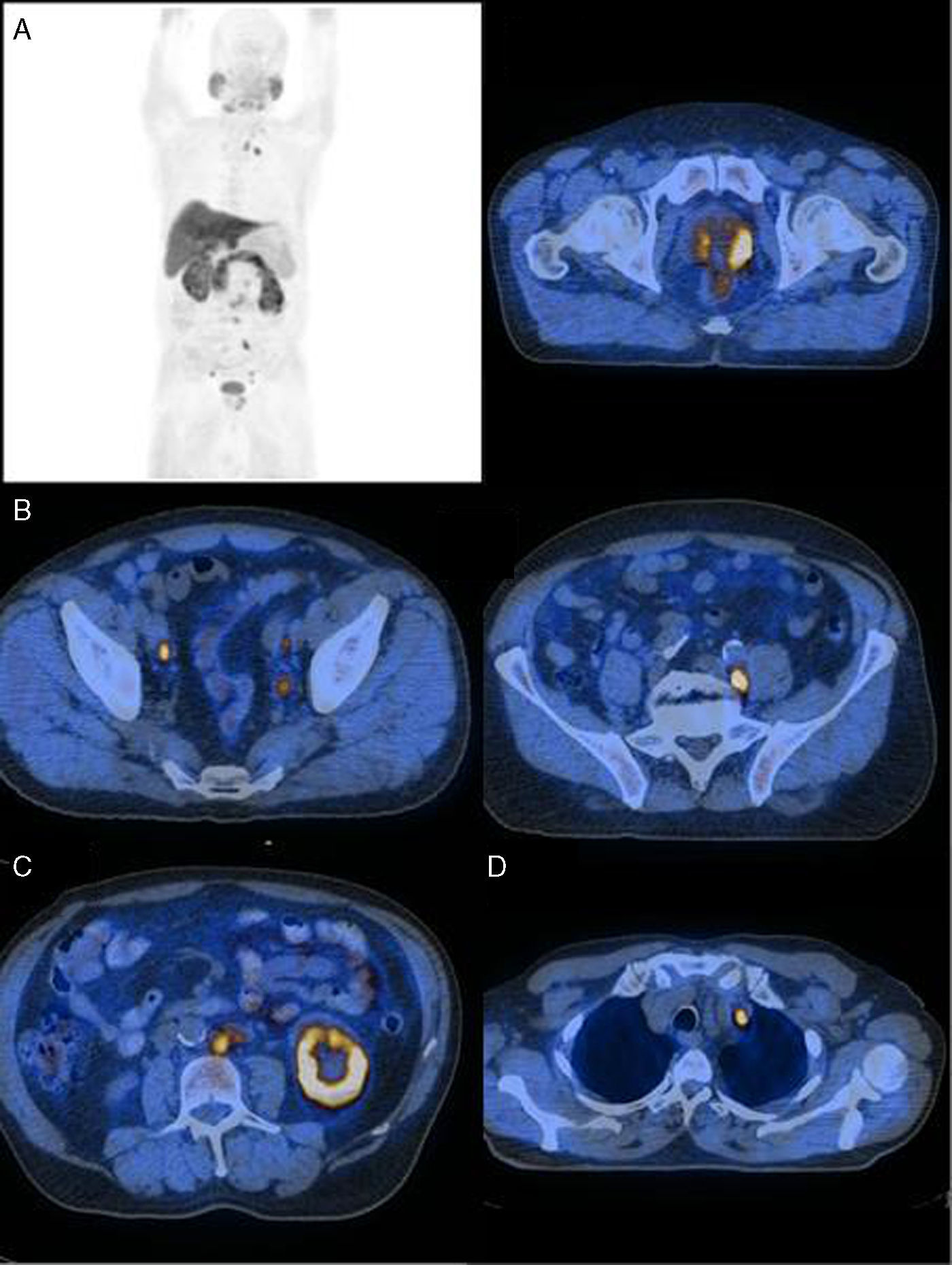
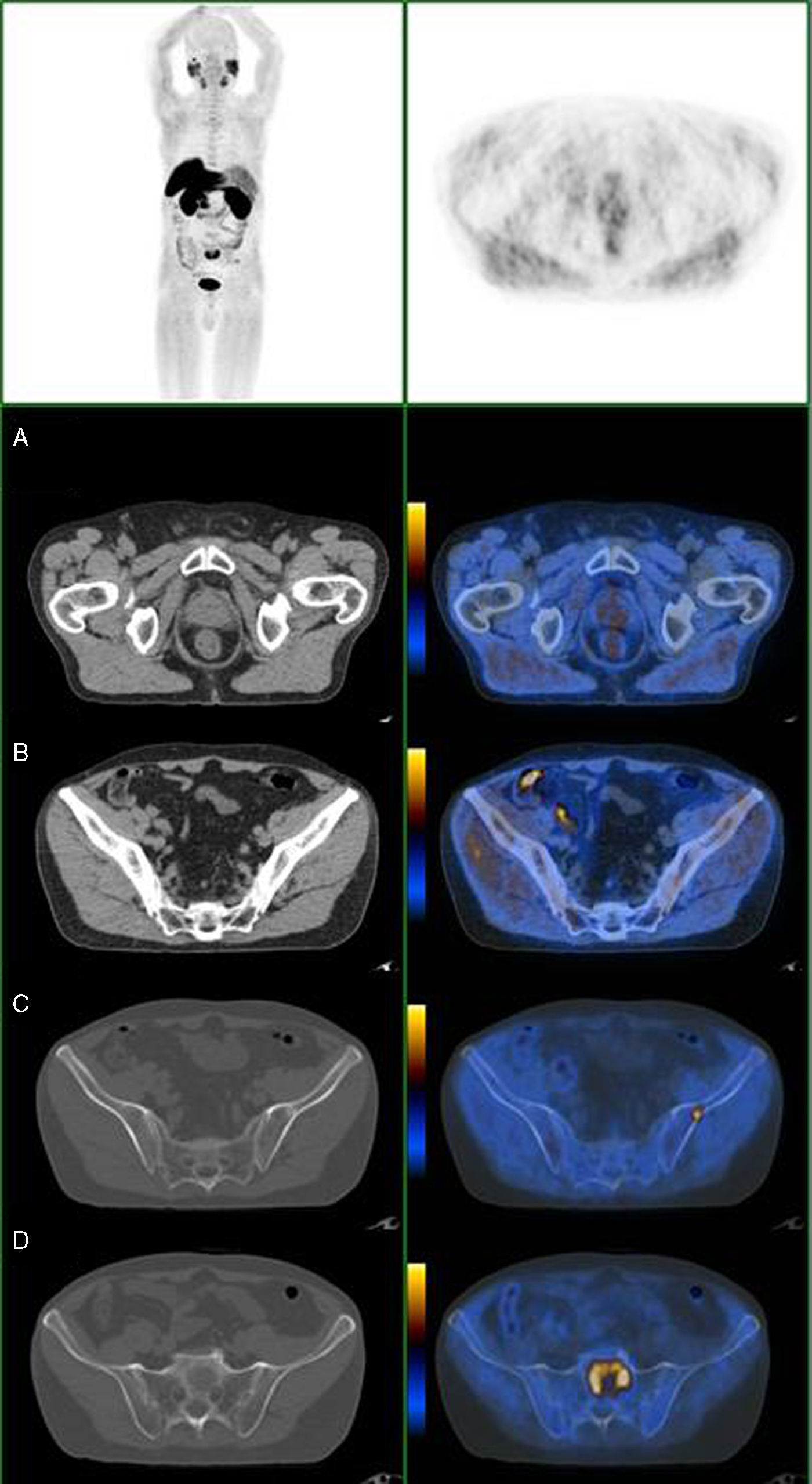
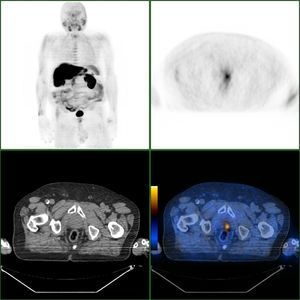
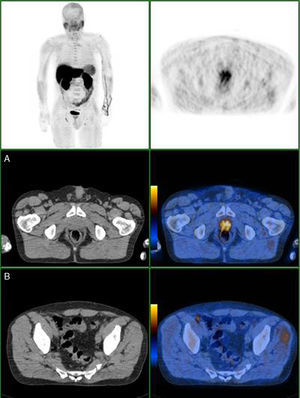
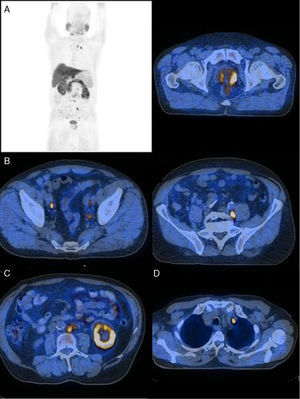
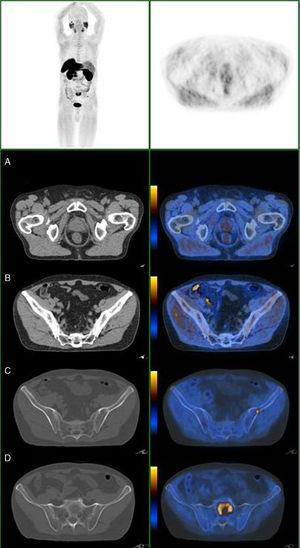
Nas figuras 1‐4 apresentam‐se 4 exames PET/CT com FCH‐F18 realizados em contexto de estadiamento inicial de CaP. Na figura 1 encontra‐se um doente apenas com doença prostática com PSA de estadiamento de 48ng/mL. Na figura 2 apresenta‐se um doente com doença prostática e metastização ganglionar pélvica com PSA de estadiamento de 40ng/mL. Na figura 3, o doente apresentava doença prostática e metastização ganglionar à distância e tinha um PSA de estadiamento de 43ng/mL. Na figura 4 o doente apresenta doença prostática e metastização óssea, e tinha uma PSA de 11ng/mL.
Na nossa amostra, correspondendo aos primeiros doentes estadiados na nossa instituição por PET/CT com FCH‐F18, esta técnica apresentou resultados favoráveis. A SEN na deteção de doença prostática foi de 100%, registando‐se, na próstata, captação significativa de FCH‐F18 em todos os doentes (SUVmax: 7,0±3,8).
Utilizando como padrões de referência os resultados histológicos e o seguimento clínico, incluindo doseamentos do PSA e vários estudos de imagem, a ACD (por lesão ganglionar) foi de 85,8% (SEN: 96,8%; ESP: 80,9%; VPP: 69,8%; VPN: 98,2%). Estes nossos resultados estão de acordo com os de outros trabalhos publicados33,34. Por exemplo, Poulsen et al. levaram a cabo um estudo prospetivo onde avaliaram a PET/CT com FCH‐F18 na identificação de metástases ganglionares no estadiamento do CaP e obtiveram valores de SEN, ESP, VPP e VPN de 100, 95, 75 e 100%, respetivamente35.
No nosso estudo, a PET/CT com FCH‐F18 detetou, ainda, metastização óssea em 15,8% doentes (3/19), identificada, também, por outros exames imagiológicos complementares e pelo seguimento. Outros trabalhos apresentam, para a PET/CT com FCH‐F18, valores elevados de SEN, ESP, VPP e VPN para a identificação de metástases ósseas24,36. Por exemplo, McCarthy et al. obtiveram, num estudo prospetivo, em que compararam a PET/CT com FCH‐F18 com a imagiologia standard para a pesquisa de metástases ósseas, valores de 96%, 96%, 99% e 81%, respetivamente37.
Quando agrupados segundo o risco de doença sistémica, registou‐se um SUVmax superior na próstata (SUVmax: 8,8±3,8 vs. 4,2±1,4) e uma percentagem de metastização ganglionar mais elevada (41,7 vs. 16,7%) nos doentes de alto risco relativamente aos doentes de risco intermédio. A percentagem de metastização óssea foi mais alta nos doentes de risco intermédio relativamente aos de alto risco (33,3 vs. 8,3%), mas este resultado está comprometido pelo reduzido número de doentes da amostra que apresentaram metastização óssea (apenas 3).
A PET/CT com FCH‐F18 contribuiu para o estadiamento, com impacto na definição da estratégia terapêutica, ao identificar doença loco‐regional em 73,7% dos doentes (14/19) e doença à distância, com metástases ganglionares extrapélvicas e/ou ósseas, em 26,3% dos doentes (5/19).
As principais limitações deste trabalho prendem‐se com a sua natureza retrospetiva, o número reduzido de doentes e a não confirmação histológica de todas as lesões, ganglionares e ósseas, identificadas na PET/CT com FCH‐F18.
Outros radiofármacos PET têm sido desenvolvidos no contexto do CaP. Um destes biomarcadores que tem revelado resultados promissores é o Prostate Specific Membrane Antigen (PSMA) marcado com Ga68. Este parece combinar uma elevada SEN, mesmo em doentes com valores reduzidos do PSA, a uma elevada ESP. Adicionalmente, a introdução de moléculas PSMA marcadas com emissores beta, como o Lu177, abre a possibilidade a uma abordagem diagnóstica/terapêutica molecular dirigida (theragnostics), que pode vir a revolucionar o tratamento do CaP metastizado38.
Os últimos desenvolvimentos em imagiologia híbrida, com a introdução na prática clínica da PET/RM, parecem, também, muito promissores. Esta técnica imagiológica foi já avaliada em alguns estudos clínicos, onde se provou ser útil neste contexto clínico e aplicável por rotina. Combina a elevada capacidade de deteção de detalhes anatómicos e a informação funcional multiparamétrica da RM com a informação molecular da PET. A PET/RM com FCH‐F18 apresenta um valor diagnóstico superior ao das 2 técnicas individualmente ou mesmo quando somadas39. Embora sejam necessários mais estudos que a validem, esta modalidade promete ser superior às atuamente disponíveis40.
ConclusõesNa nossa experiência, apesar de limitada a um pequeno número de casos, a PET/CT com FCH‐F18 apresentou valores elevados de SEN, ESP, VPP e VPN, e de ACD, no estadiamento do CaP. Realça‐se a capacidade de detetar, num único exame, doença à distância, ganglionar e principalmente óssea, em doentes com valores de PSA relativamente baixos (<20ng/mL). As informações obtidas pela PET/CT com FCH‐F18 influenciaram o estadiamento de um número significativo de doentes com CaP e tiveram impacto na estratégia terapêutica adotada. Os resultados obtidos estão de acordo com os publicados por outros autores.
Este estudo pretende ser mais um contributo para uma reflexão sobre a melhor abordagem a adotar no estadiamento inicial do CaP.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram que não aparecem dados de pacientes neste artigo.
Direito à privacidade e consentimento escritoOs autores declaram que não aparecem dados de pacientes neste artigo.
Conflito de interessesOs autores declaram não haver conflito de interesses.