CONCEPTO
Siguiendo la clasificación propuesta por la EAACI (1), la alergia al huevo es una reacción adversa, de mecanismo patogénico inmunológico, como consecuencia de la ingestión de huevo.
Aunque son posibles otros mecanismos, en la alergia al huevo el único mecanismo patogénico bien conocido en la actualidad es el de hipersensibilidad inmediata, tipo I, mediado por IgE.
El consumo de huevos de aves (en nuestro medio, de gallina), constituye una fuente importante de proteínas y está integrado como uno de los alimentos básicos en la dieta humana desde el primer año de vida.
Su alto contenido proteico, su introducción en el primer año de vida y su amplio consumo, hacen que el huevo sea el alimento que, en nuestro país, con más frecuencia produce alergia en el niño pequeño (2).
DATOS EPIDEMIOLOGICOS
El huevo es la causa mas frecuente de alergia alimentaria en niños (2-4).
Suele aparecer antes de los 2 años de vida y desaparece en los primeros 6 años en un 55 % de los casos (5).
No se han publicado estudios sobre la incidencia de la alergia al huevo y los datos sobre la prevalencia son muy dispares, en relación con los diferentes tipos de población estudiada.
En Europa se han realizado estudios de prevalencia de alergia al huevo con resultados muy variables que van desde el 8 % en un estudio de Kjellman (6) al 58 % entre niños alérgicos a la leche de vaca (7). No se han publicado estudios de prevalencia de alergia al huevo en la población general.
En España en un estudio observacional (8), con 4.000 pacientes que acudían a la consulta del alergólogo, la alergia a huevo fue la causa del 16 % de los casos de alergia alimentaria en la población general, siendo el cuarto alimento implicado por orden de frecuencia. En el subgrupo de niños menores de 5 años, esta frecuencia fue del 44 % y representaba la sensibilización principal junto con la leche. La leche y el huevo fueron los alergenos que con mayor frecuencia se encontraron implicados en los pacientes con dermatitis atópica y síntomas digestivos. En los menores de 15 años, la frecuencia de alergia al huevo fue del 20 % y junto con la alergia a la leche y los frutos secos ocupa el primer puesto de las alergias alimentarias en este grupo de edad. La mayoría de las sensibilizaciones a las proteínas de huevo (76 %) se producen antes de los 5 años, un 12 % entre los 5 y 10 años y otro 12 % entre los 10 y 15 años. El 37 % de los alérgicos al huevo presentaban patología respiratoria asociada por inhalantes.
En un grupo de 355 niños diagnosticados de alergia alimentaria en nuestro país (2) la prevalencia de alergia a las proteínas del huevo fue del 20,1 %, similar a la observada en el citado estudio (8). El 56,5 % de los pacientes iniciaron la sintomatología entre los 6 y 12 meses de vida y el 97 % de casos en los primeros 2 años. Sólo un 16 % de los niños con alergia al huevo tenían alergia además a otros alimentos (3 o más).
FACTORES CONDICIONANTES Y FAVORECEDORES DE LA SENSIBILIZACION
El desarrollo de alergia alimentaria depende de la interacción entre la predisposición genética y los factores ambientales, especialmente de la exposición a proteínas alimentarias.
Predisposición genética
Es conocida la importancia de la predisposición genética para el desarrollo de enfermedades alérgicas. El 60-70 % de los atópicos tiene una historia familiar positiva. El riesgo de padecer en el futuro una enfermedad atópica se incrementa no sólo con el antecedente familiar, sino que depende también del número de familiares afectados, siendo mayor si lo son ambos progenitores (9).
La presencia de IgE específica a huevo constituye el marcador más precoz de atopia (10).
Naturaleza del antígeno
En general, los niños alérgicos al huevo reaccionan principalmente a la ingesta de la clara. Aunque la yema de huevo tiene diversas proteínas, la clara contiene los alergenos mayores. Se han aislado hasta 24 fracciones antigénicas distintas aunque se desconoce la capacidad antigénica de la mayoría. Los alergenos principales son: ovoalbúmina, ovomucoide, ovotransferrina y lisozima. Estas proteínas han podido ser secuenciadas.
La ovoalbúmina (Gal d 2) representa más del 50 % de las proteínas de la clara, esta proteína de 45 kDa contiene 385 aminoácidos.
El ovomucoide (Gal d 1), es una glucoproteína termoestable que constituye el 10 % de las proteínas de la clara, su peso molecular es de 28 kDa, contiene 186 aminoácidos y es el alergeno más potente (11). El uso de extractos comerciales de ovoalbúmina contaminados con ovomucoide ha llevado a sobrestimar la ovoalbúmina como alergeno principal de la clara de huevo (12).
La ovotransferrina (Gal d 3) representa el 12 % del total proteico de la clara, tiene un peso molecular de 77 kDa y esta formada por 686 aminoácidos.
La lisozima (Gal d 4) es una proteína pequeña de 14,3 kDa y 129 aminoácidos. La frecuencia de sensibilización a lisozima en alérgicos al huevo es del 32 %. Se usa como aditivo en numerosos alimentos y fármacos por sus propiedades bactericidas (13).
Además de éstas se han identificado otras proteínas, algunas con carácter antigénico: ovomucina, ovoflavoproteína, avidina, ovoinhibidor, etc. Las proteínas de la yema también pueden ser alergénicas (apoviteleninas, fosvitinas, livetinas).
En el síndrome ave-huevo, que presentan un grupo de pacientes sensibilizados al huevo a través de proteínas de origen aviar (plumas, excrementos y suero de aves), predomina la sensibilización a la yema. El alergeno responsable de esta reactividad cruzada es una alfa-livetina (14). Este patrón de sensibilización es poco frecuente en niños (15) Los pacientes afectos del síndrome ave-huevo tienen mayor frecuencia de síntomas digestivos y respiratorios tras la ingesta de huevo que los afectos de alergia a proteínas de huevo aisladas (12).
Existe reacción cruzada entre proteínas de la clara y de la yema, y entre huevos de diversas aves (gallina, pavo, pato, gaviota) (16).
Con frecuencia, en los pacientes alérgicos a la clara, las pruebas cutáneas muestran sensibilización a la carne de pollo, aunque su ingestión sea bien tolerada. La relevancia clínica de la reacción cruzada entre huevo y carne de pollo es menor del 5 %.
Se ha identificado un epítopo de célula T específico para la ovoalbúmina en pacientes alérgicos al huevo (17). La activación de esta célula conduce a la producción de citocinas de clase II. La identificación del epítopo permite augurar tratamientos con péptidos bloqueantes en un futuro.
Transmisión de antígenos a través de la leche materna
Igual que ocurre con la leche, la sensibilización a la clara del huevo se produce precozmente, incluso en niños que reciben sólo lactancia materna. Es probable que la sensibilización tenga lugar por el paso de pequeñas dosis de antígeno a través de la leche materna. Los lactantes sensibilizados al huevo por esta vía pueden reaccionar tras su primera introducción en la dieta (18).
ASPECTOS CLINICOS
La hipersensibilidad al huevo puede presentarse con todos los tipos de manifestaciones clínicas de la reacción mediada por IgE (19):
1.Reacciones cutáneas:
Eritema.
Urticaria.
Angioedema.
2.Reacciones generalizadas:
Anafilaxia.
3.Reacciones gastrointestinales:
Dolor abdominal.
Náuseas.
Vómitos.
Diarrea.
4.Reacciones respiratorias:
Rinoconjuntivitis.
Edema laríngeo.
Asma.
Es conocido que existen factores moduladores de la respuesta clínica en la alergia inmediata a alimentos (18), unos son dependientes del alergeno, como la cantidad ingerida, y otros dependientes del individuo, como es la tasa de IgE específica, la capacidad de liberación de mediadores o la sensibilidad de los órganos de choque a los mediadores liberados. De ahí que la clínica de alergia al huevo pueda presentarse con una sintomatología variable.
En la mayoría de los casos la clínica se inicia tras la primera toma de clara de huevo, siendo frecuente que hayan tolerado previamente la yema cocida. Los síntomas suelen aparecer a los pocos minutos de la ingesta, casi siempre antes de transcurrida 1 h.
Cuadros clínicos
Los cuadros dermatológicos agudos y los cuadros gastrointestinales forman la gran mayoría de las reacciones clínicas patológicas tras la ingesta de huevo (4).
Las manifestaciones dermatológicas agudas consisten en eritema, urticaria y angioedema en clara relación con la ingesta de huevo. El inicio de los síntomas puede ser muy rápido, pocos minutos después de la ingesta. Caffarelli et al (18) observaron que el 93 % de las pruebas de provocación positivas a huevo lo fueron de forma inmediata, a pesar de que el niño no hubiese ingerido huevo previamente. Este inicio fue en los primeros 20 min después de la ingesta de huevo y en el 53 % de los niños, aparecieron síntomas cutáneos, en este orden de frecuencia: prurito, eritema, urticaria y angioedema. El huevo, como otros alimentos, no suele estar implicado en la urticaria crónica (20).
Se ha encontrado que un 40 % de los pacientes con dermatitis atópica está sensibilizado a algún alimento (21). Lever et al (22) han demostrado una disminución significativa tanto en el área de piel afectada como en la puntuación de síntomas en los niños que hacían dieta exenta de huevo, en comparación con los controles que no hicieron dieta.
También se han referido pacientes con síndrome de alergia oral causado por hipersensibilidad a huevo (23, 24).
Las manifestaciones gastrointestinales agudas se desarrollan habitualmente entre pocos minutos y 2 h de la ingesta del alimento. Consisten en náuseas, dolor abdominal, vómitos y/o diarrea (4). Dependiendo del mecanismo inmunológico implicado, los síntomas de la hipersensibilidad gastrointestinal, aun siendo muy similares, varían en el tiempo de inicio, la gravedad y la persistencia.
Los síntomas respiratorios aislados son raros, casi siempre ocurren acompañando a síntomas cutáneos o digestivos. En individuos muy susceptibles se han notificado reacciones asmáticas por inhalación de vapor u olor del huevo durante la cocción. Los síntomas respiratorios tras la ingesta de huevo son más frecuentes en pacientes con sensibilización a proteínas aviarias (síndrome ave-huevo) (15, 25).
La alergia alimentaria es la causa más frecuente de las reacciones generalizadas de anafilaxia vistas en los departamentos de urgencias hospitalarias, representando una tercera parte de los casos (26, 27), aunque no hay datos específicos en relación con la hipersensibilidad al huevo. Se han publicado casos de anafilaxia tras la ingesta de pequeñas cantidades de huevo crudo, en pacientes que con anterioridad habían tolerado el huevo cocido (28). En las reacciones generalizadas de anafilaxia, además de los síntomas cutáneos, respiratorios y gastrointestinales, se asocian síntomas cardiovasculares, como hipotensión, colapso vascular y disritmias cardíacas. Los factores que se asocian a reacciones graves incluyen asma concomitante, historia de reacciones previas graves y demora en iniciar la terapéutica correcta. Hasta la actualidad no conocemos ningún caso de anafilaxia inducida por ejercicio tras la ingesta de huevo.
Algunos pacientes que toleran la ingesta de huevo, el contacto con el mismo les causa urticaria. Recientemente se ha observado que estos pacientes tienen IgE que reconoce epítopos de la clara, que son inestables a la acción de las enzimas digestivas (29).
DIAGNOSTICO
La historia clínica orienta acerca de la sospecha de reacción con huevo y de su posible mecanismo. En las reacciones mediadas por IgE, las pruebas cutáneas (prick-test) y la determinación de IgE sérica (por diversos métodos: RAST, CAP, fluorimétricos, etc.), demuestran la presencia de anticuerpos IgE específicos, pero es la prueba de provocación la que confirma la reactividad clínica actual.
Historia clínica y exploración física
Para el diagnóstico clínico es esencial elaborar una anamnesis detallada que debe recoger la edad de la primera reacción con huevo, tiempo que llevaba tomándolo, la cantidad y preparación culinaria que ha motivado la reacción, la sintomatología presentada, el tiempo de latencia entre la ingesta del alimento y la aparición de los síntomas, la repetición de la reacción, el tratamiento requerido y el tiempo de su resolución así como la fecha de la última reacción. Se recogerán los antecedentes familiares y personales de atopia con especial interés en la presencia o no de dermatitis atópica.
La anamnesis debe completarse con una exploración física minuciosa en la que se prestará especial atención a la presencia de lesiones cutáneas de eccema o sequedad.
Pruebas cutáneas
La técnica de puntura (prick-test) es la prueba de elección para demostrar la sensibilización a alimentos. En general es altamente reproducible y si se utilizan extractos de calidad es un excelente medio para confirmar la alergia mediada por IgE. El prick debe realizarse con la técnica apropiada (30) considerándose positiva la pápula $ 3 mm sobre el control negativo. Siempre se usarán los correspondientes controles de positividad (histamina a 10 mg/ml) y de negatividad (solución glicerosalina).
Los extractos comerciales disponibles suelen ser glicerinados y no están debidamente estandarizados. Algunos están etiquetados en unidades P/V, y otros en mg/ml. Las concentraciones utilizadas también son diferentes. En algunos estudios se han utilizado extractos de huevo entero a concentraciones de 1/10 o 1/20 P/V (31, 32), en otros, extractos comerciales de clara y yema de huevo a concentración de 10 mg/ml (33). Otros autores han utilizado proteínas purificadas de huevo como la ovoalbúmina, ovomucoide, ovotransferrina, lisozima, aunque se comprueba que la purificación no es total y todas ellas pueden tener contaminación de las otras proteínas (12). En un trabajo (34) además de extractos de clara a10 mg/ml y de yema 1/20 P/V se han utilizado en el prick las proteínas purificadas ovoalbúmina y ovomucoide a concentración de 10mg/ml obteniéndose la mayor rentabilidad diagnóstica con la clara de huevo seguida de la ovoalbúmina. La yema del huevo, se considera en general menos alergénica que la clara pero contiene las livetinas, habiéndose identificado a la alfa-livetina con la seroalbúmina del pollo (35); en los niños es poco frecuente que la yema de lugar a sensibilización (25, 36).
Analizando la validez diagnóstica del prick en alergia a huevo, frente a la provocación, en casi todos los trabajos se encuentra que aquél tiene una alta sensibilidad: 73-100 % (18, 32-34, 37) y un alto valor predictivo negativo: 86-91 % (18, 33-38). Su especificidad suele ser mas baja: 53-71 % (18, 32, 33); así como su valor predictivo positivo (VPP): 61 % (18, 39). En estudios con alta prevalencia se han encontrado valores predictivos positivos altos: 85-92 % (33, 34). En alergia a huevo como en general en el diagnóstico de alergia a alimentos, la negatividad de las pruebas cutáneas excluye reactividad clínica en la mayoría de los casos por su alto valor predictivo negativo. Si se utilizan extractos de calidad y a la concentración adecuada, el prick es también un buen predictor de alergia a huevo.
Las pruebas cutáneas intradérmicas no suelen usarse por ser menos específicas.
Aunque se tiene la idea de que la piel de los niños por debajo de 2 años no reacciona bien (40) cuando se utilizan extractos adecuados y con la debida concentración, la reactividad es buena (34).
Pruebas in vitro
La demostración de anticuerpos IgE específicos en suero, mediante técnica de RAST o CAP, es otro modo de demostrar la presencia de sensibilización. En general la mayoría de los estudios que comparan el RAST con el prick coinciden en la menor sensibilidad y mayor especificidad del RAST (37). En un estudio en el que se comparaba el prick y el RAST frente a la prueba de provocación se vio que el RAST tenía menor sensibilidad que el prick, pero cuando se consideró un valor del RAST de clase 3 o superior, se encontraron sensibilidades semejantes (39). El CAP tiene mayor sensibilidad que el RAST (41) y se considera muy útil para correlacionar presencia de reactividad clínica con niveles más elevados de sensibilización (33, 42). La medida de los niveles de IgE específica mediante CAP permite identificar a una serie de pacientes que tienen una alta probabilidad de experimentar una provocación positiva evitándonos su realización. Se ha encontrado en sensibilizados a huevo y con dermatitis atópica (33) que con valores de CAP a clara iguales o mayores a 6 KU/l la probabilidad de que la prueba de provocación fuera positiva era mayor del 95 % y mayor del 90 % con un CAP a clara mayor o igual a 2 KU/l. Con valores por debajo de 0,6 KU/l la probabilidad de tolerancia era mayor del 90 %. En otro estudio de niños alérgicos a huevo menores de 2 años (34), para un CAP a clara de huevo mayor o igual a 0,35 KU/l el VPP fue del 94 %. El punto de corte mas bajo encontrado en este estudio podría estar en relación con la edad de los pacientes, media de 16 meses frente a 5,2 años del estudio anterior en el que, además, todos los niños tenían dermatitis atópica lo que podría explicar que hubiesen niveles más altos de IgE.
El test de liberación de histamina por los basófilos no se utiliza en la práctica habitual reservándose su uso para fines de investigación. La triptasa, mediador liberado por los mastocitos, aumenta en suero tras la provocación oral, presentando una gran especificidad pero baja sensibilidad, de ahí que no sea una técnica de uso en la práctica clínica habitual.
Prueba de provocación
La prueba de provocación oral controlada es el método para confirmar la relación entre la ingestión del alimento y su reactividad clínica. Sólo en aproximadamente el 50 % de los casos de sospecha de alergia a alimentos, se confirma el diagnóstico al realizar la prueba de provocación doble ciego (18, 37-39).
Como en cualquier provocación deben cumplirse unos requisitos, como son el de no estar tomando medicación que inhiba las pruebas cutáneas y encontrarse asintomático. Siempre se llevará a cabo disponiendo de material de resucitación y por personal experimentado en tratar este tipo de reacciones (43).
La provocación oral puede ser: abierta, en la que tanto el paciente como el médico encargado de controlarla conocen el alimento administrado, simple ciego, en la que el paciente únicamente es el que desconoce el alimento administrado y doble ciego en la que tanto el paciente como el médico no conocen el alimento administrado. La provocación doble ciego controlada con placebo (44) ha sido considerada el patrón de referencia para el diagnóstico de reacción adversa a alimentos (45). Es requerida en situaciones de investigación, cuando se trate de ver la repercusión del alimento en cuadros crónicos como dermatitis atópica o asma bronquial y en caso de estar implicados múltiples alimentos. También en cuadros donde puede haber gran componente subjetivo. En las provocaciones ciegas el alimento se administra liofilizado en cápsulas o según la edad del niño enmascarado en zumos, batidos o fórmulas infantiles (31). En el caso de provocación controlada con placebo pueden realizarse dos provocaciones diarias una activa y otra con placebo (46) o también pueden intercalarse el placebo y el alimento en distintos días.
En niños menores de 2 años puede realizarse la provocación abierta por el tipo de manifestaciones fácilmente objetivables y por el escaso componente subjetivo dada la edad de los pacientes. Se realizará estando el paciente en ayunas y de una manera gradual, comenzando por una cantidad de alimento inferior a la que produjo síntomas y doblándola progresivamente hasta que se alcance una cantidad equivalente a media clara de huevo como dosis única o cuando aparezcan síntomas (34). En las reacciones inmediatas el intervalo de administración del alimento puede ser de 15 a 90 min (46). Pero si la reacción referida es más tardía, se prolongará el intervalo. Debe observarse al paciente durante 2 h tras la provocación, en caso de hayan tenido lugar reacciones inmediatas. La provocación se considerará positiva cuando aparezcan síntomas objetivos (cutáneos, gastrointestinales o respiratorios) en un período de 2 h. No se valorarán los síntomas subjetivos como dolor abdominal, náuseas o prurito. En ese caso debe pasarse a la realización de la provocación doble ciego.
Mediante prueba de provocación se ha visto que el huevo cocido es menos alergénico que el crudo (11). En algunos estudios se ha utilizado huevo entero en la provocación (32). En otros se ha llevado a cabo la provocación abierta comenzando por clara cocida y si resultaba negativa se pasaba a la clara cruda (34). En función de la sintomatología inicial presentada puede modificarse la cantidad e intervalo de administración del huevo.
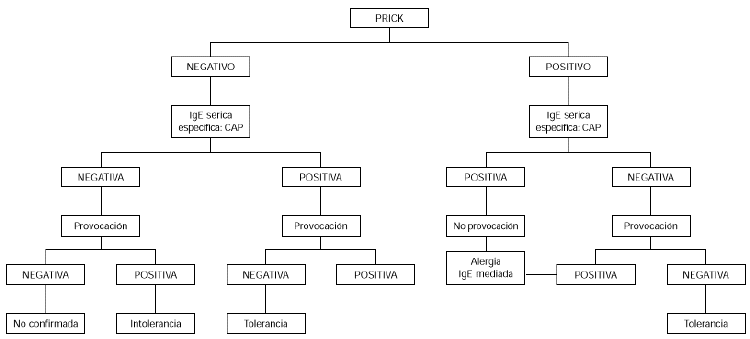
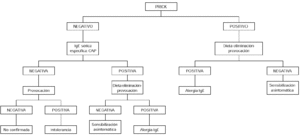
Contraindicaciones de la provocación son los cuadros graves de anafilaxia y/o edema de glotis. La provocación no sería necesaria en niños menores de 2 años con síntomas inmediatos, cutáneos, digestivos y/o respiratorios, que hubieran ocurrido en las 2 primeras horas después de haber ingerido huevo, en los que además las pruebas cutáneas con clara de huevo sean positivas, así como el CAP para clara de huevo mayor o igual a 0,35 KU/l, aunque sí estaría indicada si el prick y el CAP fueran los dos negativos o discordantes (34) (fig. 1).
Figura 1.--Algoritmo diagnóstico de alergia a huevo: síntomas inmediatos.
Dieta de eliminación-provocación
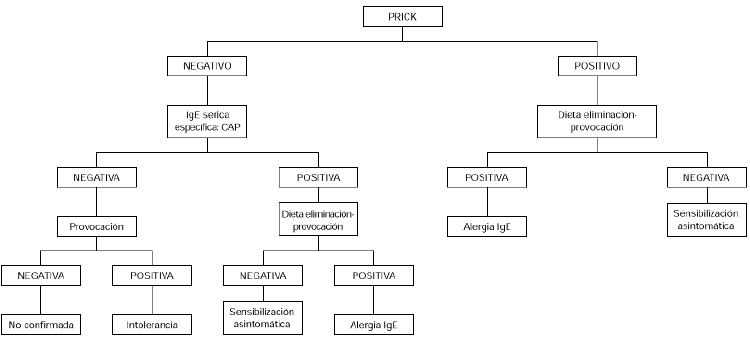
Debe realizarse en pacientes con síntomas crónicos como dermatitis atópica, gastrointestinales tardíos o asma, tratando de ver el papel que puede jugar la sensibilización a huevo en el determinismo del cuadro. Se empezará por eliminar el huevo de la dieta, durante 2 semanas. Si no hay mejoría en este tiempo, es poco probable que el huevo sea el causante de la sintomatología. En el caso de que se observe mejoría, seguidamente se realizará una provocación abierta. Si es negativa se excluye el diagnóstico de alergia al huevo. Si es positiva debería confirmarse con una provocación a doble ciego (fig. 2).
Figura 2.--Algoritmo diagnóstico de alergia a huevo: dermatitis atópica y/o síntomas gastrointestinales tardíos.
SEGUIMIENTO, EVOLUCION Y PRONOSTICO
En la evolución natural de la alergia alimentaria, al período de sensibilización clínica le sigue otro de sensibilización asintomática, hasta alcanzar la tolerancia total con la desaparición de anticuerpos IgE específicos (47). El período de sensibilización clínica depende entre otros factores, del alimento implicado.
No todos los alérgicos al huevo alcanzan la tolerancia con el tiempo. En algunos casos la sensibilización tiende a persistir durante años y cuanto más tiempo se mantiene el período sintomático, menor es la probabilidad de que en el futuro lleguen a tolerarlo (48, 49).
Los estudios publicados acerca de la evolución natural de la alergia al huevo indican que sólo el 24 % de los pacientes perdieron la reactividad clínica después de 1-2 años de dieta de exclusión (49), entre 32 y 44 % a los 3 años (49-51) y tras un período de seguimiento medio de 4 años alcanzaron la tolerancia (con una edad media de 6 años) el 55 %, siendo un índice de mal pronóstico la persistencia de la reactividad clínica a los 9 años de edad (48).
En el lactante se ha demostrado la posibilidad de sensibilización al huevo antes de su introducción en la dieta (52) lo que puede haber ocurrido intraútero o más probablemente tras el nacimiento, por la exposición a las proteínas del huevo que pasan a la leche de la madre. Los lactantes sensibilizados al huevo por esta vía pueden reaccionar tras su primera introducción en la dieta (53). En una serie de 21 niños de 5 meses a 3 años con pruebas cutáneas y/o IgE sérica específica positivas a las proteínas del huevo (todos alimentados inicialmente con lactancia materna exclusiva), en 13 (61 %) fueron positivas las pruebas de provocación doble ciego frente a placebo, efectuadas con huevo (18), siendo con esta prueba de provocación, la primera vez que ingerían huevo. Además, el pronóstico de estos niños parece ser peor, como indica un estudio publicado sobre su evolución a largo plazo, en el que sólo el 24 % habían desarrollado tolerancia a la edad de 14 años (54).
Incluso en los casos en que haya habido una reacción anafiláctica puede esperarse que con la edad se reduzca progresivamente la gravedad y el alimento pueda ser finalmente tolerado (55). En la actualidad no existe ningún parámetro clínico ni serológico suficientemente sensible y específico que permita conocer el momento en que se instaura la tolerancia, aunque hay datos que pueden orientar en este sentido:
1. La reacción clínica multisistémica con angioedema y síntomas respiratorios es índice de mal pronóstico para alcanzar la tolerancia (50).
2. Las pruebas cutáneas pueden persistir positivas en el 50 % de los niños tolerantes (48), pero su negatividad es un buen indicador de tolerancia (50).
3. Es posible que al inicio del estudio, los valores séricos de IgE específica, sobre todo frente a ovomucoide, tengan un valor pronóstico puesto que los pacientes que se vuelven tolerantes, al principio del proceso presentan niveles séricos de IgE significativamente más bajos que los niños con sensibilización clínica persistente (12, 33, 51).
4. A lo largo de la evolución, si la IgE específica es superior a RAST-clase 2, casi con toda seguridad la prueba de provocación será positiva (48). Sampson et al, en los pacientes alérgicos al huevo con clínica de dermatitis atópica, recomiendan esperar a una caída de los valores séricos de IgE específica a valores de 2 KU/l para realizar la reprovocación (33). En los pacientes sin dermatitis atópica los valores de IgE específica superiores a 1,20 KU/l indican una alta probabilidad de resultado positivo en la prueba de provocación (56).
Sobre la base de los datos actuales recomendamos repetir cada año las pruebas cutáneas e IgE específica frente a las proteínas del huevo, así como realizar una prueba de provocación para comprobar la adquisición de tolerancia en los casos en que se hayan negativizado las pruebas cutáneas o que la IgE específica sea menor de 2 KU/l, en pacientes con clínica de dermatitis atópica, o menor de 1,20 KU/l en pacientes sin dermatitis atópica.
Los cuadros graves de anafilaxia, aunque no son una contraindicación absoluta, obligan a reevaluar con más precaución el intervalo desde el primer episodio, valorando las pruebas cutáneas y las variaciones de los valores de IgE específica.
El desarrollo de IgE específica frente al huevo durante el primer año de vida es un índice predictivo de riesgo de enfermedad atópica, sugiriendo diversos estudios que la reactividad inmunológica al huevo puede ser en la actualidad el principal y más precoz marcador serológico de riesgo de una posterior sensibilización a alergenos inhalantes y del desarrollo de enfermedad alérgica respiratoria (10, 57, 58). A esta edad, la combinación de una historia familiar positiva (antecedentes de enfermedad atópica en al menos un familiar de primer grado) e IgE específica a clara de huevo mayor de 2 KU/l, es un marcador de futura sensibilización a alergenos inhalantes con una alta especificidad (99 %) y valor predictivo positivo (78 %) (59). Si la sensibilización es persistente (más de 1 año) existe un riesgo elevado de desarrollo de asma (67 %) y rinitis (50 %) a los 5 años de edad (60).
TRATAMIENTO
Tratamiento etiológico: dieta estricta de eliminación
Una vez establecido el diagnóstico de hipersensibilidad a las proteínas de huevo, el tratamiento a adoptar es la instauración de una dieta estricta de eliminación del mismo (61, 62) Las dietas de eliminación deben ser correctamente supervisadas, para evitar los derivados del huevo y posibles contaminaciones con estas proteínas. Debe prestarse atención a ciertas proteínas que se utilizan como aditivos en los alimentos, y que pueden desencadenar síntomas al pasar inadvertidos. La lisozima del huevo se utiliza en algunos fármacos y en numerosos alimentos como agente bactericida, para prevenir el desarrollo de bacterias anaerobias del tipo del Clostridium tyrobutyricum (13).
No suele existir reactividad clínica cruzada entre el huevo y la carne de pollo (63), por lo que no es necesario evitar esta fuente proteica en la mayoría de los casos. En los alérgicos a plumas habrá que comprobar la tolerancia al huevo y, recíprocamente, los alérgicos al huevo tendrán que tener precaución con la exposición a los Ag aviarios (15, 25, 64, 65).
Alimentos que contienen huevo
Los principales alimentos que contienen huevo figuran en el listado de la tabla I. Es necesario leer detenidamente los etiquetados de los productos.
La lisozima y otras proteínas de huevo pueden estar presentes también en algunos fármacos (fundamentalmente supositorios, gotas nasales, algunos preparados anestésicos, etc.), por lo que siempre hay que asegurarse de los excipientes y otros componentes incluidos en estos preparados.
Tratamiento farmacológico sintomático
Si se produjera una ingestión accidental de huevo, causando una reacción anafiláctica, estará indicada la administración de adrenalina por vía parenteral, precisando con frecuencia dosis repetidas. La vía de administración recomendada es la intramuscular por ser de absorción más rápida (66). Se debe completar el tratamiento con la administración de antihistamínicos y corticosteroides. Cuando estén afectadas las vías aéreas altas (angioedema laríngeo u orofaríngeo) puede añadirse la adrenalina por vía inhalatoria. Si se presenta sintomatología asmática o tos espasmódica se administrarán beta-adrenérgicos inhalados. Tras un cuadro de anafilaxia aguda el niño debe quedarse en observación durante 24 h (61).
Los niños con historia de reacciones anafilácticas deberían disponer de adrenalina autoinyectable en su domicilio y en el colegio (67).
En las manifestaciones cutáneas (urticaria y/o angioedema) puede ser suficiente la administración de antihistamínicos por vía oral.
Tratamiento farmacológico preventivo
También se han utilizado fármacos como preventivos (cromoglicato disódico, ketotifeno, cetirizina...), pero con resultados desiguales y con ninguno de ellos se consiguió mejorar los que se obtienen con la supresión de la ingesta de huevo (61, 68, 69).
Inmunoterapia
Se ha intentado de forma experimental con otros alimentos (70-73), pero los resultados no han sido muy alentadores. No existe experiencia de inmunoterapia con huevo de forma parenteral, y tan sólo hemos encontrado un trabajo de hiposensibilización oral obteniendo resultados satisfactorios (74).
Vacunas que pueden contener proteínas de huevo: ¿qué hacer?
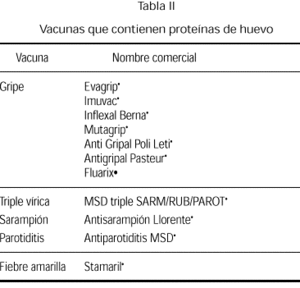
Desde siempre ha existido gran controversia con el tema de las vacunas ante la posibilidad de que puedan contener pequeñas cantidades de proteínas de huevo debido a su forma de elaboración. Las vacunas actuales que potencialmente pueden llevar derivados de huevo son las de la rubéola, sarampión, parotiditis, triple vírica (sarampión, rubéola y parotiditis), gripe y fiebre amarilla (tabla II). Anteriormente también la antitífica y antirrábica (75). Las reacciones anafilácticas a los componentes de las vacunas son raras. Incluso a veces es difícil diferenciar entre una reacción por antígenos vacunales, por alguno de los componentes de la vacuna (neomicina, sorbitol y, fundamentalmente, la gelatina) o una reacción concomitante (76-83).
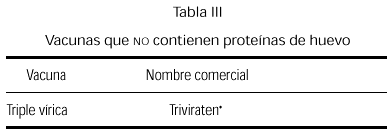
Vacuna triple vírica
La vacuna triple vírica (sarampión, rubéola, parotiditis) que se obtiene mediante cultivo en tejido de fibroblastos de embrión de pollo, no contiene cantidades significativas de proteínas de huevo (84, 85). Los niños con alergia al huevo, incluso los altamente sensibilizados, tienen un riesgo muy bajo de presentar reacciones anafilácticas con estas vacunas (86-89), aunque también se han descrito (90, 91). Las pruebas cutáneas con preparaciones diluidas de la vacuna no parecen ser predictivas de una posible reacción alérgica tras su administración (85, 92-94). El Comité de Enfermedades Infecciosas de la Academia Americana de Pediatría, en 1997, propone la administración rutinaria de la vacuna sin pruebas cutáneas previas (95), recomendando que a estos pacientes se les observe por un período de 90 min tras la vacunación y con un equipo adecuado para el tratamiento de la anafilaxia (84).
En un trabajo realizado en 140 niños con hipersensibilidad a huevo (85), el 97,5 % de los mismos toleró la vacuna triple vírica (con un 95 % de confianza) sin ninguna reacción importante, y las pruebas cutáneas no ayudaron a predecir las reacciones adversas. En otra serie de 410 niños con igual hipersensibilidad al huevo, ninguno presentó reacciones adversas importantes que precisaran medicación (92). En otro estudio con 26 niños, que tenían el antecedente de reacción anafiláctica previa tras ingesta de huevo, se comprobó que no tuvieron ninguna reacción adversa tras la vacunación (86).
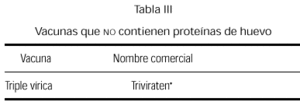
Se comercializa actualmente una vacuna triple vírica cultivada en células diploides humanas (tabla III), y aún siendo remota la posibilidad de reacción anafiláctica, pensamos que existiendo esta alternativa de vacuna preparada sin huevo, debe ser la opción a emplear en estos niños.
Vacuna de la gripe
La vacuna de la gripe (influenza) se prepara en embrión de pollo, objetivándose que tras el proceso comercial, estas vacunas contienen pequeñas cantidades (1 a 7 mg/ml) de proteína de huevo. El Comité de Enfermedades Infecciosas de la Academia Americana de Pediatría recientemente recomendaba (95) que los pacientes con reacciones anafilácticas o reacciones muy graves tras ingesta de huevo no deben recibir este tipo de vacuna, hasta no haber sido testados previamente mediante pruebas cutáneas con un preparado diluido de la vacuna. Si las pruebas realizadas son positivas, la vacuna no debe ser administrada. En aquellas situaciones clínicas en que sea necesaria y si las pruebas son negativas, la vacuna puede ser administrada bajo control médico. De todas formas, estos niños no deberían recibir generalmente la vacuna contra la gripe a causa del riesgo de reacción, y dada la probabilidad de que tengan que ser vacunados cada año.
Vacuna de la fiebre amarilla
La vacuna para la fiebre amarilla se prepara también en embrión de pollo. En todos los pacientes que vayan a vacunarse de la fiebre amarilla se debe realizar una anamnesis sobre la existencia de reacciones adversas con dosis previas de ésta u otras vacunas, y si son alérgicos al huevo.
Se recomienda que se lleven a cabo previamente las pruebas cutáneas con la vacuna de la fiebre amarilla sólo en aquellos pacientes con historia de síntomas anafilácticos sistémicos tras la ingesta de huevo (84, 96, 97). Si es necesaria la inmunización, se administran en múltiples dosis graduales de la vacuna, de forma cuidadosa en un centro médico y por personal experimentado en el tratamiento de la anafilaxia (84, 92, 95).
PREVENCION
Las medidas preventivas pueden ir dirigidas a evitar la sensibilización y desarrollo de la enfermedad alérgica o a evitar las manifestaciones de la enfermedad, una vez que el individuo se ha sensibilizado.
Las medidas preventivas para evitar la sensibilización antes del nacimiento con dietas restrictivas en las madres gestantes no son recomendables ni parecen ofrecer ninguna garantía (67, 98). Más aún, si no fueran perfectamente controladas por un especialista en nutrición, pueden ser peligrosas por el riesgo de una posible desnutrición del feto y de la madre.
No parecen estar justificadas las dietas restrictivas de huevo en madres que lactan a sus hijos, salvo en aquellos casos considerados de alto riesgo y con familias muy motivadas (67, 99-101).
En los niños de alto riesgo, la realización de una prueba cutánea al huevo previa a su introducción en la dieta, puede ser predictiva y prevenir una reacción adversa al huevo (18).
En todo caso, independientemente de la sensibilización alimentaria que pueda presentar el niño, conviene mantener una serie de medidas preventivas generales ambientales frente a posibles factores irritantes o sensibilizantes (102).