A leiomiomatose intravenosa é uma doença rara, associada a leiomiomas uterinos. Consiste na proliferação benigna de células de músculo liso no plexo venoso uterino. Pode progredir invadindo o sistema de drenagem venosa pélvico e abdominal até atingir as cavidades direitas do coração e as artérias pulmonares. Embora benigno, é um tumor fatal quando não diagnosticado e excisado em tempo oportuno. Neste artigo fazemos uma revisão do tema, chamando a atenção para esta doença, que é atualmente pouco conhecida. O diagnóstico precoce e o tratamento cirúrgico radi cal são a forma de melhorar o prognóstico destes doentes e evitar situações potencialmente fatais.
Intravenous leiomyomatosis is a rare condition associated to uterine leiomyomas. It consists on a benign proliferation of smooth muscle cells in to the uterine venous plexus. It can progress invading the venous drainage system of the pelvic and abdominal cavity reaching the inferior vena cava, the right heart cavities and the pulmonary arteries. Although benign this tumor can be lethal, when misdiagnosed and not treated in due time. Subsequently a detailed review of the topic, drawing attention to the disease, its clinical presentation, diagnostic strategy and different therapeutic approaches currently used. Early diagnosis and surgical treatment are the only way to improve prognosis of these patients and avoid potentially fatal situation.
A leiomiomatose intravenosa (LIV) foi descrita pela primeira vez em 1896 por Birch-Hirschfeld1,2. Em 1975, foi definida por Norris e Parmley3 como uma neoplasia uterina benigna rara, caracterizada pelo crescimento intravenoso de nódulos de músculo liso, histologicamente benignos, sob forma de projeções vermiformes. A idade média para o aparecimento da LIV é a quinta década de vida e, por ser uma extensão de leiomiomas uterinos, ocorre exclusivamente em mulheres. As doentes diagnosticadas com esta patologia são, frequentemente, seguidas em serviços de Ginecologia por leiomiomas uterinos e podem mesmo já ter sido histerectomizadas meses ou anos antes4–7. Em 2002, Tanaka et al.8 relataram o caso de uma doente com 72 anos à qual foi diagnosticada LIV, 30 anos após ter sido submetida a histerectomia.
O objetivo deste artigo é efetuar uma revisão sobre o conhecimento atual da etiopatogenia, clínica e tratamento desta entidade rara mas suscetível de provocar complicações graves e de implicação vital.
EtiopatogeniaA etiologia deste tumor continua a não estar completamente esclarecida e existem duas teorias principais. Uma propõe que a origem do tumor está nas células musculares lisas da parede venosa, onde se origina a proliferação intravenosa do tumor1,2,4,6,7,10–14. Outra sugere que a LIV aparece por invasão direta do sistema venoso pelo tumor que lhe está adjacente1,2,4,6,7,10–14. Recentemente, foram publicados alguns estudos que suportam esta segunda teoria ao invés da primeira14–17. Kir et al.18 efetuaram estudos imunohistoquímicos destes tumores e demonstraram que as células endoteliais são negativas ou fracamente positivas para recetores de estrogénio e progesterona ao contrário das células musculares lisas que são fortemente positivas para estes mesmos recetores14,15. Outro grupo relata não haver rutura do endotélio ao nível da entrada do tumor nos vasos e descreve a lesão como uma projeção que determina estiramento do endotélio do vaso fazendo deste o seu invólucro17. Por último, é sugerido que a LIV tem apenas um ponto fixo na zona de origem, ficando móvel e sem mais aderências aos vasos, o que também é a favor de uma origem leiomiomatosa ao invés de primariamente venosa16.
Grande parte dos casos de LIV só são diagnosticados quando já atingiram a veia cava inferior (VCI) ou mesmo as cavidades direitas do coração pois é nessa altura que começam a ser sintomáticos. Contudo, para ser estabelecido o diagnóstico de LIV apenas é necessário que exista invasão da drenagem venosa extra-uterina. De acordo com a localização do leiomioma e a respectiva drenagem venosa a leiomiomatose pode tomar dois caminhos19. Um invadindo as veias uterinas e chegando à VCI através das veias ilíacas interna e comum. O outro segue através das veias ováricas e progredindo directamente para a VCI ou passando pela veia renal à esquerda.
Apresentação clínicaA apresentação clínica varia muito de acordo com a extensão do tumor, podendo ir de totalmente assintomático até à ocorrência de morte súbita2,6,20. Numa fase inicial em que a invasão vascular ainda não atingiu os vasos de maior calibre a LIV pode ser assintomática. Contudo, a doente pode apresentar alguns sintomas como sensação de peso ou dor hipogástrica ou meno e metrorragias dependentes da presença e das características do leiomioma uterino1,2,10,11,13,21. Assim que a invasão vascular atinge os vasos de maior calibre, como as veias ilíacas comuns e a VCI, podem começar a aparecer os sintomas de obstrução venosa. É nesta altura que podem surgir edemas dos membros inferiores ou episódios de trombose venosa profunda. A progressão proximal do tumor pode levar também à oclusão das veias renais ou mesmo síndrome de Budd-Chiari tendo esta apresentação já sido descrita em várias publicações2,9,10,13,20–22. O atingimento cardíaco surge em 10 a 30% destes tumores determinando o aparecimento de sintomas como palpitações, síncope, cansaço fácil e dispneia sendo este último o sintoma mais frequentemente observado na apresentação destes doentes1,2,9–11,20,23,24. Quando o tumor atinge o ventrículo direito, passando através da válvula tricúspide, poderão aparecer sinais e sintomas de insuficiência valvular, como por exemplo um sopro sistólico na área tricúspide. Poderá também ocorrer um encarceramento do tumor ao nível da válvula levando a morte súbita da paciente. Finalmente, a obstrução e a redução do fluxo podem, em qualquer altura, conduzir a trombose venosa e posteriormente a embolia pulmonar podendo esta ser a primeira manifestação da doença1,6,7,25. Outros sintomas, como a tosse, foram descritos na associação a metástases pulmonares da LIV que parece ocorrer por embolização de pequenos fragmentos de tumor aquando da cirurgia de resecção21.
Exames complementares de diagnóstico diferencialUma vez que a dispneia é a forma de apresentação mais frequente, a investigação começa geralmente pela realização de exames do foro cardiológico e respiratório como o electrocardiograma, a radiografia de tórax e o ecocardiograma trans-toracico (ETT)5. Em qualquer destas técnicas é possível encontrar anomalias que denunciem o tumor. A radiografia pode mostrar uma lesão já antiga e calcificada8, mas é o ETT que geralmente revela uma massa intra-cardiaca pelo que é necessário fazer o diagnóstico diferencial com mixoma auricular ou trombo. Com este objectivo, é útil a realização de ecocardiograma trans-esofagico (ETE) que habitualmente mostra uma massa móvel, sem aderências que se estende para a VCI (fig. 1). O ETE pode excluir um tumor cardíaco primário mas pode ser difícil o diagnóstico diferencial com trombo flutuante ou metástases de tumores intra-abdominais tais como os carcinoma de células renais, carcinoma das supra-renais, hepatocarcinoma e leiomiosarcoma5,13,26,27.
A investigação de lesões que envolvem a VCI implica a realização de estudo imagiológico toraco-abdomino-pelvico como a tomografia computorizada (TC) com fase arterial e venosa e completada por protocolo de angio-TC. A ressonância magnética (RM) com angio-RM e venografia pode também ser uma opção27. Estes exames vão permitir diferenciar o tumor do trombo e ainda determinar a extensão e, eventualmente, a origem da massa19. No processo de investigação das lesões deve também ser incluída uma análise cuidada e detalhada de todos os restantes orgãos das regiões em causa.
A distinção entre um leiomiosarcoma e a LIV continua a ser muito difícil ou mesmo impossível de fazer sem exame histológico do tumor e, por isso, o estabelecimento do diagnóstico definitivo só é possível após a ressecção tumoral6,13,19,21. O padrão histológico de LIV mais frequentemente encontrado corresponde a uma massa composta por músculo liso e fibrose, sem atipia celular significativa e sem atividade mitótica. No entanto, ocasionalmente verifica-se evidência de alguma atipia e atividade mitótica, o que sugere a existência de outros padrões histológicos com diferentes níveis de agressividade. Alguns estudos imuno-histoquimicos relataram a presença de dois tipos de células, umas com recetores de estrogénio (RE) e progesterona (RP) positivos e CD34 negativos correspondendo as células tumorais, e outras CD34 positivos e RE e RP negativos que recobrem o tumor fazendo-nos acreditar que este está recoberto por células endoteliais não tumorais16. Quando marcado para avaliação do Ki-67 este é fracamente positivo o que indica um baixo índice proliferativo16.
Moniaga e Randall24 sugeriram a realização de biópsias intravasculares guiadas por TC com o objectivo de obter um diagnóstico definitivo antes da cirurgia. Contudo, a efectividade desta abordagem não é elevada uma vez que os fragmentos obtidos por punção com agulha não são geralmente suficientes para excluir a possibilidade de leiomiosarcoma e o diagnóstico diferencial seguro com LIV24.
TerapêuticaO único tratamento curativo da LIV é a ressecção total do tumor. Com este objectivo, várias técnicas têm sido utilizadas ao longo dos tempos.
A primeira ressecção tumoral de LIV com extensão intracardíaca foi relatada por Timmis et al. em 198028 mas neste caso a ressecção não foi total. Em 1982 Ariza et al. descreveram o primeiro sucesso de ressecção total do tumor1,5,9,29.
Atualmente, são utilizadas três estratégias cirúrgicas diferentes para o tratamento de LIV com extensão intracardíaca. A primeira, consiste em esternotomia, na qual sob bypass cardiopulmonar com circulação extracorporal (CEC), hipotermia e cardioplegia, se realiza uma auriculotomia direita, se remove o tumor intra-cavitario e a porção intravenosa. Esta abordagem tem o risco de hemorragia retro-peritoneal por avulsão da parede venosa no local de origem do tumor, complicação já descrita por vários autores30,31. De forma a reduzir este risco Hui-Li et al.14 propuseram que se associasse à esternotomia uma pequena incisão abdominal infero-lateral que permita excisar o pedículo do tumor, esteja ele na veia ilíaca interna ou na veia ovárica.
A segunda abordagem consiste em laparotomia, na qual se realiza uma venotomia da VCI permitindo extrair o tumor intravenoso e intracardíaco. Esta abordagem pode ser uma alternativa à esternotomia evitando colocar o doente em CEC mas não deve ser escolhida se a doente necessitar de reparação valvular. Por outro lado, pode permitir apenas a remoção parcial do tumor, com fractura da porção distal do tumor que, ao ficar livre na VCI ou na aurícula direita, pode conduzir a embolia pulmonar5.
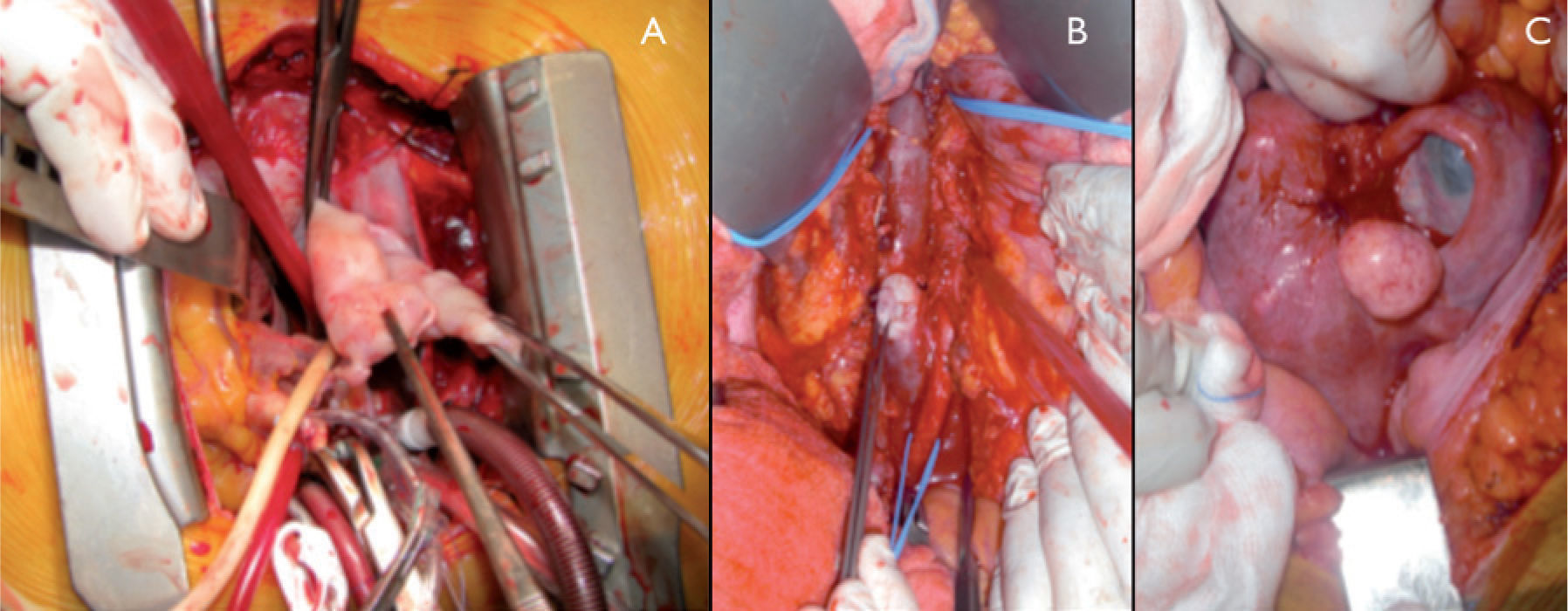
A terceira abordagem combina as duas anteriores ressecando o tumor intracardíaco e intravenoso distal (distal às veias renais) por esternotomia e o restante tumor intravenoso por laparotomia (fig. 2). Esta abordagem pode ser feita em um ou dois tempos, sendo esta última opção a escolhida quando a condição clínica das doentes não permite uma cirurgia de maior porte. Quando se escolhe a abordagem em dois tempos geralmente é efectuada primeiro a cirurgia cardiotorácica. Nesta, a doente entra em bypass cardiopulmonar, hipotermia e cardioplegia e, através da auriculotomia direita, remove-se a porção intra-cardiaca e a parte distal do tumor, em regra superior ao nível das veias renais (fig. 3A). O segundo tempo será efectuado por laparotomia 6 a 7 semanas depois e consiste na remoção do resto do tumor (fig. 3B), na histerectomia (fig. 3C) e eventualmente na colocação direta de filtro na VCI.
Exemplo de ressecção torácica e abdominal em dois tempos. (A) Resseção da porção intracardíaca por esternotomia, sob bypass cardiopulmonar com circulação extracorporal. (B) Resseção do tumor do tumor intravenoso por laparotomia. (C) Visualização do útero miomatoso antes das histerectomia.
A escolha da abordagem cirúrgica deve ter em conta as características do tumor (localização, diâmetro, aderências), a experiência do cirurgião e a condição clínica e opção da doente.
Hui-Li et al.14 recomendaram que a escolha da técnica fosse feita com base na relação diâmetro máximo do tumor/ diâmetro da VCI e na localização das porções tumorais recomendando esternotomia para os tumores com diâmetro máximo superior ao diâmetro da veia cava apenas na porção intracardíaca, laparotomia para os tumores com diâmetro máximo inferior ao diâmetro da veia cava em toda a extensão do tumor e esterno-laparotomia para os tumores com diâmetro máximo superior ao diâmetro da veia cava apenas na porção intravenosa ou em ambas as porções.
Adicionalmente a qualquer uma das abordagens, pode ser colocado um filtro na veia cava inferior. Este pode ser aberto por via retrógrada nos casos de IVL sem extensão cardíaca ou após esta ter sido removida, como Barksdale22 propôs, ou por via anterógrada após o tumor ter sido ressecado. A colocação do filtro terá importância na prevenção do embolismo pulmonar durante e após a cirurgia. Efetivamente, no período intra-operatorio a embolia pulmonar poderá ser consequência da fractura do tumor e após a cirurgia a sua natureza é geralmente trombótica, no contexto de TVP pos-operatoria, ou tumoral, no caso de tumor residual ou recidiva da doença.
Independentemente da abordagem, a chave para a cura da LIV é claramente a ressecção cirúrgica completa do tumor e, pelo facto de a LIV estar associada a leiomiomatose uterina, é fundamental associar a realização de histerectomia (fig. 3).
Esta pode ser realizada simultaneamente à tumorectomia intravenosa quando esta é feita por laparotomia ou posteriormente noutra intervenção. A combinação de salpingo-ooforectomia bilateral (SOB) continua a ser um ponto controverso no tratamento destas doentes. Todavia, por se acreditar cada vez mais numa origem leiomiomatosa do tumor, a SOB só é obrigatória nos casos em que não se consegue realizar a excisão total do tumor. Nestas circunstâncias, para além da SOB, pode optar-se também por associar um tratamento farmacológico de forma a limitar o crescimento do tumor. Este inclui inibidores das aromatases como o letrozol, antagonistas de estrogénio como o tamoxifeno ou agonistas da GnRH (gonadotropin-releasing hormone)32–35. Entre estes, os inibidores das aromatases parecem ser aqueles com melhor resposta, sem crescimento tumoral quando suspendida a terapêutica. O tratamento farmacológico pode também ser utilizado nas recidivas32 ou nas situações em que o tumor é irressecável na altura do diagnóstico de forma a diminuir a sintomatologia da doente e melhorar a sua qualidade de vida.
Finalmente, uma vez que o índice proliferativo do tumor é muito baixo, o respectivo crescimento é muito lento e assim uma eventual recidiva por demorar muitos anos a surgir e a ser sintomática. Por esta razão, no sentido de evitar as complicações graves da recidiva (morte súbita ou EP) é muito importante acompanhar estas doentes por longos períodos após a ressecção do tumor. Este acompanhamento é efectuado, para além da clínica, geralmente por ultrassonografia e TC toraco-abdominal.