Describir las características de los informes de posicionamiento terapéutico (IPT) publicados en España en el periodo 2013-2019.
Diseño y fuente de datosRevisión sistemática de todos los IPT publicados en la página web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS).
Selección de estudiosSe incluyeron todos los IPT realizados desde mayo de 2013, hasta marzo de 2019.
Extracción de datosLas principales variables recogidas fueron los grupos terapéuticos evaluados, el número de IPT, el tiempo de elaboración, la existencia de restricciones a las indicaciones autorizadas y la información sobre la eficiencia.
ResultadosEn el periodo evaluado se realizaron 214 IPT, con un tiempo medio de elaboración de 8,8 meses, casi tres veces el objetivo de 3 meses planteado inicialmente. El 57% de los IPT establecieron restricciones de uso respecto a las indicaciones de sus fichas técnicas. El 26% de los IPT hicieron referencia a la existencia de datos económicos, aunque ninguno incluyó detalles sobre la eficiencia. Se actualizaron el 10% de los IPT.
ConclusionesPara que los IPT puedan cumplir su objetivo de mejorar la eficiencia del proceso de evaluación y la coherencia en las decisiones sobre precio, reembolso y financiación de medicamentos por parte del SNS es preciso que se cumplan los plazos establecidos para su publicación, se incorpore sistemáticamente información sobre la eficiencia de los fármacos y se actualicen los informes con la nueva información generada.
Describe the characteristics of the therapeutic positioning reports (TPRs) published in Spain in the period 2013-2019.
Design and data sourceSystematic review of all TPRs published in the website of the Spanish Agency of Medicines and Health Products (AEMPS).
Selection of studiesAll TPRs published since May 2013, until March 2019
Data extractionThe main variables collected were the therapeutic groups assessed, the number of TPRs, the time of elaboration, the existence of restrictions versus the authorized indications and the information on the efficiency of medicines.
ResultsDuring the period under review, 214 TPRs were carried out, with an average production time of 8.8 months, almost three times the objective of 3-month initially set. 57% of the TPRs established restrictions of use with respect to the approved indications. 26% of TPRs referred to the existence of economic data, although none included details on the efficiency. 10% of TPRs were updated.
ConclusionsFor TPRs to meet their objective of improving the efficiency of the assessment process and the consistency in the decisions on price, reimbursement and financing of medicines by the SNS, the deadlines established for publication must be met, incorporating systematically information on the efficiency of the drugs and including periodic updates with the new information generated.
En España, tras la autorización de comercialización de un nuevo fármaco por parte de la Agencia Europea del Medicamento (EMA), se inicia un proceso de decisión sobre su precio y financiación, que, en caso de ser favorable, finaliza con la incorporación efectiva del fármaco a la práctica clínica. En dicho proceso participan la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), la Dirección General de Cartera Básica del Servicio Nacional de Salud y Farmacia (DGCBSF) y las comunidades autónomas (CC. AA.). La evaluación regulatoria se basa en la eficacia, seguridad y calidad del nuevo fármaco. Las evaluaciones posteriores, orientadas a determinar la «utilidad terapéutica» (Ley 29/2006)1, o el «posicionamiento» de los medicamentos en la prestación farmacéutica (Ley 10/2013, de 24 de julio)2, tienen en cuenta aspectos como su eficacia en relación con otras alternativas e, idealmente, su eficiencia e impacto presupuestario.
En mayo de 2013, la Comisión Permanente de Farmacia del SNS, formada por los organismos anteriormente mencionados, publicó la «Propuesta de colaboración para la elaboración de los informes de posicionamiento terapéutico de los medicamentos»3. El documento estableció un sistema de evaluación en red por el que se creaba un Grupo de Coordinación del Posicionamiento Terapéutico (GCPT), coordinado por la AEMPS y con representación de la DGCBSF y de las CC. AA., cuyo objetivo era la elaboración de Informes de Posicionamiento Terapéutico (IPT). Dichos informes, basados en la evidencia científica disponible, debían contribuir a evitar las redundancias e ineficiencias derivadas de las múltiples evaluaciones (con cierta frecuencia, contradictorias) que tenían lugar en los distintos niveles de decisión del SNS. El objetivo era, por tanto, que los IPT ayudaran a aumentar la coherencia, eficiencia, integración y continuidad de las diferentes evaluaciones de un mismo medicamento, garantizando la independencia y contribuyendo al uso racional de los medicamentos y a la equidad en el acceso de los pacientes.
Los agentes implicados en la elaboración de los IPT se estructuraron en 3 niveles: 1) la AEMPS, la DGCBSF y las Direcciones de Farmacia de las CC. AA.; 2) los técnicos y los profesionales sanitarios designados por el primer nivel, y 3) las compañías farmacéuticas, los pacientes y las sociedades científicas. El documento para la elaboración de los IPT (21 de mayo de 2013) recogía todos los detalles del procedimiento de trabajo en red, y los tiempos asignados a cada paso. En una primera fase (fase I), que finaliza con la liberación del primer informe a la DGCBSF, los IPT debían incluir una evaluación de la efectividad y la seguridad comparada, los criterios de uso y seguimiento y, opcionalmente, una evaluación económica. Posteriormente, en una segunda fase (fase II) y tras el procedimiento de fijación de precio y financiación, los IPT debían incorporar siempre la valoración económica y del impacto presupuestario. El plazo que se estableció para la elaboración del primer IPT, desde la decisión positiva del Comité de Medicamentos de Uso Humano de la EMA y la resolución de autorización de la Comisión Europea (autorización de la comercialización) fue de 3 meses, con el fin de que la información pudiese utilizarse para la decisión de precio y financiación.
El presente trabajo tiene como objetivo revisar las características de los IPT publicados desde la puesta en marcha del GCPT, así como analizar el grado de cumplimiento de los objetivos planteados.
MétodosSe realizó una revisión de todos los IPT incluidos en la web de la AEMPS desde el inicio de su publicación, el 15 de octubre de 2012, hasta el 21 de marzo de 2019 (los IPT empezaron a realizarse a partir de mayo de 2013, pero en 2012 se publicó un IPT).
Para cada uno de los IPT publicados se recogió información sobre las siguientes variables: 1) nombre del principio activo; 2) indicación aprobada; 3) área terapéutica; 4) fechas de inicio del IPT, tiempo hasta fase I y tiempo hasta publicación; 5) existencia de una segunda versión (sí/no) y motivos para la misma (actualización de eficacia, actualización de seguridad, cambios en el posicionamiento); 6) número de estudios en fases II y III; 7) número de pacientes incluidos en los diferentes estudios de fases II y III; 8) existencia (sí/no) y tipos de estudios adicionales en marcha (eficacia, seguridad, fase III a completar); 9) existencia (sí/no) y tipo de comparador (placebo, comparador activo, ambos); 10) existencia de plan de minimización de riesgos (sí/no); 11) restricción de uso respecto a la ficha técnica (sí/no) y tipo de restricción (restricción en subgrupo de pacientes, solo financia alguna indicación; no financia; no opción preferente); 12) aprobación condicionada (sí/no); 13) existencia (sí/no) y subtipos de estudios fármacoeconómicos (análisis fármacoeconómico, impacto presupuestario, ambos); 14) mención a la eficiencia (sí/no); 15) existencia de IPT previo en otra indicación (sí/no); 16) existencia de medicamentos huérfanos (sí/no), y 17) número de revisores por CC. AA. en los informes.
Con el fin de completar la información de los IPT respecto a la duración de la evaluación, se revisaron también todas las actas de las reuniones de trabajo del GCPT. Además, cuando los IPT no recogían información completa relativa a las características de los ensayos clínicos realizados, se consultaron las fichas técnicas de los fármacos.
La revisión de todos los IPT se llevó a cabo de forma independiente por VG y LC. Posteriormente, se analizaron las discrepancias entre los evaluadores y, en caso de existir, se discutieron hasta llegar a un consenso.
Análisis estadísticoSe realizó un análisis descriptivo de todas las variables recogidas. Tras clasificar los IPT por subgrupos farmacológicos definidos según el Sistema de Clasificación Anatómica, Terapéutica, Química (ATC), se estimaron sus frecuencias absolutas y relativas. En función de las frecuencias relativas se definieron 6 grandes áreas terapéuticas (A10, B02, J05, L01, L04 y R03) que incluían aquellos subgrupos con una frecuencia relativa mayor al 1%.
Se estimaron la duración media y su desviación estándar, y la mediana y el rango intercuartílico de días transcurridos desde el inicio de la elaboración de los IPT hasta la adopción de la fase I y hasta su publicación. Posteriormente, se realizó un análisis de la varianza para comprobar si la duración de estos periodos variaba en función de las áreas terapéuticas. Asimismo, se comparó la duración media desde el inicio hasta la publicación en función del año de publicación. Se calcularon el número de estudios en fases II y III, así como la media y la mediana de pacientes incluidos en dichos estudios. Se calcularon las frecuencias relativas de IPT: 1) con estudios en marcha y por tipos de estudios en marcha; 2) con restricciones y por tipo de restricciones; 3) con estudios fármacoeconómicos y por subtipos de estudios fármacoeconómicos, y 4) con restricciones. El número de revisiones por CC. AA. se representó utilizando la herramienta SPMAP del software estadístico Stata v.13. Aunque este trabajo se limita a realizar un análisis descriptivo, los datos están disponibles para aquellos autores que deseen explorar otras hipótesis mediante análisis multivariantes de los mismos.
ResultadosEl número de IPT publicados en la página web de la AEMPS en el periodo evaluado fue de 214. De ellos, 88 (41,1%) tenían un IPT previo en otra indicación. En la tabla 1 se detalla el número de IPT publicados por subgrupo farmacológico, según la clasificación ATC. Los grupos farmacológicos con mayor número de IPT fueron los agentes antineoplásicos (36,5%), los inmunosupresores (12,6%), los antivirales de uso sistémico (7,9%) y los fármacos usados en diabetes (7,0%).
Número y porcentaje de informes de posicionamiento terapéutico por subgrupos farmacológicos según el sistema de clasificación ATC
| Subgrupo ATC | Indicación | N.° | Porcentaje |
|---|---|---|---|
| A10 | Fármacos usados en diabetes | 15 | 7,0 |
| A16 | Otros productos para el tracto alimentario y metabolismo | 5 | 2,3 |
| B02 | Antihemorrágicos | 7 | 3,3 |
| C02 | Antihipertensivos | 3 | 1,4 |
| C10 | Agentes modificadores de los lípidos | 4 | 1,9 |
| J01 | Antibacterianos para uso sistémico | 4 | 1,9 |
| J05 | Antivirales de uso sistémico | 17 | 7,9 |
| L01 | Agentes antineoplásicos | 78 | 36,5 |
| L04 | Inmunosupresores | 27 | 12,6 |
| R03 | Agentes para obstrucción de las vías respiratorias | 10 | 4,7 |
| S01 | Oftalmológicos | 4 | 1,9 |
| Otros | Otros | 40 | 18,7 |
ATC: anatómica, terapéutica, química.
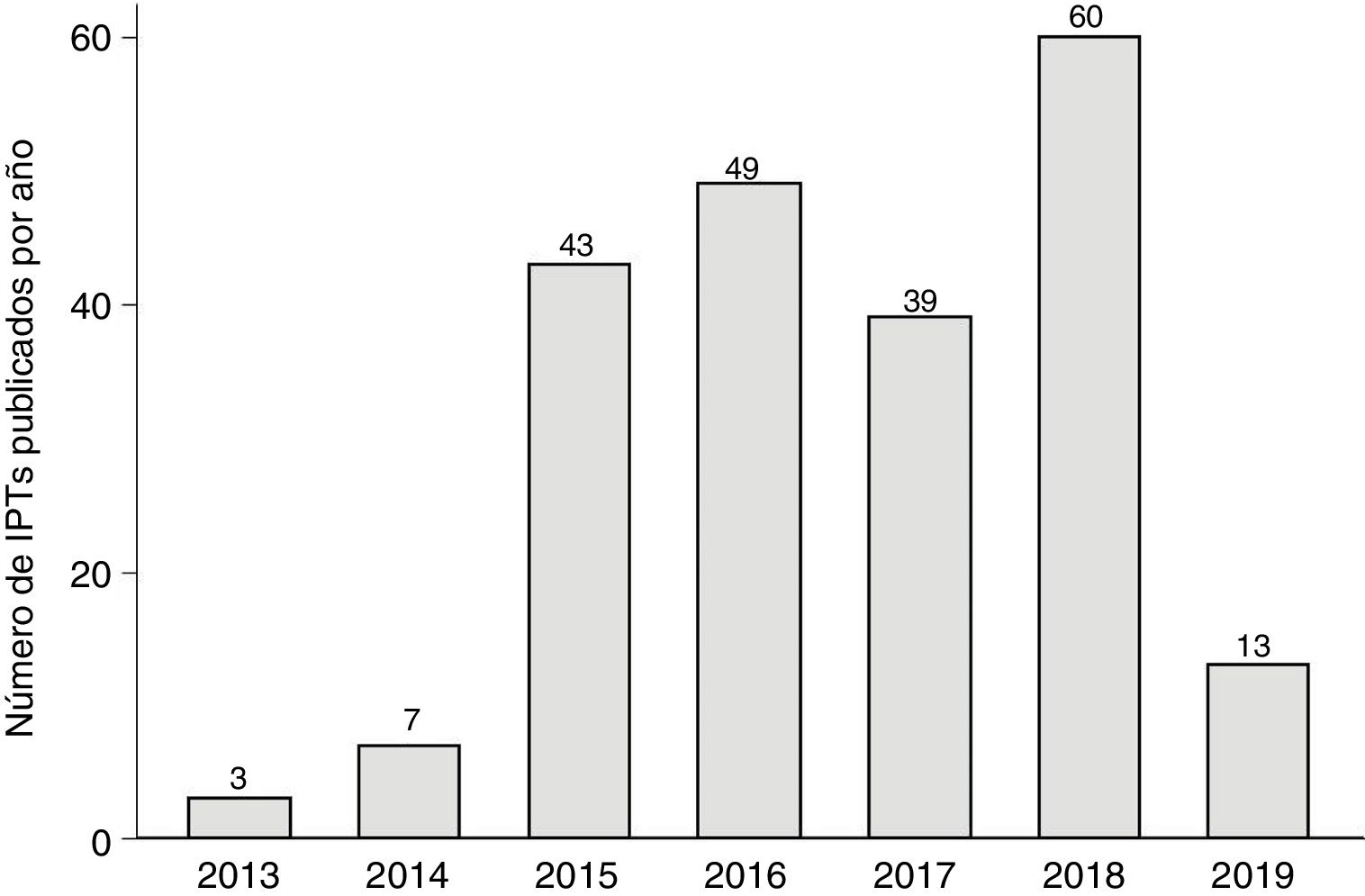
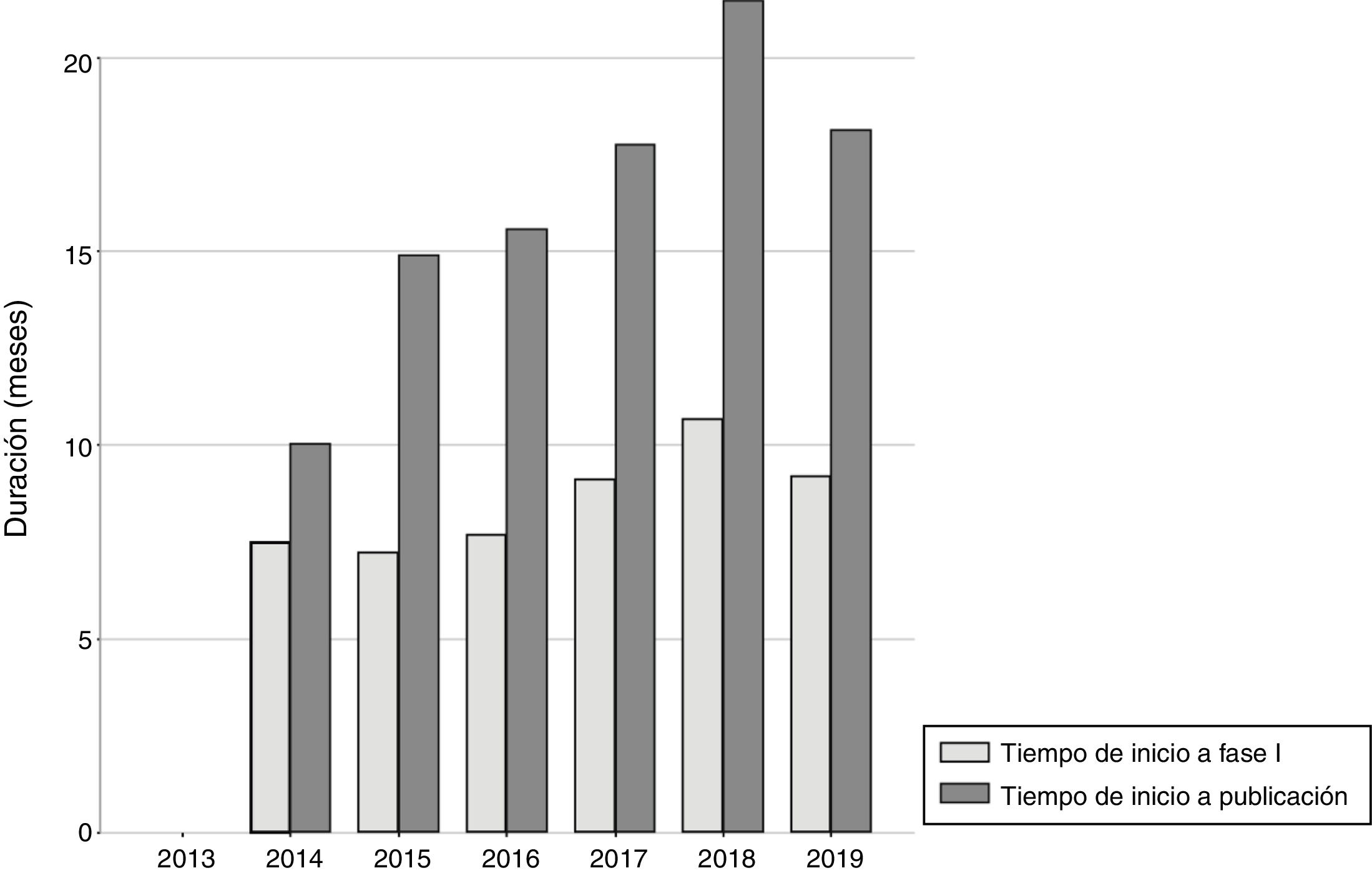
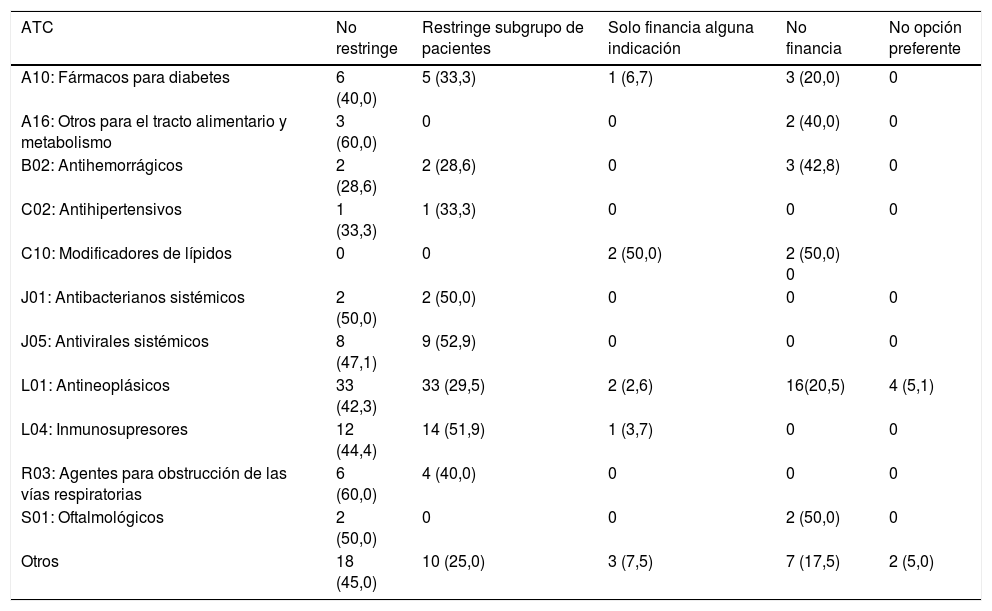
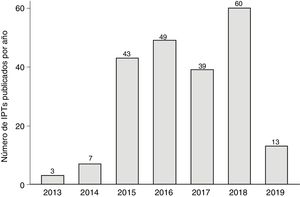
La figura 1 muestra la evolución anual del número de IPT publicados, que alcanzó los 60 en 2018. En la figura 2 se detalla el tiempo medio de elaboración de los IPT. El tiempo medio hasta el final de la fase I (liberación del primer informe) fue de 265 días (8,8 meses, DE: 6,3 meses) y desde el inicio hasta la publicación en la web de la AEMPS fue de 523 días (17,4 meses, DE: 9,3 meses) (p<0,01), llegando a superar los 20 meses en 2018. En un 2,8% de los IPT la liberación del primer informe (fase I) tuvo lugar antes de los 3 meses establecidos como objetivo. En la figura 1 del apéndice online se detallan la duración media hasta la fase I y hasta la publicación en función de las 6 áreas terapéuticas más frecuentes, observándose un tiempo medio más alto en el caso de los fármacos antihemorrágicos (casi 26,6 meses) y de los fármacos para la diabetes (23,3 meses). No se encontraron diferencias de tiempo para el primer período (inicio-fase I; p=0,23), pero sí para el segundo (fase I-publicación; p<0,01).
Evolución anual del número de IPT. En 2019 solo se incluyeron los IPT publicados hasta abril. En los años 2012 y 2013 se publicaron uno y 2 IPT, respectivamente, por lo que se han representado agrupados en la columna de 2013. No ha podido establecerse su tiempo de elaboración debido a que las actas de las reuniones del GCPT no se publicaron hasta junio de 2013.
Se identificaron 21 IPT con más de una versión publicada. En 3 (14,3%) de ellos la nueva publicación se realizó para actualizar los datos de eficacia, en 3 (14,3%) para actualizar los datos de seguridad, en 7 (33,3%) por cambios en el posicionamiento, y en 5 (23,8%) para actualizar datos de eficacia y seguridad. En 3 casos (14,3%) no se especificaba el motivo de la actualización del informe. Puesto que la fecha de publicación de estos IPT es la de la última versión disponible, y no la de la versión inicial, estos IPT no se han incluido en el análisis de los tiempos de elaboración.
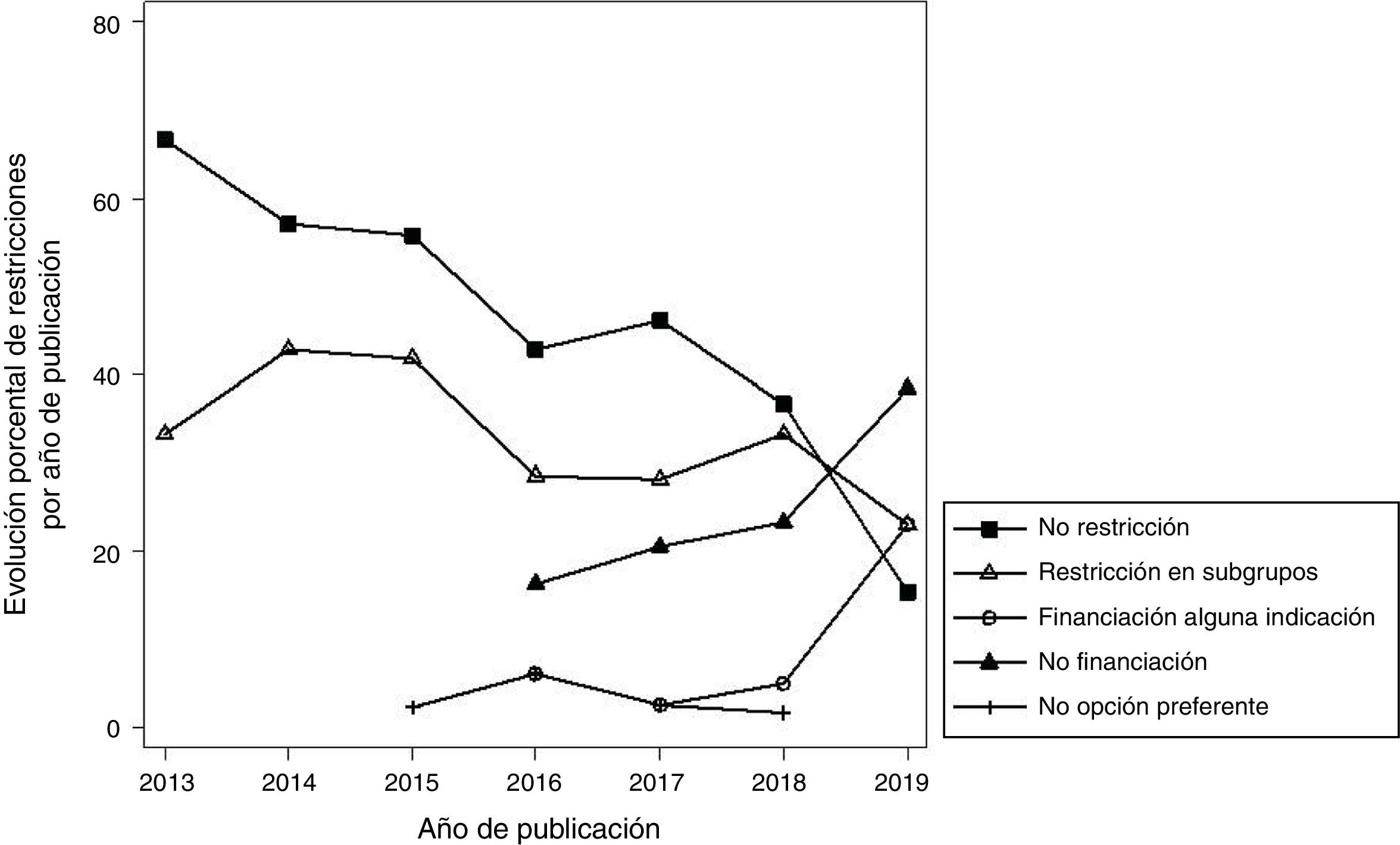
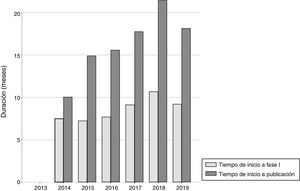
Más de la mitad (56,5%) de los IPT establecieron restricciones en el uso de los fármacos (que se incluyeron en las consideraciones finales del GCPT), respecto a las indicaciones señaladas en sus fichas técnicas. En el 32,7% de los IPT se restringió el uso del fármaco a un subgrupo de pacientes; en el 16,4% no se financió el fármaco por el SNS (máximo grado de restricción); en el 4,7% solo se financió alguna de las indicaciones evaluadas, y en el 2,8% se consideró que el fármaco no era la opción preferente de tratamiento. La figura 3 muestra la evolución del tipo de restricciones, apreciándose una disminución progresiva en el porcentaje de IPT que no realizaban ninguna restricción y de aquellos que restringían el uso para determinados subgrupos. Por el contrario, se observa un aumento en el número de fármacos no financiados y de fármacos en los que solo se financian algunas indicaciones. La tabla 2 muestra el tipo de restricciones para los diferentes grupos terapéuticos.
Número y porcentaje de restricciones, global y por subgrupos según el sitema de clasificación ATC
| ATC | No restringe | Restringe subgrupo de pacientes | Solo financia alguna indicación | No financia | No opción preferente |
|---|---|---|---|---|---|
| A10: Fármacos para diabetes | 6 (40,0) | 5 (33,3) | 1 (6,7) | 3 (20,0) | 0 |
| A16: Otros para el tracto alimentario y metabolismo | 3 (60,0) | 0 | 0 | 2 (40,0) | 0 |
| B02: Antihemorrágicos | 2 (28,6) | 2 (28,6) | 0 | 3 (42,8) | 0 |
| C02: Antihipertensivos | 1 (33,3) | 1 (33,3) | 0 | 0 | 0 |
| C10: Modificadores de lípidos | 0 | 0 | 2 (50,0) | 2 (50,0) 0 | |
| J01: Antibacterianos sistémicos | 2 (50,0) | 2 (50,0) | 0 | 0 | 0 |
| J05: Antivirales sistémicos | 8 (47,1) | 9 (52,9) | 0 | 0 | 0 |
| L01: Antineoplásicos | 33 (42,3) | 33 (29,5) | 2 (2,6) | 16(20,5) | 4 (5,1) |
| L04: Inmunosupresores | 12 (44,4) | 14 (51,9) | 1 (3,7) | 0 | 0 |
| R03: Agentes para obstrucción de las vías respiratorias | 6 (60,0) | 4 (40,0) | 0 | 0 | 0 |
| S01: Oftalmológicos | 2 (50,0) | 0 | 0 | 2 (50,0) | 0 |
| Otros | 18 (45,0) | 10 (25,0) | 3 (7,5) | 7 (17,5) | 2 (5,0) |
ATC: anatómica, terapéutica, química.
El número medio de ensayos clínicos en fase III varió en función del grupo terapéutico, con un rango que osciló entre 1,2 en el caso de IPT de fármacos antineoplásicos y 4,7 en el caso de fármacos para la diabetes (tabla I del apéndice online). El número medio de pacientes incluidos en los diferentes ensayos clínicos de fases II y III también mostró importantes variaciones. La media de pacientes en fase III fue de 1.618 para todos los IPT, con un mayor tamaño muestral en estudios de fármacos para la diabetes y las enfermedades obstructivas de las vías respiratorias, así como para los modificadores de los lípidos y los antibacterianos sistémicos (tabla II del apéndice online). Respecto al uso de comparador, un 34,2% de los ensayos clínicos en fase III incluyeron comparador activo, un 31,6% placebo, un 28,8% placebo y comparador activo, y un 5,4% ningún comparador.
El 43,5% de los IPT indicaban la existencia de estudios en marcha para completar los datos de eficacia y seguridad (15,0%), para completar los ensayos fase III (11,7%), los datos de seguridad (10,8%) o la eficacia (6,1%). El 8,5% de los IPT publicados correspondieron a fármacos que recibieron una aprobación de comercialización condicionada a la presentación de datos adicionales. Todas las aprobaciones condicionadas se produjeron en los fármacos oncológicos, representando un 15,0% de los IPT de este grupo terapéutico. Además, 19 (8,9%) IPT establecieron explícitamente la necesidad de llevar a cabo un plan de minimización de riesgos, siendo el requerimiento más frecuente en el grupo de inmunosupresores (8 IPT) y antineoplásicos (3 IPT).
Aunque el 26,2% de los IPT mencionaban la existencia de datos económicos (9,8% de análisis farmacoeconómico, 6,1% de análisis de impacto presupuestario y 10,3% de ambos), en ningún caso se detalló el contenido de estas evaluaciones. En un 49,3% de los IPT, las consideraciones finales hicieron referencia a la necesidad de utilizar criterios de eficiencia en la elección de un fármaco u otro dentro de la misma enfermedad.
Se realizó un análisis específico de los IPT correspondientes a medicamentos huérfanos, identificándose un total de 28. Los tiempos de elaboración de los IPT de estos fármacos fueron de 238 días (7,9 meses, DE: 3,7) hasta el final de la fase I y 625 días (20,8 meses, DE: 8,0) hasta la publicación. Un total de 19 (68,0%) IPT establecieron algún tipo de restricción para estos fármacos: 11 (58,0%) de ellos no se financiaron, 7 (37,0%) restringieron su uso a un subgrupo de pacientes, y uno (5,0%) no consideró al fármaco como la opción preferente (tabla III del anexo online).
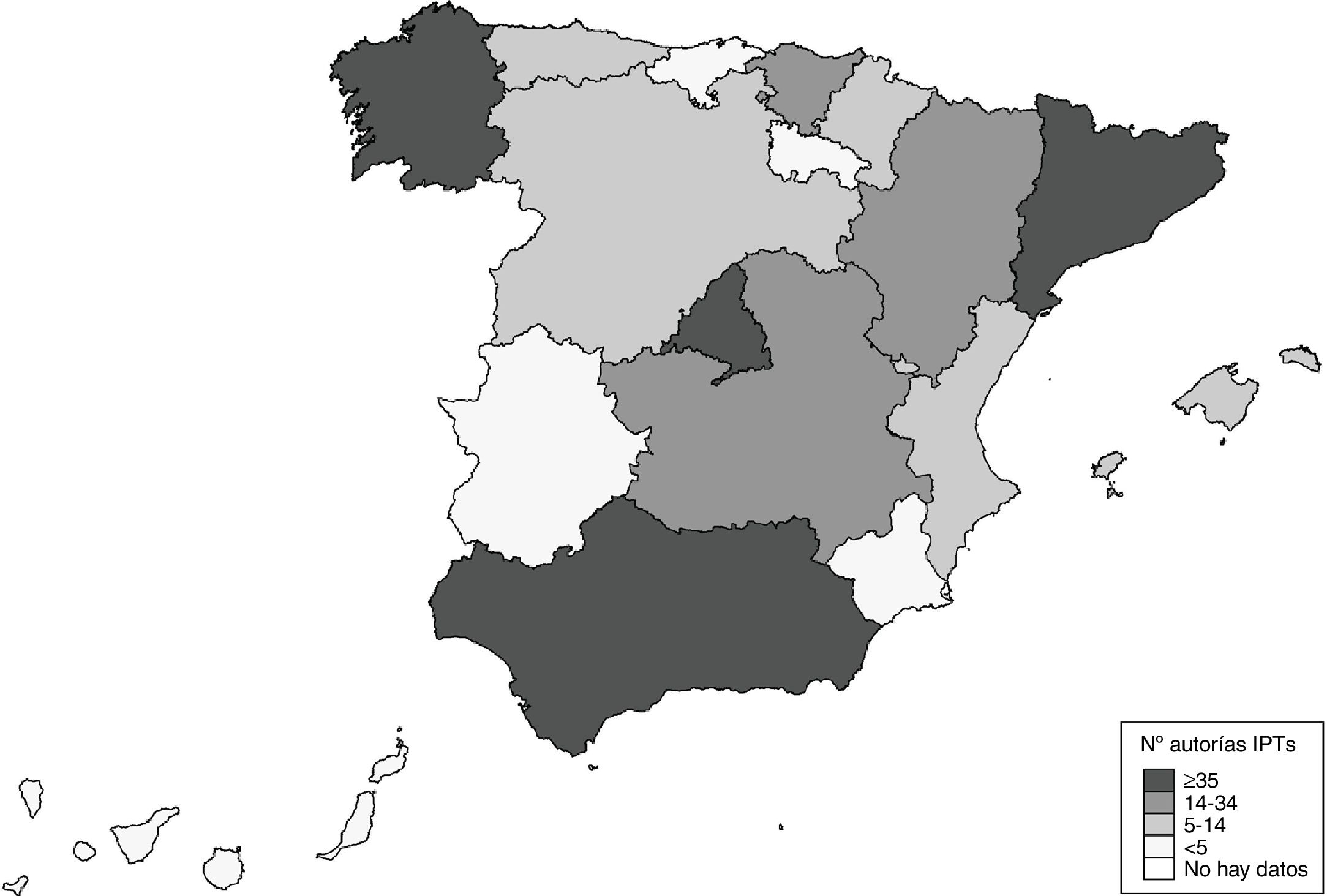
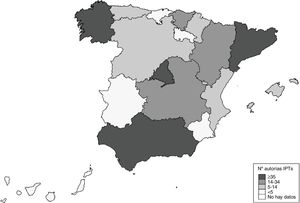
La figura 4 muestra que Andalucía, Cataluña, Madrid y Galicia han sido las CC. AA. que más veces han intervenido en la elaboración de los IPT, con al menos 35 revisiones cada una de ellas. En el otro extremo se sitúan Extremadura, La Rioja, Cantabria y Murcia, con menos de 4 revisiones por comunidad.
DiscusiónLa puesta en marcha de un sistema de evaluación en red para realizar IPT ha representado un importante avance para mejorar la calidad y disminuir la variabilidad en el posicionamiento y el acceso de los pacientes a los medicamentos entre CC. AA. y hospitales. Es probable que este sistema esté contribuyendo a disminuir el número de evaluaciones realizadas localmente, aunque el problema de la variabilidad no se ha resuelto totalmente. Por ejemplo, en el caso de los fármacos oncológicos, aún existe una alta variabilidad entre los formularios de hospitales, que es donde se toman el 65,5% de las decisiones sobre el acceso de estos fármacos4. También se ha constatado una gran variabilidad entre CC. AA. en el acceso de los pacientes a los nuevos anticoagulantes orales, así como un alto porcentaje de incumplimiento por parte de los médicos de las recomendaciones de los IPT en el tratamiento con anticoagulantes orales en pacientes ancianos con fibrilación auricular5, aunque es preciso aclarar que los IPT y las guías terapéuticas tienen un objetivo diferente.
Uno de los hallazgos más destacables de este trabajo es el progresivo retraso en la liberación de la primera fase del IPT. La media hasta la liberación del informe ha sido de 8,8 meses y hasta la publicación del informe de 17,4 meses. Aunque el dato más preocupante es que el 97,2% de los IPT han tardado más de 3 meses en liberarse, una cifra que se ha incrementado en los últimos 3 años6, lo que podría suponer retrasos en las decisiones de precio y financiación de los nuevos fármacos. Los retrasos constatados en este trabajo son mayores que los de trabajos previos, que encontraron una mediana de 7,1 y 14,5 meses hasta la liberación de la fase I y su publicación, respectivamente7, o 385 días desde la aprobación de la EMA hasta la publicación8. Es preciso aclarar que se ha tomado como fecha de inicio de fase I la primera fecha recogida en las actas del GCPT aunque, en realidad, el proceso se inicia cuando las compañías comunican a la AEMPS su intención de comercialización del fármaco, una comunicación que puede demorarse. El progresivo retraso en la elaboración de los IPT se debe fundamentalmente a la insuficiencia de evaluadores en la AEMPS. Es urgente atajar este problema y poner los recursos necesarios en un área de vital importancia para evitar retrasos que tienen consecuencias muy negativas para los pacientes, para la industria y para la credibilidad del nuevo sistema.
Respecto a las recomendaciones de los informes, el dato más destacable es que el 56,5% de los IPT establecieron restricciones en el posicionamiento de los fármacos respecto a las indicaciones aprobadas en las fichas técnicas, teniendo en cuenta que en la práctica, las CC. AA. y los hospitales pueden establecer restricciones adicionales respecto a las recogidas en los IPT. La restricción en el posicionamiento terapéutico por parte de distintos organismos de evaluación de tecnologías sanitarias es una práctica habitual en otros países europeos9 y también en EE. UU.10, país este último donde los diferentes planes de salud de las aseguradoras llegan a restringir las indicaciones de la ficha técnica hasta en un 57,0% de los fármacos.
Quizás el tema más controvertido respecto a las recomendaciones de los IPT es la ausencia de información sistemática sobre la eficiencia y el impacto económico de los fármacos evaluados. Aunque un 26,2% de los IPT incluyen alguna referencia sobre la existencia de dichos datos, tal información no está disponible en los documentos. Esta carencia es muy llamativa por tratarse de una información esencial para poder determinar el lugar de un medicamento en la terapéutica11,12. Y resulta aún más sorprendente si se considera que el 44,0% de los IPT indican en su conclusión que la eficiencia debe ser un elemento fundamental en la selección del nuevo fármaco. Obviamente, la falta de información sobre la eficiencia del medicamento contribuye a mantener la fragmentación y las inconsistencias en las decisiones sobre precio, reembolso y acceso. La reciente creación del Comité Asesor para la Financiación Farmacéutica del SNS podría contribuir a solventar esta situación.
Finalmente, en el momento de la autorización existe incertidumbre sobre la efectividad y la eficiencia de los fármacos en las condiciones de la práctica clínica habitual. Por ello sería deseable que los IPT fueran actualizándose a medida que se generan nuevos datos de la vida real, estudios comparativos y nuevos modelos de coste-efectividad e impacto presupuestario. En ese sentido llama la atención que en estos 7 años solamente se hayan publicado 21 nuevas versiones de IPT con información actualizada. Las reevaluaciones deberían constituir una parte fundamental del proceso, aunque ello exigiese una mayor inversión de recursos.
En España se están dando pasos importantes encaminados a mejorar la evaluación de los nuevos fármacos. La elaboración de IPT como paso previo a las decisiones de precio, reembolso y acceso supone un importante avance en esa dirección. Pero para que el esfuerzo inicial se consolide es preciso dotar a los organismos implicados en la evaluación de los recursos necesarios para cumplir los plazos establecidos, mejorar la transparencia y la previsibilidad de las decisiones, incorporar sistemáticamente información sobre la eficiencia, reevaluar cuando exista nueva información relevante, involucrar de manera más efectiva a todos los agentes implicados en el proceso, y evitar la proliferación de reevaluaciones locales que restan credibilidad al proceso, disminuyen la eficiencia y generan inequidades para los pacientes.
- •
En 2013 se estableció en España un sistema de evaluación en red para elaborar Informes de Posicionamiento Terapéutico (IPTs).
- •
El objetivo de los IPTs fue aumentar la coherencia y la eficiencia en el proceso de evaluación de medicamentos dentro del Sistema Nacional de Salud, ayudando a las decisiones de precio, reembolso y mejorando la equidad en el acceso de los pacientes a los fármacos.
- •
El tiempo medio de elaboración de los IPT ha sido de casi 9 meses, por encima del objetivo de 3 meses, planteado inicialmente.
- •
El 57% de los IPTs han establecido restricciones de uso respecto a las indicaciones de las fichas técnicas.
- •
Los IPTs no incluyen información sobre la eficiencia de los fármacos evaluados.
La presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público o entidades sin ánimo de lucro. El análisis estadístico de los datos, realizado por EGE, ha sido financiado por Lilly España.
AutoríasVG y LA han realizado la revisión de los IPT. EGE ha realizado los análisis estadísticos y ha preparado las tablas y figuras. Todos los autores han contribuido a la revisión crítica del trabajo con importantes aportaciones intelectuales. Todos los autores han revisado y aprobado la versión final del artículo enviado a publicación. Todos los autores se hacen responsables de que todos los aspectos que integran el manuscrito hayan sido revisados y discutidos con el fin que ser expuestos con la máxima precisión e integridad.
Conflicto de interesesVG, LC, SB y JAS son empleados de Lilly España. Sus opiniones son personales y no representan las de la compañía.