La ELA es una enfermedad poco frecuente en atención primaria (AP), representa un desafío para el médico de familia especialmente en atención domiciliaria.
ObjetivoConocer la incidencia y prevalencia de la ELA en un área de gestión de AP, las características clínicas y la utilización de recursos sanitarios.
DiseñoEstudio observacional.
EmplazamientoDirección de AP Costa de Ponent, Región Sanitaria Metropolitana Sur, Barcelona, Cataluña, España.
ParticipantesPacientes con ELA ≥18 años diagnosticados hasta el 01/03/2017.
Mediciones principalesEdad, sexo, características: forma de inicio (espinal, bulbar, otras), intervalo entre inicio de síntomas y diagnóstico, portadores gastrostomía percutánea, ventilación no invasiva o invasiva. Identificación en AP como paciente crónico complejo o con necesidades paliativas. Inclusión en programas de atención domiciliaria (PAD). Modelo de atención hospitalario.
ResultadosOchenta y un pacientes, edad media 65,6 años (±11,7), varones 49,4%. Forma de inicio: espinal 69%, bulbar 21%, otras 4%. Intervalo entre inicio de síntomas y diagnóstico 12 meses. Identificados como paciente crónico complejo o con necesidades paliativas 13,6%, incluidos en PAD 29 pacientes (35,8%). Atendidos en modelo hospitalario integral 79 pacientes (97,5%). Prevalencia 6,1/100.000 habitantes en 2017. Incidencia anual entre 1,2 casos/100.000 habitantes/año en 2012 y 3,5 casos/100.000 habitantes/año en 2016.
ConclusionesUtilizar gastrostomía percutánea en la ELA favorece la identificación como paciente crónico complejo o con necesidades paliativas e inclusión en PAD. Utilizar ventilación no invasiva favorece la inclusión en PAD. Los datos de incidencia y prevalencia de ELA son superiores a los descritos previamente en la misma área. Es necesaria la identificación precoz de estos pacientes en los modelos de atención a la cronicidad en equipos de AP.
Amyotrophic Lateral Sclerosis (ALS) is a rare disease in primary care (PC), it represents a challenge for the family doctor, especially in home care.
ObjectiveTo know the incidence and prevalence of ALS in an area of ??PA management, the clinical characteristics and use of health resources.
DesignObservational study.
LocationPC-Direction Costa de Ponent, South Metropolitan Health Region, Barcelona, Catalonia, Spain.
ParticipantsPatients with ALS ≥18 years diagnosed until 03/01/2017.
Main measurements Age, sex, characteristics: form of appearance (spinal, bulbar, others), interval between onset of symptoms and diagnosis, percutaneous gastrostomy carriers, ventilation non-invasive or invasive. Identification in PC as a Complex Chronic Patient or with palliative needs (CCP). Inclusion in home care programs (PAD). Model of attention hospitable.
Results81 patients, mean age 65.6 years (± 11.7), men 49.4%. Shape of onset: spinal 69%, bulbar 21%, another 4%. Interval between the onset of symptoms and diagnosis 12 months. Identified as a CCP 13.6%, 29 patients (35.8%) included in PAD. Attended in comprehensive hospital model 79 patients (97.5%). Prevalence 6.1/100,000 inhabitants in 2017. Annual incidence between 1.2 cases/100,000 inhabitants/year in 2012 and 3.5 cases/100,000 inhabitants/year in 2016.
ConclusionsThe use of percutaneous gastrostomy in ALS favors the identification as CCP or with palliative needs and inclusion in PAD. The use of non-invasive ventilation favors inclusion in PAD. The incidence and prevalence data for ALS are higher than those described above in the same area. Early identification is necessary of these patients in the chronic care models in PC teams.
La esclerosis lateral amiotrófica (ELA), también denominada como enfermedad de Lou Gehrig, es una enfermedad de carácter degenerativo, secundaria a la afectación de las neuronas motoras superiores o inferiores1,2. Actualmente se considera de origen multifactorial combinando factores genéticos, ambientales y de estilo de vida1. En su evolución clínica aparecen síntomas progresivos de debilidad muscular y otros síntomas, la muerte ocurre habitualmente hacia los 3 años del inicio principalmente por insuficiencia respiratoria1.
Respecto a la frecuencia de aparición, se ha informado una tasa de incidencia anual homogénea en poblaciones de Europa, América del Norte y Nueva Zelanda cercana a 1,8 pacientes/100.000 habitantes/año3. Un estudio en Cataluña (España) mostró una incidencia de 1,4 (1,6 varones y 1,2 mujeres) y una prevalencia de 5,4 pacientes/100.000 habitantes en mayores de 18 años4.
En el inicio de la enfermedad tiende a presentarse de dos diferentes formas5. La afectación espinal con debilidad en alguna extremidad (65%) y la afectación bulbar con disfonía y disfagia (33%)5. En cuanto a su asociación con trastornos cognitivos, se han descrito alteraciones cognitivas hasta en el 40% de los pacientes y en el 14% llegan a presentan una variante de demencia frontotemporal6. En cuanto a su agregación familiar, se considera como «ELA familiar» al 20% de los pacientes que tienen o han tenido familiares con ELA o con demencia frontotemporal7. Otra característica frecuente de esta enfermedad es que tiende a producirse un retraso entre el inicio de los síntomas y la confirmación del diagnóstico cercano a los 12 meses8,9.
Actualmente, no existe tratamiento curativo y se emplea el riluzole (Riluzol®) como terapia específica dado que algunos estudios han mostrado que puede retrasar la iniciación de ventilación no invasiva (VNI) o invasiva en pacientes seleccionados y aumentar ligeramente la supervivencia en 3-5 meses10. Por tanto, el manejo de estos pacientes se basa en el control de síntomas11,12 y precisando en algunos casos la implantación de gastrostomías percutáneas (PEG) y sistemas de ventilación1,2.
Referente a la gestión en los cuidados de estos pacientes, en el ámbito hospitalario existe la tendencia actual a la creación de unidades multidisciplinares que incluyen a profesionales de diferentes ámbitos y existe evidencia de que la atención en estas unidades tiende a mejorar la calidad de vida y la supervivencia de estos pacientes13–15.
En el ámbito de la atención primaria AP, actualmente, estos pacientes se integran en el área de atención a la cronicidad. Este sistema tiende a identificar de forma específica a los pacientes que presentan una o más de una enfermedad de larga evolución y cuya gestión clínica es percibida como difícil por los profesionales16. Un sistema es identificarlos como pacientes crónicos complejos (PCC) o de pacientes con enfermedad crónica avanzada (PCA) o modelo de atención a la cronicidad avanzada (MACA)17,18. Los pacientes PCA/MACA se identifican utilizando el instrumento NECPAL (CCOMS-ICO©) donde debe cumplir el tener una expectativa de vida menor de 12 meses17.
Este modelo de atención a la cronicidad también incluye la figura del gestor/a de casos18,19. El equipo de referencia (médico, enfermera y trabajador/a social), acostumbra a integrarlos en el programa de atención domiciliaria (ATDOM)20 y en algunos territorios cuentan con el soporte de los programas de atención paliativa como el «programa de atención domiciliaria y equipo de apoyo» (PADES)21.
El objetivo del presente estudio es analizar los aspectos demográficos e identificar las características asistenciales de los casos de ELA como: formas de inicio, aspectos clínicos, tiempo transcurrido sintomático previo al diagnóstico, la necesidad de dispositivos de ayuda para la alimentación y ventilación, la utilización de recursos de AP y hospitalarios de estos pacientes, así como la incidencia y prevalencia de esta enfermedad en un área geográfica específica.
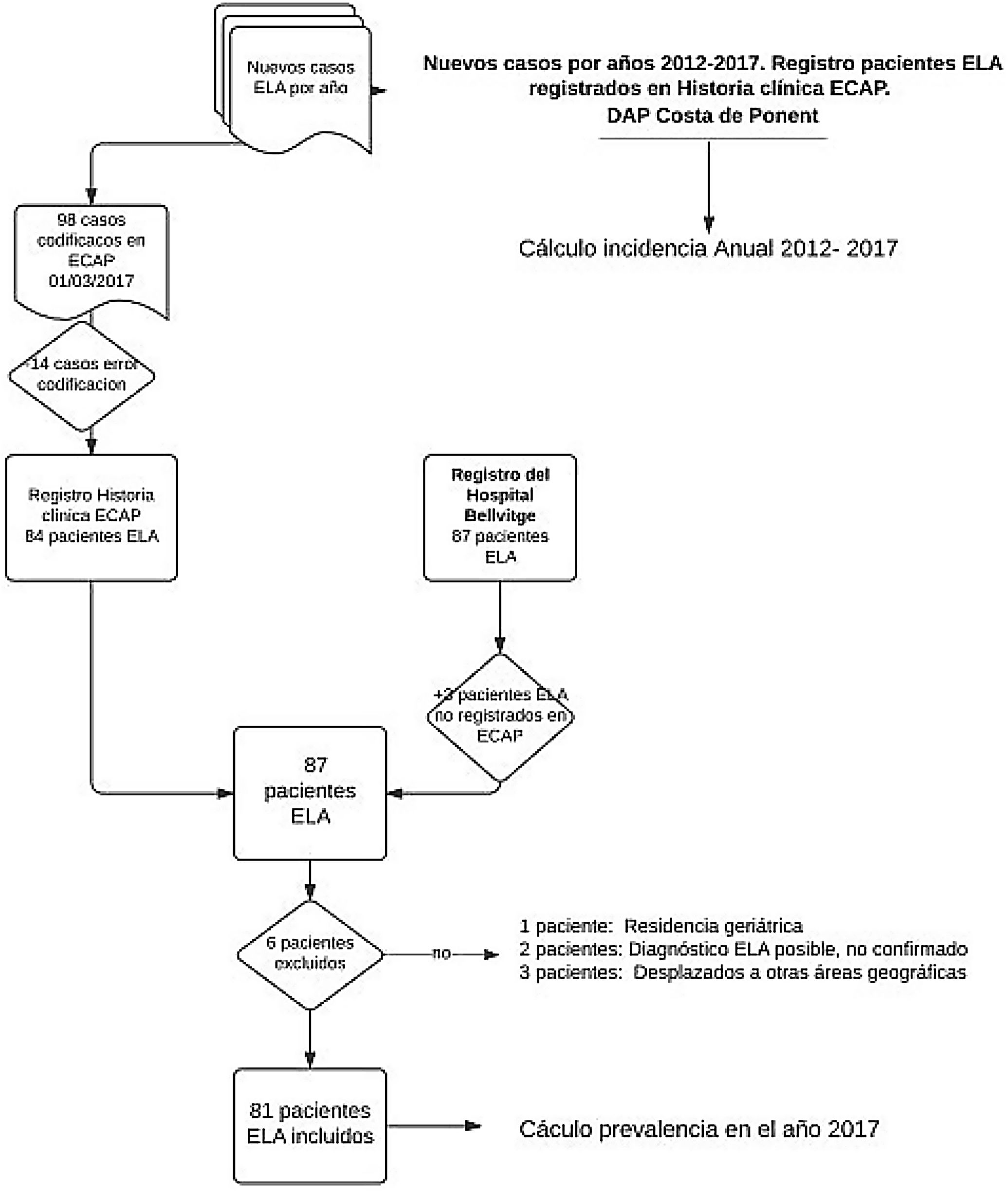
Material y métodosEstudio descriptivo transversal que incluye a pacientes vivos diagnosticados de ELA y residentes en el ámbito de estudio hasta el 1 de marzo 2017. El ámbito corresponde al territorio de la Dirección de AP (DAP) Costa de Ponent que se encuentra sectorizada en tres Servicios de AP (SAP) con más de 1,3 millones de habitantes, 68 municipios y una extensión de 1.400km.
Las fuentes de información a fecha 1 de marzo 2017 han sido: la historia clínica informatizada de Atención Primaria (ECAP) del territorio analizado y el registro de historias clínicas de la Unidad Funcional de Enfermedad de Motoneurona del Hospital de Bellvitge, Hospitalet de Llobregat, Barcelona.
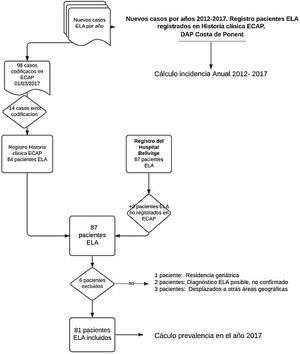
Los criterios de inclusión fueron tener diagnóstico registrado de ELA (G12.2) en la ECAP. Se excluyeron los pacientes con diagnóstico no confirmado, los pacientes no residentes y los ingresados en centros geriátricos.
Las variables recogidas fueron: edad, sexo, población de residencia, forma de inicio de la enfermedad, intervalo entre inicio de síntomas y diagnóstico, portadores de PEG, VNI o ventilación invasiva, identificación PCC o PCA/MACA en ECAP, identificación o seguimiento por gestor/a de casos, inclusión en los programas de atención domiciliaria (PAD): ATDOM y/o PADES y atención por la unidad multidisciplinar hospitalaria.
Para el estudio de incidencia de los años 2012 al 2017 se revisaron los registros de la ECAP de los casos nuevos durante años completos.
Todos los pacientes estudiados vivos a fecha 01/03/2017, firmaron el consentimiento informado mayoritariamente en la Unidad Funcional de Enfermedad de Motoneurona del Hospital de Bellvitge, Hospitalet de Llobregat, Barcelona. El estudio fue aprobado por el Comité de Ética en investigación clínica del Institut d’Investigació en Atenció PrimàriaJordi Gol de Barcelona (P17/005). Se siguieron las normas de buena práctica de investigación de la declaración de Helsinki y su actualización de la Asamblea de Fortaleza (Brasil) en 2013. Los datos de la información fueron anonimizados y tratados de forma confidencial conforme a la Ley Orgánica 3/2018, de 5 de diciembre, de Protección de Datos Personales y garantía de derechos digitales.
Análisis estadísticoLos resultados de variables cualitativas se expresan mediante frecuencias absolutas y porcentajes, y los resultados de las variables cuantitativas se presentan utilizando estadísticos de tendencia central y de dispersión como medias (desviación estándar [DE]) y medianas (1.er y 3.er cuartil). La significación estadística de las diferencias entre proporciones se realiza mediante el test de la χ2 de Pearson. Las medias de grupos independientes se comparan con la prueba de t de Student. Para estudiar la diferencia de medianas se utiliza la U de Mann-Whitney. El test exacto de Fischer se ha utilizado para estudiar la asociación entre variables cualitativas. Se consideraron estadísticamente significativas las diferencias con valores de p <0,05.
Para el cálculo de la prevalencia puntual a fecha 1 de marzo 2017, se contabiliza el número de casos registrados respecto a la totalidad de la población y respecto a los mayores de 18 años según el Instituto Nacional de Estadística. El cálculo de la incidencia se realiza mediante el recuento de los nuevos casos registrados para los años 2012-2017 en relación con la población según el Instituto Nacional de Estadística.
En el análisis estadístico se utiliza la versión 21 del programa el Statistics SSPSS de IBM para Windows.
ResultadosDe acuerdo con los criterios de exclusión se rechazaron del estudio 14 pacientes con código G12.2 en la ECAP que no corresponden al diagnóstico de ELA. Por otro lado, se agregan 3 pacientes con diagnóstico de ELA del registro hospitalario sin codificar en ECAP.
Se incluyen en el análisis los 81 casos registrados como pacientes ELA vivos a fecha 1 de marzo 2017 (tabla 1) y se detallan sus características clínicas como media de edad, sexo, forma de inicio de la enfermedad, periodo de tiempo entre inicio de síntomas y confirmación del diagnóstico de ELA.
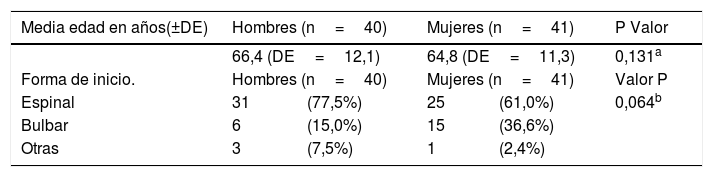
Características clínico-asistenciales de los pacientes afectos de ELA
| Media edad en años(±DE) | Hombres (n=40) | Mujeres (n=41) | P Valor | ||
|---|---|---|---|---|---|
| 66,4 (DE=12,1) | 64,8 (DE=11,3) | 0,131a | |||
| Forma de inicio. | Hombres (n=40) | Mujeres (n=41) | Valor P | ||
| Espinal | 31 | (77,5%) | 25 | (61,0%) | 0,064b |
| Bulbar | 6 | (15,0%) | 15 | (36,6%) | |
| Otras | 3 | (7,5%) | 1 | (2,4%) | |
| Tiempo entre inicio síntomas y confirmación de diagnóstico (meses) | Hombres n=34 | Mujeres n=30 | P Valor | ||
|---|---|---|---|---|---|
| < 1 año | 15 | (44,1%) | 12 | (40,0%) | 0,936c |
| 1 año | 11 | (32,4%) | 10 | (33,3%) | |
| >1 año | 8 | (23,5%) | 8 | (26,7%) | |
DE: desviación estándar; n: número de casos con este registro en historia clínica.
En estos 81 pacientes se observa que la edad de inicio de la enfermedad se sitúa en los 65 años sin diferencias entre sexos. Respecto a la forma clínica de inicio, la más frecuente es la forma espinal y en mujeres hay una mayor frecuencia de la presentación bulbar sin diferencias significativas.
El tiempo transcurrido entre el inicio de los síntomas hasta la confirmación diagnóstica se sitúa en torno a los 12 meses sin diferencias entre sexos.
La proporción de pacientes con ELA incluidos en PAD es 35,8% (29 pacientes) y su identificación en el programa de cronicidad del 13,6% (11 pacientes).
El 14,8% (12 pacientes) utilizan PEG, de estos son identificados como PCC/MACA el 41,7% (p=0,009) y en el 75% están incluidos en PAD (p=0,002).
El 29,6% (24 pacientes) son portadores de VNI, de estos están incluidos en PAD el 58,6% (p=0,006) y un 16,7% están identificados como PCC/MACA (p=0,599).
Ningún paciente ha precisado ventilación invasiva.
En relación con el modelo atención hospitalaria, el 97,5% (79 pacientes) son atendidos por Unidad Funcional de Enfermedad de Motoneurona del Hospital de Bellvitge, Hospitalet de Llobregat, Barcelona y solo el 2,5% (2 pacientes) son atendidos por el Servicio de Neurología en Hospital Comarcal.
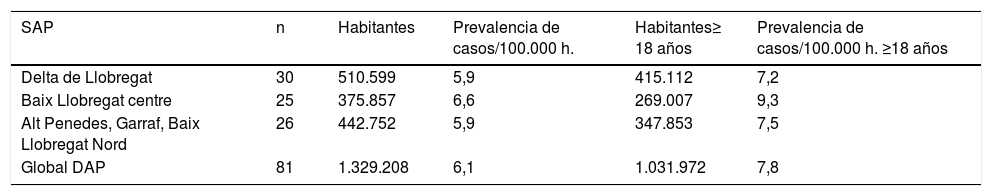
En la tabla 2 se presentan todos los casos distribuidos por territorios analizados a fecha 1 de marzo 2017 para el análisis de la prevalencia, por población global y en ≥ 18 años.
Prevalencia de casos por áreas territoriales de gestión
| SAP | n | Habitantes | Prevalencia de casos/100.000 h. | Habitantes≥ 18 años | Prevalencia de casos/100.000 h. ≥18 años |
|---|---|---|---|---|---|
| Delta de Llobregat | 30 | 510.599 | 5,9 | 415.112 | 7,2 |
| Baix Llobregat centre | 25 | 375.857 | 6,6 | 269.007 | 9,3 |
| Alt Penedes, Garraf, Baix Llobregat Nord | 26 | 442.752 | 5,9 | 347.853 | 7,5 |
| Global DAP | 81 | 1.329.208 | 6,1 | 1.031.972 | 7,8 |
DAP: Dirección de Atención Primaria; h.: habitantes; n: número de casos; SAP: Servicio de Atención Primaria.
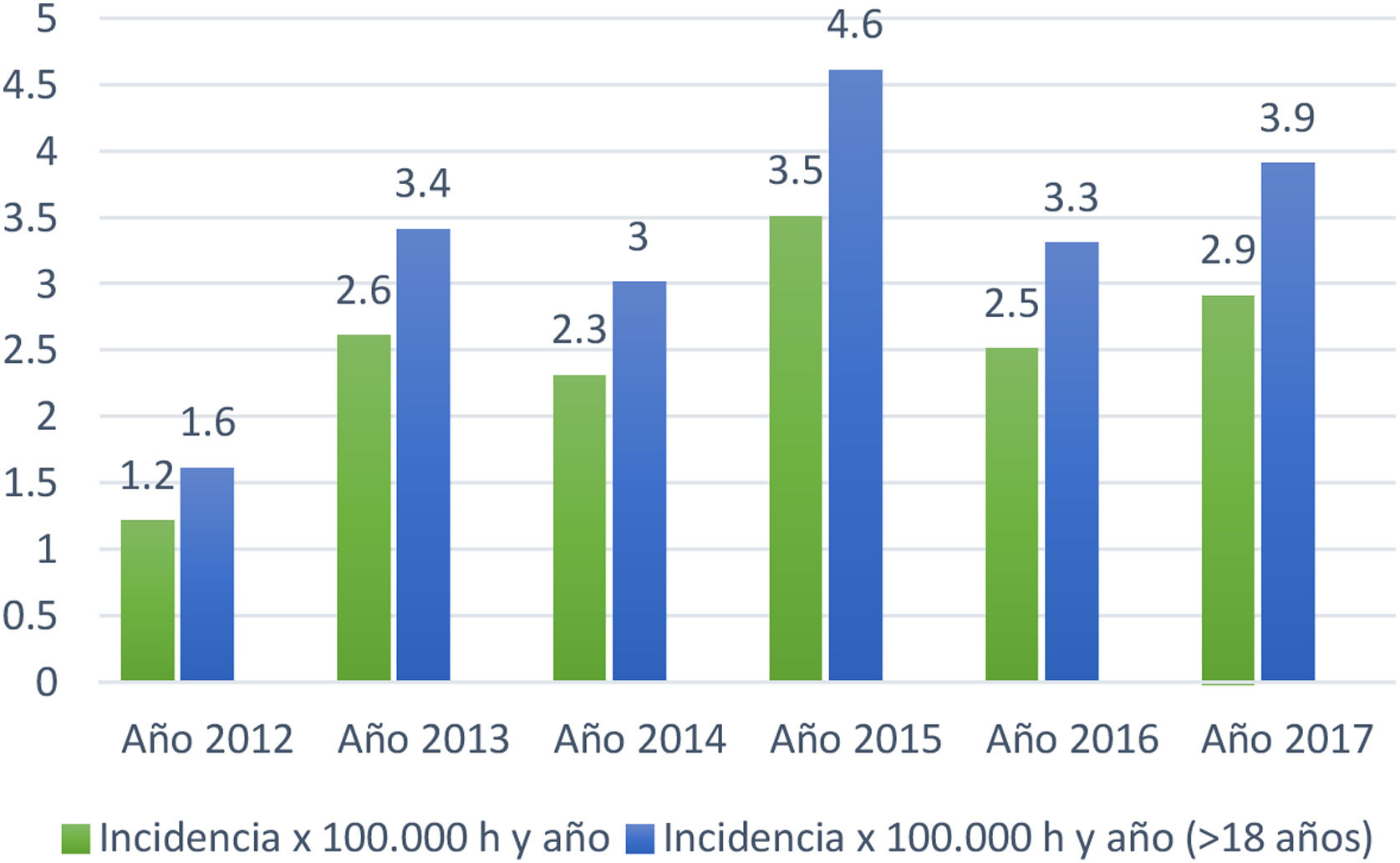
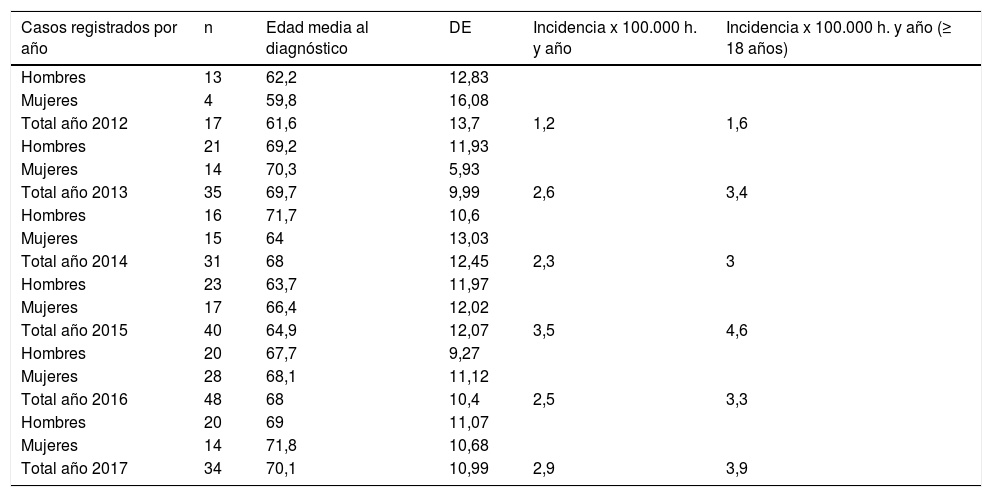
Sobre la incidencia de los años 2012 al 2017 se detectaron 231 pacientes en los registros de la ECAP identificados con el código G12.2. Se excluyeron 26 casos con error en el diagnóstico resultando un total de 205 pacientes confirmados con ELA (113 hombres y 92 mujeres) (1,2 hombres/1 mujer) (tabla 3).
Distribución por sexo, edad media de inicio y años según el registro en la ECAP
| Casos registrados por año | n | Edad media al diagnóstico | DE | Incidencia x 100.000 h. y año | Incidencia x 100.000 h. y año (≥ 18 años) |
|---|---|---|---|---|---|
| Hombres | 13 | 62,2 | 12,83 | ||
| Mujeres | 4 | 59,8 | 16,08 | ||
| Total año 2012 | 17 | 61,6 | 13,7 | 1,2 | 1,6 |
| Hombres | 21 | 69,2 | 11,93 | ||
| Mujeres | 14 | 70,3 | 5,93 | ||
| Total año 2013 | 35 | 69,7 | 9,99 | 2,6 | 3,4 |
| Hombres | 16 | 71,7 | 10,6 | ||
| Mujeres | 15 | 64 | 13,03 | ||
| Total año 2014 | 31 | 68 | 12,45 | 2,3 | 3 |
| Hombres | 23 | 63,7 | 11,97 | ||
| Mujeres | 17 | 66,4 | 12,02 | ||
| Total año 2015 | 40 | 64,9 | 12,07 | 3,5 | 4,6 |
| Hombres | 20 | 67,7 | 9,27 | ||
| Mujeres | 28 | 68,1 | 11,12 | ||
| Total año 2016 | 48 | 68 | 10,4 | 2,5 | 3,3 |
| Hombres | 20 | 69 | 11,07 | ||
| Mujeres | 14 | 71,8 | 10,68 | ||
| Total año 2017 | 34 | 70,1 | 10,99 | 2,9 | 3,9 |
DE: desviación estándar; h: habitantes; n: número de casos.
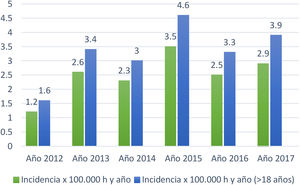
La tasa de incidencia anual promedio de los 6 años fue de 2,5/100.000 habitantes/año en todas las edades y de 3,3/100.000 habitantes/año en ≥ 18 años (fig. 1).
DiscusiónEl presente estudio presenta algunas limitaciones que son propias de las características de este tipo de análisis descriptivo y que estarían asociadas a la calidad y cantidad de los registros sanitarios22. En este caso, los datos proceden de varias fuentes y puede existir ausencia de información registrada o de inexactitudes iniciales. No obstante, esta es una limitación imputable a la mayoría de los estudios publicados en este ámbito.
En el presente estudio se muestran algunas características propias de los pacientes afectos de ELA, las necesidades habituales de cuidados que precisan y que son de interés para los médicos de familia. También destacan nuevos resultados sobre la prevalencia e incidencia de estos pacientes en el área geográfica de estudio.
Las características demográficas como edad, distribución por sexos o formas clínicas de inicio no presentan diferencias respecto a otros estudios en países desarrollados1,2,8,9.
El tiempo transcurrido entre el inicio de los síntomas y el diagnóstico de ELA supera los 12 meses. Este tiempo de retraso es similar a lo publicado por otros autores en países desarrollados. Este retraso se ha atribuido a factores propios de la enfermedad en sus inicios, sin asociarse a peculiaridades de los sistemas sanitarios analizados8,9. No obstante, se trata de uno de los elementos que genera mayor preocupación entre los sanitarios y entre los afectados y sus familiares. Por otro lado, genera controversias al tratarse de un aspecto que aparece frecuentemente en los medios de comunicación general. Para reducir este retraso es de vital importancia la implicación del médico de familia en la detección precoz de la ELA. De aquí la importancia de llamar su atención para que tenga en cuenta esta enfermedad dentro del diagnóstico diferencial cuando se encuentre ante pacientes con síntomas neuromusculares inespecíficos.
Sobre el análisis de la integración de estos pacientes en los programas de cronicidad en AP, el presente estudio muestra una baja proporción de pacientes identificados como PCC/MACA y una ligera mayor integración en los PAD (ATDOM-PADES). Este aspecto pone de manifiesto la necesidad de mejorar la coordinación entre AP y hospital. También se observa que la necesidad de dispositivos de ayuda para la alimentación y ventilación, como es el caso de PEG y en menor proporción la VNI, se han mostrado como factores relevantes para la identificación e inclusión de estos pacientes en los programas de cronicidad.
A diferencia de lo esperado, la variable del tiempo de evolución de la enfermedad no se ha mostrado como un factor relevante para la inclusión en los programas de AD ni en su identificación como PCC-MACA. Esto podría explicarse porque en la actualidad, a partir de la confirmación del diagnóstico y en los estadios iniciales, el seguimiento de estos pacientes se realiza por las unidades multidisciplinares hospitalarias cuando estas existen, como es el caso del entorno sanitario donde se ha realizado el estudio.
El modelo de atención hospitalaria de estos pacientes en esta área de gestión es mayoritariamente el modelo de atención en una unidad multidisciplinar hospitalaria, siguiendo las recomendaciones de las guías internacionales15–17.
Por todo ello, opinamos que debe considerarse la realización de rutas asistenciales o vías clínicas de forma coordinada entre AP y los servicios hospitalarios. Estas rutas pueden ayudar a la identificación precoz de los pacientes y a su inclusión en los programas de cronicidad y que permita mejorar la atención de forma integrada y continuada. Estos equipos de AP están formados por profesionales de los servicios sanitarios y de los servicios sociales que garantizan la continuidad en los cuidados con la máxima participación del paciente y de su entorno familiar16–18.
La prevalencia encontrada es mayor que en el estudio previo en la misma área geográfica4 y esta resulta ser un 44,4% superior (7,8 versus 5,4/100.000 habitantes ≥ 18 años). Este aumento parece asociarse al crecimiento de las tasas de supervivencia que han podido aportar la creación de las unidades multidisciplinares específicas y, probablemente, también a la incorporación de la VNI de una forma precoz13,14.
Respecto a la incidencia, destaca una distribución por sexos con una tasa mayor en el sexo femenino de la esperada4. La incidencia global es 2,5 veces más elevada que en la publicación utilizada como referencia en el entorno del presente estudio4. Aumenta de 1,4 a 3,3/100.000 habitantes/año en personas ≥18 años. Esta mayor incidencia podría deberse a que en el estudio de referencia analizaron el periodo 1999-2001 y en el presente estudio el periodo analizado (2012-2017) es 11 años más tarde.
Entre los factores que pueden justificar el aumento de la incidencia respecto a estudios previos están, además de un mayor número de casos, también pueden influir otros factores como el incremento de la sospecha diagnóstica y la mejora en los sistemas de registro e identificación de los pacientes en las historias electrónicas (ECAP). También hay que destacar la posibilidad de que exista un mejor registro de casos en el periodo 2012-2017 dado que el análisis de la incidencia se calcula con los datos recogidos de la ECAP22.
La relevancia del presente estudio se puede centrar en que ha permitido actualizar datos de prevalencia e incidencia que han estado poco analizados en esta área y que los resultados muestran cifras superiores a las previas en el área de estudio. También ha permitido obtener datos asociados a la identificación en el programa de cronicidad. A partir de ellos se pueden promover recomendaciones para la práctica clínica y políticas de salud para las personas afectas de ELA.
Como conclusión, el presente estudio actualiza los datos de características clínicas observando que utilizar PEG en la ELA favorece la identificación como PCC/MACA e inclusión en PAD y que utilizar VNI favorece la inclusión en PAD, así como datos de incidencia y prevalencia de la ELA que son superiores a los descritos previamente en la misma área. Además, muestra características sobre su integración e identificación en los actuales programas de cronicidad gestionados por AP que evidencia necesidades de mejora que pueden repercutir en los pacientes diagnosticados de ELA y de sus familiares.
Son necesarios nuevos estudios más amplios y complejos que amplíen áreas geográficas y contrasten los resultados del presente estudio.
- •
La esclerosis lateral amiotrófica (ELA), sigue siendo una enfermedad sin tratamiento curativo en la actualidad y con un alto grado de incapacidad y dependencia.
- •
Conocer las características de estos pacientes tiene interés en la práctica clínica diaria de Atención Primaria, así como la identificación en los programas de cronicidad e inclusión en programas de atención domiciliaria.
- •
La atención centrada en una unidad multidisciplinar hospitalaria de estos pacientes mejora la calidad de vida y la supervivencia.
- •
Existe una mayor incidencia y prevalencia a la esperada de personas afectas de ELA en el área de estudio.
- •
Evidencias sobre el retraso entre el inicio de síntomas y el diagnóstico que son semejantes a las descritas en la literatura.
- •
Nuevas evidencias sobre las características de estos pacientes que están poco registrados en los programas de cronicidad y que orienta a la necesidad de una mayor coordinación asistencial entre Atención Primaria y Atención Hospitalaria.
Los autores declaran no tener ningún conflicto de intereses.
Al Dr. Lluis Esteve, director de la SAP Delta que ha apoyado la realización de este trabajo. A la Fundació Miquel Valls por su apoyo incondicional.