Evaluar la influencia del resultado de la prueba rápida de diagnóstico para la identificación del antígeno estreptocócico en infecciones faringoamigdalares pediátricas, en términos de mejora de la adherencia a la terapia antibiótica.
DiseñoEnsayo clínico comunitario de dos grupos de estudio con asignación aleatoria.
EmplazamientoCentros de atención primaria de Cataluña Central.
ParticipantesEn el estudio se incluyeron a pacientes de tres a 15 años por muestreo consecutivo, que fueron atendidos por sospecha de infección faringoamigdalar en las consultas pediátricas entre noviembre del 2010 y febrero del 2011. De 557 pacientes que satisficieron los criterios de inclusión, se hizo seguimiento a 519.
IntervenciónEl grupo control siguió el algoritmo diagnóstico y terapéutico habitual. Al grupo de intervención, se le realizó adicionalmente la prueba diagnóstica rápida de detección del antígeno estreptocócico y se indicó tratamiento según el resultado.
Mediciones principalesEvaluación de la adherencia, los motivos de no adherencia y los factores de riesgo sociodemográficos mediante una encuesta telefónica.
ResultadosSe prescribió antibiótico al 65,6% y los pediatras del grupo control fueron más propensos a recetar antibióticos que los del grupo intervención (88,5 vs. 45,5%, p< 0,001). El 64,8% de los pacientes siguió las indicaciones del tratamiento, siendo la causa principal de no adherencia no cumplir el horario (25,6%). La adherencia terapéutica fue superior en el grupo de intervención (68%) que en el de control (62,9%), no existiendo una diferencia significativa.
ConclusionesLa prueba rápida del diagnóstico para la identificación de estreptococo, complementaria al uso de los criterios Centor evita la prescripción innecesaria de tratamiento antibiótico, aunque no ha demostrado mejorar la adherencia terapéutica.
To evaluate the influence of the result of a rapid streptococcal antigen test in paediatric pharyngotonsillitis infections, in terms of improvement of antibiotic therapy adherence.
DesignRandomized community clinical trial with two study groups.
LocationPrimary Care Centers in Central Catalonia.
ParticipantsPatients aged from 3 to 15 years, who were attended at paediatric consultations on suspicion of pharyngotonsillitis caused by an infection between November 2010 and February 2011 (both included), were included in the study on a consecutive basis. 557 patients met the inclusion criteria and 519 were evaluated.
InterventionThe control group received the usual diagnostic-therapeutic algorithm. Rapid streptococcal antigen test was additionally performed to experimental group participants and it was indicated the more convenient treatment.
Main measurementsAntibiotic adherence, non-adherence causes and socio-demographic risk factors were evaluated via telephone survey.
ResultsAntibiotics were prescribed to 65.6% and paediatricians of the control group were more likely to prescribe antibiotic than the ones in the intervention group (88.5% vs 45.5%, p< 0.0001). 64.8% followed doctor's treatment orders, being failure following medication scheduling the main cause of non-adherence (25.6%). Medication adherence was higher in the experimental group (68%) than in the control group (62.9%) but no significant differences were found.
ConclusionRapid strep test, complementing the use of Centor Criteria avoids unnecessary antibiotics prescriptions, but had not been proven to be effective in increasing medication adherence.
La adherencia terapéutica se define como el grado de coincidencia o concordancia del comportamiento de un paciente en relación con la prescripción médica. La adherencia que se considera aceptable es del 80% o superior1, sin embargo, en un metanálisis del 2005 se observó que el cumplimiento respecto a los antibióticos es del 62,2%2. Esta poca adherencia es motivo de una falta de efectividad del tratamiento prescrito y, en el caso concreto de los antibióticos y desde una perspectiva comunitaria, supone un problema de salud pública por la posibilidad emergente de resistencias antibióticas. En España, mueren aproximadamente 3.000 personas al año a causa de infecciones hospitalarias provocadas por bacterias resistentes3 y en el mundo se atribuyen 700.000 muertes anuales a esta causa4. Si no se toman medidas de carácter urgente, se estima que en 2050 la cifra de muertes anuales atribuibles a infecciones multiresistentes podría ascender a los 10 millones a nivel mundial, superando el número actual de muertes anuales por cáncer4.
Según información de la Base de datos para la Investigación Farmacoepidemiológica en Atención Primaria (BIFAP) actualizados en 2008, el diagnóstico primario con mayor prescripción de antibióticos en España fue la infección del tracto respiratorio (ITR) y el 49% de los usuarios a los que se les prescribió antibiótico fueron diagnosticados con alguna de estas5. Entre las ITR, la faringoamigdalitis es una de las más frecuentes, con una prevalencia del 18 al 20,4%6,7. En atención pediátrica, el 75% de las faringoamigdalitis son tratadas con antibióticos6, y en adultos, el 88,9% de las amigdalitis y el 18,3% de las faringitis agudas8, pese a que estas patologías no deberían tratarse de forma sistemática con estos9, ya que únicamente el 37 al 50% de las faringoamigdalitis en infantes y el 15 al 25% en adultos tienen una etiología bacteriana10,11.
El estándar para el diagnóstico de la faringoamigdalitis consiste en averiguar si es de origen viral o bacteriano siendo el Streptococcus pyogenes (EbhGA) el agente principal causante de la faringoamigdalitis bacteriana. La infección causada por este requiere la prescripción de antibiótico ya que acorta la transmisión y diseminación de la bacteria a la comunidad, reduce la sintomatología con respecto al grupo no tratado una media de 16 horas y ayuda a prevenir las complicaciones supurativas y no supurativas12.
La incertidumbre en el proceso del diagnóstico es una de las principales razones de prescripción innecesaria de antibióticos en atención primaria. Por consiguiente, uno de los objetivos del Plan Nacional frente a la Resistencia a los Antibióticos 2019-2021 (PRAN) es promover el uso racional de métodos de diagnóstico rápido13. En el documento de consenso del 2011, sobre el diagnóstico y tratamiento de la faringoamigdalitis, las pruebas de detección rápida de antígeno estreptocócico (PDR) y el cultivo de muestra faringoamigdalar se consideran no definitivas para su detección, ya que el paciente podría padecer una infección viral y ser portador de EbhGA14. Debido a lo anterior y, a que el resultado del cultivo puede demorarse 48 a 72 h, en la práctica clínica, se utilizan habitualmente los criterios clínicos para identificar a los pacientes que necesitan una prueba complementaria y tratamiento antibiótico15.
En este sentido, para el diagnóstico de la faringoamigdalitis los criterios de Centor son los más conocidos y se dividen en cuatro puntos: historia o presencia de fiebre ≥ 38°C, inflamación o exudado faringoamigdalar, adenopatías laterocervicales dolorosas y ausencia de tos. Los criterios de McIsaac, basados en los de Centor, incluyen la variable edad entre tres a 14 años, ya que la faringitis estreptocócica presenta una máxima incidencia entre los cinco y los 15 años16. Hay disparidad en cuanto al valor práctico de esta puntuación ya que tiene una elevada especificidad y valor predictivo negativo, pero menor valor predictivo positivo. La probabilidad de faringoamigdalitis estreptocócica se estima del 30 al 56% en puntuaciones en la escala de Centor ≥ 314.
Las escalas de predicción clínica no deben ser utilizadas para la decisión de instaurar antibioterapia empírica14. No obstante, según un análisis del 2017 que incluyó casos diagnosticados de faringoamigdalitis, de los pacientes menores de 14 años a los que se prescribió antibiótico (54,69%), únicamente se efectuó la PDR al 10,33%, mostrando que algunos pediatras no la realizaban a pesar de que los pacientes obtenían puntuaciones altas en la escala de Centor17.
La mayor parte de estudios sobre adherencia al tratamiento son de patologías crónicas. En un estudio sobre la asociación de la adherencia terapéutica y la PDR en adultos, se observaron mejores resultados en el grupo de pacientes a los que se les realizó la PDR18. En estudios sobre la adherencia al tratamiento antibiótico en general en población infantil se observó que el 44,4 al 65,7% de infantes cumplieron correctamente el tratamiento prescrito19,20.
Ante la posibilidad de utilizar una prueba de diagnóstico rápido del EbhGA para orientar en la toma de decisiones en la práctica clínica sobre la etiología y el tratamiento de la patología infecciosa faringoamigdalar, se planteó un programa de implantación de la PDR vinculado a un proyecto de investigación con el fin de estudiar su efectividad clínica.
El objetivo principal de este este estudio fue evaluar la influencia del resultado de la prueba diagnóstica rápida para identificar el EbhGA en las infecciones faringoamigdalares, en términos de mejora de la adherencia a la terapia antibiótica, en las consultas de pediatría de atención primaria del Instituto Catalán de la Salud de la Cataluña Central.
Los objetivos secundarios del estudio fueron: 1) describir la relación entre la puntuación de Centor, el resultado de la prueba diagnóstica rápida de EbhGA y la prescripción de tratamiento antibiótico; 2) describir el grado de adherencia terapéutica global de la población infantil al antibiótico prescrito en la patología faringoamigdalar y 3) describir los motivos de no adherencia terapéutica al antibiótico en la población del estudio.
Material y métodosDiseño del estudioSe diseñó un ensayo clínico comunitario con dos grupos de estudio. Los pacientes participantes se seleccionaron por muestreo consecutivo y la asignación a los grupos fue de forma aleatoria. En el estudio participaron 27 pediatras de diferentes dispositivos y recursos asistenciales de atención primaria pediátrica del Instituto Catalán de la Salud adscritos a la Gerencia Territorial de la Cataluña Central. La participación de los pediatras en el estudio se hizo por conveniencia (se presentó el estudio en las reuniones locales de pediatría y se les invitó a participar de forma voluntaria y por escrito, aceptándose a los facultativos clínicos interesados). El estudio se efectuó entre noviembre del 2010 y febrero del 2011, ambos inclusive.
El estudio fue aprobado por el Comité de Ética de la Fundación Jordi Gol i Gurina (P10/61) y cuenta con los consentimientos informados por escrito de los padres o tutores legales de los pacientes para su participación en el estudio, así como el consentimiento informado de los pacientes mayores de 14 años. Los datos extraídos en el estudio son anónimos y fueron tratados con confidencialidad estricta, siguiendo en todo momento los principios éticos de la Declaración de Helsinki de 1964, revisados en 2013 por la Organización Mundial de la Salud (OMS). El estudio cumple con el Reglamento Europeo de Protección de Datos – Reglamento (UE) 2016/679 de 27 de abril (GDPR) y la Ley Orgánica 3/2018, de 5 de diciembre, de Protección de Datos Personales y garantía de los derechos digitales.
Población de estudio. Criterios de inclusión y exclusiónLa población de estudio fueron pacientes con edades comprendidas entre los tres y 15 años, atendidos en las consultas pediátricas por sospecha de patología faringoamigdalar de origen infeccioso (odinofagia y fiebre), en la región de la Cataluña Central.
Se excluyeron del estudio los sujetos que presentasen una sintomatología catarral sugestiva de virasis. Debido a que el desarrollo del proyecto contempló un seguimiento telefónico, se excluyeron los pacientes cuyo padre, madre, tutor o responsable no fuera competente para expresarse en las lenguas propias del país (catalán/castellano) o no pudiera facilitar un teléfono donde recibir la llamada de seguimiento.
Tamaño muestralLa determinación del tamaño de la muestra se estimó con la calculadora online GRANMO21, con un riesgo alfa de 0,05, un riesgo beta inferior al 0,2 en un contraste bilateral y asumiendo una pérdida de seguimiento del 20%. Teniendo en cuenta que el grado de adherencia al tratamiento antibiótico es del 62,2%2, se requieren 203 sujetos por grupo para detectar una diferencia igual o superior al 15% entre el grupo control y el grupo intervención.
MetodologíaCuando un pediatra, en el ejercicio de su actividad asistencial cotidiana, identificaba a un paciente susceptible de ser incluido en el estudio, verificaba que cumplía los criterios de inclusión y en ese punto, procedía a informar al paciente y su padre, madre o tutor sobre la existencia del estudio y los invitaba a participar y a expresar su consentimiento. También se solicitó el consentimiento escrito de los pacientes de entre 12 y 15 años. Si aceptaban participar, se les asignaba aleatoriamente al grupo intervención o al grupo control.
El pediatra fue ciego a la intervención hasta el momento en el que el paciente participaba, pero no lo fue durante la fase de hacer el diagnóstico y finalización de la visita, debido a las características del diseño del estudio. La persona que realizó la evaluación de la adherencia al tratamiento antibiótico mediante una encuesta telefónica fue ciega a la intervención, ya que no conocía a qué grupo pertenecía el paciente.
Los datos se analizaron siguiendo las guías CONSORT (tabla 1). Se creó una base de datos con el programa SPSS y se empleó la prueba de X2 de Pearson para analizar la relación entre las variables categóricas. Se fijó un nivel de significación estadística del 5%.
Lista de ítems CONSORT
| Section/topic | Item No. | Checklist item | Reported on page |
|---|---|---|---|
| Title and abstract | |||
| 1a | Identification as a randomised trial in the title. | 3 | |
| 1b | Structured summary of trial design, methods, results, and conclusions. | 4,5 | |
| Introduction | |||
| Background and objectives | 2a | Scientific background and explanation of rationale. | 6,7 |
| 2b | Specific objectives or hypotheses. | 7,8 | |
| Methods | |||
| Trial design | 3a | Description of trial design (such as parallel, factorial) including allocation ratio. | 8 |
| 3b | Important changes to methods after trial commencement (such as eligibility criteria), with reasons. | Not applicable | |
| Participants | 4a | Eligibility criteria for participants. | 8 |
| 4b | Settings and locations where the data were collected. | 8 | |
| Interventions | 5 | The interventions for each group with sufficient details to allow replication, including how and when they were actually administered. | 8,9 |
| Outcomes | 6a | Completely defined pre-specified primary and secondary outcome measures, including how and when they were assessed. | Table 210, Table 2 |
| 6b | Any changes to trial outcomes after the trial commenced, with reasons. | Not applicable | |
| Sample size | 7a | How sample size was determined. | 8 |
| 7b | When applicable, explanation of any interim analyses and stopping guidelines. | Not applicable | |
| Randomisation: | |||
| Sequence generation | 8a | Method used to generate the random allocation sequence. | 9 |
| 8b | Type of randomisation; details of any restriction (such as blocking and block size). | 8,9 | |
| Allocation concealment mechanism | 9 | Mechanism used to implement the random allocation sequence (such as sequentially numbered containers), describing any steps taken to conceal the sequence until interventions were assigned. | 9 |
| Implementation | 10 | Who generated the random allocation sequence, who enrolled participants, and who assigned participants to interventions. | 9 |
| Blinding | 11a | If done, who was blinded after assignment to interventions (for example, participants, care providers, those assessing outcomes) and how. | 9,10 |
| 11b | If relevant, description of the similarity of interventions. | Not applicable | |
| Statistical methods | 12a | Statistical methods used to compare groups for primary and secondary outcomes. | 9 |
| 12b | Methods for additional analyses, such as subgroup analyses and adjusted analyses. | Not applicable | |
| Results | |||
| Participant flow (a diagram is strongly recommended) | 13a | For each group, the numbers of participants who were randomly assigned, received intended treatment, and were analysed for the primary outcome. | 10, 11, Fig. 1 |
| 13b | For each group, losses and exclusions after randomisation, together with reasons. | 12, Fig. 1 | |
| Recruitment | 14a | Dates defining the periods of recruitment and follow-up. | 8 |
| 14b | Why the trial ended or was stopped. | Not applicable | |
| Baseline data | 15 | A table showing baseline demographic and clinical characteristics for each group. | Table 3 |
| Numbers analysed | 16 | For each group, number of participants (denominator) included in each analysis and whether the analysis was by original assigned groups. | Table 310, 11, Table 3 |
| Outcomes and estimation | 17a | For each primary and secondary outcome, results for each group, and the estimated effect size and its precision (such as 95% confidence interval). | 12,13,14,15 |
| 17b | For binary outcomes, presentation of both absolute and relative effect sizes is recommended. | Not applicable | |
| Ancillary analyses | 18 | Results of any other analyses performed, including subgroup analyses and adjusted analyses, distinguishing pre-specified from exploratory. | Not applicable |
| Harms | 19 | All important harms or unintended effects in each group. | Not applicable |
| Discussion | |||
| Limitations | 20 | Trial limitations, addressing sources of potential bias, imprecision, and, if relevant, multiplicity of analyses. | 13 |
| Generalisability | 21 | Generalisability (external validity, applicability) of the trial findings. | Not applicable |
| Interpretation | 22 | Interpretation consistent with results, balancing benefits and harms, and considering other relevant evidence. | 12, 13 |
| Other information | |||
| Registration | 23 | Registration number and name of trial registry. | 5 |
| Protocol | 24 | Where the full trial protocol can be accessed, if available. | Available on request |
| Funding | 25 | Sources of funding and other support (such as supply of drugs), role of funders | 11 |
Con respecto al grupo de control, en la consulta, el pediatra llevó a cabo la práctica clínica habitual ante una infección de origen amigdalar (criterios de Centor). Los pacientes atendidos asignados a este grupo recibieron la información verbal y el tratamiento habitual en las condiciones habituales de diagnóstico y prescripción.
A los pacientes del grupo de intervención, además del diagnóstico clínico clásico (criterios de Centor), también se les efectuó la PDR. Para la realización de esta prueba se siguieron las indicaciones del fabricante para la obtención de una muestra del exudado faringoamigdalar. El pediatra mostró y explicó el significado del resultado obtenido con la prueba a los tutores del infante y reforzó con su palabra las implicaciones derivadas, incidiendo explícitamente en la recomendación terapéutica antibiótica cuando fue necesaria. Por este motivo, todos los pediatras que aceptaron participar en el estudio recibieron una formación específica sobre el modus operandi de la prueba y las recomendaciones verbales.
Al finalizar el diagnóstico, tanto en el grupo control como en el de intervención, el pediatra recogió una serie de datos clínicos y sociodemográficos del paciente mediante un cuestionario, además de la información de contacto para su posterior evaluación (tabla 2).
Variables independientes del estudio
| Grupo de aleatorización: intervención o control |
| Criterios Centor: historia o presencia de fiebre 38 °C, inflamación o exudado faringoamigdalar, adenopatías laterocervicales dolorosas y ausencia de tos. |
| Resultado de la prueba rápida del grupo intervención: positivo/negativo |
| Edad del paciente |
| Datos asistenciales: Área, fecha de la visita, hora de visita y pediatra que lo ha visitado |
| Nivel de estudios más alto de los padres: sin estudios/estudios primarios/estudios secundarios/estudios superiores |
| Lugar de nacimiento del paciente y los padres |
| Número de hermanos del paciente |
A los 12 días de la visita, se evaluó la adherencia terapéutica antibiótica mediante una encuesta telefónica al padre, madre, tutor o responsable del paciente, al que se le realizaron una serie de preguntas para valorar si el paciente cumplió el tratamiento antibiótico indicado por el médico en términos de días de terapia, número de dosis, período de tiempo entre dosis y cantidad de esta. A los acompañantes de los pacientes a los que se les indicó tratamiento antibiótico, se les preguntó si recordaban la duración y la pauta de terapia indicada en la consulta, si el paciente tomó el antibiótico prescrito, el número de días que este tomó el antibiótico, si se olvidó alguna dosis, si la cantidad fue la indicada, el motivo de finalización del tratamiento y si el paciente se visitó de nuevo en una consulta médica. A los pacientes a los que no se les indicó tratamiento antibiótico, también se les preguntó si acabaron tomando antibiótico y el motivo. Si el tutor/a del paciente no respondió el teléfono durante el día 12, se continuó llamando durante los siguientes tres días, y si todavía no respondió, se consideró como pérdida.
Variable de resultadoLa variable dependiente fue la adherencia al tratamiento. Es una variable dicotómica (adherencia o no adherencia), que se deriva del conjunto de preguntas de la encuesta telefónica de seguimiento. Se consideró adherente, aquel paciente al que se le indicó antibiótico y cumplió los criterios siguientes: 1) tomó el antibiótico; 2) tomó el antibiótico durante el número de días indicado; 3) tomó el antibiótico sin olvidar ninguna dosis; 4) no tomó ninguna dosis de más; 5) tomó la cantidad indicada y 6) tomó el antibiótico a las horas indicadas. Se preguntó al paciente el motivo de no adherencia al tratamiento, si fuese el caso, tanto si se indicó o no terapia antibiótica.
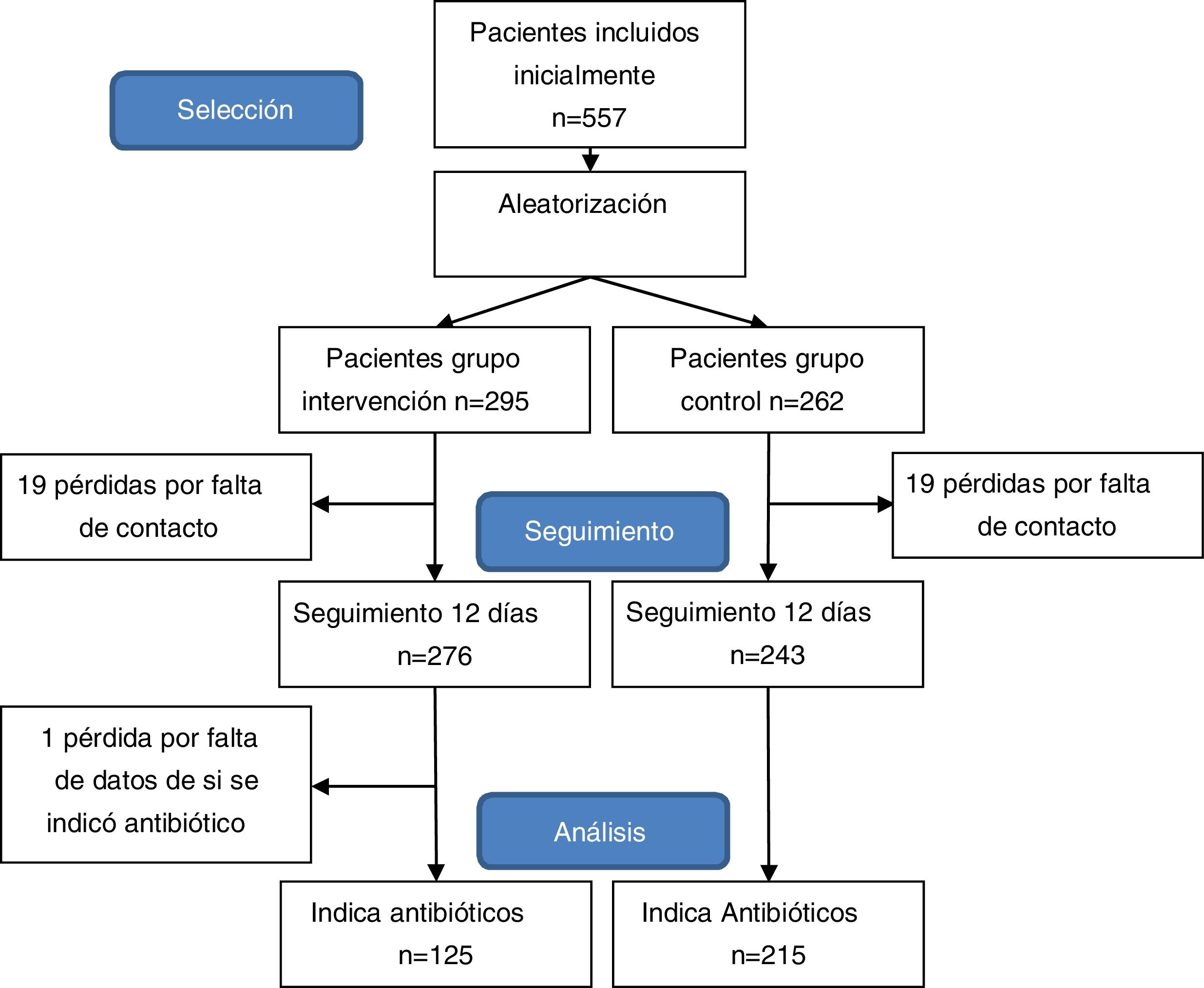
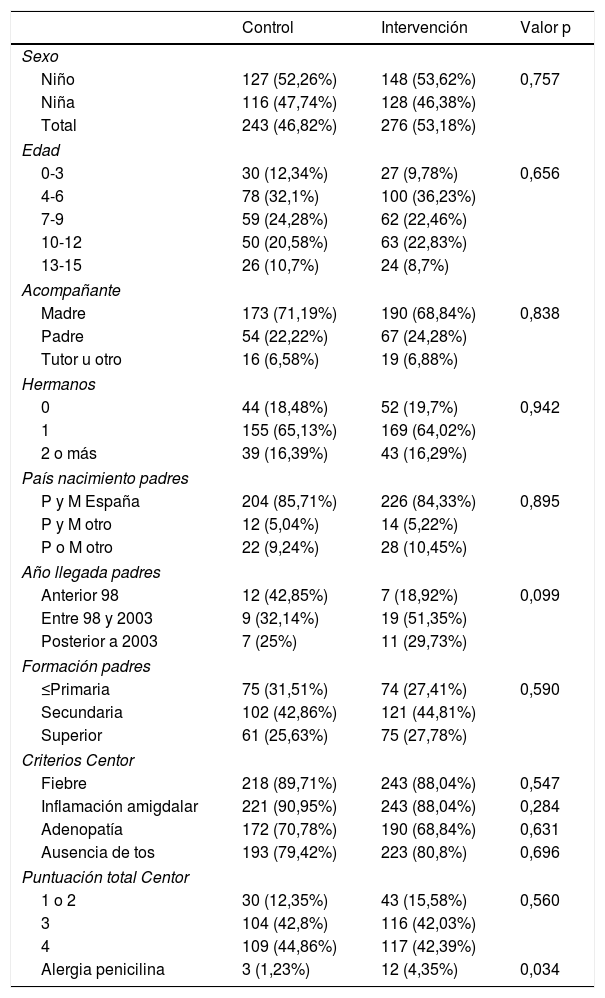
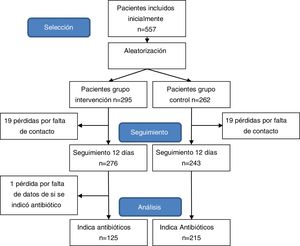
ResultadosEn el estudio se estudiaron 557 pacientes que cumplían los criterios de inclusión. Conformaron el grupo de intervención 276 (43,18%) pacientes y 243 (46,82%) el grupo de control. La edad media fue de 8,1 años y el 47% fueron niñas. Las características de la población de estudio, comparadas por grupos de estudio se expone en la tabla 3.
Características de la población de estudio
| Control | Intervención | Valor p | |
|---|---|---|---|
| Sexo | |||
| Niño | 127 (52,26%) | 148 (53,62%) | 0,757 |
| Niña | 116 (47,74%) | 128 (46,38%) | |
| Total | 243 (46,82%) | 276 (53,18%) | |
| Edad | |||
| 0-3 | 30 (12,34%) | 27 (9,78%) | 0,656 |
| 4-6 | 78 (32,1%) | 100 (36,23%) | |
| 7-9 | 59 (24,28%) | 62 (22,46%) | |
| 10-12 | 50 (20,58%) | 63 (22,83%) | |
| 13-15 | 26 (10,7%) | 24 (8,7%) | |
| Acompañante | |||
| Madre | 173 (71,19%) | 190 (68,84%) | 0,838 |
| Padre | 54 (22,22%) | 67 (24,28%) | |
| Tutor u otro | 16 (6,58%) | 19 (6,88%) | |
| Hermanos | |||
| 0 | 44 (18,48%) | 52 (19,7%) | 0,942 |
| 1 | 155 (65,13%) | 169 (64,02%) | |
| 2 o más | 39 (16,39%) | 43 (16,29%) | |
| País nacimiento padres | |||
| P y M España | 204 (85,71%) | 226 (84,33%) | 0,895 |
| P y M otro | 12 (5,04%) | 14 (5,22%) | |
| P o M otro | 22 (9,24%) | 28 (10,45%) | |
| Año llegada padres | |||
| Anterior 98 | 12 (42,85%) | 7 (18,92%) | 0,099 |
| Entre 98 y 2003 | 9 (32,14%) | 19 (51,35%) | |
| Posterior a 2003 | 7 (25%) | 11 (29,73%) | |
| Formación padres | |||
| ≤Primaria | 75 (31,51%) | 74 (27,41%) | 0,590 |
| Secundaria | 102 (42,86%) | 121 (44,81%) | |
| Superior | 61 (25,63%) | 75 (27,78%) | |
| Criterios Centor | |||
| Fiebre | 218 (89,71%) | 243 (88,04%) | 0,547 |
| Inflamación amigdalar | 221 (90,95%) | 243 (88,04%) | 0,284 |
| Adenopatía | 172 (70,78%) | 190 (68,84%) | 0,631 |
| Ausencia de tos | 193 (79,42%) | 223 (80,8%) | 0,696 |
| Puntuación total Centor | |||
| 1 o 2 | 30 (12,35%) | 43 (15,58%) | 0,560 |
| 3 | 104 (42,8%) | 116 (42,03%) | |
| 4 | 109 (44,86%) | 117 (42,39%) | |
| Alergia penicilina | 3 (1,23%) | 12 (4,35%) | 0,034 |
Se totalizaron 38 pérdidas, 19 en cada grupo, siendo la ratio de pérdidas del 9,3%. Adicionalmente, se excluyó a un paciente debido a que no constaban datos de si hubo indicación de antibiótico en la consulta pediátrica (fig. 1).
De los 340 pacientes a los que el pediatra prescribió antibiótico, 217 cumplieron las indicaciones del tratamiento (64,8%, IC 95%: 60,6 a 67,01%). Se observó una adherencia superior pero no estadísticamente significativa en el grupo de intervención (68%) vs. grupo de control (62,9%) (X2 = 0,901, p = 0,341).
Las causas principales de no cumplimiento terapéutico fueron que no se siguió el horario indicado (25,6%), la duración del tratamiento (22,3%), que no se cumplió la pauta (9,8%), que no se terminó el tratamiento (9,5%), que no se suministró la cantidad indicada (1,3%), que no se inició el tratamiento (1,1%) y que el paciente no recordó la indicación de antibiótico (0,6%).
Los motivos de finalización de la terapia antes de la fecha indicada en la consulta pediátrica (9,5%) fueron por causa voluntaria (63,6%), por indicación de un médico (33,3%) y por indicación de otra persona (3%). Los pacientes que empezaron tratamiento antibiótico sin indicación y prescripción del pediatra u otro facultativo representaron el 8,5%.
Relación entre la adherencia terapéutica y la puntuación CentorEl 88,8% de los pacientes presentó fiebre superior a 38°C, el 89,4% inflamación amigdalar, el 80,2% ausencia de tos y el 69,7% adenopatías.
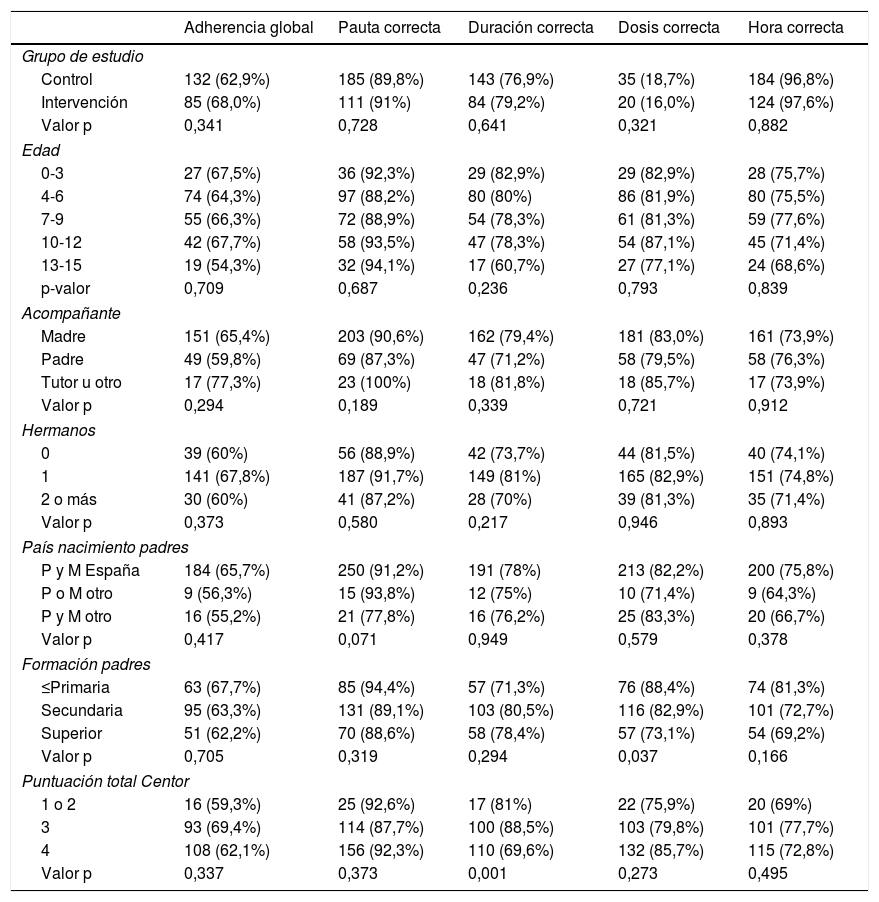
La adherencia terapéutica fue inferior en pacientes que cumplían uno o dos criterios (59,3%), vs. los que cumplían tres (69,4%) y cuatro criterios (62,1%), la diferencia no es estadísticamente significativa (p = 0,337). Se observó una diferencia significativa (p = 0,001) entre la puntuación Centor y el cumplimiento de la duración del tratamiento antibiótico, siendo inferior en pacientes con un puntuación de 4 (tabla 4).
Adherencia al tratamiento antibiótico por criterio evaluador y factor de estudio
| Adherencia global | Pauta correcta | Duración correcta | Dosis correcta | Hora correcta | |
|---|---|---|---|---|---|
| Grupo de estudio | |||||
| Control | 132 (62,9%) | 185 (89,8%) | 143 (76,9%) | 35 (18,7%) | 184 (96,8%) |
| Intervención | 85 (68,0%) | 111 (91%) | 84 (79,2%) | 20 (16,0%) | 124 (97,6%) |
| Valor p | 0,341 | 0,728 | 0,641 | 0,321 | 0,882 |
| Edad | |||||
| 0-3 | 27 (67,5%) | 36 (92,3%) | 29 (82,9%) | 29 (82,9%) | 28 (75,7%) |
| 4-6 | 74 (64,3%) | 97 (88,2%) | 80 (80%) | 86 (81,9%) | 80 (75,5%) |
| 7-9 | 55 (66,3%) | 72 (88,9%) | 54 (78,3%) | 61 (81,3%) | 59 (77,6%) |
| 10-12 | 42 (67,7%) | 58 (93,5%) | 47 (78,3%) | 54 (87,1%) | 45 (71,4%) |
| 13-15 | 19 (54,3%) | 32 (94,1%) | 17 (60,7%) | 27 (77,1%) | 24 (68,6%) |
| p-valor | 0,709 | 0,687 | 0,236 | 0,793 | 0,839 |
| Acompañante | |||||
| Madre | 151 (65,4%) | 203 (90,6%) | 162 (79,4%) | 181 (83,0%) | 161 (73,9%) |
| Padre | 49 (59,8%) | 69 (87,3%) | 47 (71,2%) | 58 (79,5%) | 58 (76,3%) |
| Tutor u otro | 17 (77,3%) | 23 (100%) | 18 (81,8%) | 18 (85,7%) | 17 (73,9%) |
| Valor p | 0,294 | 0,189 | 0,339 | 0,721 | 0,912 |
| Hermanos | |||||
| 0 | 39 (60%) | 56 (88,9%) | 42 (73,7%) | 44 (81,5%) | 40 (74,1%) |
| 1 | 141 (67,8%) | 187 (91,7%) | 149 (81%) | 165 (82,9%) | 151 (74,8%) |
| 2 o más | 30 (60%) | 41 (87,2%) | 28 (70%) | 39 (81,3%) | 35 (71,4%) |
| Valor p | 0,373 | 0,580 | 0,217 | 0,946 | 0,893 |
| País nacimiento padres | |||||
| P y M España | 184 (65,7%) | 250 (91,2%) | 191 (78%) | 213 (82,2%) | 200 (75,8%) |
| P o M otro | 9 (56,3%) | 15 (93,8%) | 12 (75%) | 10 (71,4%) | 9 (64,3%) |
| P y M otro | 16 (55,2%) | 21 (77,8%) | 16 (76,2%) | 25 (83,3%) | 20 (66,7%) |
| Valor p | 0,417 | 0,071 | 0,949 | 0,579 | 0,378 |
| Formación padres | |||||
| ≤Primaria | 63 (67,7%) | 85 (94,4%) | 57 (71,3%) | 76 (88,4%) | 74 (81,3%) |
| Secundaria | 95 (63,3%) | 131 (89,1%) | 103 (80,5%) | 116 (82,9%) | 101 (72,7%) |
| Superior | 51 (62,2%) | 70 (88,6%) | 58 (78,4%) | 57 (73,1%) | 54 (69,2%) |
| Valor p | 0,705 | 0,319 | 0,294 | 0,037 | 0,166 |
| Puntuación total Centor | |||||
| 1 o 2 | 16 (59,3%) | 25 (92,6%) | 17 (81%) | 22 (75,9%) | 20 (69%) |
| 3 | 93 (69,4%) | 114 (87,7%) | 100 (88,5%) | 103 (79,8%) | 101 (77,7%) |
| 4 | 108 (62,1%) | 156 (92,3%) | 110 (69,6%) | 132 (85,7%) | 115 (72,8%) |
| Valor p | 0,337 | 0,373 | 0,001 | 0,273 | 0,495 |
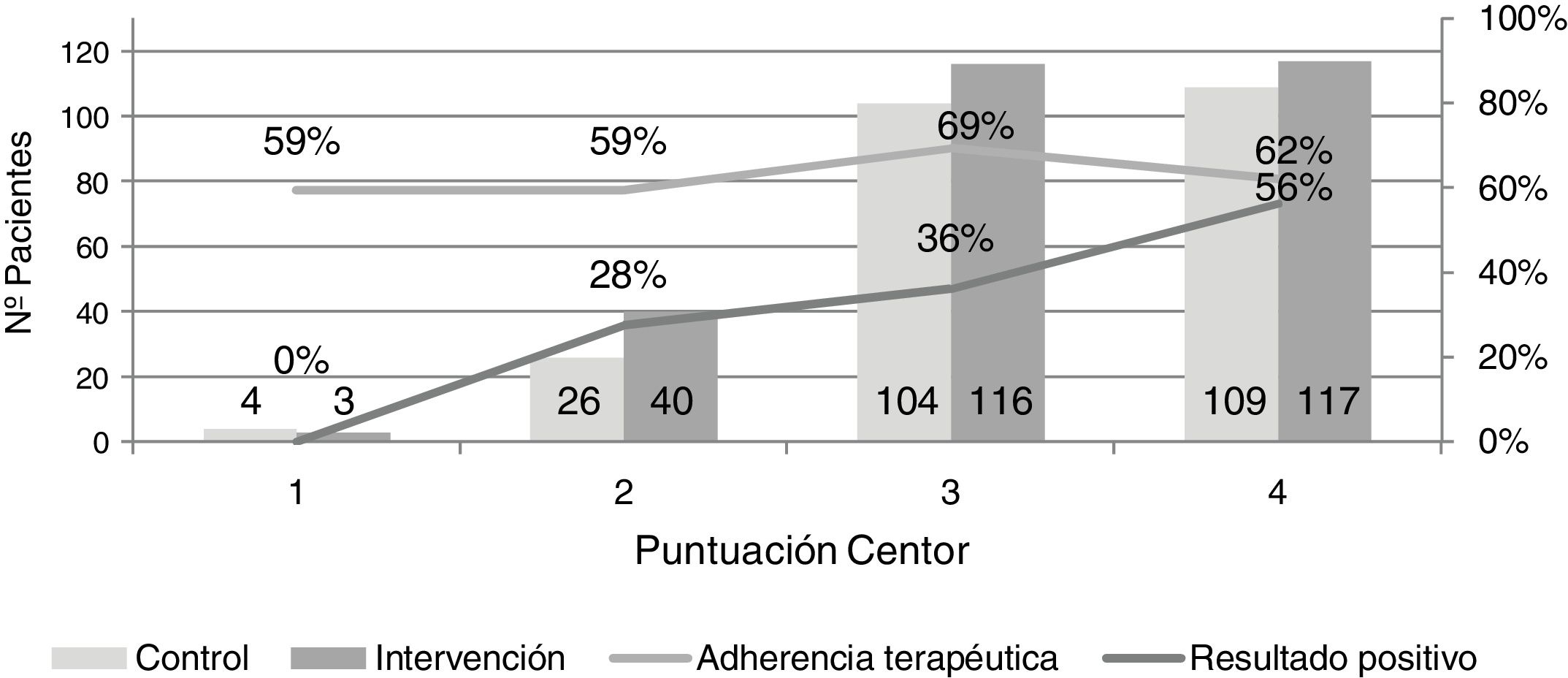
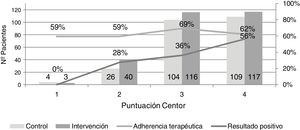
No se obtuvieron resultados positivos en la PDR en pacientes con un criterio Centor. Los individuos con resultado positivo y dos criterios Centor representaron el 27,5%, con tres criterios el 36,2% y con cuatro el 56,4% (fig. 2).
Variables sociodemográficas y adherencia terapéutica al antibióticoSe observó que la adherencia al tratamiento antibiótico fue superior cuando el acompañante era el tutor u otras personas (77,3%), seguido de si era la madre (65,4%) y finalmente, si era el padre (59,8%).
Respecto al país de nacimiento del padre y de la madre, se identificó una inferior adherencia terapéutica cuando ambos habían nacido fuera de España (55,2%), presentando mayores dificultades para comprender y/o recordar la pauta indicada; seguido de si uno de los dos había nacido fuera del país (56,3%) y superior, si ambos progenitores habían nacido en España (65,7%).
Analizando la adherencia por edades, se expone que el cumplimiento del tratamiento antibiótico es significativamente inferior en pacientes con edades comprendidas entre los 13 y 15 años, incumpliendo especialmente la duración de la terapia, a pesar de ser el grupo de edad que recordó mejor la pauta indicada.
No se ha apreciado una asociación entre el grado de adherencia terapéutica y el nivel de formación de los progenitores, el número de hermanos y la puntuación Centor (tabla 4).
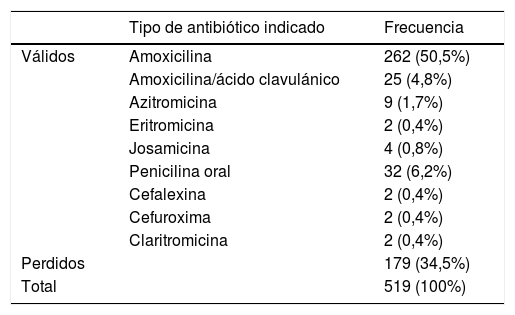
Prescripción de antibióticosSe prescribió antibiótico al 65,63% de los 519 pacientes. Se observó una diferencia significativamente superior en el grupo intervención que en el grupo control (88,5 vs. 45,5%, p < 0,001). Se prescribió antibiótico al 100% de los pacientes con resultado positivo en la PDR y únicamente al 3,85% con resultado negativo. El antibiótico más prescrito fue la amoxicilina (77,1%), seguido de la penicilina oral (9,4%), la amoxicilina con ácido clavulánico (7,4%) y otros (6,2%) (tabla 5). Un total de 15 pacientes (3%) se catalogaron como alérgicos a la penicilina.
Tipos de antibióticos indicados en la consulta pediátrica
| Tipo de antibiótico indicado | Frecuencia | |
|---|---|---|
| Válidos | Amoxicilina | 262 (50,5%) |
| Amoxicilina/ácido clavulánico | 25 (4,8%) | |
| Azitromicina | 9 (1,7%) | |
| Eritromicina | 2 (0,4%) | |
| Josamicina | 4 (0,8%) | |
| Penicilina oral | 32 (6,2%) | |
| Cefalexina | 2 (0,4%) | |
| Cefuroxima | 2 (0,4%) | |
| Claritromicina | 2 (0,4%) | |
| Perdidos | 179 (34,5%) | |
| Total | 519 (100%) |
Las pautas horarias prescritas por el pediatra con más frecuencia fueron cada ocho horas (64,3%) y cada 12 horas (31,3%). La duración más indicada fue ocho días (43,1%), seguido de siete días o inferior (37,8%) y 10 días (19,1%). No se observaron diferencias significativas entre las ramas de estudio en cuanto a duración (p = 0,829) y pautas prescritas (p = 0,148).
El 8,4% de los pacientes del grupo control visitó de nuevo a un médico vs. 11,2% del grupo intervención (p = 0,293). El 83,6% consultó en un ambulatorio, el 12,7% en un hospital y el 3,6% en una consulta privada. En la nueva visita se prescribió antibiótico de manera significativamente mayor (p < 0,001) a los pacientes del grupo de control (88,5%) vs. los del grupo intervención (50,2%).
DiscusiónEl porcentaje de pacientes con tratamiento antibiótico para una infección faringoamigdalar que cumplió el tratamiento correctamente (64,8%) fue muy similar al obtenido en una revisión sistemática que incluyó 43 estudios (62,2%)2.
El 90% de los pacientes incluidos en el estudio eran menores de 13 años, por lo que la responsabilidad principal de la correcta administración del tratamiento recayó en los padres y los tutores. Los adolescentes de entre 13 y 15 años que participaron en el estudio obtuvieron peores resultados en la adherencia terapéutica, tanto en la correcta duración, número de dosis y la hora de administración, a pesar de recordar mejor la pauta. El descenso del cumplimiento de la terapia en adolescentes podría ser causado por una mayor libertad y falta de supervisión por parte de los padres y una dificultad para cumplir las pautas del tratamiento por parte de los adolescentes.
El acompañante principal del menor fue la madre en el 70% de los casos y el padre en el 23%. Si se comparan los resultados, el grado de adherencia terapéutica fue más favorable cuando el acompañante era la madre (65,4%) respecto el padre (59,8%), pese a no existir una significación estadística. El grado de adherencia superior fue detectado cuando el acompañante era el tutor u otros (77,3%). Esta diferencia puede estar relacionada con la responsabilidad que se ejerce respecto a un tercero que no es el progenitor directo.
De igual modo que en un estudio sobre la asociación entre la adherencia terapéutica y la prueba diagnóstica rápida de EbhGA, también se obtuvieron mejores resultados en el grupo de intervención y se observó que la adherencia al tratamiento en menores de 15 años es superior que en adultos18.
En este estudio, se ha observado una diferencia significativa en la adherencia a la duración del tratamiento antibiótico respecto a la puntuación Centor, siendo inferior en pacientes con un puntuación de 4. No hemos encontrado una explicación plausible para este resultado, por lo que podría tratarse de un error de registro.
Los pediatras del grupo de control, que no tenían acceso a la PDR fueron un 43% más propensos a prescribir antibióticos que aquellos del grupo intervención, siendo este tratamiento muchas veces innecesario, ya que menos de la mitad de los casos detectados en el grupo intervención (43,7%) obtuvieron un resultado positivo para faringitis estreptocócica.
El porcentaje de prescripción de antibióticos para faringoamigdalitis (65,63%) difiere del registrado en otros estudios 80,922, 756, 57,823 y 53,81%17, esto es debido a que los estudios fueron realizados en distintos años y para diferentes rangos de edad.
El 7,4% de los pediatras eligieron la amoxicilina con ácido clavulánico como tratamiento de entrada a pesar de no ser recomendada en las guías de práctica clínicas14. En un estudio del 2013, el porcentaje de prescripciones de amoxicilina con ácido clavulánico por sospecha de faringoamigdalitis estreptocócica fue del 29%24 y en un estudio del año 2000, el 44% de los adultos recibieron amoxicilina con ácido clavulánico para tratar la amigdalitis25 La posible explicación de su uso es la falta de seguimiento de las recomendaciones de las guías de práctica clínicas.
La recogida de los datos se realizó antes de la implementación generalizada de la prueba rápida de diagnóstico en los centros de atención primaria de la zona y comprobando que los resultados de la adherencia terapéutica no se vieron influenciados por dicha implementación al no mostrar una asociación significativamente estadística, el cumplimiento del tratamiento antibiótico sigue siendo un reto farmacológico en patologías agudas. Han transcurrido más de 10 años desde la implementación generalizada de la prueba rápida y se requieren estudios futuros que permitan plantear nuevos enfoques y estrategias para mejorar el cumplimiento del tratamiento, así como hacer un seguimiento en el tiempo de la adherencia terapéutica al tratamiento antibiótico.
ConclusionesLa adherencia terapéutica se ve influenciada por varios factores y proporcionar información sobre el tratamiento y sus indicaciones es clave para su correcto cumplimiento. Utilizar el resultado de la prueba de diagnóstico rápida para mejorar la adherencia antibiótica ha mostrado una posible asociación favorable, aunque no estadísticamente significativa.
El incumplimiento del tratamiento antibiótico supone un riesgo de salud pública que provoca resistencias bacterianas.
Existen estudios cuantitativos que evalúan la adherencia terapéutica y los factores de riesgo que pueden conducir al fracaso terapéutico.
¿Qué aporta este estudio?Los hallazgos obtenidos muestran que el 64,8% los pacientes pediátricos diagnosticados de faringoamigdalitis cumplieron el tratamiento antibiótico.
A pesar de que la adherencia terapéutica fue un 5,1% superior en los pacientes a los que se les realizó el test de diagnóstico rápido de detección del antígeno estreptocócico, no se observó una diferencia significativa.
Este trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A todos los colaboradores pediatras, enfermeros y enfermeras que hicieron posible la recogida de los datos: Teresa Aguilà, Marta Almenara, Rossana Arbieto, Alicia Arinyo, Joan Azemar, Carme Boix, Teresa Bosch, Roser Bru, Xavier Bruna, Mireya Cabral, Susanna Campo, Maria Cano, Francina Cantarell, Núria Carré, Rosa M. Claramunt, Rosalia Closas, Pilar De Millán, Carme Escala, Maite Espelt, Victòria Estrada, Enrique Ferrer, Maria Gassó, Josep Lluís Grau, Eduard Guasch, Carme Guitart, Josep Guitart, Lluïsa Hidalgo, Maria Juncadella, Isabel Llagostera, Teresa Llopart, Montse Llorens, Esperança Macià, Núria Montero, Edith Ninayahuar, Mercè Oliva, Ramon Orriols, Emilia Ramon, Montse Renalíes, Carme Rialp, M.Àngels Rifà, Teresa Rifà, Núria Rossell, Imma Sabaté, Héctor Salvador, Ana Sangorrín, Lourdes Sabata, Josefina Serra, Carme Serradell, Lluïsa Serrano, Holman Shedden, Eva Sierra, Isabel Soler, Meritxell Torrabías, Guadalupe Valdés, Ramon Valdés, Àngels Vidal, Ester Vila, Eulàlia Vilaplana y Olga Villarta.