La anemia preoperatoria, la reintervención por sangrado y la necesidad de transfusión son problemas frecuentes en los pacientes tratados con una cirugía cardiaca mayor y se asocian a un aumento considerable de la morbimortalidad. El objetivo del presente trabajo es analizar nuestros resultados quirúrgicos tras la aplicación de un programa de patient blood management (PBM), poniendo el foco en los parámetros hematológicos.
MétodosEntre marzo de 2021 y mayo de 2022 hemos intervenido consecutivamente a 104 pacientes de cirugía cardiaca mayor con el programa PBM. La edad media fue de 65±11 años, el 66% fueron varones, el 21% tenían un EuroScore II>5, el 24% anemia preoperatoria y el 2,8% eran testigos de Jehová que rechazaban las transfusiones. El 19,2% de los procedimientos fueron coronarios sin circulación extracorpórea; el 8,7%, endocarditis; el 10,6%, reintervenciones; el 2,9%, síndromes aórticos agudos y el 34% fueron cirugías urgentes o emergentes.
ResultadosLa tasa de reoperación por sangrado fue del 1,9% y la de transfusión perioperatoria del 25%. El 87,5% de los pacientes operados de forma electiva y el 90,5% de los coronarios aislados no recibieron hemocomponentes. El número medio de concentrados de hematíes (índice de transfusión total), unidades de plasma fresco congelado y concentrados de plaquetas transfundidos por paciente fue de 0,47; 0,16 y 0,07, respectivamente.
ConclusionesEl PBM nos ha permitido alcanzar nuestros objetivos de calidad en cuanto a reintervención por sangrado y tasa de transfusión perioperatoria.
Preoperative anemia, reexploration for bleeding and need for transfusion are common problems in patients undergoing mayor cardiac surgery and are associated with an increase morbidity and mortality. The objective of the present report is to evaluate our surgical results focusing on hematological parameters after the implementation of a Patient Blood Management (PBM) program.
MethodsBetween March 2021 and May 2022, we have consecutively operated on 104 mayor cardiac surgery patients with the PBM program. The mean patient age was 65±11 years, 66% of the patients were male, 21% had a EuroScore II>5, 24% had preoperative anemia, and 2,8% were Jehovah's Witnesses who refused transfusions. The 19,2% of the procedures were off-pump coronary artery bypass grafting, 8,7% endocarditis, 10,6% redo operations, 2,9% acute aortic syndromes, and 34% urgent or emergent cases.
ResultsThe incidence of reexploration for bleeding was 1,9% and the perioperative transfusion rate was 25%; 87,5% of the patients operated on electively and 90,5% of the isolated coronary patients did not receive blood components. The mean number of red blood cell concentrates (total transfusion index), fresh frozen plasma, and pooled platelets transfused per patient was 0.47, 0.16, and 0.07, respectively.
ConclusionsThe PBM has allowed us to achieve our quality objectives in terms of reintervention for bleeding and perioperative transfusion rate.
El sangrado y la transfusión son 2fenómenos consustanciales a la cirugía cardiaca. Entre el 2% y el 6% de los pacientes tratados mediante un procedimiento de cirugía cardiaca mayor (CCM) en centros de excelencia tienen que ser reintervenidos por hemorragia1 y alrededor del 50% reciben algún tipo de hemocomponente2. La reoperación por sangrado se asocia a un incremento notable de mortalidad y complicaciones postoperatorias1. Con respecto a la transfusión, hay 2evidencias claras: por un lado, que los pacientes transfundidos tienen una peor evolución postoperatoria y una menor supervivencia3-5 y, por otro, que la práctica transfusional en este tipo de cirugía está sujeta a una enorme e inexplicable variabilidad6. Un mismo proceso como la revascularización coronaria puede tener tasas de transfusión que oscilan entre el 0% y el 100% según el centro7. De ambas premisas se deduce que la trasfusión de sangre innecesaria o inapropiada es frecuente en CCM y que ello tiene una importante repercusión en la evolución clínica de los pacientes y, secundariamente, en los costes.
Una de las formas de combatir este deletéreo binomio de sangrado/transfusión y mejorar los resultados en CCM es la aplicación sistematizada de Patient blood management (PBM)8. Los programas PBM en cirugía se pueden definir como un conjunto de prácticas clínicas de aplicación multidisciplinar y perioperatoria, cuya finalidad es mejorar el manejo hematológico del paciente quirúrgico, disminuir el grado de anemia, reducir el sangrado y minimizar el uso de hemoderivados y sus efectos adversos.
El Hospital Universitario de Torrejón comenzó a trabajar con un programa de ahorro de sangre PBM en el año 2015: primero lo desarrolló en el ámbito quirúrgico y posteriormente lo extendió al ámbito médico. El objetivo de este trabajo es analizar los resultados de la aplicación del PBM en los pacientes tratados con CCM desde que nuestro grupo, Cirugía Cardiaca Madrid, se ha hecho cargo del servicio.
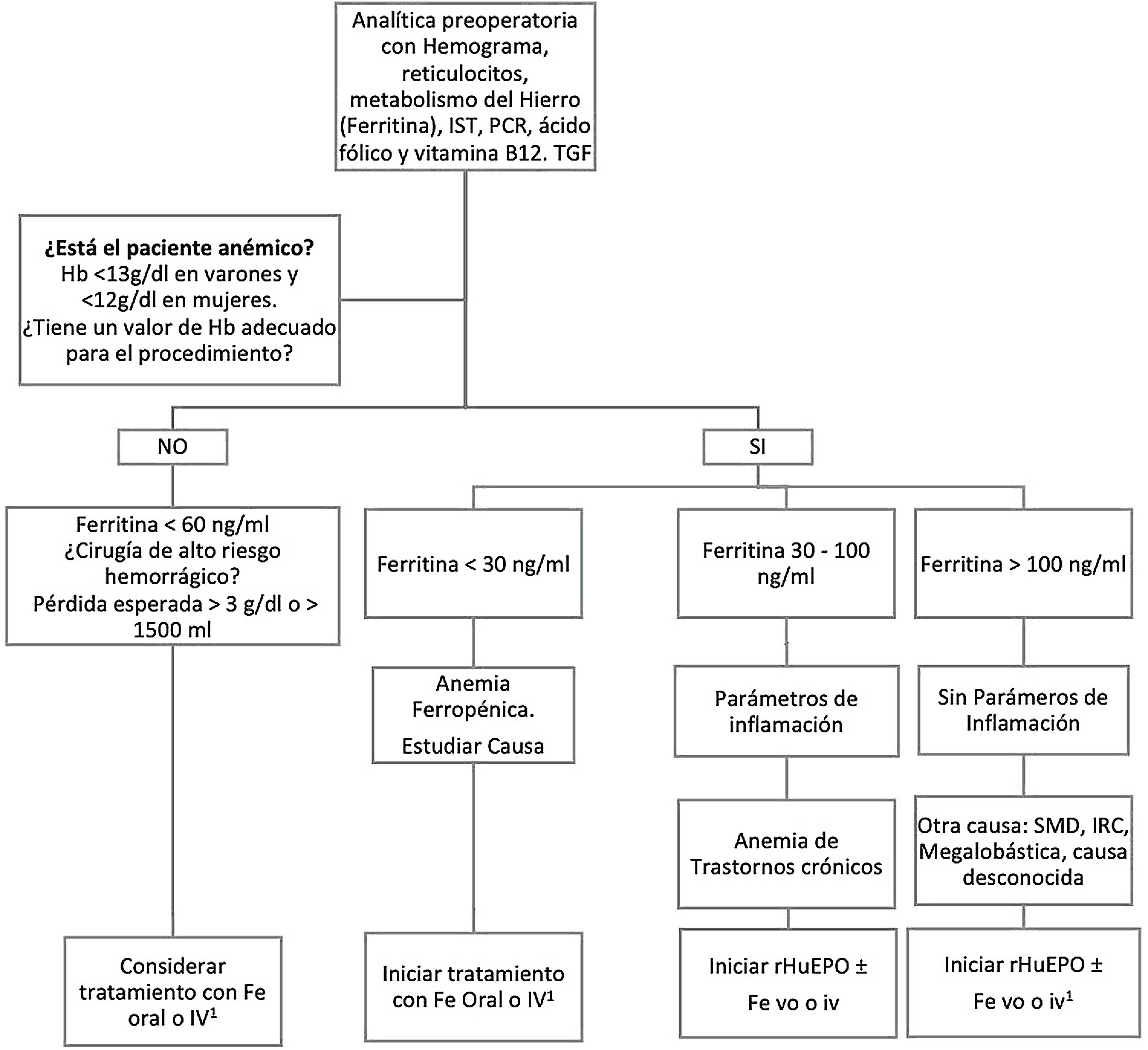
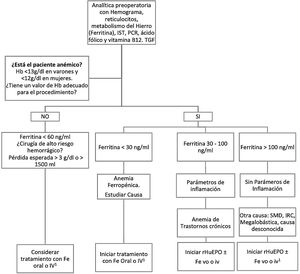
MétodosEntre marzo de 2021 y mayo de 2022 hemos intervenido consecutivamente a 104 pacientes de CCM con el programa PBM. Sus datos perioperatorios, entendiendo como «periodo perioperatorio» el total de días de la estancia hospitalaria durante los que fueron intervenidos, se recogieron de forma retrospectiva utilizando el programa de historia clínica electrónica Florence y la información del banco de sangre del hospital. Las características demográficas y los datos operatorios de los pacientes están reflejados en la tabla 1. El 2,8% de ellos (n=3) eran testigos de Jehová que rechazaban las transfusiones por motivos religiosos. Las medidas preoperatorias, intraoperatorias y postoperatorias que incluye el PBM se detallan en las tablas 2 y 3 y en la figura 1. Los pacientes electivos con anemia preoperatoria (definida como hemoglobina inferior a 12g/dL en mujeres y a 13g/dL en hombres) fueron remitidos desde la consulta preanestésica a la consulta de hematología al menos 15-21 días antes de la intervención para su optimización, que se llevó a cabo siguiendo el algoritmo reflejado en la figura 1.
Características demográficas y datos operatorios de los pacientes intervenidos (n=104)
| Edad | 64,9±11 años (rango: 28-84 años) |
|---|---|
| Sexo n (%) | Hombres: 69 (66)Mujeres: 35 (34) |
| Factores de riesgo cardiovascular n (%) | Fumador: 47 (45,2)HTA: 74 (71,2)Dislipidemia: 59 (56,7)Diabetes mellitus: 27 (9,6)IMC>30: 32 (30,8) |
| Testigos de Jehová n (%) | 3 (2,8) |
| EuroScore II n (%) | 4,89±8,17 (rango: 0,55-47,72)bajo (0-2): 42 (40,4)medio (2-5): 40 (38,5)alto (> 5): 22 (21,1) |
| Fibrilación auricular n (%) | 29 (27,9) |
| Disfunción renal n (%) | No (CC>85ml/min): 52 (50)Moderada (CC 50-85ml/min): 36 (34,6)Severa (CC<50ml/min): 15 (14,4)Diálisis: 1 (1) |
| Función ventricular izquierda n (%) | Normal (FEVI>50): 89 (85,6)Moderadamente deprimida (FEVI 31-50): 12 (11,5)Severamente deprimida (FEVI 21-30): 3 (2,9) |
| Hipertensión pulmonar n (%) | No: 72 (69,2)Moderada (31-55mmHg): 23 (22,1)Severa (>55mmHg): 9 (8,7) |
| Anemia preoperatoriaa n (%) | 25 (24), hombres (18; 72) |
| Cirugía cardiaca previa (reintervenciones) n (%) | 11 (10,6) |
| Endocarditis n (%) | 9 (8,7) |
| Síndrome aórtico agudo n (%) | 3 (2,9) |
| CEC (sí/no) n (%) | Sí: (80,8)No: 20 (19,2) |
| Carácter de la cirugíab n (%) | Electiva: 69 (66,3)Urgente: 28 (27)Emergente: 7 (6,7) |
| Tipo de procedimiento n (%) | Valvular: 57 (54,8)Coronario: 21 (20,2), 95(20) sin CECValvular y coronario: 12 (11,5)Valvular y aorta: 6 (5,8)Aorta: 5 (4,8)Valvular, coronario y aorta: 2 (1,9)Coronario y aorta: 1 (0,96) |
| Tiempo de isquemia n (%) | 65±27min (rango: 30-167min), mediana 58min |
| Tiempo de CEC n (%) | 83±34min (rango: 41-241min), mediana 75min |
CC: aclaramiento de creatinina; CEC: circulación extracorpórea; FEVI: fracción de eyección del ventrículo izquierdo (%); IMC: índice de masa corporal (kg/m2); HTA: hipertensión arterial.
Protocolo PBM para cirugía cardiaca del Hospital Universitario de Torrejón
| Fase | Objetivo | Medidas |
|---|---|---|
| Preoperatoria | Optimización de la sangre autógena del paciente: corrección de la anemia estimulando la eritropoyesis | Consulta de preanestesia:Suspensión reglada de antiagregantes (excepto en coronarios) y anticoagulantes (dicumarínicos 4 días antes de la cirugía y los NACO 2-4 días antes)Analítica con perfil de hemoderivados: si anemia (Hb <12g/dL en mujer y<13g/dL en hombre) remitir a Consulta de hematología al menos 15-21 días antes de la intervenciónConsulta de hematología: algoritmo de optimización de la Hb con Fe o rHuEPO (fig. 1)Fe oral: 100mg de Fe elemental/día en ayunas). Contraindicado en la enfermedad gastrointestinal inflamatoria activa, lesiones ulcerosas o hemorragia digestiva activaFe i.v.: Fe carboximaltosa (Ferinject®): 20mg/kg/sesión, máximo 1.000mg/sesión, máximo 1.000mg/semana.rHuEPO: Epoetina α (Eprex/Binocrit®). Dispensación en farmacia hospitalaria de hasta 4 dosis de 600 UI/kg a la semana durante 4 semanas → 40.000 UI±hierro oral/i.v. |
| Intraoperatoria | Disminuir la hemodilución durante la CECMinimizar el sangrado tras salida de CECEvitar la transfusión intraoperatoria innecesaria | Realización de la cirugía coronaria sin CECCirugía con CEC normotérmica (34°C)Cebado del circuito de CEC con sangre homóloga en casos de Hb preoperatoria<7-7,5g/dL (hematocrito 21-23%)Purgado autógeno retrógrado del circuito de CECCircuitos cortos de CECÁcido tranexámico según protocolo anexoMantener hematocrito en bomba entre 28% y 30%Ultrafiltración convencional en CEC siempre que haya exceso de volumen en el reservorioTransfusión en CEC solo si Hb<7g/dL sin posibilidad de subirla por otro métodoRecuperador de sangre (Sorin XTRAR con set de procesamiento TX Cardio y set de campana intermedia [125 cc], Sorin Group Italia S.R.L., Mirandola, Italia) de forma rutinaria en la cirugía con CECReinfusión de toda la sangre del circuito de CEC (a través del recuperador si se ha usado o directamente en caso contrario)Protocolo de hemostasia exhaustiva, hemostáticos tópicosAdministración de complejo protrombínico (500 UI+500 UI) y fibrinógeno (3 g+3g) en función de impresión clínica |
| Postoperatoria | Limitar el sangradoEvitar la transfusión innecesaria | Optimización hemodinámica y del aporte de oxígeno, tratamiento precoz de las infeccionesUmbral de transfusión restrictivo (Hb<7g/dl y<8 d/dL si factores de riesgo cardiovascular) guiado por la situación clínica y las características del pacienteEn pacientes inestables en UCI con anemia aguda hemorrágica, administrar CH para mantener Hb entre 8 y 9g/dL y corregir la coagulopatía: valorar el uso de antifibrinolíticos, fibrinógeno, vitamina K, PFC, concentrados de factores de complejo protrombínico y factor VIIa recombinanteHb entre 7 y 8g/dL: Fe i.v. (Ferinject®) (500 mg+500mg)+rHuEPOHb entre 8 y 9g/dL: Fe i.v. (Feriv®) (200mg/48h)+rHuEPO |
CEC: circulación extracorpórea; CH: concentrado de hematíes; Fe: hierro; Hb: hemoglobina; i.v.: intravenoso; NACOs: nuevos anticoagulantes orales de acción directa; PBM: Patient Blood Management; PFC: plasma fresco congelado; rHuEPO: eritropoyetina humana recombinante; UCI: Unidad de Cuidados Intensivos.
Protocolo de administración de ácido tranexámico en cirugía cardiaca del Hospital Universitario de Torrejón
| Cirugía sin CEC | Bolo de 10mg/kg i.v. en la inducciónPerfusión continua de 10mg/kg por hora durante la cirugía |
| Cirugía con CEC | 1g en el cebado del circuito de CECPerfusión continua de 10mg/kg por hora durante la cirugía |
| Contraindicaciones | Hipersensibilidad al fármaco o a sus excipientesHistoria de hipercoagulabilidad (ej: antecedentes de tromboembolia pulmonar, anticoagulante lúpico, déficit de proteína C o S, etc.) |
| Consideraciones especiales | Historia de convulsiones: no se pone bolo, solo perfusión continuaInsuficiencia renal grave (FG<30ml/min): no se pone bolo, solo perfusión continua |
CEC: circulación extracorpórea; FG: filtrado glomerular; i.v.: intravenoso.
Algoritmo de optimización preoperatoria de la hemoglobina con hierro y eritropoyetina.
Fe: hierro; Hb: Hemoglobina; i.v.: intravenoso; IRC: insuficiencia renal crónica; IST: índice de saturación de la transferrina; PCR: proteína C reactiva; rHuEPO: eritropoyetina humana recombinante; SMD: síndrome mielodisplásico; TGF: tasa de filtrado glomerular; vo: vía oral.
1 Si el tiempo disponible para la optimización de Hb no es suficiente, hay intolerancia al Fe oral, déficit funcional o poca respuesta a rHuEPO, se administrará Fe i.v..
Los autores declaran respetar la confidencialidad de la información aquí aportada y los principios bioéticos de la Declaración de Helsinki. El consentimiento informado de los pacientes se obtuvo siguiendo las instrucciones del Comité de Ética local, del cual se obtuvo la pertinente aprobación para la realización del estudio.
ResultadosPresentaron anemia preoperatoria 25 pacientes (24%), 18 de los cuales eran varones (72%). De ellos, el 60% (n=15) se operaron de forma urgente (n=12) o emergente (n=3) y, por tanto, no fueron susceptibles de optimización preoperatoria en la consulta de hematología. El otro 40% (n=10) fueron intervenidos electivamente y, en consecuencia, eran susceptibles de pretratamiento. El 20% de ellos (n=2) no se optimizaron por incumplimiento del protocolo PBM. El otro 80% (n=8) sí se optimizaron: 5 de ellos estaban siendo tratados ya con eritropoyetina debido a su insuficiencia renal crónica y los otros 3 fueron pretratados con hierro. Ningún paciente pretratado se reintervino por hemorragia, aunque a uno se le transfundió un único concentrado de hematíes (CH) en la UCI.
Fueron reintervenidos por sangrado 2 pacientes (1,9%): uno de forma precoz, un paciente que se había operado de forma urgente para retirar una TAVI disfuncionante y otro de forma diferida, 24 h después de haberse sometido electivamente a un recambio de una prótesis aórtica mecánica estenótica. Ninguno de los pacientes coronarios aislados, el 95% de los cuales fueron operados sin circulación extracorpórea (CEC), tuvo que reintervenirse por hemorragia.
Precisaron algún tipo de transfusión a lo largo de todo el proceso perioperatorio 26 pacientes (25%). La tasa de transfusión fue más baja en cirugía electiva (15,9%, 11 de 69) y en cirugía coronaria (9,5%, 2 de 21) y más elevada en los pacientes con anemia preoperatoria (52%, 13 de 25) y en cirugía urgente o emergente (42,9%, 15 de 35). De las 73 unidades de hemocomponentes administradas, el 67,1% fueron CH, el 23,3% plasma fresco congelado y el 9,6% pool de plaquetas. El 65,8% de estos hemocomponentes fueron transfundidos en la UCI, el 19,2% en quirófano y el 15% en la planta de hospitalización (tabla 4). El índice transfusional (total de bolsas de CH transfundidas/n.° de pacientes transfundidos) fue 1,88 y el índice de transfusión total o TTI (total de bolsas de CH transfundidas/n.° de pacientes intervenidos) fue 0,47. El número medio de unidades de plasma fresco congelado y de pool de plaquetas transfundidas por paciente fue de 0,16 y 0,07, respectivamente.
Hemocomponentes transfundidos distribuidos en los distintos periodos del proceso perioperatorio
| Hemocomponentes | n.° de unidades n (%) | Transfundidas en quirófano n (%) | Transfundidas en UCI n (%) | Transfundidas en planta n (%) | n.° de unidades/total de pacientes intervenidos (n=104) |
|---|---|---|---|---|---|
| Total | 73 | 14 (19,2) | 48 (65,8) | 11 (15) | 0,7 |
| CH | 49 (67,1) | 10 (20,4) | 28 (57,1) | 11 (22,4) | 0,47a |
| PFC | 17 (23,3) | 3 (17,7) | 14 (82,3) | - | 0,16 |
| PLQ | 7 (9,6) | 1 (14,3) | 6 (85,7) | - | 0,07 |
CH: concentrados de hematíes; PFC: plasma fresco congelado; PLQ: plaquetas; UCI: Unidad de Cuidados Intensivos.
La mortalidad hospitalaria global fue del 5,7%, del 1,4% en cirugía electiva, del 7,1% en cirugía urgente y del 42% en cirugía emergente. Estos datos están en consonancia con la mortalidad esperada según el EuroScore II (4,89%±8,17%). Ninguno de los pacientes que rechazaban de antemano la transfusión de sangre alogénica (n=3, 2,8%) presentó complicaciones relevantes en el postoperatorio.
DiscusiónEl concepto patient blood management fue acuñado en 2005 por James Isbister para referirse a un nuevo a paradigma en la concepción y el uso de la transfusión9. Su idea era mejorar los resultados clínicos y el pronóstico de los pacientes optimizando el uso de hemoderivados, un bien preciado y escaso que depende exclusivamente de las donaciones. La filosofía de esta estrategia es considerar la sangre autógena del paciente como su bien más valioso y evitar la transfusión no necesaria. Hoy por hoy, el PBM es una práctica cada vez más extendida en el ámbito quirúrgico8,10. Básicamente, se puede definir como un programa perioperatorio multidisciplinar que tiene como objetivo el reducir la anemia, el sangrado y las necesidades transfusionales de los pacientes intervenidos, teniendo en cuenta siempre el riesgo/beneficio individual de cada paciente. La aplicación de estos programas en CCM ha demostrado ser una medida eficaz, al reducir el sangrado en un 70%, la tasa de transfusión en un 39% (0,43 CH menos por paciente) y la mortalidad en un 11%8, a la par que eficiente, ya que secundariamente contribuye a la reducción del gasto sanitario10.
La trasfusión en cirugía depende en más del 97% de los casos de 3 factores: el grado de anemia preoperatoria, las pérdidas hemáticas y el umbral transfusional. Por ello, los PBM basan su eficacia en 3 pilares fundamentales: 1) corregir la anemia estimulando la eritropoyesis, 2) minimizar el sangrado y 3) evitar la transfusión innecesaria utilizando un umbral transfusional restrictivo11,12.
Anemia preoperatoriaEn los países desarrollados, la prevalencia de anemia entre los pacientes tratados con cirugía mayor oscila entre el 20% y el 65%; es más alta en mujeres que en hombres (53 vs. 23%)13. En el caso de la CCM, esta tasa está en torno al 30%, con un rango entre el 23% y el 45%, según las series13,14. En nuestro caso, fue del 24%, la mayoría eran varones. El origen de la anemia suele ser multifactorial, aunque la causa más frecuente es el déficit de hierro15. Casi todos los pacientes operados de corazón tienen algún grado de insuficiencia cardiaca y esta se asocia a déficit de hierro, que empeora su pronóstico16,17. El mecanismo fisiopatológico es múltiple: 1) pérdidas sanguíneas intestinales secundarias a la anticoagulación/antiagregación; 2) hiperproducción de hepcidina, que disminuye la absorción intestinal de hierro y su liberación desde el sistema retículo-endotelial; 3) dilucional, debido a la retención de líquidos secundaria a la activación del sistema renina-angiotensina-aldosterona y 4) disminución de la producción de eritropoyetina debido a la insuficiencia renal asociada con frecuencia.
Los pacientes con anemia tratados mediante una CCM presentan peores resultados que los no anémicos13,14,18,19. Padmanabhan et al., en un metaanálisis con 114.277 pacientes, han observando que los pacientes con anemia tienen una tasa de mortalidad hospitalaria 2,74 veces mayor y una mayor incidencia de insuficiencia renal (OR 3,13), infecciones (OR 2,65), accidente cerebrovascular (OR 1,65) y necesidad de transfusión (OR 1,35, 33 vs. 11,8%)19. Otras complicaciones más frecuentes entre los pacientes anémicos son el infarto de miocardio, tiempos de ingreso en planta y UCI más prolongados y mayor sangrado13,14,18. Además, la anemia es el factor independiente que mejor se correlaciona con el incremento de la tasa de transfusión en los pacientes quirúrgicos y el mayor uso de hemoderivados incrementa la morbimortalidad13,18. En nuestra serie, el 52% de los pacientes con anemia preoperatoria tuvieron que ser transfundidos.
La optimización preoperatoria de la sangre autógena es una práctica adecuada y necesaria20. La evidencia en CCM no es tan contundente, aunque hay algún estudio que ha demostrado que el pretratamiento con hierro intravenoso incrementa la hemoglobina postoperatoria y mejora los resultados quirúrgicos21-23. Recientemente, se ha puesto en marcha un estudio aleatorizado multicéntrico con 1.000 pacientes, el Iron for treatment of anemia before cardiac surgery (ITACS), que pretende evaluar los beneficios del hierro en este contexto24. En nuestra limitada experiencia, esta estrategia es de difícil aplicación, habida cuenta que solo un 40% de los pacientes con anemia preoperatoria se operaron de forma programada y eran susceptibles de optimización. El porcentaje de «urgencias» o «emergencias» (definidas según los criterios del EuroScore II recogidos en la tabla 1) puede parecer alto, pero es la realidad de nuestro centro, en el que muchos pacientes se operan directamente, sin pasar por la lista de espera, tras haber sido ingresados en Cardiología por síndrome coronario agudo o insuficiencia cardiaca.
SangradoLa tasa de reoperación por sangrado tras una CCM oscila entre el 2% y el 9%. Son múltiples los factores de riesgo: cirugía emergente, reintervenciones, empleo de CEC, hematocrito en bomba por debajo de 24%, cirugía distinta a la coronaria (especialmente reparación tricúspide y disección de aorta), tiempos de isquemia y CEC prolongados, EuroScore alto, diabetes mellitus, disfunción ventricular e insuficiencia renal preoperatorias y bajo índice de masa corporal1,25,26. La reintervención por hemorragia tiene un alto precio en términos de morbimortalidad para los pacientes. La mortalidad se multiplica por más de 3, o incluso por 6, si la reexploración es diferida; la estancia hospitalaria se prolonga. También son más frecuentes complicaciones postoperatorias como fibrilación auricular, insuficiencia renal, mediastinitis y reingresos en UCI1. Nuestra tasa de reintervención por sangrado fue baja (1,9%), lo que achacamos a la aplicación del PBM y a la sistematización de un método de hemostasia riguroso y meticuloso, que, de hecho, incluimos entre las medidas del programa (tabla 2). La aplicación rutinaria del PBM nos ha permitido también operar con seguridad a pacientes que rechazan las transfusiones, como es el caso de los testigos de Jehová, para los que nuestro hospital es centro de referencia.
TransfusiónA finales de la primera década del presente siglo, un 50% de los pacientes tratados mediante CCM recibían algún tipo de hemocomponente, lo que suponía el consumo de entre un 10% y un 15% de los depósitos del banco de sangre2. Aunque desde 2011 hay una tendencia hacia un menor consumo de hemoderivados, la CCM es la que menos ha progresado en este sentido y sigue presentando tasas de transfusión perioperatorias de hasta el 55,9%6,19,27,28. Países de nuestro entorno, como Holanda, todavía reportan tasas de transfusión del 43-54% en cirugía coronaria aislada, del 54-67% en cirugía valvular y del 80-88% en cirugía combinada29. Los factores predictores de politransfusión son: la edad mayor de 70 años, el sexo femenino, el bajo índice de masa corporal, la insuficiencia renal, el tiempo de CEC prolongado, la endocarditis y la cirugía cardiaca previa30. En nuestro caso, la tasa de transfusión observada fue del 25%, que consideramos especialmente baja teniendo en cuenta que casi un 60% de los pacientes operados tenían un EuroScore medio o alto. Los resultados fueron incluso mejores en pacientes electivos (15,9%) y, sobre todo, en coronarios (9,5%), en los que efectuar la cirugía sin CEC puede jugar un papel crucial en este sentido. Por el contrario, los pacientes con anemia preoperatoria y los operados de forma no electiva mostraron una probabilidad de transfundirse de casi el doble. El índice de transfusión total (TTI) fue de 0,47, cifra que está por muy por debajo del valor estándar del Maturity Assessment in Patient Blood Management (generado a partir de la información global obtenida del conjunto de los participantes del proyecto)31,32.
Los pacientes transfundidos tienen peores resultados que los no transfundidos. Koch et al. han observado una mayor tasa de mortalidad (3,7 vs. 0,05%) en pacientes tratados con cirugía de revascularización coronaria que reciben hemocomponentes en el postoperatorio3. El aumento de la mortalidad es proporcional a cada CH transfundido. A partir de la 5.ª unidad, el riesgo de mortalidad aumenta 1,7 veces por concentrado administrado. El riesgo de infección también es mayor: se incrementa un 29% por CH recibido4. Otras complicaciones observadas con más frecuencia son: síndrome poscardiotomía, insuficiencia respiratoria e intubación prolongada, accidente cerebrovascular, infecciones, insuficiencia renal y mayor estancia hospitalaria3,5. Este efecto deletéreo de la transfusión puede ser directo, debido a sus indudables efectos adversos (fiebre, anafilaxia, hemólisis, sobrecarga hídrica, infecciones, lesiones pulmonares, etc.) o indirecto, achacable a la anemia asociada. Los pacientes que más se transfunden son los más anémicos y la anemia, como hemos visto, empeora los resultados.
¿Cuándo transfundir?Un estudio de correlación entre la anemia y la transfusión con la mortalidad a largo plazo tras CCM ha constatado que los peores resultados se observan en los pacientes con anemia preoperatoria que no se transfunden, seguidos por los anémicos transfundidos, luego los transfundidos no anémicos y, finalmente, los no anémicos ni transfundidos, que son los que mejor van33. Es decir, transfundir es malo, pero dejar de hacerlo y tener al paciente anémico puede ser peor. Por eso, es importante determinar un adecuado umbral de transfusión. El punto de corte en CCM es más controvertido que en otro tipo de pacientes, dado que el menor aporte de oxígeno motivado por la anemia lo toleran peor los pacientes cardiópatas. El ensayo clínico TRICS III, un estudio multicéntrico aleatorizado realizado en 5.035 pacientes, ha demostrado la no inferioridad de la terapia restrictiva (umbral transfusional de 7,5g/dL de hemoglobina) frente a la terapia liberal (umbral de 9,5g/dL)34. Este umbral de transfusión restrictivo reduce la tasa de transfusión en un 30%35,36 y es el recomendado actualmente en las guías clínicas, aunque siempre teniendo en cuenta la situación clínica del paciente, la repercusión hemodinámica y el sangrado37,38. En nuestro caso, la aplicación de un umbral restrictivo todavía más bajo (7g/dL) se ha traducido en una baja tasa de transfusión sin comprometer en absoluto los resultados clínicos.
ConclusiónLa aplicación de un PBM en CCM nos ha permitido alcanzar nuestros objetivos de calidad en cuanto a reintervención por sangrado y tasa de transfusión perioperatoria.
LimitacionesEl presente trabajo se ve limitado por el tamaño muestral y la falta de seguimiento, carencias que confiamos subsanar en futuras publicaciones. Nuestras conclusiones deben, por tanto, interpretarse con las debidas reservas. El fin del estudio es comunicar nuestra experiencia en la fase hospitalaria con la aplicación de un programa PBM en CCM, pero no dogmatizar sobre la medicina transfusional en este ámbito, que debe basarse en ensayos aleatorizados más amplios y en la experiencia individual de cada centro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.