La quinasa ligada a integrina (ILK) endotelial controla la producción del óxido nítrico, modulando señales de transducción al interior celular. La disminución de ILK endotelial se ha relacionado con la calcificación valvular. Analizamos la asociación de la ILK con la calcificación de la válvula aórtica.
MétodosEstudio observacional, unicéntrico y prospectivo. Recogimos tejido valvular aórtico de pacientes intervenidos de estenosis aórtica, y controles de válvulas no calcificadas. Cuantificamos los niveles de ILK endotelial empleando técnicas de análisis molecular, así como marcadores de crecimiento óseo (BMP2 y RUNX2). Para el control de factores de confusión empleamos regresión logística múltiple por pasos, introduciendo parámetros relacionados con la aterosclerosis y calcificación valvular (edad, DM, HTA, insuficiencia renal).
ResultadosObtuvimos muestras de 75 pacientes y 28 controles. El 69,9% eran varones, la edad media fue de 67 años (DE 9,59 años). Los niveles de ILK fueron significativamente más bajos en válvulas patológicas que en controles (0,96 vs. 0,76; p<0,001). Existió correlación lineal negativa significativa entre la ILK y la calcificación valvular (coeficiente de Pearson=−0,35; p=0,002). En el modelo multivariante, ILK presentó una asociación significativa con la calcificación valvular (OR 0,068; p<0,001), así como la DM (OR 11,80; p=0,03). Observamos un aumento de marcadores de crecimiento óseo según avanzaba la calcificación, con correlación inversa significativa de ILK y BMP2 (R=−0,417; p<0,001) y RUNX2 (R=−0,587; p<0,001).
ConclusionesLa disminución de la expresión endotelial de ILK puede influir en la calcificación de la válvula aórtica, marcando el inicio del proceso de transdiferenciación del endotelio valvular a tejido con capacidad osteogénica.
The endothelial integrin-linked kinase (ILK) controls the production of nitric oxide, modulating transduction signals of mechanical stress in the cell. Decreased endothelial ILK has been related to valve calcification. We analyzed the association of ILK expression with aortic valve calcification.
MethodsObservational, single-center and prospective study. Aortic valve tissue samples were obtained from patients whit aortic stenosis, and controls for non-calcified aortic valves. Endothelial ILK levels were quantified using molecular analysis techniques, as well as bone growth markers (BMP2 and RUNX2). Stepwise multiple logistic regression was used to control for confounding factors, introducing clinical parameters related to atherosclerosis and valve calcification (age, DM, HBP, kidney failure).
ResultsSamples from 75 patients whit aortic stenosis, and 28 controls were obtained. A percentage of 69.9 were men, mean age 67 years (SD 9.59 years). ILK levels were significantly lower in diseased valves than in controls (0.96 vs. 0.76; P<.001). There was a significant negative linear correlation between ILK and degree of valve calcification (Pearson linear correlation coefficient=−0.35; P=.002).In the multivariate model, ILK was significantly associated with valve calcification (OR adjusted 0.068; P<.001), as well as DM (OR 11.80; P=.03). In addition, an increase in bone growth markers was observed as calcification progressed, with a significant inverse correlation between ILK and BMP2 (R=−0.417; P<.001) and RUNX2 (R=−0.587; P<.001).
ConclusionsThe decrease in the endothelial expression of ILK may influence the calcification of the aortic valve, marking the beginning of the process of transdifferentiation of the valvular endothelium to tissue with osteogenic capacity.
La estenosis de la válvula aórtica es la valvulopatía más prevalente en la población adulta, y alrededor del 80% de los casos son debidos a degeneración calcificada1, seguidos de la enfermedad reumática y la valvulopatía bicúspide congénita. En mayores de 65 años, la esclerosis valvular aórtica está presente en un 29% de la población, con una tasa de progresión a estenosis aórtica de 1,7% al año2.
Se ha relacionado la disfunción del endotelio valvular con el inicio de la inflamación, el acúmulo de lípidos y el inicio de la calcificación valvular. La quinasa ligada a la integrina (ILK) es una proteína endotelial cuya presencia se ha relacionado con la preservación de esta función endotelial3.
La ILK es una serina/treonina que interactúa con la integrina beta-1 y se expresa ampliamente en tejidos de mamíferos. Desempeña funciones importantes en la transducción de señales inducida por la interacción entre las células y la matriz extracelular. Es una proteína clave mecanosensible que controla la producción endotelial de óxido nítrico (ON)4,5. La ILK endotelial protege y promueve la producción fisiológica del ON y previene la disfunción endotelial. Los mecanismos por los que la ILK influye en la calcificación valvular aún no han sido completamente esclarecidos.
En el siguiente estudio, analizaremos la relación de la expresión endotelial de la ILK a nivel valvular con el desarrollo de la calcificación de la válvula aórtica, en pacientes intervenidos de sustitución valvular aórtica calcificada, así como de un grupo de controles sin calcificación valvular.
MétodosPoblación a estudioEstudio observacional de cohortes prospectivo, unicéntrico, realizado en el Hospital Universitario Ramón y Cajal, desde enero del 2019 hasta diciembre del 2020. Se analizaron válvulas aórticas humanas obtenidas de pacientes intervenidos de sustitución valvular aórtica por estenosis aórtica severa calcificada.
Como grupo de control se incluyeron aquellos pacientes intervenidos de insuficiencia aórtica severa no calcificada.
Criterios de inclusión:
- 1.
Todo paciente intervenido de sustitución de válvula aórtica por estenosis aórtica severa o insuficiencia aórtica severa no candidata a reparación valvular, asociadas o no a otra enfermedad cardiaca.
Criterios de exclusión:
- 1.
Pacientes menores de 18 años.
- 2.
Pacientes con sustitución previa de válvula aórtica.
- 3.
Pacientes intervenidos por endocarditis de válvula aórtica o alguna otra válvula.
El Comité Ético de Investigación Clínica del Hospital Universitario Ramón y Cajal autorizó la realización del presente estudio, quedando reflejado en acta 356 el 17/12/2018. Todos los pacientes dieron su consentimiento informado por escrito y de forma individual.
Características clínicas y cardiológicasLas características demográficas, clínicas y cardiológicas fueron recogidas de manera prospectiva en el momento de la intervención en la base de datos del Servicio de Cirugía Cardiaca del Hospital Universitario Ramón y Cajal.
Estudio proteico de las válvulas aórticasLas proteínas se obtuvieron del lisado completo de la válvula aórtica. Las secciones se disgregaron mecánicamente con tampón de lisis para la liberación del contenido proteico, y se conservaron a −20°C. Posteriormente, se analizaron los niveles de expresión de ILK y de los marcadores de calcificación RUNX2 y BMP2 mediante la técnica Western Blot. En resumen, se separaron 15μg de proteínas en un gel de electroforesis de SDS-poliacrilamida y se transfirieron a una membrana de PVDF (Bio-Rad, Hercules, CA, EE. UU.). Para la detección de proteínas, las membranas se bloquearon durante una hora en BSA al 5% en tampón TTBS, y se incubaron con anticuerpos específicos toda la noche a 4°C. Tras varios lavados, las membranas se incubaron con un anticuerpo secundario durante una hora. Las bandas inmunorreactivas se visualizaron con el Pierce™ ECL Western Blotting Substrate según los procedimientos del fabricante (Pierce, Waltham, MA, EE. UU.). La cuantificación de las bandas se realizó usando el software ImageJ (National Institutes of Health, EE. UU.), normalizando los niveles de expresión de las proteínas de interés respecto al control de carga utilizado. Cada muestra se analizó como mínimo por triplicado.
Clasificación ecocardiográfica de la calcificación valvularSe realizó la valoración cualitativa mediante ecocardiografía transtorácica del grado de calcificación valvular aórtica. Las calcificaciones de las valvas aórticas se describieron empleando una escala ecocardiográfica ordinal validada, siguiendo el esquema de Bahler et al.6 mediante la observación de la válvula aórtica en el eje corto paraesternal. La gradación de la calcificación se estableció de acuerdo con la citada escala en 6 grados:
- -
Grado 1: sin calcificación.
- -
Grado 2: área localizada con calcificación, sin áreas de calcificación densa.
- -
Grado 3: marcado aumento de calcificación en uno de los velos.
- -
Grado 4: aumento notable de calcificación en 2 de los velos.
- -
Grado 5: con aumento moderado de la calcificación en los 3 velos.
- -
Grado 6: marcada calcificación en los 3 velos.
Por otro lado, para realizar el análisis univariante, se generó una variable dicotómica en función de la presencia o no de calcificación valvular intensa. Se consideraron como válvulas con calcificación intensa todas las válvulas con calcificación en al menos 2 de los velos de la válvula aórtica (grados 4, 5 y 6).
Variables analizadasSe recogieron datos demográficos y características clínicas preoperatorias (hipertensión arterial [HTA], enfermedad pulmonar obstructiva crónica, diabetes mellitus [DM], presencia y severidad de hipertensión pulmonar, antecedentes de insuficiencia renal, arritmias auriculares, enfermedad coronaria asociada, enfermedad valvular concomitante). Además, se obtuvieron datos ecocardiográficos preoperatorios (función ventricular izquierda, gradiente transvalvular medio y máximo de la válvula aórtica, área de la válvula aórtica indexada y grado de calcificación).
Se analizó la expresión de ILK, BMP2 y RUNX2 en los pacientes con válvulas calcificadas y no calcificadas.
Definición de variables- -
Función ventricular izquierda, considerando la fracción de eyección del ventrículo izquierdo como normal cuando era mayor o igual a 55%.
- -
La presión arterial pulmonar sistólica se estimó de forma indirecta por parámetros ecocardiográficos, considerándose hipertensión pulmonar leve si la presión pulmonar sistólica era mayor de 35mmHg, moderada si era mayor de 40mmHg y severa si era mayor de 55mmHg.
- -
Enfermedad hepática, considerada en aquellos pacientes que presentaban insuficiencia hepática diagnosticada previamente, o hepatitis B o C.
- -
Enfermedad renal, considerada en aquellos pacientes que presentaban insuficiencia renal crónica diagnosticada previamente.
- -
Estenosis aórtica severa, se consideró severa cuando el gradiente transvalvular máximo era igual o>80mmHg o el gradiente transvalvular medio era igual o>40mmHg, o un área valvular aórtica indexada<0,6cm2.
- -
Insuficiencia aórtica severa; se consideró severa cuando la vena contracta era≥6mm o cuando el flujo inverso en la aorta descendente era holodiastólico.
- -
La estimación de riesgo quirúrgico se realizó mediante las escalas de riesgo EuroSCORE I logístico y EuroSCORE II.
- -
Dislipidemia: considerada en aquellos pacientes previamente diagnosticados de dislipidemia.
- -
Estudiar la correlación de la expresión de la ILK con la calcificación valvular.
- -
Estudiar la correlación de la proteína morfogenética ósea con la calcificación valvular.
- -
Estudiar la correlación de la expresión de marcadores osteogénicos como RUNX2 con la calcificación valvular.
Todos los pacientes seleccionados en el estudio y evaluables según los criterios de inclusión y exclusión fueron considerados en el análisis.
Los datos fueron analizados utilizando el software estadístico Stata 14 (StataCorp. LP, College Station, TX, EE. UU.). Los datos estadísticos descriptivos se expresaron con un intervalo de confianza del 95%.
Las variables categóricas fueron descritas mediante distribuciones de frecuencias absolutas y relativas y se compararon mediante el test de chi cuadrado o el test de Fischer, según la frecuencia observada en las tablas de contingencia.
Las variables continuas con distribución normal fueron descritas utilizando la media y la desviación estándar; las variables no normales se expresaron con la mediana y el rango intercuartílico. Para analizar la correlación de variables numéricas se utilizó el test de Pearson para variables con distribución normal y el test de Spearman para variables con distribución no normal.
Para analizar las comorbilidades relacionadas con la calcificación valvular y el control de factores de confusión se empleó la regresión logística múltiple por pasos. Se creó un modelo multivariante, introduciendo para el control de posibles factores de confusión aquellas variables que a priori tienen plausibilidad biológica relacionadas con la calcificación valvular. Se generó un modelo multivariante en el que se incluyó la edad, el grado de calcificación, los niveles de ILK y comorbilidades relacionadas con la aterosclerosis y la calcificación valvular como son la DM, la HTA, la dislipidemia y la insuficiencia renal.
Se consideraron como valores significativos aquellos cuya probabilidad fuera menor del 5% (p<0,05). Se realizó el cálculo de la potencia estadística a través de un test de medias de variables independientes, obteniendo una potencia del 99%.
ResultadosCaracterísticas clínicas preoperatorias y comorbilidadesDurante el periodo de estudio se incluyeron un total de 103 pacientes, 75 con estenosis aórtica y 28 con insuficiencia aórtica.
Las características clínicas y cardiológicas y las comorbilidades preoperatorias más relevantes se presentan en la tabla 1. El 69,90% eran varones y la edad media de 67 años (DE 9,59). Las comorbilidades más prevalentes fueron la HTA (67,96%), la DM (26,21%) y la dislipidemia (52,43%).
Características clínicas y cardiológicas, y comorbilidades preoperatorias
| Variable | Valor |
|---|---|
| Características y comorbilidades | |
| Edad (años), media (DE) | 67 (12,61) |
| Sexo masculino, n (%) | 72 (69,90) |
| Diabetes mellitus, n (%) | 27 (26,21) |
| Dislipidemia, n (%) | 54 (52,43) |
| Enfermedad vascular periférica, n (%) | 19 (18,45) |
| Enfermedad pulmonar obstructiva crónica, n (%) | 17 (16,50) |
| Enfermedad hepática, n (%) | 3 (2,91) |
| Insuficiencia renal, n (%) | 11 (10,68) |
| Disfunción sistólica de VI, n (%) | 50 (48,54) |
| Hipertensión arterial, n (%) | 70 (67,96) |
| Insuficiencia cardiaca congestiva, n (%) | 15 (14,56) |
| Enfermedad coronaria, n (%) | 16 (15,53) |
| Clase funcional de la NYHA III-IV, n (%) | 51 (49,52) |
| Hipertensión pulmonar, n (%) | 44 (42,72) |
| Fibrilación auricular preoperatoria, n (%) | 24 (23,30) |
| QxVM concomitante, n (%) | 15 (14,56) |
| QxVT concomitante, n (%) | 6 (5,82) |
| Qx aorta concomitante, n (%) | 18 (17,48) |
| EuroSCORE I logístico, media (DE) | 8,47 (8,77) |
| EuroSCORE II, media (DE) | 4,67 (6,6) |
DE: desviación estándar; NYHA: New York Heart Association; VI: ventrículo izquierdo.
El 87,38% se encontraban en clase funcional II-III de la NYHA, y un 9,71% se encontraba en clase funcional IV de la NYHA.
La etiología con mayor incidencia fue la degenerativa calcificada, presente en 63 pacientes (61,17%), seguida de la valvulopatía reumática, presente en 6 pacientes (5,83%), y bicúspide en 6 pacientes (5,83%). Los niveles medios de ILK se encuentran reflejados en la tabla 2.
Los grados de calcificación se presentan en la tabla 3.
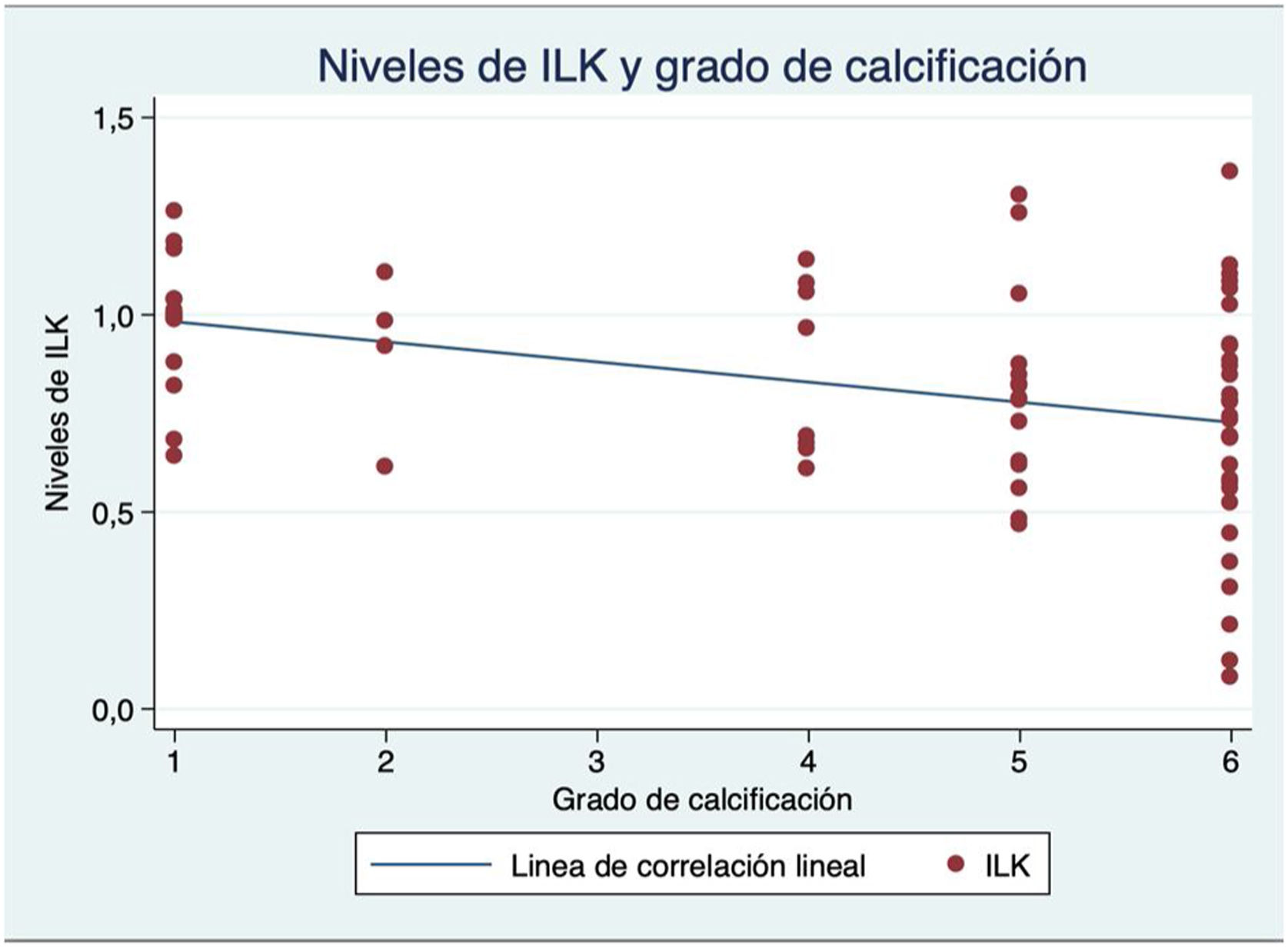
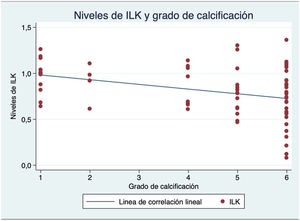
Los niveles de ILK medios en las muestras obtenidas fueron de 0,82, comparados con la proteína basal, con un rango desde 0,31 a 1,36. Existió una correlación lineal negativa significativa entre la ILK y el grado ordinal de calcificación valvular por ecocardiografía (coeficiente de correlación lineal de Pearson=−0,35, p=0,002) (fig. 1).
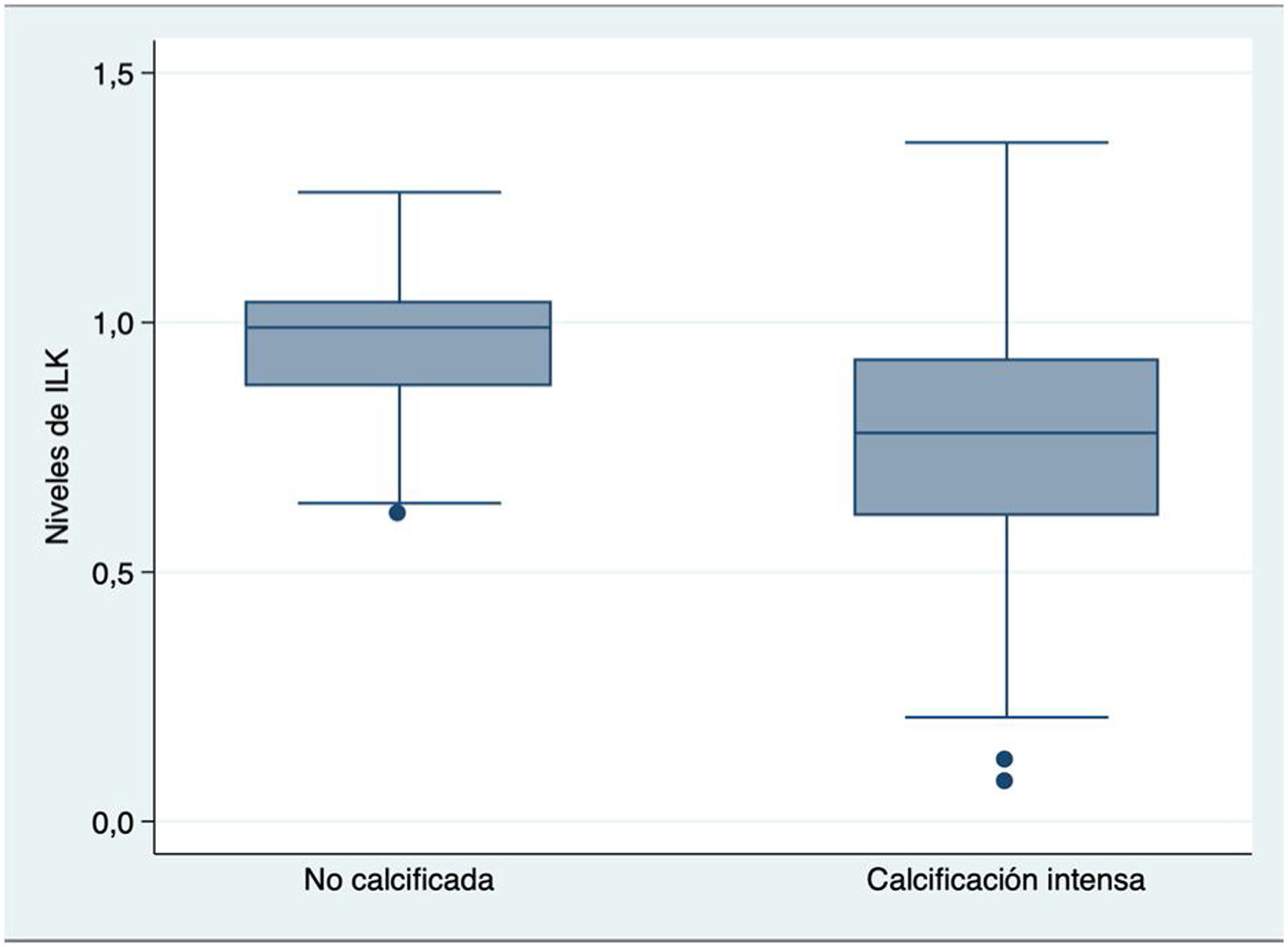
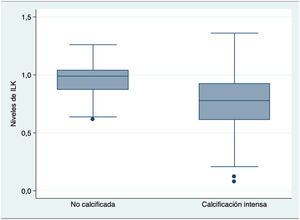
Los niveles medios de ILK fueron significativamente más bajos en las válvulas con calcificación intensa que en las válvulas sin calcificación intensa (0,76 vs. 0,96; p<0,001) (fig. 2), principalmente en las válvulas de etiología degenerativa calcificada con niveles medios de ILK de 0,74, en relación con las otras etiologías previamente descritas.
Esta diferencia en los niveles de ILK se mantenía a pesar del ajuste por posibles factores de confusión (edad, HTA, DM, insuficiencia renal y dislipidemia).
En el modelo multivariante en el que se incluyeron la edad, el grado de calcificación, los niveles de ILK, DM, HTA, dislipidemia e insuficiencia renal, la ILK presentó una asociación significativa con la calcificación valvular (OR ajustada 0,068; p<0,001).
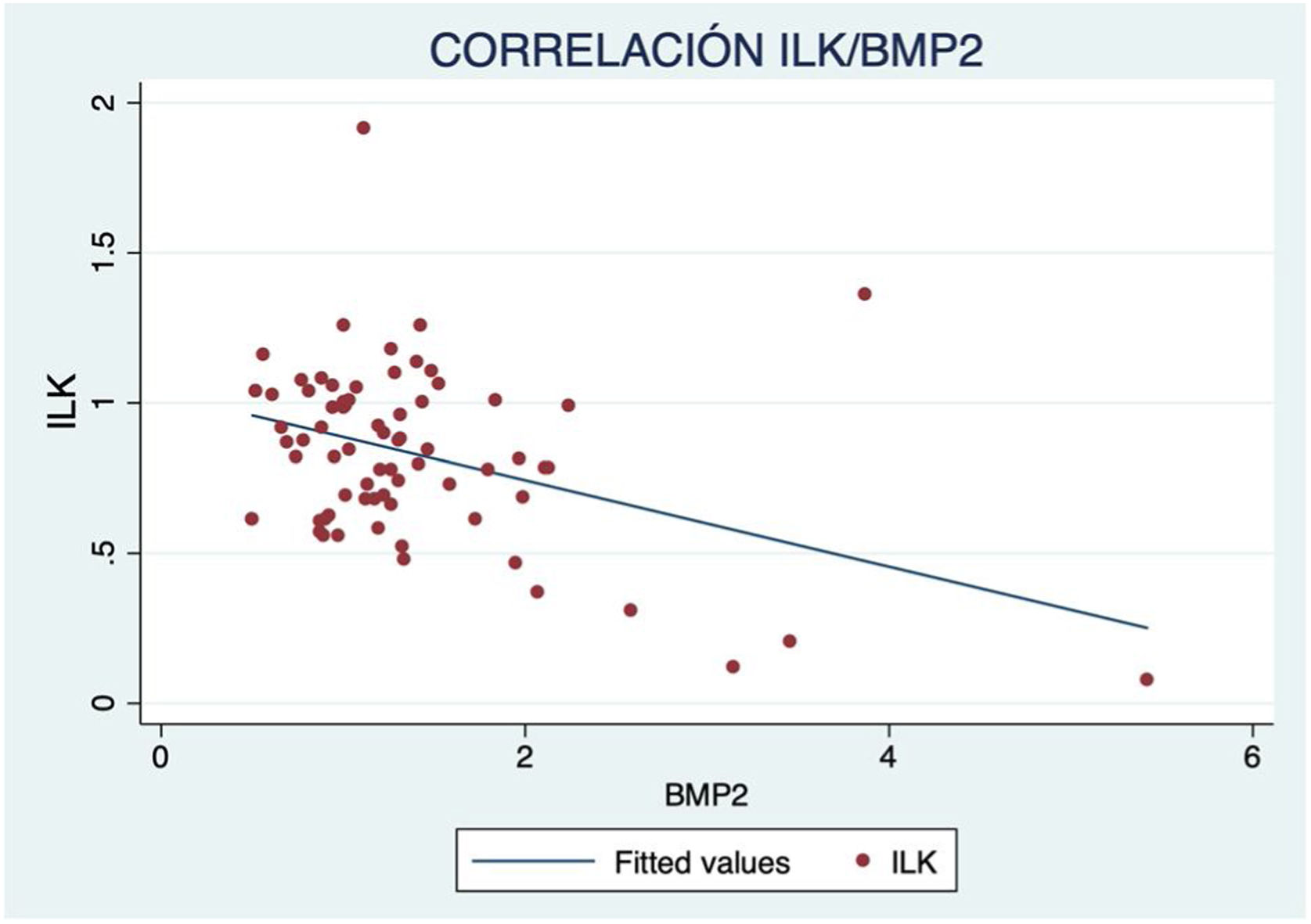
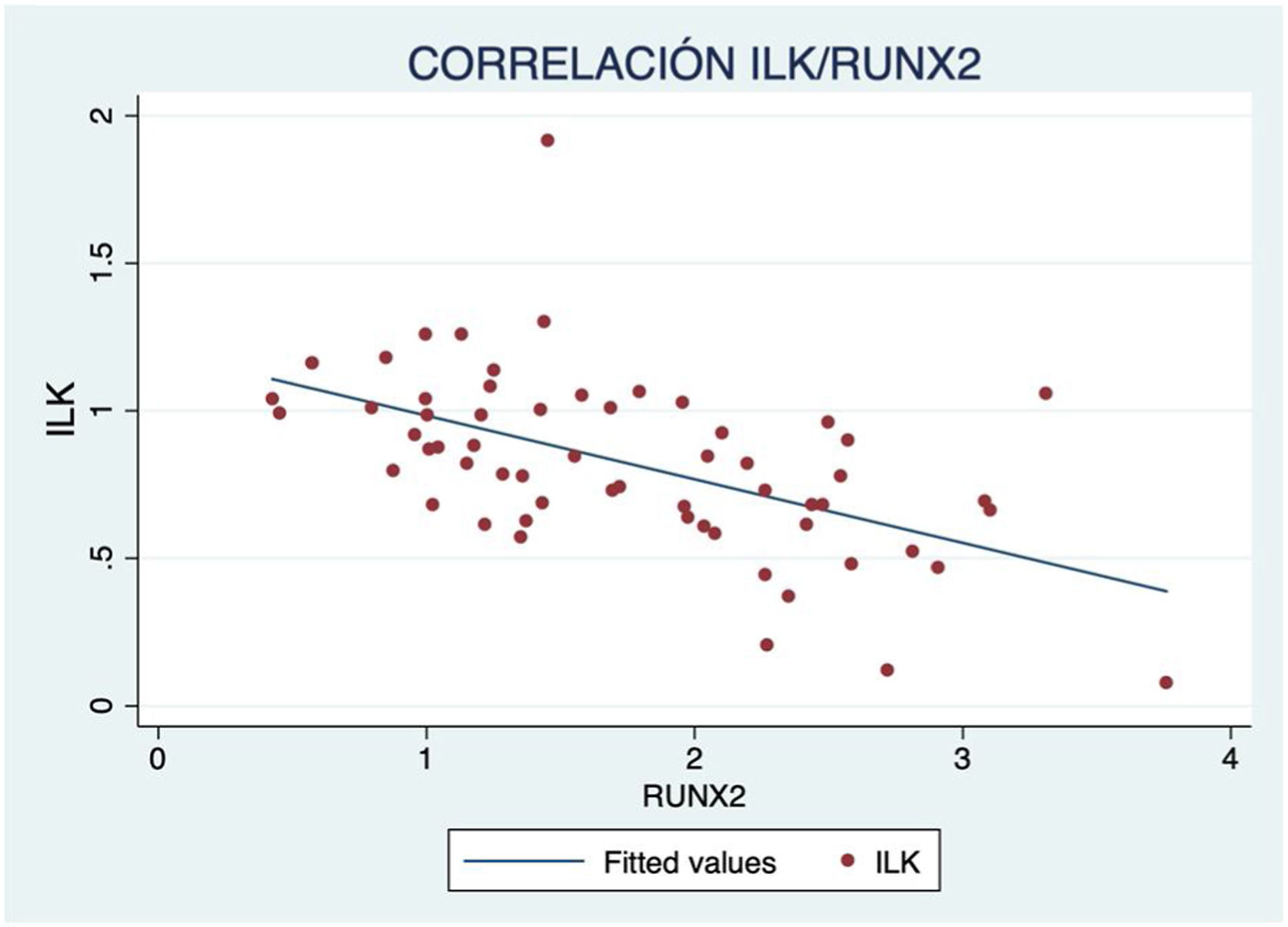
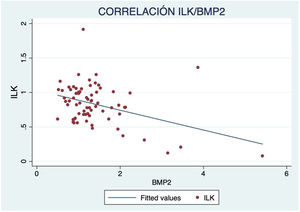
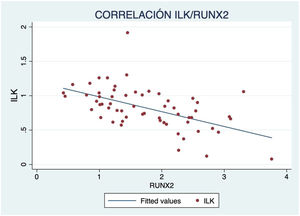
Además, se observó un aumento de marcadores de crecimiento óseo según avanzaba el grado de calcificación, con correlación inversa significativa de ILK y BMP2 (R=−0,417; p<0,001) (fig. 3) y RUNX2 (R=−0,587; p<0,001) (fig. 4).
DiscusiónLos mecanismos moleculares por los que acontece la calcificación de la válvula aórtica aún no son bien conocidos; en el siguiente estudio hemos relacionado la disminución de la ILK en el endotelio valvular con la etiopatogenia de la calcificación valvular y la transdiferenciación celular a células con capacidad osteogénica. La ILK es una proteína mecanosensible, implicada en la transducción de señales de estrés a través del endotelio. En el presente estudio analizamos la correlación de la ILK en el proceso de la calcificación de la válvula aórtica en la estenosis aórtica degenerativa, y observamos en nuestra muestra que los niveles de ILK eran menores en las muestras calcificadas que en los controles (0,76 vs. 0,96; p<0,001), lo que puede confirmar esta etiopatogenia de la estenosis valvular aórtica.
A lo largo del tiempo, la calcificación de la válvula aórtica se ha considerado consecuencia del envejecimiento, y aunque los mecanismos de la calcificación de la válvula aórtica siguen siendo desconocidos, en la actualidad se considera la calcificación de la válvula como un proceso activo de osificación, en el que la matriz extracelular valvular pierde su arquitectura debido a un daño en el endotelio7.
Se estima que la estenosis aórtica por calcificación valvular aórtica afecta a en torno al 2% de la población mayor de 65 años8, y probablemente esta incidencia tienda a aumentar por el envejecimiento de la población.
En primer lugar, es importante resaltar la estructura de los velos de la válvula aórtica, que se componen de una capa externa de células endoteliales valvulares, que está en continuidad con el endotelio de la aorta y el endocardio del ventrículo izquierdo, y 3 capas internas, compuestas por células intersticiales valvulares conocidas como capa fibrosa, capa espongiosa y capa ventricularis. Las células intersticiales valvulares in situ tienen características de fibroblastos en reposo, pero una vez activadas, pueden diferenciarse en otro tipo de células, como miofibroblastos y osteoblastos, que responden a señales celulares diferentes que los osteoblastos esqueléticos1,9.
La inflamación y el estrés oxidativo son los principales mecanismos de daño endotelial, producidos por factores de riesgo ateroscleróticos, similares a los de la aterosclerosis vascular9. La disfunción endotelial hace que haya una menor disponibilidad de los valores fisiológicos de ON en el endotelio valvular. El ON endotelial inhibe la calcificación regulando la vía de señalización Noch110,11.
El Noch1, conocido como una vía de señalización encargada del destino celular, se ha relacionado en el proceso del desarrollo óseo, de células sanguíneas y en diferenciación celular y la formación de válvulas cardiacas. En estudios previos, desarrollados con ratones, se ha observado que la presencia del Noch1 puede reprimir la actividad de BMP2 y RUNX2, y en su ausencia, un aumento de los niveles de los marcadores de crecimiento óseo anteriormente mencionados, teniendo como resultado un mayor calcificación de la válvula aórtica en los ratones12.
Consideramos que la ILK endotelial protege y promueve la producción fisiológica del ON y previene la disfunción endotelial. Un adecuado nivel de expresión de ILK es crítico para mantener una adecuada producción de ON por parte de la eNOS13.
Las citocinas proinflamatorias también juegan un papel importante en la calcificación valvular; una de ellas es el factor de crecimiento transformante B1, que tiene propiedades «formadoras de hueso» y pertenece a la familia de las proteínas morfogenéticas óseas (BMP2) y son un potente factor proosteogénico12,13.
La RUNX2 es un regulador transcripcional central del destino de los osteoblastos. En otros estudios se ha demostrado que la presencia de los marcadores BMP2 y RUNX2 en válvulas aórticas calcificadas aumenta antes de que aparezca la calcificación en las valvas aórticas14.
Por ello, se estudió el papel de la ILK en diferentes rutas de señalización implicadas en la formación de hueso y cartílago, como con la proteína morfogénica ósea (BMP) y RUNX2, debido a su implicación en la calcificación de la válvula.
Las BMP2 tienen la capacidad de modificar las células intersticiales valvulares a un fenotipo similar a osteoblastos, y de esta forma crear proteínas de matriz ósea con posterior formación de nódulos calcificados2.
En nuestro estudio, observamos una correlación inversa significativa entre niveles de BMP2 e ILK, lo que nos indica que a menor disponibilidad de ILK, existe mayor actividad osteogénica en las válvulas. Lo mismo se observó al correlacionarlo con el RUNX2, existiendo también una correlación inversa significativa.
La calcificación de la válvula aórtica se ha descrito anteriormente asociada a comorbilidades como la insuficiencia renal, la HTA, la dislipidemia y la DM. Incluso se ha planteado que el sistema renina-angiotensina podría estar involucrado en el proceso de calcificación en la válvula aórtica13; sin embargo, en nuestra muestra de pacientes la HTA no resultó ser factor independiente de riesgo de calcificación valvular. En nuestro análisis, las comorbilidades como la dislipidemia, la insuficiencia renal, e incluso la edad no resultaron ser factores de riesgo independientes asociados con la calcificación de la válvula aórtica.
Hemos propuesto un modelo multivariante incluyendo las variables mencionadas anteriormente, en el que a pesar del ajuste estadístico la ILK presentó asociación significativa con la calcificación valvular (OR ajustada 0,068; p<0,001).
La diabetes ha sido relacionada anteriormente en el estudio MESA (estudio multiétnico de aterosclerosis), en el que se incluyeron 5.723 pacientes y donde se demostró que la DM aumenta las probabilidades de desarrollar estenosis aórtica (OR 2,06). En el estudio CANHEART, realizado por el Equipo de Investigación de Atención Ambulatoria en salud cardiovascular, se observó en una cohorte de 9,8 millones de adultos que también se asocia la DM a un mayor riesgo de estenosis aórtica15. En nuestro estudio, la DM presentó una OR de 2,15, sin embargo, no fue significativo; es posible que se deba a un factor de confusión, aun así, es probable que debamos considerar realizar estudios de imagen de forma precoz a pacientes diabéticos.
Nuestro trabajo plantea que la calcificación de la válvula aórtica podría iniciarse a través de la disminución de la ILK con el inicio de la disfunción endotelial. Los mecanismos que inducen a la disminución de esta proteína de membrana no están claros en la actualidad, y se necesitan más estudios para clarificar este proceso.
En conclusión, con estos hallazgos se abre una puerta a la búsqueda de una diana terapéutica o un biomarcador que nos pueda ayudar a un diagnóstico temprano del inicio de la degeneración valvular, incluso antes de producir repercusión clínica, o incluso prevenir las consecuencias que se derivan de esta enfermedad.
Limitaciones del estudioDentro de las limitaciones del estudio se encuentra la falta del score de calcio guiado por tomografía computarizada, para obtener valores cuantitativos en el momento de analizar los marcadores de crecimiento óseo.
ConclusionesLa disminución de la expresión endotelial de ILK puede influir en la calcificación de la válvula aórtica, marcando el inicio del proceso de transdiferenciación del endotelio valvular a tejido con capacidad osteogénica.
FinanciaciónEsta investigación ha sido financiada por el Instituto de Salud Carlos III (PI20/00930) (MS) sostenido por el Fondo Europeo de Desarrollo Regional (FEDER).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.