Actualmente, existe un vacío de información en España respecto a la evidencia disponible en pacientes de más de 65años sobre los resultados clínicos y el consumo de recursos sanitarios relacionados con el uso de prótesis mecánicas o biológicas.
MétodosEstudio retrospectivo incluyendo pacientes mayores de 65años intervenidos de sustitución valvular aórtica aislada o con cirugía coronaria concomitante entre 2003 y 2016. Se aplicaron métodos de emparejamiento por puntuación de propensión y modelos multivariantes de riesgos competitivos para estimar las diferencias en mortalidad y en complicaciones mayores. Las diferencias en consumo de recursos sanitarios se contrastaron con pruebas no paramétricas y modelos multivariantes.
ResultadosLa muestra emparejada incluyó 522 casos (n=348 biológicas, n=174 mecánicas). A largo plazo no se encontraron diferencias significativas en la mortalidad (HR=0,848; IC95%: 0,663-1,086), ictus (HR=1,672; IC95%: 0,672-4,161) o reintervención valvular (HR=0,454; IC95%: 0,193-1,071). El riesgo de evento hemorrágico fue mayor para los portadores de una prótesis mecánica (HR=3,171; IC95%: 1,102-9,123; p=0,032). De manera intrahospitalaria, las prótesis mecánicas se asociaron a un mayor consumo de recursos.
ConclusionesEn pacientes con edad igual o superior a 65años, los portadores de prótesis mecánicas presentaron un riesgo incrementado de eventos hemorrágicos en el seguimiento. Las prótesis biológicas se asociaron a un menor consumo de recursos hospitalarios.
Currently in Spain, there is a gap in knowledge regarding clinical outcomes and resource utilization in patients aged ≥65years undergoing aortic valve replacement with a bioprosthesis or mechanical prosthesis.
MethodsThis is a retrospective study of patients older than 65years, undergoing aortic valve replacement, isolated or in combination with coronary artery bypass grafting between 2003 and 2016. Comparison between types of prosthesis for mortality and major adverse events and were performed in a propensity score matched cohort using competitive risk analysis. Resource utilization was compared with non-parametric tests and multivariant models.
Results522 patients were included (348 bioprosthesis, 174 mechanical). At long term, there were no significant differences in mortality (HR=0.848; 95%CI: 0.663-1.086), stroke (HR=1.672; 95%CI: 0.672-4.161) or valve reintervention (HR=0.454; 95%CI: 0.193-1.071). The risk for major bleeding was significantly higher for patients with a mechanical prosthesis (HR=3.171; 95%CI: 1.102-9.123; p=0.032). Regarding in-hospital resource utilization, mechanical prosthesis were associated to a higher consume.
ConclusionsIn patients aged ≥65, patients with a mechanical prosthesis were at higher risk for major bleeding at follow-up. Bioprosthesis were associated with a lower in-hospital resource utilization.
La estenosis aórtica es una de las valvulopatías más frecuentes en adultos y, dado el envejecimiento progresivo de la población en países occidentales, es ya un importante problema de salud. En Europa, las guías clínicas recomiendan la sustitución valvular aórtica (SVA) quirúrgica frente al implante transcatéter en pacientes por debajo de 75años y bajo riesgo quirúrgico (STS PROM / EuroSCOREII <4%) o en pacientes operables donde la vía transfemoral no resulta viable (grado de evidenciaI-B)1.
Por su parte, la elección entre el tipo de prótesis valvular (biológica o mecánica) dependerá de múltiples factores, como la esperanza de vida del paciente, su preferencia y estilo de vida, el riesgo tromboembólico relacionado con las terapias de anticoagulación y la capacidad de realizar un ajuste correcto de las mismas, y las posibilidades para una posible reintervención quirúrgica o transcatéter en los años siguientes. Actualmente, en pacientes mayores de 65años de edad se recomiendan las prótesis biológicas (IIa-C)1,2. Aunque su uso en nuestro país es variable en los últimos años en función de las comunidades autónomas, parece que en pacientes entre 60-70años las tasas de utilización de ambos tipos de prótesis son similares desde 2016, aunque a partir de 70años las tasas por millón de implantes de prótesis mecánica ha descendido notablemente en la medida que se ha incrementado el uso de prótesis biológicas y el implante transcatéter3.
Hasta la fecha, si bien el reciente estudio SPAVALVE analizó los resultados diferenciales en pacientes entre 50 y 65años4, existe un claro vacío de información en España con respecto a las evidencias disponibles en pacientes de más de 65años sobre los resultados clínicos y sobre los consumos de recursos sanitarios relacionados con el uso de prótesis mecánicas y la necesidad de seguir un tratamiento anticoagulante, monitorización del rango de anticoagulación y manejo de posibles complicaciones. Debido a esto, el presente estudio tiene como objetivo realizar un análisis comparativo de los resultados asociados a las prótesis biológicas y mecánicas en esta población de pacientes ≥65años, primero en términos clínicos (muerte, complicaciones postoperatorias y a largo plazo) y también, en relación con los consumos de recursos sanitarios como la estancia hospitalaria, re-hospitalizaciones y necesidad de tratamiento anticoagulante de por vida.
MétodosPoblaciónEl estudio consistió en un análisis retrospectivo de los registros médicos de todos los pacientes intervenidos en nuestro centro entre abril de 2003 y diciembre de 2016 con SVA aislada o con revascularización coronaria quirúrgica concomitante, siguiendo la práctica clínica habitual. La información del registro se ha descrito en una publicación previa5. Se excluyeron aquellos pacientes que tuvieran otras intervenciones valvulares concomitantes o que hubieran sido intervenidos de SVA de forma previa al horizonte temporal definido. Además, se consideraron únicamente aquellos pacientes de 65años o más que cumplieran dicho criterio de inclusión.
Respecto a los procedimientos quirúrgicos, todos se realizaron con acceso quirúrgico mediante esternotomía media o miniesternotomía bajo anestesia general y circulación extracorpórea. En todos los casos, en la elección de la prótesis a implantar se consideró la opinión informada del paciente y aspectos clínicos relevantes en la toma de decisiones como contraindicaciones para la terapia de anticoagulación. Este proceso se llevó a cabo de acuerdo al protocolo del centro, que, a su vez, observa las recomendaciones de las guías clínicas de referencia en el momento del estudio.
DefinicionesLa mortalidad perioperatoria fue definida como muerte por cualquier causa a 30días tras la intervención o durante el ingreso hospitalario, independientemente del tiempo de estancia.
El infarto de miocardio postoperatorio fue definido como un incremento en troponinaT o CK-MB superior a 5veces el rango de referencia durante las primeras 72horas tras la intervención, esto asociado a cambios electrocardiográficos o ecocardiográficos sugerentes de isquemia.
El ictus fue definido como un déficit neurológico global o focal, con duración mayor a 24horas o menor a 24horas en caso de existir evidencia mediante imagen de hemorragia o infarto reciente6.
El evento hemorrágico mayor incluyó las categorías de evento hemorrágico mayor y evento hemorrágico que amenaza la vida de acuerdo a las definiciones del Valve Academic Research Consortium26.
La estimación de riesgo preoperatorio fue realizada empleando el European System for Cardiac Operative Risk Evaluation (EuroSCOREI). El riesgo quirúrgico alto fue definido como un EuroSCORE ≥67.
El consumo elevado de recursos hospitalario fue definido como una estancia hospitalaria tras la intervención mayor o igual a 7días o una estancia en la unidad de cuidados intensivos mayor o igual a 3días8.
Variables del estudioEn el registro se recoge de forma sistemática información detallada sobre las características clínicas de cada caso, variables sobre la intervención quirúrgica, su resultado hasta el alta hospitalaria, el estado del paciente a los 30días y de seguimiento. Se registraron las complicaciones clínicas y las visitas de seguimiento de cada paciente hasta junio de 2020, contrastando los datos del registro con el nacional de defunciones en los casos necesarios con el objeto de realizar el análisis de supervivencia.
Análisis estadísticoEl análisis estadístico se basó en un análisis descriptivo de la información previa al procedimiento, la intervención y los resultados hasta el alta hospitalaria, así como del seguimiento con la información disponible hasta junio de 2020. Se aplicó un test de distribución normal (Kolmogorov Smirnov —corrección Lilliefors—) para las variables continuas, y se calcularon la media y la desviación estándar, mientras que, para variables categóricas, se señaló la frecuencia absoluta y relativa de pacientes en cada grupo definido. Se contrastó la existencia de diferencias estadísticamente significativas entre muestras independientes de variables continuas con pruebas de T-test o ANOVA, en caso de variables con distribución paramétrica y U Mann-Whitney-Wilcoxon, o Kruskal-Wallis si su distribución no se ajustaba a la normalidad. Asimismo, en los contrastes de variables categóricas se aplicaron pruebas de test exacto de Fisher, en caso de que la variable independiente fuera dicotómica, o de test chi-cuadrado, de Pearson para variables politómicas. A continuación, se aplicó una técnica de emparejamiento por puntuación de propensión (propensity score matching) para ajustar las características basales entre ambos grupos de pacientes. El cálculo de la puntuación se realizó usando una regresión logística multivariante con varios factores de los pacientes. Dichos factores fueron seleccionados por un algoritmo estadístico que estimó automáticamente el mejor ajuste posible atendiendo al criterio de información de Akaike. Debido a su relevancia clínica, tanto la edad como la fracción de eyección del ventrículo izquierdo (FEVI) fueron incluidas en todos los modelos multivariantes para ajustar convenientemente los resultados. Tras comprobar que las características de los grupos estaban equilibradas (diferencias de medias estandarizadas), se ejecutó un algoritmo de emparejamiento basado en las anteriores puntuaciones utilizando la técnica de nearest neighbour y una ratio 2:1 (dos pacientes con prótesis biológica por cada paciente con prótesis mecánica).
Sobre la muestra emparejada, se llevaron a cabo modelos multivariantes de supervivencia para estimar el riesgo de complicaciones hasta el alta y durante el seguimiento, incluyendo muerte por cualquier causa, ictus, reintervención, hemorragia mayor y un composite de ellas. Se calculó la supervivencia utilizando modelos no paramétricos de Kaplan-Meier y los resultados de ambos grupos se compararon con la prueba log-rank. Posteriormente, se plantearon modelos semi-paramétricos de Cox para la corrección de los hazard ratios (HR) y la comparación de los riesgos competitivos (método Fine-Gray). De nuevo, las variables de cada modelo fueron seleccionadas automáticamente por un algoritmo estadístico en función del criterio de información de Akaike. De forma complementaria al análisis de supervivencia, se plantearon modelos multivariantes de supervivencia hasta la ocurrencia durante el seguimiento de eventos adversos mayores (major adverse events [MAE]) (ictus, hemorragia mayor, reintervención), un compuesto de todos ellos y otro excluyendo el riesgo de reintervención (MAE sin reintervención), para aislar su influencia dada su elevada presencia en la muestra.
Se ejecutó un modelo de conteo multivariante usando la distribución binomial negativa para estudiar los factores asociados a la estancia hospitalaria tras la cirugía en planta y en la unidad de cuidados intensivos tras la operación. La distribución de Poisson fue descartada, dado que los datos no cumplían su asunción de igualdad de media y varianza. La binomial negativa era más apropiada para este estudio, pues es más flexible con esta hipótesis. Asimismo, se planteó una regresión logística multivariante para identificar los factores asociados a un consumo elevado de recursos hospitalarios hasta el alta tras la intervención quirúrgica. Los factores candidatos para el análisis fueron seleccionados en base al criterio clínico y la evidencia empírica, y su inclusión se decidió siguiendo el método exploratorio descrito por Hosmer y Lemeshow9 y Zhang10. Tras ejecutar una regresión univariante de cada factor candidato sobre el consumo elevado de recursos, se incluyeron finalmente en el análisis multivariante aquellos con un valor de p <0,250. El análisis estadístico de los datos se llevó a cabo con el programa estadístico R (versión 4.0.4; https://www.r-project.org/).
Consideraciones éticasEl protocolo del estudio (código: ED-VAL-2018-01 v.1.2) fue aprobado por el Comité Ético de nuestro centro (acta 6.2/18) y se llevó a cabo de acuerdo a la Declaración de Helsinki de la Asociación Médica Mundial (junio de 1964) sobre principios éticos para las investigaciones médicas en seres humanos y en sus posteriores revisiones (Brasil, octubre de 2013). Debido al diseño y la fuente de información, el estudio se consideró exento de la recogida del consentimiento informado.
ResultadosUn total de 1.055 pacientes fueron incluidos en el estudio: 881 (83,51%) portadores de una prótesis biológica y 174 (16,49%) de una mecánica (tabla 1). El emparejamiento (ratio 2:1) permitió obtener una muestra para el análisis conformada por 522 pacientes (348 [66,66%] prótesis biológica y 174 [33,33%] prótesis mecánica) con un buen ajuste en el perfil de riesgo (EuroSCORE) y clase funcional (escala NYHA), entre otras (tabla 1). No obstante, en esta muestra emparejada aún se encontraron diferencias estadísticamente significativas entre grupos, en edad (72,52 años; DE=4,25 en biológicas y 71,67años; DE=4,89 en mecánicas; p=0,041) y en la FEVI (55,73%; DE=21,77 vs. 48,48%; DE=27,94; p=0,001). La tabla 1 muestra las características fundamentales de los pacientes incluidos en la muestra original (sin emparejar) y en la emparejada. Los resultados detallados a continuación se circunscriben a la muestra emparejada.
Estadísticos descriptivos de las características intraoperatorias y postoperatorias
| Muestra sin emparejar | Muestra emparejada | ||||||
|---|---|---|---|---|---|---|---|
| Biológicasn=881n (%) | Mecánicasn=174n (%) | p | Biológicasn=348n (%) | Mecánicasn=174n (%) | p | SMD | |
| Sexo (H) | 442 (50,17) | 95 (54,59) | 0,325 | 191 (54,88) | 95 (54,59) | 1,000 | 0,006 |
| Edad, media (DE) | 76,41 (5,14) | 71,67 (4,89) | <0,001 | 72,52 (4,25) | 71,67 (4,89) | 0,041 | 0,186 |
| Angioplastia coronaria | 55 (6,24) | 12 (6,89) | 0,878 | 19 (5,45) | 12 (6,89) | 0,647 | 0,060 |
| Tabaquismo | 240 (27,24) | 51 (29,31) | 0,642 | 106 (30,5) | 51 (29,31) | 0,866 | 0,025 |
| Diabetes | 276 (31,33) | 51 (29,31) | 0,951 | 116 (33,3) | 51 (29,31) | 0,789 | 0,096 |
| HTA | 690 (78,31) | 132 (75,86) | 0,539 | 255 (73,31) | 132 (75,86) | 0,596 | 0,059 |
| Dislipemia | 533 (60,49) | 99 (56,89) | 0,423 | 205 (58,9) | 99 (56,89) | 0,730 | 0,041 |
| Arteriopatía periférica | 80 (9,11) | 20 (11,49) | 0,394 | 32 (9,21) | 20 (11,49) | 0,502 | 0,076 |
| EPOC | 117 (13,28) | 28 (16,09) | 0,388 | 54 (15,51) | 28 (16,09) | 0,966 | 0,016 |
| Ictus previo | 43 (4,91) | 12 (6,89) | 0,365 | 20 (5,71) | 12 (6,89) | 0,747 | 0,047 |
| IMC, media (DE) | 27,78 (6,17) | 28,01 (6,09) | 0,655 | 27,93 (6,31) | 28,01 (6,09) | 0,887 | 0,013 |
| IRC | 108 (12,26) | 21 (12,07) | 1,000 | 39 (11,21) | 21 (12,07) | 0,884 | 0,027 |
| IAM reciente | 16 (1,81) | 1 (0,57) | 0,390 | 2 (0,56) | 1 (0,57) | 1,000 | <0,001 |
| Ritmo sinusal | 758 (86,04) | 128 (73,56) | <0,001 | 278 (79,98) | 128 (73,56) | 0,127 | 0,150 |
| Marcapasos previo | 188 (21,34) | 29 (16,67) | 0,197 | 68 (19,54) | 29 (16,67) | 0,499 | 0,075 |
| Diámetro aurícula izquierda, media (DE) | 28,81 (20,53) | 24,37 (22,42) | 0,010 | 26,95 (21,98) | 24,37 (22,42) | 0,209 | 0,116 |
| FEVI, media (DE) | 56,97 (21,02) | 48,48 (27,94) | <0,001 | 55,73 (21,77) | 48,48 (27,94) | 0,001 | 0,290 |
| PCP, media (DE) | 5,68 (5,90) | 4,33 (5,94) | 0,006 | 4,93 (5,22) | 4,33 (5,94) | 0,006 | 0,108 |
| PSAP, media (DE) | 22,89 (15,53) | 18,16 (17,60) | <0,001 | 22,29 (15,53) | 18,16 (17,60) | <0,001 | 0,249 |
| EuroSCORE I, media (DE) | 7,97 (6,23) | 7,38 (6,74) | 0,259 | 6,74 (6,06) | 7,38 (6,74) | 0,277 | 0,099 |
| NYHA (III-IV), n (%) | 18 (2,04) | 4 (2,29) | 0,765 | 4 (1,15) | 4 (2,29) | 0,381 | 0,161 |
| CCS (3-4), n (%) | 38 (4,31) | 8 (4,59) | >0,900 | 16 (4,59) | 8 (4,59) | 0,948 | 0,088 |
| Variables del procedimiento | |||||||
| Tiempo de CEC, media (DE) | 64,77 (30,86) | 69,20 (26,82) | 0,078 | 65,80 (39,76) | 69,20 (26,82) | 0,311 | 0,100 |
| Tiempo de isquemia, media (DE) | 49,74 (16,94) | 51,44 (17,76) | 0,231 | 50,65 (19,96) | 51,44 (17,76) | 0,658 | 0,042 |
CCS: grado de angina según el score CCS; CEC: circulación extracorpórea; DE: desviación estándar; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; H: hombre; HTA: hipertensión arterial; IAM: infarto agudo de miocardio; ICC: insuficiencia cardiaca congestiva preoperatorio; IMC: índice de masa corporal; IRC: insuficiencia renal crónica; NYHA: New York Heart Association; PCP: presión capilar pulmonar; PSAP: presión sistólica pulmonar; SMD: diferencia de medias estandarizadas.
En general, las intervenciones quirúrgicas tuvieron un buen perfil de efectividad y seguridad a corto plazo (tabla 2). Se registraron 26 casos de muerte postoperatoria, de los cuales 17 (4,91%) correspondían a pacientes con prótesis biológicas y 9 (5,21%) a pacientes con prótesis mecánicas, sin existir diferencias estadísticamente significativas entre grupos.
Complicaciones postoperatorias
| Complicaciones | Biológicas(n=348)n (%) | Mecánicas(n=174)n (%) | p |
|---|---|---|---|
| Hemorragia | 30 (8,62) | 16 (9,19) | 0,956 |
| Sangrado | 20 (5,75) | 10 (5,75) | 1,000 |
| Mediastinitis | 6 (1,72) | 6 (3,45) | 0,353 |
| Infarto agudo de miocardio | 7 (2,01) | 3 (1,72) | 1,000 |
| Taponamiento | 12 (3,45) | 7 (4,02) | 0,934 |
| Intubación prolongada | 27 (7,76) | 22 (12,64) | 0,100 |
| Terapia de sustitución renal | 13 (3,74) | 4 (2,29) | 0,542 |
| Ictus | 11 (3,16) | 9 (5,17) | 0,375 |
| Ataque isquémico transitorio | 5 (1,44) | 5 (2,87) | 0,429 |
| Sepsis | 6 (1,72) | 5 (2,87) | 0,590 |
| Muerte de origen cardiaco | 6 (1,72) | 1 (0,57) | 0,501 |
| Muerte postoperatoria | 17 (4,89) | 9 (5,17) | 1,000 |
Con relación a la supervivencia (fig. 1, tabla 2S), no se encontraron diferencias estadísticamente significativas (HR=0,848; IC95%: 0,663-1,086; p=0,190) entre ambos tipos de prótesis durante los años de seguimiento (media 6,44años; DE: 4,20años). La enfermedad pulmonar obstructiva crónica (EPOC), la FEVI, el EuroSCORE y el nivel de creatinina fueron factores de riesgo asociados a una mayor mortalidad (tabla 3).
Riesgos proporcionales para muerte por cualquier causa durante el seguimiento
| Factores | HR | IC (95%) | p |
|---|---|---|---|
| EPOC | 1,64 | (1,219-2,181) | <0,001 |
| FEVI | 1,01 | (1,009-1,011) | <0,001 |
| EuroSCORE | 1,03 | (1,009-1,051) | <0,001 |
| Creatinina | 1,26 | (1,009-1,571) | 0,041 |
| Tipo de prótesis (1=mecánicas) | 0,85 | (0,659-1,091) | 0,191 |
EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; HR: hazard ratio; IC: intervalo de confianza.
En el análisis por riesgos competitivos no se encontraron diferencias estadísticamente significativas entre ambos grupos respecto al riesgo de ictus (HR=1,672; IC95%: 0,672-4,161; p=0,271) o reintervención valvular (HR=0,454; IC95%: 0,193-1,071; p=0,071). Sin embargo, observamos diferencias significativas respecto al riesgo de hemorragia mayor para los portadores de prótesis mecánicas (HR=3,171; IC95%: 1,102-9,123; p=0,032). La tabla 4 resume los resultados obtenidos para los modelos sin ajustar, los ajustados por Cox y los riesgos competitivos.
Análisis multivariante ajustado de las complicaciones mayores registradas en el seguimiento y asociadas a la sustitución valvular aórtica por tipo valvular (Válvula 1=mecánicas)
| Evento | Sin ajustar | Ajustado (Cox) | Riesgos competitivos | p |
|---|---|---|---|---|
| Muerte | 0,824 (0,645-1,052) | 0,848 (0,663-1,086) | − | 0,190 |
| Ictus | 1,215 (0,499-2,957) | 1,336 (0,536-3,327) | 1,672 (0,672-4,161) | 0,270 |
| Hemorragia mayor | 1,998 (0,695-5,742) | 2,353 (0,806-6,868) | 3,171 (1,102-9,123) | 0,032 |
| Reintervención | 0,246 (0,101-0,599) | 0,258 (0,103-0,650) | 0,454 (0,193-1,071) | 0,071 |
| MAE | 0,679 (0,416-1,109) | 0,759 (0,458-1,255) | 1,137 (0,702-1,841) | 0,600 |
| MAE (sin reintervención) | 0,938 (0,544-1,617) | 1,108 (0,633-1,942) | 1,374 (0,798-2,365) | 0,250 |
MAE: eventos adversos mayores (incluye muerte, ictus, hemorragia mayor y reintervención).
Los valores superiores muestran los HR, mientras que los valores inferiores muestran el intervalo de confianza (95%).
Respecto al consumo de recursos sanitarios, no observamos diferencias significativas en la estancia hospitalaria tras la intervención (11,3días, DE: 14,15 para prótesis biológicas vs 12,4 días, DE: 13,41 en mecánicas; p=0,393). No obstante, se observó una mayor estancia en cuidados intensivos para portadores de prótesis mecánicas (2,95días, DE: 8,23 vs 6,81días, DE: 31,13; p=0,031). Por otro lado, durante el seguimiento tras el alta el número de visitas al cardiólogo fue similar, con una media de 3 visitas en ambos grupos (p=0,485); la media de visitas a urgencias (biológicas: 0,20, DE: 0,76; mecánicas: 0,13, DE: 0,47; p=0,105) y re-hospitalizaciones por causa cardiovascular (biológicas: 0,08, DE: 0,33; mecánicas: 0,06, DE: 0,35; p=0,413) fue similar para ambos grupos. El número de ecografías realizadas entre los pacientes con prótesis biológica fue significativamente mayor (3,45, DE: 3,64, frente a 2,33, DE: 2,88; p<0,001). Por otra parte, el porcentaje de pacientes con tratamiento anticoagulante de por vida fue superior en el caso de las válvulas mecánicas (31,61% frente al 82,8%; p<0,001).
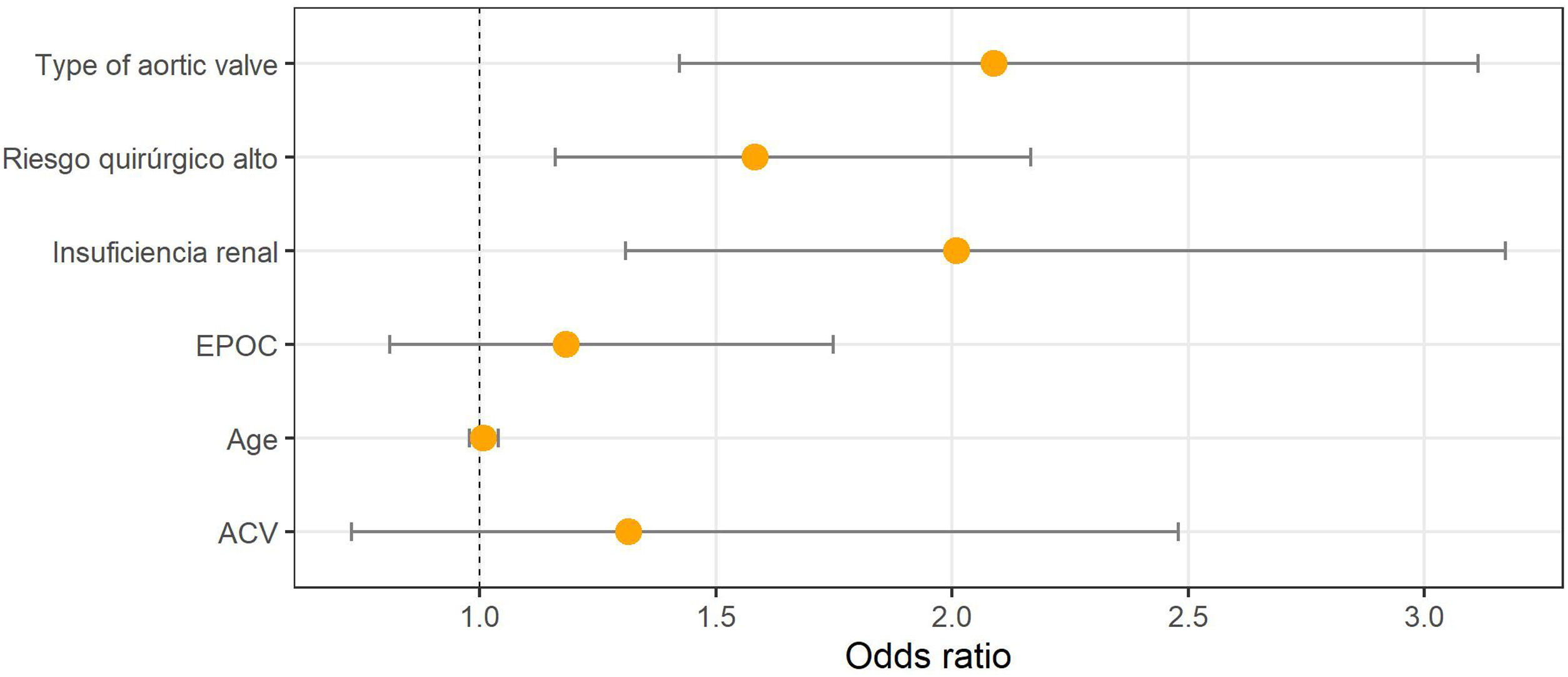
Finalmente, en el análisis multivariante para identificar los factores asociados a un elevado consumo de recursos hospitalarios se consideraron como potenciales factores explicativos el tipo de prótesis, el riesgo quirúrgico alto (EuroSCORE ≥6), la edad, la existencia de EPOC, accidentes cerebrovasculares previos e insuficiencia renal (fig. 2, tabla 1S). En el caso de la estancia en cuidados intensivos elevada, únicamente el riesgo quirúrgico y la existencia de insuficiencia renal fueron relevantes como factores explicativos asociados (fig. 3).
Factores asociados a consumo elevado de recursos hospitalarios (≥7 días).
Factores explicativos, coeficiente (error estándar, valor de p): Tipo prótesis, 0,736 (0,199, p<0,001); riesgo quirúrgico alto, 0,459 (0,159, p=0,003); edad, 0,008 (0,015, p=0,594); EPOC (enfermedad pulmonar obstructiva crónica), 0,168 (0,195, p=0,388); ACV (accidente cerebrovascular), 0,274 (0,310, p=0,376); insuficiencia renal, 0,698 (0,224, p=0,001).
Desde el punto de vista clínico, en términos de seguridad hasta el alta hospitalaria no identificamos diferencias significativas entre prótesis mecánicas y biológicas en pacientes mayores de 65años. De manera similar, a largo plazo, el tipo de prótesis no parece influir de manera significativa en la supervivencia o en el ictus. No obstante, observamos un riesgo significativamente mayor de eventos hemorrágicos en el seguimiento en los portadores de prótesis mecánicas. Estos resultados presentan similitudes con lo descrito en un registro multicéntrico en España recientemente publicado4 con datos a largo plazo de pacientes con edades comprendidas entre 50 y 65años y con lo reportado por Goldstone et al.11 en un análisis del registro de salud del estado de California. Por otro lado, Kytö et al.12, en su análisis del registro nacional de salud finlandés sobre prótesis aórticas biológicas o mecánicas en mayores de 70años, reportaron un beneficio en la supervivencia en portadores de prótesis biológicas, además de un menor riesgo de eventos hemorrágicos.
Si bien nuestro análisis es pionero en el estudio de factores explicativos de un mayor consumo de recursos en SVA, un análisis similar fue llevado a cabo por Okoh et al.8 en pacientes con implante transcatéter, definiendo un nivel alto de consumo de recursos como casos con 7días de hospitalización o continuidad asistencial en otro centro. En dicho trabajo se describieron como factores explicativos de un mayor consumo de recursos el año de realización de la cirugía (más alto en intervenciones durante 2012 frente a las realizadas a partir de 2017, como cabe esperar por la experiencia con la técnica), la edad de los pacientes, el sexo (mayor estancia en mujeres), el antecedente de EPOC y enfermedad coronaria, entre otras. En nuestro trabajo encontramos que el riesgo quirúrgico alto, el tipo de prótesis y la insuficiencia renal se asocian a una estancia más prolongada tras la intervención. En cuanto a la estancia en cuidados intensivos, únicamente la insuficiencia renal y el riesgo quirúrgico alto se asociaron a una mayor estancia.
En términos de consumo de recursos en el seguimiento, las prótesis biológicas presentan un riesgo mayor de reintervención y pueden presentar ventajas respecto al riesgo de eventos hemorrágicos y costos asociados al control de anticoagulación. Recientemente Nguyen et al.13 publicaron los resultados de un modelo económico que comparó costos de distintos eventos (muerte, reintervención, hemorragia, trombosis, endocarditis y control de anticoagulación) entre prótesis aórticas biológicas y mecánicas a medio y a largo plazo, estratificado en tres grupos de edad (45, 55 y 65años). Desde los 30días y hasta 25años tras la intervención, se estimó un costo más bajo para las intervenciones donde se empleó una prótesis biológica en comparación con las mecánicas. Se identificó que, a largo plazo, las reintervenciones y el control de anticoagulación tuvieron el mayor impacto en costos. En nuestro estudio identificamos resultados similares respecto a dichos eventos, que, añadidos a una menor estancia hospitalaria en portadores de prótesis biológicas, podrían traducirse en un menor consumo de recursos tanto a corto como a largo plazo.
En cuanto a las limitaciones de este trabajo, se debe reconocer, en primer lugar, la naturaleza retrospectiva del análisis estadístico. En este punto, cabe señalar que se llevó a cabo un análisis de muestras emparejadas por riesgos competitivos para ajustar los grupos comparados y se diseñó, siguiendo los trabajos de referencia metodológica, un análisis detallado con modelos multivariantes ajustados para el estudio de los resultados clínicos y de recursos sanitarios. En dichos modelos multivariantes siempre se incluyeron las variables de edad y FEVI para ajustar convenientemente los resultados para cada caso, ya que, a pesar de que los métodos de emparejamiento empleados minimizaron la heterogeneidad intergrupal, aún persistían ciertas diferencias que debían ser consideradas por su importancia clínica. Debido a estas limitaciones, reconocemos que estos resultados deben tomarse con la precaución debida, más si cabe cuando se trata de un estudio unicéntrico, por lo que la capacidad de generalización de los resultados debe estar sujeta a replicación en otros centros de referencia. En este sentido, los hallazgos de este estudio deberían ser contrastados en estudios prospectivos con una muestra más representativa de centros, si es posible, con el fin de aumentar el nivel de evidencia disponible. Por último, hay que tener en cuenta que el periodo de observación, con procedimientos quirúrgicos desde 2005, incluye un rango extenso de válvulas biológicas con desiguales propiedades de anti-calcificación y durabilidad, por lo que sería relevante realizar un análisis similar comparando para ambos grupos prótesis con tecnologías más recientes. Además, el tiempo medio de seguimiento de 6,4años en nuestro estudio puede ser insuficiente para captar re-intervenciones debidas al daño estructural de las prótesis biológicas, por lo que recomendamos emplear esta información con cautela, debiendo ser objeto de estudio en registros multicéntricos con un seguimiento más prolongado.
ConclusionesEn pacientes sometidos a cirugía de sustitución valvular aórtica y edad mayor o igual a 65años no se observan diferencias relevantes entre las prótesis biológicas y mecánicas en la supervivencia ni en complicaciones mayores a corto plazo. A largo plazo, el riesgo de eventos hemorrágicos mayores es significativamente mayor entre las prótesis mecánicas. Además, existen implicaciones relevantes en términos de consumo de recursos sanitarios para el sistema y desigual proporción de tratamiento anticoagulante que pueden ser factores críticos en la decisión sobre la prótesis a emplear con cada paciente.
FinanciaciónAnálisis estadístico de los datos realizado con financiación de Edwards Lifesciences España. Tanto el diseño, como la revisión del análisis estadístico y la interpretación de los resultados fueron realizados de forma independiente por los profesionales del Hospital Universitario Clínico San Carlos, en colaboración con los expertos investigadores de Axentiva Solutions.
Conflicto de interesesJesús Cuervo es director en Axentiva Solutions, S..L., que ha recibido fondos por parte de Edwards Lifesciences España para realizar el análisis estadístico de los datos. Belén Martí y Paloma González son empleadas de Edwards Lifesciences. Los demás autores declaran no tener ningún conflicto de intereses.