La bioprótesis autoexpandible sin sutura Perceval S ofrece resultados a un año similares a las bioprótesis convencionales. No obstante, la evidencia a medio plazo aún es escasa.
ObjetivosAnalizar eventos cardiovasculares mayores (muerte, ictus, reintervención valvular) y el comportamiento hemodinámico a mediano plazo, en una cohorte ajustada de pacientes portadores de una prótesis Perceval S y bioprótesis convencionales.
MétodosRevisión retrospectiva de una cohorte ajustada 1:1 mediante propensity score de pacientes con sustitución valvular aórtica, con o sin revascularización miocárdica concomitante.
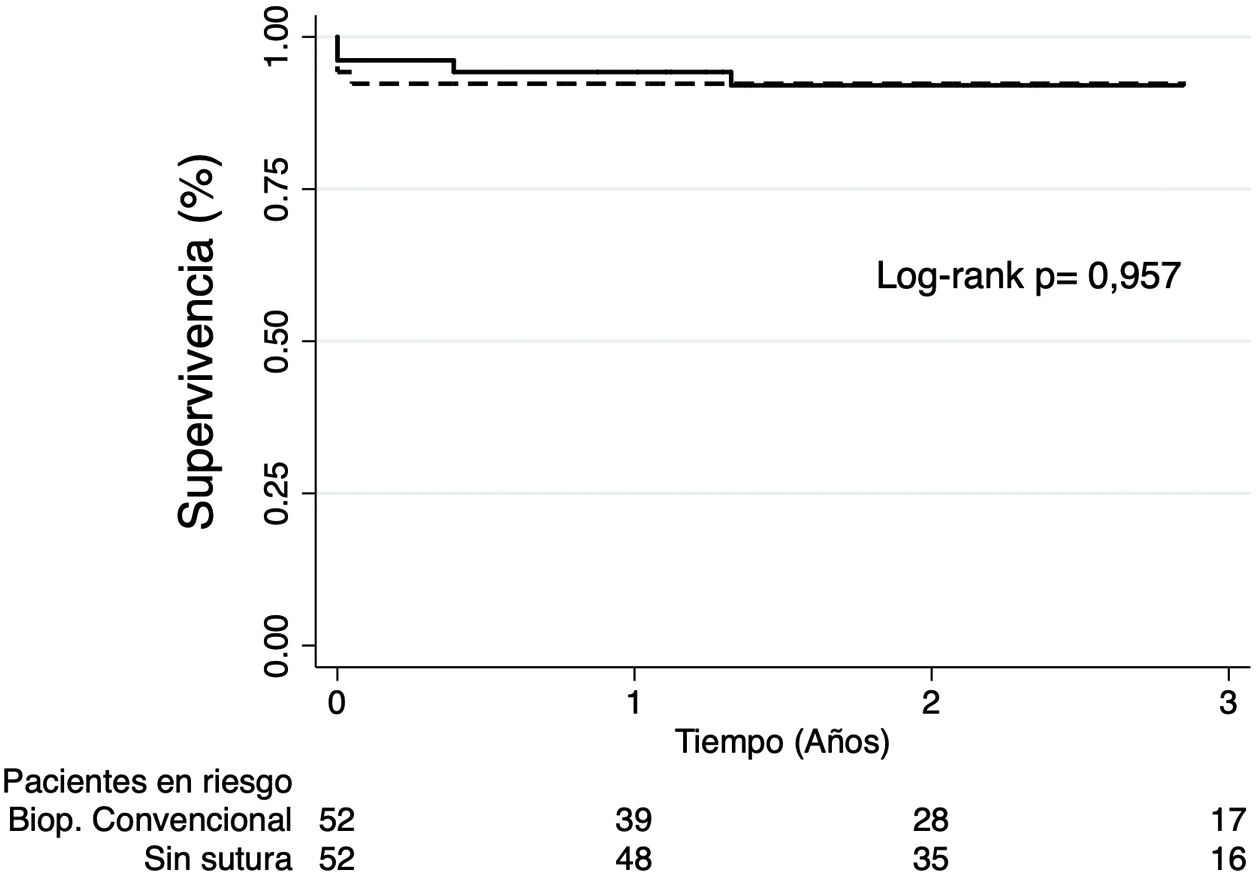
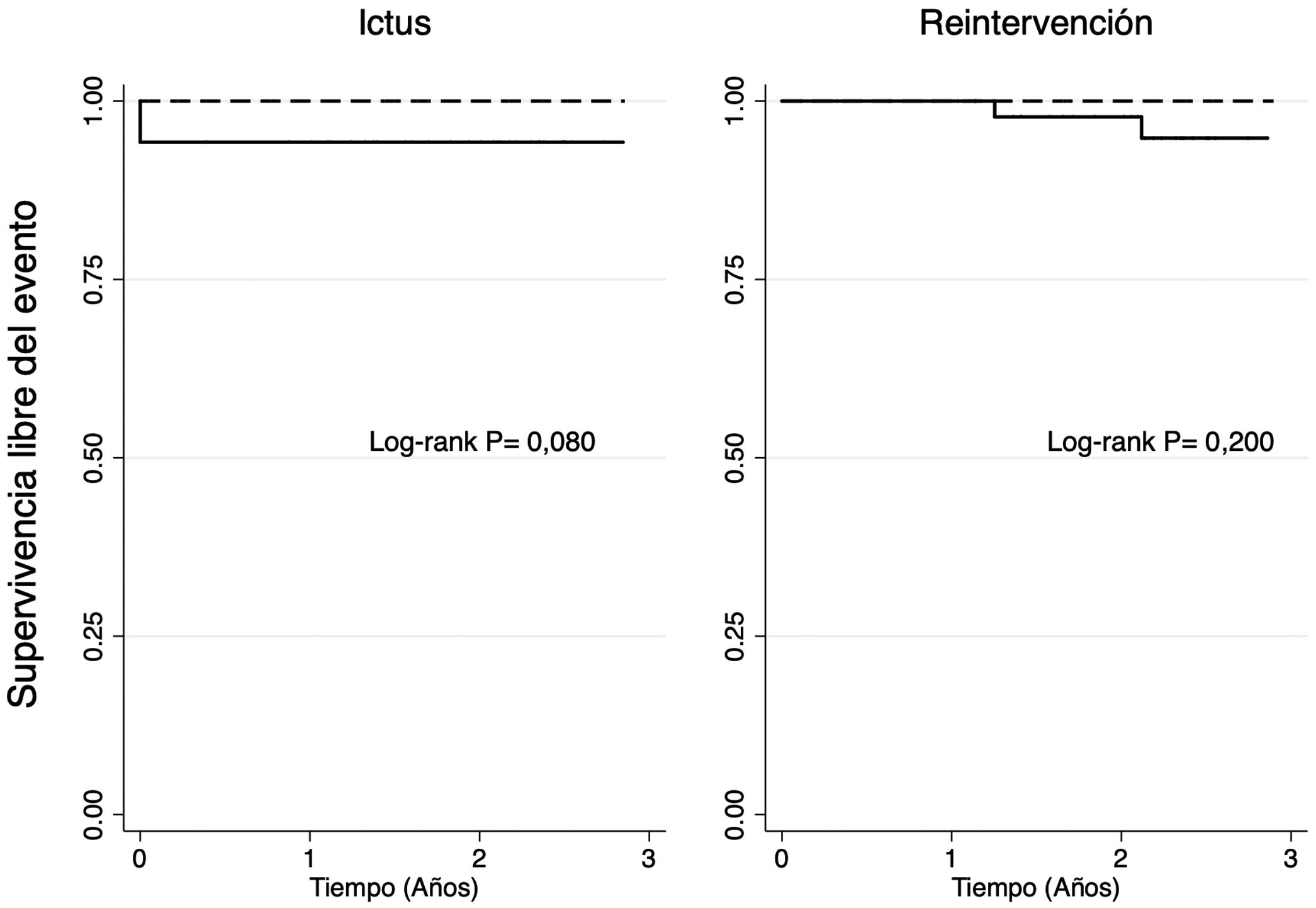
ResultadosSe incluyeron 52 pacientes en cada grupo, sin diferencias significativas en características preoperatorias. A 3años, no identificamos diferencias significativas en la supervivencia libre de eventos adversos cardiovasculares mayores, ni en el comportamiento hemodinámico entre bioprótesis convencionales y sin sutura. Supervivencia: 92,31% vs 92,1%; p=0,957. Ictus: 100% vs 94,23%; p=0,080. Reintervención valvular: 100% vs 94,81%; p=0,200. Gradiente medio: 10,6mmHg vs 10,7mmHg; p=0,875. Gradiente máximo: 20,7mmHg vs 21,0mmHg; p=0,856. Fuga periprotésica moderada o severa: 0 vs 1,92%; p=0,136.
ConclusionesA 3 años, la bioprótesis Perceval S se asocia a una supervivencia libre de eventos adversos cardiovasculares mayores, similar al de las bioprótesis convencionales. El comportamiento hemodinámico de la prótesis es similar entre ambos grupos a medio plazo.
1-year outcomes of the sutureless bioprosthesis Perceval S are similar to conventional bioprostheses. Nevertheless, the mid-term evidence is scarce.
ObjectivesMid-term follow up analysis of major adverse cardiovascular events analysis and hemodynamic performance, after aortic valve replacement with conventional bioprostheses or the Perceval S bioprosthesis in an adjusted cohort.
MethodsRetrospective analysis of a 1:1 propensity score matched cohort of patients who underwent aortic valve replacement, with or without concomitant coronary artery bypass grafting.
Results52 patients were included in each group, with similar preoperative characteristics. At 3-year follow up, we observed no statistically significant differences in major adverse cardiovascular events nor hemodynamic performance between conventional or sutureless bioprostheses. Survival: 92,31% vs 92,1%; P=.957. Stroke: 100% vs 94,23%; P=.080. Valve reintervention: 100% vs 94,81%; P=.200. Mean gradient: 10,6mmHg vs 10,7mmHg; P=.875. Peak gradient: 20,7mmHg vs 21,0mmHg; P=.856. Moderate or severe periprosthetic leak: 0 vs 1,92%; P=.136.
ConclusionsAt 3 years, the Perceval S bioprosthesis presented similar outcomes in major adverse cardiovascular events and hemodynamic performance as conventional bioprosthesis.
Actualmente, la estenosis aórtica es la patología valvular que con mayor frecuencia requiere una intervención quirúrgica o transcatéter como parte de su tratamiento. Con el incremento en la esperanza de vida, los pacientes referidos para una intervención valvular aórtica suelen tener una edad más avanzada y múltiples comorbilidades asociadas. En consecuencia, en las últimas dos décadas se ha observado una tendencia al mayor uso de bioprótesis, abordajes mínimamente invasivos y técnicas transcatéter1-3.
La cirugía de sustitución valvular aórtica (SVAo) empleando la bioprótesis sin sutura (BSS) autoexpandible Perceval S (LivaNova Group, Milán, Italia) combina las ventajas de una cirugía abierta convencional, una resección valvular y decalcificación anular completa, con una disminución significativa de los tiempos quirúrgicos tanto de circulación extracorpórea como de isquemia, al no requerir sutura, lo cual podría ser particularmente beneficioso para el subgrupo poblacional mencionado previamente, al aligerar la carga fisiológica de una cirugía abierta. Hasta el momento, este tipo de prótesis han demostrado resultados comparables a las bioprótesis convencionales (BC). No obstante, la mayoría de estudios publicados se limitan a los resultados perioperatorios y al seguimiento a corto plazo, con evidencia escasa a mediano plazo4-7. Dadas estas circunstancias, realizamos un estudio con el objetivo de analizar y comparar eventos adversos cardiovasculares mayores y el comportamiento hemodinámico entre pacientes portadores de BSS y BC a medio plazo.
MétodosDiseñoEl presente trabajo es un estudio retrospectivo de pacientes con SVAo por bioprótesis, con o sin revascularización concomitante. Los pacientes fueron incluidos según los siguientes criterios: SVAo aislada o SVAo con cirugía de revascularización concomitante. Fueron excluidos pacientes con prótesis transcatéter, pacientes con cirugía cardiaca previa, intervenidos de manera urgente o emergente, y los intervenidos con anterioridad al año en que se implantó la primera prótesis sin sutura en nuestra institución.
DefinicionesLa mortalidad perioperatoria fue definida como muerte por cualquier causa a 30días tras la intervención, o durante el ingreso hospitalario, independientemente del tiempo de estancia.
El infarto de miocardio postoperatorio fue definido como un incremento en troponinaT o CK-MB, superior a 5 veces el rango superior de referencia durante las primeras 72horas tras la intervención, esto asociado a cambios electrocardiográficos o ecocardiográficos sugerentes de isquemia.
El ictus postoperatorio fue definido como un déficit neurológico global o focal, con duración mayor de 24horas o menor de 24horas, en caso de existir evidencia mediante imagen de hemorragia o infarto reciente.
La estimación del riesgo preoperatorio fue realizada empleando el EuroScoreII (European System for Cardiac Operative Risk Evaluation)8.
Recogida de datosLa recogida de las variables perioperatorias se realizó de manera prospectiva al momento del ingreso y de la intervención. Los datos referentes a la supervivencia fueron obtenidos del registro del Instituto Nacional de Defunciones. Los datos referentes a los eventos adversos, a la clase funcional y al comportamiento hemodinámico de las prótesis en el seguimiento fueron extraídos de informes clínicos de los centros hospitalarios del Servicio Madrileño de Salud.
Intervención quirúrgicaTodas las intervenciones se realizaron bajo anestesia general y circulación extracorpórea. El acceso quirúrgico mediante esternotomía completa o parcial dependió del tipo de intervención (SVAo aislada o con revascularización concomitante) y de la preferencia del cirujano. El tipo de prótesis implantada fue decidido de manera conjunta entre el paciente, el cirujano y el cardiólogo, tras valorar los riesgos y los beneficios de cada tipo de prótesis. La técnica de implante ya se ha descrito previamente9,10. En los pacientes con cirugía coronaria concomitante la elección de los injertos (arteria mamaria interna, arteria radial, vena safena) fue realizada según el vaso afectado.
ObjetivosEl objetivo primario fue la supervivencia a 3años. Los objetivos secundarios incluyeron: supervivencia libre de ictus, infarto agudo de miocardio y reintervención valvular a 3años; comportamiento hemodinámico valvular aórtico basal, al alta y en el seguimiento, y la evolución de la clase funcional basal y en el seguimiento. Los objetivos para determinar la seguridad incluyeron la incidencia en el periodo perioperatorio de muerte, ictus, infarto agudo de miocardio, reintervención por hemorragia o taponamiento cardiaco, fracaso renal con necesidad de terapia de sustitución e implante de marcapasos.
Análisis estadísticoSe aplicó un test de normalidad a todas las variables perioperatorias. Las variables continuas fueron expresadas como mediana y rango intercuartílico, y las categóricas, como frecuencia absoluta y relativa. Las comparaciones entre grupos se realizaron utilizando el test de χ2, test de Fisher y t de Student o Wilcoxon, según el tipo de variable y su distribución. La supervivencia fue estimada mediante el método de Kaplan-Meier, y la comparación entre grupos, con el test de Log-Rank.
Con la finalidad de limitar sesgos, el análisis de los eventos se realizó en una muestra ajustada mediante puntuación de propensión. Para dicho ajuste se identificaron variables con distribución desigual entre grupos (p<0,20), que posteriormente fueron incluidas en un modelo no saturado para estimar una puntación de propensión. Los pacientes fueron apareados en una proporción 1:1 con el método de nearest neighbor; el caliper fue seleccionado tras estimar el 0,25 de la desviación estándar del logit de la puntación de propensión.
Todas las pruebas de contraste de hipótesis fueron de dos colas, con un nivel de significación estadística de p<0,05. El análisis estadístico fue realizado con Stata 14 (StataCorp, 2015. College Station, TX).
Consideraciones éticasEl presente estudio sigue las recomendaciones de la Declaración de Helsinki de la Asociación Médica Mundial sobre los principios éticos para las investigaciones médicas en seres humanos. Dado el diseño y la fuente de información, el estudio se consideró exento de la recogida del consentimiento informado.
ResultadosCaracterísticas de la cohorteDe 2015 a 2021, 624 pacientes fueron intervenidos. Tras el ajuste mediante puntuación de propensión, 104 pacientes fueron incluidos en el análisis (52BC y 52BSS). La eficacia del apareamiento mediante puntuación de propensión fue analizada con histogramas de la puntuación de propensión según el tipo de prótesis (BC/BSS), mediante análisis de diferencia estandarizada y comparación de medias, sin observar diferencias significativas en las características preoperatorias de ambos grupos. La mediana de edad fue de 73,65años (IQR: 68,58-77,19) y el riesgo de mortalidad perioperatoria estimado mediante EuroScoreII fue del 2,11% (IQR: 1,39-3,66). Las características preoperatorias se muestran en la tabla 1.
Características preoperatorias
| Variable | Bioprótesis convencional (n=52) | Bioprótesis sin sutura (n=52) | p |
|---|---|---|---|
| Sexo M | 24 (46,15) | 27 (51,92) | 0,556 |
| Edad (mediana; IQR) | 73,75 (68,9-77,5) | 73,42 (68,4-77,1) | 0,983 |
| Diabetes | 15 (28,85) | 23 (44,23) | 0,103 |
| Hipertensión arterial | 41 (78,85) | 39 (75) | 0,642 |
| Obesidad | 22 (42,31) | 18 (34,62) | 0,420 |
| Tabaquismo | − | 1 (1,92) | 0,190 |
| ERC | 15 (28,85) | 12 (23,08) | 0,502 |
| Arteriopatía periférica | 11 (21,15) | 11 (21,15) | 1,00 |
| EPOC | 6 (11,54) | 7 (13,46) | 0,767 |
| Ictus previo | 1 (1,92) | 1 (1,92) | 1,00 |
| Fibrilación auricular | 8 (15,38) | 9 (17,31) | 0,791 |
| Marcapasos previo | 2 (3,85) | 2 (3,85) | 1,00 |
| NYHA III-IV | 20 (38,46) | 23 (44,23) | 0,550 |
| IAM previo | 2 (3,85) | 3 (5,77) | 0,647 |
| Intervención coronaria percutánea previa | 1 (1,92) | 3 (5,77) | 0,308 |
| Enfermedad coronaria | 14 (26,92) | 13 (25) | 0,823 |
| FEVI (mediana; IQR) | 60 (60-65) | 60 (60-65) | 0,975 |
| Euroscore II (mediana; IQR) | 2,57 (1,6-3,9) | 1,68 (1,2-3,7) | 0,696 |
EPOC: enfermedad pulmonar obstructiva crónica; ERC: enfermedad renal crónica; FEVI: fracción de eyección de ventrículo izquierdo; IAM: infarto agudo de miocardio; NYHA: clase funcional según la New York Heart Association.
El acceso por miniesternotomía se empleó de manera más frecuente en pacientes con BSS (25% vs 63,46%; p<0,001). Los tiempos de circulación extracorpórea y de isquemia miocárdica fueron significativamente menores en el grupo BSS (p<0,001). Los tamaños de prótesis más frecuentemente implantados en el grupo BC fueron el 21 y el 23, mientras que en el grupo BSS fue el L. No existieron diferencias respecto a la revascularización concomitante (p=1,00) (tabla 2).
Características perioperatorias
| Variable | Bioprótesis convencional (n=52) | Bioprótesis sin sutura (n=52) | p |
|---|---|---|---|
| Acceso por miniesternotomía | 13 (25) | 33 (63,46) | <0,001 |
| Válvula aórtica bicúspide | 8 (15,38) | 7 (13,46) | 0,780 |
| Tamaño de la prótesis | |||
| S | − | 9 (17,3) | |
| M | − | 10 (19,2) | |
| L | − | 21 (40,38) | |
| XL | − | 12 (23,1) | |
| 19 | 9 (17,3) | − | |
| 21 | 19 (36,5) | − | |
| 23 | 19 (36,5) | − | |
| 25 | 3 (5,8) | − | |
| 27 | 1 (1,9) | − | |
| 29 | 1 (1,9) | − | |
| Tiempo de CEC, min (mediana; IQR) | 84 (67-111) | 67 (54,3-85,3) | <0,001 |
| Tiempo de isquemia, min (mediana; IQR) | 67 (55-82) | 48,5 (41-60) | <0,001 |
| Revascularización concomitante | 10 (19,23) | 10(19,23) | 1,00 |
| Tiempo de IOT, horas (mediana; IQR) | 6 (3-13,5) | 6 (3-7,8) | 0,757 |
| Estancia en UCI, días (mediana; IQR) | 1 (1-2) | 1 (1-3) | 0,328 |
| Estancia hospitalaria, días (mediana; IQR) | 7 (5-11,8) | 6 (3-7,8) | 0,140 |
| Reintervención por hemorragia | 6 (11,54) | 2 (3,85) | 0,141 |
| Taponamiento cardiaco | 1 (1,92) | 2 (3,85) | 0,558 |
| Fibrilación auricular de novo | 14 (26,92) | 13 (25) | 0,823 |
| Fracaso renal con necesidad: terapia de sustitución | 1 (1,92) | 3 (5,77) | 0,308 |
| Implante de marcapasos | 1 (1,92) | 7 (13,46) | 0,027 |
| Mediastinitis | − | 1 (1,92) | 0,315 |
| IAM | − | − | − |
| Ictus | − | 3 (5,8) | 0,079 |
| Muerte | 3 (5,77) | 2 (3,85) | 0,647 |
CEC: circulación extracorpórea; IAM: infarto agudo de miocardio; IOT: intubación orotraqueal; UCI: unidad de cuidados intensivos.
La mediana de seguimiento fue de 2,34años (IQR: 1,36-3,41). A 3años, no se identificaron diferencias significativas en la supervivencia (92,31% vs 92,1%; p=0,957) (fig. 1), la supervivencia libre de ictus (100% vs 94,23%; p=0,080), de infarto agudo de miocardio (100% en ambos grupos) ni de reintervención valvular (100% vs 94,81%; p=0,200) entre BC y BSS, respectivamente (fig. 2).
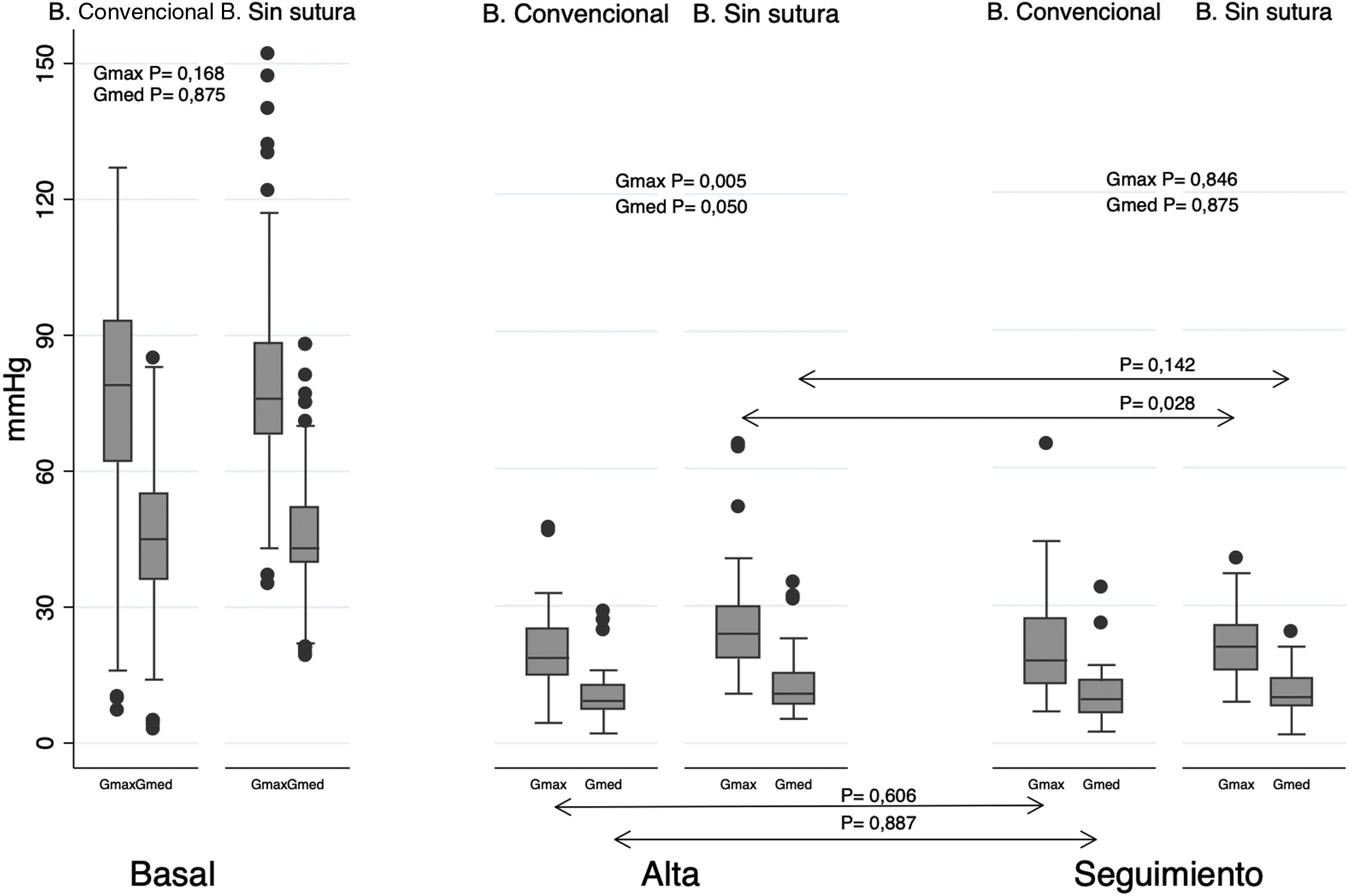
Respecto al comportamiento hemodinámico, se observó un gradiente máximo y medio en el momento del alta hospitalaria significativamente mayor para las BSS (Gmax: 19,86mmHg vs 26,02mmHg; p=0,004; Gmed: 10,46mmHg vs 12,95mmHg; p=0,049). En el seguimiento se observó una disminución significativa en el gradiente máximo aórtico respecto al medido al alta en el grupo de BSS (26,02mmHg vs 21,55mmHg; p=0,027), sin diferencias significativas en el gradiente medio. No se observaron diferencias significativas entre grupos (Gmed BSS: 10,7mmHg; Gmed BC: 10,6mmHg; p=0,875; Gmax BSS: 21,0mmHg; Gmax BC: 20,7mmHg; p=0,856) (fig. 3).
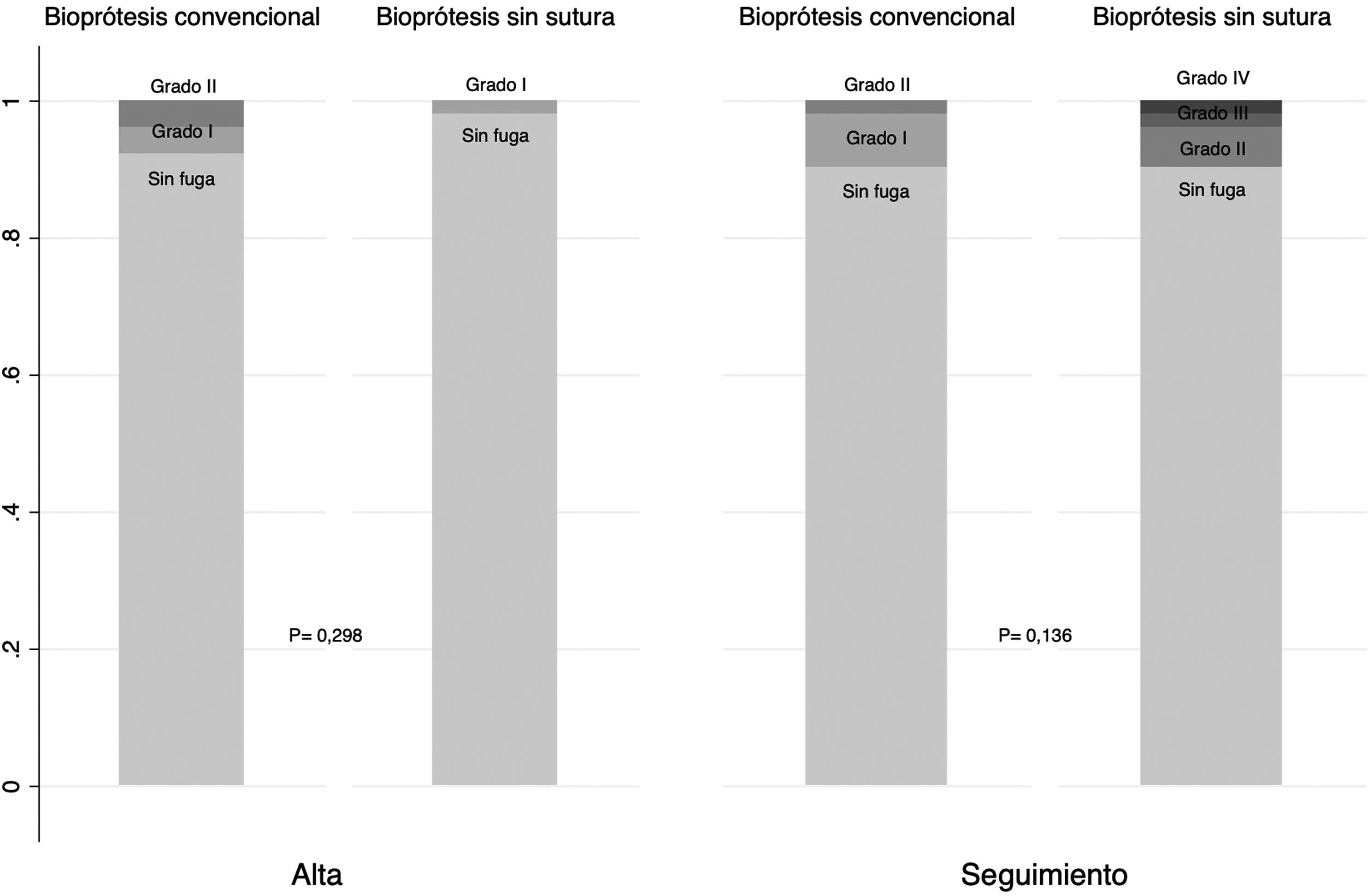
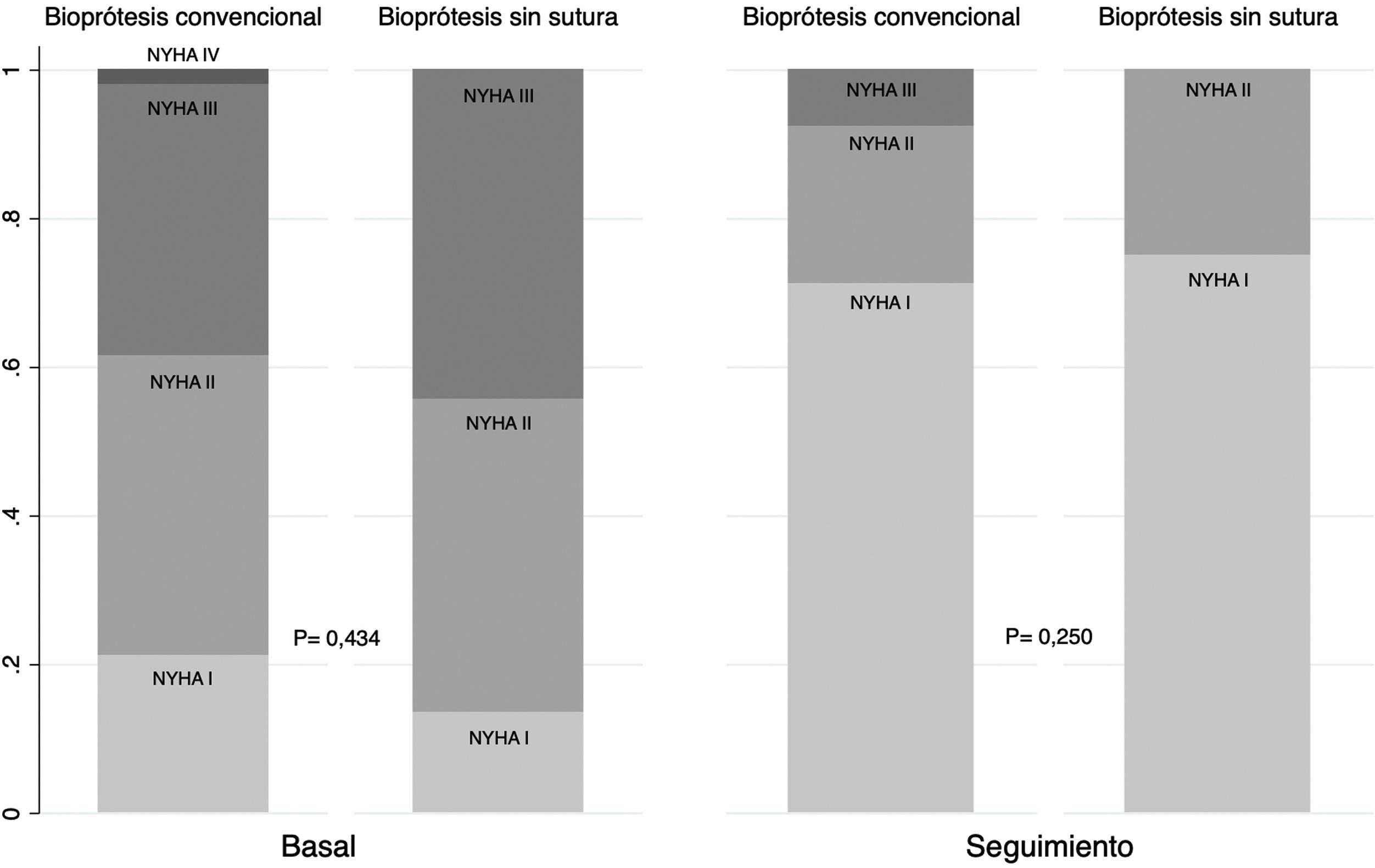
Al alta, ningún paciente presentó fuga periprotésica moderada o severa y en el seguimiento, y no se observaron diferencias significativas en este evento (0 vs 1,92%; p=0,136) (fig. 4). Finalmente, se observó una mejoría no significativa en la clase funcional en ambos grupos, sin existir diferencias significativas entre portadores de BC y BSS (NYHAI-II: 92,83% vs 100%; p=0,117) (fig. 5).
Eventos de seguridadDe manera perioperatoria, la incidencia de los eventos de seguridad fue baja y no se identificaron diferencias significativas en la incidencia de muerte, ictus, infarto agudo de miocardio y reintervención por hemorragia o taponamiento. No obstante, la incidencia de implante de marcapasos tras la intervención fue significativamente mayor en pacientes con BSS (1,92% vs 13,46%; p=0,027) (tabla 2).
DiscusiónLa evidencia comparativa a medio plazo entre BSS y BC es escasa. A nuestro conocimiento, nuestro estudio es el primero en realizar una comparación a 3años de eventos adversos cardiovasculares mayores y comportamiento hemodinámico entre BSS y BC.
A medio plazo, la supervivencia reportada para portadores de BSS varía entre el 88% al 70%11-13. Ensayos clínicos aleatorizados y registros prospectivos no han identificado diferencias significativas respecto a las BC. No obstante, Muneretto et al.6 han reportado un beneficio significativo al comparar las BSS con prótesis aórticas transcatéter en pacientes con riesgo quirúrgico intermedio (STS score 6%; HR: 1,86; IC95%: 1,09-3,16). En nuestro estudio observamos una supervivencia a 3años del 92,1% para BSS, sin diferencias significativas con las BC. Estos resultados se deben principalmente al perfil de pacientes incluidos en el estudio de riesgo quirúrgico bajo (EuroScoreII<3%) y una mediana de edad de 73años. De manera similar, en los ensayos clínicos PARTNER3 y Evolut Low Risk Trial, que compararon SVAo quirúrgica con prótesis aórticas transcatéter en pacientes de bajo riesgo, la supervivencia a 2años fue superior al 90%14,15.
No se presentaron ictus en el seguimiento en ambos grupos. No obstante, el 5,8% de BSS presentaron un evento en periodo perioperatorio. Como ha sido estudiado previamente, las principales causas de estos eventos se encuentran en relación con la edad y el proceso degenerativo de aterosclerosis, con mayor riesgo de desprendimiento y embolización de placas ateromatosas durante la intervención16. Respecto a la tasa de reintervención valvular, no identificamos diferencias significativas entre BSS y BC (100% vs 94,81%; p=0,200). En registros publicados previamente, la incidencia de este evento en el seguimiento varía entre el 1,5% y el 4%, siendo la endocarditis infecciosa y la fuga paravalvular las principales causas de reintervención valvular en dichas series11,13.
En cuanto al comportamiento hemodinámico a mediano plazo, estudios previos reportan un gradiente medio en BSS entre 9,3 y 11,3mmHg11-13. Nuestro estudio reportó resultados satisfactorios para ambos grupos (Gmed BSS: 10,7mmHg; Gmed BC: 10,6mmHg; p=0,875), además de una incidencia baja de fuga paravalvular. Como hallazgo relevante, identificamos una disminución significativa en el gradiente máximo en el seguimiento respecto al alta para las BSS. Posibles causas de esta observación podrían ser el estado hiperdinámico postoperatorio o la anemia, que, una vez resueltas, provocarían un descenso en dicho gradiente.
La incidencia de los eventos de seguridad fue en general baja y en línea con lo publicado. No obstante, observamos una incidencia alta de implante de marcapasos postoperatorio para las BSS. Este hallazgo ya ha sido reportado previamente y se ha asociado a una inadecuada selección del tamaño de la prótesis, así como a la técnica de implante17-21. El presente estudio, al tener un tamaño de muestra limitado, no permite realizar un análisis a posteriori con la finalidad de evaluar con más detalle esta complicación y su impacto en la supervivencia.
En resumen, el presente estudio pone en evidencia la similitud que hay entre los resultados a corto y a medio plazo entre la SVAo con BC y BSS en cuanto a supervivencia, eventos cardiovasculares mayores, parámetros hemodinámicos y perfil de seguridad. A su vez, nuestro estudio apoya la evidencia científica respecto al uso y al comportamiento de la BSS disponible hoy en día. No obstante, se necesita evidencia de mayor calidad a medio y largo plazo. El ensayo clínico PERSIST-AVR (NCT02673697), que compara BSS versus BC y que ya ha reportado resultados a 1año, esclarecerá cuestiones importantes en este tema.
LimitacionesSe trata de un estudio retrospectivo, unicéntrico y con una muestra de pacientes limitada. A pesar del uso de técnicas estadísticas para obtener muestras similares, pueden existir sesgos no controlados que influyan nuestros resultados, por lo que estos deben interpretarse con cautela y únicamente como generadores de hipótesis.
ConclusiónA 3 años, la BSS Perceval S se asocia a una supervivencia libre de eventos adversos cardiovasculares mayores similar a la de las BC. El comportamiento hemodinámico de la BSS es comparable al de las BC a medio plazo.
Conflicto de interesesNinguno que declarar.