La reparación mitral sin circulación extracorpórea, con implante de neocuerdas por vía transapical (TOP MINI) es un procedimiento eficaz y reproducible para el tratamiento de la insuficiencia mitral degenerativa. El objetivo de este estudio es presentar la experiencia inicial en este procedimiento.
MétodosSe incluyeron de forma retrospectiva a todos los pacientes intervenidos mediante TOP-MINI entre marzo de 2017 y enero de 2022. Se evaluaron eventos de seguridad y eficacia perioperatoria además de supervivencia libre de eventos cardiovasculares y recurrencia de insuficiencia mitral en el seguimiento.
ResultadosFueron intervenidos 55 pacientes, todos con IM de etiología degenerativa. El procedimiento se realizó con éxito en el 87,3%. A 24 meses, la supervivencia de la cohorte total fue de 92,6%. En los pacientes con éxito del procedimiento, 77,1% presentaron insuficiencia mitral recurrente menor o igual a II/IV; 6,3% III/IV y 8 (16,7%) IV/IV. Se observó una disminución significativa en el diámetro telesistólico del ventrículo izquierdo respecto al basal (36,07mm vs. 32,84mm; p= 0,035).
ConclusionesEl implante transapical de neocuerdas es una técnica segura y eficaz a corto plazo en pacientes con IM severa degenerativa con prolapso limitado al velo posterior de la válvula mitral.
Transapical Off-Pump mitral valve repair with transapical neochord implantation (TOP-MINI), is safe and effective for the treatment of primary mitral regurgitation. The propose of this study is to present our initial experience with this procedure.
MethodsAll patients who underwent TOP-MINI between march 2017 and January 2022 were included. Perioperative safety and efficacy outcomes were evaluated. Short-term survival and freedom from mitral regurgitation at follow-up were also analyzed.
Results55 patients were included, all with degenerative mitral regurgitation. Procedural success was achieved in 87,3%. At 24 months of follow-up, survival was 92,6%. In patients with procedural success, 77,1% had recurrent MR ≤ II/IV; 6,3% III/IV and 16,7% IV/IV. A significant reduction in left ventricular telesystolic diameter was also observed (36,07mm vs. 32,84mm; p= 0.035).
ConclusionsTransapical neochord implantation is safe and effective for the treatment of degenerative mitral regurgitation with limited disease of the posterior mitral valve leaflet.
La insuficiencia mitral (IM) es una de las valvulopatías cardiacas más prevalentes, siendo la etiología degenerativa la más frecuente en el mundo occidental1–3. La reparación quirúrgica de la válvula mitral (VM) es la técnica de elección para tratar la IM degenerativa severa, dado su perfil de seguridad, eficacia y resultados a largo plazo en comparación con la sustitución valvular4,5. Dentro de la patología degenerativa, la situación más frecuente es la IM secundaria al prolapso del segmento P2 del velo posterior mitral, donde la resección parcial ha demostrado ser una técnica muy reproducible con excelentes resultados a largo plazo. En los últimos años, las técnicas de preservación sin resección con la implantación de neocuerdas de politetraflouroetileno han demostrado unos resultados al menos tan buenos como la técnicas de resección6. Además, la combinación de resección e implantación de neocuerdas ha permitido extender las técnicas de reparación a mecanismos de insuficiencia mitral más complejos, como el prolapso del velo anterior o de ambos velos. Paralelamente, la cirugía cardiaca ha ido evolucionando hacia procedimientos cada vez menos invasivos, pasando de la esternotomía media, a la minitoracotomía, o incluso la toracoscopia, aunque siendo necesaria la circulación extracorpórea en todos los casos7,8.
La reparación mitral sin circulación extracorpórea, con implante de neocuerdas por vía transapical (Transapical Off-Pump Mitral Valve Intervention with Neochords implantation [TOP-MINI]), es una nueva opción de tratamiento de la IM9. Se realiza por minitoracotomía anterior izquierda y abordaje transapical, utilizando el dispositivo NeoChord DS1000 (NeoChord, Ins., Eden Praire, MN), y bajo control con ecocardiografía transesofágica (ETE) 2D y 3D en tiempo real10. El estudio Transpical Artificial Chordae Tendinae, demostró que este procedimiento es fiable y reproducible con bajo riesgo de complicaciones11. Posteriormente, distintos grupos han publicado series de menor o mayor tamaño muestral con resultados a corto y medio plazo prometedores12–14.
El programa de reparación mitral sin circulación extracorpórea con la técnica TOP-MINI comenzó en marzo de 2017 en nuestro centro. El objetivo de este artículo es presentar nuestra experiencia en el implante transapical de neocuerdas sin CEC.
MétodosDiseñoSe incluyeron de forma retrospectiva a todos los pacientes intervenidos mediante TOP-MINI entre marzo de 2017 y enero de 2022.
DefinicionesLa mortalidad perioperatoria fue definida como muerte por cualquier causa a 30 días tras la intervención o durante el ingreso hospitalario, independientemente del tiempo de estancia.
El infarto de miocardio postoperatorio fue definido como un incremento en troponina T o CK-MB superior a 5 veces el rango superior de referencia durante las primeras 72 h tras la intervención, esto asociado a cambios electrocardiográficos o ecocardiográficos sugerentes de isquemia.
El ictus postoperatorio fue definido como un déficit neurológico global o focal, con duración mayor a 24 h o menor a 24 h en caso de existir evidencia mediante imagen de hemorragia o infarto reciente.
La estimación del riesgo preoperatorio fue realizada empleando el European System for Cardiac Operative Risk Evaluation (EuroScore II)15.
Con la finalidad de medir la eficacia y seguridad del procedimiento, se emplearon las definiciones (éxito técnico, éxito en el procedimiento) del Mitral Valve Academic Research Consortium para evaluar los resultados del procedimiento en el momento intraoperatorio, a los 30 días y durante el seguimiento16.
Selección de pacientesLa selección de pacientes se realizó según la clasificación de IM propuesta por Colli et al.17. Esta clasificación divide la insuficiencia mitral degenerativa en 4 categorías de acuerdo a la complejidad de la valvulopatía para su reparación mediante TOP-MINI. Tipo A: prolapso aislado de P2; tipo B: prolapso de varios componentes del velo posterior; tipo C: prolapso del velo anterior o de ambos velos y tipo D: prolapso comisural o con calcificación del anillo o de los velos. En este estudio, incluimos pacientes de todos los tipos, pero principalmente del tipo A o B. Se excluyeron los pacientes con IM funcional, secundaria a endocarditis, aquellos con disfunción ventricular moderada/severa y los que no cumplían criterio anatómico en función del índice velo-anillo (fig. 1).
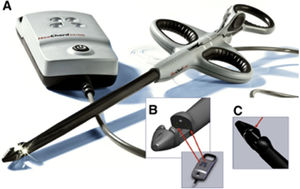
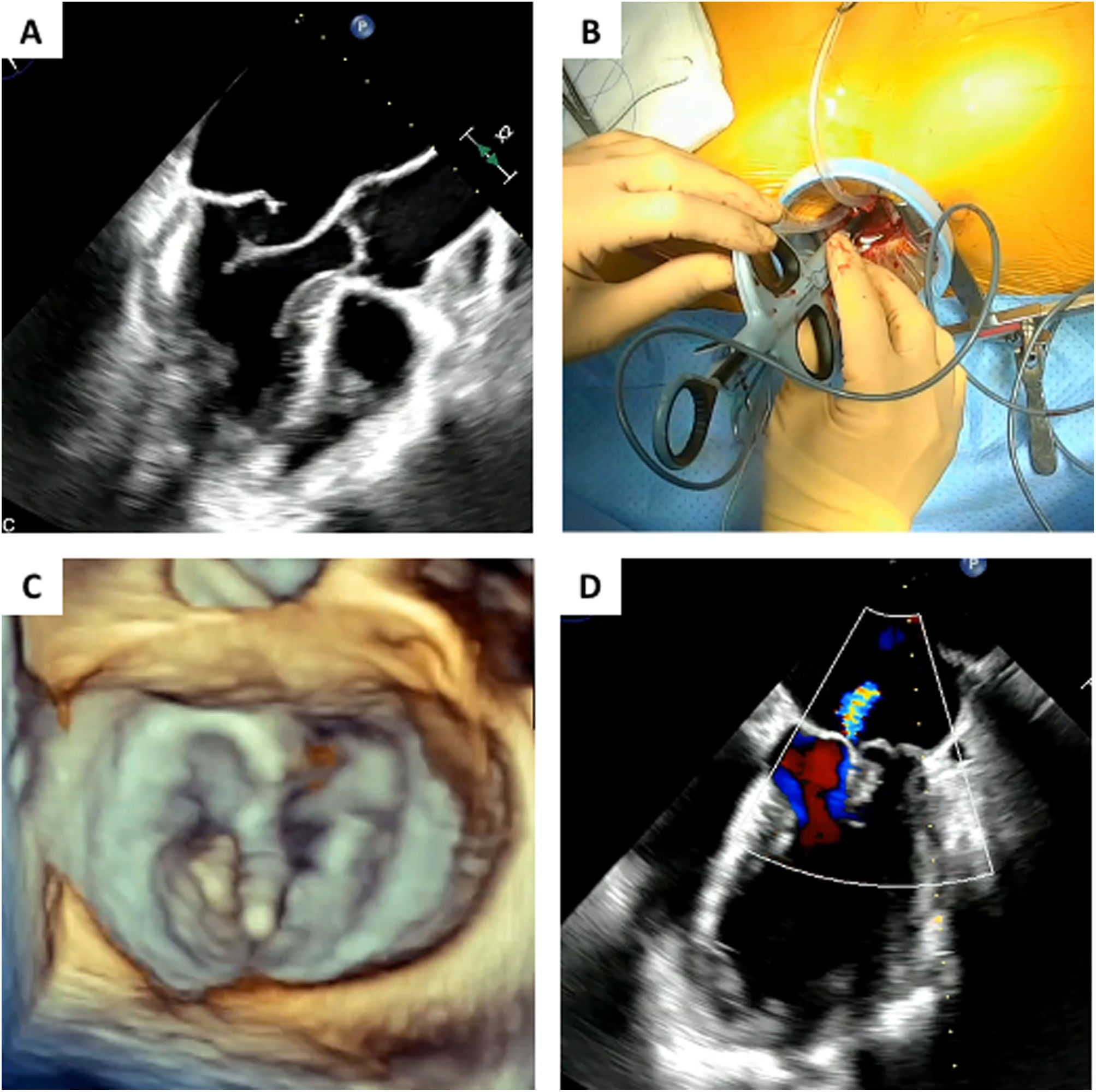
Dispositivo NeoChord DS1000El dispositivo NeoChord DS 1000 consta de un instrumento a modo de pinza de 24 Fr que captura el borde libre del velo e implanta una neocuerda de politetraflouroetileno. Incorpora un sistema 4 de luces LED a modo de testigo que sirve para verificar la cantidad de tejido de velo capturado por el dispositivo. Si la pinza ha capturado 4mm o más de velo las cuatro luces cambian de rojo a blanco, y se puede proceder a implantar la neocuerda, esto lo realiza mediante una aguja que perfora el borde del velo, ancla la cuerda y extrae los extremos por el ápex (fig. 2).
A) Dispositivo formado por un instrumento de liberación y un monitor de confirmación de captura de tejido. B) El monitor consta de cuatro luces que indica la cantidad de tejido captada en la punta del instrumento que se abre y se observa cuatro fibras ópticas. C) Sutura montada en el instrumento.
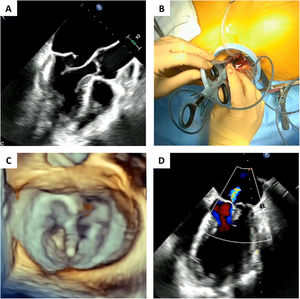
El procedimiento se realiza bajo anestesia general en el quirófano de Cirugía Cardiaca. La monitorización incluye arteria radial, vía central y ETE 2D y 3D en tiempo real. Se utiliza el recuperador de sangre. El acceso al ventrículo izquierdo (VI) se realiza a través de una minitoracotomía anterior izquierda. La zona de entrada en el VI se determina mediante el «finger test», que consiste en presionar con el dedo índice en distintos puntos alrededor de ápex, y mediante ETE identificar el punto adecuado, que variará en función del velo afectado, cantidad de tejido (según las medidas de los índices) y tamaño del VI.
Una vez localizada la zona de acceso más adecuada, se realiza una doble bolsa de tabaco con polipropileno 3/0 apoyada sobre teflón. Se hace una pequeña incisión con un bisturí, y a través de ella se introduce el dispositivo. Mediante ETE 2D se controla la navegación del dispositivo a través del ventrículo izquierdo hasta atravesar la válvula mitral y alcanzar la aurícula izquierda, teniendo especial cuidado de no interferir con las cuerdas tendinosas nativas. Una vez en la aurícula izquierda, se procede a la captura del segmento prolapsante bajo control con ETE 3D. Si la cantidad de tejido atrapada es suficiente (4 luces en el monitor), se implanta la neocuerda avanzando y retirando la aguja. Se controla el extremo de la neocuerda en el ápex y se extrae el dispositivo completo. Este procedimiento se realiza tantas veces como neocuerdas se implanten. El número de neocuerdas vendrá determinado por el tamaño del segmento prolapsante, con el objetivo de conseguir soporte suficiente para el velo. Tras ello, se procede a determinar la longitud adecuada de cada cuerda implantada mediante control por ETE, donde se observa cómo se va reduciendo la IM, siendo recomendable cierto grado de sobretensión, que incluso provoque un mínimo de IM por restricción, para así contrarrestar el futuro remodelado inverso del VI, y la aparición de un nuevo prolapso. Por último, se fijan las cuerdas tensionadas al epicardio del ápex anudándolas sobre un parche de teflón18 (fig. 3).
Recogida de datosLa recogida de las variables perioperatorias se realizó de manera prospectiva al momento del ingreso y de la intervención. Los datos referentes a la supervivencia fueron obtenidos del registro del Instituto Nacional de Defunciones. Los datos referentes a la supervivencia, eventos, clase funcional y evaluación ecocardiográfica en el seguimiento fueron extraídos de informes clínicos de los centros hospitalarios del Servicio Madrileño de Salud.
Análisis estadísticoLas variables continuas fueron expresadas como mediana e intervalo intercuartílico. Las variables categóricas fueron expresadas como frecuencias absolutas y relativas. Se utilizó el test de X2 o el test de Fisher para la comparación de variables categóricas y la prueba t de Student pareada para variables continuas. El análisis de supervivencia se realizó con el método de Kaplan-Meier. Se consideró estadísticamente significativo un valor de P <0,05. El análisis estadístico fue realizado con Stata 14 (StataCorp 2015, College Station, TX).
Consideraciones éticasEl presente estudio sigue las recomendaciones de la Declaración de Helsinki de la Asociación Médica Mundial sobre los principios éticos para las investigaciones médicas en seres humanos. Dado el diseño y la fuente de información, el estudio se consideró exento de la recogida del consentimiento informado.
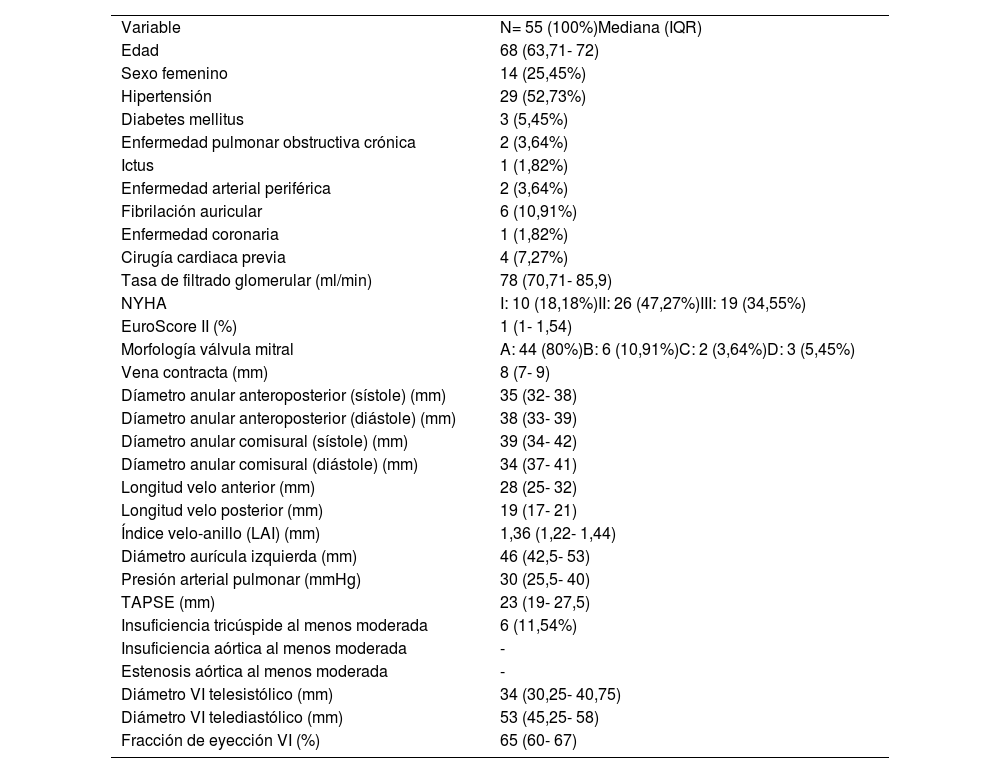
ResultadosCincuenta y cinco pacientes fueron intervenidos entre marzo del 2017 y enero de 2022. Las características preoperatorias se definen en la tabla 1. La mediana de edad fue de 68 años (63,71-72). Todos presentaban IM severa de etiología degenerativa: 10 (18,18%) eran asintomáticos y el resto se encontraba en clase funcional II-III, 44 (80%) presentaban una morfología tipo A, 6 (10,91%) tipo B, 2 (3,64%) tipo C y 3 (5,45%) tipo D. Cuatro (7,27%) pacientes tenían una cirugía previa de reparación mitral con anillo y neocuerdas implantados por vía convencional. La mediana de riesgo quirúrgico estimado mediante EuroScore II fue de 1% (1-1,54). Todos los pacientes tenían función VI conservada (65%; 60- 67). y solo cuatro (7,27%) presentaban dilatación leve del VI. Tres pacientes (5,45%) tenían hipertensión pulmonar severa.
Características demográficas
| Variable | N= 55 (100%)Mediana (IQR) |
| Edad | 68 (63,71- 72) |
| Sexo femenino | 14 (25,45%) |
| Hipertensión | 29 (52,73%) |
| Diabetes mellitus | 3 (5,45%) |
| Enfermedad pulmonar obstructiva crónica | 2 (3,64%) |
| Ictus | 1 (1,82%) |
| Enfermedad arterial periférica | 2 (3,64%) |
| Fibrilación auricular | 6 (10,91%) |
| Enfermedad coronaria | 1 (1,82%) |
| Cirugía cardiaca previa | 4 (7,27%) |
| Tasa de filtrado glomerular (ml/min) | 78 (70,71- 85,9) |
| NYHA | I: 10 (18,18%)II: 26 (47,27%)III: 19 (34,55%) |
| EuroScore II (%) | 1 (1- 1,54) |
| Morfología válvula mitral | A: 44 (80%)B: 6 (10,91%)C: 2 (3,64%)D: 3 (5,45%) |
| Vena contracta (mm) | 8 (7- 9) |
| Díametro anular anteroposterior (sístole) (mm) | 35 (32- 38) |
| Díametro anular anteroposterior (diástole) (mm) | 38 (33- 39) |
| Díametro anular comisural (sístole) (mm) | 39 (34- 42) |
| Díametro anular comisural (diástole) (mm) | 34 (37- 41) |
| Longitud velo anterior (mm) | 28 (25- 32) |
| Longitud velo posterior (mm) | 19 (17- 21) |
| Índice velo-anillo (LAI) (mm) | 1,36 (1,22- 1,44) |
| Diámetro aurícula izquierda (mm) | 46 (42,5- 53) |
| Presión arterial pulmonar (mmHg) | 30 (25,5- 40) |
| TAPSE (mm) | 23 (19- 27,5) |
| Insuficiencia tricúspide al menos moderada | 6 (11,54%) |
| Insuficiencia aórtica al menos moderada | - |
| Estenosis aórtica al menos moderada | - |
| Diámetro VI telesistólico (mm) | 34 (30,25- 40,75) |
| Diámetro VI telediastólico (mm) | 53 (45,25- 58) |
| Fracción de eyección VI (%) | 65 (60- 67) |
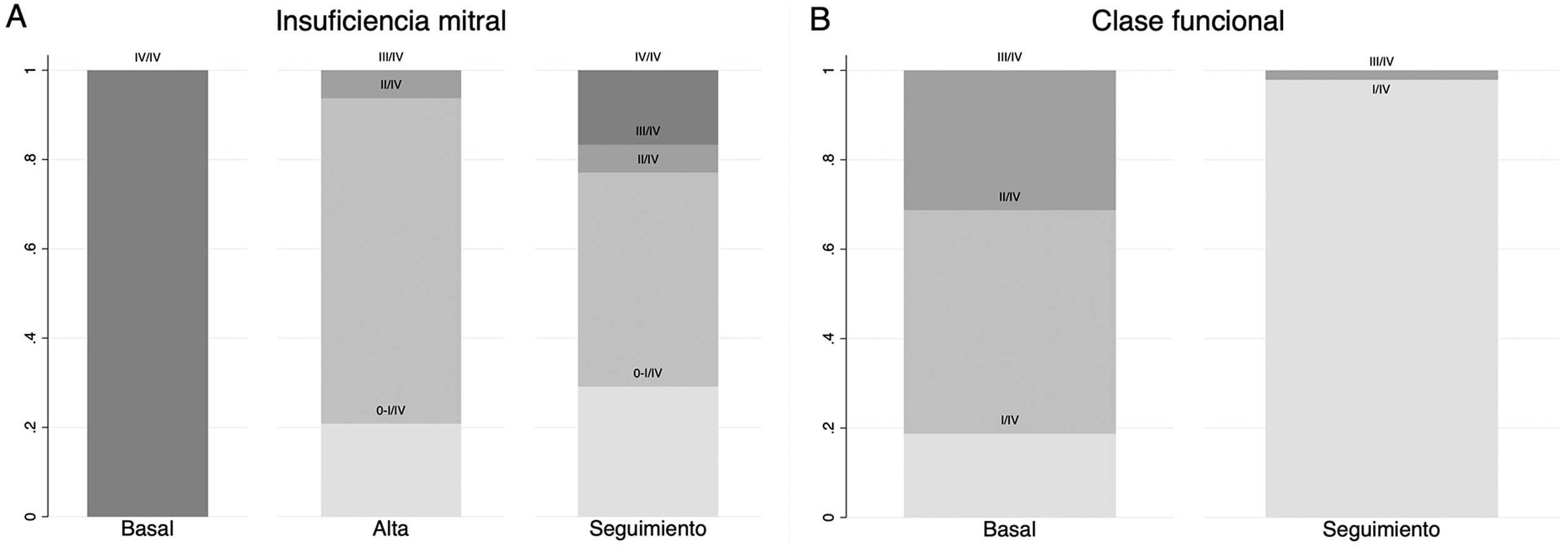
Los resultados intra- y postoperatorios se presentan en la tabla 2. La mediana de cuerdas implantadas fue de 3 (2-3) La mediana del tiempo del procedimiento fue de 90 min 75-120. Todos los pacientes con éxito del procedimiento fueron extubados en quirófano. En 48 (87,27%) casos, el procedimiento se realizó con éxito. En siete casos, fue necesario convertir la intervención a una cirugía convencional por IM residual grado III. En dos de los 7 casos se produjo un desgarro del velo posterior durante la implantación de una de las cuerdas. En ambos pacientes se pudo preservar la válvula mitral nativa mediante una resección de P2 y anuloplastia. En otros 2 de los 7 casos, la IM residual se explicó por una inadecuada selección: a pesar del implante de 4 pares de cuerdas en cada caso, nunca se consiguió una superficie de coaptación adecuada, ambos pacientes se repararon por vía abierta. Por último, los otros tres pacientes tenían una IM tipo D con jet comisural que en ningún caso pudo ser corregido. Los tres casos fueron convertidos y recibieron prótesis biológica. En 2 pacientes se produjo un desgarro del ápex que se reparó sin incidencias. Dos pacientes fueron reintervenidos por sangrado. El tiempo de estancia en UCI fue de 1 día (1-1). Ocho pacientes presentaron fibrilación auricular (FA) postoperatoria revertida farmacológicamente a ritmo sinusal antes del alta. El tiempo medio de estancia postoperatoria fue de 5 días (4-6). Al alta, 45 pacientes tenían IM menor o igual a II/IV, y tres pacientes IM III/IV con origen comisural.
Resultados intraoperatorios y postoperatorios
| Variable | N= 55 (100%) Mediana (IQR) |
| Número de neocuerdas implantadas | 3 (2-3) |
| Duración (min) | 90 (75- 120) |
| Conversión a cirugía convencional | 7 (12,73%)Reparación: 2Sustitución: 5 |
| ECMO | - |
| Complicaciones del acceso apical | 2 (3,64%) |
| Hemorragia mayor | 2 (3,64%) |
| Éxito técnico (MVARC) | 48 (87,27%) |
| Complicaciones de la herida | - |
| Fibrilación auricular postoperatoria | 8 (14,55%) |
| Fracaso renal agudo con requerimiento de terapia de sustitución | - |
| Infarto agudo de miocardio | - |
| Ictus | - |
| Muerte | 1 (1,82%) |
| Estancia en UCI (días) | 1 (1-1) |
| Estancia hospitalaria (días) | 5 (4-6) |
| Insuficiencia mitral residual al alta enpacientes con en el procedimiento(n= 48) | Ausente- mínima (0-I/IV): 15 (28,30%)Leve (II/IV): 35 (66,04%)Moderada (III/IV): 3 (5,66%) |
| Éxito en el procedimiento (MVARC) | 48 (87,27%) |
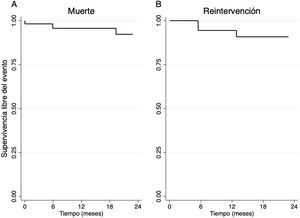
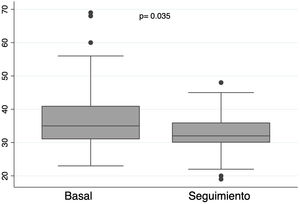
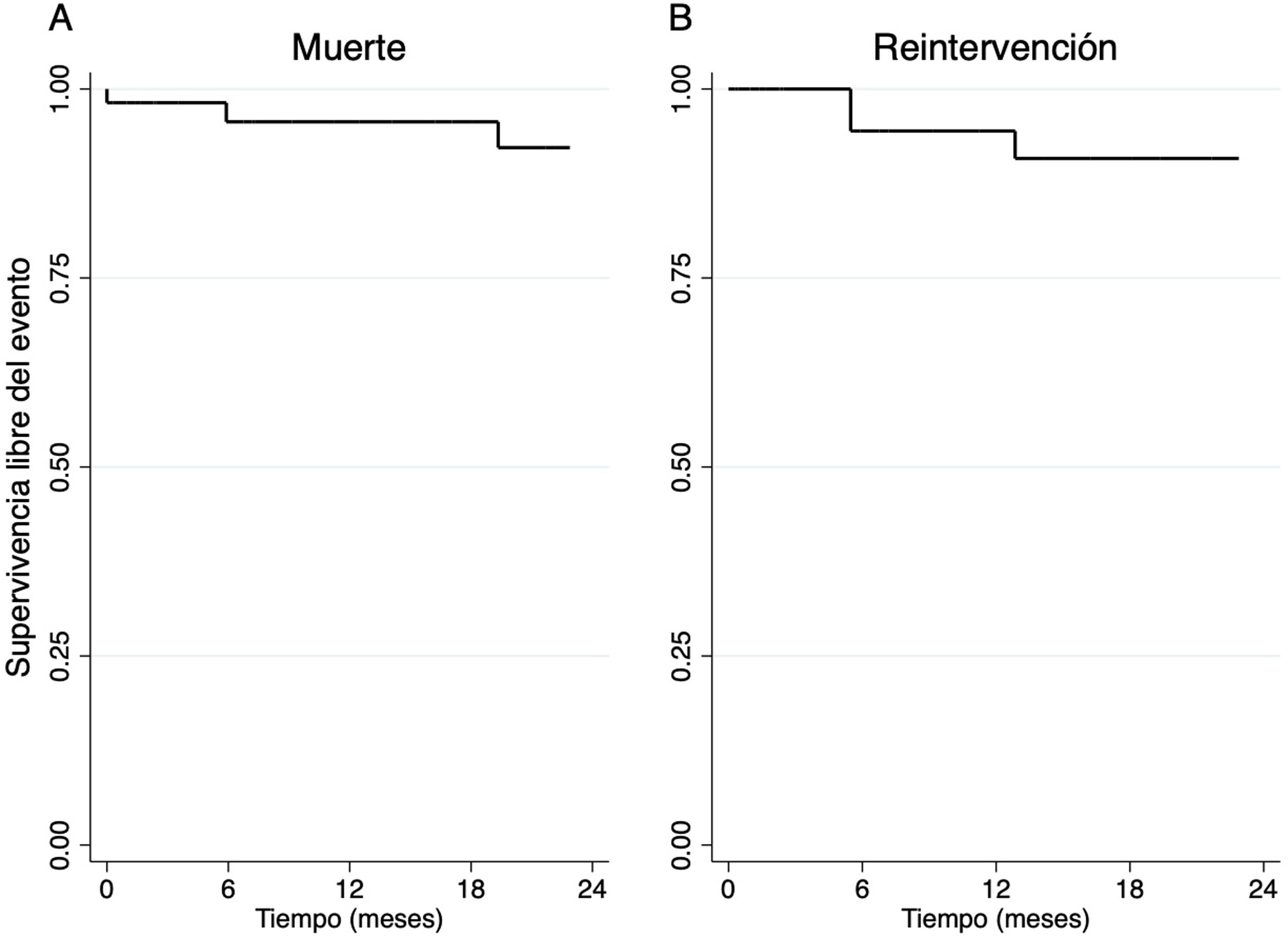
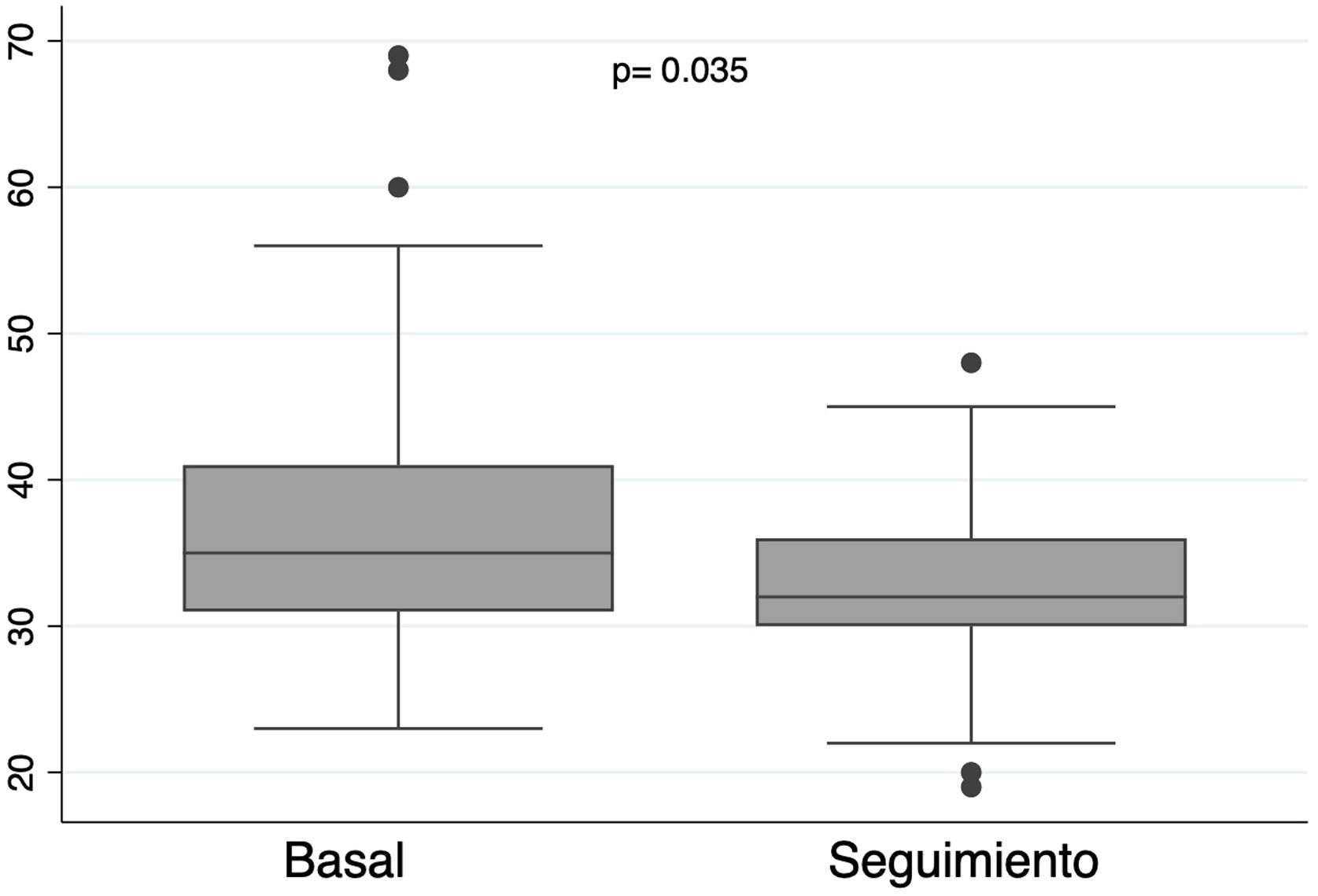
La mediana de seguimiento fue de 18,7 meses (3,25-36,47). A los 24 meses, la supervivencia de la cohorte total fue de 92,25% (fig. 4A). De los 48 pacientes con éxito del procedimiento, 37 pacientes (77,08%) presentaron IM recurrente menor o igual a II/IV, 3 pacientes (6,25%) III/IV y 8 (16,67%) IV/IV (fig. 5A); 47 pacientes (97,92%) estaban en clase funcional I (fig. 5B). Finalmente, se observó una disminución significativa en el diámetro telesistólico del VI respecto al previo a la intervención (36,07mm vs. 32,84mm; p= 0,035) (fig. 6).
La supervivencia libre de reintervención en los pacientes con éxito del procedimiento a 24 meses fue de 90,81% (fig. 4B). Ocho pacientes fueron reintervenidos, 2 por endocarditis infecciosa, 2 por rotura de neocuerdas y 4 por remodelado inverso del VI con reaparición de IM significativa. Los 2 casos reintervenidos por endocarditis requirieron sustitución valvular mitral, en 5 casos se reparó la válvula mitral mediante cirugía convencional y en un caso se llevó a cabo una reparación percutánea edge-to-edge.
DiscusiónLos resultados de nuestra experiencia inicial del procedimiento TOP MINI confirman la factibilidad, seguridad y eficacia de la técnica.
La selección de los pacientes es clave en el éxito del procedimiento. En nuestra cohorte, se puede observar que el fracaso del procedimiento se explicó principalmente por una mala selección de pacientes en 5 de los 7 casos de fallo. Previamente se ha reportado que una anatomía favorable (tipo A o B) se asocia a una disminución en el riesgo fracaso del procedimiento y de recurrencia de IM en el seguimiento12. En consecuencia, se recomienda seleccionar pacientes con un prolapso limitado al velo posterior (principalmente P2), con anillo mitral conservado y con un VI de dimensiones normales.
En nuestro centro, consideramos la técnica en dos escenarios distintos: 1) pacientes de bajo riesgo con IM severa degenerativa por prolapso de P2 (tipo A y B, que tienen altas tasas de reparabilidad con esta técnica), 2) pacientes de alto riesgo e IMs con anatomías más desfavorables: prolapsos del velo anterior, o de ambos velos, insuficiencias paracomisurales o con válvulas calcificadas (tipo C y D). Los resultados de la técnica son mejores en aquellos casos en que la IM aún no ha producido dilatación ventricular con nula o mínima dilatación anular19. Esto supone el tratamiento de la IM en su fase más precoz, cuando, precisamente, es sabido que se protege el VI de su deterioro y se asegura una mayor supervivencia y mínima clínica residual20.
Cuando se indica el procedimiento pacientes con VI o anillo dilatado es más probable el fracaso de la técnica por remodelado inverso. La reducción del volumen ventricular (remodelado inverso) asociado a la reparación mitral es un fenómeno frecuentemente observado, y que puede generar la reaparición de un mayor o menor grado de prolapso. Colli et al. han demostrado que es necesario realizar un cierto grado de sobretensionamiento de las cuerdas para evitar la el mecanismo antes explicado y la recurrencia del prolapso21. En el seguimiento, observamos que 14,5% de los pacientes presentaron recurrencia de IM severa, debido en su mayoría al remodelado inverso en pacientes con VI dilatado.
También es crucial la adecuada selección de abordaje del ápex, que ha de ser más posterolateral que en otros procedimientos como la TAVI transapical. Esto permite alinear el dispositivo con el plano valvular de manera más ortogonal, y, además, disminuir la posibilidad de interferir con las cuerdas del velo anterior de la mitral. Por otro lado, permite implantar las neocuerdas generando cierta tracción posterior del velo posterior, lo que redunda en un aumento de la superficie de coaptación22.
De los 15 pacientes que han tenido que ser o bien convertidos durante el procedimiento o reoperados en el seguimiento, en 8 se ha podido reparar la válvula mitral. Esto demuestra que el fracaso de esta técnica no conlleva la imposibilidad de una reparación convencional, al contrario de lo que ocurre con otros dispositivos como MitraClip. Previamente se ha reportado que, en el seguimiento, los pacientes donde la técnica fracasó, pudieron ser reintervenidos sin un aumento en el riesgo operatorio17.
LimitacionesEste estudio comunica la experiencia inicial de un centro aislado, con un tamaño muestral pequeño y resultados a corto plazo.
ConclusiónEl implante transapical de neocuerdas es una técnica segura y eficaz a corto plazo en pacientes con IM severa degenerativa con prolapso limitado al velo posterior de la válvula mitral.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.








![Índice velo-anillo (Leaflet-to-annulus index,[LAI]), estimado mediante la suma de la longitud del velo anterior mitral (AML) y velo posterior mitral (PML), sobre el diámetro anteroposterior del anillo mitral (AP), medidos en el eje largo durante la mesosístole. Índice velo-anillo (Leaflet-to-annulus index,[LAI]), estimado mediante la suma de la longitud del velo anterior mitral (AML) y velo posterior mitral (PML), sobre el diámetro anteroposterior del anillo mitral (AP), medidos en el eje largo durante la mesosístole.](https://static.elsevier.es/multimedia/11340096/00000030000000S1/v1_202308100556/S1134009623000451/v1_202308100556/es/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)