Las guías de práctica clínica recomiendan, en pacientes jóvenes y centros con experiencia, la cirugía conservadora valvular aórtica para el tratamiento de la insuficiencia aórtica como alternativa al reemplazo valvular aórtico. Es una cirugía compleja, pero demandada más frecuentemente. Debemos plantearla como opción terapéutica y explicar sus resultados.
MétodosAnálisis prospectivo, no randomizado, de 138 pacientes intervenidos con cirugía conservadora valvular aórtica (2011-2019).
ResultadosPresentaban: edad media 58,1±14,2 años, 33 (23,9%) mujeres, 9 (6,5%) emergentes; EUROSCORE-II: 3,35±2,9, EUROSCORE-LOGÍSTICO: 9,29±7. Morfología valvular: 83 (60,1%) - tricúspide, 44 (31,9%) - bicúspide, 11 (8%) -unicúspide. Procedimientos realizados: (reimplante valvular [DAVID] + plastia aórtica): 78 (56,5%); (remodelado aórtico [YACOUB] + plastia aórtica): 22 (15,9%); plastia aórtica + tubo supracoronario: 15 (10,9%); plastia aórtica: 23 (16,7%). El 69,36% de velos aórticos precisó múltiples técnicas: (63,5%) plicatura central, (10,3%) decalcificación y (20,9%) plastia pericardio.
Hubo reoperación por sangrado 4 (2,9%). Fallecieron 8 (5,8%) pacientes en el postoperatorio inmediato (3,9% de electivos).
La insuficiencia aórtica preoperatoria era: I-II(18,1%), III (17,4%) y IV (64,5%). En 16 (11,6%) pacientes persistía insuficiencia grado-II intraoperatoria, reconvirtiéndose a prótesis aórtica. El seguimiento medio fue 44,2±28,6 (mediana 42,5) meses.
A 9 años están libres de insuficiencia aórtica ≥ III: 83,5% (serie entera); 84,6% (tratamiento raíz aórtica [DAVID+YACOUB]) vs. 81,9% (sin tratamiento raíz aórtica) (p=0,4); 88,8% (DAVID), 63,2% (YACOUB), 85,7% (plastia aórtica + tubo supracoronario) y 78,3% (plastia aórtica) (p=0,22); 63,5% (plastia pericardio) vs. 97,7% (sin plastia pericardio) (p<0,0001). Y están libres de reoperación: 88,4% (serie entera); 89,7% (tratamiento raíz aórtica [DAVID+YACOUB]) vs. 85,8% (sin tratamiento raíz aórtica) (p=0,27); 89,5% (DAVID), 93,3% (YACOUB), 92,8% (plastia aórtica + tubo supracoronario) y 78,3% (plastia aórtica) (p=0,24); 71,5% (plastia pericardio) vs. 100% (sin plastia pericardio) (p<0,0001). En el seguimiento hubo 2 (1,75%) endocarditis, no hubo eventos tromboembólicos.
ConclusionesLa durabilidad de la cirugía conservadora valvular aórtica es buena, sin diferencias significativas entre diferentes tipos de técnicas; la utilización de pericardio heterólogo es la principal causa de reducción de la durabilidad.
Clinical practice guidelines recommend, in young patients and experienced centers, aortic valve sparing surgery for the treatment of aortic regurgitation as an alternative to aortic valve replacement. It is a complex surgery, but demanded more frequently. We must consider it as a therapeutic option and explain its results.
MethodsProspective, non randomized, analysis of 138 patients operated on with aortic valve sparing surgery (2011-2019).
ResultsThey presented: mean-age 58.1±14.2 years, 33 (23.9%) women, 9 (6.5%) emerging; EUROSCORE-II: 3.35±2.9, EUROSCORE-LOGISTIC: 9.29±7. Valve morphology was: 83 (60.1%)-tricuspid, 44 (31.9%)-bicuspid, 11 (8%)-unicuspid. Procedures performed: (valve-reimplantation [DAVID] + aortic-plasty): 78 (56.5%); (aortic-remodeling [YACOUB] + aortic-plasty): 22 (15.9%); aortic-plasty+supracoronary-tube: 15 (10.9%); aortic-plasty: 23 (16.7%). The 69.36% of aortic leafleats required multiple techniques: (63.5%) central-plication, (10.3%) decalcification and (20.9%) pericardium-plasty.
There was reoperation for bleeding 4 (2.9%). Eight (5.8%) patients died in the immediate postoperative period (3.9% of electives).
Preoperative aortic regurgitation was: I-II(18.1%), III(17.4%) and IV(64.5%). Intra-operative regurgitation grade II persisted in 16 (11.6%) patients, converting to aortic prostheses. The mean follow-up was 44.2±28.6 (median 42.5) months.
At 9 years they are free of aortic regurgitation ≥ III: 83.5% (whole-series); 84.6% (aortic-root-treatment [DAVID+YACOUB]) vs. 81.9% (no-aortic-root-treatment) (p=0.4); 88.8% (DAVID), 63.2% (YACOUB), 85.7% (aortic-plasty+supracoronary-tube) and 78.3% (aortic-plasty) (p=0.22); 63.5% (pericardium-plasty) vs. 97.7% (without pericardium-plasty) (p<0.0001). And they are free of re-operation: 88.4% (whole-series); 89.7% (aortic-root-treatment [DAVID+YACOUB]) vs. 85.8% (no-aortic-root-treatment) (p=0.27); 89.5% (DAVID), 93.3% (YACOUB), 92.8% (aortic-plasty+supracoronary-tube) and 78.3% (aortic-plasty) (p=0.24); 71.5% (pericardium-plasty) vs. 100%(without pericardium-plasty) (p<0.0001). At follow-up there were endocarditis in 2 (1.75%) patients, there were no thromboembolic events.
ConclusionsThe durability of aortic valve sparing surgery is good, without significant differences between different types of techniques; the use of heterologous pericardium is the main cause of reduced durability.
Los pacientes con insuficiencia aórtica (IAo) con indicación de cirugía encuentran en el reemplazo valvular el tratamiento estándar1. Sin embargo, las guías europeas de práctica clínica en valvulopatías contemplan, en pacientes jóvenes con tejidos móviles, la opción de reparación en centros con experiencia1. Estas guías se centran en las técnicas de reimplante valvular2 y de remodelado aórtico3 cuyos óptimos resultados, con tasas libres de reoperación a 10 y 15 años en torno al 85-90%, han sido publicados ampliamente4–7. Sin embargo, la reparación valvular puede realizarse sin necesidad del tratamiento de la raíz aórtica cuando no sea necesario con buenos resultados8,9. Así mismo, parece clara una idea, la reducción de eventos relacionados con las válvulas aórticas (trombosis y tromboembolismo, hemorragias y endocarditis) del 3-5% por paciente/año al 1,6% por paciente/año cuando estas son reparadas10–13.
Los pacientes con IAo, especialmente los jóvenes, cada día están más informados de las opciones terapéuticas. Es nuestro deber aportar todas las opciones posibles e informar de los diferentes resultados, a nivel internacional, y especialmente a nivel local. Nuestro objetivo es analizar nuestros resultados en la cirugía conservadora valvular aórtica, poder aprender para mejorarlos y presentarlos cuando lo requieran los pacientes.
MétodosSe ha llevado a cabo un análisis prospectivo, no randomizado, de 138 pacientes con IAo intervenidos con cirugía conservadora valvular aórtica en un único centro entre marzo de 2011 y noviembre de 2019. Los datos han sido recogidos en el momento de la cirugía y durante el seguimiento a los dos meses y posteriormente anual con ecocardiograma transtorácico de control. Los tipos de procedimientos realizados fueron cuatro: reimplante-valvular (DAVID) + plastia aórtica (Pl-Ao): 78 (56,5%); remodelado aórtico (YACOUB) + Pl-Ao: 22 (15,9%); Pl-Ao + tubo supracoronario (TSC): 15 (10,9%); Pl-Ao aislada: 23 (16,7%). El estudio no practica técnicas desconocidas en el tratamiento de los pacientes ni es un ensayo clínico que plantee discrepancias éticas.
Técnica quirúrgicaLa cirugía conservadora valvular aórtica y procedimientos asociados se han realizado, vía esternotomía completa, con circulación extracorpórea (CEC), hipotermia 32° (excepto en los casos de sustitución de hemiarco con parada circulatoria donde la hipotermia es a 26° con perfusión cerebral anterógrada) y parada cardiaca inducida por cardioplejía cristaloide Celsior© (Genzyme Corp., Boston, MA) vía retrógrada y anterógrada directa en ostia coronaria. En los casos de reimplante valvular se ha realizado la técnica DAVID I y DAVID IV con injertos de Dacron de tamaños entre 28 y 34. Para el remodelado aórtico se ha realizado la técnica de YACOUB asociada a anuloplastia con sutura de la unión ventrículo-aórtica según técnica descrita por Schäfers5, utilizando sutura de CV-0 polytetrafluoroethyleno Gore© (W. L. Gore & Associates, Munich, Alemania). Esta misma sutura se ha utilizado en el procedimiento de Pl-Ao+TSC. En los casos de Pl-Ao aislada se realizaron inicialmente anuloplastias de unión ventrículo-aórtica, asociando posteriormente anuloplastia de la unión sinotubular para restablecer las relaciones geométricas de la raíz aórtica. Se realizó un análisis sistemático de la geometría y tamaño de los velos, presencia de fenestraciones, calcificación, rotura, fibrosis, retracciones. Para las reconstrucciones valvulares cuando fuera preciso se ha utilizado pericardio heterólogo.
Análisis estadísticoEl análisis descriptivo de los datos se expresó mediante media ± desviación estándar y mediana para las variables continuas y frecuencias (porcentajes) para las no continuas. Las comparaciones entre proporciones se realizaron con el test chi cuadrado, aplicando el test de Fisher en los casos en que el número de sujetos es <5 o igual a 0, y para comparar variables continuas se ha empleado t de Student para muestras independientes y U de Mann-Whitney y Kruskal-Wallis para las que no cumplen características de normalidad. El análisis de supervivencia se realizó con las curvas de sobrevida de Kaplan-Meier y su comparación con el Log-Rank Test y con el análisis de riesgos competitivos de Fine-Gray. Para comparar el riesgo de desarrollo de IAo≥III se ha utilizado la regresión de Cox.
El análisis estadístico se realizó con Infostat Software Estadístico para Windows, creado por la Universidad de Córdoba, versión 2017 y por XLSTAT (Addinsoft Inc 244 Fifth Avenue, Suite E100 Nueva York, N.Y. 10001). Un p valor < 0,05 (asumiendo bilateralidad) se consideró significativo estadísticamente.
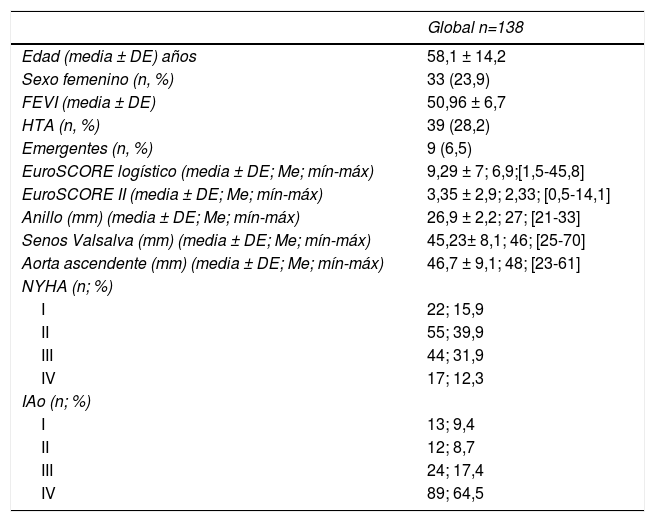
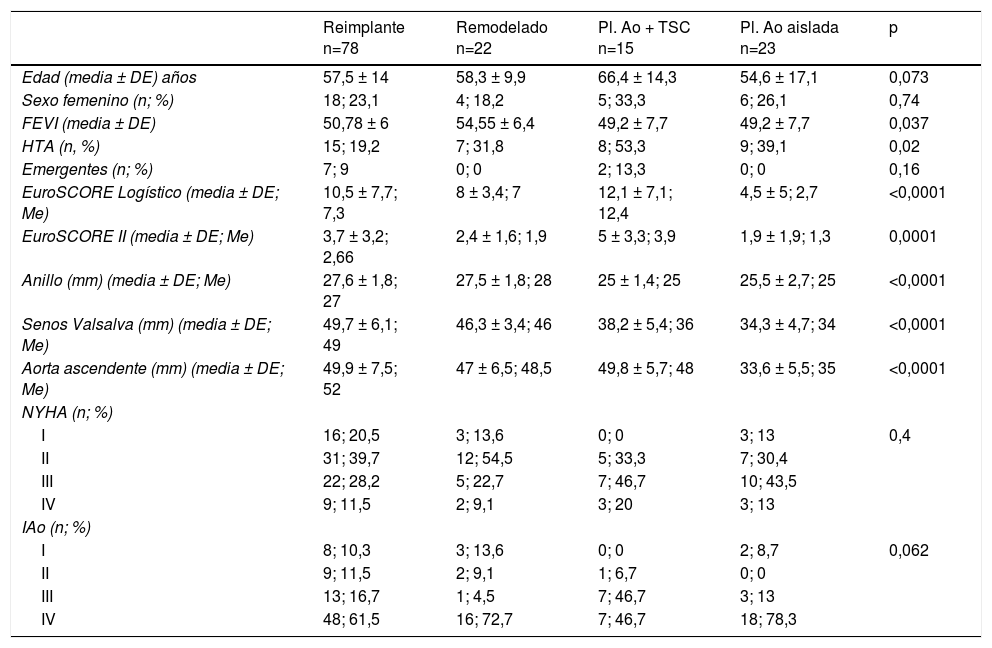
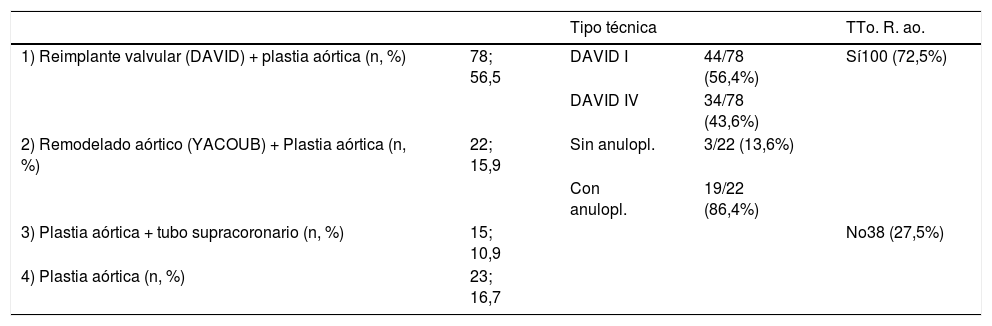
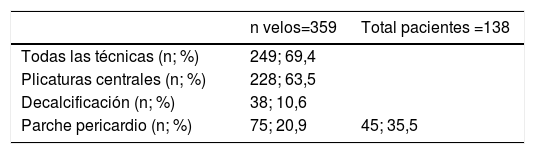
ResultadosLa edad media de la serie global era de 58,1 ± 14,2 años, de las que 33 (23,9%) eran mujeres y presentaba un EuroSCORE-LOGÍSTICO medio de 9,29 ± 7% y un EuroSCORE-II medio de 3,35 ± 2,9%. Las medianas del tamaño del anillo aórtico, senos de Valsalva y aorta ascendente eran 27, 46 y 48mm, respectivamente. Los pacientes en el momento de la cirugía se encontraban, principalmente, en grado funcional II (39,9%) y III (31,9%) de la New York Heart Association (NYHA), y la IAo era severa (grado IV) en el 64,5%. Las variables clínicas preoperatorias de la serie global y por grupos de procedimientos realizados las podemos ver en la tablas 1 y 2. En la tabla 2 observamos que no hubo diferencias significativas en cuanto al sexo, ni edad, aunque los pacientes que recibieron Pl-Ao+TSC eran más añosos (66,4 ± 14,3 años, p=0,073) frente al resto de grupos. Puesto que los pacientes no eran randomizados a los procedimientos, sino que estos se aplicaban en función de las características de los pacientes, es lógico que haya diferencias significativas en los diámetros del anillo aórtico, senos de Valsalva y aorta ascendente, siendo los de mayor tamaño los presentes en pacientes que recibieron reimplante y remodelado aórtico. La IAo grado IV era la más frecuente en todos los grupos. En la tabla 3 vemos desglosados los procedimientos de reparación, con tratamiento de la raíz aórtica en 100 pacientes (72,5%) frente a 38 (27,5%) en los que no se modificó la raíz aórtica. Los reimplantes se dividieron en dos variantes DAVID I (56,4%) y DAVID IV (43,6%) y los remodelados se asociaron muy frecuentemente a anuloplastia con sutura de unión ventrículo-aórtica (86,4%). Hubo 55(40%) de válvulas bicúspides. El 69,4% de los velos recibieron algún tipo de técnica de reparación (tabla 4), siendo la más frecuente la plicatura central (63,5% de los velos). Se realizó decalcificación en el 10,6% de los velos y se utilizó pericardio para la reconstrucción valvular en el 20,9% de los velos, esto supone que 45 pacientes (35,5%) recibieron pericardio en la reparación.
Variables clínicas de los pacientes
| Global n=138 | |
|---|---|
| Edad (media ± DE) años | 58,1 ± 14,2 |
| Sexo femenino (n, %) | 33 (23,9) |
| FEVI (media ± DE) | 50,96 ± 6,7 |
| HTA (n, %) | 39 (28,2) |
| Emergentes (n, %) | 9 (6,5) |
| EuroSCORE logístico (media ± DE; Me; mín-máx) | 9,29 ± 7; 6,9;[1,5-45,8] |
| EuroSCORE II (media ± DE; Me; mín-máx) | 3,35 ± 2,9; 2,33; [0,5-14,1] |
| Anillo (mm) (media ± DE; Me; mín-máx) | 26,9 ± 2,2; 27; [21-33] |
| Senos Valsalva (mm) (media ± DE; Me; mín-máx) | 45,23± 8,1; 46; [25-70] |
| Aorta ascendente (mm) (media ± DE; Me; mín-máx) | 46,7 ± 9,1; 48; [23-61] |
| NYHA (n; %) | |
| I | 22; 15,9 |
| II | 55; 39,9 |
| III | 44; 31,9 |
| IV | 17; 12,3 |
| IAo (n; %) | |
| I | 13; 9,4 |
| II | 12; 8,7 |
| III | 24; 17,4 |
| IV | 89; 64,5 |
DE: desviación estándar; EuroSCORE: European System for Cardiac Operative Risk Evaluation; FEVI: fracción de eyección de ventrículo izquierdo; HTA: hipertensión arterial; IAo: insuficiencia aórtica; Me: mediana; mín-máx: mínimo-máximo; mm: milímetros; n: número de pacientes; NYHA: New York Heart Association; %: porcentaje.
Variables clínicas de los pacientes por tipo de cirugía
| Reimplante n=78 | Remodelado n=22 | Pl. Ao + TSC n=15 | Pl. Ao aislada n=23 | p | |
|---|---|---|---|---|---|
| Edad (media ± DE) años | 57,5 ± 14 | 58,3 ± 9,9 | 66,4 ± 14,3 | 54,6 ± 17,1 | 0,073 |
| Sexo femenino (n; %) | 18; 23,1 | 4; 18,2 | 5; 33,3 | 6; 26,1 | 0,74 |
| FEVI (media ± DE) | 50,78 ± 6 | 54,55 ± 6,4 | 49,2 ± 7,7 | 49,2 ± 7,7 | 0,037 |
| HTA (n, %) | 15; 19,2 | 7; 31,8 | 8; 53,3 | 9; 39,1 | 0,02 |
| Emergentes (n; %) | 7; 9 | 0; 0 | 2; 13,3 | 0; 0 | 0,16 |
| EuroSCORE Logístico (media ± DE; Me) | 10,5 ± 7,7; 7,3 | 8 ± 3,4; 7 | 12,1 ± 7,1; 12,4 | 4,5 ± 5; 2,7 | <0,0001 |
| EuroSCORE II (media ± DE; Me) | 3,7 ± 3,2; 2,66 | 2,4 ± 1,6; 1,9 | 5 ± 3,3; 3,9 | 1,9 ± 1,9; 1,3 | 0,0001 |
| Anillo (mm) (media ± DE; Me) | 27,6 ± 1,8; 27 | 27,5 ± 1,8; 28 | 25 ± 1,4; 25 | 25,5 ± 2,7; 25 | <0,0001 |
| Senos Valsalva (mm) (media ± DE; Me) | 49,7 ± 6,1; 49 | 46,3 ± 3,4; 46 | 38,2 ± 5,4; 36 | 34,3 ± 4,7; 34 | <0,0001 |
| Aorta ascendente (mm) (media ± DE; Me) | 49,9 ± 7,5; 52 | 47 ± 6,5; 48,5 | 49,8 ± 5,7; 48 | 33,6 ± 5,5; 35 | <0,0001 |
| NYHA (n; %) | |||||
| I | 16; 20,5 | 3; 13,6 | 0; 0 | 3; 13 | 0,4 |
| II | 31; 39,7 | 12; 54,5 | 5; 33,3 | 7; 30,4 | |
| III | 22; 28,2 | 5; 22,7 | 7; 46,7 | 10; 43,5 | |
| IV | 9; 11,5 | 2; 9,1 | 3; 20 | 3; 13 | |
| IAo (n; %) | |||||
| I | 8; 10,3 | 3; 13,6 | 0; 0 | 2; 8,7 | 0,062 |
| II | 9; 11,5 | 2; 9,1 | 1; 6,7 | 0; 0 | |
| III | 13; 16,7 | 1; 4,5 | 7; 46,7 | 3; 13 | |
| IV | 48; 61,5 | 16; 72,7 | 7; 46,7 | 18; 78,3 | |
DE: desviación estándar; EuroSCORE: European System for Cardiac Operative Risk Evaluation; FEVI: fracción de eyección de ventrículo izquierdo; HTA: hipertensión arterial; IAo: insuficiencia aórtica; Me: mediana; mín-máx: mínimo-máximo; mm: milímetros; n: número de pacientes; NYHA: New York Heart Association; Pl. Ao: plastia aórtica; TSC: tubo supracoronario; %: porcentaje.
Procedimientos
| Tipo técnica | TTo. R. ao. | |||
|---|---|---|---|---|
| 1) Reimplante valvular (DAVID) + plastia aórtica (n, %) | 78; 56,5 | DAVID I | 44/78 (56,4%) | Sí100 (72,5%) |
| DAVID IV | 34/78 (43,6%) | |||
| 2) Remodelado aórtico (YACOUB) + Plastia aórtica (n, %) | 22; 15,9 | Sin anulopl. | 3/22 (13,6%) | |
| Con anulopl. | 19/22 (86,4%) | |||
| 3) Plastia aórtica + tubo supracoronario (n, %) | 15; 10,9 | No38 (27,5%) | ||
| 4) Plastia aórtica (n, %) | 23; 16,7 |
Anulopl.: anuloplastia; n: número de pacientes; TTo R. ao.: tratamientode la raíz aórtica; %: porcentaje.
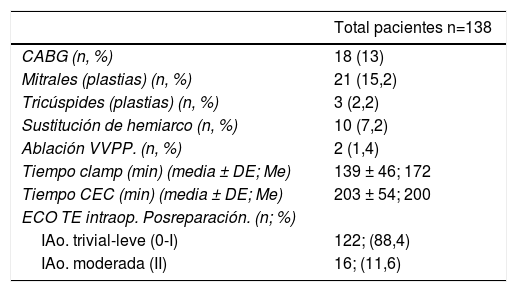
Se realizaron procedimientos quirúrgicos asociados (tabla 5), revascularización miocárdica (13%), plastia mitral (15,2%) y sustitución de hemiarco (7,2%) son los más frecuentes. El tipo de cirugía, junto con los procedimientos asociados hacen que los tiempos de pinzamiento aórtico y CEC (139 ± 46 y 203 ± 54 min, respectivamente) sean prolongados. Tras la cirugía el ecocardiograma transesofágico intraoperatorio mostraba IAo grado II (moderada-baja) en 16 pacientes (11,6%), resultado que no se consideró óptimo por lo que se procedió a conversión a prótesis en estos pacientes. Puesto que se partía de un porcentaje muy alto de IAo grado IV se consiguió el éxito de la reparación (IAo trivial-leve) en 122 pacientes (88,4%).
Procedimientos asociados y variables intraoperatorias
| Total pacientes n=138 | |
|---|---|
| CABG (n, %) | 18 (13) |
| Mitrales (plastias) (n, %) | 21 (15,2) |
| Tricúspides (plastias) (n, %) | 3 (2,2) |
| Sustitución de hemiarco (n, %) | 10 (7,2) |
| Ablación VVPP. (n, %) | 2 (1,4) |
| Tiempo clamp (min) (media ± DE; Me) | 139 ± 46; 172 |
| Tiempo CEC (min) (media ± DE; Me) | 203 ± 54; 200 |
| ECO TE intraop. Posreparación. (n; %) | |
| IAo. trivial-leve (0-I) | 122; (88,4) |
| IAo. moderada (II) | 16; (11,6) |
CABG: cardio artery bypass grafting; CEC: circulación extracorpórea; clamp: pinzamiento; DE: desviación estándar; ECO TE: ecocardiograma transesofágico; IAo: insuficiencia aórtica; intraop.: intraoperatorio; n: número; Me: mediana; min: minutos; %: porcentaje.
La mortalidad hospitalaria fue de 8 pacientes (5,8%), si consideramos solo los pacientes electivos (129) la mortalidad hospitalaria es de 5(3,9%) y la mortalidad a 30 días (según EuroSCORE-II) de los electivos es de 3 pacientes (2,3%). Se calculó el índice de mortalidad ajustada al riesgo (IMAR) obteniendo un IMAR de 1,75 para la mortalidad global hospitalaria, y de 0,8 para mortalidad de los electivos a 30 días (tabla 6).
Mortalidad e IMAR
| Total hospitalaria (n=138) | Electivos hospitalaria (n=129) | Electivos ≤ 30 d (n=129) | |
|---|---|---|---|
| Mort. obs. (n; %) | 8; (5,8) | 5; (3,9) | 3; (2,3) |
| Mort. esp. hospitalaria EuroScore II (media ± DE; Me) (%) | 3,35 ± 2,9; 2,33 | ||
| Mort. esp. electivos ≤ 30 d EuroScore II (media ± DE; Me) (%) | 2,96 ± 2,6; 2,1 | ||
| IMAR | 1,75 | 0,8 |
d: días; DE: desviación estándar; EuroSCORE: European System for Cardiac Operative Risk Evaluation; IMAR: índice de mortalidad ajustada al riesgo; Me: mediana; mort. esp.: mortalidad esperada; mort. obs.: mortalidad observada; n: número; %: porcentaje.
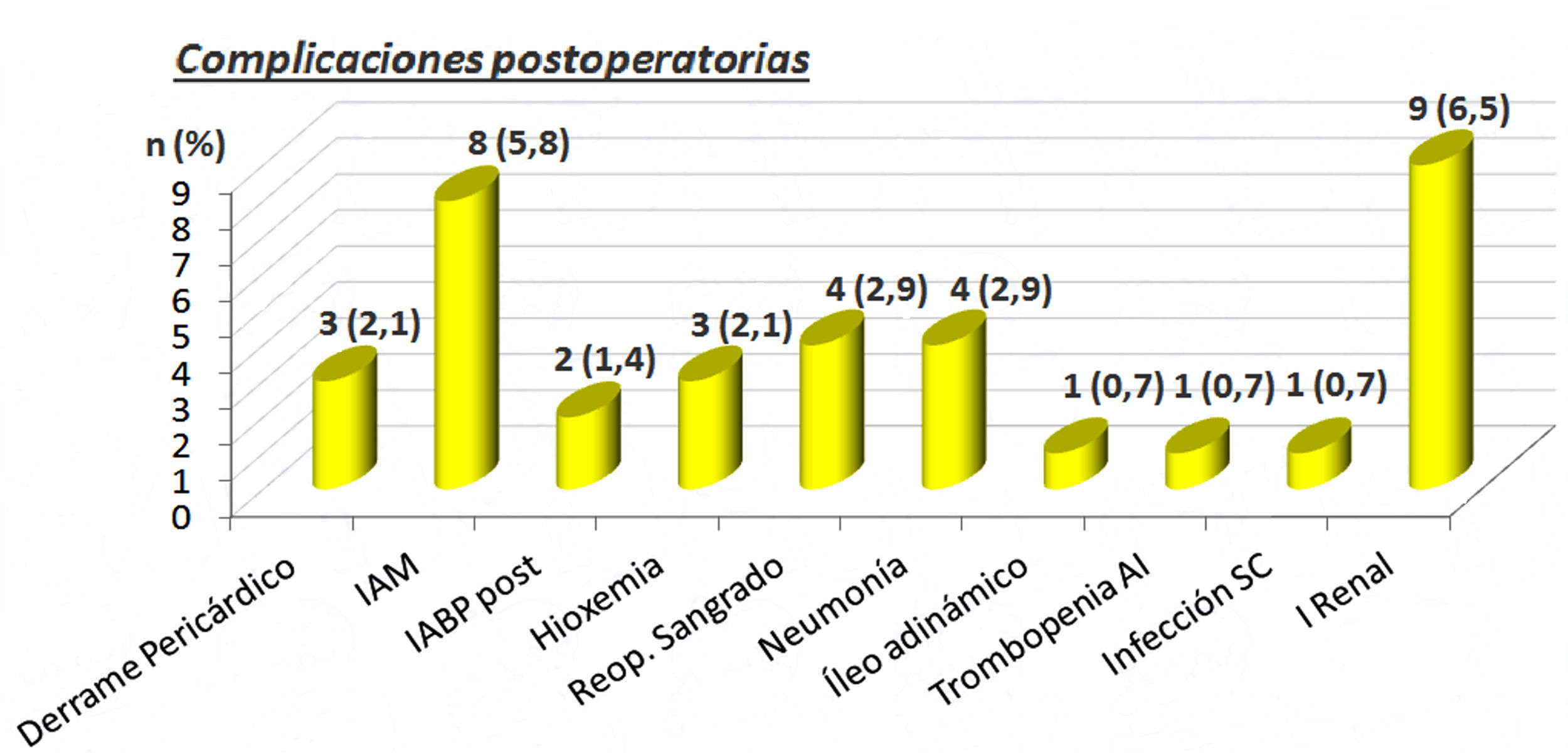
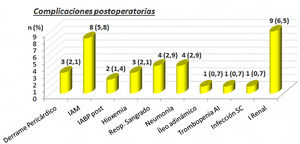
Las complicaciones postoperatorias las podemos ver en la figura 1. Destacan 8 (5,8%) pacientes con infarto agudo de miocardio perioperatorio y 9 (6,5%) con insuficiencia renal. Cuatro pacientes 2,9% precisaron reoperación por sangrado en el postoperatorio inmediato.
Complicaciones postoperatorias. AI: trombocitopenia autoinmune; IABP post: balón de contrapulsación intraórtico postoperatorio; IAM: infarto agudo de miocardio; I. renal: insuficiencia renal; n: número de pacientes; Reop. sangrado: reoperación por sangrado; Trombopenia infección SC: infección subcutánea; (%): porcentaje.
Tras los éxitus y las conversiones a prótesis intraoperatorias nos quedan 114 pacientes que tuvieron un seguimiento medio de 44,2 ± 28,6 meses con una mediana de 42,5 meses.
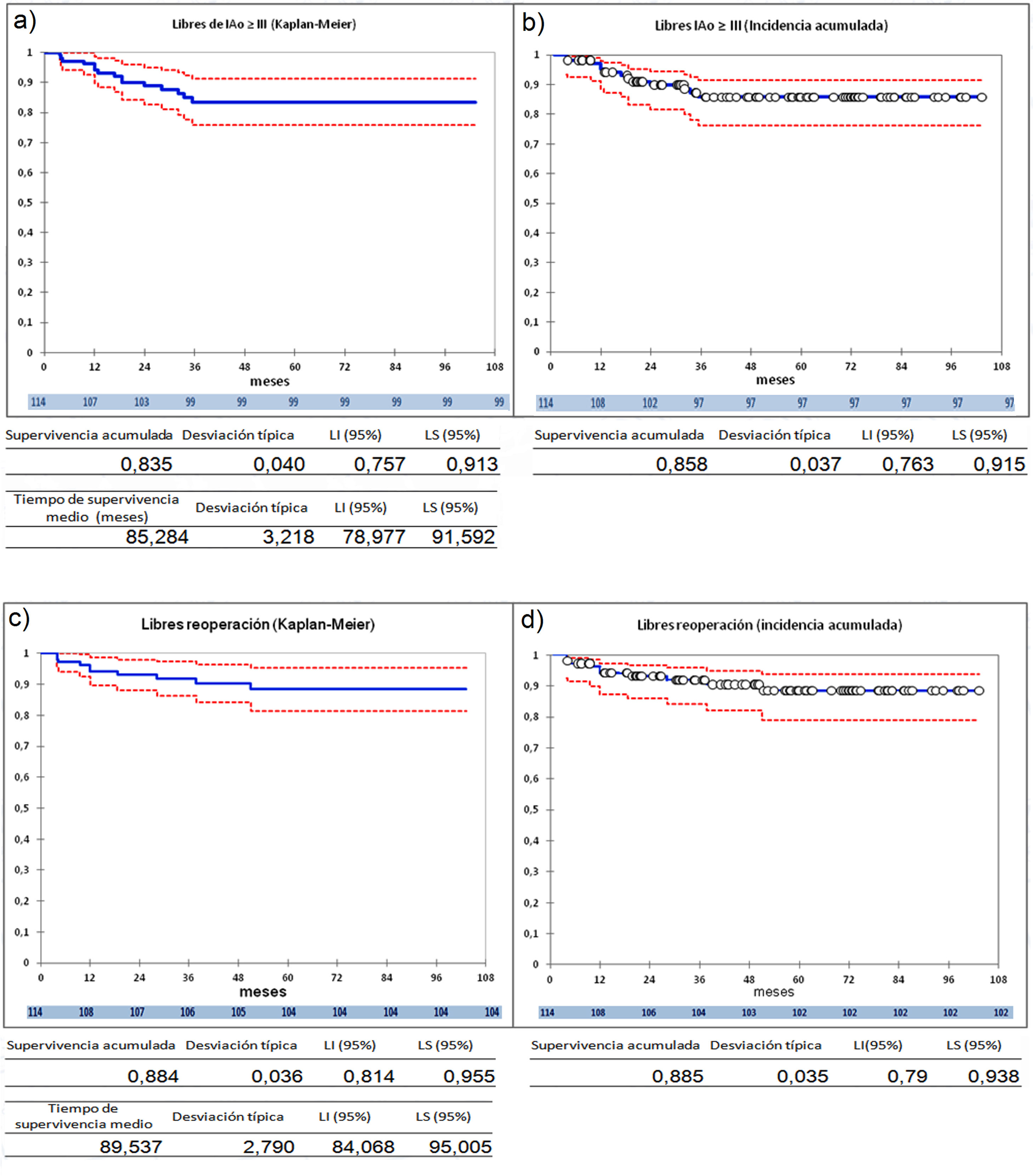
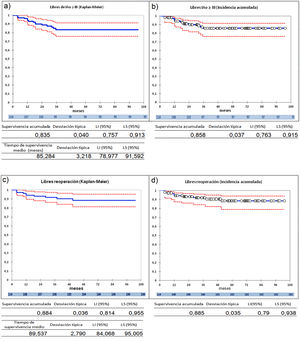
La serie entera (n=114) presenta una supervivencia a 9 años libres de IAo≥III del 83,5%, por el método Kaplan-Meier, y de 85,8% por el análisis de riesgos competitivos (fig. 2 a y 2b) y una supervivencia libres de reoperación del 88,4% por el método Kaplan-Meier, y de 88,5%, por el análisis de riesgos competitivos (fig. 2 c y 2d). Durante el seguimiento no hubo eventos tromboembólicos. Los eventos competitivos son escasos, un paciente falleció en el seguimiento, otro paciente recibió un trasplante cardiaco. Dos pacientes (1,75%) presentaron endocarditis pero no se consideraron eventos competitivos. Debido a esto, hemos utilizado el método Kaplan-Meier para el análisis, incluyendo las dos endocarditis como desarrollo de insuficiencia aórtica y reoperación en el seguimiento, aunque la insuficiencia aórtica no se debiera estrictamente a fallo de la reparación.
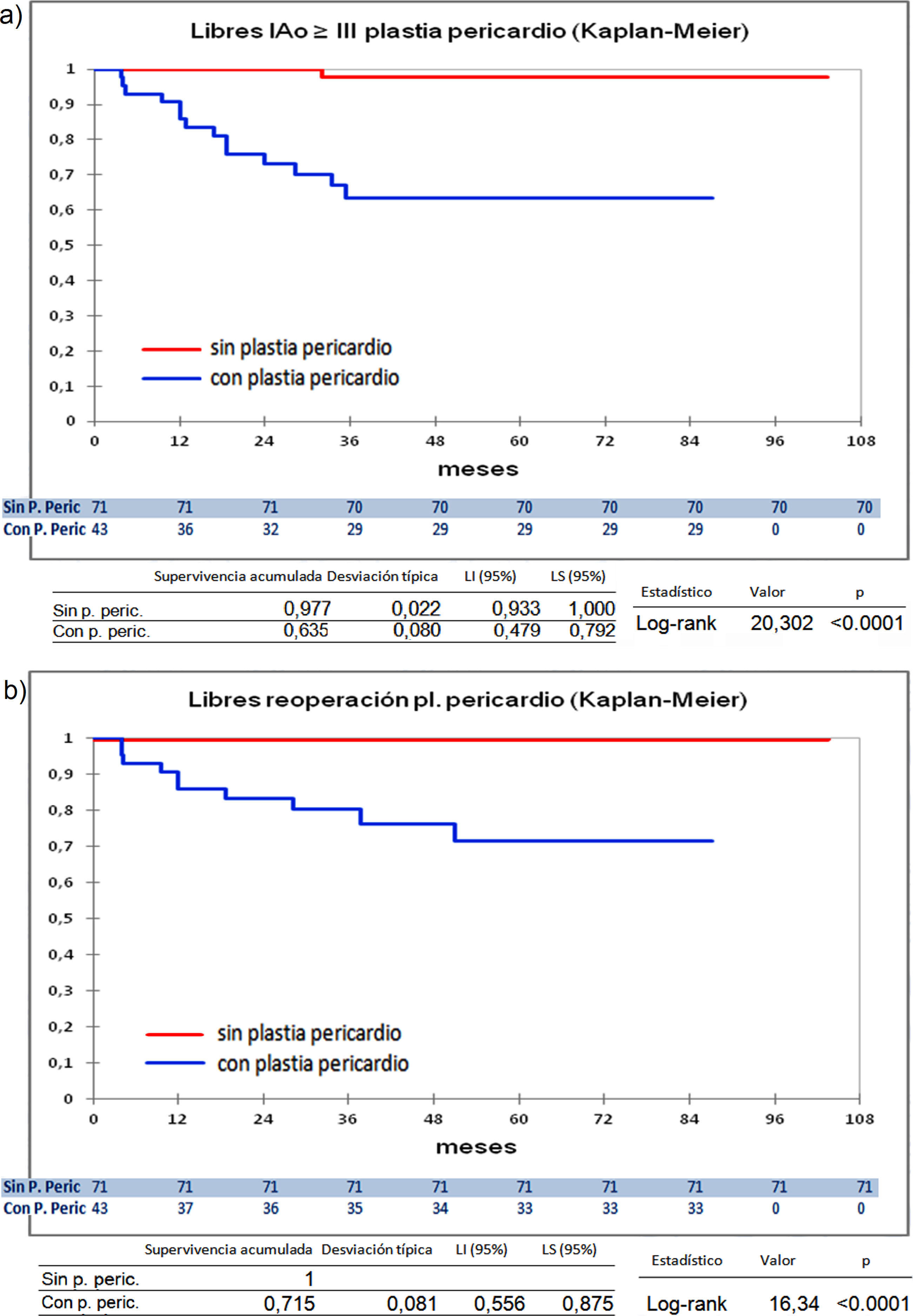
Curvas de supervivencia de insuficiencia aórtica y de reoperación en el seguimiento. a) Libres insuficiencia aórtica ≥ III por el método Kaplan-Meier. b) Libres insuficiencia aórtica ≥ III por el método de eventos competitivos. c) Libres de reoperación por el método Kaplan-Meier. d) Libres de reoperación por el método de eventos competitivos. LI: límite inferior; LS: límite superior.
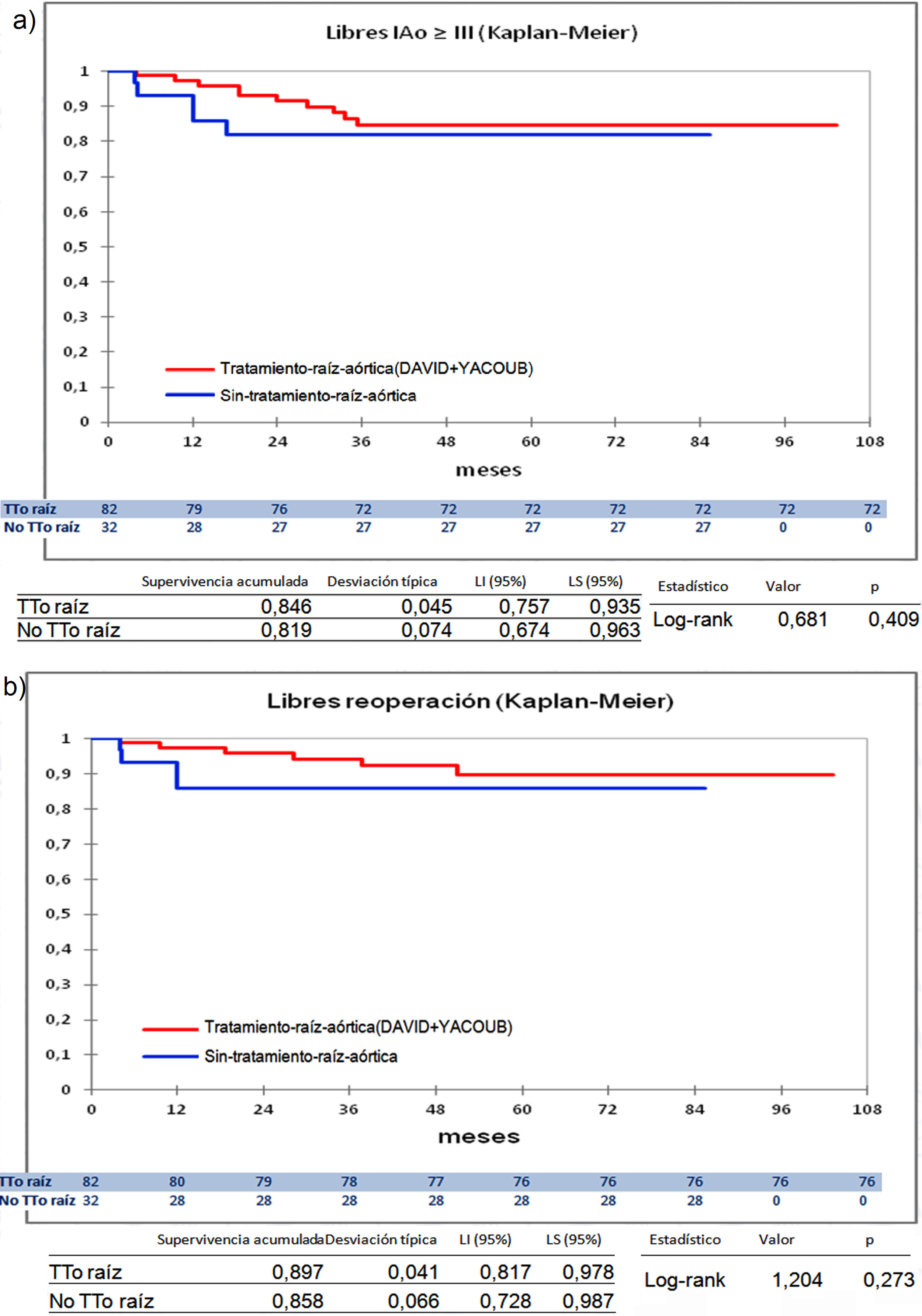
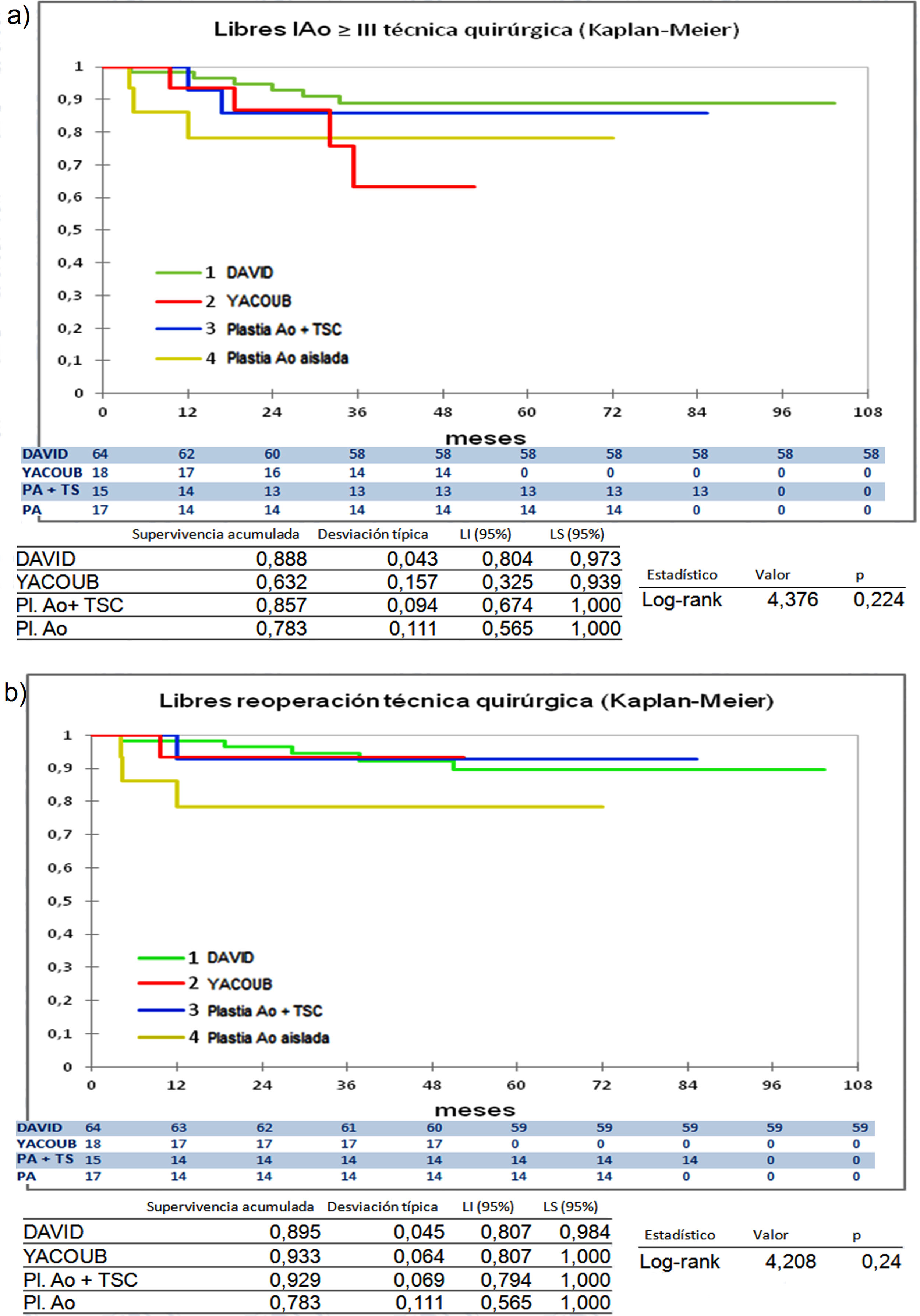
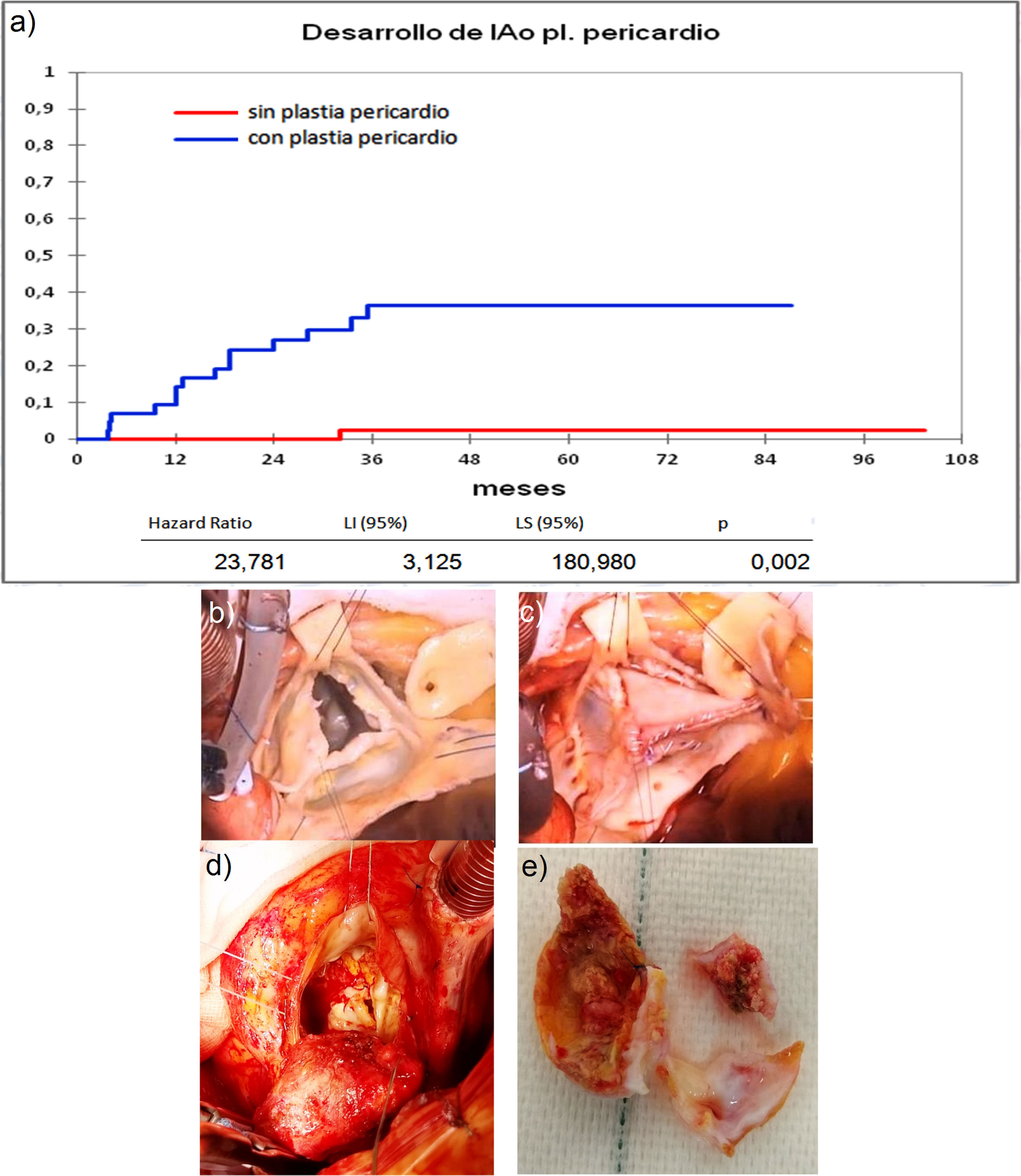
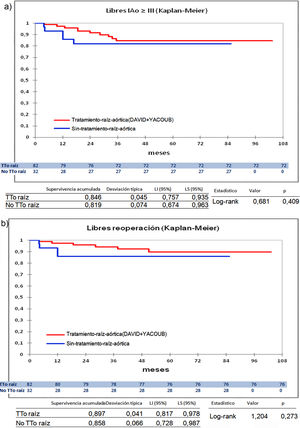
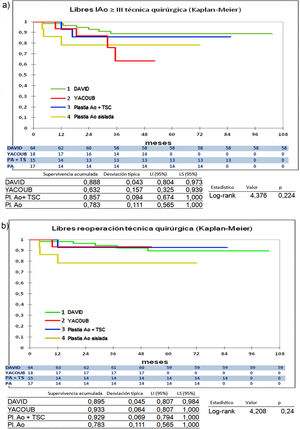
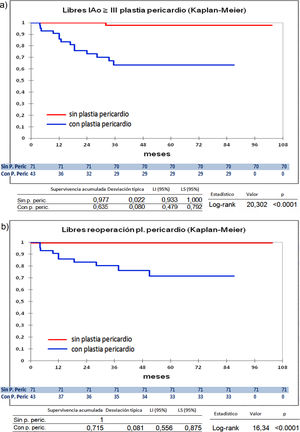
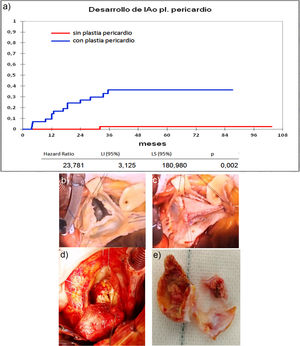
Cuando comparamos los pacientes que recibieron tratamiento de la raíz aórtica frente a los que no lo recibieron (fig. 3) y cuando comparamos los pacientes por el tipo de procedimiento realizado (fig. 4) no hubo diferencias significativas, ni en el desarrollo de IAo ni en la necesidad de reoperación. Las diferencias significativas las encontramos entre los pacientes que recibieron pericardio en la reparación y los que no lo recibieron, estos con supervivencias libres de IAo≥III y de reoperación muy superiores (fig. 5) (libres de IAo≥III: 63,5% plastia-pericardio vs. 97,7% sin plastia-pericardio, p<0,0001; libres de reoperación: 71,5% plastia-pericardio vs. 100% sin plastia-pericardio, p<0,0001). Un paciente que recibe pericardio en la reparación tiene 23 veces más riesgo de desarrollar IAo en el seguimiento (fig. 6a) (HR 23,7 IC95% 3,1-180,9; p=0,002), especialmente en los 3 primeros años por degeneración del mismo y retracción del tejido propio (fig. 6 b, c, d y e).
Curvas de supervivencia. a) Libres insuficiencia aórtica ≥ III en el seguimiento comparando el grupo que recibió tratamiento de la raíz aórtica frente al grupo que no recibió tratamiento de la raíz aórtica por el método Kaplan-Meier. b) Libres de reoperación en el seguimiento comparando el grupo que recibió tratamiento de la raíz aórtica frente al grupo que no recibió tratamiento de la raíz aórtica por el método Kaplan-Meier. LI: límite inferior; LS: límite superior; No TTo raíz: no recibió tratamiento de raíz aórtica; TTo raíz: tratamiento de raíz aórtica.
Curvas de supervivencia. a) Libres insuficiencia aórtica ≥ III en el seguimiento comparando los diferentes tipos de procedimientos de reparación por el método Kaplan-Meier. b) Libres de reoperación en el seguimiento comparando los diferentes tipos de procedimientos de reparación por el método Kaplan-Meier. DAVID: reimplante valvular según técnica de David; LI: límite inferior; LS: límite superior; Pl. Ao: plastia aórtica aislada; Plastia Ao + TSC: plastia aórtica más tubo supracoronario; YACOUB: remodelado aórtico según técnica de Yacoub.
Curvas de supervivencia. a) Libres insuficiencia aórtica ≥ III en el seguimiento comparando el grupo que recibió pericardio en la reparación frente a los que no recibieron pericardio por el método Kaplan-Meier. b) Libres de reoperación en el seguimiento comparando el grupo que recibió pericardio en la reparación frente a los que no recibieron pericardio por el método Kaplan-Meie. LI: límite inferior; LS: límite superior; Pl: plastia; P. Peric: plastia pericardio.
a) Curva de incidencia de insuficiencia aórtica en los que recibieron plastia pericardio frente a los que no la recibieron. LI: límite inferior; LS: límite superior. b) Válvula bicúspide con resección de fragmento calcificado. c) Reconstrucción con pericardio de válvula bicúspide. d) Degeneración de válvula bicúspide con reparación de pericardio en reimplante valvular aórtico. e) Pericardio calcificado y velo autóctono degenerado extraídos de figura c.
El tratamiento estándar de la IAo es el reemplazo valvular aórtico1, pero sabemos que las prótesis valvulares tienen complicaciones asociadas, como trombosis, tromboembolismo, hemorragias en las mecánicas, degeneración en biológicas y endocarditis, con un riesgo acumulado de complicaciones de al menos el 50% a 10 años14, y con una supervivencia reducida frente a la población normal con tasas de supervivencia de solo el 74 ± 4,9% a 10 años15. Frente al reemplazo valvular, desde hace años ha surgido la cirugía conservadora valvular aórtica, adoptada por las guías clínicas europeas de valvulopatías1, especialmente para pacientes jóvenes con tejidos móviles, en centros con experiencia y para técnicas de reimplante2 y remodelado3. La reparación valvular aórtica puede ser una alternativa a la cirugía de reemplazo protésico, son cirugías exigentes con una curva de aprendizaje importante, no obstante, parece aportar una reducción de las complicaciones relacionadas con las válvulas a 1,6% por paciente/año10–13, manteniendo unas tasas de reoperación a largo plazo bajas, oscilando entre el 4,2%16, 10%8 y el 11,7%17 a 10 años, con una supervivencia parecida a la de la población normal, 94,1%16 y 90%17 a 10 años.
Nuestra serie presenta una edad media de 58,1 ± 14,2 años, con un 23,9% de mujeres, datos similares a los presentados en la literatura como Arabkhani et al.12 Ouzounian et al.16 y Klotz et al.17. La IAo suele ser una enfermedad de adultos y adultos jóvenes, en estos es especialmente frecuente la morfología bicúspide. A diferencia con otras series presentadas en la literatura nuestros pacientes tienen un grado funcional ligeramente peor, se encontraban principalmente en grado II (39,9%) y III (31,9%) de la NYHA. En la serie de Zeeshan et al.8 el 88% están en grado funcional I y II, Ouzounian et al.16 apuntan que más del 70% se encuentran en grado I de la NYHA, Klotz et al.17 señalan un 70% en grado I y II de la NYHA. De igual forma ocurre con la IAo previa a la cirugía, en nuestra serie era severa (grado IV) en el 64,5%, mientras que en muchos artículos la IAo era severa en el 23%8 y leve en más del 30%16, de hecho la presencia de IAo severa preoperatoria se considera un factor de riesgo para fracaso de la reparación en el tiempo8,12, conjetura con la que nosotros no estamos de acuerdo pues con el gran porcentaje de IAo severa previa a la cirugía nuestra tasa libre de insuficiencia ≥III es bastante buena.
Nuestro grupo aplica las técnicas de reparación en función de las características de los pacientes dominando las múltiples técnicas establecidas. Vemos que más de la mitad de los procedimientos realizados es reimplante valvular (DAVID) + Pl-Ao 78 (56,5%), debido a que fue el primer procedimiento con el que se empezó el programa de reparación aórtica y posteriormente se fueron introduciendo los otros procedimientos con proporciones similares. Todos estos procedimientos llevan un porcentaje muy elevado (69,4%) de actuación sobre los velos aórticos, entre ellos un 20,9% de los velos recibieron pericardio, como podemos ver en la tabla 4, superior a la de otros autores con solo un 33% de reparación de velos12. En 18 (29%) de las válvulas tricúspides y 25 (48%) de las bicúspides en seguimiento se había utilizado pericardio. En las válvulas tricúspides el pericardio se ha utilizado principalmente para el cierre de fenestraciones, mientras que en las bicúspides se ha utilizado para reconstrucción comisural y alargamiento de velos. Esto supone dos consecuencias, la reparación lleva más tiempo de parada cardiaca, que junto con los procedimientos asociados hace que tengamos unos tiempos de isquemia y CEC prolongados (tabla 5), superiores a los de otras series16,17; la patología que da lugar a la IAo en esta serie está fuertemente relacionada con los propios velos aórticos, no solo es consecuencia de los cambios de dimensiones en la raíz aórtica, y es sabido que las alteraciones en velos se relacionan con la menor durabilidad de la reparación8,18.
La mortalidad hospitalaria global de nuestra serie incluyendo los pacientes emergentes (disecciones de aorta) fue de 8 pacientes (5,8%), pero si consideramos la mortalidad de los pacientes electivos a 30 días esta se reduce a 3(2,3%) con in IMAR de 0,8 que es un resultado aceptable. La mortalidad <1% en series como la Karliova et al.18 y Schneider et al.19, y de 1,2% Zeeshan et al.8 son todavía inferiores a las nuestras.
En el seguimiento los 114 pacientes restantes mostraron una libertad de IAo≥III de 83,5% y de reoperación del 88,4% a 9 años, resultados aunque algo inferiores son bastante concordantes con la literatura7,8,19–21.
Entre los factores señalados en íntima relación con el fracaso de la reparación en el tiempo están, el grado de regurgitación previa a la cirugía, cuanto más severa, más riesgo de fallo8,12, la estabilización del anillo5,6,19, la presencia de válvula bicúspide16,17,20, que aunque presenta buenos resultados a largo plazo son inferiores a las tricúspides y la utilización de pericardio en la reparación8,22.
Previamente hemos comentado que a pesar de tener un 64,5% de IAo grado IV precirugía los resultados son buenos en el tiempo. Desde el principio consideramos que la estabilización de la raíz aórtica es un factor fundamental para lograr resultados duraderos, por eso comenzamos la serie realizando la técnica de reimplante valvular (DAVID) que proporciona una estabilización del anillo y del resto de la raíz. Posteriormente sumamos el remodelado, casi siempre asociando anuloplastia con sutura (86,4%). Esta anuloplastia con sutura se utiliza de forma muy frecuente también en la Pl-Ao+TSC y en Pl-Ao aislada. La anuloplastia con sutura creemos que proporciona más estabilidad, de ahí su uso casi sistemático, salvo que la geometría de la raíz analizada con ecocardiograma transesofágico nos indique que el anillo no está en relación con la IAo, estos casos son escasos. Nuestro objetivo es reducir la unión ventrículo-aórtica a 23mm, y en un caso la hemos reducido a 21mm. En estos dos procedimientos hemos añadido la anuloplastia de la unión sinotubular, realizada igualmente con polytetrafluoroethyleno, para restablecer la relación diámetro unión sinotubular/diámetro de anillo aórtico ≤1,2 que colabora fuertemente en la durabilidad de la reparación22. Cuando hemos comparado los pacientes que recibieron tratamiento de la raíz aórtica frente a los que no se trató vemos que no ha habido diferencias significativas (89,7% y 85,8% libres de reoperación, p=0,2) (fig. 3). En estudios previos habíamos visto que las plastias aisladas tenían peor resultado pero desde la incorporación de la anuloplastia de la unión sinotubular los resultados se han mantenido en el tiempo. Youssefi et al.22, realizan esta doble anuloplastia con anillo, nosotros pensamos que es más cómodo, rápido y exige menos disección profunda en el ventrículo si se realiza con sutura, pero el concepto de devolver las relaciones geométricas de la raíz es lo que permite mantener buenos resultados de reparación. Esta técnica de la doble anuloplastia se aplica cuando no hay dilatación de la raíz aórtica o esta es leve, pues en el resto de los casos debemos proceder con un procedimiento de valve sparing root replacement.
La comparación entre procedimientos tampoco arroja diferencias significativas entre ellos (fig. 4). El desarrollo de IAo≥III es mayor en los pacientes con YACOUB, pero eso no se traduce en mayor tasa de reoperación. El reimplante valvular se mantiene muy estable en el tiempo con 88,8% libres de IA≥III y 89,5% libres de reoperación. Esto coincide con otros autores donde no han encontrado diferencias significativas entre las dos técnicas17,23.
Las diferencias significativas las hemos encontrado entre los pacientes que recibieron pericardio en la reparación, estando libres de IAo≥III el 63,5% y libres de reoperación el 71,5% frente a casi el 100% de los pacientes que no recibieron pericardio, esto coincide con hallazgos de otros autores8,18. Zeeshan et al.8 señalan que la decalcificación y desbridamiento se asocian con rápida calcificación de novo. Karliova et al.18 apuntan que los pacientes con pericardio tienen una supervivencia libre de reoperación a 10 años del 53%, peor en las válvulas bicúspides, cuando se usa para aumentar la longitud de los velos y en la reconstrucción comisural. Estos hallazgos han sido muy similares a los nuestros, pues los pacientes reoperados por fallo de reparación en los que se utilizó pericardio tenían realizadas reconstrucción comisural, muchos eran bicúspides, y ampliación de velos. En los hallazgos nos ha llamado la atención, junto con la degeneración del pericardio, la afectación el tejido propio del velo, muy fibrosado y retraído, como si hubiera sufrido un proceso de degeneración acelerado (fig. 6). Cuando hemos utilizado el pericardio para reconstruir fenestraciones en válvulas tricúspides los resultados han sido mejores coincidiendo con Karliova et al.18. Mirando los resultados desde otra perspectiva los pacientes con reparación sin pericardio tienen una excelente durabilidad con 97,7% libres de IAo≥III y 100% libres de reoperación, por lo que en los últimos tiempos tratamos de evitar la utilización de este elemento en las reparaciones.
ConclusionesLa cirugía conservadora valvular aórtica es una cirugía exigente, cada vez más requerida por los pacientes, que se puede realizar con unos términos de seguridad importantes, baja mortalidad y morbilidad y cuyos resultados a largo plazo son buenos, sin diferencias significativas entre los diferentes tipos de procedimientos. El mayor problema es cuando se utiliza pericardio heterólogo en la reparación pues se asocia con reaparición de insuficiencia y de reoperación de forma significativa. Esta situación cambia radicalmente en los pacientes reparados sin pericardio con unos resultados excelentes.
LimitacionesLa principal limitación de este estudio es el número de pacientes y los cuatro tipos de técnicas utilizadas que crean subgrupos, esto condiciona los resultados, pues la potencia estadística es menor. Aún así, recoger 138 pacientes en un estudio unicéntrico de cirugía conservadora valvular aórtica en nuestro país es una tarea de años. Otras limitaciones son el tipo de estudio, aunque prospectivo, es descriptivo y observacional, con asimétrico seguimiento en los tipos de técnicas y el reducido número de pacientes en riesgo a más de 5 años.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.