Paciente varón de 80 años con primer implante de marcapasos DDD Medtronic Kappa el año 2000, con recambio de generador el 2008 y el 2014. El año 2020 se indica actualización del dispositivo a DAI-TRC. Ingresa en septiembre del 2021 por infección del dispositivo, con cultivo positivo a Staphyloccocus aureus y hemocultivos negativos. En la región del bolsillo del generador presenta lesión granulomatosa con exudado hemático. En el ecocardiograma transtorácico se observan un electrodo ventricular totalmente adherido al velo septal de la válvula tricúspide y el otro en ventrículo derecho que interfiere con el movimiento del velo anterior que condiciona una insuficiencia tricúspide severa. Se indica extracción completa del dispositivo y reimplante contralateral de un nuevo sistema DAI-TRC. Para el procedimiento se realizó una tomografía axial computarizada, donde se observa el recorrido de los electrodos más antiguos apoyados completamente en la cara posterior y lateral de la innominada y cava, dando la impresión de estar situados en el espesor de la grasa perivascular y sin poder descartar su curso extravascular. Se realizó extracción completa del dispositivo y reimplante contralateral. Se implantó un electrodo epicárdico de ventrículo izquierdo a través de una pequeña toracotomía izquierda y un electrodo de desfibrilación endocavitario en ventrículo derecho, a través de subclavia derecha. Luego, mediante la utilización de vainas de extracción con láser excimer se consiguió la extracción completa de los electrodos previos. Finalmente, se tuneliza el electrodo de ventrículo izquierdo a la región subclavicular derecha y se conectan los electrodos al generador.
An 80-year-old male patient with the first DDD Medtronic Kappa pacemaker implantation in 2000, with generator replacement in 2008 and 2014. In 2020, a device upgrade to CRT-ICD is indicated. He was admitted in September 2021 due to device infection, with a positive culture for Staphyloccocus aureus and negative blood cultures. In the region of the generator pocket, he presented a granulomatous lesion with hematic exudate. The transthoracic echocardiogram shows one ventricular electrode totally adhered to the septal leaflet of the tricuspid valve and the other in the right ventricle that interferes with the movement of the anterior leaflet, leading to severe tricuspid insufficiency. Complete removal of the device and contralateral reimplantation of a new ICD-CRT system is indicated. For the procedure, a computed tomography was performed. Where the path of the oldest leads supported completely on the posterior and lateral face of the innominate and vena cava are observed, giving the impression of being located in the thickness of the perivascular fat and without being able to rule out their extravascular course. Complete removal of the device and contralateral reimplantation were performed. A left ventricular epicardial electrode was implanted through a small left thoracotomy and an endocavitary defibrillation electrode in the right ventricle, through the right subclavian artery. Then, by using excimer laser extraction sheaths, complete extraction of the previous leads was achieved. Finally, the left ventricular lead is tunneled to the right subclavicular region and the leads are connected to the generator.
Paciente varón de 80 años con antecedentes de tabaquismo e hipertensión arterial como factores de riesgo cardiovascular. Diagnóstico de miocardiopatía dilatada de etiología no isquémica con FEVI severamente disminuida. Presenta además fibrilación auricular permanente e insuficiencia tricuspídea severa. Primer implante de marcapasos DDD Medtronic Kappa en el año 2000 por bloqueo auriculoventricular de segundo grado. Recambio de generador en el 2008 y en el 2014. En revisiones posteriores se objetivó la presencia de rachas de taquicardia ventricular monomórfica sostenidas, por lo que, en el año 2020 se indicó la actualización del dispositivo a DAI-TRC. Se procedió a implante de 2 nuevos electrodos, uno de desfibrilación en ventrículo derecho y otro de estimulación de ventrículo izquierdo, abandonando el electrodo ventricular derecho previo.
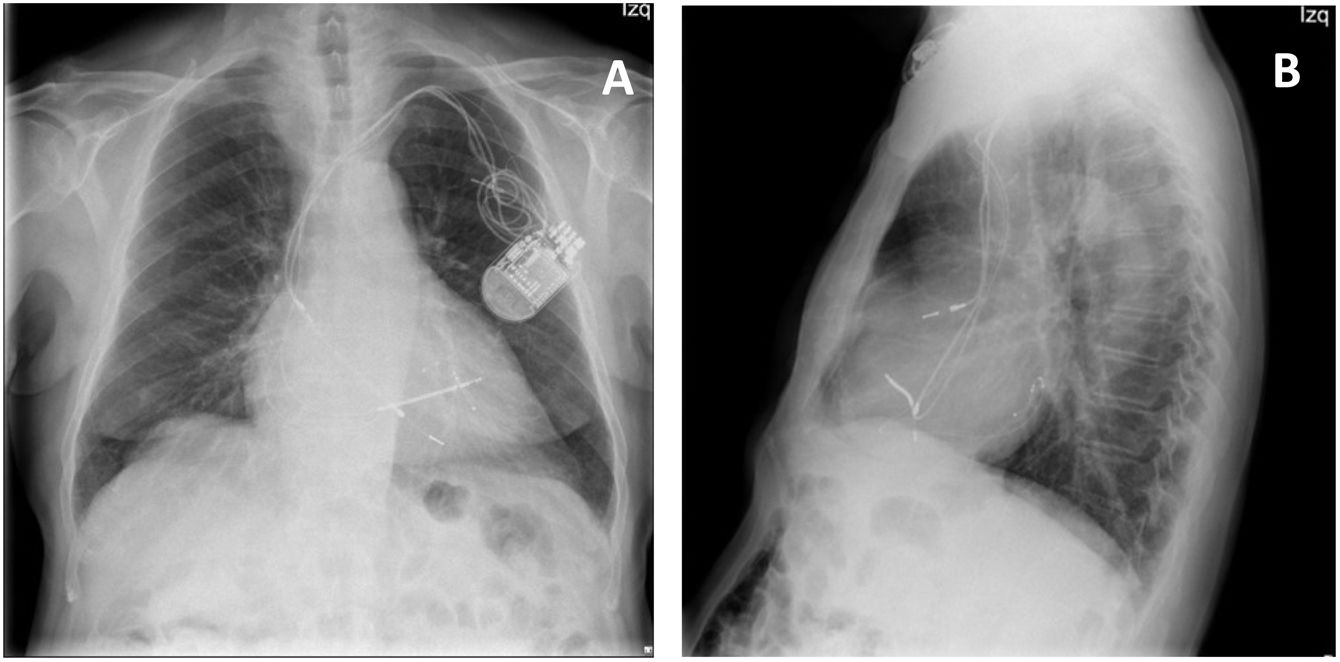
Ingresa en septiembre del 2021 por infección del dispositivo, con supuración, signos de infección local y cultivo de la herida positivo para Staphyloccocus aureus, sin presencia de infección sistémica. Hemocultivos negativos. En la región del bolsillo del generador del DAI-TRC, presenta una lesión granulomatosa de 0,5cm en tercio medio con exudado hemático. En la radiografía de tórax (fig. 1A y 1B) se visualizan los electrodos posicionados correctamente en las cavidades correspondientes. En el ecocardiograma transtorácico se observa uno de los electrodos ventriculares totalmente adherido al velo septal de la válvula tricúspide y el otro electrodo ventricular derecho que interfiere con el movimiento del velo anterior. Además, se detecta un defecto de coaptación central importante que condiciona una insuficiencia tricúspide severa.
Con este cuadro clínico se indica la extracción completa del dispositivo y reimplante contralateral de un nuevo sistema de DAI-TRC.
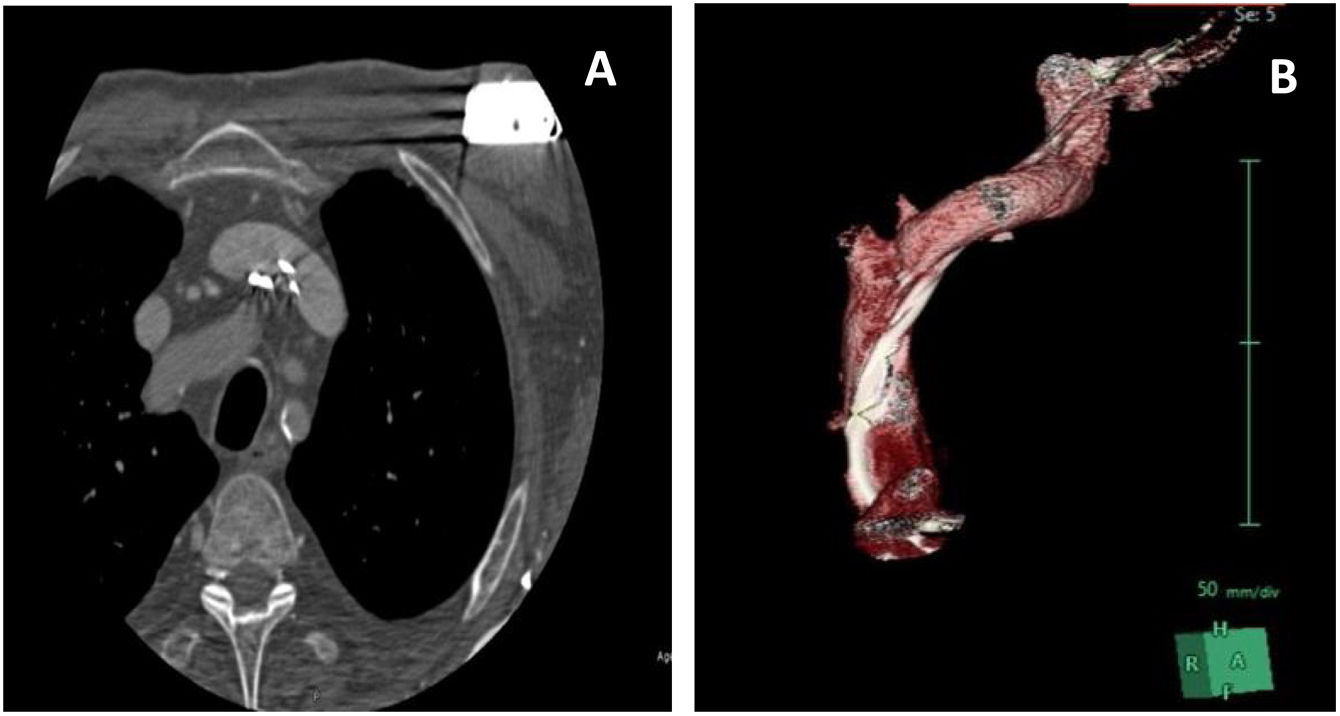
Con vistas a la planificación del procedimiento de extracción se realizó una tomografía axial computarizada (TAC) con reconstrucción 3D del trayecto de los electrodos. En las imágenes de la TAC se observa que el trayecto de los electrodos implantados más recientemente está centrado en el interior de la vena innominada y cava superior. Sin embargo, el recorrido de los electrodos más antiguos es diferente, estando apoyados completamente en la cara posterior y lateral de la innominada y cava, dando la impresión de estar situados en el espesor de la grasa perivascular y sin poder descartar su curso extravascular (fig. 2).
Dada la antigüedad de los electrodos y los hallazgos de la TAC, se consideró el procedimiento de extracción como de alto riesgo y se programó en el quirófano, con anestesia general, monitorización invasiva, máquina de circulación extracorpórea preparada y cebada y con posicionamiento profiláctico de un balón de oclusión temporal de vena cava (Bridge, Philips).
Se realizó extracción completa del dispositivo y reimplante contralateral en el mismo acto.
Tras la inducción anestésica se implantó un electrodo epicárdico de ventrículo izquierdo a través de una pequeña toracotomía izquierda. A continuación, se implantó un electrodo de desfibrilación endocavitario en ventrículo derecho, a través de subclavia derecha. Posteriormente mediante la utilización de vainas de extracción con láser excimer de 14Fr se consiguió la extracción completa de todos los electrodos previos sin complicaciones de ningún tipo. Finalmente, se tuneliza el electrodo de ventrículo izquierdo a la región subclavicular derecha y se conectan los electrodos al generador. Su evolución posterior en planta fue satisfactoria y fue dado de alta sin incidencias una vez completada la pauta de tratamiento antibiótico intravenoso de 14 días.
DiscusiónLa dificultad técnica en los procedimientos de extracción viene derivada de la formación de adherencias fibrosas entre los electrodos implantados y el endotelio que recubre el sistema venoso y las cavidades cardiacas. Estas adherencias son más abundantes y firmes conforme aumenta el tiempo desde el implante y pueden aparecer tanto en la porción extravascular del electrodo a nivel del bolsillo del generador, como en su porción intravascular e intracardiaca en la aurícula y ventrículo derechos, la válvula tricúspide y el sistema venoso epicárdico del ventrículo izquierdo en el caso de los dispositivos de resincronización1.
Desde el punto de vista anatomopatológico, el proceso comienza con la formación de una película de tejido trombótico a lo largo del electrodo poco después de su implante. A los 4-5 días desde su implante, la fibrosis del tejido resulta en la práctica total encapsulación del electrodo en tejido fibrótico. A medida que aumenta el tiempo desde el implante, se irán desarrollando adherencias más o menos firmes con las estructuras adyacentes. Con el paso del tiempo y especialmente en pacientes jóvenes, puede presentarse una progresiva calcificación del tejido fibrótico.
En los procedimientos de extracción, las lesiones que se pueden llegar a producir durante la liberación percutánea de estas adherencias suponen una grave complicación que puede comprometer la vida del paciente. Por este motivo, el poder disponer de información preoperatoria sobre la cantidad, localización y la «calidad» de estas adherencias puede ser de gran utilidad para la planificación del procedimiento2.
En este sentido, la TAC preoperatoria puede ayudar tanto para la identificación de zonas de adherencias y fibrosis a lo largo del trayecto del electrodo como para estudiar el recorrido de los distintos electrodos y descartar la presencia de otros factores como perforaciones y trayectos anómalos y/o extravasculares que podrían complicar el procedimiento de extracción3. En este sentido, la confirmación de un trayecto extravascular del electrodo posiblemente obligue a replantear el procedimiento y planificar la extracción mediante esternotomía y circulación extracorpórea4.
En el caso que presentamos, a pesar de que las imágenes obtenidas con la TAC preoperatoria podrían mostrar un trayecto extravascular de los electrodos, no se cambió la indicación de extracción percutánea de los mismos, ya que dichas imágenes se interpretaron como un trayecto intramural, en el espesor de la pared de la vena innominada y cava, más que como un verdadero trayecto extravascular.
Hay que tener en cuenta que los electrodos implantados actúan como un cuerpo extraño intravascular y el organismo, lentamente, tratará de ir excluyéndolos de la circulación. De esta manera, en electrodos con mucho tiempo de implante, es plausible que la endotelización del tejido fibroso que los recubre haga que, lentamente, los electrodos vayan quedando englobados en la pared venosa. Si el proceso continúa, es posible que el electrodo quede localizado en la parte más externa de la pared vascular, recubierto en lugar de por una capa endotelial, por la propia adventicia de la vena.
ConclusiónLa TAC puede ser de gran utilidad para la planificación de los procedimientos de extracción, especialmente cuando se prevén complejos. La fibrosis que recubre a los electrodos que llevan mucho tiempo implantados puede ir englobando al electrodo en el espesor de la pared venosa, reflejándose en las imágenes de la TAC como falsos trayectos extravasculares.
Responsabilidades éticasEs un caso clínico descriptivo, no se consideró necesario la aprobación por el Comité Ético.
Al ser un caso clínico retrospectivo y descriptivo, no se obtuvo un consentimiento informado específico para la publicación. Sin embargo, todos los pacientes firman un consentimiento informado general antes de realizar la cirugía, en donde se especifica que sus datos pueden ser utilizados con fines científicos y/o investigación.
FinanciaciónLos autores declaran que no han recibido financiación de investigación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.