Las enfermedades cardiovasculares (ECV) siguen siendo la primera causa de muerte a nivel mundial (incluyendo Cuba); dentro de estas entidades, la cardiopatía isquémica (CI) es la más frecuente. La cirugía de revascularización miocárdica (CRM) es un método establecido para su tratamiento, específicamente en la enfermedad coronaria multivaso, por ello, disponer de una herramienta de evaluación de la calidad de los injertos como la flujometría con doppler pulsado (FDP) es un complemento que puede ser de gran utilidad y que además se encuentra accesible en nuestro país. Para exponer la eficacia de la FDP en la CRM, se realizó una revisión bibliográfica no sistemática de la literatura disponible, en relación con la medición de los flujos coronarios en los injertos con esta herramienta. Se efectuó un rastreo desde el primero de marzo hasta el 30 de abril de 2023 en el motor de búsqueda de libre acceso PubMed. La efectividad de la flujometría fue demostrada por varios autores en los momentos en que fue creada y, aunque actualmente esté en desuso por otros métodos más efectivos, su aplicabilidad, en ausencia de otros recursos, ha contribuido a la identificación y corrección de errores técnicos en la ejecución quirúrgica.
Cardiovascular diseases are the first cause of death worldwide and in Cuba, ischemic heart disease is the most frequent, myocardial revascularization surgery is an established method for its treatment, specifically in coronary multivessel disease. Having a graft quality assessment tool such as Pulsed Doppler Flowmetry is a complement that can be very useful and is also available in our country. To expose the usefulness of the use of pulsed Doppler flowmetry in myocardial revascularization surgery. A non-systematic bibliographic review of the available literature was carried out, in relation to the measurement of coronary flows in the grafts during. A search was carried out from March 1 to April 30, 2023 in the free access search PubMed. The effectiveness of flowmetry was demonstrated by several authors at the time it was created and, although it is currently out of use due to other more effective methods, its applicability in the absence of other tools has contributed to the identification and correction of technical errors in the surgical practice.
Las enfermedades cardiovasculares (ECV) constituyen la primera causa de muerte a nivel mundial1,2, representan aproximadamente 31% de toda la mortalidad; dentro de estas entidades, la cardiopatía isquémica (CI) en el 2019 afectaba a alrededor de 126 millones de personas, lo que equivalía a 1,72% de la población global, ocasionando cada año un estimado de nueve millones de decesos, 16,17% de todas las causas3,4. En Cuba, desde hace varios años, la causa principal de muerte son las ECV, en 2021 hubo 43.052 defunciones y la CI fue la responsable de más de la mitad de los casos (25.849)5.
La cirugía de revascularización miocárdica (CRM) es un método establecido para el tratamiento de la enfermedad de las arterias coronarias, tiene una indicación robusta sobre todo en pacientes con lesiones múltiples complejas, fracción de eyección del ventrículo izquierdo disminuida y con diabetes6–11. En este grupo de sujetos, dicho procedimiento ha demostrado mejorar los síntomas, prevenir eventos clínicos y aumentar la supervivencia a largo plazo por encima del intervencionismo coronario.
A pesar de la eficacia demostrada de la CRM el «talón de Aquiles» sigue siendo la permeabilidad del injerto; que, a largo plazo, está determinada por el tipo de conducto empleado, la progresión de la enfermedad en el injerto y el vaso nativo; mientras que, a corto plazo, se ve afectada por problemas técnicos intraoperatorios12.
Se estima que entre 3 y 5% de los injertos de arteria mamaria izquierda (AMI) y 20% de los de vena safena (VS) fallan al cabo de un año, a menudo, esto se atribuye a problemas técnicos13. El ensayo clínico Project of Ex-vivo Vein Graft Engineering via Transfection (PREVENT IV) informó una tasa de fracaso del injerto venoso de 25% y de AMI de 8% en un año, la mayoría sin un evento cardiaco adverso importante14. Fukui et al.15 reportaron un fallo de VS de 5,5% al alta médica y de 17,4% al año, de igual manera ocurrió en la AMI de 1,3 y 3,2%, respectivamente. Biancari et al.16, en un metaanálisis de nueve estudios de 1.104 pacientes con infarto de miocardio perioperatorio, observaron una mortalidad temprana de 12,6%, el fracaso del injerto estuvo presente en 62% de ellos.
Si bien, la causa del fallo tardío del injerto se atribuye a la hiperplasia de la íntima y la aterosclerosis, se cree que dentro del primer año está relacionada, en parte, con un error técnico que podría corregirse en el momento de la operación. El riesgo de oclusión del injerto durante la ejecución de la anastomosis se amplifica en casos técnicamente exigentes como la CRM sin bomba17.
Tiene sentido intuitivo que si pudiera existir una técnica para evaluar la permeabilidad de una anastomosis entre dos vasos de 1 a 2mm de diámetro, no solo debería ser el estándar de atención sino también obligatorio12.
Existen varias herramientas para la evaluación intraoperatoria del injerto: la angiografía coronaria (AC), la medición del flujo en tiempo de tránsito (TTFM), la ultrasonografía epicárdica (UTE) de alta resolución y las imágenes de fluorescencia intraoperatoria (IFI). La AC es el mejor y más confiable método para evaluar el flujo, sin embargo, la infraestructura requerida para su realización rara vez está disponible en los quirófanos, de igual manera, su alto coste y la nefrotoxicidad del contraste la hacen inviable18.
Las guías europeas de revascularización miocárdica del 2018 recomiendan (IIa/B) la medición del flujo a través del injerto para confirmar o descartar cualquier problema técnico del implante. El TTFM es la técnica más empleada actualmente para la evaluación del injerto y ha permitido detectar 2-4% de aquellos que requieren revisión6.
Los primeros dispositivos de medición de flujo se basaron en tecnología electromagnética y pronto fueron abandonados por sus numerosas limitaciones. Gracias a las mejoras tecnológicas, aquellos basados en ultrasonido (principalmente doppler) estuvieron disponibles en el mercado a principios de los años 8019, en ese momento, apareció la flujometría con doppler pulsado (FDP) cuya eficacia se ve modificada por la forma y el diámetro del vaso, así como el ángulo doppler. La capacidad de esta herramienta y su desempeño, a pesar de sus limitaciones, es demostrada por varios autores20–23.
El Servicio de Cirugía Cardiovascular del Hospital Clínico Quirúrgico «Hermanos Ameijeiras» cuenta con un sistema doppler pulsado bidireccional de flujo sanguíneo, el cual ha sido desarrollado en colaboración con el Departamento de Ingeniería en Sistemas Computacionales (DISCA), del Instituto de Investigaciones en Matemáticas Aplicadas y Sistemas (IIMAS) de la Universidad Nacional Autónoma de México (UNAM). En más de 15 años se han llevado a cabo mejoras al desarrollo del dispositivo; todo esto, con el fin de obtener mayor certidumbre en el cálculo de los parámetros asociados al flujo sanguíneo y que pueda ser una herramienta útil en la toma de decisiones de los cirujanos cardiovasculares.
El objetivo de este trabajo consiste en exponer la utilidad de la FDP como método de control de calidad de la CRM.
MétodosSe realizó una revisión bibliográfica no sistemática de la literatura disponible, en relación con la medición de los flujos coronarios en los injertos durante la CRM con la FDP. Se efectuó un rastreo desde el primero de marzo hasta el 30 de abril de 2023 en el motor de libre acceso PubMed, mediante la opción de búsqueda avanzada.
Al buscar en PubMed, se utilizaron los términos Medical Subject Headings (MeSH): myocardial revascularization; ultrasonography, doppler, pulsed y coronary artery bypass.
Las combinaciones que se usaron empleando operadores booleanos fueron: (myocardial revascularization [MeSH Terms]) AND (Ultrasonography, Doppler, Pulsed [MeSH Terms]) y (Coronary Artery Bypass [MeSH Terms]) AND (Ultrasonography, Doppler, Pulsed [MeSH Terms]). En todos los términos MeSH se eligió la opción de restringir al título y al resumen como función principal de búsqueda, ambos términos inclusivos. Se seleccionaron como criterios: los artículos publicados en inglés, que tuvieran el texto completo disponible, en humanos y sin restricción de fecha, puesto que la tecnología de la FDP alcanza su auge en la década de los 80. La identificación, manipulación y control de las referencias bibliográficas y de los archivos se realizaron con Zotero Versión 6.0.18 (Center for History and New Media, Universidad George Mason, Fairfax, EE. UU.).
Selección de los estudiosSe hallaron 114 artículos, de ellos, solo nueve eran originales con resultados del empleo de la FDP en pacientes operados de CRM de interés para la investigación, de igual manera, se obtuvieron seis trabajos de revisión por citaciones relacionadas de los documentos seleccionados. Los textos donde se constatan los resultados de la aplicación de la FDP son relevantes para el análisis de esta investigación, a pesar de su antigüedad, son pocos los que exponen hallazgos directos, por esta razón fueron incluidos.
AntecedentesLa necesidad de que el cirujano verifique su trabajo durante la cirugía coronaria comenzó hace más de 40 años. En septiembre de 1972, Grondin et al. publicaron uno de los estudios más leídos y citados sobre el destino de la VS autóloga en la cirugía coronaria. Este trabajo demostró por primera vez la correlación entre la medición del flujo del injerto intraoperatorio y la permeabilidad del bypass en un seguimiento tardío; de 94,4% de los injertos que se encontraron ocluidos en la angiografía después de un año, el flujo medio (Qmed) medido en el transoperatorio fue inferior a 48mL/min24.
Los primeros dispositivos de medición de flujo se basaron en tecnología electromagnética y pronto fueron abandonados por sus muchas limitaciones, entre las que destacan la influencia por el movimiento, el hematocrito del paciente y que el volumen del flujo solo puede obtenerse si se conoce el diámetro del vaso estudiado, por lo cual la sonda debe calibrarse de forma cuidadosa13,19.
A principios de los años 80, aparece entonces la FDP; aunque esta ofrecía muchas ventajas en comparación con la de tecnología electromagnética, todavía tenía algunas limitaciones: el haz de inclinación del transductor en el momento de la medición y el conocimiento previo del diámetro del hemoducto; no obstante, su desempeño era mejor25.
A finales de los 90, con la introducción y popularización de la cirugía coronaria sin bomba, se estimuló el interés a documentar intraoperatoriamente la permeabilidad de los injertos coronarios. Al mismo tiempo, un nuevo logro tecnológico estaba disponible con la introducción de TTFM que ofrecía un método simple para probar el flujo de injerto coronario, con este se alcanzaba madurez en la medición de flujos, se corregían los defectos en los anteriores dispositivos y se volvía más fiable el resultado12,19,26, más recientemente la UTE de alta resolución como complemento ha permitido discriminar mejor en la calidad del resultado27.
¿Fue la FDP abandonada por calidad insuficiente en sus resultados o por la aparición de un método más preciso?
Varios artículos originales demuestran la aplicación de este método; Tavilla et al.28, observaron que, con la FDP, el volumen de flujo de la arteria gastroepiploica después de la anastomosis con la coronaria tiene una correlación significativa con el diámetro de la arteria coronaria objetivo (p=0,0011). Después de la operación, dos pacientes desarrollaron isquemia. En ambos, el flujo fue inferior a 25mL/min en comparación con uno promedio de 55,78mL/min.
En 1993, Louagie et al.22 evidenciaron que la evolución clínica posoperatoria temprana no satisfactoria no tuvo relación con las mediciones de los flujos coronarios; de 988 injertos medidos en 352 pacientes, en el grupo de peor evolución, el promedio del Qmed fue de 43±6mL/min, considerado normal; las variables que condicionaron significativamente la mala evolución fueron: cirugía de emergencia (p<0,001), tiempo de clampeo aórtico (p<0,001), de circulación extracorpórea (p<0,001) y apoyo con esta última (p<0,0001). Un año más tarde, los mismo autores21 publicaron otro artículo donde además de realizar 909 mediciones en los injertos, validaron primero la calidad del dispositivo de FDP, se efectuaron mediciones con doppler en la AMI de forma simultánea con la recolección de sangre en volumen cronometrado cuando el injerto AMI distal estaba abierto, lo que representó el valor absoluto. Hubo una correlación satisfactoria entre ambas medidas (r=0,86; p<0,0001, n=32) con una ligera sobreestimación del flujo con la ecografía doppler. Determinaron que en siete pacientes (2%) hubo necesidad de revisar los injertos, y después el flujo aumentó de 9±4mL/min a 69±13mL/min.
En el estudio monocéntrico de Louagie et al.23 en 1999, de un total de 1.512 anastomosis, el uso de la FDP identificó que eran necesarias las correcciones en los injertos de 5,9% de las arterias gastroepiploicas (5/85); 3,4% de AMI (15/442); 2,0% de arterias mamarias derechas (3/149) y 0,7% de VS (6/831); aunque estos datos no sean trascendentes, lo que si llama la atención es que el flujo medido en los injertos defectuosos promedió 8±2mL/min y después de la corrección o en un nuevo injerto implantado alcanzó 54±5 mL/min (p<0,0001) siendo significativo su resultado.
En la década de los 90, se introdujo el TTFM con mejoras en cuanto a limitaciones de la FDP, eliminó la dependencia del diámetro y la angulación del haz. Con el objetivo de comparar ambas técnicas, Matre et al.20 demostraron que el TTFM tiene una excelente concordancia con el método doppler tanto para estudios in vitro como in vivo, en este último se realizó la medición en nueve pacientes, 17 anastomosis y 34 mediciones. La independencia del diámetro del TTFM fue una ventaja, ya que muestra que el método de tiempo de tránsito tiene un error medio aún menor que el doppler en comparación con el flujo verdadero (4,4mL vs. 7,3mL). Esto significa que el sesgo constante para sobrestimar fue menor para el método de tránsito. Los dos procedimientos probados en el equipo pulsátil in vitro tienen una precisión similar.
No cabe duda de que, después de la aparición de TTFM (que cuando se combina con ultrasonido epicárdico brinda al cirujano la seguridad de la funcionalidad del injerto)26, dejó de implementarse la FDP, pero, donde no exista alguna herramienta que permita evaluar a los injertos coronarios, esta constituye una alternativa no despreciable que aportaría en aras de mejorar la calidad de la cirugía coronaria
De la evidencia a la prácticaAunque la mayoría de los cirujanos cardiacos realizan intervención coronaria en estructuras milimétricas, no emplean frecuentemente algún tipo de método de control de calidad directo para probar la permeabilidad de las anastomosis construidas19,26,29.
La simple evaluación del desempeño hemodinámico perioperatorio inmediato se considera un marcador aceptable del éxito quirúrgico. Los parámetros electrocardiográficos y hemodinámicos pueden permanecer sin cambios en el posoperatorio, incluso con uno o dos injertos coronarios defectuosos27.
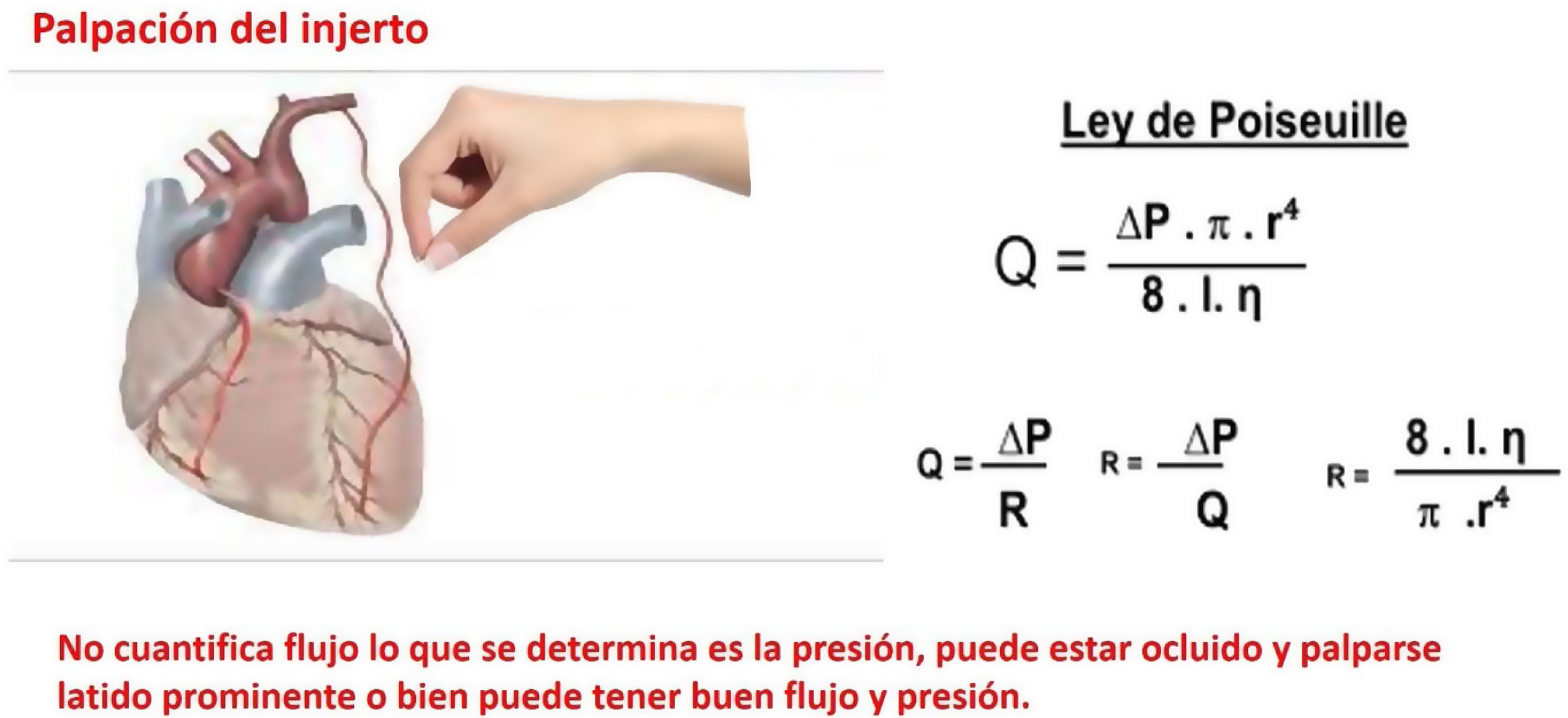
Una forma habitual de comprobar la permeabilidad de un injerto libre es la instilación de sangre heparinizada con jeringas (casi siempre venoso) en el extremo proximal del injerto coronario, esta maniobra solo nos aporta cualitativamente si una anastomosis es permeable o no, según la presión ejercida por el émbolo, pero no permite cuantificar el flujo. La palpación de los injertos (fig. 1) para determinar su funcionalidad, una vez anastomosados, contradice en algunos escenarios la ley física de Hagen–Poiseuille30, que demuestra que el flujo (Q) en el interior de un conducto, es directamente proporcional al gradiente de presión (ΔP) entre los extremos de este, e inversamente proporcional a la resistencia (R), a medida que aumenta esta última lo hace directamente la presión, disminuyendo en igual razón proporcional el flujo a su través; por lo tanto, palpar un hemoducto anastomosado que tenga un latido prominente solo significa que tiene una presión alta y no necesariamente un flujo incrementado, existe la posibilidad de que exista estenosis significativa y aún se palpe un latido prominente debido al exceso de presión; no obstante, lo más frecuente es que presión y flujos estén elevados.
Cualquier herramienta práctica, disponible, comprobada, que no retarde ni interfiera con el tiempo quirúrgico resulta de gran utilidad en el control de la calidad en la cirugía coronaria.
Actualidad y experienciaActualmente, como se mencionó previamente, el Servicio de Cirugía Cardiovascular del Hospital Clínico Quirúrgico «Hermanos Ameijeiras» cuenta con un sistema doppler pulsado bidireccional de flujo sanguíneo, el cual ha sido desarrollado por el DISCA, del IIMAS de la UNAM en colaboración con el Instituto de Cibernética, Matemática y Física (ICIMAF) de nuestro país. Este sistema emplea el efecto Doppler – Fizeau, basado en el principio del cambio de la frecuencia en relación con la posición del transductor, analizando la velocidad de los hematíes, el doppler pulsado facilita una evaluación satisfactoria del flujo, pero se ve artefactado por el ángulo de las ondas ecográficas, los diámetros y forma del vaso13,31.
Este sistema capta las señales de flujo sanguíneo por medio de un detector doppler ultrasónico a 8MHz, utilizando un módulo para obtener los datos, que se comunica con una computadora por medio de un puerto Universal Serial Bus (USB). Se calibra con un phantom emulador de flujo sanguíneo, integrado por una bomba dosificadora con una capacidad de proporcionar hasta 200mL/min de un fluido mimetizador de sangre; un transductor ultrasónico a 8MHz, esterilizable y un aditamento para fijar el ángulo de incidencia del transductor a 60°32, este último permite corregir una de las limitaciones de la FDP al estandarizar el ángulo del haz doppler.
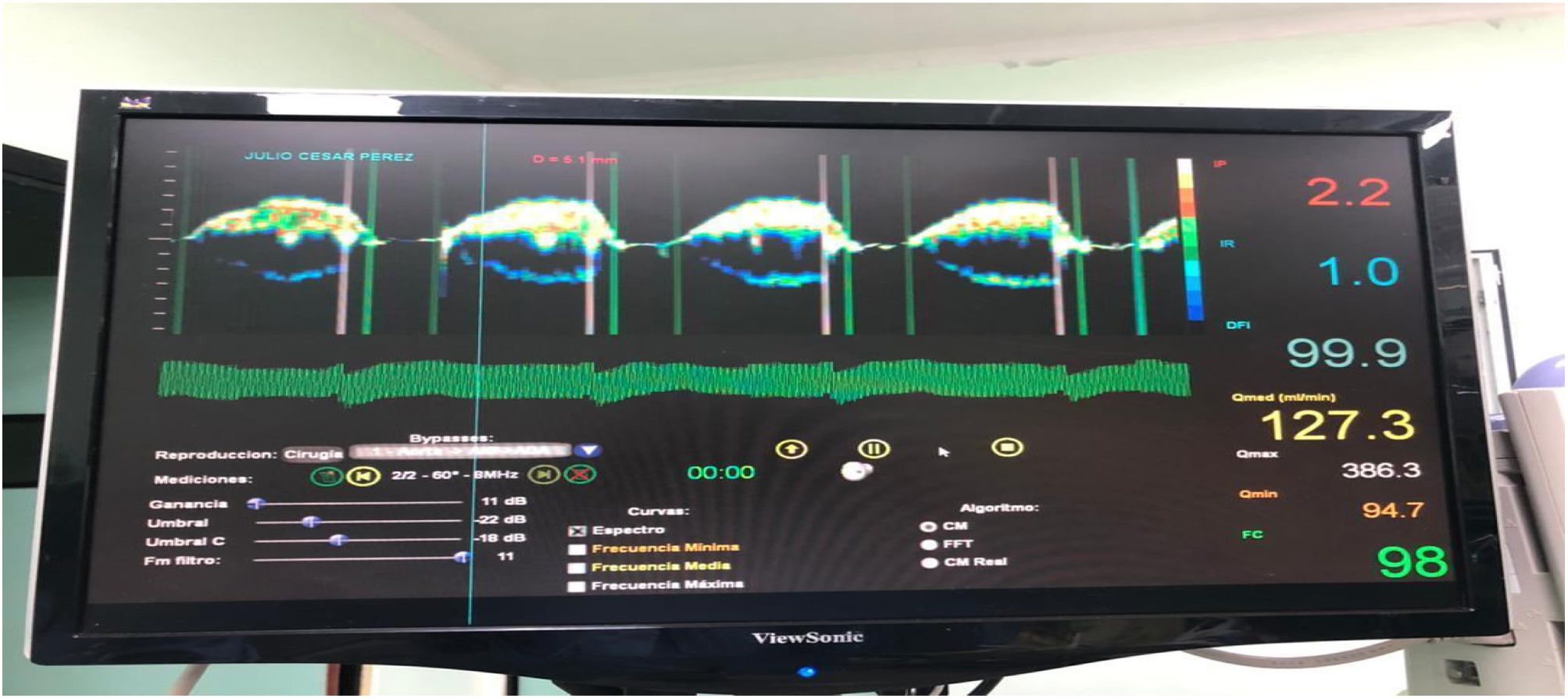
En más de 15 años de colaboración con nuestro hospital, se han llevado a cabo mejoras al dispositivo, se han generado innovaciones al desarrollo tecnológico del sistema doppler, hasta llegar a la versión del sistema doppler FLUXVISUM (UNAM, IIMAS, México), con el objetivo de obtener mayor certidumbre en el cálculo de los parámetros asociados al flujo sanguíneo y pueda ser una herramienta útil en la toma de decisiones de nuestros cirujanos cardiovasculares. El dispositivo cuenta con un espectrograma que está sincronizado con el electrocardiograma del paciente, realiza cálculos y despliega los valores de los siguientes parámetros asociados al flujo sanguíneo: índice de pulsatilidad (IP), índice de resistividad (IR), porcentaje de llenado diastólico (DFI), flujo medio (Qmed), flujo máximo (Qmáx), flujo mínimo (Qmin), frecuencia cardiaca (FC) y las curvas de frecuencias media, máxima y mínima (fig. 2).
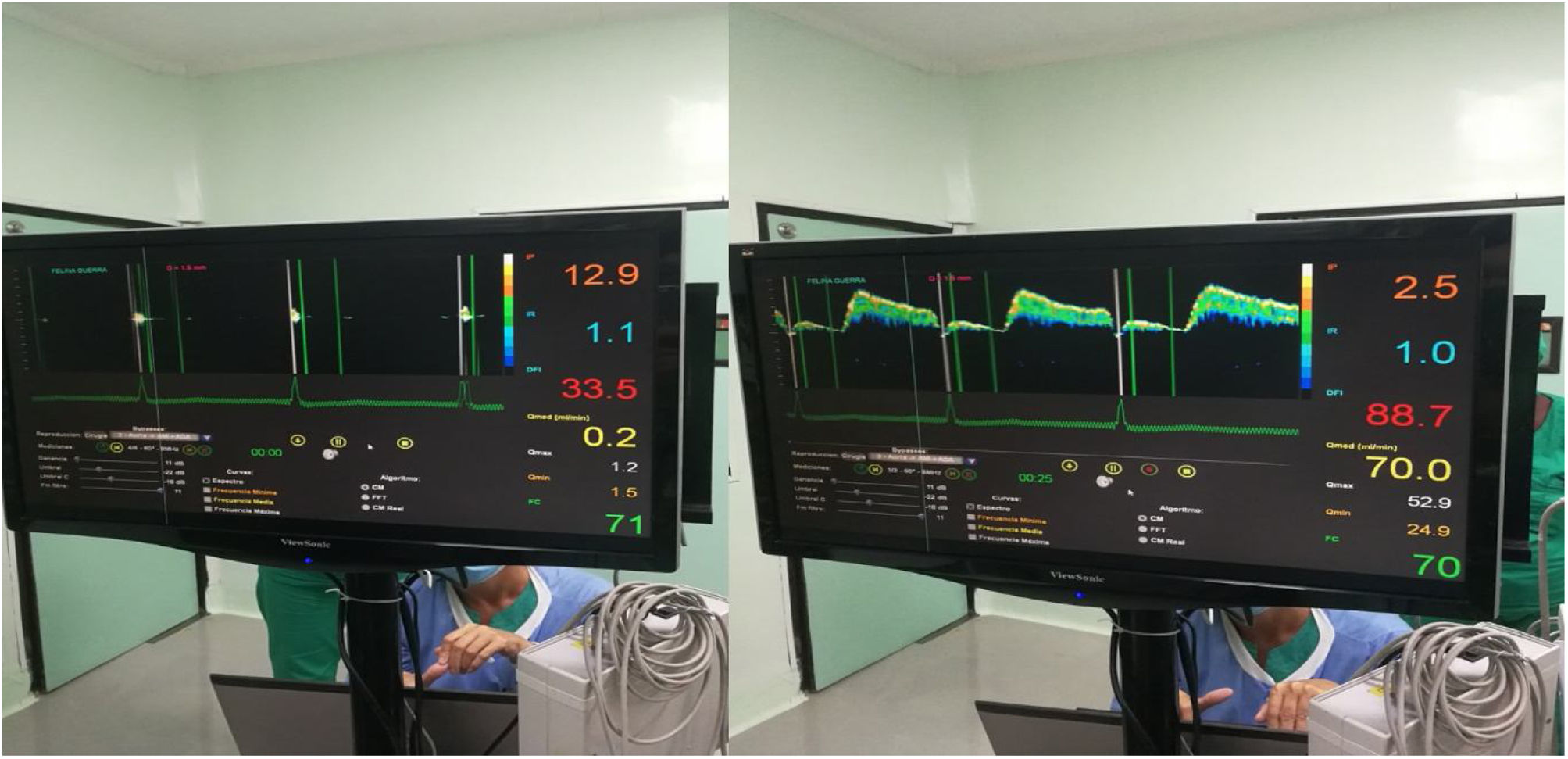
El dispositivo se ha utilizado desde marzo de 2012 a la fecha, durante este periodo se realizaron actualizaciones para mejorar su desempeño, específicamente en 2019, se introdujo un medidor para determinar el diámetro del injerto a cuantificar su flujo (otra limitación conocida), haciendo más precisas las mediciones al introducir los datos en el software destinado a calcular las variables antes descritas. Si bien, es cierto que un correcto desempeño hemodinámico y la ausencia de cambios eléctricos en el transoperatorio, una vez concluidas las anastomosis, es un indicador aceptable de la calidad de la CRM, es destacable mencionar que cuando no sucede así la valoración de los flujos ayuda a discriminar cuál de los injertos tiene mala calidad y debe ser revisado, o simplemente encontrar alguna causa probable (acodadura, rotación, compresión externa, hematoma, espasmo o aire) que pueda resolverse sin mayor complejidad (fig. 3).
Contar con la FDP durante tantos años ha sido de gran valor, pues se trata de una herramienta mejorada en cuanto a limitaciones, fácil de emplear, inocua, que requiere un mínimo de tiempo de ejecución, sin costo alguno y ha permitido mejorar el resultado oportunamente; de igual forma, el registro documentado de su funcionamiento en cada caso nos permite correlacionar la aparición de complicaciones posoperatorias, sobre todo las derivadas de isquemia miocárdica, con los valores de flujos obtenidos en cada injerto.
ConclusionesLa FDP es un complemento que puede ser de gran utilidad en la CRM, sobre todo con las mejoras añadidas, a pesar de no ser la más difundida o recomendada. Generalizar su aplicación en nuestro país, en ausencia de otra tecnología, pudiera resultar atractivo, ya que está disponible, es fácil de usar y está libre de costos.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses.