La enfermedad valvular cardíaca mitral en recién nacidos tiene una alta prevalencia a nivel mundial. El tratamiento convencional son los reemplazos valvulares, ya sean implantes mecánicos o bioprótesis. El objetivo de esta revisión es identificar los parámetros de diseño de un implante valvular mitral pediátrico a partir de los tratamientos de ingeniería de tejidos aplicados a cardiopatías congénitas de la válvula mitral en los artículos publicados entre los años 2010 y 2021. Se realizó una revisión de la literatura del tratamiento de cardiopatías congénitas de la válvula mitral con ingeniería de tejidos a través de una búsqueda estructurada en bases de datos (PubMed, Elsevier, Scielo, Chrocaine, LILACS y Scopus) entre 2011 y 2021. Fueron revisados 92 artículos que cumplieron los criterios de inclusión. La ingeniería de tejidos valvular ha desarrollado constructos mitrales con biomateriales de origen sintético, natural o híbrido en soportes o hidrogeles empleados en bioimpresoras 3D en las cuales se pueden emplear células endoteliales valvulares o células intersticiales valvulares diferenciadas o no desde células madre mesenquimales o células madre inducidas con factores de crecimiento específicos. Los requerimientos funcionales identificados para el desarrollo de un nuevo implante valvular mitral fueron: a) durabilidad, b) características mecánicas, c) imitar el tejido nativo valvular mitral, d) antitrombogenicidad, e) seguridad, f) biodegradabilidad controlada, g) abordaje trascatéter, h) biocompatibilidad, i) adaptación precisa, anatómica y personalizada y j) crecimiento sincrónico de la válvula con el niño.
Mitral heart valve pathology in newborns has high prevalence worldwide. Conventional treatment is valve replacements, mechanical implants or bioprostheses. The aim of this review is to identify the design parameters of a pediatric mitral valve implant based on tissue engineering treatments applied to congenital heart disease of the mitral valve in articles published between 2010 and 2021. A literature review on the treatment of mitral valve congenital heart disease with tissue engineering was carried out through a structured search in databases (Pubmed, Elsevier, Scielo, Chrocaine, LILACS and Scopus) between 2011 and 2021. Were reviewed 92 articles according to inclusion criteria. Valve tissue engineering has developed mitral constructs with biomaterials of synthetic, natural or hybrid origin on supports or hydrogels used in 3D bioprinters in which valve endothelial cells or valve interstitial cells differentiated or not from mesenchymal stem cells or induced stem cells can be used with specific growth factors. Functional requirements identified for the development of a new mitral valve implant were: a) durability, b) mechanical characteristics, c) mimic native mitral valve tissue, d) antithrombogenicity, e) safety, f) controlled biodegradability, g) transcatheter approach, h) biocompatibility, i) precise, anatomical and personalized adaptation, j) synchronous growth of the valve with the child.
Las cardiopatías congénitas son enfermedades que se pueden presentar hasta en el 2% de los recién nacidos, con una mortalidad del 12%, ya sea por anomalías cromosómicas (12%), malformaciones graves (30%) o por factores ambientales (2%)1. La enfermedad valvular tiene una alta prevalencia en los recién nacidos y se han desarrollado diferentes opciones terapéuticas con el objetivo de desarrollar válvulas capaces de imitar el tejido valvular nativo con características como durabilidad, resistencia, capacidad de adherencia, flexibilidad, capacidad de cierre, que, además, soporten las presiones transvalvulares y resistan la trombogénesis2. Tradicionalmente las válvulas mecánicas han sido empleadas como implantes, pero son propensas a aumentar la tasa de eventos tromboembólicos, por lo que se requiere que el paciente tenga tratamiento anticoagulante durante toda su vida. Otra alternativa han sido las bioprótesis, las cuales son efectivas, pero con un riesgo mayor de rechazo inmunológico y de infección3; además, tienen tendencia a la calcificación y su uso en la población pediátrica es controvertido.
Dentro de los desarrollos de la ingeniería de tejidos se han usado matrices descelularizadas de origen alogénico o xenogénico, soportes elaborados con polímeros naturales, sintéticos o híbridos, con características biodegradables4; sin embargo, los polímeros de origen natural (colágeno, gelatina y fibrina) tienen una rápida degradación y una contracción significativa del tejido. Cuando estos polímeros son tratados mediante un proceso de entrecruzamiento con agentes como el glutaraldehído pueden disminuir la respuesta inmunológica y mejorar las características mecánicas5.
Dentro de los recursos celulares utilizados están las células madre pluripotentes inducidas (iPS), las cuales son reprogramadas para su diferenciación en células vasculares o miocárdicas y luego son autotransplantadas, y cuyo uso actualmente es limitado por el riesgo de tumorogénesis, ya que implica en su desarrollo vectores virales6.
La presente revisión busca identificar los parámetros de diseño de un implante valvular mitral pediátrico a partir de los tratamientos de ingeniería de tejidos aplicada a cardiopatías congénitas de la válvula mitral descritos en artículos publicados entre los años 2010 y 2021.
MétodosSe llevó a cabo una revisión de alcance de la literatura revisada por pares relacionada con el tratamiento de cardiopatías congénitas de la válvula mitral con tratamientos de ingeniería de tejidos.
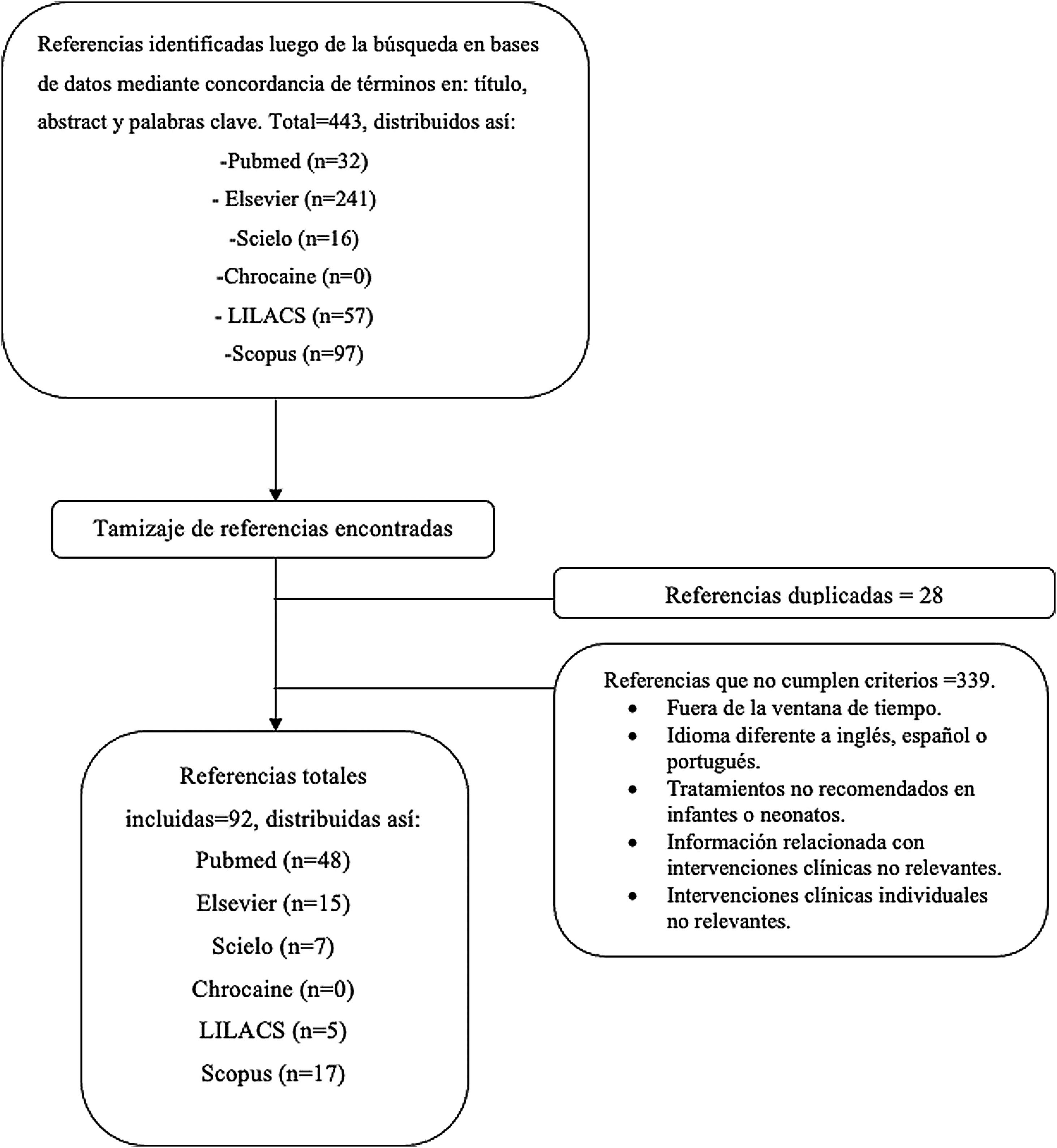
Estrategia de búsqueda y criterios de selecciónLas referencias utilizadas se obtuvieron de una búsqueda estructurada en las bases de datos: PubMed, Elsevier, Scielo, Chrocaine, LILACS y Scopus, centrándose en los títulos de los artículos. Las siguientes palabras clave debían estar presentes en el título, en el resumen o en las palabras clave: mitral valve AND neonates AND implant, mitral valve AND pediatric, mitral valve AND neonates, ALL («mitral valve») AND TITLE-ABS-KEY (*neonates OR child) TITLE-ABS-KEY (*tissue AND engineering). Los artículos debían estar escritos en inglés, español o portugués. Se buscaron artículos, informes o editoriales, publicados entre 2011 y 2021, con el fin de cubrir únicamente los tratamientos más importantes propuestos en los últimos años. La última búsqueda se realizó en abril de 2022. Los métodos de búsqueda y el proceso de selección se resumen en la figura 1.
Se estipulan los criterios de inclusión y exclusión para identificar la literatura relevante que fue considerada dentro de la revisión. Los criterios definidos fueron: población identificada como neonatos y pediátricos <10 años, referencias publicadas en idioma español, inglés y portugués, información relacionada con ingeniería de tejidos y cirugía para el tratamiento de enfermedades congénitas de válvula mitral, información relevante de estudios preclínicos de implantes valvulares: in vitro, en animales y humanos y, por último, se estableció una ventana de tiempo de publicación de 2011 a 2021.
Datos obtenidosPara la extracción de datos, se utilizó una base de datos en Excel para completar la siguiente información sobre los registros revisados: título, año, base de datos, fecha, términos de referencia usados, resumen, URL, revista, autores, métodos y técnicas utilizados, tipo de muestra, objetivos, hipótesis y variables medidas. Después de la búsqueda bibliográfica, todos los documentos se importaron al gestor de referencias Mendeley®.
ResultadosLa válvulva mitral: conceptos básicosLa válvula mitral es una estructura con 2valvas: la anterior y la posterior, compuesta por 3comisuras unidas por un anillo mitral dinámico conectado con múltiples cuerdas tendinosas que llegan hasta el ventrículo izquierdo y los músculos papilares7. La estructura histológica de la sección transversal de las valvas mitrales normales está formada por 3capas de tejido bien definidas: la auricular, la esponjosa y la fibrosa/ventricular, cada una con un grosor diferente. Las células características (células endoteliales valvulares, VEC y células intersticiales valvulares, VIC) se encuentran en estas capas de manera diferencial. La composición de la matriz es principalmente colágeno, elastina y hialuronano con características biomecánicas que contribuyen a su correcto funcionamiento1,7. La disfunción valvular mitral es una causa de insuficiencia cardíaca que conlleva la muerte en adultos y niños7,8. En edades tempranas requiere una intervención oportuna, por lo que todos los esfuerzos disponibles por comprender y acceder a nuevas formas de tratamiento repercuten en la expectativa de vida de la población pediátrica.
Tratamientos actualesLa elección de la prótesis adecuada para reemplazar la válvula mitral debe tener en cuenta factores como la edad, ya que un mínimo porcentaje de niños puede ser candidato a válvulas mecánicas, mientras que cuando se tienen en cuenta factores como los riesgos asociados a la anticoagulación, reintervenciones y, sobre todo, la durabilidad de la prótesis valvular, se puede optar por válvulas9. Los reemplazos de la válvula mitral en neonatos o durante el primer año de vida son principalmente de 3tipos: las válvulas protésicas mayores a 17mm, válvulas con prótesis de vena yugular bovina con stent (Melody®) en posición mitral y prótesis mecánica bivalva de 15mm de tamaño. Tanto las válvulas mecánicas como las bioprotésicas carecen de la capacidad de remodelación y de crecimiento sinérgico con el paciente, lo que lleva inherentemente a múltiples cirugías para reemplazar la válvula, sobre todo en pacientes pediátricos10.
Válvulas mecánicasSon prótesis valvulares cardíacas compuestas de metales o materiales artificiales que no incluyen productos biológicos adicionales. Las válvulas mecánicas se fabrican en su mayoría con carbón pirolítico, un elemento de carbono entre el grafito y el diamante. Este carbono pirolítico le otorga a la válvula extremada dureza y biocompatibilidad a la hora del reemplazo. No obstante, una de las desventajas de este material es el alto riesgo de formar trombos debido a la acumulación de un infiltrado celular y, por consiguiente, un alto riesgo de formar émbolos. Así, un paciente intervenido con una válvula mecánica, de forma independiente de su edad, debe seguir la medicación anticoagulante9.
Las válvulas protésicas mayores de 17mm han sido consideradas como la «única opción» en el tratamiento de reemplazo valvular mitral. Sin embargo, este tipo de prótesis suele ser demasiado grande para el neonato, incluso en el primer año de vida. Además, representan un alto costo. Por lo anterior, en la mayoría de estos casos, actualmente se emplea la prótesis bivalva reducida de 15mm de tamaño, diseñada para implantación quirúrgica con técnicas básicas. La técnica quirúrgica empleada en el reemplazo de válvula mitral de pequeño tamaño o de 15mm se define como supraanular y consiste en la implantación de la válvula con orientación antianatómica, 90 grados ortogonales a la orientación nativa10,11.
Válvulas bioprotésicasLa válvula protésica biológica usada en el reemplazo de la válvula mitral en neonato se denomina válvula Medtronic Melody ® (Medtronic Inc, Minneápolis, MN, EE. UU.) o válvula de injerto de vena yugular bovina con endoprótesis. Este tipo de prótesis restaura la funcionalidad de la válvula, aunque no está diseñada para ser implantada quirúrgicamente, es de alto costo y puede ocasionar la obstrucción del tracto de salida del ventrículo izquierdo, entre otros problemas, como la creación de una fuga paravalvular u obstrucción de la vena pulmonar11.
La elección de una bioprótesis está determinada por: a) la expectativa de vida del paciente, b) la reintervención tras una trombosis de una válvula mecánica (falla terapéutica a la anticoagulación a largo plazo y la ausencia de defectos estructurales) y c) contraindicación de la anticoagulación12.
Todos los tipos de válvulas protésicas pueden presentar un fallo en su funcionamiento en algún momento. Las válvulas bioprotésicas pueden presentar fallos entre los 10 (30%) y los 15 años (70%) después de su implantación por complicaciones asociadas al periodo postoperatorio inmediato, a la técnica quirúrgica, al tratamiento anticoagulante o la disfunción inherente a la válvula protésica.
Tratamientos diagnósticos y quirúrgicosAyudas diagnósticas, como la ecocardiografía transesofágica tridimensional, permiten la evaluación anatómica y la comprensión estructural e integral de la enfermedad mitral, ya que identifica candidatos para el tratamiento transcatéter. En los últimos años, se han venido utilizando los procedimientos transcatéter para válvula mitral en pacientes sintomáticos con estenosis e insuficiencia valvular, ya que es un método para restablecer el flujo sanguíneo y aminorar los síntomas13. Esta intervención busca reducir el tamaño del anillo mitral, reparar y reinsertar las cuerdas y aproximar el borde libre de las valvas para favorecer su coaptación (técnica de Alfieri)14.
Los pacientes pediátricos con valvulopatías congénitas pueden presentar múltiples enfermedades y requieren abordajes quirúrgicos complejos, como el caso reportado por Carretero et al.13 acerca de un niño con complejo de Shone, coartación aórtica, anomalía de la válvula mitral, estenosis subaórtica y comunicación interventricular. Dos años después de la intervención por reacortación con angioplastia y parche pericárdico, realizaron la intervención transcatéter por una insuficiencia mitral de nueva aparición por perforación de la valva anterior, empleando el sistema Amplatzer Duct Occluder II (ADO II, Abbot Vascular, IL, EE. UU.). Este procedimiento quirúrgico percutáneo es el más eficaz para el tratamiento de la reparación de la insuficiencia mitral10,13.
Ingeniería de tejidos valvular mitralIdentificación de parámetros de diseño de implantes valvulares mitralesLa revisión de la literatura permitió obtener unos atributos de los artículos publicados por los investigadores expertos en el área enfocados en las necesidades principales del diseño de un implante valvular pediátrico. Estas necesidades fueron transformadas en requerimientos funcionales10, que pueden orientar en un futuro parámetros de diseño y variables del proceso en la elaboración de válvulas mitrales (fig. 2):
- 1.
Durabilidad (>15 años)15.
- 2.
Altas características mecánicas: resistencia, dureza, flexibilidad, capacidad de cierre, cizalla, velocidad de flujo15.
- 3.
Imitar el tejido nativo valvular mitral.
- 4.
Antitrombogénica.
- 5.
Seguridad: bajo riesgo de rechazo inmunológico, de tumorogénesis o infección.
- 6.
Biodegradabilidad controlada.
- 7.
Abordaje transcatéter, en un único tiempo sin reintervenciones.
- 8.
Biocompatibilidad: adhesión, proliferación, diferenciación y migración celular, permitiendo que las células produzcan los componentes de la matriz extracelular valvular16.
- 9.
Adaptación precisa, anatómica y personalizada del tamaño de la válvula mitral del niño.
- 10.
Crecimiento sincrónico del niño y de la válvula.
Parámetros de diseño desde la ingeniería de tejidos de un implante valvular mitral.
Parámetros de diseño identificados en la revisión correlacionados con los procedimientos y los tipos de implantes aplicando los conceptos de ingeniería de tejidos valvulares como el uso de biomateriales, soportes y células nativas, utilizando bioimpresión y caracterizando su compatibilidad biológica y mecánica, entre otras, para generar un ambiente similar al nativo.
iPS: células pluripotentes inducidas a células nativas; VEC: células endoteliales valvulares; VIC: células instersticiales valvulares.
Estas necesidades son abordadas desde la ingeniería de tejidos a través de la construcción de estructuras valvulares tridimensionales en las cuales cada parámetro de diseño responde a una necesidad específica como, por ejemplo: la elección de los biomateriales, las técnicas de desarrollo de la válvula por bioimpresión o electrohilado, los tipos de células (origen), los factores bioactivos que intervienen en la diferenciación celular y la optimización de las propiedades mecánicas del implante valvular por efecto del entrecruzamiento, entre otras16.
Desarrollo de la ingeniería de tejidos valvular mitral desde sus componentesEl dogma central de la ingeniería de tejidos es la tríada conformada entre las células, los biomateriales y los factores bioactivos (tales como los factores de crecimiento)17, los cuales pueden ser utilizados de manera independiente o asociados con el propósito de regenerar o reparar un tejido, en este caso, la válvula mitral. Algunos de los desarrollos descritos a continuación para estos 3componentes son generales en la ingeniería de tejidos de válvulas cardíacas, lo que podría incluir otras válvulas, como la aórtica.
El recurso celularLas células madre dentro de la ingeniería tisular pueden someterse a la autorrenovación, proliferación y diferenciación a través de la inducción celular adecuada. Cuando se utilizan células madre en el nicho sintético de las plataformas de microingeniería de tejidos, se deben considerar cuidadosamente el origen y las propiedades de las células madre. Por ejemplo, las células madre aisladas de tejidos con rápida renovación y regeneración, como el intestino, la sangre y la piel, se diferencian rápidamente, mientras que las células madre del hígado y del músculo esquelético tienen un mecanismo de reclutamiento más alto que las células madre de otros tejidos18.
Un alto porcentaje de las válvulas cardíacas biológicas modernas están hechas de pericardios porcinos o bovinos19. El principal problema con las válvulas cardíacas biológicas existentes es su rápida degeneración debido a la falta de células autorreplicantes. La ingeniería de tejidos puede resolver este problema mediante la creación de una válvula cardíaca utilizando una combinación de células madre y biomateriales. El concepto general de la ingeniería de tejidos valvulares es combinar 2tipos de células presentes en la válvula cardíaca fisiológica, células estromales y células endoteliales, para crear un andamio extracelular tridimensional que participa en el soporte mecánico y el movimiento de las valvas20. Cada célula está involucrada en la integridad estructural y la homeostasis vascular. Al igual que en otras áreas de la ingeniería de tejidos, la diferenciación de las células valvulares de varios tipos de células madre diferentes se ha estudiado ampliamente. El desafío actual en la ingeniería de tejidos de válvulas es encontrar la combinación óptima de células y estructuras que garanticen la resistencia a largo plazo, especialmente con respecto a la homeostasis vascular y la resistencia a la desnaturalización. Tanto los materiales naturales como los sintéticos se han estudiado mucho y pueden proporcionar un microambiente adecuado para la proliferación y diferenciación de células madre21 (tabla 1).
Recurso celular empleado en ingeniería de tejidos valvulares
| Tipo celular | Origen |
|---|---|
| Miofibroblastos de vena safena | Humano |
| Células vasculares mediales y de músculo liso | Ovino |
| Células madre mesenquimales | Murino, ovino y humano |
| Fibroblastos dérmicos | Humano |
| iPSCs aislados de fibroblastos de piel | Humano |
| Células endoteliales bovinas y fibroblastos dérmicos humanos | Bovino, humano |
| Células endoteliales y miofibroblastos | ovino |
| VIC (Células intersticiales valvulares) y VEC (Células endoteliales valvulares) | Porcino |
Adaptado de Uspresch et al.90.
Un ejemplo del uso de células madre en las matrices descelularizadas de origen bovino para implantes valvulares es el reportado con fibroblastos y células madre derivadas de tejido adiposo con el objetivo de estimular la proliferación y diferenciación de las células madre a células endoteliales caracterizadas por la formación de colágeno IV, en donde obtuvieron una preservación de la histoarquitectura, bioquímica y biomecánica del soporte con formación de componentes de matriz extracelular22.
Otros elementos celulares igual de importantes son las células VIC y VEC, que pueden ser utilizadas directamente en el soporte para promover la proliferación y formación de matriz celular del tejido nativo. En cultivos 3D han sido encapsuladas con hidrogeles de colágeno y elastina (VIC) y en la superficie (VEC) y han formado un cocultivo con el fenotipo celular valvular, en un periodo de 7 días la expresión de intergrina β1 y F-actina, al igual que la proliferación celular fue manifiesta en las células VIC y en la VEC se mantuvo el fenotipo al día 5 con una transformación a fenotipo mesenquimal en un 20%, lo que indica que son necesarios más estudios acerca del comportamiento in vitro de las interacciones célula-célula y célula-matriz extracelular23.
Las células madre pluripotentes inducidas (iPSC) y las técnicas de edición genómica permitirán la detección de genes y su corrección en la red de genes en células humanas de enfermedades específicas. Un ejemplo de esta aplicación lo realizaron en una enfermedad valvular aórtica con una corrección de la red de genes con el candidato terapéutico XCT790, extendida a las células de la válvula aórtica primaria derivadas del paciente y, al aplicarlo en un modelo de ratón, lograron la prevención y el tratamiento de la enfermedad. Se espera que esta metodología se extienda a la enfermedad valvular mitral24.
Biomateriales y bioimpresiónBioimpresiónLa bioimpresión 3D permite realizar constructos de células e hidrogeles con una geometría anatómica y propiedades mecánicas idóneas. Sin embargo, la dificultad para la implementación de esta técnica radica en que existen muy pocos materiales biocompatibles que pueden utilizarse25-27. Entre los materiales utilizados actualmente, se encuentran algunos biopolímeros sintéticos utilizados como base para construir válvulas cardíacas diseñadas por ingeniería de tejido (TEHV)28-31, como el ácido poliglicólico, el copolímero ácido poli(láctico-co-glicólico) (PLGA) y los polihidroxialcanoatos. Alguna de las desventajas de estos materiales es que son demasiado rígidos, producen gradientes transvasculares elevados y el aumento de características fibroblásticas32-37.
Recientemente, se han fabricado constructos que imitan mejor las condiciones nativas de las válvulas mediante la implementación de técnicas de electrohilado y microfabricación, utilizando polímeros sintéticos como poliéster uretano urea (PEUU) y poliglicerol sebacato (PGS), que ofrecen propiedades mecánicas y de degradación ajustables y flexibles38-41. Al contrario que ciertos biopolímeros sintéticos, estos implantes carecen de la rigidez necesaria para formar completamente los conductos de la válvula.
Los hidrogeles tienen un mejor ajuste fisicoquímico y mecánico, ya que son más permeables e inclusive pueden imitar el microambiente de la matriz extracelular y permitir la remodelación de la válvula diseñada33,42,43. Los diseños de los moldes de las válvulas son difíciles de crear, ya que generalmente se construyen con un solo material, lo que repercute de forma directa en el mantenimiento del entorno de las células residentes y las distintas estructuras de las válvulas nativas44-48. Debido a todo esto, la bioimpresión 3D es una herramienta versátil, ya que permite incorporar componentes biológicos y celulares mediante el diseño asistido por computadora y construir válvulas cardíacas completas utilizando varios tipos de células y materiales biohíbridos que presentan mejores propiedades mecánicas49,50.
Para la bioimpresión se han utilizado hidrogeles bioinertes poco remodelables y degradables como: alginato, pluronic F127, polietilenglicol dimetacrilato (PEGDMA)50-55. Otros hidrogeles como la gelatina y el ácido hialurónico no se pueden imprimir debido a que utilizan una baja concentración y viscosidad49,56, o a que necesitan un modificador de viscosidad no bioactivo o no biodegradable, como alginato y dextrano57,58.
Actualmente existe una necesidad de desarrollar más materiales bioactivos y biofuncionales que permitan la bioimpresión 3D y la mejora de las características microambientales59. En 2010, Skardal et al. implementaron hidrogeles híbridos Me-HA/Me-Gel, los cuales tuvieron inconvenientes en el tamaño y la precisión de la geometría49,60. Para mejorar las propiedades de compresión de estos hidrogeles híbridos, se realizó una variación de las concentraciones de los componentes. Por ejemplo, el aumento de la concentración de Me-Gel aumenta la viscosidad debido a la concentración y al efecto de gelificación termorreversible y, por lo tanto, disminuye significativamente las propiedades compresivas de los hidrogeles híbridos con lo que se obtienen niveles de rigidez que se encuentran dentro del rango de módulos elásticos locales y globales de VIC (∼3-20kPa)61. La mayor parte de la investigación de TEHV se ha enfocado en replicar la rigidez del material62-64, ya que algunas veces los materiales utilizados presentan mayor rigidez que la que se observa en el ámbito fisiológico in vivo65. De acuerdo con lo anterior, los hidrogeles híbridos Me-HA/Me-Gel pueden imitar mejor las propiedades mecánicas de tensión fisiológica.
Además de lo anterior, los materiales bioimprimibles necesitan suficiente fluidez para extruirse intactos a través de un tubo/aguja angosta, pero conservan la viscosidad suficiente para mantener la forma después de la impresión y antes del entrecruzamiento51. La viscosidad de los hidrogeles híbridos Me-HA/Me-Gel con el 2% de Me-HA son menos viscosos y mantienen la forma impresa, mientras que los hidrogeles con el 6% de Me-HA son demasiado viscosos para depositarlos sin problemas. El rango de viscosidad de hidrogel más adecuado para el sistema de bioimpresión 3D Fab@Home en este estudio fue de alrededor de 400 a 4.000 Pa. Los hidrogeles híbridos con 4% Me-HA y 6%, 10% y 12% Me-Gel son, por tanto, más apropiados para la bioimpresión 3D.
También es de gran importancia evaluar el éxito de los comportamientos celulares de las células encapsuladas dentro del microambiente bioimprimible. Skardal et al. demostraron que el aumento de la concentración de Me-Gel del 6% al 12% disminuye la rigidez del hidrogel y aumenta la densidad de adhesión celular. El cambio de microambiente mejoró la propagación celular y aumentó la secreción de GAG en un cultivo de 3 días. La propagación celular depende de la rigidez de la matriz y de la densidad del sitio de adhesión celular38,66. Por un lado, el aumento de la rigidez del hidrogel reduce el tamaño de los poros y limita el espacio para el alargamiento, la propagación y la migración celular67,68. Por otro lado, el aumento de la densidad promueve la adhesión celular y afecta a los eventos celulares posteriores como la proliferación, migración y diferenciación66,69-75.
Como resultado, los constructos de células intersticiales valvulares aórticas humanas (HAVIC) empleando los hidrogeles híbridos con porcentajes del 4, el 10 y el 12% mostraron más expresión de todos los genes diana (αSMA, vimentina, periostina y colágeno I), lo que indicó que las HAVIC encapsuladas fueron más activas. En este estudio, usaron el modelo con geometría de válvula simplificada en lugar de la anatomía natural para probar la bioimpresión de los hidrogeles híbridos y se enfocaron en la respuesta de las HAVIC encapsuladas dentro de valvas de las válvulas bioimpresas. La disminución de la rigidez y el aumento de la densidad del sitio de adhesión celular aumentó la vimentina, que es uno de los principales biomarcadores del fenotipo fibroblástico de VIC. Esto indica que la adición de Me-Gel disminuyó la activación miofibroblástica, lo cual es consistente con los hallazgos previos con formulaciones de hidrogel híbrido no imprimibles56. En general, al cambiar la concentración del componente de gelatina, los hidrogeles Me-HA/Me-Gel demostraron microentornos 3D sincronizables que pueden regular la respuesta celular. Al combinar la bioimpresión 3D con hidrogeles híbridos Me-HA/Me-Gel optimizados, se generaron conductos de válvulas cardíacas de 3valvas con una morfología similar al diseño CAD original con encapsulación directa de las HAVIC dentro de las valvas impresas. Las estrategias para desarrollar conductos de válvulas cardíacas vivas anatómicamente precisas y mecánicamente heterogéneas con un microambiente ECM similar al tejido nativo han ganado importancia para el avance de la ingeniería de tejidos de válvulas cardíacas60,76,77.
Una preocupación para la impresión de tejidos y órganos a base de hidrogel es la viabilidad celular y las funciones dentro de las construcciones; sin embargo, se ha obtenido una viabilidad celular mayor al 90%59. Algunos estudios muestran que las células se adhieren fácilmente y formaron una monocapa en la superficie de la construcción bioimpresa, por lo que el uso de células encapsuladas debajo de la superficie puede remodelar el hidrogel después de 3 días de cultivo. Las estrategias exitosas de válvulas cardíacas diseñadas por ingeniería tisular deben permitir que las células remodelen su microambiente inicial y secreten su propia MEC78-81.
Además de la viabilidad celular, existen otros desafíos clave para la impresión de tejidos y órganos, que incluyen: a) la resolución de la bioimpresora y la precisión de las construcciones bioimpresas; b) la vascularización y c) la estructura heterogénea y biomecánica. La plataforma de bioimpresión 3D Fab@Home admite la fabricación de construcciones de tejido con forma anatómica82 y potencialmente permite la impresión heterogénea de construcciones de tejido utilizando múltiples materiales y tipos de células49,77. La optimización sistemática de las condiciones y los parámetros de impresión puede mejorar la precisión de las plataformas de impresión 3D para aplicaciones de biofabricación e ingeniería de tejidos77,83.
Las valvas de las válvulas humanas sanas son casi completamente avasculares84,85 y esta estructura solo requiere la difusión de nutrientes y metabolitos. La construcción de hidrogel cargada de células 3D con un grosor razonable puede cumplir este requisito y, por lo tanto, mantener una alta viabilidad celular y un fenotipo normal para las células de la válvula. Los conductos de la válvula basados en hidrogel bioimpresos también proporcionan un entorno fisiológico más adecuado para VIC en comparación con otros polímeros sintéticos que tienen una rigidez mucho mayor y pueden presentar un fenotipo miofibroblástico patológicamente activo de VIC33,86. Aunque las construcciones de válvulas de hidrogel impresas aún no cumplen con el rango mecánico completo del tejido de válvula nativa, sí proporcionan una fidelidad del dominio fisiológico del rendimiento biomecánico, como la resistencia del material. Se puede lograr una mejora adicional de las propiedades del material de los conductos de válvula bioimpresos mediante el acondicionamiento en un biorreactor pulsátil, como se ha demostrado en otras investigaciones87,88.
La tecnología de impresión 3D también permite crear guías realistas específicas de cada paciente neonato que orientan el dimensionamiento del diseño valvular. Por último, es importante resaltar que la evaluación hemodinámica va de la mano con el desarrollo de bioimpresiones 3D de válvulas mitrales. Se han reportado algunos datos utilizando Doppler y transductor TEE, en adultos89, sin embargo, las mediciones en neonatos no se han realizado. A través del enfoque de impresión 3D, es posible abordar en el futuro cómo la composición del material prescrito y su organización espacial contribuyen a la fidelidad estructural y mecánica de la válvula a macro- y microescala.
BiomaterialesLos polímeros biorreabsorbibles sintéticos tienen la ventaja de que el cuerpo los absorbe y metaboliza de forma natural y, debido a esto, están ganando interés como posibles materiales in situ; además, poseen unas propiedades mecánicas, químicas y geométricas adaptables que los hacen muy promisorios. Los polímeros sintéticos son reproducibles, escalables y de fácil acceso en el mercado. En los últimos años, se ha investigado la funcionalidad y el potencial de remodelación de las válvulas poliméricas biorreabsorbibles en modelos de animales (tabla 2). Los polímeros biorreabsorbibles sintéticos son adecuados para aplicaciones transcatéter, ya que los polímeros supramoleculares a base de bisurea y ureidopirimidona compatibles con las técnicas de implantación quirúrgica78 y transcatéter79 se han utilizado para fabricar válvulas bioabsorbibles que tienen potencial regenerativo y han demostrado una funcionalidad aceptable hasta por 12 meses78,79. Se ha observado una rápida proliferación celular, depósito de matriz extracelular y degradación del constructo con las válvulas explantadas, lo que confirma su potencial de remodelación. Sin embargo, independientemente del polímero y de la técnica de implantación utilizada, se han informado diferencias intravalvulares e intervalvulares en la remodelación tisular, tales como: la infiltración celular, el engrosamiento, el depósito de elastina y la reabsorción del constructo78,79, lo que indica la necesidad de mayores estudios al respecto. A pesar de esto, algunos reemplazos basados en polímeros se han explorado en los primeros ensayos clínicos (tabla 2). Cinco pacientes de 4 a 12 años recibieron un injerto a base de polímeros como conducto cavopulmonar extracardíaco para el tratamiento de malformaciones cardíacas univentriculares80. No se observaron eventos adversos después de la implantación y el rendimiento del injerto fue estable y se obtuvo una mejoría en el estado de salud general de los pacientes a los 12 meses. Sin embargo, se necesita un seguimiento más prolongado para evaluar en profundidad el rendimiento del injerto, el potencial de remodelación e incluso la capacidad de crecimiento de estos injertos vasculares biorreabsorbibles. En el estudio Xplore-116781, se evaluaron conductos de válvula pulmonar diseñados con los mismos materiales en 12 pacientes de 2 a 12 años (tabla 2). Los informes preliminares a los 24 meses demostraron resultados desfavorables. Aunque no se informaron eventos clínicos importantes (muerte o necesidad de reoperación o intervención), la evaluación ecocardiográfica mostró la presencia de insuficiencia pulmonar de moderada a grave en la mayoría de los pacientes a partir de los 6 meses del implante. Además, se observó una valva protuberante en 6de las válvulas implantadas. Posteriormente, en el ensayo Xplore-2169, se implantó un dispositivo de segunda generación en 6niños de 2 a 9 años, en los que los informes de seguimiento de 12 meses mostraron un buen desempeño de la válvula sin insuficiencia, pero se observó un caso de estenosis de la válvula y un paciente requirió una reoperación83. De acuerdo con lo anterior, se necesitan más datos clínicos con un periodo de seguimiento más prolongado para determinar la seguridad y eficacia generales de los conductos de válvula basados en polímeros biorreabsorbibles o biodegradables.
Algunos resultados con algunos polímeros biorreabsorbibles o biodegradables usados para TEHV
| Polímeros | Estudio | Resultados |
|---|---|---|
| PGA con P4HB | 91 | Constructos PGA-P4HB degradados en 8 semanas. Capas de tejido compuestas de colágeno, glicosaminoglicanos y elastina después de 20 semanas. Insuficiencia valvular de leve a moderada dentro de las 20 semanas posteriores a la implantación. Adición de hidrogel de fibrina como portador de células, para diseñar válvulas aórticas y pulmonares. Presencia de fibroblastos que provocaron el deterioro de la función valvular debido a la contracción del tejido o la fusión de la valva a la pared, lo que provocó una disminución significativa en el área de coaptación y el fracaso 4-6 meses después de la implantación |
| Policarbonato uretano urea y stent de aleación de magnesio AZ31 | 85 | Implantación exitosa, con función normal de las valvas; no se observó evidencia de trombosis, regurgitación ni degradación |
| Ácido poliláctico (PLLA) y PLLA | 86 | Evidencia de depósito de MEC y remodelación tisular en capas. Regurgitación de leve a moderada hasta 6 semanas después de la implantación; sin embargo, se observó regurgitación de moderada a grave en los seguimientos de 12 y 20 semanas debido a un acortamiento de las valvas >70%. Evidencia de residuos de polímeros sintéticos en las válvulas explantadas después de 20 semanas in vivo |
| Ureidopirimidinona basadas en PC | 79 | Estas válvulas de polímero de ureidopirimidinona basadas en PC han mostrado un rendimiento hemodinámico aceptable sin regurgitación grave hasta 2 años in vivo. Presión máxima relativamente estable e insuficiencia de leve a moderada en las válvulas pulmonares Xeltis en el plazo de un año en modelos ovinos causada principalmente por la contracción del neotejido colágeno que se formó alrededor de la valva sintética. Las hojas sintéticas no fueron infiltradas por las células huésped y mostraron una degradación mínima con plegamiento dentro del neotejido |
| Ureidopirimidinona-PC | 87 | El constructo contenía alineación de fibras de biomateriales acelulares en la remodelación de tejidos endógenos. Después de 12 meses in vivo mostraron un engrosamiento del tejido con un armazón parcialmente degradado encerrado en el neotejido rico en colágeno. Presentaron regurgitación de leve a moderada con un ligero aumento en el gradiente de presión máxima durante 12 meses in vivo. Este estudio concluyó que los andamios con fibras alineadas circunferencialmente no dieron como resultado la alineación del colágeno sintetizado de novo con las fibras del biomaterial |
| Ácido hialurónico metacrilado (Me-HA) y gelatina metacrilada (Me-Gel) | 60 | Sirven para realizar bioimpresión. El aumento de la concentración de Me-Gel dio como resultado una disminución de la rigidez del hidrogel y un aumento de la densidad de adhesión celular. Se generó un conducto de válvula cardíaca trivalva viva con una adecuada precisión, alta viabilidad celular y potencial de remodelación |
| Hidrogeles | 92 | Se han utilizado colágeno y fibrina para construir andamios de hidrogel porque son abundantes y fáciles de polimerizar. Sin embargo, estos materiales carecen de la resistencia mecánica del tejido valvular nativo, lo que los hace inadecuados para la implantación. Se reforzó con una malla de poliacrilonitrilo anisotrópico dentro de un hidrogel de gelatina hialuronano cargado con VIC y se obtuvo una construcción que mostró una buena morfología celular y un comportamiento mecánico similar al de la válvula aórtica nativa |
| Basado en PGA-P4HBTEM humano | 88 | El estudio demostró la viabilidad de TAVR utilizando TEHV clínicamente diseñados sobre la base de TEM derivado de células humanas; se observó buen comportamiento hemodinámico, con flujo coronario libre, sin estenosis y sin fuga paravalvular; las válvulas explantadas mostraron la presencia de células derivadas de la sangre en el tejido |
| UPy-poliéster-uretanos(Xplore-1) | 81,83 | A los 2 años, no se observaron eventos clínicos importantes (muerte o reoperación) ni signos de aneurisma o estenosis; sin embargo, la ecocardiografía detectó regurgitación moderada o grave en 11 de 12 pacientes; 6 valvas presentaban valvas sobresalientes |
| UPy-poliéster-uretanos(Xplore-1) | 83 | Al cabo de un año, la ecocardiografía realizada en 6pacientes no reveló regurgitación grave ni valvas protuberantes; sin embargo, se informó una estenosis de válvula y un paciente requirió una nueva operación |
PC: policarbonatos; PGA: ácido poliglicólico.
Los factores bioactivos en su mayoría se caracterizan por ser de crecimiento o de diferenciación celular, porque permiten que las células adquieran el fenotipo requerido. Algunos de los factores utilizados en ingeniería de tejidos de válvulas cardíacas son90: el factor de crecimiento transformante ß1 (TGF-ß1), el cual estimula la diferenciación de fibroblastos a miofibroblastos positivos para SMA (actina de músculo liso); el factor de crecimiento de hepatocitos, que promueve la endotelialización por inducción de la proliferación y la motilidad de las células endoteliales, particularmente en conjunción con la fibronectina; el factor de crecimiento de fibroblastos (FGF-2), el cual inhibe la fibrosis en las células valvulares intersticiales por disminución de la activación de miofibroblastos; el factor de crecimiento ligado a heparina (HB-EGF), que actúa como un regulador negativo para la proliferación de células madre mesenquimales durante el desarrollo valvular cardíaco; el factor de crecimiento derivado de las plaquetas (PDGF), con un efecto proliferativo y de síntesis sobre las células vasculares del músculo liso, pero que también está involucrado en el apropiado desarrollo valvular y ha sido usado en conjunto con otros factores de crecimiento en estudios de desarrollo valvular en ingeniería de tejidos; el factor de crecimiento endotelial vascular (VEGF), involucrado en la formación valvular y en la obtención de un apropiado fenotipo de las células madre mesenquimales. Finalmente, otros factores que contribuyen a la diferenciación del fenotipo valvular son FGF8 y BMP2.
ConclusionesResultados como los obtenidos mediante la bioimpresión 3D con hidrogeles híbridos Me-HA/Me-Gel, optimizados con encapsulación de células HAVIC, son un ejemplo del potencial uso de esta tecnología para imitar el ambiente celular nativo utilizando células iPSC, VEC y VIC, principalmente. Además de esto, el uso de iPSC bajo el contexto de edición genómica para condiciones congénitas es prometedor. A pesar de los avances desarrollados desde la bioimpresión 3D, aún es necesario desarrollar nuevas alternativas al tratamiento de las valvulopatías mitrales que cumplan con los requerimientos de la población pediátrica, ya que los desarrollos en ingeniería de tejidos de válvula cardíaca mitral para población pediátrica, en su mayoría, se encuentran en fase de estudios preclínicos. A través de esta revisión, se logró definir algunos de los requerimientos funcionales según las necesidades específicas en niños, que se deberían tener en cuenta para nuevos desarrollos, como son: a) la mayor durabilidad, b) las características mecánicas biosimilares a la válvula nativa, c) la imitación del tejido nativo valvular mitral, d) efectos antitrombogénicos, e) la seguridad del implante, f) la biodegradabilidad controlada, g) el abordaje transcatéter, h) la biocompatibilidad, i) la adaptación precisa, anatómica y personalizada y j) el crecimiento sincrónico de la válvula de acuerdo con el desarrollo anatómico del niño.
De acuerdo con lo anterior, los distintos componentes utilizados en ingeniería de tejidos (células, biomateriales y factores bioactivos) están en constante evolución y permitirán orientar el cumplimiento de estos requerimientos para el diseño de nuevos implantes valvulares mitrales para niños, lo que los convierte en una esperanza en la cirugía cardiovascular pediátrica.
FinanciamientoUniversidad Antonio Nariño - Sede Bogotá, Colombia.
Conflicto de interesesLos autores manifiestan no presentar conflicto de interés.