El angio-TAC se ha convertido en una herramienta imprescindible para la elección del tamaño y del tipo de prótesis a emplear, así como la mejor vía de abordaje para el tratamiento de la estenosis aórtica severa transcatéter (TAVI).
En este artículo describimos los puntos importantes que hay que tener en cuenta para la correcta planificación y ejecución de dicha técnica, con el empleo del angio-TAC.
Angio CT has become an essential tool for choosing the size and type of prosthesis to use, as well as the best approach, for the treatment of severe transcatheter aortic stenosis (TAVI).
In this article we describe the important points that must be considered for the correct planning and execution of this technique, with the use of angio CT.
La técnica de implante transcatéter de prótesis aórtica (TAVI), se ha consolidado en los últimos años como el tratamiento de elección en los pacientes mayores de 75 años, según las últimas guías de actuación de la Sociedad Europea de Cardiología1. El éxito del implante, aparte de la pericia del cirujano o cardiólogo implantador, viene dado por una buena planificación del mismo.
El tratamiento TAVI comienza en el año 2002 cuando Cribier et al. describen en un artículo publicado en Circulation2, el tratamiento percutáneo anterógrado vía transeptal de una estenosis aórtica, de un paciente pluripatológico en situación crítica, rechazado para la cirugía convencional. Este autor estaba desarrollando de manera experimental una válvula de uso percutáneo llamada PHV, que consistía en 3 velos de pericardio montados en un stent de acero de 14mm, que una vez expandida sobre un balón de valvuloplastia llegaba a 21 o 23mm. Tras obtener el consentimiento del comité de ética de su hospital, aplica este procedimiento en este paciente, con éxito, donde el comportamiento de la válvula implantada era normal. Sin embargo, el paciente fallece a las 17 semanas debido a sus comorbilidades.
Este acontecimiento da el pistoletazo de salida al recambio valvular aórtico por vía transcatéter, por diferentes vías, femoral, apical, transaórtica, axilar, carotidea, transcava, etc., que fueron describiéndose y evolucionando a lo largo del tiempo.
Una parte esencial de este procedimiento es la planificación de la vía del implante, así como la elección de la prótesis a implantar.
A diferencia de las técnicas quirúrgicas abiertas convencionales, las medidas de las prótesis a implantar se tienen que hacer de manera indirecta, con las dificultades que eso entraña, aparte de las complicaciones, incluso muy graves que resultan de la mala elección de las prótesis, desde embolizaciones a rotura de anillo, así como obstrucciones coronarias, entre otras complicaciones.
La ecocardiografía 2D transtorácica y transesofágica, se empleaban para el diagnóstico de la enfermedad y para la elección de las prótesis. Pero los resultados del Partner3 alertaban del riesgo de la fuga periprotésica en cuanto al aumento de morbimortalidad, y eso empujó a buscar técnicas más idóneas para caracterizar la anatomía de la raíz aórtica.
El angio-TAC comienza a tener su peso, aparte del estudio del acceso vascular, a aplicarse para evaluar la anatomía de la raíz aórtica4.
Gurvich et al.5 en un trabajo de 2011, realizaron mediciones anulares en 50 pacientes planificados para el implante de válvula aórtica transcatéter en múltiples planos: anillo basal (eje corto y largo, diámetro medio, diámetro derivado del área), proyecciones coronales, sagitales y de 3 cámaras. Se desarrolló un modelo teórico teniendo en cuenta las diferencias entre las mediciones de angio-TAC más reproducibles y la ecocardiografía transesofágica para guiar la elección del tamaño de la válvula. Sus conclusiones eran que las mediciones más reproducibles del anillo son el diámetro derivado del área y el diámetro promedio del anillo basal, con valores derivados generalmente mayores que los obtenidos con ecocardiografía. Si se utiliza el angio-TAC para el dimensionamiento de la válvula, puede ser importante una estrategia que incorpore estas diferencias. La TAC puede ser ideal para dimensionar las válvulas aórticas transcatéter, ya que tiene en cuenta la excentricidad del anillo aórtico, son reproducibles y no son invasivas.
Kasel et al.6, sientan las bases de las mediciones por la TAC, del anillo aórtico, sobre todo del área y perímetro, así como de los diámetros máximo-mínimo y diámetro medio, medidas que ya se incorporaron para todas las generaciones de prótesis auto y balón expandibles.
Las guías actuales del empleo del angio-TAC7, en las técnicas transcatéter aórticas, refieren la realización de una TAC sincronizada con EKG para el estudio de la raíz aórtica, y otra no sincronizada para el estudio del árbol vascular desde femorales a carótidas.
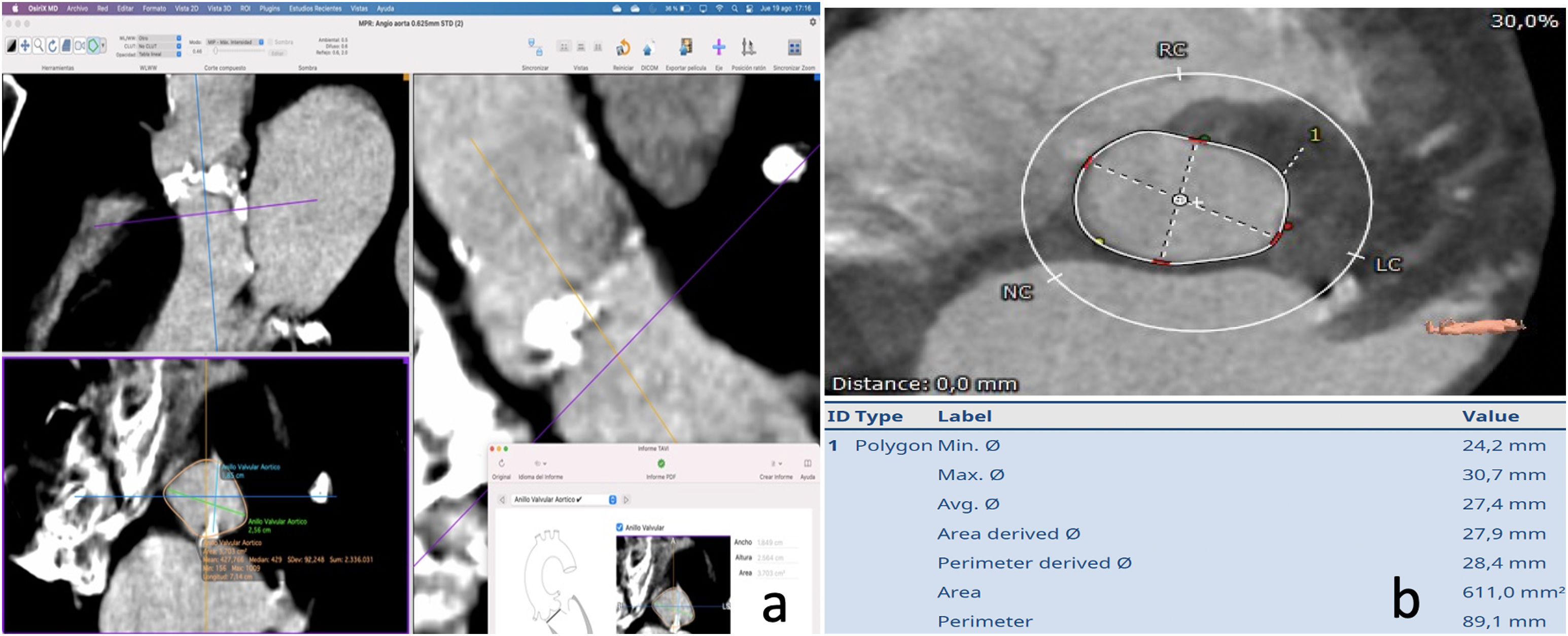
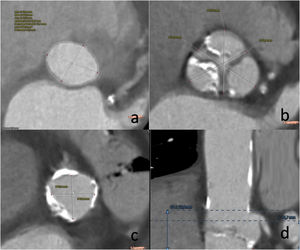
El estudio de la raíz aórtica debe incluirAnular aórtico: definiciones y técnicas de mediciónA los efectos del dimensionamiento anatómico en el contexto de TAVI, el anillo aórtico se define como el contorno luminal dentro de un plano virtual alineado con los puntos de unión más basales de las 3 cúspides de la válvula aórtica (a veces denominados «puntos de bisagra basal»). La evaluación cuantitativa requiere la identificación precisa de cada uno de estos tres puntos a su vez para crear un plano que transecte los 3. Se puede realizar usando el software Osirix®, que requiere menos inversión, se mide de manera manual en el modo 3D MPR o el software semiautomático 3mensio®, mucho más caro y menos disponible (fig. 1).
Es importante medir en sístole cardiaca, donde el área y el perímetro anular son mayores que en diástole8.
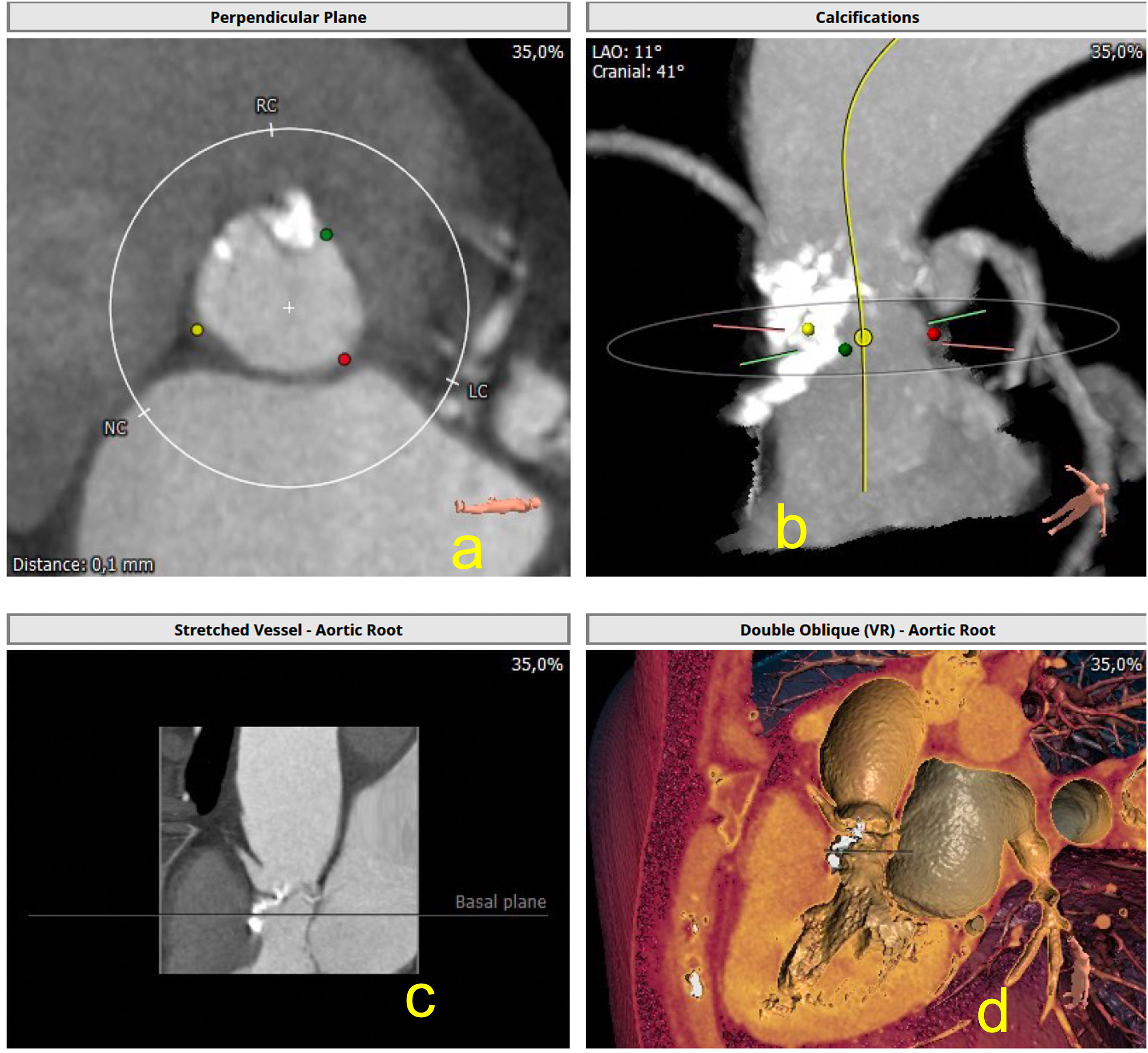
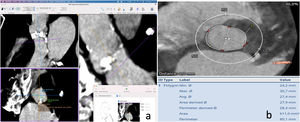
Zona de implanteLa zona de implante del dispositivo comprende las cúspides de la válvula, el anillo aórtico y el tracto de salida del ventrículo izquierdo (TSVI). Se ha demostrado que la presencia de calcificación a dicho nivel se asocia con un mayor riesgo de insuficiencia paravalvular9. En la práctica clínica, la descripción de calcificación anular (dentro del plano anular) y subanular (de 4 a 5mm superiores de la TSVI donde el dispositivo entra en contacto) se realiza casi exclusivamente de manera subjetiva y cualitativa clasificada como ninguna, leve, moderada, grave en función de la extensión circunferencial, la profundidad y el grosor de las calcificaciones. La calcificación anular y subanular debe describirse como media luna/plana/adherente o sobresaliente, así como su relación con las cúspides aórticas.
La región debajo del velo no coronaria/coronaria izquierda, incluida la fibrosa intervalvular, se ve afectada con mayor frecuencia. Los nódulos grandes de calcio que sobresalen pueden aumentar el riesgo de rotura anular, particularmente con válvulas expandibles con balón y, por lo tanto, se les debe prestar mucha atención10 (fig. 2).
a) Muestra la calcificación del anillo aórtico, a nivel de velo derecho; b y c) Se observa la intensa calcificación a nivel de dicho velo, así como en el tracto de salida del ventrículo izquierdo; d) Imagen de reconstrucción en modo VR, que muestra anatómicamente dicha calcificación, algo que nos puede dar idea del riesgo del implante en este caso.
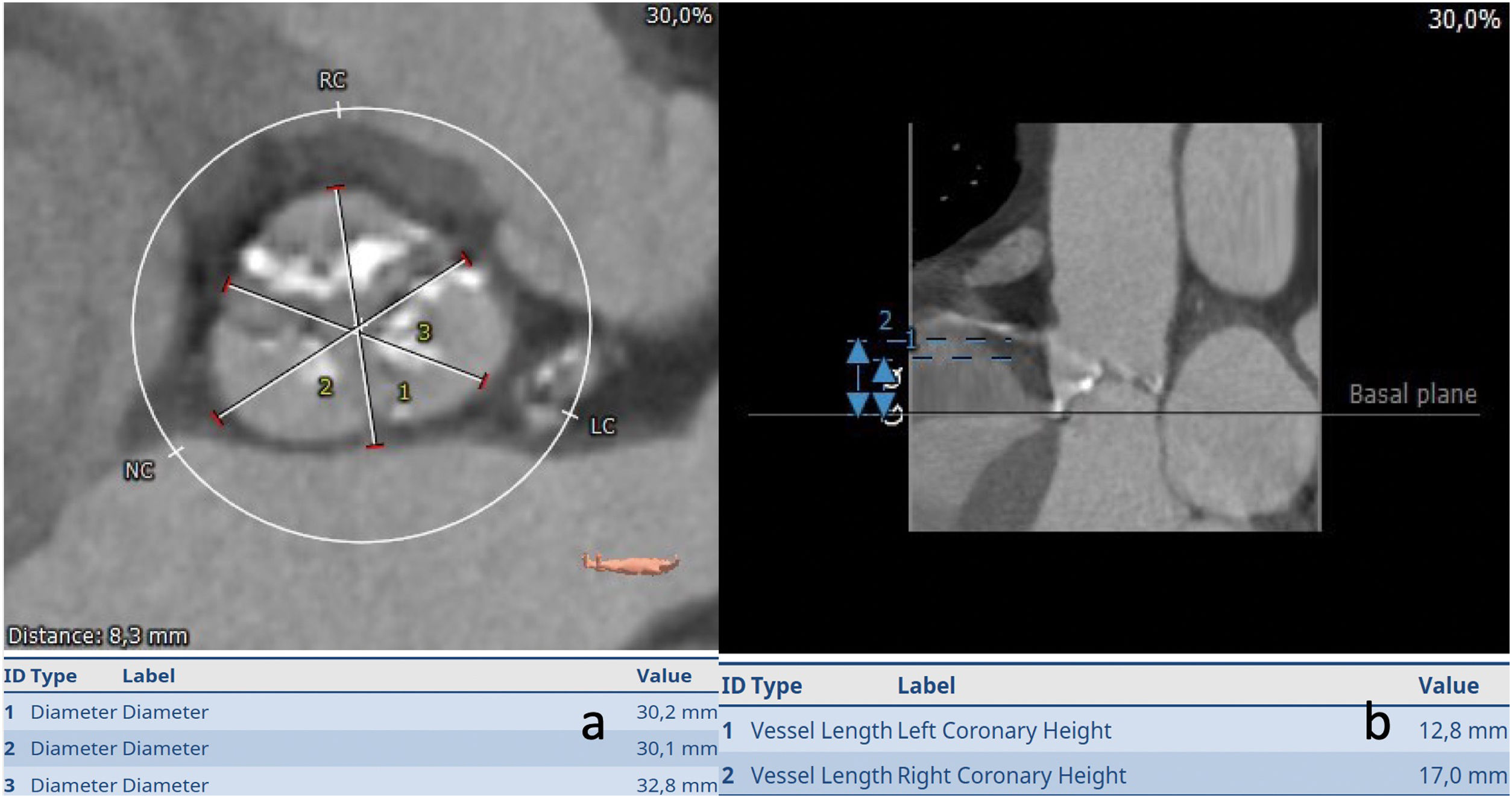
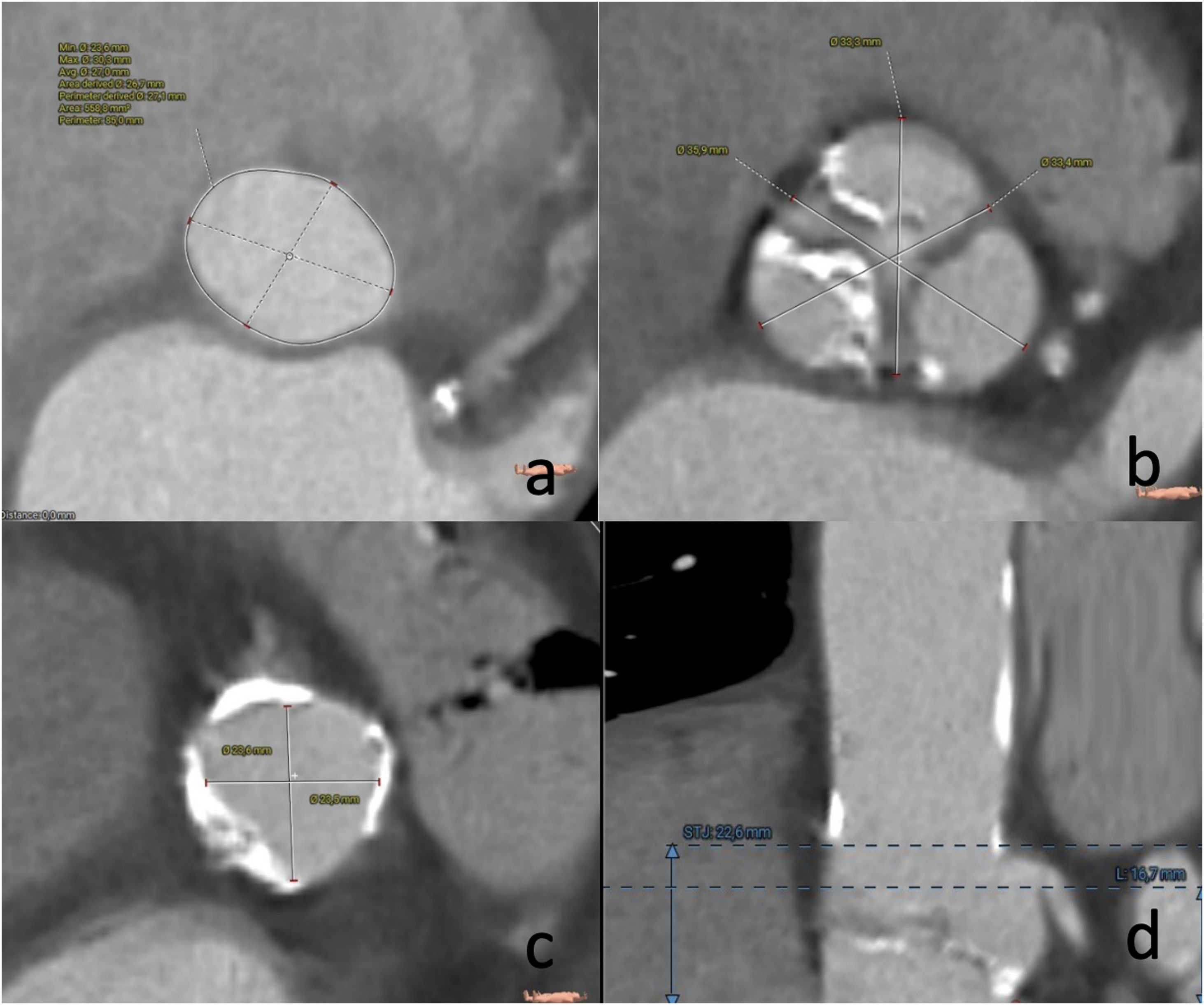
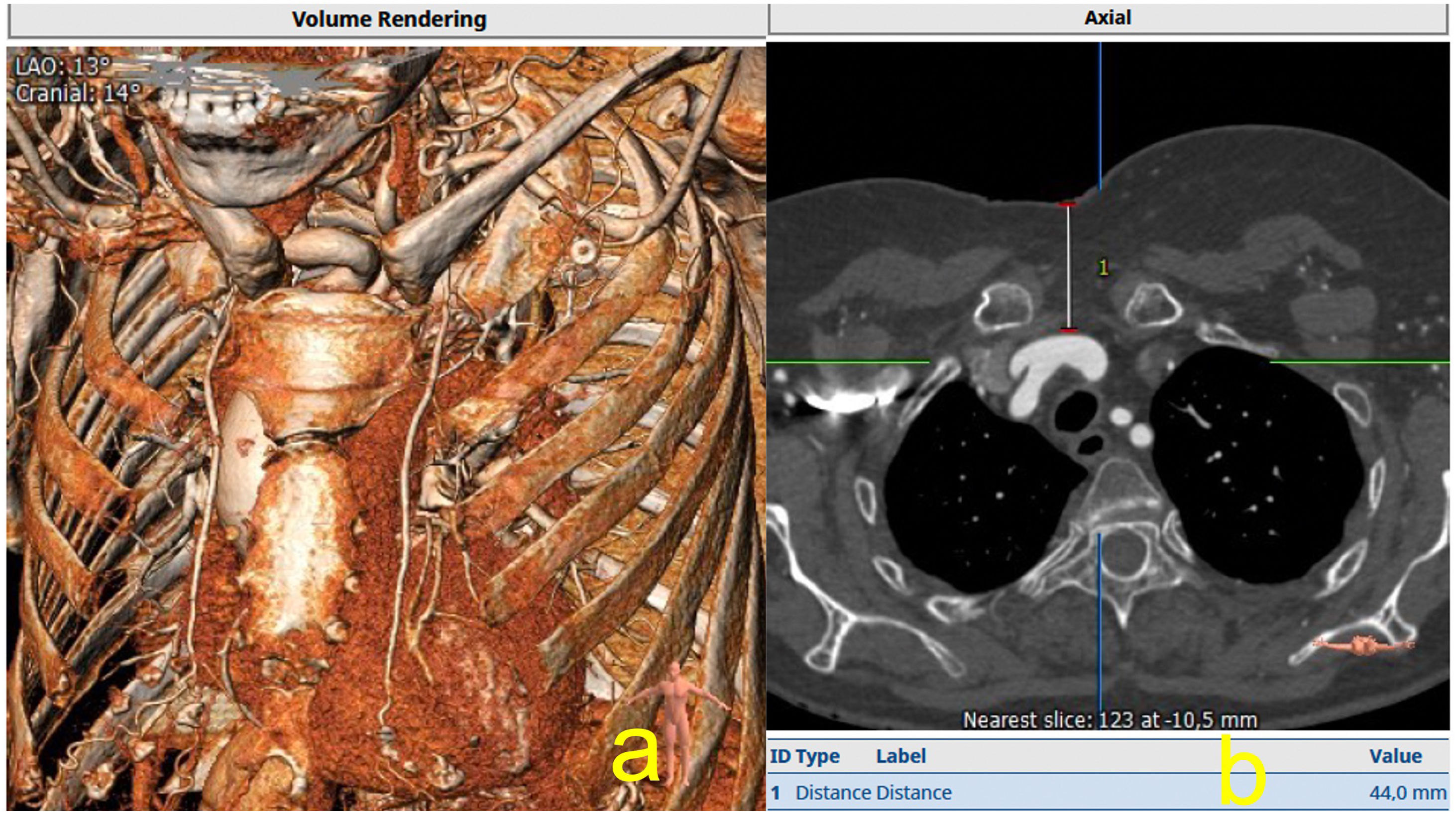
La oclusión coronaria es una complicación temida del TAVI que, aunque es relativamente rara con una incidencia del 0,66%, se asocia con un mal resultado clínico con una mortalidad reportada a 30 días de hasta el 40,9%11,12. La TAC está bien establecida como el estándar de oro para la determinación del riesgo de oclusión coronaria. La baja altura del ostial coronario (<10mm) desde el anillo y el diámetro medio de los senos de Valsalva <30mm connota un mayor riesgo de oclusión coronaria. Sin embargo, cabe señalar que no hay un umbral absoluto en el que el procedimiento deba considerarse contraindicado, dada la especificidad relativamente baja de estas mediciones, y por lo tanto la altura ostial coronaria no debe considerarse como una medida aislada del riesgo de oclusión. Más bien, los valores derivados para la altura coronaria y la anchura de los senos de Valsalva deben interpretarse en el contexto de las dimensiones anulares, las dimensiones generales de la raíz y el tamaño elegido de la prótesis a implantar (fig. 3).
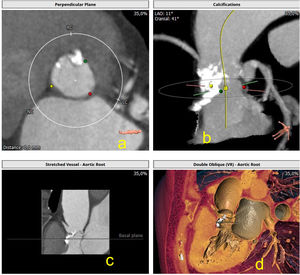
Unión sinotubularEl diámetro y la altura de la unión sinotubular son medidas relevantes para identificar anatomías de riesgo, en particular, en casos de usar prótesis balón expandibles en anatomías de baja altura y/o estrechamiento de la unión sintotubular (fig. 4).
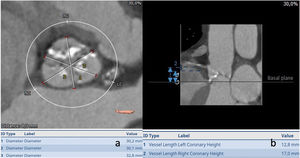
Caso real donde: a) La medida del anillo aórtico hace idóneo el empleo de la prótesis con balón expandible; b) Medida de los senos para evaluar riesgo de obstrucción coronaria; c) Se observa la intensa clasificación de la unión sinotubular con el riesgo que supone de rotura a dicho nivel, algo a tener en cuenta en el implante; d) Medidas de la altura de las arterias coronarias.
La aorta ascendente debe evaluarse para detectar la presencia de calcificaciones, zonas de estenosis o aneurismas que entrañan riesgos añadidos al procedimiento.
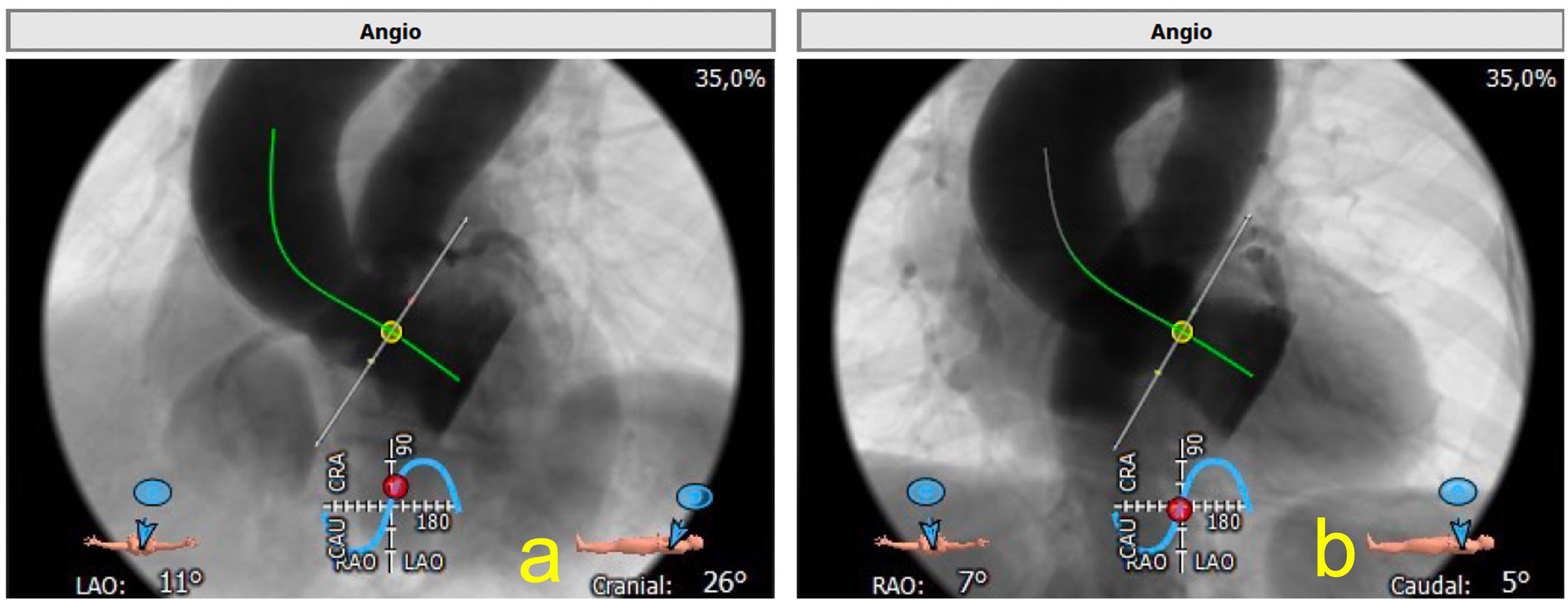
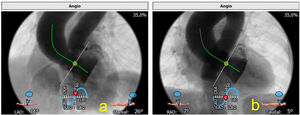
Curva de proyección óptimaIdealmente, el TAVI se realiza con angulaciones fluoroscópicas que proporcionan una vista coplanar del anillo aórtico. La TAC se puede utilizar para identificar estas angulaciones «óptimas». El uso de estas angulaciones derivadas de TAC permite reducir la exposición a la radiación, el uso del contraste y el tiempo de procedimiento. Se miden tanto la proyección coplanar como la llamada overlap que solapa el seno derecho con el izquierdo (fig. 5).
Análisis de acceso vascularLas complicaciones vasculares se asocian de forma independiente con un aumento de la morbimortalidad después del TAVI, sin embargo, las tasas de complicaciones han disminuido con una mejor detección previa al procedimiento con complicaciones vasculares mayores que actualmente ocurren en el 4,5% de los procedimientos13,14.
Se requiere un análisis del tamaño del vaso iliofemoral, la calcificación y la tortuosidad para determinar si se puede lograr el acceso transfemoral sin riesgos de complicaciones o si se requiere una ruta de acceso alternativa. Debido a su capacidad para cuantificar con precisión todos estos aspectos, la TAC proporciona un mayor valor predictivo para las complicaciones vasculares que la angiografía invasiva.
Los factores de riesgo para las complicaciones vasculares son un diámetro externo de la vaina que excede el diámetro mínimo de la arteria, la calcificación moderada o grave y la tortuosidad del vaso. De ahí que se deben medir todas esas variables, a nivel del eje iliofemoral, así como los ejes axilares y carotÍdeos, para valorar la mejor vía de acceso para el paciente en cuestión.
Análisis femoralEl análisis del acceso vascular femoral comprende la valoración del sitio de punción en los casos que se pretende la técnica percutánea o de la apertura quirúrgica. Para ello es muy importante valorar la bifurcación femoral, su altura, de manera general se pretende acceder al menos a 1cm superior a dicha bifurcación para poder implantar stent en caso de fallo del dispositivo de cierre, las calcificaciones a dicho nivel, sobre todo las calcificaciones anteriores que pueden predisponer al fallo de los sistemas de cierre basados en sutura. Es importante valorar la profundidad del vaso a dicho nivel, algo importante cuando se usa el sistema Manta para el cierre percutáneo.
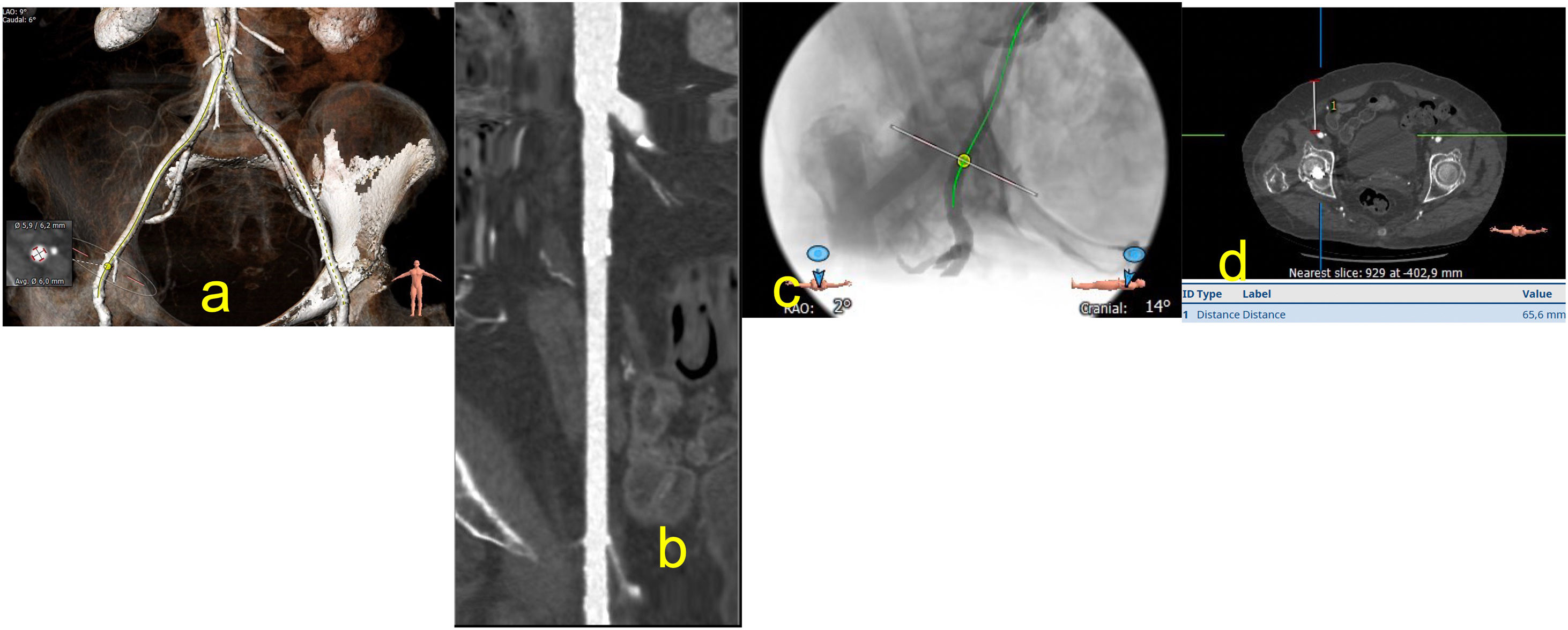
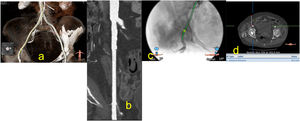
Se debe valorar el diámetro del vaso desde el sitio de punción hasta la aorta abdominal, sus calcificaciones y sus tortuosidades (fig. 6).
a) Imagen de reconstrucción en modo VR, del sitio de punción y las medidas de la arteria femoral a dicho nivel; b) Muestra la arteria diana desde la bifurcación femoral a la aorta abdominal, donde podemos evaluar los diámetros, las calcificaciones y los tombos; c) Muestra arteriografía del sitio de punción, sus relaciones con las estructuras vecinas, algo que facilita la punción en el sitio indicado; d) Imagen de corte axial a nivel del sitio de punción que nos muestra la profundidad de la arteria, dato importante en el caso del empleo del sistema de cierre percutáneo Manta.
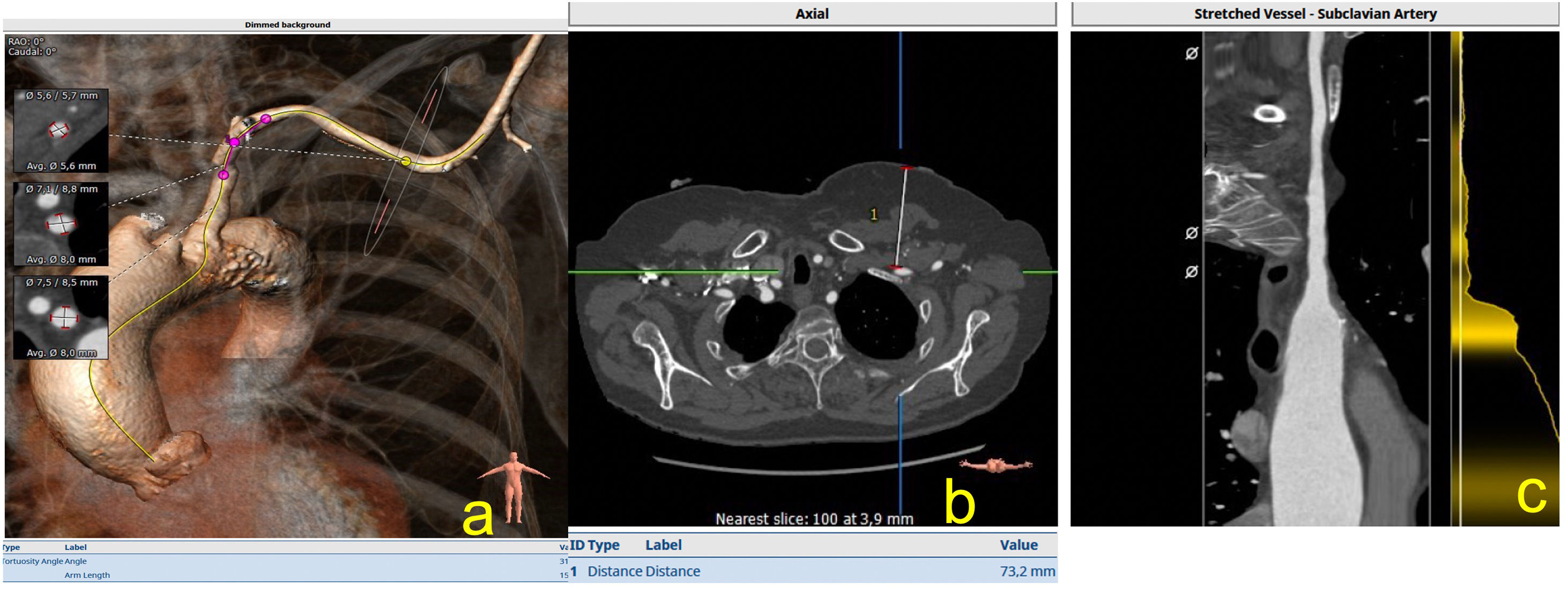
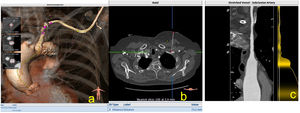
Se trata del segundo acceso que se emplea tras el femoral, en España la mayoría de los cirujanos emplean la apertura quirúrgica, aunque hay autores que realizan acceso percutáneo. Se trata de acceso que ha demostrado ser competitivo con el acceso femoral15, al igual que dicho acceso, hay que evaluar los diámetros, las calcificaciones y las tortuosidades, así como la profundidad a la que se encuentra la arteria axilar en la zona anterior al pectoral menor (fig. 7).
a) Imagen de reconstrucción en modo VR de las medidas, de las tortuosidades y el sitio de punción axilar; b) Corte axial que muestra la profundidad en el sitio de punción; c) Imagen en modo MPR, donde podemos evaluar la arteria axilar en toda su longitud hasta la aorta ascendente.
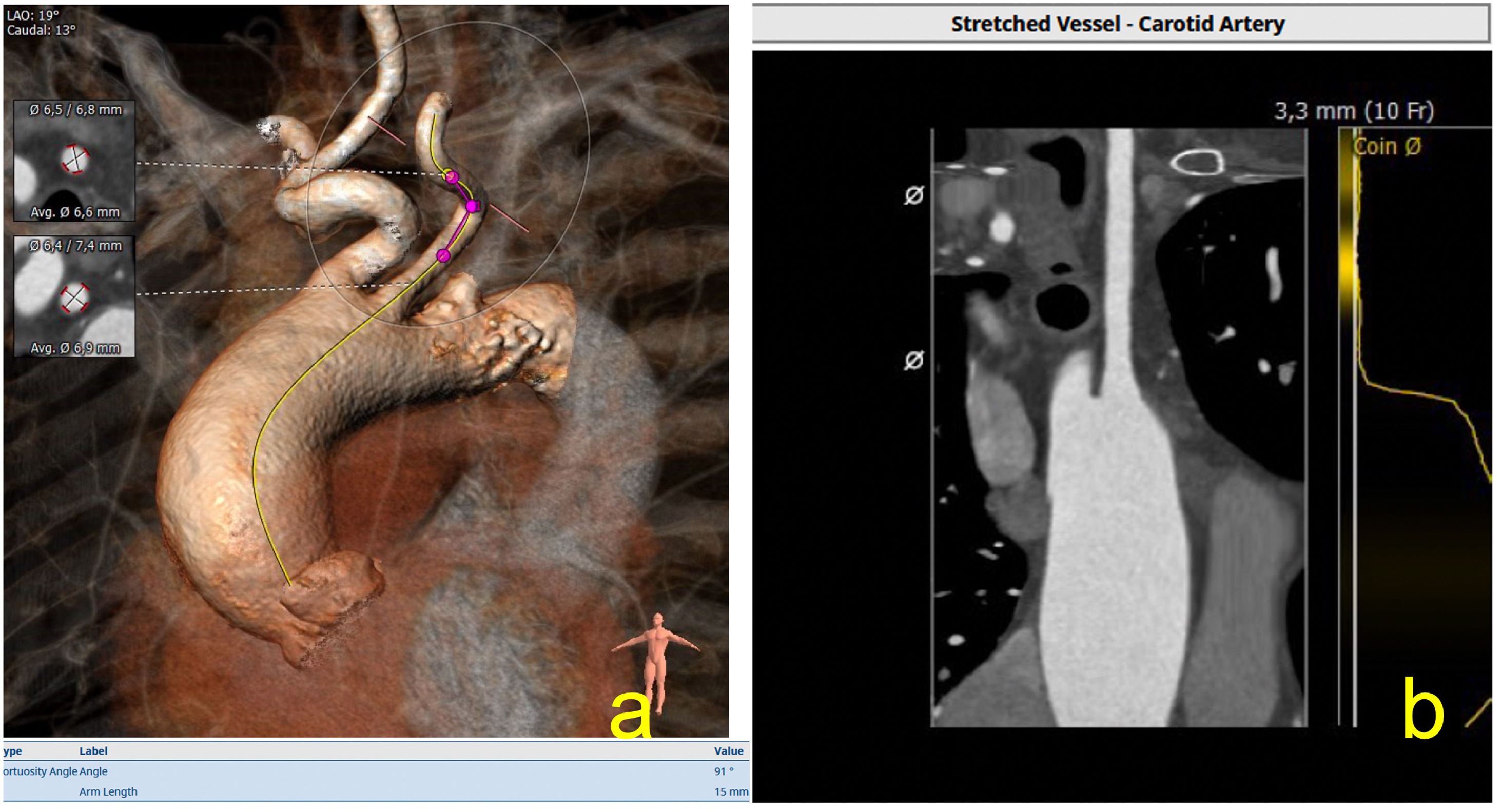
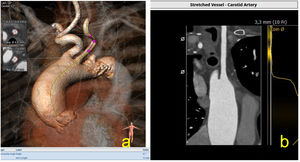
La arteria carótida se está convirtiendo en el tercer acceso en la técnica TAVI, con buenos resultados. Generalmente presenta buen calibre, poca tortuosidad y calcificación, algo que la hace atractiva sobre todo para las prótesis balón expandibles, ya que la guía alcanza el ventrículo por la curvatura menor aórtica, algo que hace del implante de las prótesis autoexpandibles algo más dificultosas de realizar (fig. 8).
a) Evaluación de la arteria carótida izquierda, aparte de evaluar las medidas de la arteria, es importante evaluar tortuosidades, algo que se puede realizar con el programa 3mensio®, se observa la intensa tortuosidad de este caso de más de 90°; b) Imagen de reconstrucción en modo MPR, donde se puede estudiar dicho vaso hasta la aorta ascendente.
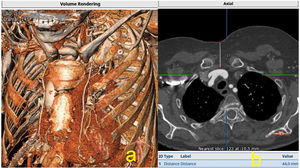
Se trata de un acceso interesante como alternativa a la falta de idoneidad del resto de vías, es importante analizar su profundidad y relación con el esternón. Usamos esa vía en 5 ocasiones, utilizando incisión transversa supraesternal, con buenos resultados. Es importante determinar su calibre, calcificaciones y profundidad. Al igual que la vía carotídea, es algo más idónea para el empleo de las prótesis balón expandibles (fig. 9).
Consideraciones éticasSe obtuvo el consentimiento de los pacientes, para la publicación de los datos relacionados con su cirugía.
Conflicto de interesesEl autor es Proctor Abbott Laboratories.