La cirugía abierta del aneurisma toracoabdominal es un procedimiento con alta morbilidad, así como una incidencia de daño medular y mortalidad preocupante. La experiencia de los centros, la adecuada planificación quirúrgica y el manejo perioperatorio son factores muy determinantes.
Objetivo y métodosEl objetivo del presente trabajo es describir, a propósito de 2 casos recientes de aneurisma toracoabdominal tipo 2 posdisección en Marfan, la estrategia quirúrgica en nuestro centro para la reparación quirúrgica abierta de forma retrógrada.
ResultadosEl abordaje fue toracorretroperitoneal con frenotomía circular parcial o completa, con uso de doble retractor. La estrategia de protección medular multimodal incluyó perfusión distal con dispositivo oxigenador de membrana extracorpórea, hipotermia ligera (32-34°C), drenaje de líquido cefalorraquídeo, pinzamiento aórtico secuencial, monitorización neurofisiológica intraoperatoria (potenciales somatosentivos y motores) y reimplante selectivo de arterias segmentarias. La reparación fue realizada de forma retrógrada (de distal a proximal), con la preparación previa de un injerto de dacron bifurcado y multirrama que reconstruyó la bifurcación ilíaca izquierda, los troncos viscerales de forma independiente y las arterias segmentarias con injerto paralelo de 10mm (técnica snake) con parche múltiple. La detección de alteraciones de potenciales motores modificó la agresividad del reimplante de arterias segmentarias con recuperación de los mismos tras su revascularización.
ConclusionesEl tratamiento de elección de los aneurismas toracoabdominales en el síndrome de Marfan es la cirugía abierta. Hay ciertas herramientas quirúrgicas que pueden ser especialmente útiles en estos casos, como la reparación retrógrada, los injertos protésicos multirrama y la técnica snake.
Thoracoabdominal aneurysm open repair is a high morbidity procedure, with worrisome spinal cord injury and mortality rate. The center experience, an adequate procedure planning and perioperative management are very determining factors for outcomes.
Objective and methodsThe objective of this article is to describe, in relation to 2 recent cases of post-dissection type 2 thoracoabdominal aneurysm in Marfan, the surgical strategy for retrograde open surgical repair in our center.
ResultsThoraco-retroperitoneal approach with circumferential phrenotomy (partial or complete) assisted by 2 simultaneous retractors was done. Multimodal strategy for spinal cord injury protection included: distal perfusion by extracorporeal membrane oxygenator device, mild hypothermia (32-34°C), spinal cord drainage, sequential aortic clamping, neurophysiological introperative monitoring (motor and somatosensory evoked potentials) and selective intercostal arteries reattachment. A retrograde fashion repair (from distal to proximal) was performed. A home-made dacron graft with a bifurcated graft and multibranched graft was previously made. It allowed to repair the left iliac bifurcation, visceral vessels independently and segmental arteries by a parallel 10mm dacron graft (Snake technique) with multipatch reimplantation. The loss of evoked potentials during the procedure guided and changed the agressivity of intercostal arteries reattachment, with recovery of the evoked potentials.
ConclusionsOpen repair is the first choice of therapy for thoracoabdominal aneurysms in Marfan syndrome. There are certain surgical adjuncts that could be especially useful in these cases such as retrograde fashion repair, multibranched prosthetic grafts and snake technique.
La cirugía abierta del aneurisma toracoabdominal (ATA) es de los procedimientos más agresivos en cirugía cardiovascular, con un alto índice de morbilidad (respiratoria 35,8-58%, cardíaca 26%, parálisis recurrencial izquierda 15-26%, renal 30,4%, ictus 8,4%)1,2,3, así como de daño medular permanente (2,6-9,5%) y mortalidad quirúrgica (6,4-33%)1,2,4. Actualmente, la incidencia de daño medular precoz es del 25-50% (en las primeras 24h o al despertar el paciente) y tardío del 50-75%1,4,5. El precoz tiene peor pronóstico (permanente>75%)6, y el tardío puede recuperarse (parcial o totalmente) hasta en un 66% de las ocasiones con la implementación del protocolo COPS (Cerebrospinal drain status, Oxygen delivery, Patient Status)6. La edad, la extensión del ATA, la insuficiencia renal previa, una fracción de eyección ventricular izquierda<30%, aneurismas degenerativos y cirugía no electiva son factores asociados a mortalidad hospitalaria2,7,8. La causa más frecuente de mortalidad hospitalaria es el fallo multiorgánico (67,5%)1. La supervivencia estimada tras la reparación abierta es de 83,5; 63,6; 36,8-50 y 18% a uno, 5, 10 y 15 años, respectivamente1,2. En disección crónica, la supervivencia es mayor que en los aneurismas degenerativos1.
La indicación por diámetro para cirugía abierta es de 60mm, o 55mm en centros de alta experiencia9,10. En conectivopatías se puede reducir el diámetro a 50mm, ya que el riesgo de disección o rotura es mayor11. La cirugía abierta es la técnica de elección en conectivopatías9. Los resultados en el síndrome de Marfan son excelentes11, con mortalidad<6% y libertad de fallo de reparación a 10 años de 82-90%.
Los resultados del tratamiento endovascular del ATA12, actualmente, son competitivos comparados con la cirugía abierta, al menos en centros de alto volumen, con una mortalidad hospitalaria similar (7,4 vs. 8,9%), daño renal agudo menor (11,7 vs. 21,7%), pero con mayor daño medular (13,5 vs. 7,4%), si bien la parálisis permanente es similar (5,2 vs. 4,4%). Aunque la mayor necesidad de reintervenciones y la incertidumbre de la durabilidad a largo plazo son inconvenientes.
Objetivo y métodosSe presenta la estrategia quirúrgica en nuestro centro para la reparación quirúrgica abierta de forma retrógrada, con injerto multirrama, reimplante de arterias intercostales con técnica snake y reconstrucción ilíaca, a propósito de 2 casos recientes de ATA tipo 2 posdisección en síndrome de Marfan. Se describirá, paso a paso, dicho procedimiento, incluyendo consideraciones de utilidad. Además, se reportarán las características específicas de cada caso clínico.
ResultadosMonitorización y preparación anestésica- •
Drenaje de líquido cefalorraquídeo (implante el día previo) con sistema de monitorización de presión continua LiquoGuard® (Möller Medical GmbH, Fulda, Alemania) para presión objetivo<10mmHg.
- •
Potenciales evocados somatosensoriales (PESS) y motores (PEM).
- •
Tubo endotraqueal de doble luz.
- •
Presión arterial invasiva: radial derecha y femoral derecha.
- •
Presión arterial no invasiva en brazo izquierdo.
- •
Punción ecoguiada de introductores 6Fr en vena femoral bilateral.
- •
Sonda nasofaríngea de temperatura.
- •
Vía central (alto volumen-introductor Swan-Ganz) con calentador de líquidos e infusor de alto flujo.
- •
Ecocardiografía transesofágica.
- •
Oximetría cerebral y somática INVOS™ e índice biespectral.
- •
Palas externas adhesivas de desfibrilador.
- •
Colchón calefaccionado de aire y de agua.
El paciente se coloca en decúbito lateral derecho (tórax 60-90°, pelvis 30-45°), sobre un colchón de vacío (bean bag) y la mesa se flexiona a nivel de xifoides.
Se realiza una incisión curvilínea izquierda por debajo de la punta de la escápula, cruzando el margen costal y con trayecto pararrectal. Dicha incisión puede ser ampliada superiormente entre la escápula y la línea media de la columna, o inferiormente en la fosa ilíaca izquierda.
El nivel del espacio intercostal puede ser útil planificarlo con la imagen 3D obtenida de la tomografía axial computarizada (TAC). El 6.o espacio es la opción más versátil. El 5.o espacio puede mejorar el campo para anastomosis en el arco (zona 0-3), especialmente si se trata de anatomías complejas. El 7.o espacio puede ser suficiente para anastomosis en la zona 4 distal o zona 5. Las costotomías posteriores de costilla superior y/o inferior evitan fracturas yatrógenas y optimizan el campo.
Al cruzar el margen costal se inicia la apertura de la pared abdominal y se alcanza el plano retroperitoneal. Posteriormente, se secciona el reborde costal resecando un fragmento osteocartilaginoso de aproximadamente 2-3cm.
La frenotomía circunferencial se va realizando progresivamente conforme se va exponiendo el diafragma en la cara abdominal al ir liberando el plano retroperitoneal. Se identifica la entrada del nervio frénico en el diafragma para evitar lesiones accidentales. Para la reconstrucción posterior del diafragma, es recomendable realizar su sección a unos 3cm de su inserción en la pared costal, así como ir colocando puntos de referencia a ambos lados de la frenotomía. Si se realiza una frenotomía parcial3,8, se mantiene una zona intermedia, solo seccionando la parte más anterior y la crura diafragmática. La frenotomía parcial mejora la función respiratoria y el cierre del diafragma, y suele permitir trabajar adecuadamente.
La sección del ligamento pulmonar inferior, cuyo límite superomedial es la vena pulmonar inferior izquierda, así como la liberación de adherencias pulmonares, nos permite movilizar el pulmón izquierdo favoreciendo el acceso. El bisturí bipolar LigaSure Maryland 23cm (Covidien-Valleylab, Boulder, CO, EE. UU.) facilita una disección más hemostática de ello, así como del tejido periaórtico. Si se precisa control del arco aórtico o de la zona 3, se localiza el nervio frénico izquierdo proximal, así como el nervio vago izquierdo pre/posrecurrencial y el recurrente. La sección del nervio vago posrecurrencial puede ser útil en ciertas ocasiones. El control de la arteria subclavia izquierda a 1-3cm del ostium es más fácil, especialmente en aneurismas próximos a ella. La TAC nos informa del origen de la arteria vertebral izquierda y la distancia al ostium de la arteria subclavia izquierda (habitualmente a unos 4cm), de su dominancia o de variantes anatómicas que puedan tener implicaciones en la estrategia quirúrgica. La sección del ligamento arterioso en el suelo del arco es útil para el pinzamiento en la zona 2, o incluso en la zona 1.
El plano retroperitoneal idóneo (casi avascular) respeta la fascia transversalis que queda junto al resto de la pared. El músculo psoas es una marcador anatómico del trayecto adecuado. El riñón izquierdo se moviliza en anterior (acceso aórtico retrorrenal), así como su uréter y el resto del paquete visceral (bazo, páncreas y paquete intestinal). Ocasionalmente se deja el riñón in situ (acceso aórtico prerrenal), como en la existencia de vena renal izquierda retroaórtica.
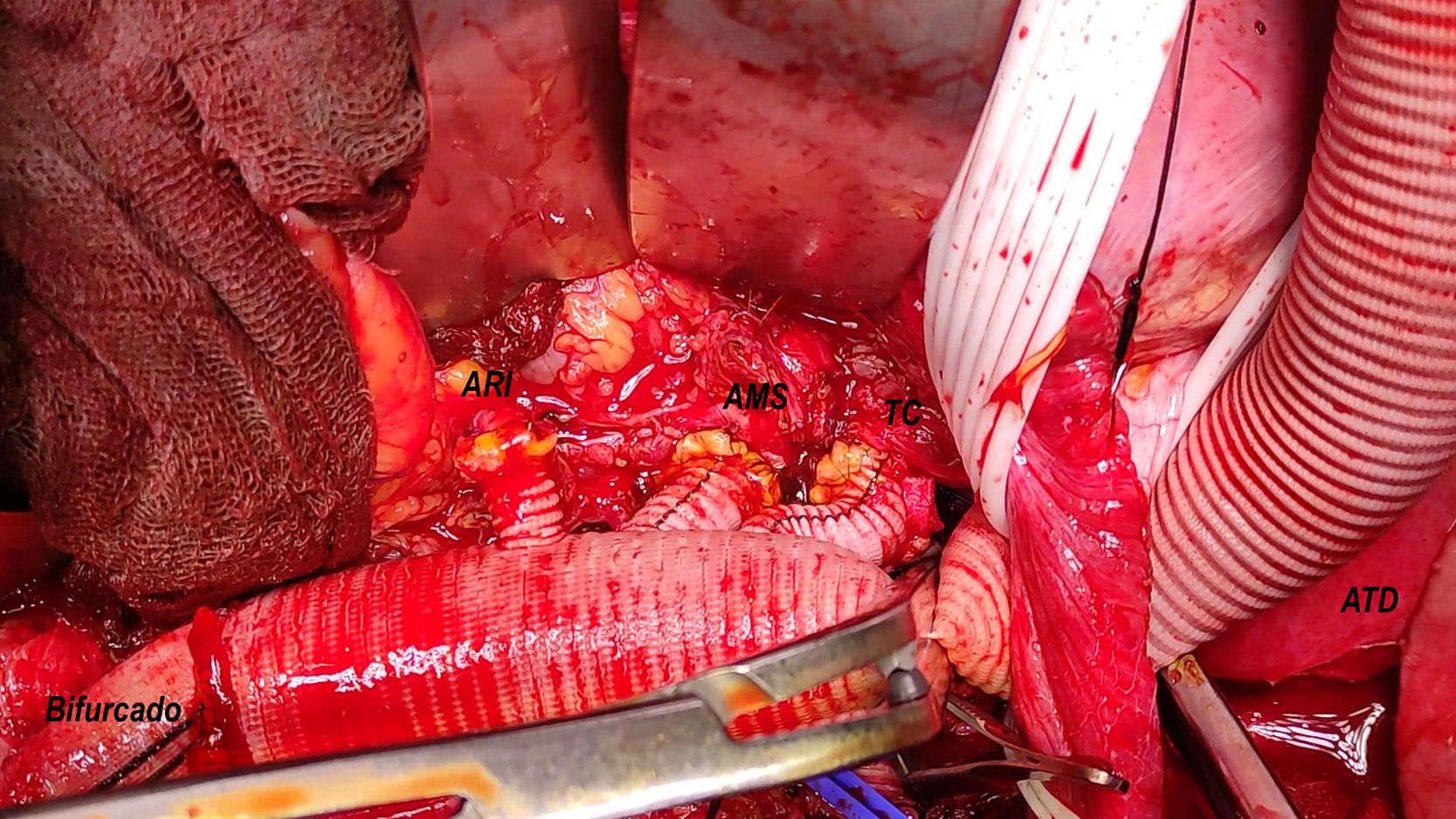
A continuación se expuso la aorta infradiafragmática con 4 elementos clave para ello: primero, la identificación de la arteria ilíaca común izquierda o su bifurcación; segundo, la sección del pilar diafragmático izquierdo; tercero, la identificación de la arteria renal izquierda y su ostium, habitualmente en la cara lateral izquierda de la aorta e inmediatamente distal a donde cruza el pilar diafragmático izquierdo a la aorta visceral; cuarto, la sección de la vena renolumbar izquierda (normalmente inmediatamente caudal a la arteria renal izquierda), la cual puede ser causa de sangrado desde la vena renal izquierda por un mal manejo. Posteriormente, se libera la aorta infrarrenal y se realiza el control del resto de los vasos viscerales, excepto la arteria renal derecha (endoluminal). El control de la arteria ilíaca común derecha habitualmente es endoluminal.
Finalmente, si es posible anatómicamente, se realiza el control de los vasos segmentarios torácicos y lumbares accesibles del lado izquierdo, así como de las zonas aórticas de pinzamiento.
Para el abordaje se utilizan 2 retractores FastSystem® Vascular Retractor System VF400 (Omni-Tract Surgical, St. Paul, EE. UU.).
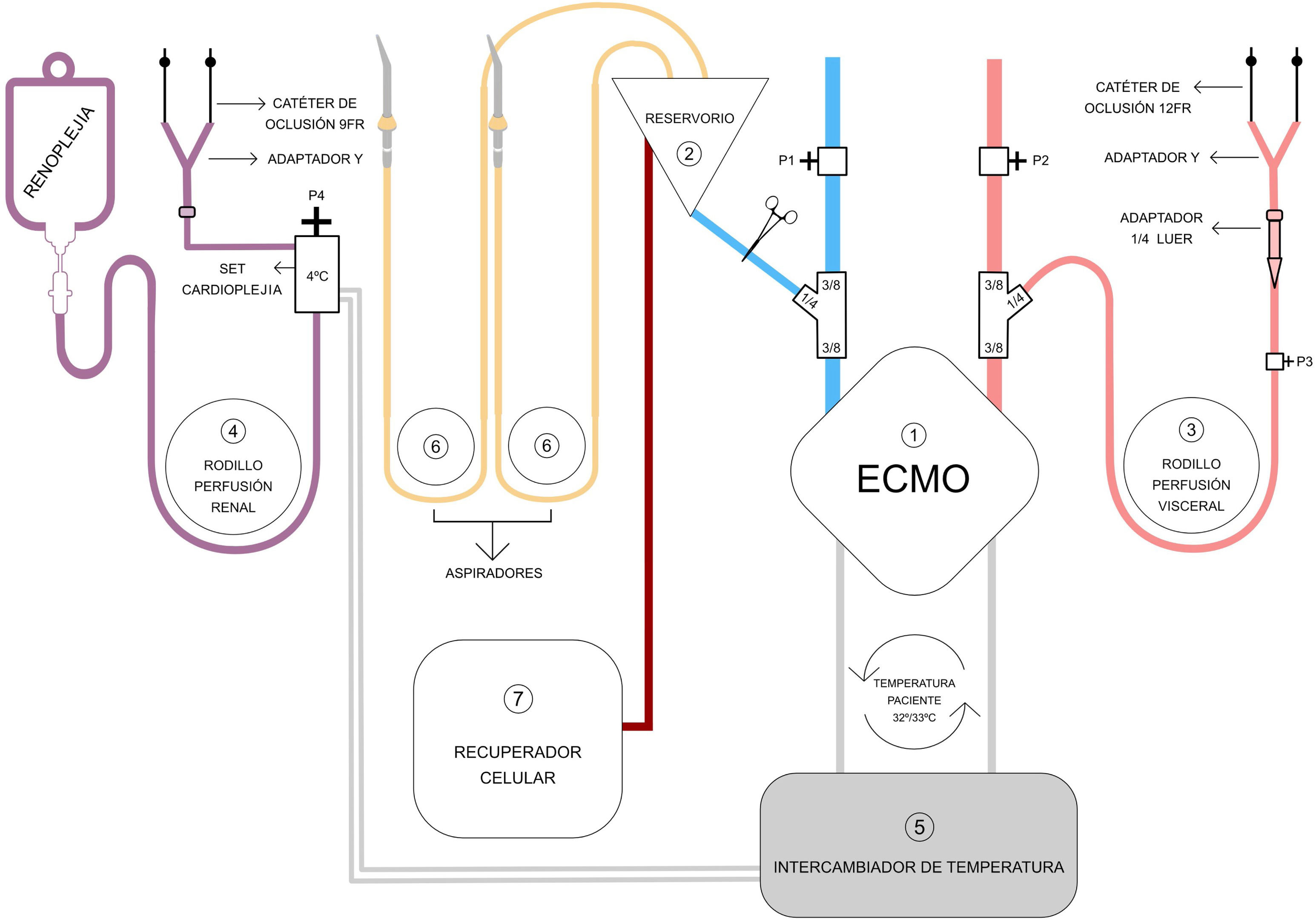
Sistema de perfusión (fig. 1, tablas 1 y 2)El sistema de perfusión se realiza con circuito extracorporeal membrane oxigenator (ECMO, «oxigenador de membrana extracorpórea») de corta duración (membrana microporosa) con tubuladuras 3/8-3/32 con recubrimiento biocompatible.
Componentes del circuito de perfusión híbrido. Circuito oxigenador de membrana extracorpórea (ECMO) de corta duración Maquet Cardiohelp® (1). En azul, la línea venosa de drenaje, con monitorización de la presión (P1), y con una conexión 3/8-3/8-1/4 de derivación al reservorio (2) para introducción de volumen. En rojo, la línea arterial de retorno, con monitorización de la presión sistémica (P2), y con una conexión 3/8-3/8-1/4 que sirve para derivar sangre oxigenada al rodillo para la perfusión visceral (3), cuya presión también está monitorizada (P3). El rodillo de perfusión renal o de renoplejía (4) es independiente; utiliza un sistema de distribución de cardioplejía también con monitorización de la presión (P4). El intercambiador de temperatura (5) sirve para el circuito ECMO y para el circuito de renoplejía. Adicionalmente, se usan rodillos de aspiración del campo quirúrgico (6) y recuperador celular (7) conectados al reservorio.
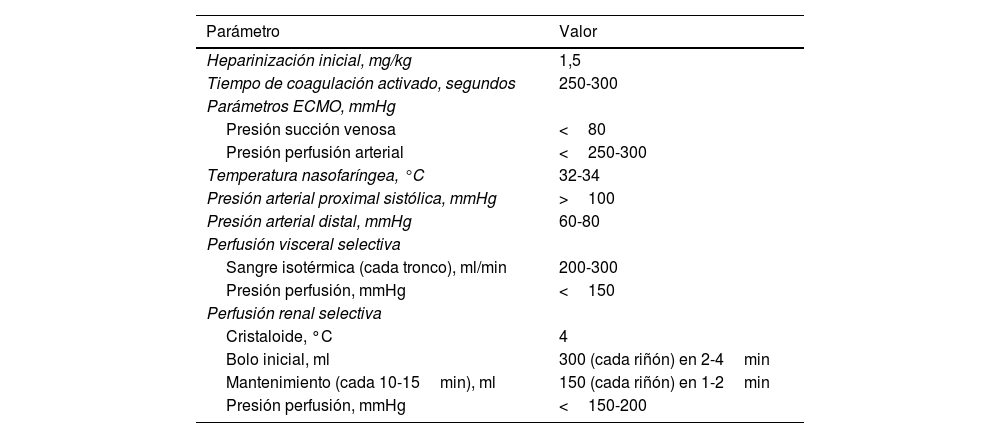
Parámetros-objetivo del sistema de perfusión
| Parámetro | Valor |
|---|---|
| Heparinización inicial, mg/kg | 1,5 |
| Tiempo de coagulación activado, segundos | 250-300 |
| Parámetros ECMO, mmHg | |
| Presión succión venosa | <80 |
| Presión perfusión arterial | <250-300 |
| Temperatura nasofaríngea, °C | 32-34 |
| Presión arterial proximal sistólica, mmHg | >100 |
| Presión arterial distal, mmHg | 60-80 |
| Perfusión visceral selectiva | |
| Sangre isotérmica (cada tronco), ml/min | 200-300 |
| Presión perfusión, mmHg | <150 |
| Perfusión renal selectiva | |
| Cristaloide, °C | 4 |
| Bolo inicial, ml | 300 (cada riñón) en 2-4min |
| Mantenimiento (cada 10-15min), ml | 150 (cada riñón) en 1-2min |
| Presión perfusión, mmHg | <150-200 |
ECMO: extracorporeal membrane oxygenator («oxigenador de membrana extracorpórea»).
Cánulas del sistema de perfusión
| Localización | Tipo de cánula |
|---|---|
| Cánula venosa (drenaje) | 23 o 25Fr multiperforada Bio-Medicus® Life-Support (Medtronic)Percutánea en vena femoral (ETE guiada) |
| Cánulas viscerales (perfusión visceral selectiva) | Cánula retrógrada de inflado manual de silicona DLP 15Fr (Medtronic)AlternativaPruitt® 12Fr (LeMaitre Vascular, Burlington, EE. UU.)Pruitt® 9Fr (en vasos más pequeños) |
| Cánulas renales (perfusión renal selectiva) | Pruitt® 9FrAlternativa (vasos más pequeños)Cánula de perfusión ostial coronariaJeringa urológica 50cc (bolos directos) |
ECMO: extracorporeal membrane oxygenator («oxigenador de membrana extracorpórea»); ETE: ecografía transesofágica.
Se realiza perfusión visceral selectiva con sangre oxigenada isotérmica desde la línea arterial del circuito ECMO mediante un tubo de 1/4 bombeada por un rodillo independiente.
La perfusión renal selectiva o renoplejía se realiza con solución cristaloide a 4°C de Ringer lactato (1l), manitol al 20% (12,5g/l) y metilprednisolona (125mg/l)14.
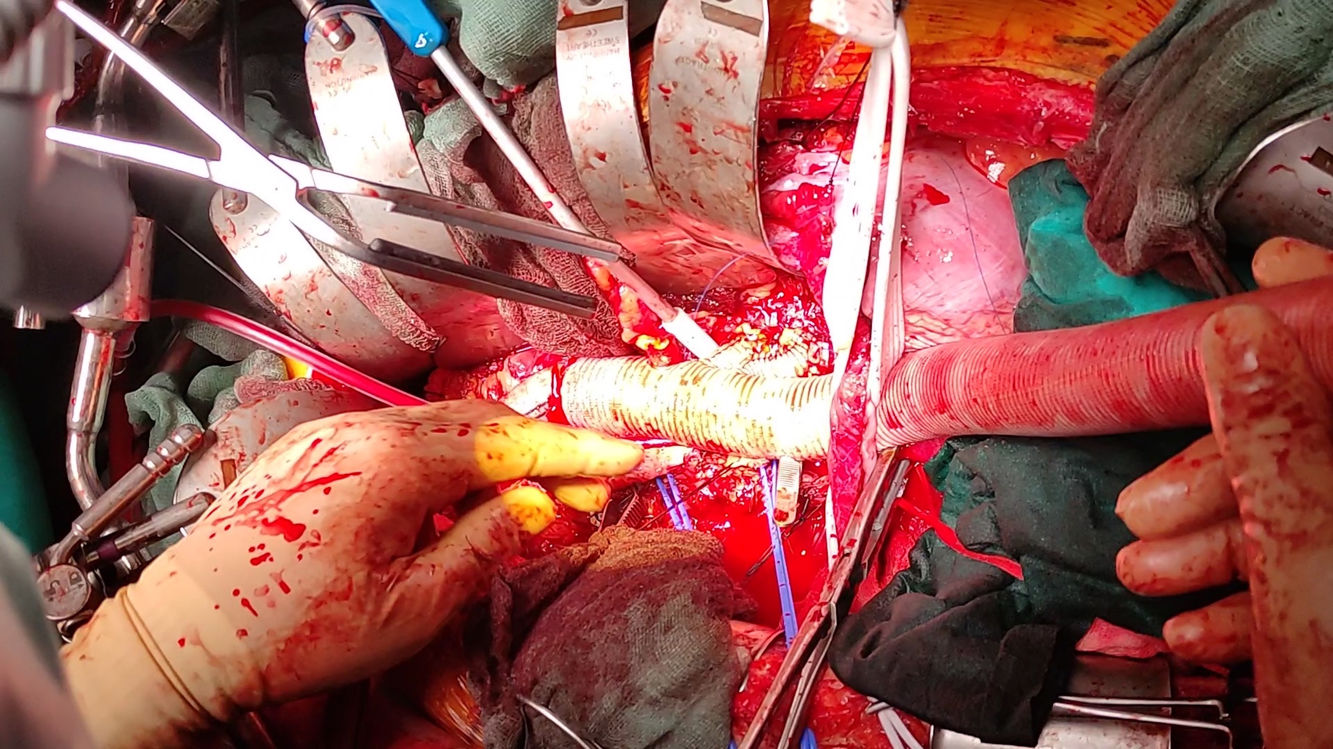
Estrategia quirúrgica retrógradaSe construye un injertohome-made a medida de una prótesis bifurcada knitted dacron con un injerto multirrama woven dacron, añadiendo una rama lateral de 10mm de perfusión (fig. 3), y se impregna en una solución de rifampicina (1.800mg en 100ml de suero fisiológico).
Tras la heparinización sistémica se realiza la canulación venosa femoral percutánea.
Con el pinzamiento aislado de la arteria ilíaca izquierda (común, hipogástrica y externa), se realiza la anastomosis distal término-terminal con monofilamento 4/0 en la bifurcación ilíaca izquierda, permitiendo en dicho momento el inicio de la perfusión ECMO (solo en el miembro inferior izquierdo a bajo flujo).
Posteriormente, con el pinzamiento infrarrenal se ocluyen las lumbares bajas y mesentérica inferior, y se efectúa la anastomosis distal término-terminal con monofilamento 4/0 en la ilíaca común derecha, iniciando así la perfusión ECMO en la ilíaca bilateral.
Se pinza el supracelíaco y se abre la aorta visceral, se canulan los vasos renoviscerales para su perfusión selectiva y se controlan las arterias segmentarias locales (bulldog externo, vessel loop y/o Fogarty endoluminal n.o 3-4). A continuación, se efectúan las anastomosis término-terminales con monofilamento de 4/0 o 5/0 y reperfusión secuencial por el ECMO de los vasos renoviscerales (renal derecha, mesentérica superior, renal izquierda y tronco celíaco). El orden puede modificarse según las características específicas, pero la renal derecha suele ser la primera.
Tras el tiempo abdominal, se realiza el pinzamiento de la aorta torácica descendente media, la apertura aórtica y el control de las segmentarias. A continuación, se lleva a cabo el pinzamiento proximal aórtico en la zona 1-4 (según el caso) y se realiza la anastomosis proximal término-terminal con monofilamento de 3/0 o 4/0 (con/sin tira de teflón externa). Con el despinzamiento aórtico se reanuda el flujo pulsátil distal.
Si no ha habido previamente alteraciones significativas de los PESS/PEM, se realiza el reimplante de las arterias segmentarias (técnica snake); en cambio, si hubiera habido alteraciones sin respuesta a maniobras correctoras de isquemia medular, se adelantaría dicho reimplante. En la técnica snake, se dispone un injerto de dacron de 10mm de forma paralela y se reimplantan las segmentarias (en una o más pastillas) habitualmente entre T7-L2 con monofilamento 4/0. El número y qué segmentarias se decide en el campo quirúrgico en función de los hallazgos PESS/PEM y las características de la pared aórtica, aunque un análisis pormenorizado de la TAC puede ser útil. Tras la anastomosis de las segmentarias se inicia la perfusión del snake (200-300ml/min) por un cabo del injerto. Se finaliza con las anastomosis proximal y distal del snake con monofilamento 4/0 en el injerto aórtico (con pinzamiento parcial) o en una rama lateral del mismo, buscando la morfología óptima para evitar acodamientos.
Tras la normotermia, se finaliza la perfusión con ECMO, se retiran las cánulas, se revierte coagulación con protamina y hemoderivados, así como se realiza hemostasia exquisita. Se cubre el injerto a nivel torácico con saco aneurismático y/o pericardio bovino, se colocan 3 drenajes torácicos y un redón abdominal. El diafragma se cierra con sutura continua y puntos en U de monofilamento reabsorbible n.o 1, la toracotomía con 2 bandas Ortholox® UHMWPE (Ortolog Medical Innovations, Yenimahalle/Ankara, Turquía) y múltiples puntos percostales reabsorbibles loop n.o 1 o 2, así como la pared abdominal (mono/biplano) con monofilamento reabsorbible loop n.o1.
Recientemente, en nuestro centro, se intervinieron 2 pacientes con síndrome de Marfan en los que se realizó una reparación abierta retrógrada de ATA tipo 2, conforme se ha desarrollado en los párrafos previos. Se describen sus características preoperatorias, así como aspectos relevantes intraoperatorios y postoperatorios de ambos casos clínicos (tablas 3–5).
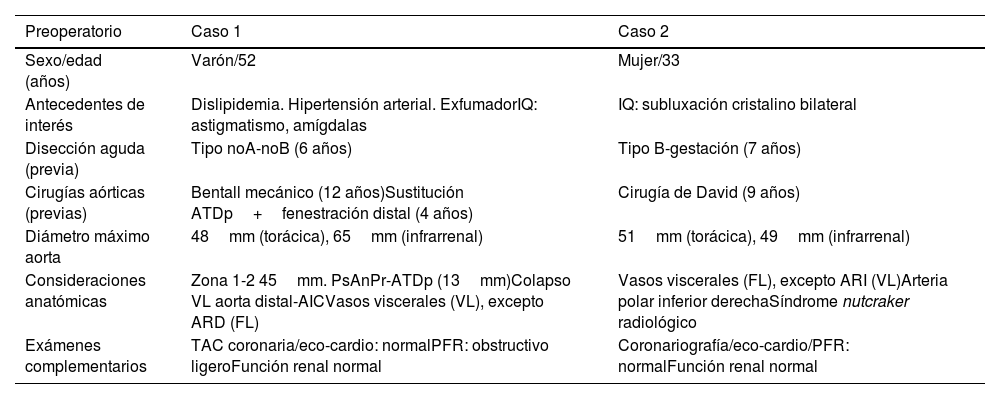
Características específicas preoperatorias de los casos clínicos
| Preoperatorio | Caso 1 | Caso 2 |
|---|---|---|
| Sexo/edad (años) | Varón/52 | Mujer/33 |
| Antecedentes de interés | Dislipidemia. Hipertensión arterial. ExfumadorIQ: astigmatismo, amígdalas | IQ: subluxación cristalino bilateral |
| Disección aguda (previa) | Tipo noA-noB (6 años) | Tipo B-gestación (7 años) |
| Cirugías aórticas (previas) | Bentall mecánico (12 años)Sustitución ATDp+fenestración distal (4 años) | Cirugía de David (9 años) |
| Diámetro máximo aorta | 48mm (torácica), 65mm (infrarrenal) | 51mm (torácica), 49mm (infrarrenal) |
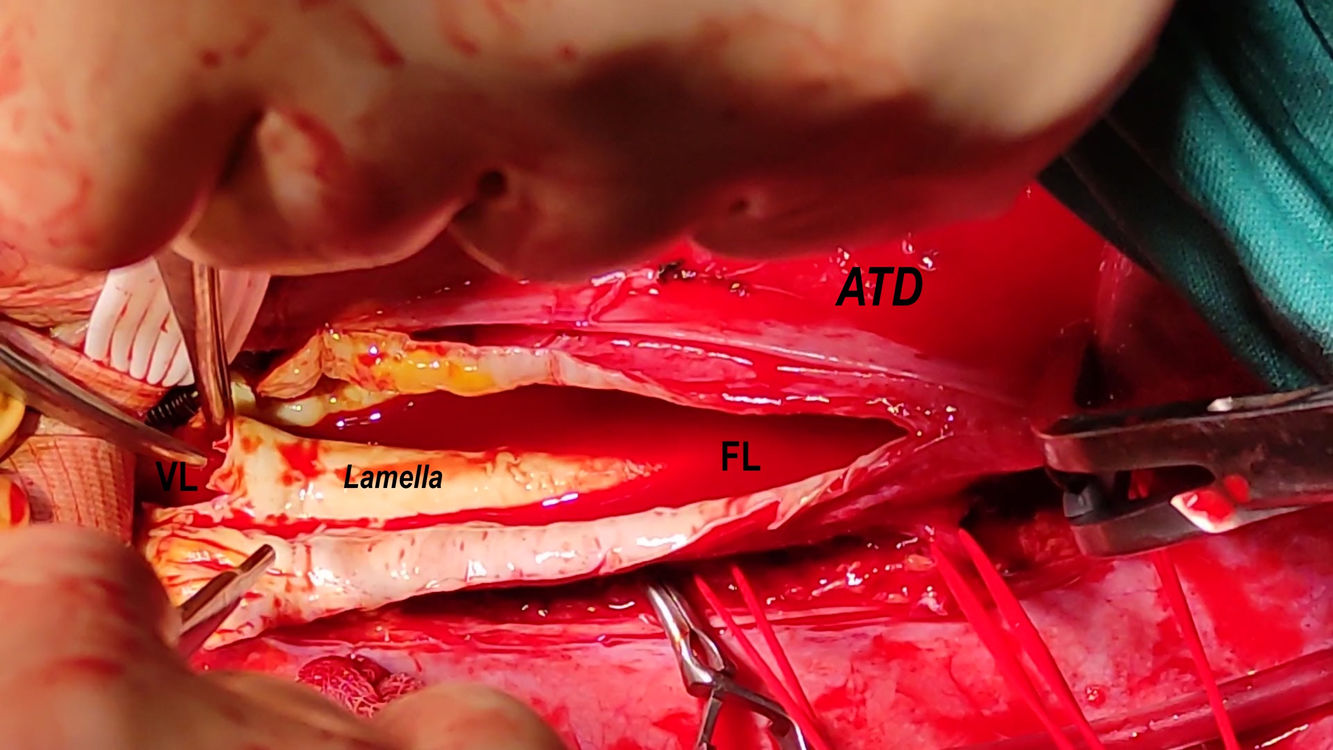
| Consideraciones anatómicas | Zona 1-2 45mm. PsAnPr-ATDp (13mm)Colapso VL aorta distal-AICVasos viscerales (VL), excepto ARD (FL) | Vasos viscerales (FL), excepto ARI (VL)Arteria polar inferior derechaSíndrome nutcraker radiológico |
| Exámenes complementarios | TAC coronaria/eco-cardio: normalPFR: obstructivo ligeroFunción renal normal | Coronariografía/eco-cardio/PFR: normalFunción renal normal |
AIC: arteria ilíaca común; ARI: arteria renal izquierda; ARD: arteria renal derecha; ASI: arteria subclavia izquierda; ATDp: aorta torácica descendente proximal; FL: falsa luz; IQ: intervención quirúrgica; PFR: pruebas funcionales respiratorias; PsAnPr: pseudoaneurisma anastomosis proximal; TAC: tomografía axial computarizada; VL: verdadera luz.
Aspectos relevantes intraoperatorios de los casos clínicos
| Intraoperatorio | Caso 1 | Caso 2 |
|---|---|---|
| Acceso | 7.o espacio (reintervención) | 6.o espacio |
| Frenotomía circunferencial | Completa | Parcial |
| Canulación venosa percutánea | Femoral derecha | Femoral izquierda |
| Canulación arterial | Injerto (postanastomosis ilíaca izquierda) | Injerto (postanastomosis ilíaca izquierda) |
| Home-made graft (dacron) | Coselli 30mm+bifurcado 20×10×10mm | Coselli 28mm+bifurcado 20×10×10mm |
| Anastomosis proximal | Zona 4 (injerto previo) | Zona 3-4+trompa elefante reversa |
| Anastomosis distal | AICD media (+fenestración)+Bf-AICI | AICD proximal+Bf-AICI |
| Snake (segmentarias) | Dacron 10mm, 2 parches (T8-L2) | Dacron 10mm, 3 parches (T7-L2) |
| Tiempo ECMO, minutos | 186 | 344 |
| PESS/PEM | Caída PESS/PEM (pinza proximal), recuperación PEM/PESS con snake, excepto la latencia PEM-MII | Caída PEM (pinza proximal), recuperación PEM con snake |
| Otras consideraciones | Líquido mínimo periinjerto previo de ATD (lavado con rifampicina+cultivo) | Rotura ostial-reimplante polar derecha por canulación forzada |
AICD: arteria ilíaca común derecha; ATD: aorta torácica descendente; Bf-AICI: bifurcación de la arteria ilíaca común izquierda; ECMO: extracorporeal membrane oxygenator («oxigenador de membrana extracorpórea»); MII: miembro inferior izquierdo; PEM: potenciales evocados motores; PESS: potenciales evocados somatosensoriales.
Aspectos relevantes postoperatorios de los casos clínicos
| Postoperatorio | Caso 1 | Caso 2 |
|---|---|---|
| Estancia UCI/hospitalaria, días | 4/19 | 5/16 |
| Extubación, horas | <24 | <24 |
| Complicaciones intrahospitalarias | IRA transitoria (creatinina pico 2,3mg/dl)Síndrome febril sin focoParaparesia 3/5, déficit sensitivo ciático MID | IRA transitoria (creatinina pico 2mg/dl)Parálisis recurrencial izquierdaSíndrome febril sin foco |
| TAC (prealta) | Snake permeable | Snake permeable. Trombosis arteria polar derecha |
| Seguimiento, meses | 7 | 3 |
| Secuelas | Radiculopatía lumbosacra (cauda equina)Incontinencia rectal controladaEyaculación precoz/no disfunción eréctilParestesias MID. Fuerza 4-5/5 (MID peor) | Disfonía (mejoría progresiva) |
IRA: insuficiencia renal aguda; MID: miembro inferior derecho; TAC: tomografía axial computarizada; UCI: Unidad de Cuidados Intensivos.
Como comentarios de relevancia de los casos clínicos cabe destacar:
Caso 1 (Figuras 2, 3, 4). El paciente presentó un déficit sensitivo a nivel ciático derecho inmediato; posteriormente, con el intento de bipedestación-deambulación se detectó una debilidad y dificultad en la misma. Estos hallazgos traducían una paraparesia (escala de Tarlov modificada 3/5) que no fue sospechada como potencial lesión neurológica y, por tanto, no se activó el protocolo Cerebrospinal drain status, Oxygen delivery, Patient Status. El diagnóstico del daño neurológico fue tardío (a los 2 meses), si bien el inicio de la rehabilitación desde la Unidad de Daño Medular ha permitido que progresivamente siga mejorando a nivel motor (escala de Tarlov modificada 4-5/5) y aumentar significativamente su autonomía. La evolución intraoperatoria de PEM/PESS era de alto riesgo para déficit medular, lo que manifiesta que este grupo de pacientes precisa una vigilancia muy exquisita con exploraciones neurológicas precisas diarias y un alto índice de sospecha de lesión medular precoz, o incluso tardía si el postoperatorio más inmediato es óptimo.
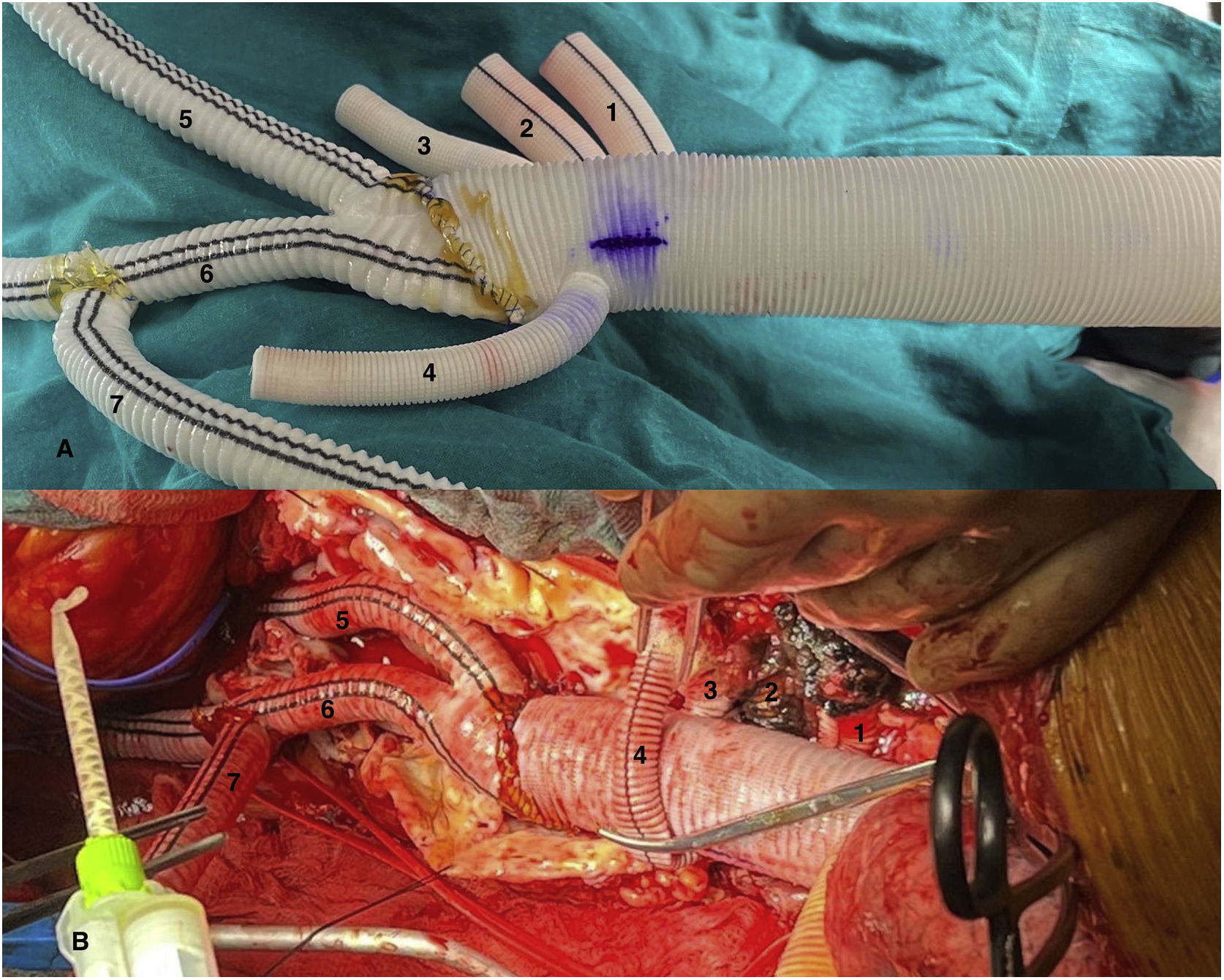
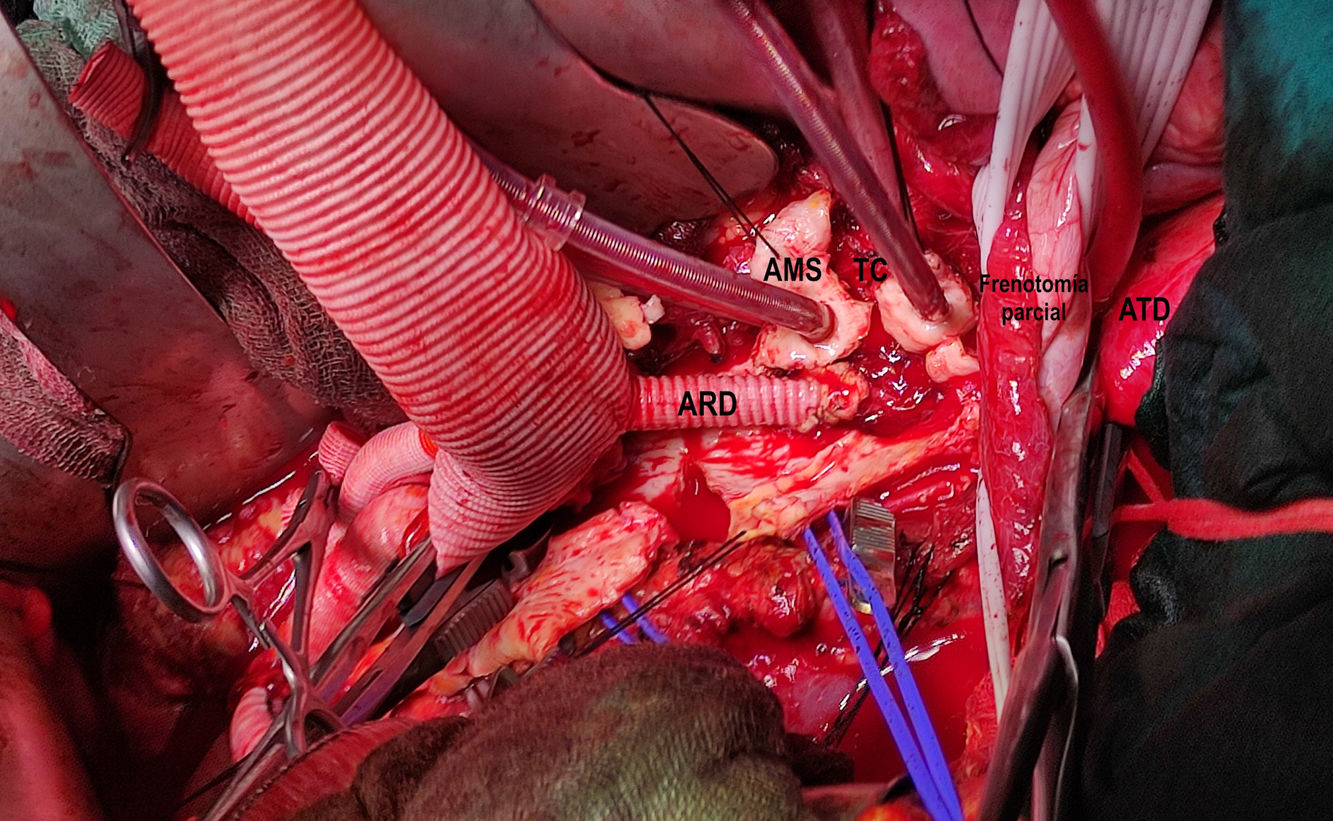
Figura 2.Imagen comparativa injerto dacron home-made tras su confección y tras su implante (caso 1). A) Anastomosis biselada término-terminal de injerto multirrama 30mm (Gelweave™ Coselli Thoracoabdominal Graft, Terumo Aortic, Inchinnan, Escocia) y cuerpo bifurcado 20×10×10mm (AlboGraft®, LeMaitre Vascular, Burlington, EE. UU.), así como porción de injerto dacron knitted 10mm a rama izquierda del bifurcado mediante anastomosis término-lateral y en posición ascendente, permitiendo así la canulación del sistema arterial con conexión 3/8-3/8-3/8. Anastomosis con monofilamento 4/0 y biosellante NE’X Glue® (Grena Biomed Ltd., Nottingham, Reino Unido). Marcaje con rotulador de posición superior del injerto. B) Prótesis implantada en paciente. 1. Rama a tronco celíaco. 2. Rama a arteria mesentérica superior. 3. Rama a arteria renal derecha. 4. Rama a arteria renal izquierda. 5. Rama a arteria ilíaca común derecha. 6. Rama a bifurcación arteria ilíaca izquierda. 7. Rama de perfusión sistémica y de conexión a injerto de reimplante de intercostales (técnica snake).
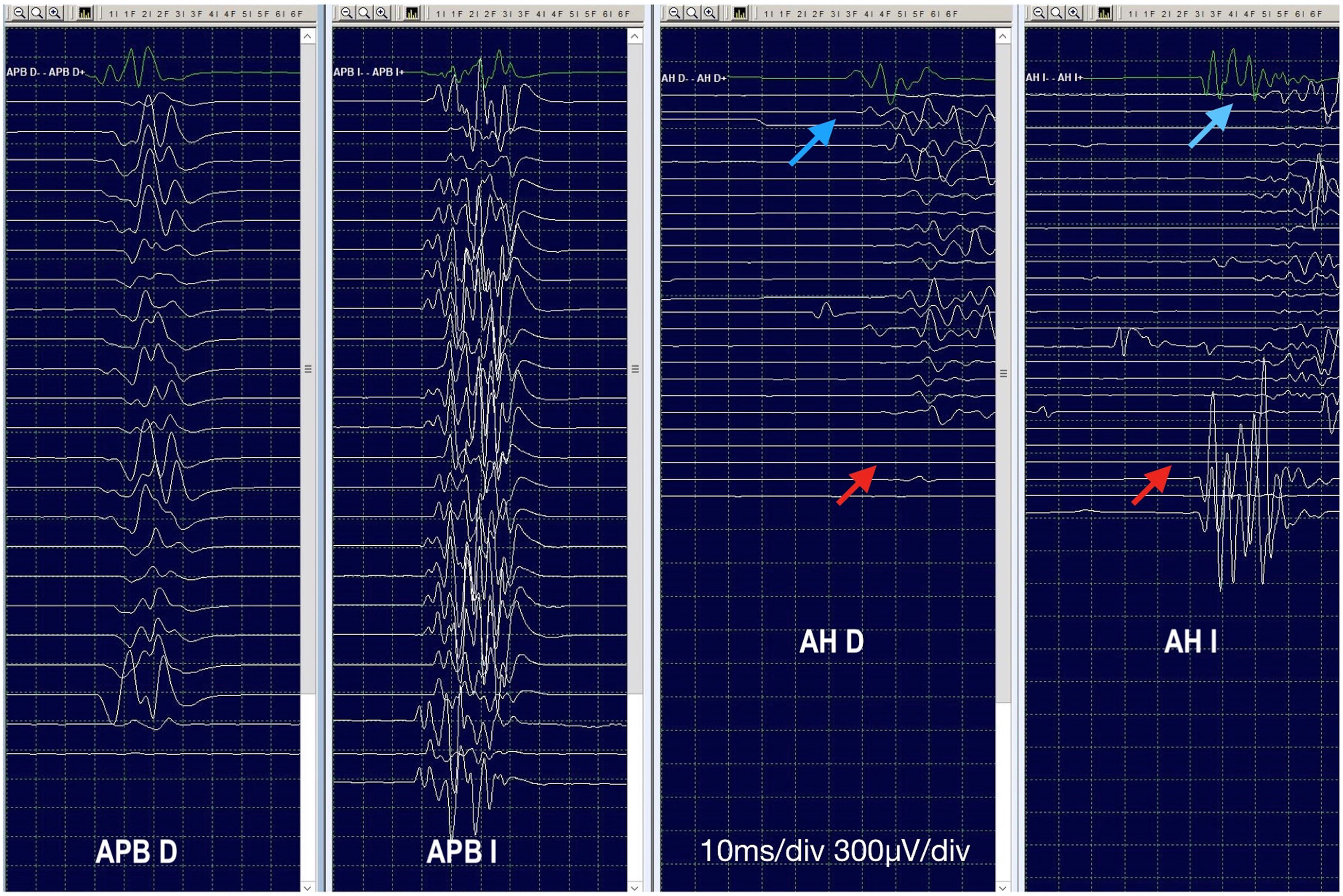
(0.38MB).Figura 3.Registro de potenciales evocados motores transcraneales (PEMt) (caso 1). Durante el pinzamiento y la anastomosis proximal, se produce abolición de PEMt y de potenciales evocados somatosensoriales (PESS). No hay recuperación tras reinstaurar el flujo anterógrado pulsátil, por lo que se reimplantan segmentarias con recuperación completa de PESS y subtotal de los PEMt. Las flechas rojas indican ausencia de respuesta y las azules la recuperación a la basal en el abductor del primer dedo del pie derecho (AH D) y con latencia alargada en el izquierdo (AH I). Músculo abductor corto del pulgar derecho (APB D) e izquierdo (APB I).
(0.83MB).Figura 4.Visión general tras finalizar la sustitución de la aorta toracoabdominal (caso 1). 1. Prótesis de aorta a nivel supradiafragmático. 2. Rama a arteria renal izquierda. 3. Rama a arteria ilíaca común derecha. 4. Rama a bifurcación arteria ilíaca izquierda. 5. Injerto para reimplante de arterias intercostales (técnica snake). 6. Anastomosis proximal del injerto snake. 7. Anastomosis distal del injerto snake. 8. Anastomosis proximal con injerto previo de aorta torácica descendente.
(0.13MB).Caso 2 (figs. 5 y 6). Las disecciones generan reacciones inflamatorias que enrarecen la anatomía y favorecen generar lesiones de nervios en el control del arco distal, como vago o recurrente. Si está dificultada la canulación de vasos renoviscerales por diámetros o características de la pared, conviene usar dispositivos alternativos a los habituales o hacerlo sin protección, ya que puede prevenir lesiones yatrógenas que generan más problemas (lesión vascular, infarto renal, aumento del tiempo quirúrgico).
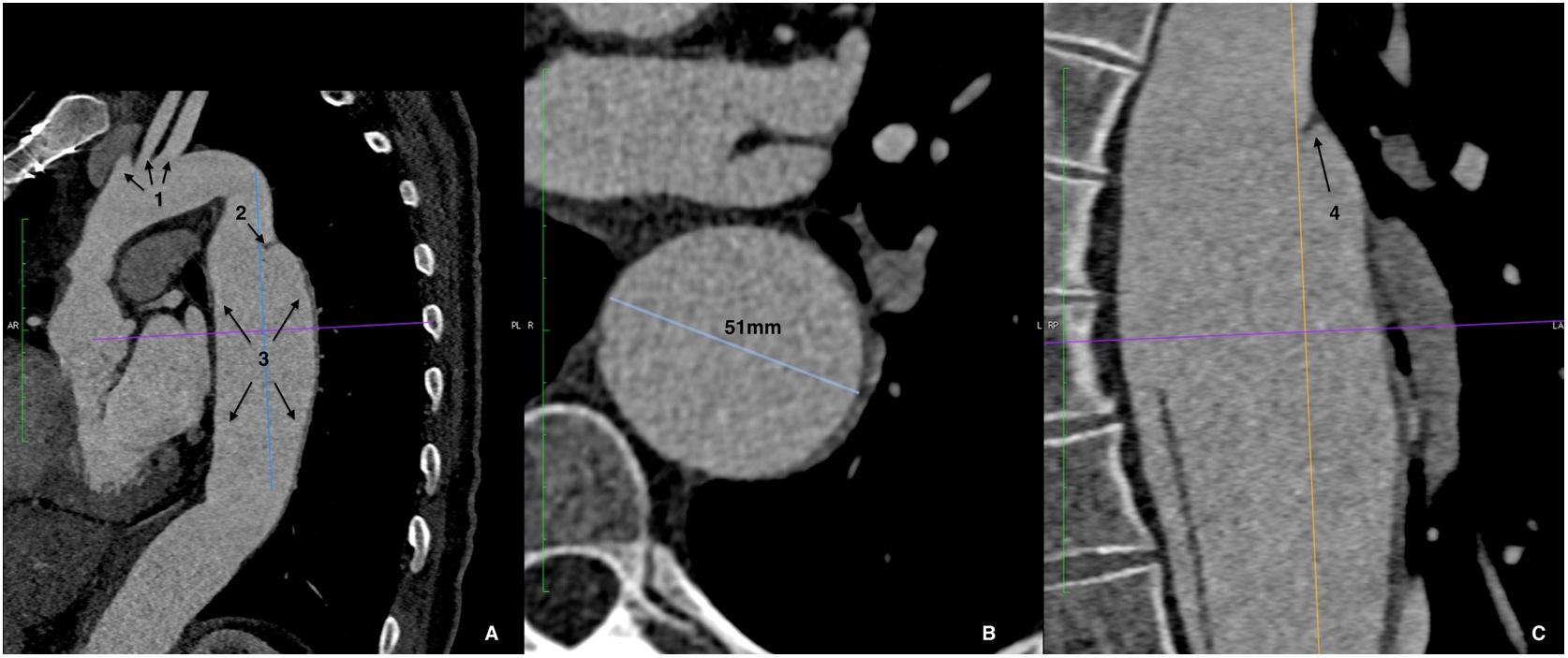
Figura 5.Tomografía axial computarizada preoperatoria con reconstrucción multiplanar del caso 2. Disección de aorta tipo B que se inicia en aorta descendente proximal y se extiende distalmente. A. Corte sagital: cayado y origen de troncos supraaórticos (1), puerta de entrada (2), dilatación difusa de aorta torácica descendente (3). B. Corte axial. Dilatación aneurismática de aorta torácica descendente, diámetro máximo 51mm en zona 4. C. Corte coronal: amplia puerta de entrada (rotura intimal) en zona 4 (4).
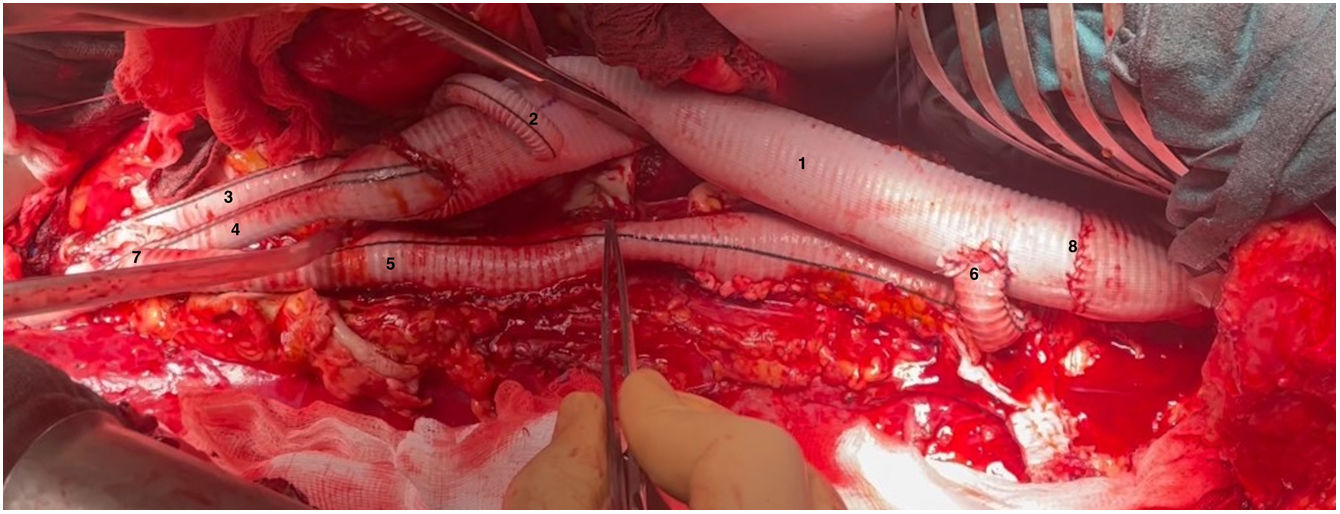
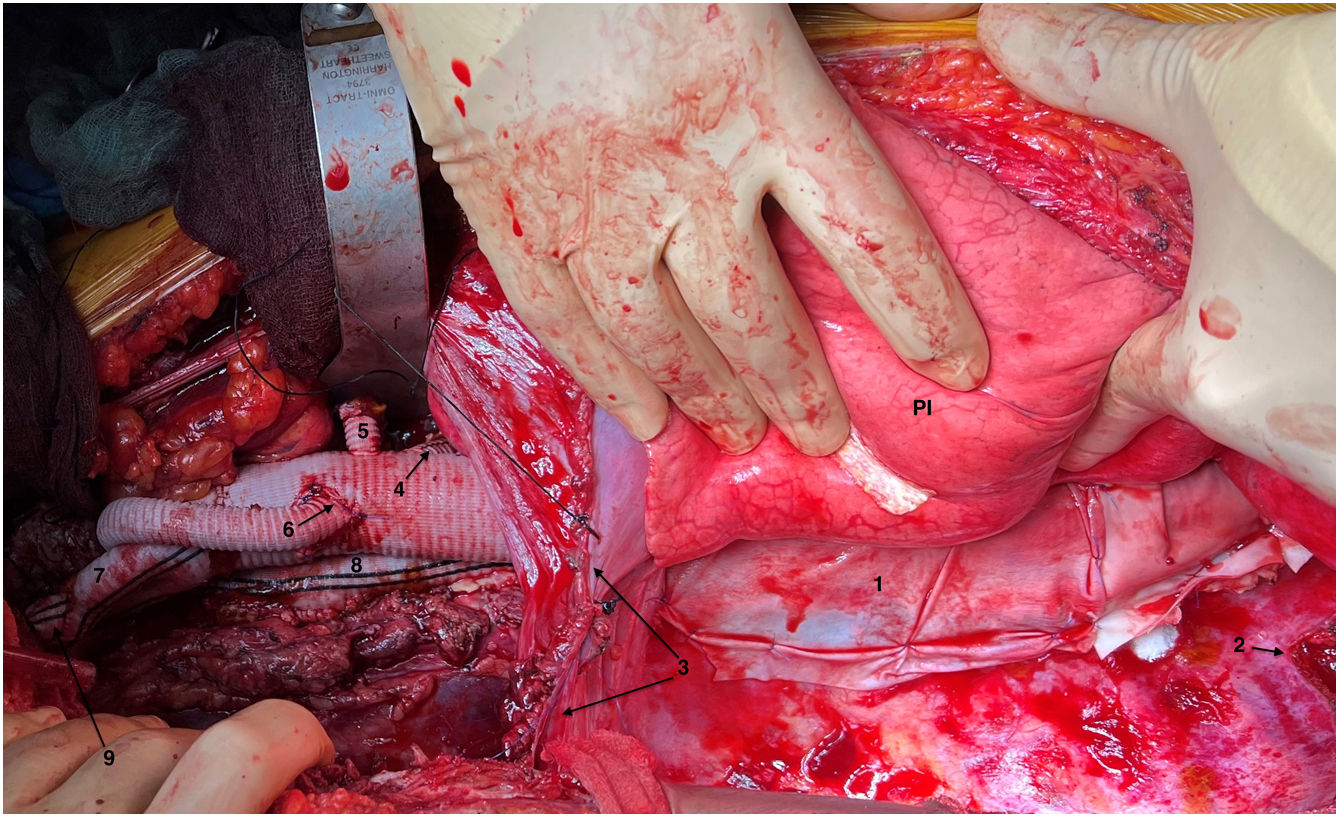
(0.13MB).Figura 6.Visión general tras finalizar la sustitución de la aorta toracoabdominal (caso 2). 1. Pericardio bovino cubriendo injerto aórtico en tórax. 2. Costotomía posterior de sexta costilla izquierda. 3. Frenotomía parcial circunferencial. 4. Rama a arteria mesentérica superior. 5. Rama a arteria renal izquierda. 6. Anastomosis distal de snake. 7. Rama a bifurcación arteria ilíaca izquierda. 8. Injerto snake con áreas de reimplante de arterias segmentarias en zona infradiafragmática. 9. Muñón (ligado) de injerto de perfusión conectado a rama ilíaca izquierda. PI: pulmón izquierdo.
(0.26MB).
El sistema de perfusión en ATA es muy variado en la literatura, predominando fundamentalmente el bypass izquierdo en grupos de alto volumen4,8,14. Nuestro equipo utiliza el sistema ECMO si no se prevé una hipotermia moderada o profunda. Presenta la ventaja, respecto a la circulación extracorpórea convencional, de menor necesidad de anticoagulación y mayor biocompatibilidad, y respecto al bypass izquierdo, de permitir asistencia cardiopulmonar completa en caso de fracaso respiratorio y/o cardíaco durante el procedimiento. Como desventajas conlleva un mayor coste y, en caso de necesitar una hipotermia mayor (no prevista), precisa conversión a circulación extracorpórea convencional.
La forma de reparación clásica y habitual del ATA es anterógrada, si bien la reparación retrógrada2 es otra alternativa. El minucioso análisis de la TAC, especialmente en disecciones crónicas (roturas intimales, tamaño de luces, origen de troncos renoviscerales e ilíacos, tanto la luz que los nutre como sus potenciales estenosis o compresiones), puede hacer prever si la perfusión será errática desde el lugar de canulación seleccionado. La reparación retrógrada es más segura cuando se prevén problemas de perfusión renovisceral, especialmente en disecciones crónicas con luz verdadera pequeña11. La canulación se puede realizar incluso en una rama lateral del injerto aórtico, evitando canulaciones adicionales. No obstante, si la anastomosis proximal es compleja, dificulta discretamente más su hemostasia tras la anastomosis (alternativamente, se pueden usar 2 injertos independientes y unirlos). Por otra parte, si se precisa parada circulatoria proximal para anastomosis proximal, prolongaría el tiempo quirúrgico y pudiera precisar algún tipo de canulación proximal.
Una de las herramientas en la protección medular es la monitorización con PESS/PEM3,6,8,15. Ello precisa una adaptación de la técnica anestésica y mayor infraestructura (humana y material), motivo por el cual ciertos grupos la han abandonado1,7. PESS/PEM aportan información medular en tiempo real, orientando la necesidad de medidas correctoras respecto al gasto cardíaco, la perfusión distal, la hemoglobina o el reimplante de segmentarias2,6,8. Por otra parte, en situaciones donde las características de la pared aórtica implican una anastomosis de riesgo, su información es útil para la oclusión quirúrgica de dichas segmentarias3. Incluso si los PEM permanecen disminuidos pese a las medidas correctoras optimizadas y hay segmentarias ocluidas, podría plantearse la endarterectomía de dicha porción aórtica y el reimplante con injerto3. La alteración de los PEM está directamente asociada a una mayor incidencia de daño medular inmediato o tardío, especialmente si no se produce la recuperación de los mismos durante la cirugía3,6. Cuando los PESS se alteran por causa medular, suelen ser más tardíos que los PEM y reflejan un mayor grado de isquemia6. Las maniobras correctoras habituales que recuperan PEM son: aumento de la presión arterial o flujo de perfusión distal (21%), recuperación de la pulsatilidad del flujo pélvico (32%) o reimplante de intercostales (34%)6.
El desarrollo del concepto de la circulación colateral de la médula espinal y la estrategia multimodal han ido debilitando la teoría anatómica del reimplante de segmentarias8. No obstante, múltiples trabajos han demostrado la utilidad del reimplante sistemático de la zona crítica, especialmente en las extensiones mayores1,5. La zona crítica varía desde T8-T12 hasta T7-L2, según los grupos4,8. Existen diferentes técnicas de reimplante. La más clásica, e impulsada por Crawford, es el reimplante directo (por técnica de inclusión o técnica de Carrel) en el injerto aórtico8. La permeabilidad es mayor respecto al uso de injertos independientes (77,1-94% vs. 31-85,9%); en este último grupo la permeabilidad es mayor en las técnicas de injerto paralelo8,16. Las desventajas del reimplante directo son: una mayor dificultad de hemostasia en paredes de mala calidad, la potencial distorsión del injerto aórtico y la mayor tendencia a pseudoaneurismas17.
Respecto a las técnicas que usan injertos para reimplantar las arterias segmentarias, probablemente la más versátil es la técnica snake o variantes como el frontage graft16. La técnica del parallel graft, loop graft o técnica snake fue descrita por primera vez en Filadelfia15. Posteriormente, muchos grupos han ido utilizándola, con injertos de 8-16mm de dacron4,8,15,18,19. La ventaja fundamental es la gran versatilidad y adaptabilidad a la disposición de las segmentarias, una mayor facilidad para la hemostasia, que el tratamiento (endovascular o abierto) es potencialmente más fácil en caso de pseudoaneurisma, así como que permite el reimplante tras reanudar el flujo pulsátil distal aórtico8,18.
En caso de conectivopatía, una separación de ostia visceral>2-3cm o incluso una pared aórtica muy desfavorable, el uso de injertos multirrama prefabricados4,8,14 o home-made son una excelente opción para la prevención de aneurismas del parche visceral. Es importante estirar el injerto14,20 antes de cortarlo para realizar la primera anastomosis aortoilíaca (ya sea proximal o distal), y así anticipar la posición de las ramas viscerales (evitar acodamientos). Opcionalmente, se puede colocar alguna marca radiopaca en anastomosis viscerales de riesgo para un potencial rescate endovascular si fuera necesario.
ConclusionesLa cirugía abierta del ATA con adecuado riesgo quirúrgico es el tratamiento de elección, especialmente en disección crónica y Marfan. La reparación de forma retrógrada, el uso de injerto multirrama, la técnica snake para reimplante de arterias segmentarias y la monitorización intraoperatoria de PESS/PEM deben ser herramientas a disponer en nuestro armamentarium. La prevención, el diagnóstico y el tratamiento precoz del daño medular durante todo el proceso asistencial es un elemento esencial.
Consideraciones éticasSe obtuvo el consentimiento informado de los pacientes por escrito para la publicación del artículo.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A todo el equipo de Enfermería (quirófano, reanimación, sala de hospitalización), de Perfusión, de Anestesia, de Neurofisiología y de Cirugía Cardiovascular de nuestro centro, por la dedicación y el esfuerzo que realizan a diario en la atención de la enfermedad aórtica compleja.