El momento óptimo de la cirugía correctora de la comunicación interventricular (CIV) postinfarto es todavía hoy en día asunto de controversia entre la comunidad científica. El propósito del artículo es revisar las publicaciones más relevantes en los últimos 5años sobre la implantación de dispositivos de asistencia circulatoria mecánica (ACM) puente a la reparación quirúrgica en pacientes con una CIV postinfarto.
Para los pacientes que se encuentran en shock cardiogénico secundario a una CIV, la tendencia actual es el empleo de ACM puente a la cirugía, ya sea de manera aislada (ECMO-VA o Impella) o combinada (ECMO-VA+Impella o ECMO-VA+drenaje tipo «Vent» en ventrículo izquierdo). La cirugía correctora podría llevarse a cabo cuando la situación hemodinámica sea favorable, el tejido haya cicatrizado y sea adecuado para anclar los puntos.
El factor principal que determina la supervivencia tras la cirugía de una CIV postinfarto es el momento de la misma, por lo que la mayoría de los centros difieren la cirugía correctora siempre que sea posible. Existe una predilección cada vez mayor a implantar dispositivos de ACM en pacientes en shock cardiogénico puente a la corrección quirúrgica, con resultados probablemente superiores a los de la cirugía emergente. Aunque los resultados son alentadores, las cifras de mortalidad en este perfil de pacientes continúan siendo muy elevadas (mayores del 40%).
The optimal timing of corrective surgery in post-infarction ventricular septal defect (VSD) is still a matter of debate among the scientific community.
The purpose of this article is to review the most relevant publications in the last 5years on the implementation of mechanical circulatory support (MCS) devices as a bridge to surgical repair in patients with a post-infarction VSD.
For patients who are in cardiogenic shock as a result of a VSD, the current trend is the use of MCS as a bridge to surgery, either in an isolated (VA-ECMO or Impella) or combined (VA-ECMO+Impella or VA-ECMO+vent drainage in left ventricle) manner. Corrective surgery will be performed when the hemodynamics are favorable, the tissue has healed and is adequately enough to support stitches.
The main factor that determines survival after VSD is the timing of the surgery. Therefore, most centers tend to postpone corrective surgery whenever possible. There is a growing tendency to implant MCS devices in patients in cardiogenic shock as a bridge to surgical correction, with results likely superior to those of emergent surgery. Although the results are encouraging, the mortality rate in this profile of patients remains very high (over 40%).
Con el desarrollo del intervencionismo y las terapias de reperfusión precoz, la comunicación interventricular (CIV) postinfarto se ha convertido en una complicación muy poco frecuente en la actualidad, con una incidencia aproximada del 0,17-0,32%1.
Pese a los avances en el tratamiento médico y quirúrgico, las altas cifras de mortalidad, que oscilan entre el 94% con tratamiento médico conservador y el 42,5% con cirugía2, hacen que sea una complicación potencialmente letal.
El momento de llevar a cabo la cirugía correctora de la CIV sigue siendo todavía motivo de controversia hoy en día3. Las guías actuales europeas (ESC) y americanas (ACCF/AHA) sobre el tratamiento del infarto agudo de miocardio en pacientes con elevación del segmento ST, recomiendan la cirugía urgente o emergente para aquellos pacientes con insuficiencia cardíaca grave que no respondan al tratamiento intensivo inicial; y considerar la cirugía electiva aplazada para pacientes que mantienen una buena situación hemodinámica.
Esta segunda indicación se basa en que la reparación quirúrgica puede llevarse a cabo con mayor tasa de éxito una vez haya aparecido el tejido cicatricial adecuado para anclar los puntos, asumiendo por contra el riesgo de extensión de la rotura y colapso hemodinámico durante la espera.
La indicación actual del empleo de dispositivos de asistencia circulatoria mecánica (ACM) en las guías europeas es de clase IIa (nivel de evidencia C) para los pacientes con CIV complicados con shock cardiogénico. Aun así, las guías no especifican el tipo de soporte preferido a emplear.
Las guías americanas no hacen ninguna referencia sobre el nivel de evidencia relacionado con el empleo de ACM en pacientes con CIV con o sin shock cardiogénico secundario asociado.
Las cifras de mortalidad del tratamiento quirúrgico urgente/emergente en los pacientes que se encuentran en shock cardiogénico secundario a CIV son todavía prohibitivas (superiores al 43%). Los pacientes en esta situación podrían beneficiarse de diferentes formas de ACM, las cuales podrían evitar el deterioro hemodinámico progresivo, impedir el desarrollo de fallo multiórgano y permitir diferir la cirugía correctora hasta un momento más favorable, mejorando así los resultados quirúrgicos y por ende las cifras de supervivencia global.
El propósito de este artículo es revisar las publicaciones más recientes y relevantes sobre el uso de ACM puente a la cirugía correctora en pacientes en shock cardiogénico secundario a una CIV postinfarto.
Factores de riesgo de desarrollo de comunicación interventricular postinfartoPreviamente al desarrollo de las terapias de reperfusión, la prevalencia de la CIV superaba el 2% de todos los infartos y era la responsable del 10% de todas las roturas cardíacas4.
Fundamentalmente el principal factor de riesgo de desarrollo de una CIV es la revascularización tardía. Además se han descrito otros factores de riesgo:
- -
Daño miocárdico extenso, infartos transmurales y pobre circulación septal colateral5.
- -
Enfermedad coronaria monovaso, fundamentalmente de la descendente anterior (DA), aunque también puede ocurrir en el seno de enfermedad multivaso6. La CIV tiene una mayor prevalencia en el primer infarto.
- -
Pacientes con una arteria descendente anterior larga y que se extiende más allá del ápex por la cara posterior, irrigando parte del septo inferior: «wraparound LAD7».
La incidencia de CIV es similar en infartos de localización anterior y territorio ínfero-posterolateral. En los infartos anteriores la localización de la CIV es predominantemente apical, mientras que en los infartos inferiores y posterolaterales la rotura tiene lugar en los segmentos basales del septo interventricular (SIV).
La literatura sugiere peores cifras pronósticas y mayor incidencia de shunt residual para la reparación de CIV secundarias a infartos inferiores y posterolaterales, dado el mayor grado de repercusión funcional del ventrículo derecho y la mayor complejidad de la técnica quirúrgica.
La zona de rotura se desarrolla en la región delimitada entre tejidos necrótico y sano, suele ser una CIV única y puede alcanzar varios centímetros de longitud. Las CIV basales suelen tener una trayectoria más anfractuosa y compleja anatómicamente que las asociadas a infartos anteriores, que suelen ser lineales.
El tamaño de la comunicación determinará la magnitud del shunt izquierda-derecha y por tanto el grado de afectación del ventrículo derecho; el cual tiene una repercusión directa sobre el pronóstico y la supervivencia8.
Manifestaciones clínicas y diagnósticoLa rotura del SIV tiene lugar habitualmente varios días después del infarto (entre 3 y 5días), aunque a veces puede presentarse en las primeras 24h o incluso 2semanas después. En la mayoría de los casos, cursa clínicamente con signos y síntomas de insuficiencia cardíaca aguda, fundamentalmente derecha, con deterioro hemodinámico rápido y shock cardiogénico secundario.
Ante la sospecha, el diagnóstico se lleva a cabo mediante ecocardiografía doppler (transtorácica y transesofágica) que, además de descartar otras complicaciones mecánicas asociadas como la rotura de pared libre ventricular y la insuficiencia mitral, permite localizar la zona de rotura, analizar su trayecto en el espesor del SIV, así como cuantificar el shunt izquierda-derecha y valorar la función biventricular.
En el laboratorio de hemodinámica puede diagnosticarse con la inserción de un catéter balón en la arteria pulmonar, documentándose el shunt izquierda-derecha.
Manejo inicial y estrategias de tratamientoEl empleo de diuréticos de asa y nitratos intravenosos (siempre y cuando la presión arterial lo permita) son las medidas iniciales de tratamiento a realizar. El uso del balón intraaórtico de contrapulsación (BCIAo) está ampliamente recomendado como tratamiento inicial, junto con apoyo inotrópico, para estabilizar a los pacientes a la espera de la coronariografía y posterior cirugía9.
El factor principal que determina la supervivencia tras la cirugía de CIV es la precocidad de la misma. Un estudio de cohortes retrospectivo publicado en The Annals of Thoracic Surgery en el año 20122 analizó una base de datos de 2.786 pacientes intervenidos de CIV entre los años 1999 y 2010 y concluyó una mortalidad del 54% para pacientes en los cuales la cirugía se había llevado a cabo en los primeros 7días frente a un 18% en aquellos en los que se difería la cirugía más allá del séptimo día. Estas cifras podrían explicarse porque a los pacientes a quienes se les intervenía de manera precoz eran peores candidatos, ya que llegaban a quirófano en situación de inestabilidad hemodinámica con datos de fallo multiórgano.
Por tanto, los datos sugieren que en una cohorte seleccionada de pacientes en shock cardiogénico y que no responden a las medidas iniciales descritas, podría resultar adecuado el uso de ACM para la estabilización del paciente, delimitación y cicatrización del tejido infartado, pudiendo así demorar la cirugía y mejorar los resultados técnicos y cifras de supervivencia posquirúrgicas posteriores.
El beneficio de la ACM es mayor cuanto antes se decida el implante, por ello es importante el reconocimiento y diagnóstico precoz de las complicaciones mecánicas, así como la selección de pacientes que puedan beneficiarse de estos dispositivos. Si el fallo multiorgánico ya está establecido, el pronóstico será ominoso independientemente de la medida que se adopte.
Hasta la fecha, hay pocas publicaciones al respecto (todas ellas de estudios de diseño observacional) dada la baja incidencia de esta entidad y el sesgo de publicación por las elevadas cifras de mortalidad asociada.
Soporte circulatorio con membrana de oxigenación etracorpórea veno-arterial (ECMO-VA)Aunque no describen el empleo de membrana de oxigenación ECMO-VA puente a cirugía correctora, Liebelt et al.10 publican en el año 2016 un estudio de cohortes retrospectivo de una serie de 14 pacientes con CIV postinfarto, reclutados de 2009 a 2015 en el Montefiori Medical Center (Nueva York). La edad media de los pacientes fue de 69,8años, la mayoría varones (57,1%) y únicamente un paciente tenía historia de cardiopatía isquémica previa. En 13 pacientes se realizó coronariografía al momento del diagnóstico del infarto y en 4 pacientes (30,8%) se realizó angioplastia con stent. Finalmente, 5 pacientes sobrevivieron y 9 fallecieron. En todos los pacientes se implantó BCIAo en el día 1 de ingreso y se utilizó ECMO-VA en el postoperatorio de 3 pacientes por shock poscardiotomía. El tiempo medio a cirugía correctora fue de 6,5±3,4días, con diferencias significativas entre el grupo de supervivientes y el de no supervivientes (9,8 vs. 4,3; p=0,01). El retraso de la cirugía más allá del noveno día se asoció a un incremento significativo de la supervivencia y la angioplastia precoz fue más común en el grupo de los fallecidos, sin alcanzar la significación estadística.
Finalmente sugieren que la reperfusión precoz podría tener una repercusión negativa sobre la mortalidad. Además, el empleo de ACM tipo BCIAo±ECMO-VA en pacientes seleccionados podría aportar beneficio mejorando la supervivencia; y concluyen que la cirugía diferida en el grupo de pacientes que mantienen la estabilidad hemodinámica (ya sea con soporte circulatorio o sin él) es el método preferido de reparación.
Rob et al.11 presentan en 2017 en el European Journal of Heart Failure un estudio de cohortes retrospectivo de 31 pacientes con CIV reclutados de 2007 a 2016 en el General University Hospital en Praga (República Checa). De esos 31 pacientes, 14 se presentaron al ingreso en situación de shock cardiogénico. El objetivo primario fue determinar las características hemodinámicas antes y 24h después de la implantación de una ECMO-VA puente a cirugía en pacientes en shock cardiogénico. El objetivo secundario fue determinar la mortalidad de dicho grupo de pacientes al mes y al año.
En 7 de los 14 pacientes se implantó ECMO-VA puente a la decisión ante el diagnóstico de shock cardiogénico (taquicardia>100lpm, lactato>2mmol/L y presión arterial sistólica<90mmHg) a pesar de medidas farmacológicas y BCIAo. La configuración de canulación preferida fue femoro-femoral. En los 7 pacientes mejoraron significativamente las cifras de presión arterial (64mmHg vs. 83mmHg, p<0,01), frecuencia cardíaca (115/min vs. 68/min, p<0,01) y se corrigieron progresivamente los valores de lactato (7,9mmol/L vs. 1,6mmol/L, p=0,01) y pH (7,25 vs. 7,40; p<0,04).
La duración media de soporte en ECMO-VA fue de 12±6,3días. En 5 de los 7 pacientes se realizó cirugía correctora. A 4 pacientes (57,1%) se les pudo retirar la ECMO-VA, 3 (42,9%) sobrevivieron más de 30días y 2 (28,6%) vivieron más allá del año. En 2 pacientes no pudo realizarse cirugía correctora porque fallecieron en los primeros días por complicaciones derivadas del dispositivo: dislocación de cánula (n=1) y hemorragia retroperitoneal (n=1). No hubo diferencias significativas, aunque sí menores cifras de mortalidad al mes y al año entre el grupo de pacientes en shock cardiogénico tratado con ECMO y el grupo de shock cardiogénico tratado con cirugía emergente, respectivamente.
Concluyen que la utilización precoz de ACM tipo ECMO-VA en pacientes con CIV consigue evitar el deterioro hemodinámico progresivo de los pacientes en shock cardiogénico, revirtiendo dicha situación en la mayoría de los casos; y sugieren que las cifras de supervivencia en estos pacientes son mayores en comparación con el grupo de pacientes en shock cardiogénico en quienes se realiza directamente cirugía emergente. Si bien es verdad, no se encuentran diferencias significativas, quizá debido a la falta de potencia estadística.
Park et al.12 publican en The Korean Journal of Thoracic andCardiovascular Surgery en 2017 un caso clínico de un paciente de 68años con un SCACEST inferoposterior, en el que se diagnostica una CIV a la tercera hora tras la angioplastia coronaria, requiriendo inicialmente implantación de BCIAo y posterior ECMO-VA femoro-femoral derecha (retirando el balón inmediatamente después). Al tercer día de soporte circulatorio despiertan al paciente y realizan lo que denominan «awake ECMO», eliminando así los riesgos inherentes a la sedación y a la ventilación mecánica invasiva (infecciones, pérdida de masa muscular, etc.)2,13–15. Se realiza cirugía correctora el noveno día con buen resultado final.
Rozado et al.16 presentan en The Journal of Thoracic Disease en 2017 otro caso clínico de un varón de 55años con una CIV tras SCACEST inferoposterior. Dada la estabilidad hemodinámica inicial se implanta BCIAo tras la coronariografía y se decide diferir la cirugía correctora. El cuarto día comienza con datos clínicos y analíticos de bajo gasto cardíaco, por lo que se implanta ECMO-VA, realizándose cirugía correctora y de revascularización al quinto día post-ECMO, con buen resultado. El paciente fue dado de alta el día 10 tras la reparación quirúrgica.
Jacob et al.17 también presentan un caso de un paciente de 69años con una CIV que se trata de entrada con un BCIAo. Posteriormente el paciente sufre una parada cardíaca y tras 10min de reanimación se implanta una ECMO-VA sin incidencias. Se consigue diferir la cirugía (técnica de «doble parche») hasta el tercer día de soporte, con buenos resultados posteriores.
Por último, Pascual et al.18 publican en 2016 una carta al editor en la Revista Española de Cardiología, que expone la utilización de ECMO-VA puente a trasplante cardíaco en un único paciente de 62años con una doble complicación mecánica: una CIV de localización basal y un pseudoaneurisma ventricular izquierdo. Debido a la gran extensión y la localización de la CIV se consideró irreparable quirúrgicamente. El trasplante se realizó el tercer día post-ECMO-VA en situación de urgencia cero; el postoperatorio trascurrió sin incidencias reseñables.
Soporte circulatorio con ImpellaA pesar de que la introducción de un dispositivo de tamaño considerable como el Impella dentro de un ventrículo izquierdo irritado, friable y perforado no parezca a priori una técnica muy segura, existen algunas publicaciones con relación a la utilización exitosa del mismo, en el escenario de la CIV postinfarto. No obstante, la seguridad y la eficacia están aún por demostrar.
Ancona et al.19 publican en Cardiovascular Intervention and Therapeutics (2017) un caso de un paciente de 68años con una CIV en el seno de un infarto inferior evolucionado por oclusión trombótica de la arteria coronaria derecha. Se implanta BCIAo pero ante la mala evolución se decide soporte ventricular izquierdo precoz con Impella CP. El paciente mantiene estabilidad hemodinámica y buenos datos de perfusión orgánica clínica y analítica, pudiéndose demorar la cirugía correctora al séptimo día, que trascurre de manera satisfactoria. El paciente fue dado de alta el día 28 del postoperatorio.
En 2011 La Torre et al.20 presentan en The Texas Heart Institute Journal una serie de 5 pacientes diagnosticados de shock cardiogénico secundario a CIV a los que se trató con Impella CP puente a cirugía correctora, con un tiempo medio de soporte total de 14,4±6días. La mortalidad a los 30días fue del 40%20. Si bien es verdad, en los 5 pacientes de la serie se realizó el implante de manera tardía, cuando todos tenían ya datos analíticos de fracaso multiórgano de mal pronóstico (INR 3,2; AST 3.588U/L; ALT 1.434U/L; bilirrubina 35,9μmol/L; láctico 0,58mmol/L).
Soporte circulatorio con dispositivos tipo «total artificial heart» (TAH)En algunos pacientes el trasplante cardíaco urgente o la terapia de destino con un corazón artificial total pueden ser la única solución. No obstante, el conocimiento y la experiencia en la utilización de estos dispositivos en este escenario clínico es muy limitado.
Knezevic et al.21 (University Medical Center Ljubliana, Eslovenia) publicaron un caso en 2013 de un paciente con una CIV no reparable mediante cirugía en el que se implanta un TAH puente a trasplante cardíaco.
Cierre percutáneo de la comunicación interventricular durante el soporteEl desarrollo de dispositivos de cierre de CIV podría hacer factible en un futuro cercano el tratamiento percutáneo de esta entidad en casos seleccionados22, aunque actualmente la experiencia es limitada.
Las guías actuales europeas (ESC) y americanas (ACCF/AHA) sobre el tratamiento del infarto agudo de miocardio en pacientes con elevación del segmento ST únicamente citan el cierre percutáneo como medida de tratamiento en desarrollo y que podría reemplazar a la cirugía en un futuro.
Ibebuogu et al.23 describen en 2016 un caso de una paciente de 72años con antecedentes de cirugía de bypass coronario 10años antes, que ingresó por un SCACEST anterior. En la coronariografía se implantó BCIAo y se realizó angioplastia sobre la descendente anterior. Debido al deterioro hemodinámico después del procedimiento se intercambió BCIAo por Impella 2,5 y se realizó un ecocardiograma transtorácico que mostró disfunción ventricular izquierda severa (FEVI 25-30%) y una CIV apical de 15mm, con un gradiente de 36mmHg y ratio QP:QS>1,8. La paciente fue desestimada para reparación quirúrgica y se optó por cierre percutáneo al cuarto día. Durante el soporte la paciente permaneció hemodinámicamente estable pero evolucionó con insuficiencia renal y fallo hepático a causa de la hemólisis, además se le diagnóstico de un ictus isquémico transitorio.
El cierre se realizó con dispositivo Amplatzer muscular VSD occluder 18mm y transcurrió sin complicaciones, con mejoría hemodinámica posterior pudiéndose retirar con éxito el dispositivo Impella. Pese a todo, la paciente falleció a causa de una sepsis.
Cruz-González et al.24 publican en 2019 el primer caso en España de cierre percutáneo de comunicación interventricular postinfarto (CIV) en paciente asistido con ECMO-VA. Se trata de un paciente de 75años que ingresó a causa de un infarto anterior extenso complicado con shock cardiogénico. En la ecocardiografía transtorácica se objetivó disfunción ventricular izquierda severa y una CIV. La coronariografía mostró una oclusión trombótica del segmento proximal de la arteria descendente anterior. Tras decisión multidisciplinar se decidió implantar BCIAo, ECMO-VA y realizar angioplastia sobre la descendente anterior además de cerrar la CIV con dispositivo Amplatzer PI Muscular VSD 22mm. El procedimiento transcurrió con éxito, quedando un cortocircuito residual mínimo.
Complicaciones derivadas de la utilización de membrana de oxigenación extracorpórea (ECMO-VA) en la comunicación interventricularEl empleo de ECMO-VA conlleva per se un riesgo significativo de complicaciones inherentes al dispositivo y es particularmente alto en el grupo de pacientes con CIV dado que al implante presentan una situación hemodinámica precaria y en muchas ocasiones datos de fallo multiorgánico asociado. Se sabe que el índice de complicaciones de la ECMO-VA es directamente proporcional al tiempo de soporte.
Independientemente del régimen de anticoagulación empleado y de la estrategia de canulación, el sangrado es una complicación muy frecuente y potencialmente letal. En el artículo de Rob et al.11 expuesto previamente, de 7 pacientes a quienes se implantó una ECMO-VA puente a cirugía correctora, 5 sufrieron sangrados mayores de los cuales 3 fallecieron a consecuencia de ello.
Otra potencial complicación grave es la expansión de la CIV, ya que la ECMO-VA aumenta de manera directa la poscarga y por ende la presión telediastólica ventricular izquierda (PTDVI), empeorando así el shunt izquierda-derecha y pudiendo aumentar el tamaño de la rotura. De manera secundaria se produciría mayor hiperaflujo e hipertensión pulmonar y posterior deterioro de la función ventricular derecha25, lo cual tiene repercusión directa sobre la supervivencia y ensombrece aún más el pronóstico.
Selección del tipo de dispositivoUn reciente artículo publicado en julio de 2019 por Pahuja et al.26 en Circulation: Heart Failure estudia en un modelo de simulación de CIV los efectos hemodinámicos entre diferentes tipos de dispositivo de soporte circulatorio (BCIAo, ECMO-VA, Impella, ECMO+Impella «ECPELLA», TandemHeart, y ECMO+cánula de drenaje de ventrículo izquierdo «Vent»).
Ninguno de los diferentes dispositivos de ACM analizados es capaz de normalizar la situación hemodinámica en una CIV, ya que aunque consiguen disminuir en mayor o menor medida el cociente Qp:Qs, siempre persiste un cierto grado de hiperaflujo a través de la arteria pulmonar; ya sea por un aumento del retorno venoso sistémico por las venas cavas o por un aumento del shunt izquierda-derecha.
De mayor a menor eficacia en cuanto a mejoría del gasto cardíaco y la presión arterial se exponen: ECMO-VA+Impella>Impella 5.0>ECMO-VA>TandemHeart>Impella CP>ECMO-VA+«Vent»>BCIAo. No obstante, el orden varía si lo que se tiene en cuenta es la disminución del valor de presión de enclavamiento pulmonar (PCP) o del flujo a través de la CIV.
El Impella es el dispositivo que logra con mayor eficacia reducir el valor de PCP, seguido del BCIAo y de la ECMO combinada con drenaje directo a través del ventrículo izquierdo (Vent). La ECMO utilizada de forma aislada es la que más aumenta el flujo a través de la CIV por un aumento de la poscarga ventricular izquierda.
Finalmente, de entre todos los dispositivos analizados se concluye que la estrategia más eficaz es la combinación de 2 dispositivos (ECMO-VA+Impella) ya que, además de proporcionar un excelente grado de soporte circulatorio, con la descarga directa a través del ventrículo izquierdo se reduce o «elimina» el shunt a través de la CIV y se disminuye la PCP.
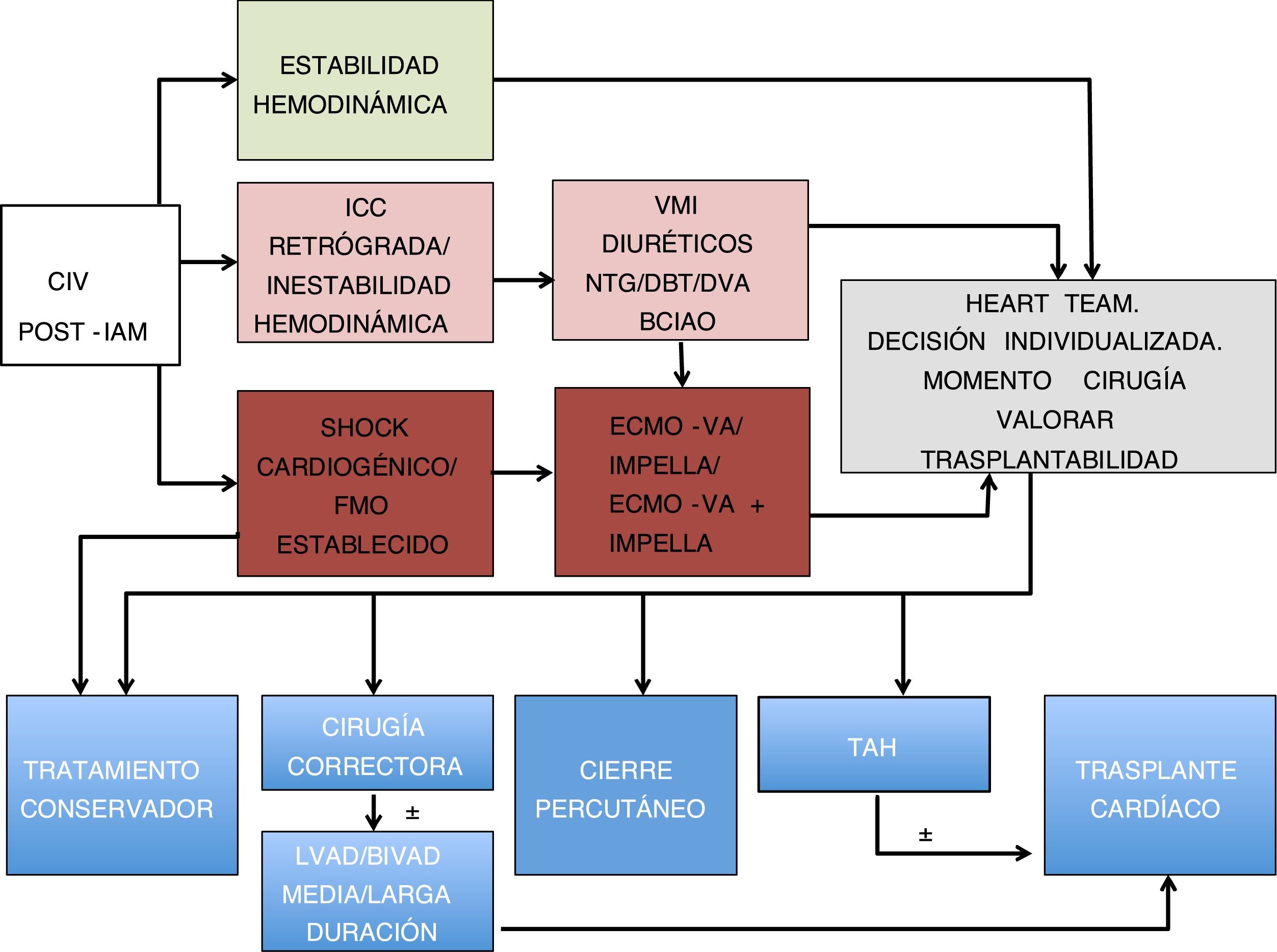
En cuanto a la utilización de un dispositivo de manera aislada, se recomiendan aquellos que descargan de manera directa el ventrículo izquierdo (Impella 5.0, CP) relegando la ECMO-VA a aquellos pacientes que necesiten un grado mayor de soporte circulatorio o estén hipoxémicos (fig. 1).
Propuesta de algoritmo de tratamiento de CIV postinfarto de miocardio.
BCIAO: balón de contrapulsación intraaórtico; BIVAD: biventricular assist device; CIV: comunicación interventricular; DBT: dobutamina; DVA: fármacos vasoactivos; ECMO-VA: membrana de oxigenación extracorpórea veno-arterial; FMO: fallo multiorgánico; IAM: infarto agudo de miocardio; ICC: insuficiencia cardíaca; LVAD: left ventricular assist device; NTG: nitroglicerina; TAH: total artificial heart; VMI: ventilación mecánica invasiva.
El factor principal que determina la supervivencia tras la cirugía de CIV es el momento de la misma. Es por esto que la opción preferida en centros experimentados es la de diferir la cirugía correctora siempre que sea posible. Existe una tendencia cada vez mayor a implantar ACM en pacientes en shock cardiogénico puente a la corrección quirúrgica, con resultados probablemente superiores a los de la cirugía emergente. Pese a todo, el pronóstico en este último grupo de pacientes es malo, con cifras de mortalidad todavía en torno al 40%.
Aunque ningún dispositivo de ACM normaliza del todo la situación hemodinámica e iguala el cociente Qp:Qs en una CIV, la combinación de ECMO-VA+Impella podría resultar atractiva ya que es la que más ventajas ha demostrado en modelos experimentales.
La ventaja del Impella sobre la ECMO-VA es la descarga directa del ventrículo izquierdo, disminuyendo la PCP, minimizándose el riesgo teórico de progresión de rotura, el shunt izquierda-derecha y la disfunción ventricular derecha secundaria. Por contra, implica introducir un dispositivo de manera directa dentro de la cavidad ventricular.
Se desconoce el momento óptimo de la cirugía correctora y hay que individualizarlo en cada paciente. Para todos los pacientes a quienes se ha implantado ACM, ya sea ECMO-VA, Impella o una combinación de ambos, la cirugía no debería demorarse más de 8-10días dado el incremento del riesgo de complicaciones potencialmente letales asociadas al soporte que aparecen a partir de la primera semana.
Son pocos los artículos publicados hasta la fecha acerca de la utilización de ACM en el contexto de la CIV postinfarto. No existe ningún ensayo clínico aleatorizado y la mayoría son estudios observacionales y series de casos, por lo que la evidencia actual es escasa.
Conflicto de interesesNinguno de los autores declara tener conflictos de interés.