La existencia de una arteria coronaria anómala cruzando el infundíbulo del ventrículo derecho puede dificultar la reparación quirúrgica, así como aumentar la morbilidad y la mortalidad operatoria de ciertas enfermedades en las que es preciso tratar la estenosis a nivel del tracto de salida del ventrículo derecho, como es el caso de los pacientes con tetralogía de Fallot. La presencia de esta anomalía requiere en muchos casos una variación de la estrategia quirúrgica para evitar lesionar la arteria coronaria anómala y sus fatales consecuencias. Una de las opciones quirúrgicas es el implante de un conducto entre el ventrículo derecho y la arteria pulmonar, pero este procedimiento presenta ciertas desventajas. En este artículo se recogen la mayoría de las técnicas quirúrgicas descritas en la literatura, que intentan tratar con buenos resultados a este grupo de pacientes, evitando el implante de un conducto extracardiaco. Además, incluimos un posible esquema de decisión, que puede ayudar al cirujano en la elección de la técnica quirúrgica más apropiada, en función de las características anatómicas del paciente.
The existence of an anomalous coronary artery crossing the infundibulum of the right ventricle can make surgical repair difficult, as well as increase morbidity and operative mortality in certain pathologies in which it is necessary to treat stenosis at the level of the right ventricular outflow tract, as in the case of patients with Tetralogy of Fallot. The presence of this anomaly often requires a variation of the surgical strategy to avoid injury to the anomalous coronary artery and its fatal consequences. One surgical option is the implantation of a conduit between the right ventricle and the pulmonary artery, but this procedure has certain disadvantages. In this article we report most of the surgical techniques described in the literature, which attempt to treat this group of patients with good results, avoiding the implantation of an extracardiac conduit. In addition, we include a possible decision scheme, which may help the surgeon in the choice of the most appropriate surgical technique, depending on the anatomical characteristics of the patient.
Las anomalías coronarias son comunes en numerosas cardiopatías congénitas, en concreto, en la tetralogía de Fallot (TF) se ha reportado la presencia de una anomalía coronaria hasta en un 14% de los casos1,2 y de ellos entre el 2 y el 9% de los casos la arteria coronaria anómala (ACA) cruza el tracto de salida del ventrículo derecho (TSVD)1. Cuando esto último ocurre, dificulta en gran medida la reparación quirúrgica1–5, aumentando la morbimortalidad operatoria3,6,7.
En algunos pacientes, la ACA puede ser fácilmente identificada al inspeccionar la superficie cardiaca durante la cirugía, pero en otras ocasiones puede resultar difícil, por ejemplo, si presenta un trayecto intramiocárdico, si está oculta por grasa epicárdica o por adherencias epicárdicas secundarias a una cirugía previa8,9. Por ello, el diagnóstico preoperatorio de una ACA es de suma importancia5. Actualmente, en la mayoría de los centros, la anatomía coronaria se determina mediante el estudio ecocardiográfico y, en los últimos años, se ha incrementado el empleo de tomografía axial computarizada cardiaca y resonancia magnética para identificar y delinear exactamente las ACA en la TF2.
La presencia de esta anomalía puede requerir un cambio en la estrategia quirúrgica para evitar lesionar la ACA durante la ventriculotomía o la resección de la obstrucción en el TSVD10, ya que esta complicación podría ocasionar una importante isquemia miocárdica y la muerte del paciente3,5,11. Por ello, es importante conocer las distintas opciones quirúrgicas que podemos llevar a cabo en estos casos. A lo largo del artículo, describiremos la gran mayoría, sino todas, de las técnicas que podemos encontrar en la literatura.
Manejo del paciente con tetralogía de Fallot y anomalía coronariaEn el pasado, la presencia de una arteria coronaria importante cruzando el infundíbulo, a menudo conducía a una paliación inicial empleando una fístula de Blalock-Taussig o una fístula central en lugar de una reparación primaria4. Otra de las opciones quirúrgicas empleadas en este grupo de pacientes era el implante de un conducto desde el ventrículo derecho (VD) a la arteria pulmonar (AP). Sin embargo, esta opción tiene distintas desventajas, ya que, con el crecimiento del paciente, la desproporción entre el conducto y el paciente (mismatch) hace que el reemplazo del conducto sea inevitable1, lo que conlleva un riesgo acumulativo quirúrgico significativo dada la necesidad de reintervención3, además se debe ser muy cuidadoso al elegir el sitio de implantación y la orientación del conducto para evitar la compresión de la ACA y sus fatales consecuencias5,7,11–15. Por todo ello, se han descrito numerosas técnicas destinadas a realizar una corrección completa primaria, evitando el empleo de un conducto extracardiaco entre el VD y AP. Pero, tal y como indican Kalfa et al.5, la gran variedad de técnicas demuestra que no existe un claro consenso sobre la opción ideal de manejo.
A continuación, describiremos las distintas opciones quirúrgicas que podemos emplear ante un paciente con esta peculiar anatomía.
a. Shunt sistémico-pulmonarActualmente se lleva a cabo con poca frecuencia, ya que la mayoría de cirujanos prefieren la reparación primaria1,16. Se trata de una opción quirúrgica paliativa válida para aquellos pacientes sintomáticos que se encuentran por debajo del límite de peso o edad para realizar una reparación primaria, aunque esto dependerá de la política del equipo médico-quirúrgico1. En pacientes con una arteria coronaria cruzando el TSVD, realizar un shunt puede estar justificado para ganar tiempo y retrasar el momento de implantar un conducto entre el VD y la AP, con el objetivo de minimizar el número y probabilidad de reoperaciones por fallo del conducto1. Llevar a cabo un proceso paliativo en un primer tiempo y, posteriormente, una reparación, no influiría en la supervivencia o supervivencia libre de reoperación5,17.
b. Abordaje transauricular, con o sin arteriotomía pulmonarEl abordaje transauricular fue descrito por primera vez por Hudspeth et al.18 en 1963, quienes describen la realización de esta técnica con éxito en 10 pacientes consecutivos. Aunque describieron su utilidad para evitar la ventriculotomía, también se reconoció su posible empleo en los casos de TF con ACA cruzando el TSVD1,18.
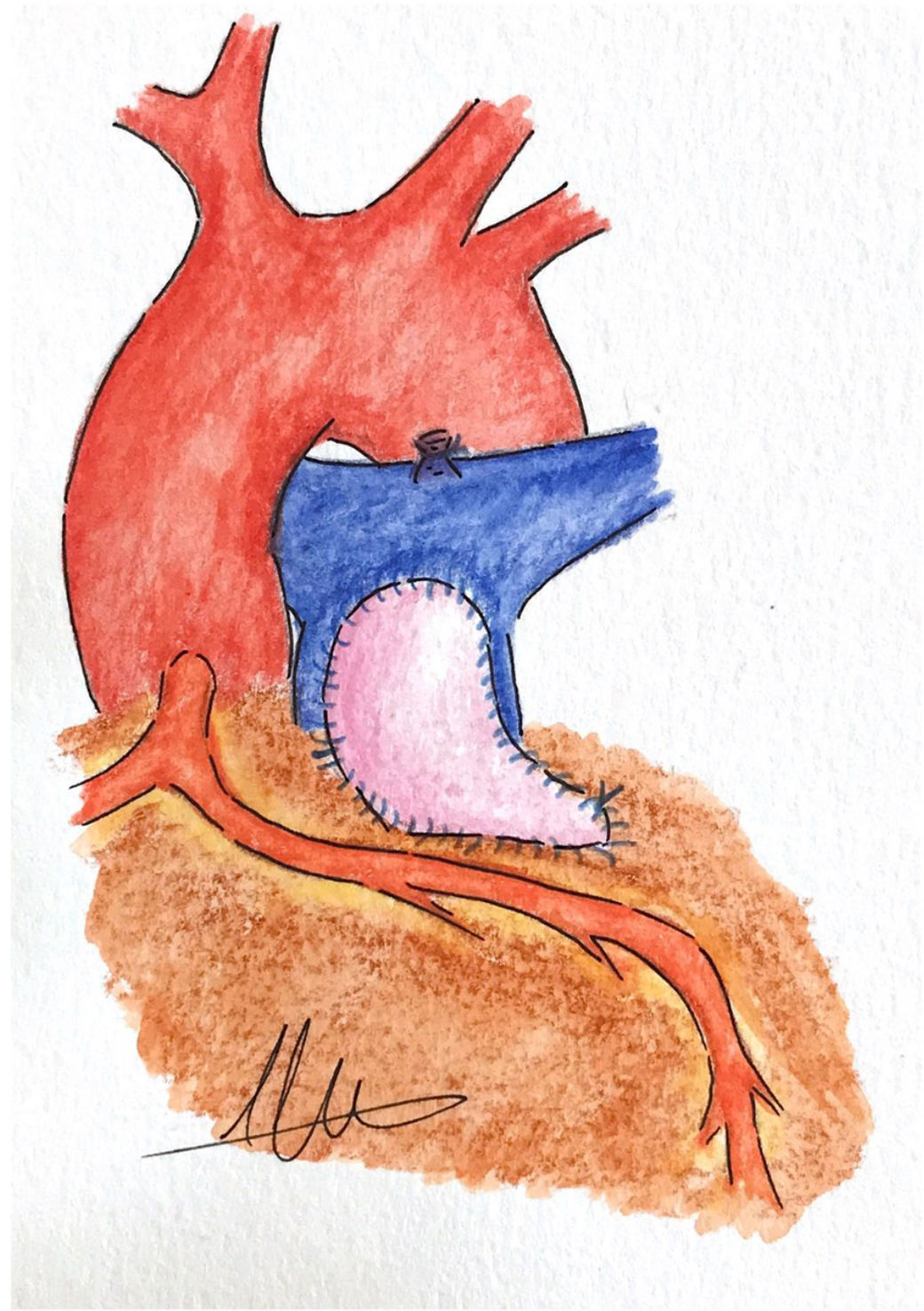
El abordaje consiste en cerrar el defecto interventricular y aliviar lo máximo posible la obstrucción del TSVD a través de la auriculotomía derecha. Para mejorar la exposición tanto del defecto interventricular como de la obstrucción en el TSVD, podemos realizar la desinserción circunferencial del velo septal tricuspídeo, extendiendo la incisión hacia la base del velo anterior o posterior, si se requiere una mayor exposición. Si es necesario se lleva a cabo también una arteriotomía pulmonar para inspeccionar la válvula pulmonar y realizar, si es preciso, una valvuloplastia1,18. Brizard et al.10 describen que cuando emplean esta técnica quirúrgica, realizan una incisión transanular cuando la válvula pulmonar y el anillo tienen un diámetro inadecuado, y cuando la localización de la ACA complica resolver la estenosis infundibular sin lesionarla, la incisión se extiende paralela al vaso coronario para maximizar la apertura del TSVD1,10. Kalra et al.12 describen también este abordaje transauricular en estos pacientes y de forma similar a Brizard et al.10, cuando era necesario abordar el anillo pulmonar, llevaban a cabo una arteriotomía pulmonar que extienden a través del anillo valvular hasta el VD, siendo la incisión paralela al vaso coronario y separada del mismo por unos 3-4mm como margen de seguridad12 (fig. 1).
Para Brizard et al.10 el abordaje transauricular es la mejor estrategia cuando nos encontramos con esta condición anatómica, ya que en la mayoría de los casos permite aliviar adecuadamente la obstrucción infundibular sin la necesidad de insertar un conducto VD-AP y se consiguen buenos resultados hemodinámicos y funcionales a largo plazo. Refieren que uno de los puntos importantes de su serie es el hecho de que emplean el abordaje transauricular-transpulmonar en todos los pacientes con TF, lo que les aporta años de experiencia con esta técnica, resultando muy beneficioso cuando la resección para aliviar la obstrucción en el TSVD es más exigente10. Otra de las ventajas de este abordaje, en comparación con el abordaje clásico transventricular, es el hecho de que probablemente desarrollan menor disfunción de VD a largo plazo19.
Una de las preocupaciones que expresan otros autores que reportan esta técnica (Kalra et al.12) es que la resección insuficiente de la pared anterior del VD para evitar el posible daño en la ACA se puede asociar con gradientes a nivel del TSVD más altos. Además, otro aspecto a tener en cuenta es que cuando existe una hipoplasia infundibular, conseguir una completa resolución de la obstrucción en el TSVD por vía transauricular puede ser difícil7.
La mayor serie ha sido reportada por Karl et al.20, de Melbourne, en 1992, quienes describen este abordaje en 366 pacientes, de los cuales 11 presentaban una anomalía coronaria significativa, pero este hecho no requirió que cambiaran su estrategia quirúrgica. Describen un 0,5% de mortalidad y libertad de reoperación por cualquier causa del 95% a los 5 y 10 años de seguimiento1,20. Brizard et al.10, en la serie de 611 pacientes consecutivos con TF, reportaron 36 con ACA1,10, de los cuales a 34 se les realizó de manera exitosa este abordaje; en 25 de ellos fue necesario un parche transanular limitado. En 2pacientes de los 36 descritos no pudo evitarse el implante de un conducto entre el VD y AP, ya que la arteria coronaria se encontraba muy próxima al anillo pulmonar e inhabilitaba un adecuado alivio de la obstrucción del TSVD10. No presentaron muertes precoces ni tardías durante el seguimiento (media de seguimiento de 52 meses). La media de gradiente de presión entre VD-AP en el último seguimiento fue de 19mmHg, muy similar al de los pacientes sin anomalías coronarias de su propia serie, que fue 15mmHg. A los 120 meses había un 96,5% de pacientes libres de reoperación10.
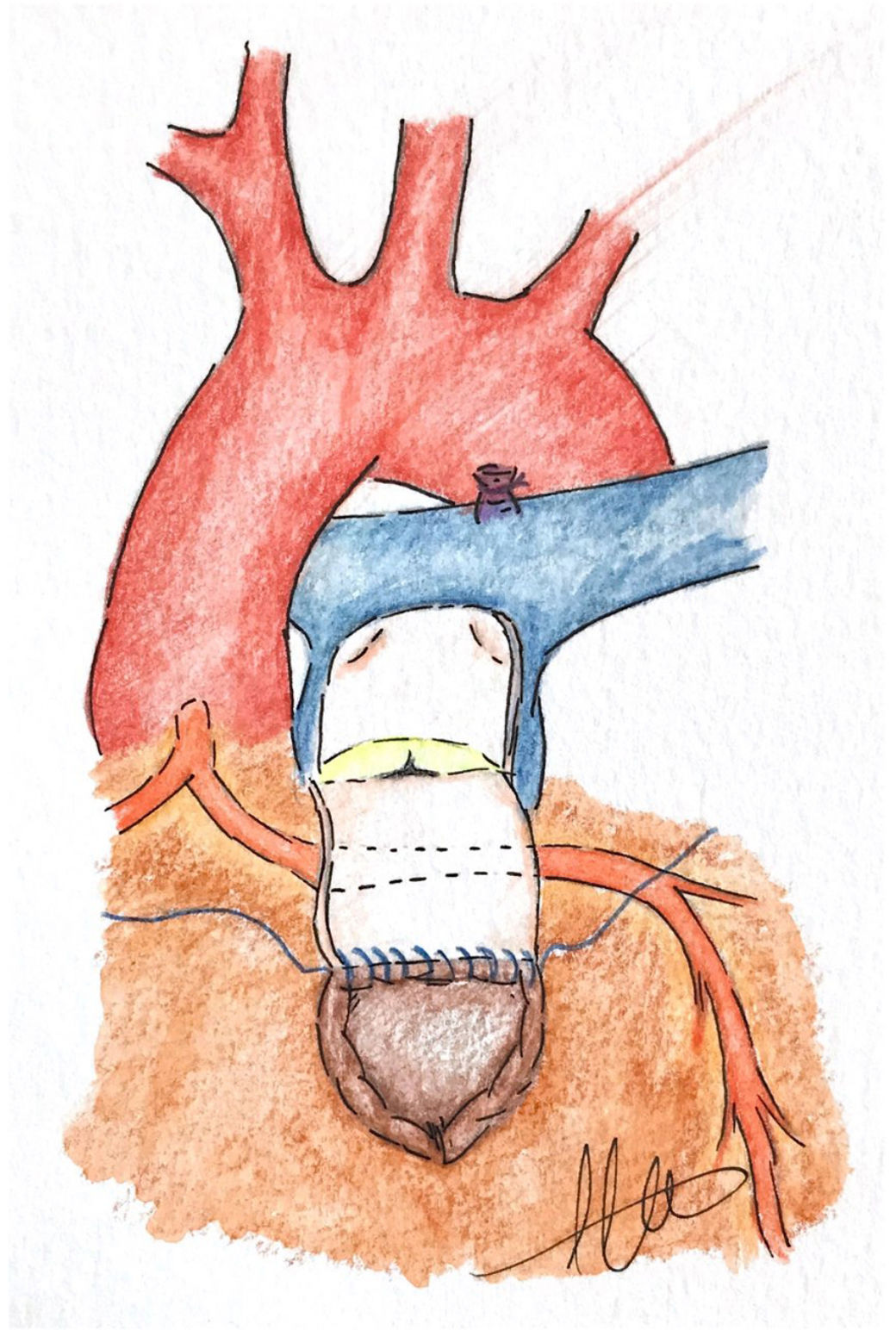
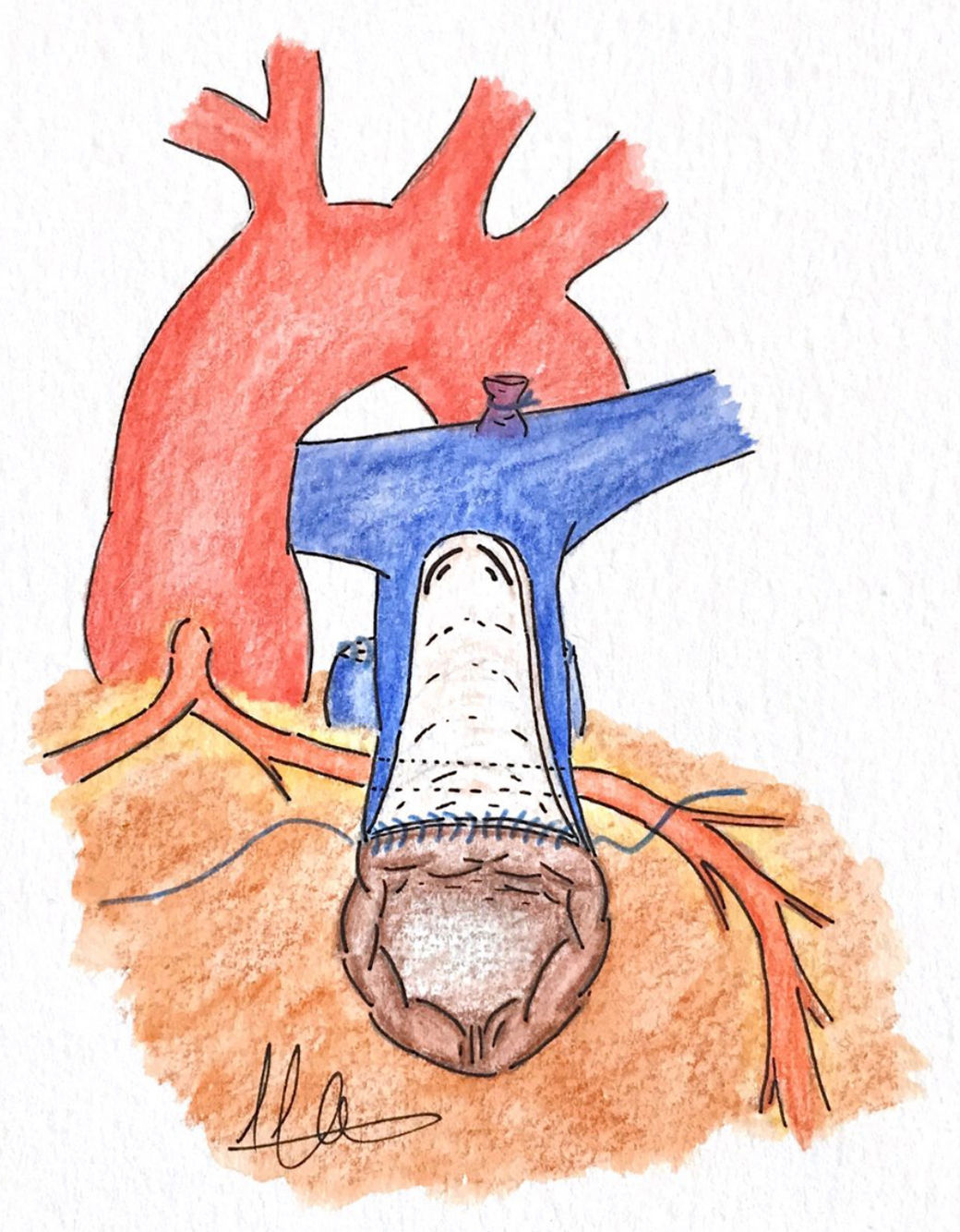
c. Doble salida o técnica van SonEsta técnica inspirada en el trabajo de Barbero-Marcial et al.21 para la reparación del truncus arterioso sin el empleo de conducto extracardiaco fue ideada por van Son19 en San Francisco para la reconstrucción del TSVD en un paciente de 2 meses de edad. La técnica consiste en realizar una incisión longitudinal extendida en el TSVD aproximadamente 4mm por debajo de la ACA. A través de esta ventriculotomía se realiza la resección de bandas musculares a nivel infundibular. Posteriormente, se llevan a cabo 2incisiones paralelas en el tronco pulmonar conectadas por una incisión transversal, de forma que creamos un colgajo con la pared anterior del tronco pulmonar, el cual debe ser lo suficientemente largo como para llegar al borde superior de la ventriculotomía19 (fig. 2). La longitud de este colgajo debe ser ligeramente mayor que la longitud entre la base del colgajo y el margen superior de la incisión a nivel infundibular; esto es importante para evitar que, tras la sutura, quede estirado sobre la superficie de la ACA y pueda comprometer el flujo coronario22. Dicho colgajo en forma de U invertida se gira hacia atrás pasando por encima de la ACA, como un puente sobre la coronaria y se sutura al extremo superior de la ventriculotomía (fig. 3). Para completar esta nueva vía de salida de flujo se puede emplear tejido pulmonar criopreservado, pericardio o material protésico, creando un generoso parche con morfología elíptica que debe suturarse a los bordes de la arteriotomía pulmonar, a los bordes del colgajo de tejido autógeno y, por último, a la ventriculotomía19,22. Podemos ayudarnos con un tallo de Hegar u otro dilatador, colocándolo debajo del parche para calibrar el tamaño de la vía de salida que estamos creando quirúrgicamente22.
Al final de este procedimiento, el VD tendrá 2tractos de salida: la vía presumiblemente obstructiva a través del infundíbulo y la válvula pulmonar nativa, y la nueva vía, creada con el colgajo de pared de AP y el techo con el parche de tejido pulmonar criopreservado, pericardio o material protésico22.
Debemos tener en cuenta que, para poder llevar a cabo esta técnica adecuadamente, el paciente no debe tener un tronco pulmonar hipoplásico9,23.
La principal ventaja es el potencial crecimiento de la nueva vía de flujo creada con el colgajo de tejido autógeno, lo que reduce la probabilidad de estenosis en el TSVD a largo plazo1,19. Van Son et al.19 también describen como posible ventaja, un riesgo reducido de comprensión o estiramiento de la ACA en comparación con otras técnicas.
Al igual que cuando se emplea un parche transanular, se produce inevitablemente una insuficiencia pulmonar1,22, pero si se emplea un parche de homoinjerto pulmonar con una válvula monocúspide, podríamos limitar esta insuficiencia, y en cierta medida preservar la compliancia del VD en presencia de un incremento de la resistencia arteriolar pulmonar19.
Van Son19 refiere que, a los 9 meses de seguimiento, en la ecocardiografía de control se objetiva un TSVD ampliamente permeable y con un aumento de 3mm a nivel del anillo pulmonar en el diámetro transversal de la vía de salida creada quirúrgicamente. Dandolu et al.22 durante el seguimiento de 3 a 7 años de 4 pacientes intervenidos con esta técnica reportan solo un caso de reintervención al año de seguimiento por obstrucción muscular proximal a nivel de la ventriculotomía derecha1. Asano et al.24 reportan el caso de un paciente que a los 7 años de la cirugía el gradiente de presión en el TSVD había aumentado de 20 a 80mmHg, a pesar de que el anillo valvular pulmonar nativo y el orificio del TSVD reconstruido habían aumentado. El crecimiento del TSVD no influyó de manera nociva en la ACA, la cual no presentaba distorsión en su trayecto, pero parece que el flujo sanguíneo a través de las 2vías de salida podía haber creado un flujo turbulento en el punto de unión de ambas, produciendo que la pared posterior, creada con el colgajo de pared pulmonar nativa, se encontrara dilatada y elevaba hacia arriba, generando un pliegue transversal que producía una estenosis a dicho nivel.
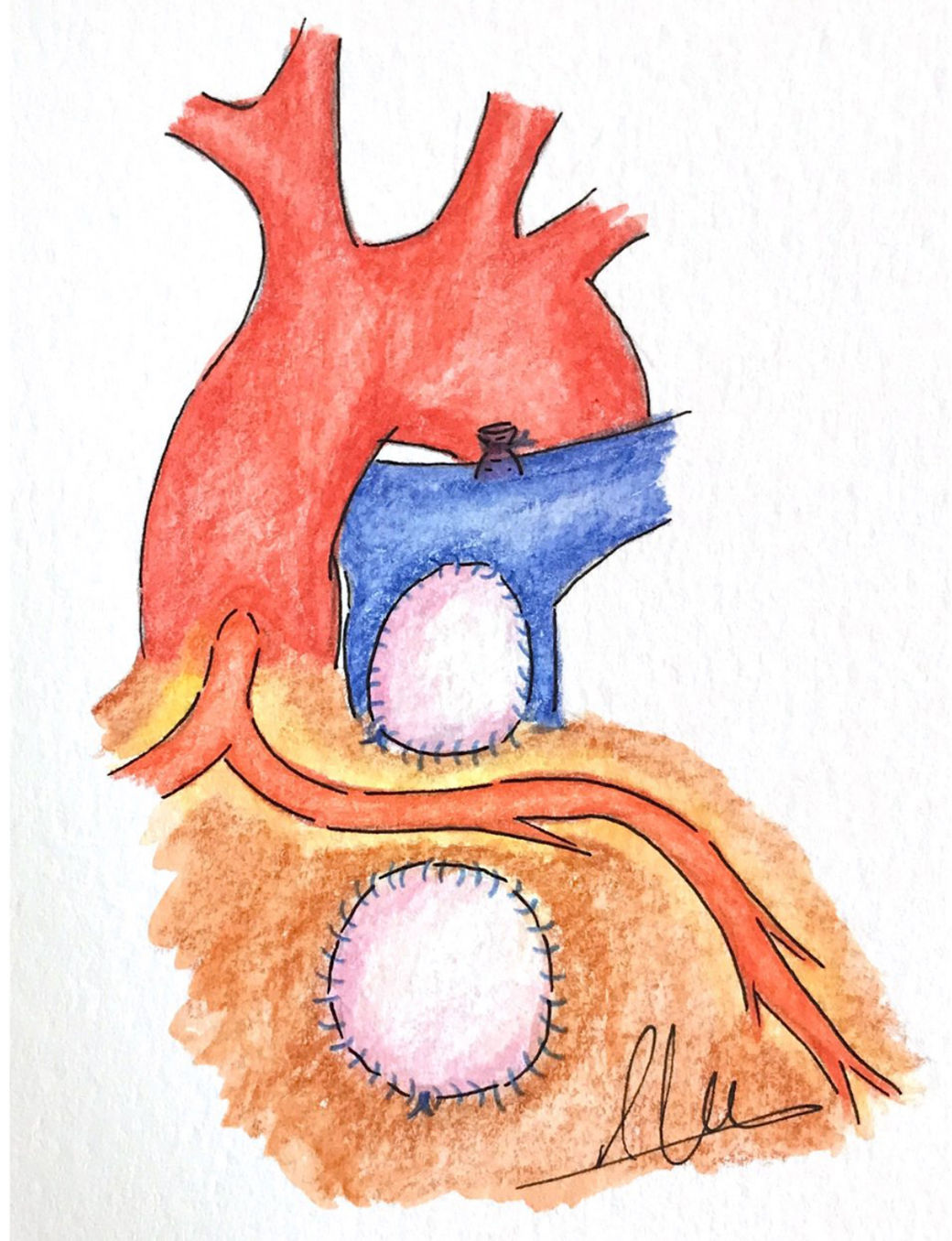
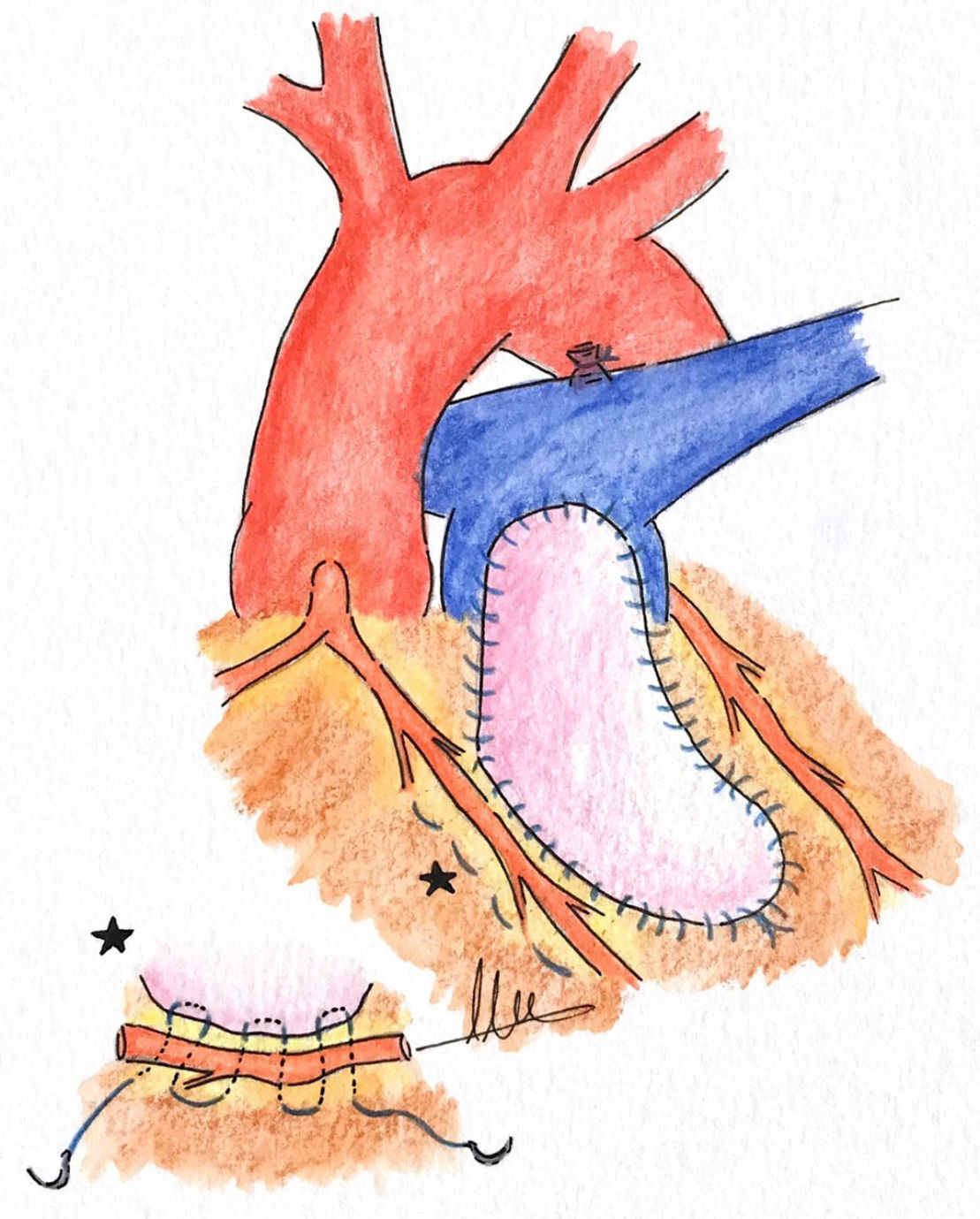
d. Doble parcheEsta técnica consiste en emplear 2parches separados, uno a nivel del tronco pulmonar, extendiéndose al anillo pulmonar si es preciso y otro en la porción infundibular de TSVD por debajo de la ACA, la cual quedaría estratégicamente colocada en el espacio libre1,13 (fig. 4).
Ozkara et al.13 presentan buenos resultados empleando esta estrategia quirúrgica. Estos autores13 comentan que, en su opinión, como mínimo debe dejarse un centímetro de distancia de seguridad entre la incisión y la ACA para poder realizar la sutura sin riesgo isquémico. Al inicio de su experiencia dejaban una distancia de seguridad de 5mm, pero observaron graves complicaciones isquémicas en 2pacientes, por ello cambiaron su política y pasaron a dejar al menos un centímetro de distancia de seguridad13. Hay otros grupos quirúrgicos que defienden un área de seguridad más pequeña (5mm)10.
Pontailler et al.3 reportan buenos resultados con esta técnica en este grupo de pacientes. Para los autores3 una de las claves del éxito de la intervención es realizar una extensa resección muscular bajo la zona de cruce de la ACA, con especial cuidado a nivel de la pared posterior de la arteria coronaria. Ellos, al finalizar la resección muscular, siempre pasan cardioplejía anterógrada para comprobar que no se ha producido ninguna lesión.
Ruzmetov et al.7 refieren que, a la hora de la resección de las bandas musculares septo-parietales para aliviar la estenosis en el TSVD, en los casos en los que la ACA cruzaba directamente el área de la obstrucción tuvieron la precaución de dejar 5 o 6mm de miocardio por debajo de la arteria coronaria para evitar una dilatación aneurismática de la pared del VD a dicho nivel, ya que podría comprometer el flujo coronario7.
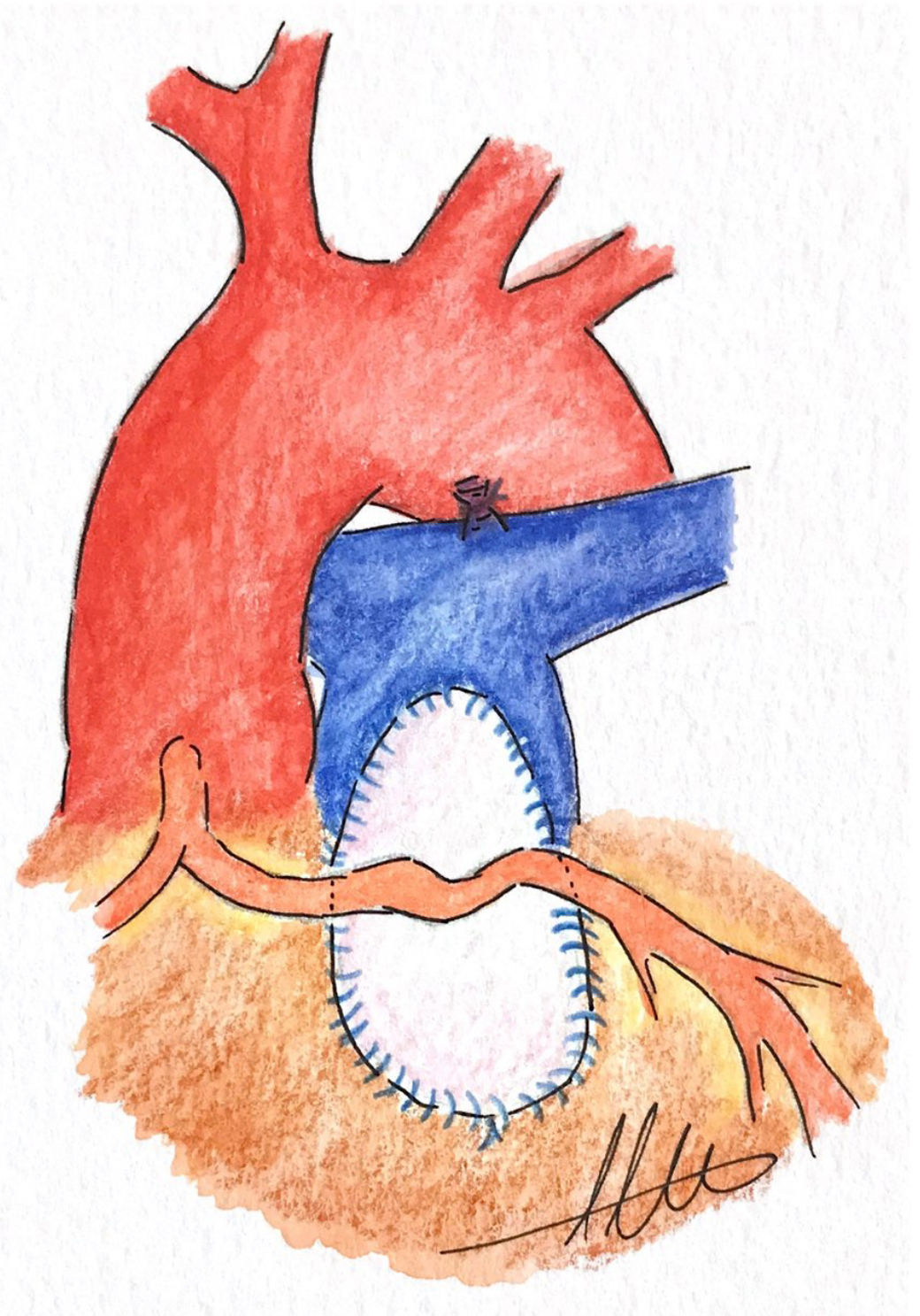
e. Movilización de arteria coronariaBonchek25 describió una interesante técnica en 1976 en una paciente de 11 años con TF y ACA cruzando el TSVD bajo el anillo pulmonar, el cual era hipoplásico. La reparación consistió en movilizar la ACA, realizando una cuidadosa disección que permitiera movilizarla al menos 3 cm, de forma que pudiera ser levantada del TSVD adecuadamente; en este caso no había ramas en este segmento de arteria y el segmento movilizado parecía bastante elástico, lo que permitió el implante de un parche transanular de teflón cubriendo el TSVD por debajo de la arteria coronaria movilizada, sin aparente tensión25 (fig. 5). Esta técnica puede emplearse si la arteria coronaria aberrante es tortuosa y sin ramas a nivel del TSVD, lo que permite su movilización junto con el epicardio adyacente y el miocardio subyacente, con mucho cuidado de no denudar la arteria coronaria. El parche transanular debe ser ligeramente más pequeño para evitar cualquier estiramiento o comprensión de la arteria coronaria1,6. Bonchek25 refiere que al quedar fijo el TSVD en su parte anterior con el parche, el crecimiento se producirá en la parte posterior, por lo que no debería producirse un estiramiento de la arteria coronaria con el tiempo.
Benjaout et al.15 emplearon esta técnica en 14 pacientes (media de edad de 50,3 meses [2,5-103,8 meses]), ellos realizaban la disección de la ACA desde el origen de la arteria hasta su primera gran rama más allá del infundíbulo, todo ello antes de entrar en circulación extracorpórea. Si encontraban arteriolas, las cauterizaban. El parche de ampliación del TSVD era 4mm menor que la longitud de arteria coronaria disecada para evitar su compresión con el abombamiento del parche. Solo un paciente requirió un conducto de VD-AP debido a persistencia de altas presiones en VD tras la ampliación del TSVD15. Los autores recomiendan una juiciosa selección de los casos en los que aplicar esta técnica y una cuidadosa disección de la arteria coronaria y reconstrucción con parche para evitar el daño o compresión de la ACA15.
Diferentes autores que han descrito el empleo de esta técnica no han reportado problemas en el seguimiento6,15,25,26.
f. Métodos de translocación del tronco arterial pulmonarEn pacientes que requieren un parche transanular, se puede llevar a cabo esta técnica que consiste en la translocación de toda la AP principal. Se movilizaba el tronco pulmonar principal, las ramas arteriales pulmonares derecha e izquierda, y se seccionaba el ductus arterioso. El tronco arterial pulmonar se divide justo distal al anillo y se transloca hasta la ventriculotomía derecha, dejando así la ACA detrás1,6. Se sutura la mitad posterior del tronco pulmonar seccionado a la ventriculotomía y se realiza una incisión longitudinal en la cara anterior del tronco pulmonar para permitir una ampliación adecuada mediante la sutura de un parche de pericardio autógeno a este nivel y a la ventriculotomía6 (fig. 6).
Tchervenkov et al.6 realizan esta técnica quirúrgica sin llevar a cabo la maniobra de Lecompte, ya que no les parece adecuado movilizar unas ramas arteriales pulmonares pequeñas delante de una aorta aumentada de tamaño6. De esta forma, se mantiene la rama pulmonar derecha detrás de una aorta agrandada y desplazada anteriormente6, pero hay autores que han expresado preocupación por la posible compresión de la rama pulmonar derecha por la aorta al no realizarse la maniobra de Lecompte1.
Antes de plantearnos esta técnica deberíamos considerar que, a pesar de una extensa movilización del tronco pulmonar y sus ramas, este tipo de reparación puede no ser posible si la ACA atraviesa la porción baja del TSVD6, ya que puede suponer una excesiva distancia de translocación.
Tchervenkov et al.6 refieren que, entre las ventajas de esta técnica se encuentra una baja probabilidad de obstrucción en el TSVD o estenosis en el tronco pulmonar principal, ya que la pared posterior de la vía construida es tejido autógeno con potencial de crecimiento.
Esta técnica podría recomendarse especialmente en aquellos casos en los que el anillo pulmonar es muy pequeño y la localización de la ACA está muy estrechamente relacionada con el mismo, lo que haría muy complicado aplicar, sin riesgo de daño coronario y de obstrucción residual, técnicas como el abordaje transauricular/transpulmonar o el implante de un parche transanular por debajo de la arteria coronaria5.
g. Doble salida creada completamente con parcheShivaprakasha23 describe un tipo de reparación de «doble salida del TSVD» para aquellos casos en los que el tronco pulmonar principal es corto o muy hipoplásico como para llevar a cabo la técnica van Son19. Para emplear esta técnica, el autor refiere que un prerrequisito es tener unas ramas pulmonares intrapericárdicas adecuadas. Tras el cierre de la comunicación interventricular y el abordaje transauricular de la obstrucción a nivel del infundíbulo, realizan una incisión en el TSVD por debajo y paralela al curso de la ACA. La incisión será oblicua u horizontal dependiendo del trayecto de la arteria coronaria. A través de la ventriculotomía se procede a la resección de bandas musculares hipertróficas. Se lleva a cabo una incisión en la AP principal desde bifurcación pulmonar hasta el anillo valvular (sin atravesarlo), cuando existe fusión comisural, se realiza una comisurotomía valvular pulmonar, intentando asegurar la integridad de la válvula. Se crea un parche de pericardio rectangular, el cual se sutura al borde superior de la ventriculotomía y el otro extremo a nivel del anillo valvular pulmonar. Para restablecer el techo de esta continuidad VD-AP empleamos otro parche de pericardio con forma elíptica. El parche de la cara anterior debe ser 1,5 veces el ancho del parche de pericardio colocado como pared posterior. El resultado es un tubo de pericardio cuyo diámetro debe ser el adecuado según el tamaño del paciente. Dando lugar de esta forma a una doble salida para el VD. La vía posterior corresponde al TSVD nativo con su válvula pulmonar, mientras que la vía anterior es el nuevo TSVD reconstruido. La ACA se localizará entre las 2vías. Las líneas de sutura se refuerzan con puntos apoyados en teflón para asegurar una adecuada hemostasia antes de salir de circulación extracorpórea23.
Los autores23 llevaron a cabo esta técnica en 16 pacientes con TF, anillo pulmonar pequeño y ACA cruzando el TSVD, con buenos resultados. En el ecocardiograma se demostró un adecuado flujo anterógrado en la vía nativa, sin insuficiencia, y un buen flujo anterógrado en la nueva vía, con insuficiencia libre. Solo un paciente presento gradiente significativo en TSVD (41mmHg). Durante el seguimiento (15-70 meses) los pacientes continúan presentando un adecuado flujo anterógrado en el TSVD. No han reportado problemas a nivel de la ACA que queda entre ambas vías.
El autor23 refiere que la técnica descrita por van Son19 no es posible aplicarla cuando existe una hipoplasia pulmonar supraanular, debido a que el tejido del tronco pulmonar será insuficiente para crear el colgajo y emplearlo como pared posterior de la nueva vía. La técnica descrita por Shivaprakasha23 elimina esta variable al interponer un parche de pericardio autógeno, aunque son conscientes de que su técnica no tiene potencial de crecimiento. Aunque enfatizan en que la vía nativa si tiene potencial de crecimiento. Sus resultados a corto-medio plazo parecen prometedores23.
h. Desplazamiento de la ventriculotomía y sutura subcoronariaTchervenkov et al.6 describen también una técnica que emplearon en 8 pacientes con ACA cruzando de manera oblicua el TSVD por debajo del anillo valvular pulmonar. Se realizó una incisión transanular extendiéndose dentro del ventrículo de manera oblicua, con un trayecto paralelo al vaso coronario anómalo (fig. 7). Cuando se trata de una rama conal de gran tamaño, el espacio entre este vaso y la arteria descendente anterior (DA) es a menudo estrecho, por ello para evitar lesionar el vaso coronario el cierre de la ventriculotomía se realizó mediante una línea de sutura subcoronaria. Se trataba de una línea de sutura continua con puntos en U, comenzando en el parche de pericardio, pasando por debajo la arteria coronaria y saliendo lateral a ella en el epicardio. Después la sutura regresa desde el epicardio al endocardio bajo la arteria coronaria, llegando al parche de pericardio, manteniendo así la arteria coronaria como en una isla de miocardio1,6 (fig. 8). Ocasionalmente podemos reforzar esta sutura con puntos sueltos subcoronarios en U apoyados en teflón6.
Implante de parche de pericardio para la ampliación del tracto de salida del ventrículo derecho, donde una parte de la línea de sutura es subcoronaria, aquella más próxima a la arteria coronaria anómala. Se trata de una línea de sutura continua con puntos en U, comenzando en el parche de pericardio, pasando por debajo la arteria coronaria y saliendo lateral a ella en el epicardio. Después la sutura regresa desde el epicardio al endocardio bajo la arteria coronaria, llegando al parche de pericardio, manteniendo así la arteria coronaria como en una isla de miocardio.
Esta técnica es especialmente útil si la ACA se localiza no solo bajo el anillo pulmonar, sino que pasa también muy cerca de la DA, dejando muy poco espacio en medio para colocar un parche1.
i. Translocación de la arteria coronaria anómalaEn un artículo reportado por Luo et al.27 se describe la técnica empleada en 2pacientes de 3 y 19 años con TF y origen anómalo de la arteria coronaria derecha (ACD) desde la arteria coronaria izquierda. En este caso, la ACD proximal fue cuidadosamente desinsertada de la arteria coronaria izquierda y movilizada, sus ramas pequeñas proximales fueron pinzadas y seccionadas para conseguir una longitud adecuada para realizar la anastomosis, ya que la ACD proximal deberá ser reimplantada en la aorta ascendente sin tensión ni acodamiento. Tras la movilización de la ACD proximal, se realizó la incisión en el TSVD para la ampliación del infundíbulo. Para reimplantar la arteria coronaria se creó un orificio de 4mm en la cara anterior de la aorta ascendente. Tras completar la anastomosis entre la ACD proximal y la aorta ascendente, se administró cardioplejía para comprobar la ausencia de fugas a nivel del segmento movilizado.
Podemos encontrarnos con situaciones en las que existe una estenosis severa y extensa del TSVD, particularmente en niños mayores y adultos con TF, en los que sería necesario un parche transanular amplio para poder aliviar la obstrucción, pudiendo no ser efectivas otras técnicas. Si queremos intentar evitar el implante de un conducto, está técnica descrita podría resultar útil. Los autores sugieren que es una técnica relativamente sencilla, efectiva y coste-eficiente, y entre otras ventajas encontraríamos que evita el empleo de conductos y, al mismo tiempo, se mantiene el potencial de crecimiento de la arteria coronaria translocada1,27. Los resultados descritos a corto y medio plazo son satisfactorios. Pero también tiene ciertas limitaciones; en primer lugar, no es aplicable a todas las anomalías coronarias. En segundo lugar, debe tenerse precaución a la hora de realizar esta técnica en pacientes de corta edad, ya que la pequeña arteria coronaria tras el reimplante puede presentar un alto riesgo de estenosis u otros problemas, por ello los propios autores no recomiendan esta técnica en pacientes muy pequeños27.
Lesión en la arteria coronaria anómalaLa ACA puede ser seccionada accidentalmente al realizar la ventriculotomía. Diferentes autores han reportado el resultado y la técnica empleada para tratar esta complicación.
Cooley et al.28 reportaron el empleo de un injerto de arteria mamaria interna (AMI) a la DA anómala en un paciente de 16 meses de edad. La arteria coronaria, cuya localización no era conocida previamente, fue seccionada al realizar la ventriculotomía derecha. Tras disecar la AMI de forma pediculada, se aplicó clorhidrato de papaverina para favorecer su dilatación y el flujo a través de la misma, ya que su diámetro era de 1mm.
En un paciente de 13 años reportado por Shaffer et al.29, tras la ventriculotomía derecha se objetivó la lesión de una arteria DA aberrante. Se restauró el flujo sanguíneo de la arteria coronaria empleando un injerto de vena safena1,29.
En otro caso reportado por di Carlo et al.30 se produjo la transección inadvertida de una DA anómala que se originaba en la ACD. Fue manejado con un puente aorto-coronario creado con un conducto de politetrafluoroetileno de 4mm. Un cateterismo temprano postoperatorio comprobó la adecuada permeabilidad del injerto. Sin embargo, una gammagrafía miocárdica realizada a los 3 meses de la operación demostró una perfusión reducida de las áreas irrigadas por el sistema coronario izquierdo1,30.
Asano et al.31 describen un caso clínico en el que fue necesario el implante de una asistencia extracorpórea como puente a recuperación. El paciente tenía una arteria conal que se originaba de la porción proximal de la ACD, atravesaba el TSVD cerca del tronco pulmonar y alcanzaba el vértice del corazón. También existía una DA relativamente pequeña, pero con una localización normal, que terminaba en el ápex. Se supuso que la DA proporcionaría el suministro de sangre suficiente al miocardio incluso después de llevar a cabo una transección de la arteria conal para poder implantar un parche transanular como reconstrucción del TSVD. Aunque en un principio fue posible destetar al paciente de circulación extracorpórea, acabó necesitando un sistema de asistencia extracorpórea. Al séptimo día postoperatorio se pudo retirar la asistencia ante la mejoría progresiva ecocardiográfica y clínica. Al año de la cirugía se realizó un cateterismo cardiaco que mostró un DA sin anormalidades y una adecuada función cardiaca. Se objetivó el remanente de arteria del cono rellenándose retrógradamente desde la DA31. Es posible cortar una arteria del cono si es inevitable para poder reparar el TSVD, siempre y cuando se confirme que la DA es de adecuado tamaño y con una localización normal. El caso descrito nos hace ver la importancia de confirmar el área de miocardio irrigado por la ACA, así como la relación entre el tamaño de dicha arteria y otras arterias coronarias mayores antes de cualquier maniobra que pueda comprometer su flujo. Está claro que realizar un puente coronario puede ser la única forma de restablecer el suministro de sangre distal al sitio en el que se ha producido la transección de la arteria coronaria. Sin embargo, puede ser imposible realizar un injerto con un adecuado flujo sanguíneo en niños pequeños. En el caso clínico descrito por los autores31, el diámetro de la AMI era inferior a 1mm por lo que no era posible emplearla como injerto. Colocar un sistema de soporte extracorpóreo puede ser el único procedimiento de rescate, siempre que exista otra arteria coronaria que pueda asegurar el doble suministro de sangre31.
Respecto a la elección del tipo de injerto para tratar una lesión coronaria en la población pediátrica parece que la mejor opción es la AMI siempre que sea posible, ya que presenta muy buenos resultados a largo plazo y puede crecer en longitud y en diámetro conforme se produce el crecimiento somático, algo fundamental en estos pacientes. Además, se ha observado que el injerto de vena safena autóloga muestra una pobre respuesta al crecimiento del paciente, esencialmente no crece en longitud y, además, a menudo desarrolla una hiperplasia intimal y cambios degenerativos como estenosis, elongación, obstrucciones y dilatación aneurismática, lo que eventualmente conduce a la ateroesclerosis en 10-20 años32.
ComentariosAdemás de la elección de la técnica quirúrgica que más se adapte a nuestro paciente y a nuestra experiencia, en estos pacientes debemos tener en cuanta otros aspectos importantes. Cuando existe obstrucción a nivel del TSVD, tras la reparación es muy importante evaluar el gradiente de presión entre el VD y el ventrículo izquierdo; en concreto, en este grupo de pacientes, diferentes autores consideran que un relación de presión entre el VD y el ventrículo izquierdo en el postoperatorio inmediato de hasta 0,7 podría ser aceptable y no justificaría el implante de un conducto entre VD-AP5,7,13. Además, se ha observado que se produce un descenso significativo de la presión en el VD en el periodo postoperatorio temprano tras la intervención quirúrgica; de hecho hay autores10 que refieren que no miden gradiente de presión entre VD-AP de manera rutinaria en quirófano ni la relación de presión entre VD y el ventrículo izquierdo, por ello es menos probable que decidan emplear un conducto VD-AP por presiones elevadas en VD. Esta actitud la basan en su experiencia inicial, en la que observaron una caída significativa del gradiente de presión entre VD-AP días después de la reparación10. Es esperable que los gradientes dinámicos postoperatorios secundarios a un músculo cardiaco hipercontráctil por al empleo de inotrópicos disminuyan con el tiempo, mientras que los gradientes fruto de una obstrucción anatómica residual pueden persistir o incluso empeorar con el tiempo12. La persistencia de gradiente en el momento del alta excluye la posibilidad de que se deba al empleo de tratamiento inotrópico12. Posiblemente, la evaluación con ecocardiografía transesofágica intraoperatoria ayude a identificar a aquellos pacientes con ciertas características anatómicas que predicen una progresión del gradiente en el TSVD en el postoperatorio12. Kalra et al.12 han estudiado el gradiente de presión entre VD-AP en 25 pacientes con ACA y han concluido que los pacientes con gradientes inferiores a 30mmHg tienen un alivio eficaz a nivel del TSVD en el seguimiento12,13.
Respecto a la comparación entre las diferentes técnicas quirúrgicas que se han descrito para el tratamiento de estos pacientes, los resultados obtenidos por Kalfa et al.5 concluyen que el abordaje transauricular-transpulmonar parece presentar los mejores resultados a largo plazo, reduciendo el riesgo de obstrucción en el TSVD y de reoperación, aunque no mejoraba la supervivencia del paciente. Se trata de un estudio retrospectivo en el que estudian a 72 pacientes con TF y ACA cruzando el infundíbulo, los cuales fueron intervenidos quirúrgicamente empleando distintas técnicas (ventriculotomía adaptada a la localización de la arteria coronaria y reconstrucción con parche; conducto VD-AP; abordaje transatrial ± transpulmonar, y translocación de tronco pulmonar, aunque esta última técnica no la evaluaron, ya que solo se llevó a cabo en un paciente). Refieren además que los excelentes resultados no son el fruto de una selección sesgada de esta técnica quirúrgica en tipos menos graves de TF, ya que las puntuaciones z del anillo pulmonar fueron clínica y estadísticamente comparables en todos los grupos de técnicas quirúrgicas. El implante de un conducto entre VD-AP era factor de riesgo independiente para la obstrucción en el TSVD y la reoperación, lo que se explica por la ausencia de potencial de crecimiento del conducto implantado y su inevitable evolución hacia la restricción. Una relación de presión entre VD y ventrículo izquierdo en el postoperatorio de >0,5 se relaciona con una relación de presión VD/ventrículo izquierdo >0,5 a largo plazo, pero no es factor de riesgo para la reoperación o mortalidad. Signos electrocardiográficos de isquemia en el postoperatorio aumentaban independientemente el riesgo de fallo cardiaco a largo plazo. En el estudio de Pontailler et al.3 una relación de presión entre el VD y el ventrículo izquierdo superior a 2/3 fueron identificados como factores de riesgo para la reintervención y reoperación a nivel del TSVD.
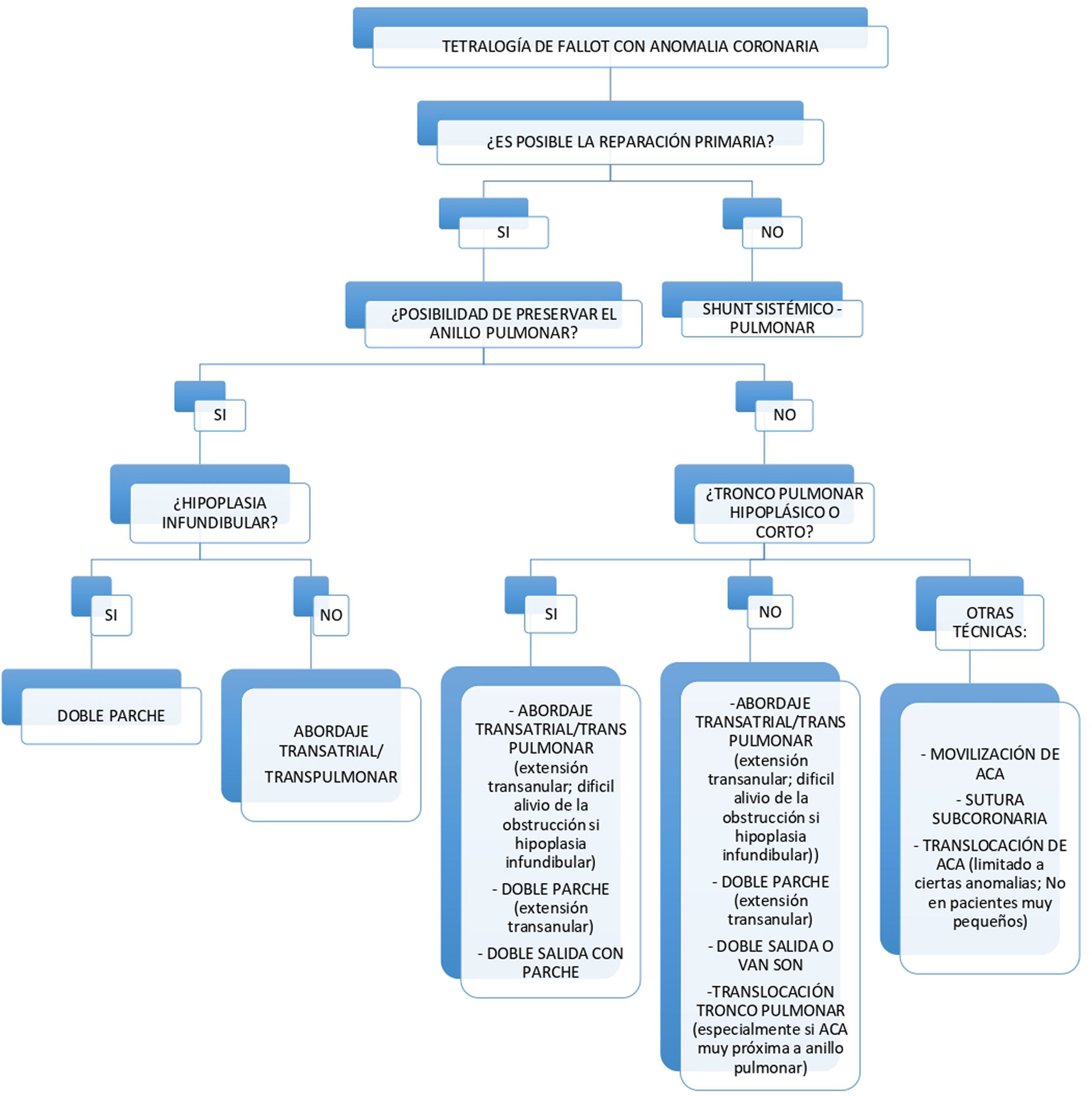
A lo largo del artículo hemos intentado recopilar la gran parte de las técnicas quirúrgicas que podemos encontrar en la literatura, cuyo objetivo fundamental es evitar el empleo de un conducto entre el VD y la AP en este grupo de pacientes. Basándonos en la literatura previamente comentada, y en las distintas características anatómicas que podemos encontrar en estos pacientes, podríamos considerar, como ayuda para elegir la técnica quirúrgica más apropiada, el siguiente esquema (fig. 9):
- –
En primer lugar, debemos preguntarnos si las características del paciente nos permiten realizar una reparación primaria, ya que, si no es posible, debemos plantearnos como primer acto quirúrgico la realización de un shunt sistémico-pulmonar para ganar tiempo.
- -
Si la reparación primaria es posible, creemos que la primera cuestión que debemos valorar es si el anillo pulmonar presenta un tamaño adecuado para poder ser conservado, evitando de esta manera una incisión transanular y la consiguiente insuficiencia pulmonar.
La técnica que nos plantearíamos en primer lugar sería el abordaje transauricular con o sin arteriotomía pulmonar; esta técnica evita la ventriculotomía pudiendo preservar mejor la función del VD a largo plazo, lo que consideramos de gran importancia. Otra técnica que valoraríamos sería la implantación de un doble parche, posiblemente sea mejor opción que la anterior si existe hipoplasia del infundíbulo, ya que en estos casos aliviar la obstrucción por vía transauricular-transpulmonar sin una ventriculotomía puede ser difícil.
b. Anillo valvular pulmonar hipoplásico- –
El abordaje transauricular/transpulmonar continúa siendo una opción válida, siendo necesario en este caso extender la incisión del tronco pulmonar de manera transanular; además, esta incisión podemos adaptarla y desviarla de forma que quede paralela a la ACA para evitar dañarla.
- –
Otra opción quirúrgica sería la técnica del doble parche y, al igual que lo comentado anteriormente, extenderíamos la incisión del tronco pulmonar atravesando el anillo pulmonar y de forma paralela al vaso coronario anómalo.
- –
La técnica de «doble salida o van Son» también sería una opción válida en este caso, con la limitación de que no sería posible realizarla si nos encontramos con un tronco pulmonar hipoplásico o demasiado corto; en ese caso, la creación de una doble vía con parche podría ser adecuada.
- –
La translocación del tronco pulmonar sería adecuada especialmente en los casos en los que el vaso coronario se encuentra muy próximo al anillo.
- –
Otras técnicas descritas en la literatura serían la movilización de la arteria coronaria para la ampliación del TSVD con parche por debajo de la misma, recordando que es necesario que el vaso coronario sea tortuoso y sin ramas a nivel de la región que es necesario movilizar. Por último, translocar la ACA, técnica limitada a ciertas anomalías coronarias y no recomendada en pacientes muy pequeños.
Nos parece interesante conocer también la técnica de sutura subcoronaria, ya que en algún caso puede resultar de ayuda.
Por tanto, la estrategia quirúrgica dependerá fundamentalmente de 3importantes aspectos:
- –
Localización y curso de la ACA.
- –
Tamaño del anillo pulmonar.
- –
Experiencia del cirujano con las diferentes técnicas.
Es primordial un adecuado diagnóstico preoperatorio de una anomalía coronaria en la TF, ya que esto será de gran ayuda para guiar al cirujano. La decisión final de la estrategia elegida deberemos hacerla en el momento de la cirugía, evaluando los distintos factores anatómicos interrelacionados y valorando los beneficios y riesgos de las diferentes técnicas. Nuestro objetivo final, sea cual sea la técnica elegida, deberá ser aliviar la obstrucción a nivel del TSVD todo lo posible, sin dañar la ACA.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.