El cruce duodenal de una anastomosis (SADI-S) es una cirugía bariátrica concebida como una simplificación del cruce duodenal. El objetivo de este estudio es valorar su seguridad y eficacia, comparando los casos operados en uno o dos tiempos.
MétodosEstudio descriptivo unicéntrico que compara los resultados de pacientes intervenidos de SADI-S en uno o dos tiempos entre 2014 y 2019.
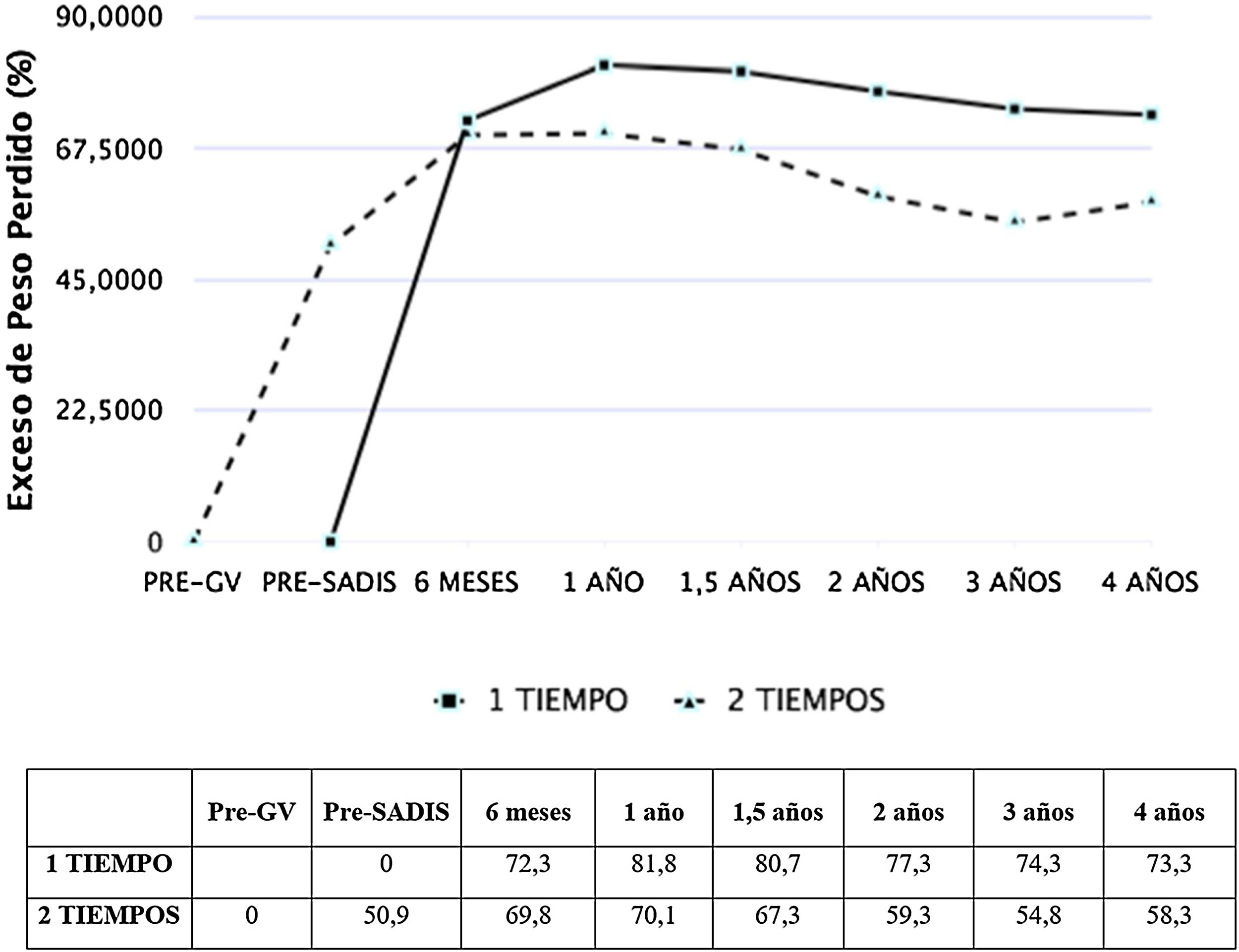
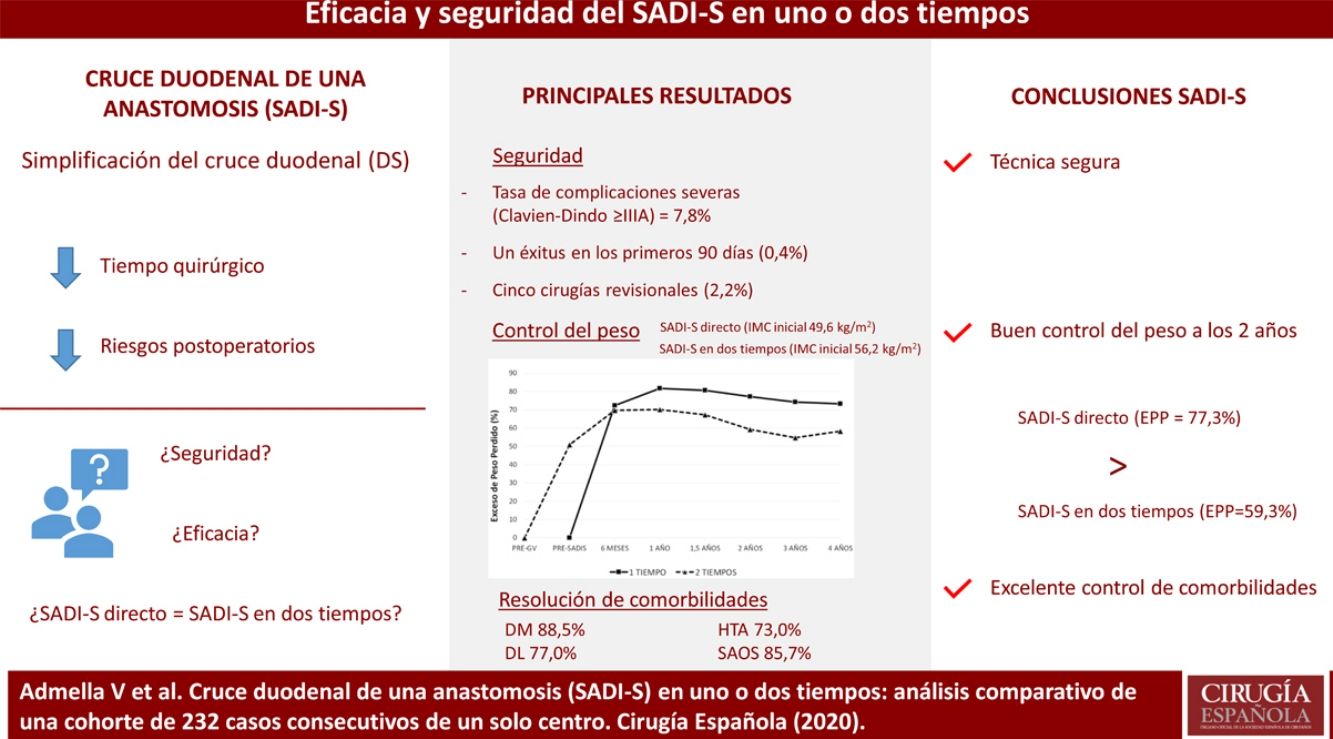
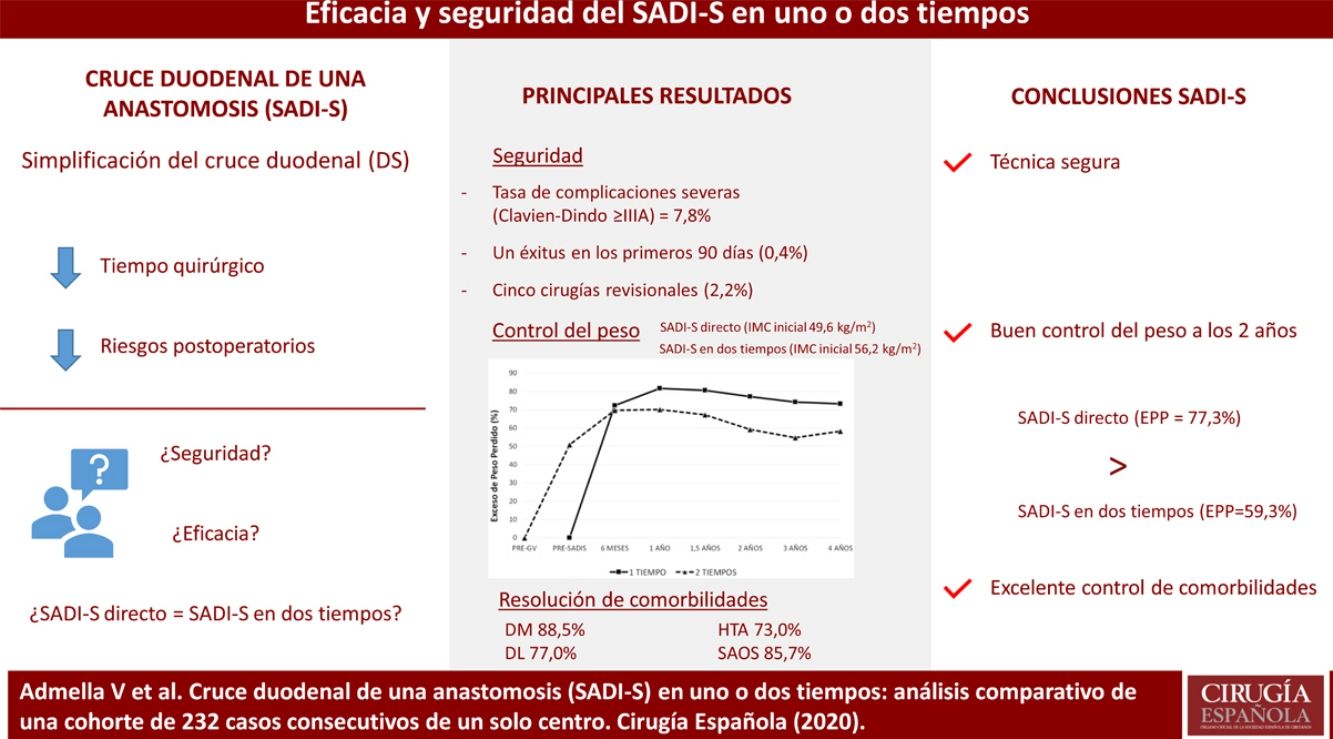
ResultadosSe incluyeron a 232 pacientes, 192 operados directamente y 40 sometidos previamente a una gastrectomía vertical. La tasa de complicaciones Clavien-Dindo ≥ IIIA fue 7,8%, siendo las más frecuentes el hemoperitoneo y la fístula de muñón duodenal. Hubo un éxitus en los primeros 90 días del 0,4%. Los pacientes sometidos a SADI-S directo partieron de un índice de masa corporal (IMC) de 49,6 kg/m2 y los operados en dos tiempos de 56,2 kg/m2 (p < 0,001), siendo el exceso de peso perdido a los dos años de ambos grupos de 77,3% y 59,3% respectivamente (p < 0,05). La tasa de resolución de la diabetes, hipertensión arterial, dislipemia y síndrome de apnea obstructiva del sueño fue de 88,5, 73,0, 77,0 y 85,7% respectivamente, sin diferencias entre el SADI-S en uno o dos tiempos.
ConclusiónEl SADI-S es una técnica segura y eficaz a medio plazo para la pérdida de peso y control de comorbilidades. Los pacientes intervenidos en dos tiempos partieron de un IMC mayor y presentaron menor porcentaje de exceso de peso perdido que los operados directamente.
The «Single Anastomosis Duodeno-Ileal bypass with Sleeve gastrectomy» (SADI-S) is a bariatric surgery conceived to simplify the duodenal switch in order to reduce its postoperative complications. The objective of this study is to assess the safety and efficacy of SADI-S, comparing its results in both direct and two-step procedure.
MethodsUnicentric cohort study that includes patients submitted to SADI-S, both direct or in two-step, between 2014 and 2019.
ResultsTwo hundred thirty-two patients were included, 192 were submitted to direct SADI-S and 40 had previously undergone a sleeve gastrectomy. The severe complications rate (Clavien-Dindo ≥ IIIA) was 7.8%, being hemoperitoneum and duodenal stump leak the most frequent ones. One patient was exitus between the first 90 days after surgery (0.4%). Patients submitted to direct SADI-S had an initial body mass index (BMI) of 49.6 kg/m2 in comparison of 56.2 kg/m2 in the two-step SADI-S (p < 0.001). The mean excess weight loss (EWL) at two years was higher in direct SADI-S (77.3 vs. 59.3%, p < 0.05). Rate of comorbidities resolution was 88.5% for diabetes, 73.0% for hypertension, 77.0% for dyslipidemia and 85.7% for sleep apnea, with no differences between both techniques.
ConclusionIn medium term, SADI-S is a safe and effective technique that offers a satisfactory weight loss and remission of comorbidities. Patients submitted to two-step SADI-S had a higher initial BMI and presented a lower EWL than direct SADI-S.
El cruce duodenal (CD) ha demostrado ser el procedimiento quirúrgico más efectivo para el tratamiento de la obesidad mórbida y sus comorbilidades1-5. Sin embargo, actualmente representa un reducido porcentaje de las cirugías bariátricas realizadas en el mundo, probablemente debido a su complejidad técnica y al riesgo de complicaciones a largo plazo6,7. Con la intención de simplificar la técnica del CD, en 2007 los doctores Sánchez-Pernaute y Torres introdujeron el CD de una anastomosis (Single Anastomosis Duodeno-Ileal bypass with Sleeve gastrectomy - SADI-S)8. La reconstrucción en omega, evitando la anastomosis distal íleo-ileal, pretende disminuir el tiempo quirúrgico y reducir los riesgos postoperatorios9. El SADI-S consiste en una gastrectomía vertical (GV) y una anastomosis duodeno-ileal con preservación del píloro, exclusión yeyunal y una asa común-alimentaria total, originalmente de 200 cm y estandarizada después a 300 cm para disminuir el riesgo de déficits nutricionales. El SADI-S puede realizarse como cirugía primaria directa, planificada en dos tiempos o como cirugía revisional en caso de fracaso de pérdida ponderal tras GV.
A pesar de las potenciales ventajas del SADI-S, existe escasa literatura que describa sus resultados en series amplias y homogéneas. El objetivo de este estudio es valorar las complicaciones postoperatorias, la pérdida de peso, la remisión de comorbilidades y los déficits nutricionales de una cohorte de pacientes sometidos a SADI-S en un único centro hospitalario de tercer nivel. Asimismo, comparar la seguridad y eficacia de realizar dicha técnica en uno o dos tiempos.
MétodosDiseño del estudio y poblaciónEstudio descriptivo que incluye a los pacientes intervenidos de SADI-S en uno o dos tiempos entre mayo de 2014 y septiembre de 2019. La cirugía bariátrica se indicó siguiendo los criterios de los National Institutes of Health (NIH)10. El algoritmo terapéutico de nuestra unidad indica las técnicas hipoabsortiva en pacientes con un índice de masa corporal (IMC) ± 45 kg/m2 con comorbilidades asociadas y sin clínica sugestiva de reflujo gastroesofágico (RGE), definida como la existencia de pirosis retroesternal, regurgitación alimentaria y/o toma habitual de fármacos inhibidores de la bomba de protones.
Circuito preoperatorioLos pacientes fueron valorados por el equipo multidisciplinar compuesto por especialistas en endocrinología, nutrición, psiquiatría, neumología, anestesia y cirugía, recibiendo educación sobre hábitos alimentarios, el tipo de cirugía y el manejo de sus emociones. Tras ello y antes de firmar el consentimiento informado, se discutieron los riesgos y potenciales beneficios de la cirugía. Se excluyeron los pacientes que presentaban un incremento superior al 10% del peso total en espera de cirugía. Un mes antes de la intervención se indicó una dieta hipocalórica de 1.500 kcal y, dos semanas antes, una dieta líquida con preparados hiperproteicos de 1.500 kcal para fomentar la pérdida de peso.
Técnica quirúrgicaLos pacientes fueron intervenidos bajo anestesia general en posición de anti-Trendelenburg con piernas separadas, situándose el cirujano principal entre las piernas del paciente. Al medir el intestino delgado, el cirujano principal se colocó al lado izquierdo del paciente. Se colocaron cinco trócares en la zona supraumbilical del abdomen y otro en fosa ilíaca izquierda. El primer paso consistía en la disección del bulbo duodenal hasta la arteria gastroduodenal, ligando de manera sistemática las arterias gastroepiploica derecha y gástrica derecha en sus orígenes. La GV se inició a 6 cm del píloro, utilizando una sonda de 36-40 Fr. Posteriormente, el duodeno fue seccionado utilizando una GIA de carga blanca. El asa de intestino delgado fue medida desde la válvula íleo-cecal hasta 300 cm, realizando una anastomosis duodeno-ileal manual con sutura monofilamento reabsorbible en dos planos. Se cerró el espacio de Petersen mediante una sutura continua no absorbible. Se comprobó la indemnidad de la sutura mediante azul de metileno o endoscopia. Finalmente, se colocó un drenaje intraabdominal próximo a la anastomosis y el ángulo de His11.
Seguimiento postoperatorioDurante el ingreso, se reforzó la educación dietética. Al alta se pautaron suplementos multivitamínicos (vitaminas del grupo B, C y E, cinc, selenio y coenzima Q10), comprimidos de vitamina D y calcio (1.000 mg carbonato cálcico + 800 UI colecalciferol), ácido ursodesoxicólico (300 mg/8 h), subgalato de bismuto (200 mg/8 h) y módulo de proteínas (20 g/día). Los pacientes fueron visitados en consultas por cirujano, endocrinólogo y nutricionista al mes 1, 3, 6, 12 y 18; después anualmente hasta los seis años, incluyendo analíticas a los 3, 6, 12, 18 meses y posteriormente anuales.
Recogida de datos y definicionesLos datos se extrajeron de una base de datos prospectiva, incluyendo variables demográficas, ponderales, de diabetes mellitus (DM), hipertensión arterial (HTA), dislipemia (DL), síndrome de apnea obstructiva del sueño (SAOS), tipo de cirugía, complicaciones en los primeros 30 días (tipo y gravedad según el score de Clavien-Dindo), mortalidad a los 30 y 90 días, evolución postoperatoria del peso a los seis meses, al año y después anualmente, resolución de las comorbilidades, complicaciones a largo plazo, necesidad de suplementación extraordinaria por déficits nutricionales y cirugías revisionales. El porcentaje de exceso de peso perdido (% EPP) fue calculado tomando como referencia un IMC ideal de 25 kg/m2. La resolución de comorbilidades fue definida como la completa retirada del tratamiento específico.
Análisis estadísticoAl tratarse de un estudio de cohortes no se realizó una hipótesis previa ni se calculó un tamaño muestral12. La evolución del peso corporal fue expresada por el % EPP y el IMC. Las diferencias entre el SADI-S en uno o dos tiempos fueron estudiadas mediante un análisis χ2 para las variables discretas y t-Student para las continuas, considerando la diferencia significativa si p < 0,05. Todos los análisis estadísticos fueron realizados con el programa informático IBM-SPSS Statistics 20®.
ResultadosDatos demográficos basales y operatoriosSe incluyeron 232 pacientes operados de SADI-S, 192 (82,8%) directamente y 40 (17,2%) tras GV, con un intervalo medio entre ambas cirugías de 34,3 meses (rango 6,2-107,1 meses).
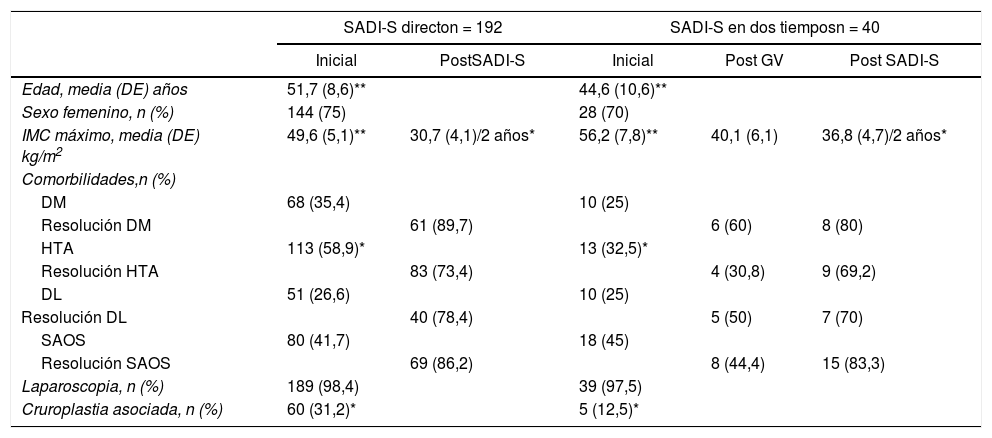
En la tabla 1 se describen las principales características de los pacientes intervenidos de SADI-S en uno o dos tiempos. Los pacientes operados directamente presentaron mayor edad (51,7 vs. 44,6 años, p < 0,001) y menor IMC inicial que los intervenidos en dos tiempos (49,6 vs. 56,2, p < 0,001). En la prevalencia de comorbilidades ambos grupos fueron homogéneos excepto para la HTA (p < 0,05). Todos los procedimientos fueron realizados laparoscópicamente a excepción de cuatro casos que fueron operados por cirugía abierta: un paciente de entrada por antecedente de diversas cirugías previas y tres convertidos por dificultades técnicas.
Características demográficas basales y postoperatorias de los pacientes intervenidos de SADI-S en uno y dos tiempos
| SADI-S directon = 192 | SADI-S en dos tiemposn = 40 | ||||
|---|---|---|---|---|---|
| Inicial | PostSADI-S | Inicial | Post GV | Post SADI-S | |
| Edad, media (DE) años | 51,7 (8,6)** | 44,6 (10,6)** | |||
| Sexo femenino, n (%) | 144 (75) | 28 (70) | |||
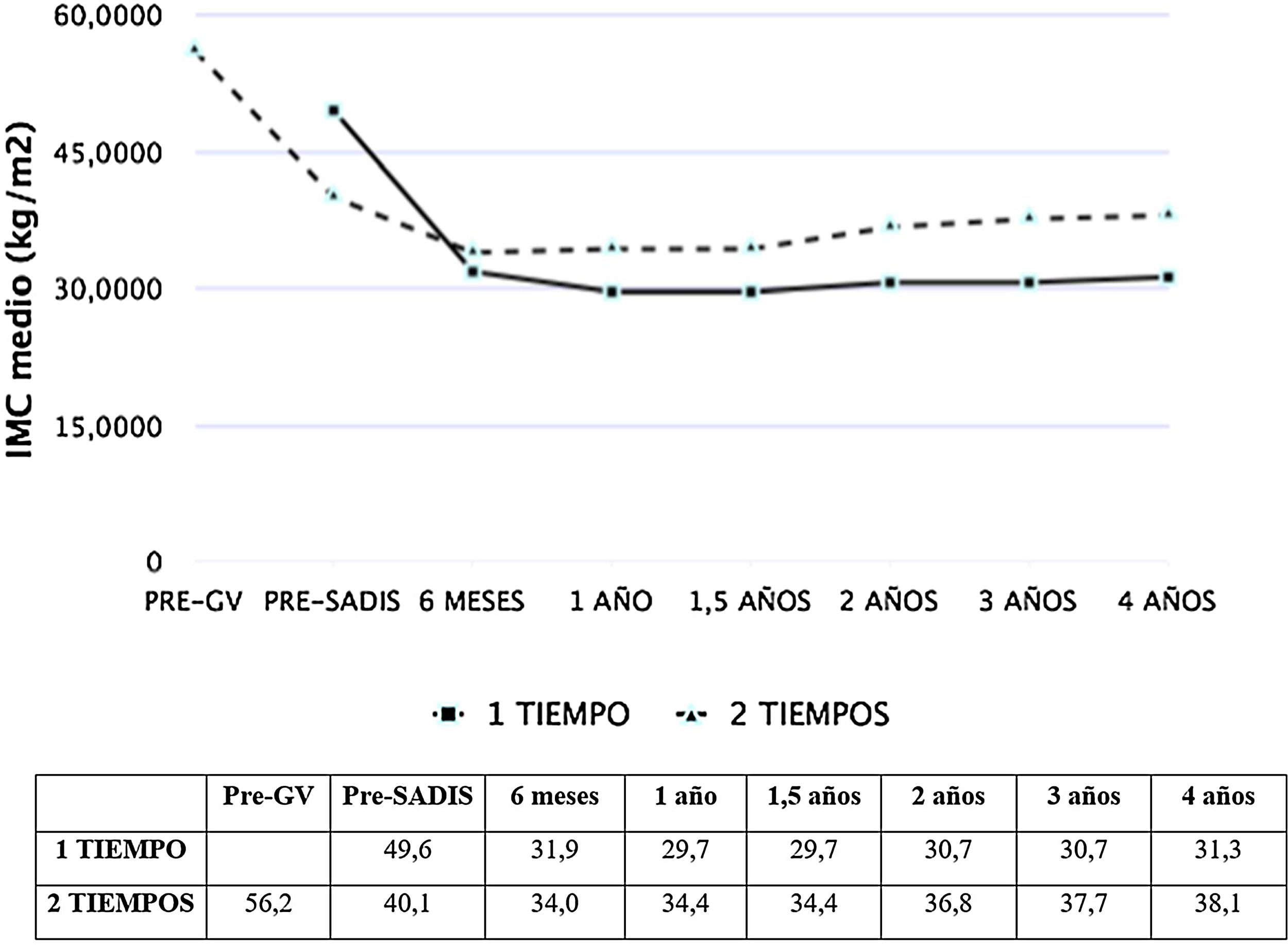
| IMC máximo, media (DE) kg/m2 | 49,6 (5,1)** | 30,7 (4,1)/2 años* | 56,2 (7,8)** | 40,1 (6,1) | 36,8 (4,7)/2 años* |
| Comorbilidades,n (%) | |||||
| DM | 68 (35,4) | 10 (25) | |||
| Resolución DM | 61 (89,7) | 6 (60) | 8 (80) | ||
| HTA | 113 (58,9)* | 13 (32,5)* | |||
| Resolución HTA | 83 (73,4) | 4 (30,8) | 9 (69,2) | ||
| DL | 51 (26,6) | 10 (25) | |||
| Resolución DL | 40 (78,4) | 5 (50) | 7 (70) | ||
| SAOS | 80 (41,7) | 18 (45) | |||
| Resolución SAOS | 69 (86,2) | 8 (44,4) | 15 (83,3) | ||
| Laparoscopia, n (%) | 189 (98,4) | 39 (97,5) | |||
| Cruroplastia asociada, n (%) | 60 (31,2)* | 5 (12,5)* | |||
DL: dislipemia; DM: diabetes mellitus; HTA: hipertensión arterial; IMC: índice de masa corporal; SADI-S: single anastomosis duodeno-ileal bypass with sleeve gastrectomy; SAOS: síndrome de apnea obstructiva del sueño.
El seguimiento medio de los pacientes fue de 22,3 ± 12 meses (3,3-63,9 meses), sin diferencias entre los pacientes operados en uno o dos tiempos (22,5 ± 12 meses vs. 21,4 ± 14 meses). El número de pacientes con seguimiento a los 1, 2, 3 y 4 años fue de 175, 68, 27 y 11 respectivamente.
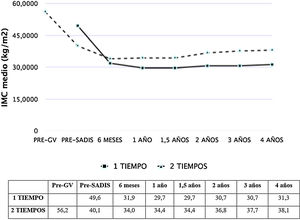
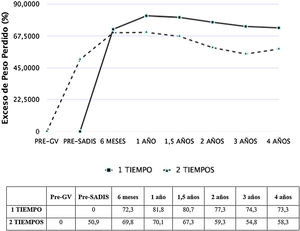
Las figuras 1 y 2 muestran la evolución del IMC y % EPP en ambos grupos. En los pacientes operados directamente el % EPP fue de 81,8% al año y 73,3% a los cuatro años. En los intervenidos en dos tiempos, considerando como peso máximo el previo a la GV, el % EPP tras la GV fue 50,9%, llegando a un máximo de 70,1% tras seis meses del SADI-S y descendiendo a 58,3% a los cuatro años. El porcentaje de peso total perdido fue de 40,3% al año y 38,5% a los dos años, sin diferencias significativas entre el SADI-S en uno o dos tiempos.
La tasa de resolución global de la DM, HTA, DL y SAOS fue del 88,5%, 73,0%, 77,0% y 85,7% respectivamente, sin observarse diferencias entre el SADI-S en uno o dos tiempos (tabla 1).
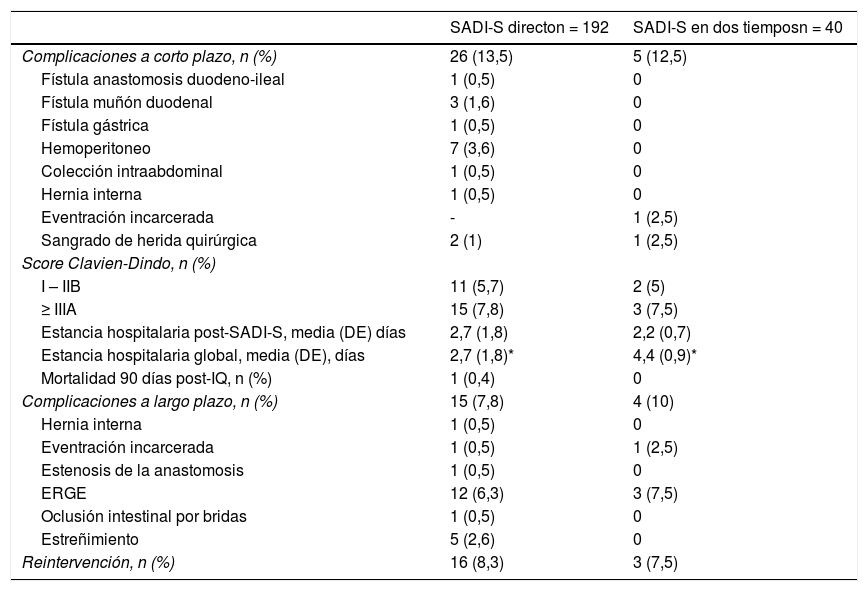
Complicaciones postoperatorias y cirugías revisionalesEn la tabla 2 se resumen las complicaciones a corto (< 30 días) y largo plazo (> 30 días). La tasa global de complicaciones a corto plazo fue 13,4% y la de complicaciones severas (Clavien-Dindo ≥ IIIA) 7,8%; sin diferencias entre los dos grupos. Las complicaciones más frecuentes fueron el hemoperitoneo (3,0%) y la fístula del muñón duodenal (1,3%), ambos únicamente en los pacientes sometidos a SADI-S directo. No hubo ninguna complicación secundaria a la GV previa en los pacientes operados en dos tiempos. La estancia media post SADI-S fue de 2,9 ± 2 días, sin diferencias entre los dos grupos. Existió un caso de mortalidad en los primeros 30 días (0,4%) por infarto tras reintervención por hemoperitoneo. No hubo ningún éxitus entre los 30 y los 90 días del postoperatorio.
Complicaciones a corto (< 30 días) y largo plazo (> 30 días) tras SADI-S en uno o dos tiempos
| SADI-S directon = 192 | SADI-S en dos tiemposn = 40 | |
|---|---|---|
| Complicaciones a corto plazo, n (%) | 26 (13,5) | 5 (12,5) |
| Fístula anastomosis duodeno-ileal | 1 (0,5) | 0 |
| Fístula muñón duodenal | 3 (1,6) | 0 |
| Fístula gástrica | 1 (0,5) | 0 |
| Hemoperitoneo | 7 (3,6) | 0 |
| Colección intraabdominal | 1 (0,5) | 0 |
| Hernia interna | 1 (0,5) | 0 |
| Eventración incarcerada | - | 1 (2,5) |
| Sangrado de herida quirúrgica | 2 (1) | 1 (2,5) |
| Score Clavien-Dindo, n (%) | ||
| I – IIB | 11 (5,7) | 2 (5) |
| ≥ IIIA | 15 (7,8) | 3 (7,5) |
| Estancia hospitalaria post-SADI-S, media (DE) días | 2,7 (1,8) | 2,2 (0,7) |
| Estancia hospitalaria global, media (DE), días | 2,7 (1,8)* | 4,4 (0,9)* |
| Mortalidad 90 días post-IQ, n (%) | 1 (0,4) | 0 |
| Complicaciones a largo plazo, n (%) | 15 (7,8) | 4 (10) |
| Hernia interna | 1 (0,5) | 0 |
| Eventración incarcerada | 1 (0,5) | 1 (2,5) |
| Estenosis de la anastomosis | 1 (0,5) | 0 |
| ERGE | 12 (6,3) | 3 (7,5) |
| Oclusión intestinal por bridas | 1 (0,5) | 0 |
| Estreñimiento | 5 (2,6) | 0 |
| Reintervención, n (%) | 16 (8,3) | 3 (7,5) |
IQ: intervención quirúrgica; RGE: reflujo gastroesofágico; SADI-S: single anastomosis duodeno-ileal bypass with sleeve gastrectomy.
La tasa global de complicaciones a > 30 días fue de 8,2%. La más frecuente fue el RGE sintomático, presente en 15 pacientes (6,5%), demostrándose en tres de ellos una etiología biliar. Dos pacientes (0,9%) presentaron una hernia interna por defecto del espacio de Petersen a los 12 días y a los cuatro meses del SADI-S. Un total de 19 pacientes (8,2%) precisaron una reintervención urgente a raíz de las complicaciones presentadas a corto o largo plazo. Entre los motivos principales de reintervención destacó el hemoperitoneo, interviniéndose durante el ingreso el conjunto total de pacientes que presentaron dicha complicación; además de la presencia de fístula del muñón duodenal, eventración incarcerada y hernia interna. Se produjeron cinco cirugías revisionales (2,2%): dos por reganancia ponderal, dos por reflujo biliar persistente y una por estenosis de la anastomosis, realizándose en todos los casos la conversión a CD.
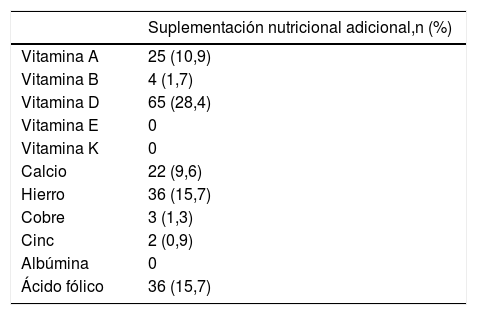
Necesidad de suplementos nutricionalesLa tabla 3 describe las necesidades de suplementación nutricional adicional al estándar. No se observaron diferencias entre el SADI-S en uno o dos tiempos. No hubo casos de hipoalbuminemia o desnutrición proteínica que requirieran suplementos o cirugía revisional.
Proporción global de pacientes con suplementación nutricional adicional tras SADI-S
| Suplementación nutricional adicional,n (%) | |
|---|---|
| Vitamina A | 25 (10,9) |
| Vitamina B | 4 (1,7) |
| Vitamina D | 65 (28,4) |
| Vitamina E | 0 |
| Vitamina K | 0 |
| Calcio | 22 (9,6) |
| Hierro | 36 (15,7) |
| Cobre | 3 (1,3) |
| Cinc | 2 (0,9) |
| Albúmina | 0 |
| Ácido fólico | 36 (15,7) |
Nuestro estudio de cohortes confirma que la técnica SADI-S, en uno o dos tiempos, es una técnica segura y eficaz en pacientes con un IMC > 45 kg/m2, tanto a nivel ponderal como de control de comorbilidades. Actualmente, ésta es una de las cohortes de referencia con mayor número de pacientes y seguimiento a nivel internacional.
SeguridadEl 7,8% de los pacientes presentaron complicaciones precoces severas (Clavien-Dindo ≥ IIIA), con una tasa de reintervención global del 8,2% y una mortalidad del 0,4%, valores similares a los descritos en la literatura13,14. No se evidenciaron diferencias en la proporción de complicaciones ni en la estancia hospitalaria post-SADI-S entre el SADI-S directo o en dos tiempos, también en concordancia con estudios previos15,16. Sin embargo, las complicaciones en el SADI-S directo presentaron mayor relevancia: los casos de hemoperitoneo y fístula de muñón duodenal sólo se dieron en dicho grupo. Biertho et al. describieron que el riesgo de fístula de anastomosis duodeno-ileal disminuyó de 2,6 a 0,4% cuando pasaron de sutura mecánica circular a manual17. En todos los pacientes de nuestra cohorte se realizó una anastomosis manual, presentando un riesgo global de fístula de anastomosis duodeno-ileal del 0,4%. Nuestro grupo inició la práctica de esta anastomosis en 2008 con el CD, por lo que al introducir el SADI-S en 2016 había superado la curva de aprendizaje.
Igual que en otras cirugías bariátricas, el cierre del orificio de Petersen es controvertido. En nuestro centro lo cerramos sistemáticamente, tanto en el SADI-S, como en CD y bypass gástrico. En la actualidad, solo existe un caso publicado de hernia interna tras SADI-S18; los dos casos reportados en el presente estudio suponen el 0,9% de nuestra cohorte. El CD, en el que el mesenterio es dividido, presenta tasas de hernia interna de hasta el 8%19.
Uno de los argumentos de los detractores del SADI-S es la posibilidad de reflujo biliar. En nuestra serie hubo tres casos sintomáticos. Sería razonable esperar una mayor incidencia en las técnicas con reconstrucción tipo Billroth ii que no preservan la barrera pilórica, como el mini-gastric bypass. Aunque las incidencias publicadas de reflujo biliar sintomático tras un mini-gastric bypass varían entre el 0,5-1,5%20,21, comparables a las de nuestro estudio, conviene recordar que no todos los reflujos biliares son sintomáticos y que la gastritis biliar es una condición premaligna22.
Nuestros pacientes presentaron una proporción de necesidad de suplementación extra a la habitual inferior a las propias del CD23-25, sin ningún caso de desnutrición. Es sabido que la absorción de nutrientes, en especial de vitaminas liposolubles, está relacionada directamente con la longitud del asa común26. El SADI-S descrito originalmente, cuya asa eferente era de 200 cm, presentó tasas de hipoalbuminemia del 12% y cirugía revisional por diarrea de hasta 5%9; los pacientes de esta cohorte tenían un asa eferente de 300 cm, variante técnica que algunos autores han denominado «SIPS» (Stomach-Intestinal Pylorus Sparing surgery)27,28.
EficaciaLos pacientes intervenidos de SADI-S directo presentaron un óptimo control del peso a medio plazo. A los tres años se alcanzó un IMC de 30,7 kg/m2, similar al de 28,1 kg/m2 reportado por Torres et al.29. El % EPP de nuestro estudio, de 77,3% a los dos años, es comparable con el rango de 72-100% descrito en la revisión sistemática de Shoar et al.30, a pesar de que el IMC inicial de nuestros pacientes fue de 50 kg/m2, superior al de varios de esos estudios. Estos resultados globales son similares a los obtenidos por el CD23 y superiores a los de la GV y el bypass gástrico, en especial para el tratamiento de la súper obesidad (IMC ≥ 50 kg/m2)1,4-6.
La eficacia del SADI-S en dos tiempos fue menos satisfactoria, presentando un % EPP de 59,3% a los dos años de la cirugía, inferior al de otras series similares como la de Sánchez-Pernaute et al. (72%)15 y la de Balibrea et al. (78,9%)16. Un motivo del fracaso relativo en este grupo de pacientes de nuestro estudio podría ser su alto IMC inicial: 56,2 kg/m2 (vs. 49,6 kg/m2 en el SADI-S directo, p < 0,001). En un estudio previo, evidenciamos que el CD obtenía mejor control del peso que el SADI-S en pacientes con IMC máximo inicial ≥ 55 kg/m2 (IMC/dos años < 35 kg/m2 = 82,6% vs. 65,7%; p < 0,05), así como mayor resolución de DM (100 vs. 75%; p < 0,05)23. Probablemente, al decidir la técnica para rescatar a un paciente con mal control ponderal tras GV, sea importante valorar el IMC máximo pre-GV, indicando preferentemente un CD si fue ≥ 55 kg/m2. El fracaso inicial de una cirugía bariátrica selecciona los pacientes con menor adherencia a las recomendaciones dietéticas, por lo que en ellos es especialmente necesario valorar la técnica más eficaz. Otro argumento que podría justificar la diferencia de resultados entre ambos grupos es el largo tiempo transcurrido entre la GV y el SADI-S (media de 34,3 meses); ello puede haber ocasionado una adaptación de los pacientes a la primera intervención quirúrgica, influyendo negativamente en el resultado de la pérdida ponderal del SADI-S en dos tiempos.
La tasa de resolución global de comorbilidades en este estudio fue destacable, con valores para DM, HTA, DL y SAOS de 88,5, 73,0, 77,0 y 85,7% respectivamente, resultados similares a los obtenidos en otros estudios de cirugía hipoabsortiva y superiores a los conseguidos tras cirugía restrictiva1,13,29,30.
Las limitaciones del presente estudio incluyen su naturaleza retrospectiva, lo que hace posible que no todas las complicaciones leves hayan sido recogidas. Además, solo el 4,7% de pacientes presentan un seguimiento > 4 años, motivo por el cual aún desconocemos el comportamiento del SADI-S a largo plazo.
En conclusión, el SADI-S es una técnica segura y eficaz a medio plazo en pérdida de peso y control de comorbilidades tanto en uno como en dos tiempos, aunque los pacientes intervenidos directamente presentaron complicaciones de especial relevancia. El grupo de SADI-S directo consiguió mejor control de peso que el realizado en dos tiempos, partiendo de un IMC inicial menor. Son necesarios estudios con resultados a largo plazo para definir la adecuada indicación del SADI-S.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este artículo.
Conflicto de interesesVíctor Admella, Javier Osorio, Maria Sorribas, Lucía Sobrino, Anna Casajoana, y Jordi Pujol-Gebellí declaran no tener ningún conflicto de interés.