El tratamiento más efectivo para el cáncer de pulmón es la resección pulmonar completa, si bien las recidivas llegan hasta el 10% y la aparición de segundos primarios, hasta el 6%. Será, por tanto, indispensable el seguimiento de estos pacientes para la detección y tratamiento precoces de estos eventos; sin embargo, no existe una definición de la forma, tiempo y cadencia de estos seguimientos. En el presente documento de consenso, tratamos de definirlos con base en la evidencia científica disponible.
Se realiza una revisión crítica de la bibliografía (metaanálisis, revisiones sistemáticas, revisiones, recomendaciones de consenso de sociedades científicas, estudios controlados aleatorizados, estudios controlados no aleatorizados, estudios observacionales y estudios de series de casos) y comunicaciones a los principales congresos de oncología y cirugía torácica en castellano, inglés y francés. Se clasifican las evidencias halladas siguiendo el sistema GRADE.
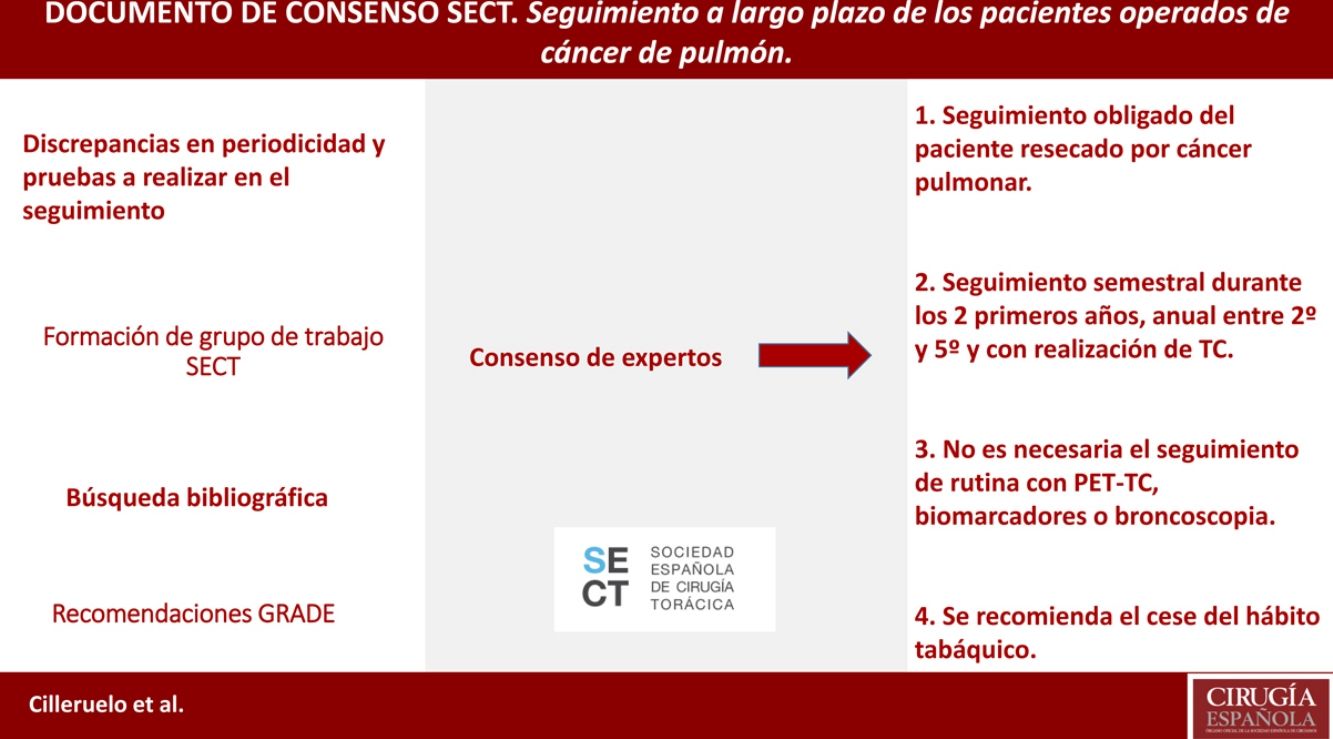
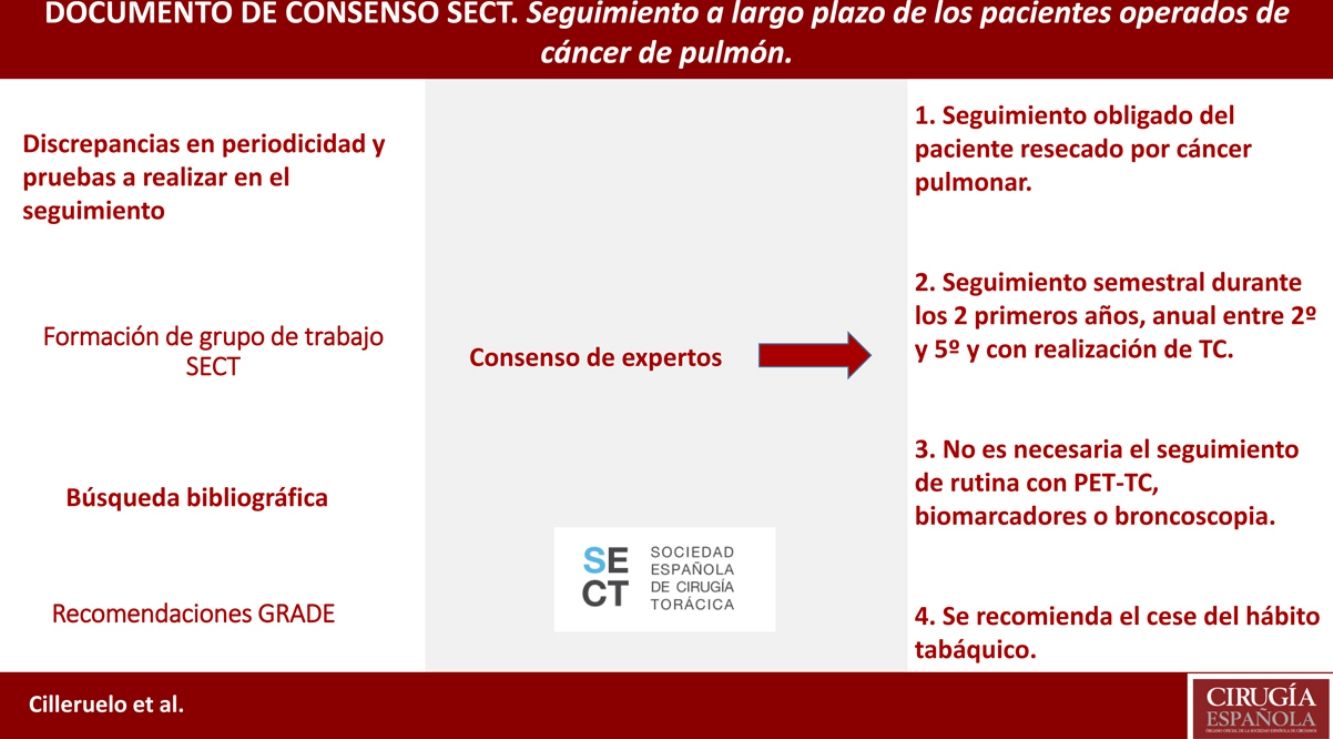
Queda definido, según la evidencia existente, que se debe realizar un seguimiento del paciente resecado por cáncer pulmonar, así como que este seguimiento debe ser estrecho durante los primeros años y con realización de TC (no siendo necesario el seguimiento con tomografía por emisión de positrones-tomografía computarizada [PET-TC], biomarcadores o broncoscopia). Se recomienda también en ese seguimiento el cese del hábito tabáquico.
The most effective treatment for lung cancer is complete lung resection, although recurrences reach up to 10% and the appearance of second neoplasms, up to 6%. Therefore, the follow-up of these patients will be essential for the early detection and treatment of these events; however, there is no definition of the form, time and cadence of these follow-ups. In this consensus document, we try to define them based on the available scientific evidence.
A critical review of the literature is carried out (meta-analysis, systematic reviews, reviews, consensus recommendations of scientific societies, randomized controlled studies, non-randomized controlled studies, observational studies and case series studies) and communications to the main congresses on oncology and thoracic surgery in Spanish, English and French. The evidences found are classified following the GRADE system.
It is defined according to the existing evidence that the patient resected for lung cancer should be followed up, as well as that this follow-up should be close during the first years and with CT (not being necessary to follow up with PET-CT, biomarkers or bronchoscopy). Cessation of smoking is also recommended in this follow-up.
El cáncer de pulmón es la principal neoplasia maligna con una elevada incidencia mundial y la mayor tasa de mortalidad a nivel global, provocando cerca de 1,9 millones de muertes anualmente. Aproximadamente el 85% de los tumores se clasifican como no microcítico1 (CPNCP), siendo el carcinoma microcítico (CPCP) la práctica totalidad del grupo restante.
La resección completa del CPNCP sigue siendo el método más eficaz para el control del mismo en estadios iniciales (I, II y en algunos estadios III de la American Joint Committee on Cancer TNM); en el caso del CPCP, la resección con intención curativa también puede lograrse en estadios I2.
Pese al tratamiento radical, la supervivencia acumulada de los pacientes a cinco años tras cirugía con intención curativa es de 50-60%, con un descenso significativo y relevante conforme aumenta la estadificación patológica del tumor 2. Esta caída en la supervivencia puede venir derivada de complicaciones del tratamiento quirúrgico, comorbilidades presentes, recidivas tumorales (tratables o no) y de la aparición de segundos tumores.
Las complicaciones inmediatas tras cirugía no son infrecuentes, en un análisis de la base de datos Surveillance, Epidemiology and End Results (SEER) se identificaron hasta un 12,8% de pacientes que requirieron reingreso en el mes posterior a cirugía pulmonar por complicaciones cardiorrespiratorias, en relación con factores identificados como el tipo de resección, edad, radioterapia previa y comorbilidades, siendo el riesgo de mortalidad a 90 días en estos pacientes seis veces superior a la de los pacientes que no presentaban estas complicaciones3. Además, los pacientes que presentan mayor exceso de mortalidad a largo plazo por causas diferentes del cáncer lo hacen por comorbilidad respiratoria o cardiovascular4.
En una amplia serie quirúrgica, el riesgo individual de recidiva tumoral oscilaba entre el 6 al 10% anual en los primeros cuatro años poscirugía, cayendo al 2% anual, a partir de entonces; el riesgo de padecer una segunda neoplasia pulmonar no decaía con el tiempo, siendo este del 3 al 6% de manera constante5.
En los dos primeros años de seguimiento, el patrón de recidivas es habitualmente a nivel local y regional, cobrando mayor importancia la recaída metastásica entre el segundo y el cuarto años, con una posterior disminución paulatina con el tiempo6. Existe aún incertidumbre acerca del riesgo de segundos tumores en función del hábito tabáquico previo7.
Para que una estrategia de seguimiento tras un tratamiento con intención curativa tenga éxito, la detección de una posible recaída local o a distancia, o un segundo tumor metacrónico deberían poder ser tratados con algún tipo de tratamiento radical que pueda prolongar la supervivencia.
Los tratamientos curativos tras una recaída local en pocas ocasiones son posibles, con unas cifras de supervivencia a cinco años tras la recurrencia del 15%8. En el caso de un segundo tumor primario, las cifras son mejores, con supervivencia a los cinco años de hasta 60%9. Esta posibilidad de incrementar la supervivencia tras una recaída o una segunda neoplasia hace especialmente indicado elaborar una estrategia de seguimiento por ese potencial beneficio en supervivencia.
Incluso en el caso de recaídas en forma de enfermedad metastásica, donde la posibilidad de curación es una opción escasamente alcanzable, hay datos prospectivos que invitan a pensar que un manejo con terapias ablativas puede tener un impacto positivo en supervivencia10.
Por todo esto se debe protocolizar y estandarizar una metodología de seguimiento basada en la anamnesis periódica, exploración física y un uso racional de pruebas complementarias en los pacientes sometidos a resección curativa por un cáncer de pulmón, dado el potencial impacto beneficioso en la supervivencia de estos en caso de producirse una recidiva tumoral.
Este documento de consenso pretende ser una propuesta cuyo objetivo es armonizar un protocolo de seguimiento para los pacientes tratados quirúrgicamente de cáncer de pulmón que sea aplicable y reproducible en los diferentes entornos asistenciales, basado en la evidencia científica disponible en la actualidad.
Material y métodosEn enero de 2019 se conformó el grupo para el «Estudio del seguimiento a largo plazo de los pacientes operados de cáncer de pulmón», dentro de la Sociedad Española de Cirugía Torácica (SECT), conformado por cirujanos torácicos y oncólogos.
Inicialmente se procedió a realizar una búsqueda de la literatura en las siguientes bases de datos: PubMed, Cochrane Library, UpToDate y Embase, escogiéndose los siguientes términos para la búsqueda: «lung cancer», «thoracic surgery», «follow-up» y «lung resection surgery or cancer lung surgery». Se consideraron aptos para ello, los metaanálisis, revisiones sistemáticas, revisiones, recomendaciones de consenso de otras sociedades distintas a las implicadas en estas guías, estudios controlados aleatorizados, estudios controlados no aleatorizados, estudios observacionales y estudios de series de casos. Se incluyeron los estudios en los que se dispuso de acceso completo al contenido y que habían sido publicados desde enero de 2010 hasta mayo de 2020 que estuvieran escritos en inglés, francés o español. Adicionalmente, se añadieron algunas referencias más antiguas por su relevancia. El número de trabajos revisados fue 75, de los que se excluyeron 26 por no cumplir el número mínimo de pacientes incluidos en el estudio (10) o por existir alguna referencia bibliográfica posterior de actualización. De igual manera, se hizo una revisión de las recomendaciones de seguimiento de las principales sociedades científicas internacionales, así como de las comunicaciones más relevantes en congresos internacionales de cirugía torácica y oncología médica. El análisis bibliográfico se realizó por todos los miembros del grupo, con base en los hallazgos encontrados se decidió qué aspectos del seguimiento merecían ser valorados con detenimiento y cada experto analizó en profundidad cada área asignada. Cada autor aportó sus recomendaciones, las discrepancias se resolvieron con reunión del equipo, puesta en común de todos los argumentos y decisión consensuada de todo el grupo de trabajo de forma telemática.
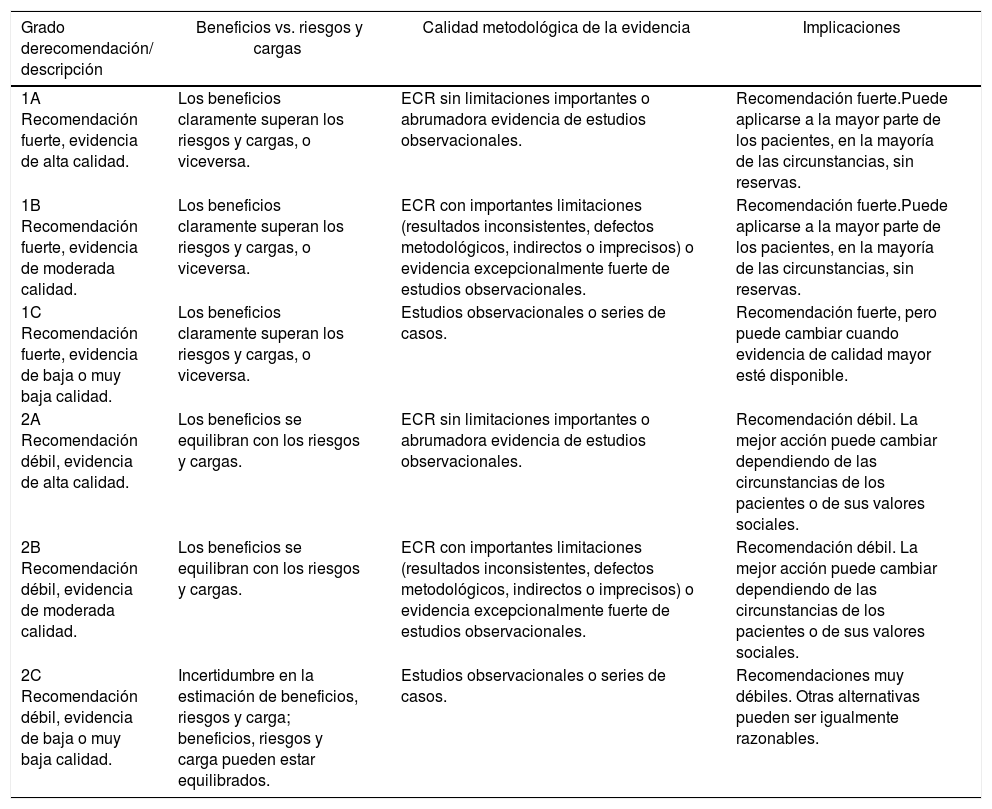
Para la evaluación de la calidad de la evidencia y la elaboración de las recomendaciones se han seguido las directrices del grupo de trabajo GRADE. Una recomendación fuerte implica que la mayoría de los pacientes deberían recibir la intervención y una débil reconoce que diferentes opciones son válidas, y habrá que tener en cuenta los valores y las preferencias de los pacientes. El nivel de evidencia en el que se sustenta la recomendación puede ser alto, moderado, bajo o muy bajo; la clasificación se basa en el diseño y la calidad metodológica de los estudios analizados11 (tabla 1).
Resumen de las directrices del grupo de trabajo GRADE
| Grado derecomendación/ descripción | Beneficios vs. riesgos y cargas | Calidad metodológica de la evidencia | Implicaciones |
|---|---|---|---|
| 1A Recomendación fuerte, evidencia de alta calidad. | Los beneficios claramente superan los riesgos y cargas, o viceversa. | ECR sin limitaciones importantes o abrumadora evidencia de estudios observacionales. | Recomendación fuerte.Puede aplicarse a la mayor parte de los pacientes, en la mayoría de las circunstancias, sin reservas. |
| 1B Recomendación fuerte, evidencia de moderada calidad. | Los beneficios claramente superan los riesgos y cargas, o viceversa. | ECR con importantes limitaciones (resultados inconsistentes, defectos metodológicos, indirectos o imprecisos) o evidencia excepcionalmente fuerte de estudios observacionales. | Recomendación fuerte.Puede aplicarse a la mayor parte de los pacientes, en la mayoría de las circunstancias, sin reservas. |
| 1C Recomendación fuerte, evidencia de baja o muy baja calidad. | Los beneficios claramente superan los riesgos y cargas, o viceversa. | Estudios observacionales o series de casos. | Recomendación fuerte, pero puede cambiar cuando evidencia de calidad mayor esté disponible. |
| 2A Recomendación débil, evidencia de alta calidad. | Los beneficios se equilibran con los riesgos y cargas. | ECR sin limitaciones importantes o abrumadora evidencia de estudios observacionales. | Recomendación débil. La mejor acción puede cambiar dependiendo de las circunstancias de los pacientes o de sus valores sociales. |
| 2B Recomendación débil, evidencia de moderada calidad. | Los beneficios se equilibran con los riesgos y cargas. | ECR con importantes limitaciones (resultados inconsistentes, defectos metodológicos, indirectos o imprecisos) o evidencia excepcionalmente fuerte de estudios observacionales. | Recomendación débil. La mejor acción puede cambiar dependiendo de las circunstancias de los pacientes o de sus valores sociales. |
| 2C Recomendación débil, evidencia de baja o muy baja calidad. | Incertidumbre en la estimación de beneficios, riesgos y carga; beneficios, riesgos y carga pueden estar equilibrados. | Estudios observacionales o series de casos. | Recomendaciones muy débiles. Otras alternativas pueden ser igualmente razonables. |
ECR: ensayo clínico randomizado.
El seguimiento de rutina de pacientes operados con intención radical de un cáncer de pulmón en estadio localizado está recomendado en todas las guías de las principales sociedades científicas, tanto a nivel nacional o internacional. Sin embargo, dada la escasez de evidencia científica, no hay consenso en el esquema y modalidades de seguimiento óptimo de los pacientes. A continuación, se resumen las principales recomendaciones de otras sociedades científicas:
Sociedad Española de Oncología Médica (SEOM)12Año de publicación: 2019.
- 1.
Recomendación: seguimiento cercano después del tratamiento curativo para identificar complicaciones relacionadas con el tratamiento, la detección de una recaída tratable o la aparición de un segundo cáncer primario de pulmón.
- 2.
Modalidad: visita de seguimiento incluyendo historia clínica y examen físico, así como tomografía computarizada (TC) del tórax cada 6-12 meses durante los primeros dos años y anualmente a partir de entonces.
- 3.
Otras recomendaciones:
- -
Abandono del hábito tabáquico.
- -
No se recomienda seguimiento de rutina con análisis de sangre, tomografía por emisión de positrones-tomografía computarizada (PET-TC) u otra evaluación radiológica.
Año de publicación: 2016.
- 1.
Recomendación: seguimiento por equipo multidisciplinario, considerando las complicaciones relacionadas con la terapia y detectar la recidiva tumoral y/o la aparición de cualquier segundo tumor primario.
- 2.
Modalidad: monitorización inicial cada tres o seis meses y luego una vez al año. Un periodo de cinco años no es suficiente para considerar a un paciente curado, particularmente en el caso de afectación de los ganglios linfáticos o vascular.
Año de publicación: 2020.
- 1.
Recomendación: seguimiento rutinario con exámenes de detección programados, para la detección de recurrencia local o de un segundo primario.
- 2.
Modalidad: vigilancia cada seis meses durante dos años (al menos a los 12 y 24 meses), y después anual, con una visita que incluye historia, examen físico y TC de tórax, preferiblemente con contraste, para detectar segundos tumores primarios.
- 3.
Otras recomendaciones:
- -
Abandono del hábito tabáquico, preferiblemente combinando técnicas de comportamiento con tratamiento médico.
- -
En caso de un nuevo hallazgo se deberá discutir el caso en un equipo multidisciplinario para evaluar si se trata de una complicación del tratamiento, una metástasis o un nuevo tumor primario.
Año de publicación: 2017.
- 1.
Recomendación: seguimiento periódico recomendado después de cirugía radical, considerando el riesgo de recurrencia.
- 2.
Modalidad: visita periódica (sin frecuencia definida) que incluya historia clínica, examen físico y TC de tórax con/sin contraste durante los dos a cinco primeros años, seguidos de una visita anual con una historia/exploración física y TC de baja dosis.
- 3.
Otras recomendaciones:
- -
Abandono del hábito tabáquico, incluyendo asesoramiento y tratamientos médicos disponibles.
- -
El PET-TC o la resonancia magnética (RM) cerebral no se recomienda como pruebas de rutina.
Año de publicación: 2013.
- 1.
Recomendación: seguimiento de rutina recomendado después de la resección.
- 2.
Modalidad: visita de seguimiento con TC de tórax cada seis meses durante los primeros dos años y cada año posteriormente.
- 3.
Otras recomendaciones:
- -
Los médicos de referencia deberían participar en la toma de decisiones durante el seguimiento.
- -
Utilización de instrumentos validados de calidad de vida relacionados con la salud en las visitas iniciales y durante el seguimiento.
- -
No se recomienda el PET-TC, gammagrafía con receptor de somatostatina o ecografía abdominal como exámenes de rutina.
- -
No se recomienda la realización de biomarcadores de seguimiento (fuera de los ensayos clínicos).
Año de publicación: 2019.
- 1.
Recomendación: seguimiento periódico recomendado para detectar recidivas y nuevos tumores pulmonares primarios, a partir de los dos primeros años.
- 2.
Modalidad: seguimiento cada seis meses durante dos años, y después anualmente, siendo la TC de tórax la prueba de imagen óptima para el seguimiento. A partir de los dos años, se deberá realizar una TC de tórax de baja dosis.
- 3.
Otras recomendaciones:
- -
El PET-TC y la resonancia magnética (RM) cerebral no deben utilizarse para el seguimiento.
- -
No se recomienda la realización de biomarcadores circulantes para la detección de recurrencia.
- -
La edad no debe considerarse una restricción para el seguimiento. Se recomienda considerar el estado de salud general, las condiciones médicas crónicas y las preferencias de los pacientes.
- -
En el caso de un CPCP en estadio I-III sometido a tratamiento con intención curativa, la RM cerebral puede usarse cada tres meses durante el primer año y cada seis meses durante el segundo año.
Teniendo en cuenta lo expuesto anteriormente, uno de los factores que más influye en la supervivencia de los pacientes intervenidos de cáncer de pulmón (50-60% a 5 años) es el desarrollo de recidivas5. La dinámica de estas recurrencias muestra un pico en los primeros nueve meses postratamiento, así como al final del segundo y cuarto años6. Es por ello que se recomienda realizar un seguimiento postratamiento para detectar precozmente la aparición de recurrencias o de segundas neoplasias antes de que aparezcan síntomas e iniciar un potencial tratamiento sin demora, y con ello mejorar la supervivencia y la calidad de vida18–20.
Hoy en día disponemos de varias guías clínicas para la estadificación, tratamiento y seguimiento de los pacientes con cáncer de pulmón. La mayoría se basan en estudios observacionales y revisiones sistemáticas, no existiendo consenso sobre cuál es el mejor esquema y la frecuencia ideal de seguimiento postoperatorio. En otras neoplasias se realizan revisiones cada tres a seis meses, con lo que la mayoría de clínicos considera razonable este esquema de seguimiento en el caso del cáncer de pulmón21–22. Por el contrario, un estudio reciente ha demostrado que un seguimiento estrecho cada tres meses tras la resección pulmonar no se asocia con una mejora de la supervivencia global ni la supervivencia tras una recidiva, comparado con un seguimiento bianual o anual23.
Las principales guías previamente comentadas recomiendan un seguimiento más estrecho durante los dos primeros años, coincidiendo con el riesgo máximo de recidivas, pero difieren tanto en la modalidad como en los intervalos de tiempo recomendados.
Como conclusión, no existe consenso en cuanto a la frecuencia y la duración ideal de seguimiento de los pacientes tratados de cáncer de pulmón. Con base en la evidencia disponible de otros tumores sólidos, parece razonable establecer controles clínicos cada seis meses durante los primeros dos años, incluyendo pruebas de imagen (TC de tórax). (Recomendación fuerte; nivel de evidencia bajo).
Por otra parte, se recomienda el seguimiento más allá de esos dos primeros años tras el tratamiento curativo, especialmente por el riesgo de desarrollo de nuevas neoplasias de pulmón hasta los cinco años, pudiendo alargar dicho seguimiento hasta los 10 años. (Recomendación débil; nivel de evidencia bajo).
Entrevista, exploración y pruebas complementarias a realizar en el seguimientoa) Entrevista clínica y exploración físicaLa entrevista clínica y exploración física pueden resultar determinantes en el diagnóstico precoz de complicaciones postoperatorias, ya que hasta el 12,8% de los pacientes operados pueden reingresar después de una resección pulmonar, siendo los motivos principales: insuficiencia respiratoria, neumonía, neumotórax y complicaciones cardíacas3. Teniendo en cuenta los tiempos actuales en los que nos encontramos, resulta especialmente interesante el uso de las herramientas ofimáticas que permiten hacer un seguimiento sin necesidad del desplazamiento de los pacientes. En 2017 se publicaron los resultados de un estudio comparando el seguimiento tradicionalmente aceptado con uno basado en herramientas vía web, observando una supervivencia mayor en el grupo de intervención (mediana de supervivencia global [SG] de 19 meses vs. mediana de SG de 12,0 meses; hazard ratio [HR] 0,32, intervalo de confianza [IC] 95%, 0,15-0,67)24. Más tarde, el mismo grupo ha demostrado que este seguimiento vía web es más coste-eficaz que el tradicional (diferencia de 362 euros por paciente por año, en Francia)25. El cuestionario online contenía 12 datos o síntomas que se recomiendan valorar en cada visita, tanto física como virtual: pérdida de peso, disminución de apetito, dolor, tos, disnea, depresión, fiebre, sudoración facial, cambios en la voz, esputos hemoptoicos y aparición de bultos bajo la piel24,25.
En estas visitas también resulta fundamental incidir en el cese del hábito tabáquico, ya que con ello se consiguen mejores resultados al tratamiento26. (Recomendación fuerte, nivel de evidencia alto).
b) Marcadores tumoralesAunque los marcadores tumorales pueden tener un papel relevante en el seguimiento de algunos tumores sólidos, no se ha demostrado una utilidad clínica en el cáncer de pulmón no célula pequeña16.
En la actualidad son muchos los biomarcadores en investigación en cáncer de pulmón, siendo un ejemplo de ello el seguimiento postoperatorio de la enfermedad mínima residual (EMR) por biopsia líquida, pero por el momento se encuentran en investigación. Por ello, no se recomienda el uso de marcadores tumorales en el seguimiento fuera de ensayos clínicos13,16,26. (Recomendación débil; nivel de evidencia bajo).
c) Radiografía simple de tóraxAunque la radiografía se ha utilizado clásicamente para el seguimiento del cáncer de pulmón tras cirugía, las últimas actualizaciones de las principales guías recomiendan preferiblemente el seguimiento mediante TC13,16,26. Por ello, parece que el papel de la radiografía en el seguimiento dependerá principalmente de la frecuencia de las revisiones, presencia de complicaciones postoperatorias y hallazgos en la exploración o anamnesis de los pacientes. Podría considerarse la realización de radiografía de tórax cuando, por cualquier motivo clínico, se prefiera realizar un seguimiento más estrecho entre los periodos en que se realice la TC, así como cuando se sospeche alguna complicación. No se recomienda seguimiento con radiografía simple en ausencia de sospecha de complicaciones pleuropulmonares. (Recomendación fuerte, nivel de evidencia moderado).
d) TC: dosis estándar, baja y mínimaLa TC es a día de hoy una de las estrategias de vigilancia posquirúrgica más empleada en estos pacientes (tabla 2). Sin embargo, la mayor parte de la evidencia disponible para justificar su uso rutinario deriva de estudios observacionales retrospectivos, teniendo, por tanto, un nivel de evidencia bajo.
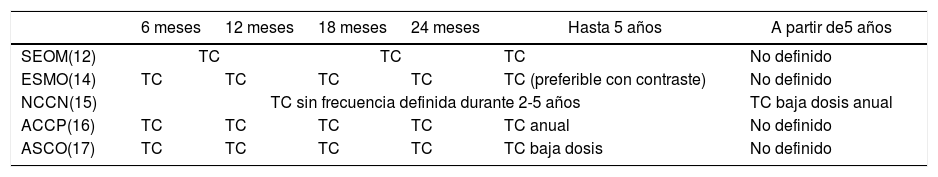
Resumen de pruebas complementarias recomendadas por las sociedades científicas
| 6 meses | 12 meses | 18 meses | 24 meses | Hasta 5 años | A partir de5 años | |
|---|---|---|---|---|---|---|
| SEOM(12) | TC | TC | TC | No definido | ||
| ESMO(14) | TC | TC | TC | TC | TC (preferible con contraste) | No definido |
| NCCN(15) | TC sin frecuencia definida durante 2-5 años | TC baja dosis anual | ||||
| ACCP(16) | TC | TC | TC | TC | TC anual | No definido |
| ASCO(17) | TC | TC | TC | TC | TC baja dosis | No definido |
SEOM: Sociedad Española de Oncología Médica; ESMO: European Society of Medical Oncology; NCCN: National Comprehensive Cancer Network; ACCP: American College of Chest Physicians; ASCO: American Society of Clinical Oncology; TC: tomografía computarizada.
Un metaanálisis incluyendo datos de 1.669 pacientes intervenidos por CPNCP demostró que el seguimiento con TC se asociaba con una mejora significativa en la supervivencia cuando se diagnostica una recurrencia asintomática (odds ratio [OR]: 0,61, IC 95%: 0,5-0,7)27. No obstante, los propios autores advierten de la heterogeneidad en el diseño y potenciales limitaciones de los estudios incluidos.
La única evidencia de seguimiento en ensayo prospectivo aleatorizado es el estudio multicéntrico IFCT-030228, en el que se evaluó la estrategia de seguimiento con examen clínico y radiografía de tórax, o un seguimiento con TC toracoabdominal y broncoscopia (opcional para adenocarcinomas). Se incluyeron 1.775 pacientes con CPNCP en estadio I-II-IIIA resecado que completaron visitas de seguimiento cada seis meses durante los primeros dos años, y anualmente hasta cinco años. Sus resultados preliminares fueron presentados en el congreso europeo de la ESMO 2017, en Madrid, con una mediana de seguimiento de ocho años y 10 meses. No se observaron diferencias en SG entre los grupos (HR 0,95, IC 95%: 0,82-1,09), con una mediana de 99,7 meses en el brazo de control y 123,6 meses en el brazo experimental. Las tasas de supervivencia libre de enfermedad a tres años también fueron similares, 63,3 y 60,2%, respectivamente, al igual que las tasas de SG a ocho años, 51,7 y 54,6%, respectivamente. Los resultados definitivos de este trabajo no han sido publicados aún.
Dado que los principales objetivos del seguimiento son la detección de una recidiva loco-regional y el diagnóstico precoz de una neoplasia pulmonar metacrónica, se recomienda el seguimiento con TC torácica. No existe evidencia que justifique la inclusión del campo cerebral o abdomino-pélvico para detección de metástasis extratorácicas asintomáticas.
Tampoco disponemos de evidencia concluyente en relación con la frecuencia óptima de seguimiento con TC. La mayor parte de sociedades científicas recomienda una vigilancia más estrecha durante los dos primeros años, como se especifica en el apartado correspondiente de este documento.
Uno de los principales argumentos en contra del seguimiento con TC es la exposición continuada a la radiación ionizante, con el potencial riesgo iatrogénico que ello implica29. Esto ha condicionado un creciente interés por las nuevas modalidades tecnológicas de tomografía con dosis baja y mínima. La tabla 3 resume las dosis efectivas de radiación de las pruebas de imagen más utilizadas en este contexto.
Dosis efectivas de radiación en pruebas de imagen
| Prueba de imagen | Dosis de radiación efectiva aproximada |
|---|---|
| Radiografía simple de tórax | 0,1 mSv |
| TC torácica estándar | 7-8 mSv |
| TC torácica de dosis baja | 1,5 mSv |
| TC de dosis mínima | 0,2 mSv |
| PET-TC | 25 mSv |
PET-TC: tomografía por emisión de positrones-tomografía computarizada.
Frente a la dosis aproximada de 7-8 mSv que ofrece una TC de dosis estándar (equivalente a unas 70-80 radiografías simples de tórax), la TC de dosis baja emite en torno a 1,5 mSv30. Aunque no existen estudios específicos que analicen esta tecnología para el seguimiento, los buenos resultados obtenidos en el ámbito del cribado de cáncer de pulmón tal vez puedan extrapolarse a esta subpoblación de alto riesgo18,31,32.
La TC de dosis mínima emite una dosis media de 0,2 mSv, comparable a los 0,1 mSv de una radiografía simple de tórax. En un estudio prospectivo comparando estas dos pruebas de imagen en 231 pacientes tras resección de un carcinoma pulmonar, la TC de dosis mínima tuvo mayor valor predictivo negativo que la radiografía para el diagnóstico de recidiva o segunda neoplasia33. Otro estudio prospectivo confirmó una sensibilidad del 91% para la detección de nódulos pulmonares, tomando la TC de dosis estándar como referencia34. Algunas publicaciones advierten de las posibles limitaciones de la técnica en pacientes obesos o para evaluación de opacidades en vidrio deslustrado34,35.
Por tanto, se recomienda el seguimiento con TC como herramienta diagnóstica. (Recomendación fuerte; nivel de evidencia bajo).
e) PET-TCLa PET-TC no se considera una prueba de elección en el seguimiento del paciente asintomático intervenido quirúrgicamente. En el contexto postoperatorio pueden obtenerse falsos positivos derivados de la inflamación, especialmente en las cicatrices de toracotomía36. Algunos estudios han demostrado su utilidad para diagnosticar recurrencias37,38, incluso mejor que las exploraciones radiológicas estándar39,40, pero también pueden pasar desapercibidas hasta un 10% de las lesiones identificadas en TC debido a la imposibilidad de realizar la técnica con respiración controlada41. Además, implica una dosis de radiación elevada (en torno a 25 mSv), no fácilmente accesible en todos los entornos clínicos y existe controversia acerca de su coste-efectividad.
En cualquier caso, la PET-TC sí puede resultar de utilidad en casos de alta sospecha clínico-radiológica o recurrencia confirmada para determinar la mejor estrategia terapéutica y el pronóstico42,43.
Como conclusión, se considera adecuada la realización de PET-TC en los pacientes intervenidos por cáncer de pulmón que presenten sospecha de recidiva o metástasis en la TC, no recomendándose en el seguimiento rutinario. (Recomendación débil, nivel de evidencia bajo).
f) FibrobroncoscopiaEn un estudio clásico de vigilancia posquirúrgica intensiva con TC y broncoscopia sobre 192 pacientes, fue diagnosticada una recidiva exclusivamente gracias a la técnica endoscópica en el 7% de los pacientes44. Los resultados del estudio IFCT-0302 reflejan que no existen diferencias significativas en la supervivencia global, al comparar el seguimiento con TC más broncoscopia vs. radiografía de tórax28.
En cambio, el seguimiento endoscópico resulta de vital importancia tras cirugías seleccionadas con márgenes de resección escasos, como las broncoplastias parciales o completas (en manguito o «sleeves»), así como en el caso de resección endoscópica de tumores carcinoides45 o ante la sospecha de recidiva central por pruebas de imagen. En este sentido, la ecografía endobronquial (EBUS) ha adquirido un especial protagonismo por su versatilidad, permitiendo de forma adicional la biopsia de lesiones sin componente endobronquial o adenopatías hilio-mediastínicas46,47.
No existe evidencia sólida acerca de la frecuencia y duración del seguimiento recomendados en estos contextos seleccionados. Dado que la mayor parte de recurrencias tras una cirugía por carcinoma pulmonar se diagnostican en los dos primeros años48, suele extrapolarse este dato al seguimiento estrecho de una broncoplastia. En el caso de resección endoscópica de tumores carcinoides, parece prudente mantener el seguimiento al menos 10 años49.
Por tanto, se recomienda no realizar broncoscopia como estrategia sistemática de seguimiento. (Recomendación débil, nivel de evidencia bajo).
Resumen de recomendaciones SECT- 1.
Se recomienda incidir en el cese del hábito tabáquico en las consultas de seguimiento. (Recomendación fuerte, nivel de evidencia alto).
- 2.
Se recomienda hacer seguimiento con radiografía simple cuando exista sospecha de complicaciones pleuropulmonares, no recomendándose en el seguimiento rutinario. (Recomendación fuerte, nivel de evidencia moderado).
- 3.
Seguimiento con TC cada seis meses durante los dos primeros años. (Recomendación fuerte, nivel de evidencia bajo).
- 4.
Seguimiento con TC cada 12 meses, a partir del segundo hasta el quinto año, pudiéndose alargar hasta los 10 años por la posibilidad de desarrollo de segundas neoplasias. (Recomendación débil, nivel de evidencia bajo).
- 5.
No se recomienda la utilización rutinaria de marcadores tumorales en el seguimiento fuera de ensayos clínicos. (Recomendación débil, nivel de evidencia bajo).
- 6.
Se considera adecuada la realización de PET-TC en los pacientes intervenidos por cáncer de pulmón que presenten sospecha de recidiva o metástasis en la TAC, no recomendándose en el seguimiento rutinario. (Recomendación débil, nivel de evidencia bajo).
- 7.
No se recomienda el seguimiento con broncoscopia en los pacientes intervenidos de cáncer de pulmón. (Recomendación débil, nivel de evidencia bajo).
Los autores declaran no haber recibido ninguna fuente de financiación para la elaboración de este estudio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.