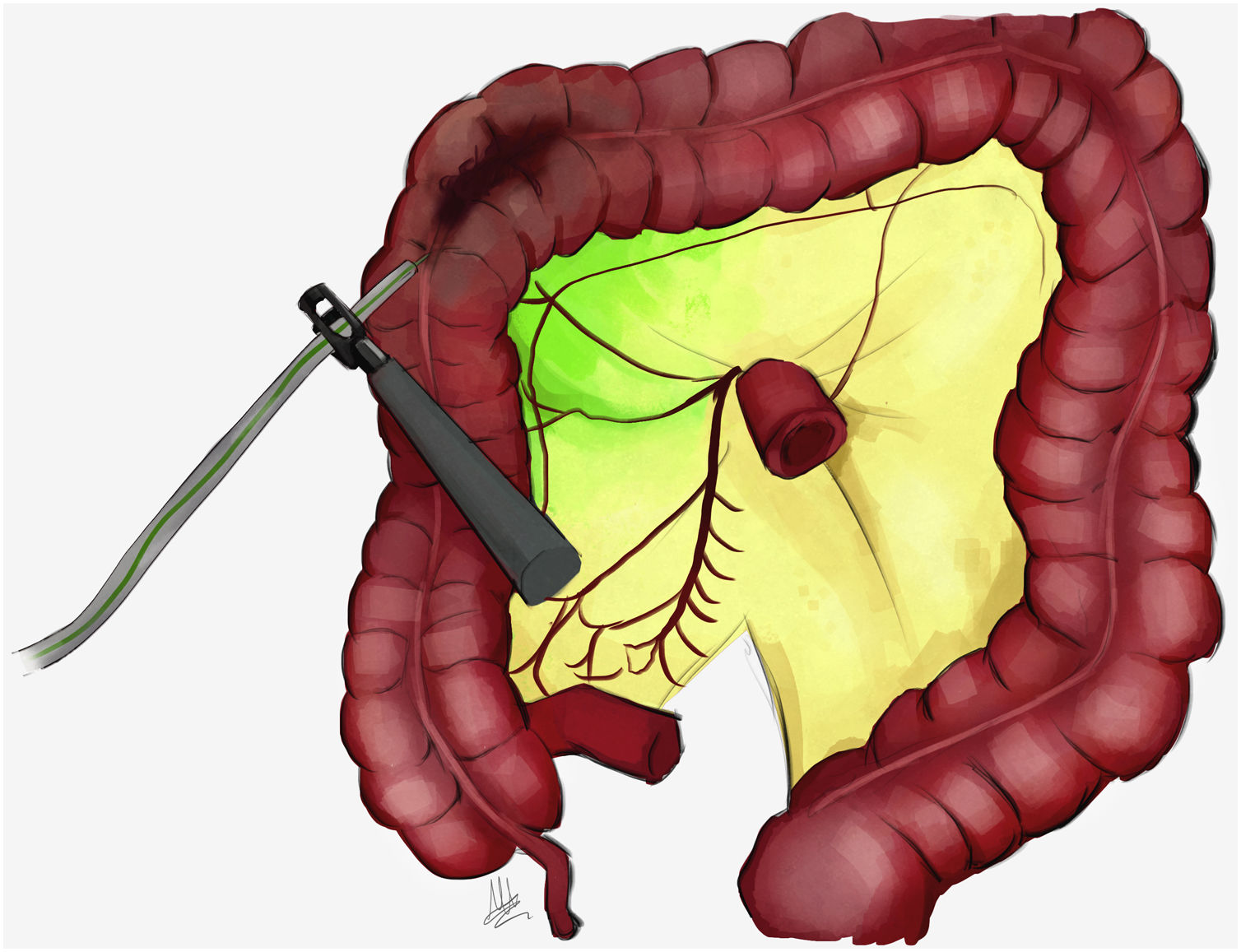
El cáncer de colon es el más frecuente en nuestro país. El tratamiento con mayores garantías de curación a día de hoy es la resección quirúrgica con márgenes libres y un adecuado recuento ganglionar. En dicha resección, la escisión del tejido mesentérico/linfoganglionar1, que hipotéticamente podría estar afecto por la diseminación de la lesión primaria en función de su localización, cobra un valor crucial con importancia en la curación, la estadificación y consecuentemente el pronóstico del paciente2.
En la última década se ha producido una revolución en términos de radicalidad oncológica linfoganglionar y estándares de calidad quirúrgica en el cáncer de colon. El término escisión completa del mesocolon, que inició esta revolución de la mano del equipo del profesor Werner Hohenberger de la Universidad de Erlangen, define la disección del plano embriológico mesocólico y la ligadura central o próxima a la raíz de las principales estructuras vasculares relacionadas con el tumor como un estándar3. Por otra parte, y de manera más heterogénea y reciente, se define la linfadenectomía D3 o aquella que incluye la estación ganglionar más alta (como la vela mesocólica derecha y el tronco de la vena cólica superior derecha en la colectomía derecha), defendida por algunos autores que principalmente encuentran respaldo en su defensa en los tumores con adenopatías positivas en los territorios descritos4. La calidad de la evidencia disponible, y la dificultad en universalizarlas debido a la demanda técnica y logística que exigen, colocan la cuestión de la radicalidad resectiva del mesocolon en el punto de mira de la controversia en lo que se refiere al tratamiento quirúrgico estándar del cáncer de colon2,4–7.
Del mismo modo, el concepto de cirugía guiada por fluorescencia ha ido creciendo exponencialmente en los últimos ya casi 10 años en la coloproctología. La base de dicho concepto es la infusión de un colorante biológico como el verde indocianina o ICG, su estimulación mediante la aplicación de luz infrarroja y la captación de una señal fluorescente que es traducida por un conmutador y mostrada en una pantalla que traduce la anatomía continente de dicho colorante. El uso más desarrollado de esta tecnología, y que va ganando evidencia progresivamente, es la traducción intraoperatoria del espacio intravascular, fundamental en la evaluación de la correcta perfusión de estructuras como el colon en la realización de anastomosis8. Otros empleos menos extendidos, pero con líneas de desarrollo en cirugía colorrectal, son la identificación de uréteres, tumores primarios, recurrencias locorregionales, lesiones metástasicas y estructuras nerviosas. Todas las utilidades de la cirugía guiada por fluorescencia se basan en la llegada de un colorante por diferentes vías a una estructura fisiológica o patológica y la traducción de la misma, mediante una imagen fluorescente, en el contexto de la anatomía concreta de nuestro paciente9. La tecnología convierte lo imperceptible en perceptible al ojo humano y a la propia computadora.
En este sentido, la cirugía guiada por fluorescencia también se está desarrollando hace años en el campo de la delimitación ganglionar para las resecciones oncológicas de colon. El objetivo es definir una cirugía colorrectal curativa ajustada a cada paciente con la menor agresión posible. En el año 2012 el grupo del profesor Neil J. Mortensen en Oxford mostró la primera serie al respecto10. Desde entonces, han sido publicados diversos trabajos que emplean diferentes dosis (0,2-5ml) y concentraciones de ICG (0,5; 2,5; 5mg/ml), así como múltiples lugares (subserosa [fig. 1], submucosa y ambas) y tiempos (preoperatorio, intraoperatorio y ambos) de infusión del colorante y espera (4-25min) para su correcta evaluación (fig. 2). La elección subserosa peritumoral para el lugar de inyección parece la más efectiva con la evidencia disponible en la actualidad11,12. Los estudios publicados encontraron valor para identificar ganglios linfáticos mesocólicos relacionados con el drenaje propio del tumor; sin embargo, no se ha descrito ninguna técnica estandarizada auspiciada por un estudio de precisión diagnóstica sólido. Una revisión sistemática de 12 estudios con 248 pacientes informó que las tasas combinadas de sensibilidad y especificidad fueron del 71 y el 84,6%. Sin embargo, la revisión incluyó cáncer de colon y recto y demostró la heterogeneidad en los datos informados. Los autores concluyeron que la cirugía guiada por fluorescencia es una técnica prometedora para la detección de ganglios en el cáncer colorrectal, aunque se desconoce su utilidad oncológica13. El reciente documento de consenso presentado por la European Association of Endoscopic Surgery(EAES) sugirió que era necesario realizar más estudios antes de poder recomendarlo para su uso rutinario.
En el año 2020 fue publicado, desde Japón, el primer artículo que realiza una traducción histológica de los ganglios extirpados mediante cirugía guiada por fluorescencia en 72 pacientes con cáncer de colon localizado en el ángulo esplénico. Los autores argumentan que un elevado porcentaje de ganglios ocupados por células tumorales no mostraron fluorescencia y lo atribuyeron a una obstrucción/destrucción del drenaje linfático por este motivo. Por lo tanto, fallan en poder recomendar una linfadenectomía guiada exclusivamente por fluorescencia en estos casos14.
Pero el desarrollo tecnológico y biológico continúan. El primero en busca de algoritmos basados en multitud de datos e inteligencia artificial principalmente. Y el segundo en la línea de marcadores y colorantes con afinidad anatómica específica. La suma y el desarrollo de estos factores probablemente supongan el camino a una cirugía más guiada, simplificada y con una traducción en beneficio oncológico al menor coste de invasión9,15.
En conclusión, con la evidencia disponible en la actualidad, el controvertido balance en la radicalidad ganglionar del cáncer de colon no puede ser respondido mediante la cirugía guiada por fluorescencia. Pero con la estandarización de la técnica, la mejora de los sistemas de imagen y el desarrollo de nuevos y más específicos fluoróforos que permitan describir el sistema linfático con precisión, probablemente seamos capaces de alcanzar un método más óptimo en favor de dicho objetivo. Por lo tanto, la pregunta formulada en el título sigue abierta al desarrollo de líneas de investigación que podrían dar una respuesta que confiera evidencia al empleo de la cirugía guiada por fluorescencia en la linfadenectomía oncológica del cáncer de colon en un futuro.