Obesidad y Reflujo Gastro Esofágico
More infoEl bypass de una sola anastomosis se ha convertido, actualmente, en la tercera técnica bariátrica más realizada a nivel mundial. Sin embargo, como consecuencia de su conformación, presenta una serie de complicaciones crónicas (úlcera de boca anastomótica y reflujo biliar) que debemos conocer y valorar. Con esta revisión narrativa, se pretende realizar una puesta al día, tanto en el diagnóstico como en el tratamiento de cada una de ellas. Hay una serie de estrategias preventivas pre, intra y postoperatorias que deben tenerse en cuenta para disminuir, en lo posible, su aparición.
One-anastomosis gastric bypass has now become the third most commonly performed bariatric technique worldwide. However, as a consequence of the configuration of this surgery, it can present some chronic complications (anastomotic mouth ulcers and biliary reflux) that physicians must come to better understand and assess. In this narrative review we aimed to update our knowledge of both the diagnosis and treatment of these two complications in the context of bariatric surgeries. We concluded that a series of pre-, intra-, and postoperative preventive strategies should be considered by surgeons to help reduce the appearance of these complications as far as possible.
La obesidad se ha convertido en un importante problema de salud mundial que, además, va aumentando a lo largo de los últimos años1,2. La cirugía bariátrica está considerada el tratamiento más adecuado para pacientes obesos con IMC>35kg/m2 cuando fracasan las medidas conservadoras (dieta, ejercicio y cambio de comportamiento) y debe considerarse en personas con enfermedad metabólica y un IMC de 30-34,9kg/m23. Está demostrado que la cirugía bariátrica presenta mejoría en resultados ponderales a medio y largo plazo, así como mejoría en gran parte de las comorbilidades de los pacientes3–5.
Rutledge fue el cirujano que presentó la primera serie de mini-gastric bypass con 1274 casos, mostrándola como una técnica segura, con menor tiempo operatorio y corta estancia hospitalaria6. Carbajo et al. publican su primera serie en 20057, incluyendo a 205 pacientes, y posteriormente una segunda serie de 1200 pacientes8, donde muestran unas modificaciones respecto a la técnica anterior (la medición de todo el intestino, así como la realización de una sutura continua entre el asa ascendida de yeyuno y el reservorio de unos 8cm con la intención de disminuir el reflujo biliar) a la que nombra como bypass de una sola anastomosis (BAGUA).
Desde entonces, la técnica ha ido creciendo en popularidad y ha sido aprobada por la IFSO como procedimiento bariátrico independiente9. En 2020 se publica la declaración de Consenso de la IFSO (resultados de un estudio Delphi modificado)10 ampliando los resultados de la Declaración de Consenso anterior9, particularmente con respecto a aspectos técnicos del procedimiento y comparaciones con otros, especialmente las relacionadas con el bypass gástrico en Y-Roux (RYGB).
A pesar de ser una técnica que presenta cierta controversia, su popularidad va en aumento durante los últimos años. Tan solo hay que mirar el registro de la IFSO de 2021, donde se considera la tercera técnica más realizada a nivel mundial (BAGUA 7,6%, RYGB 36,9%, sleeve gastrectomy 50,2%)11. Dicha controversia viene dada por las ventajas e inconvenientes que presenta la misma. Con relación a las ventajas, el hecho de presentar solamente una anastomosis supone un menor tiempo y riesgo quirúrgico. Añadido a que, actualmente, la mayoría de los autores defienden que no es necesario el cierre de los defectos mesentéricos para evitar hernias internas. Además, los resultados en cuanto a pérdida ponderal y mejora de comorbilidades son incuestionables6–8. Sin embargo, no deja de ser una técnica tipo Billroth II, donde se desconoce si el posible reflujo biliar podrá tener consecuencias en un futuro.
Se presenta, a continuación, una revisión narrativa sobre las 2 complicaciones crónicas típicas de esta técnica, haciendo especial interés tanto en la prevención como en su tratamiento.
MetodologíaSe ha realizado una revisión narrativa en las plataformas PubMed, Embase, Medline y Cochrane Library, utilizando para ello palabras clave «one anastomosis gastric bypass» (con sus variaciones, «OAGB», «mini-gastric bypass»)«marginal ulcera» y «bile reflux»según la estrategia que se detalla en la figura 1. La búsqueda se llevó a cabo en abril de 2022 teniendo en cuenta las publicaciones realizadas en los últimos 10 años. Dos revisores independientes (MFM y MGR) evaluaron todos los estudios. Entre los artículos encontrados, fueron excluidos aquellos que no se ajustaban a los objetivos de nuestra revisión, los casos clínicos aislados, así como aquellos escritos en un lenguaje distinto al inglés o castellano, realizándose posteriormente una evaluación de los abstract y/o textos completos del resto de los artículos. Se excluyeron aquellos que no se consideraron relevantes, como aquellos estudios llevados a cabo en animales. Se realizó la revisión narrativa a partir de los textos de los artículos no excluidos y priorizando aquellos de mayor calidad metodológica. Se repitió dicho proceso con algunas de las referencias cruzadas de esos trabajos, añadiéndose a la revisión narrativa en caso de considerarse relevantes para el desarrollo de cada uno de los epígrafes que se detallan.
ResultadosLa figura 1 resume el proceso de búsqueda realizado. Se encontraron un total de 874 documentos tras una búsqueda mediante las palabras clave. De entre todos los artículos encontrados se excluyeron los que no se ajustaban a los criterios de selección, los anteriores a los últimos 10 años, los casos clínicos aislados, aquellos escritos en otro idioma y los duplicados. Después de la lectura completa de los abstract y/o textos completos, se excluyeron aquellos considerados no relevantes para nuestra revisión o realizados en animales. Se añadieron 2 artículos por referencias cruzadas. Finalmente, se incluyeron un total de 36 artículos para ser analizados exhaustivamente.
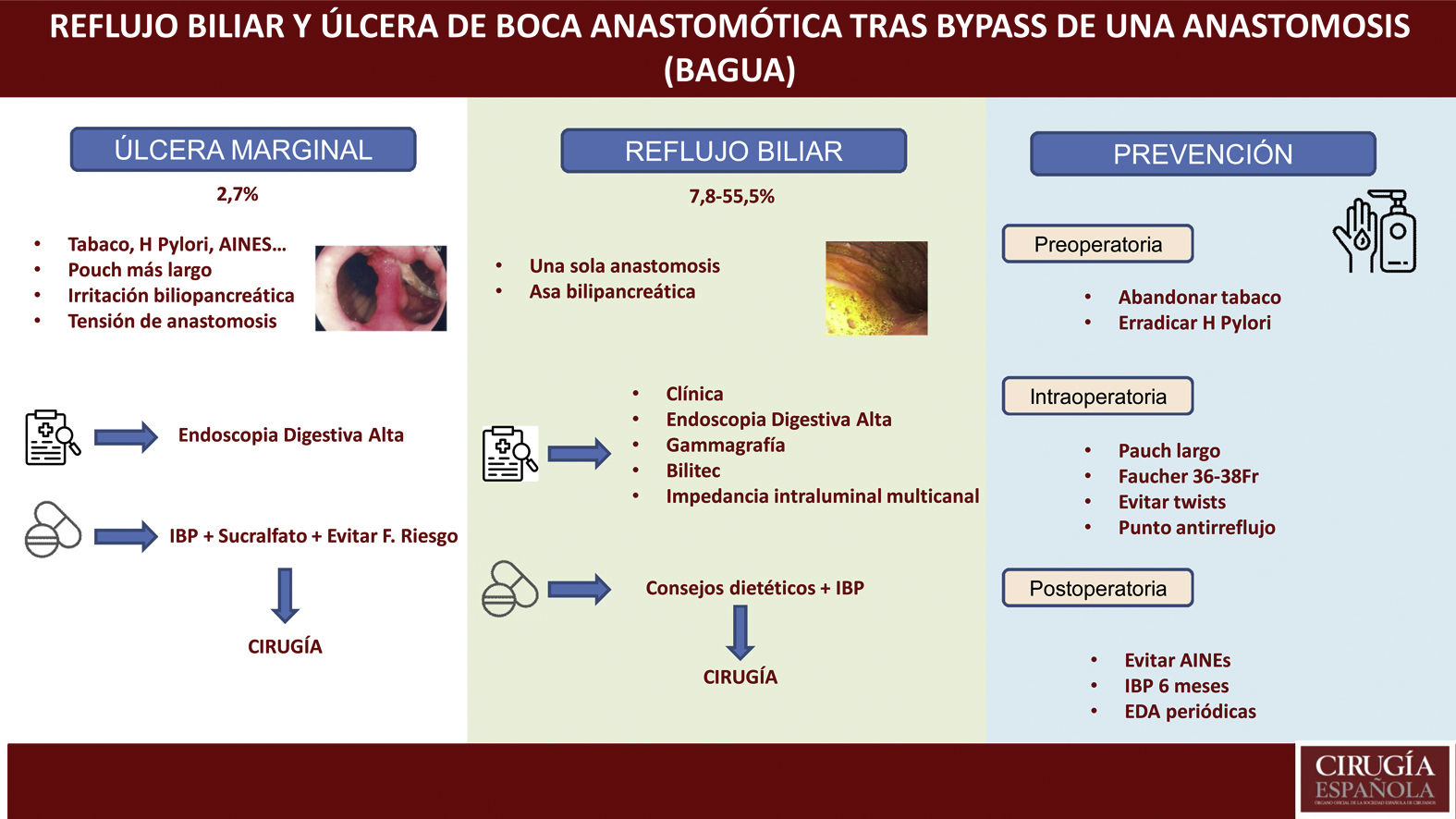
Úlcera marginalLa úlcera marginal o de boca anastomótica puede aparecer tras la derivación gástrica en el tratamiento quirúrgico de la obesidad, siendo descrita tanto en los primeros días como muchos años después de la cirugía. Por este motivo, debe estar incluida en el diagnóstico diferencial del dolor abdominal tras cirugía bariátrica (principalmente cuando aparece meses o años tras la misma)12. La existencia de signos vitales (frecuencia cardíaca, temperatura y presión arterial) y reactantes de fase aguda (fórmula leucocitaria, proteína C reactiva) no siempre son indicativos, por lo que el índice de sospecha clínica debe permanecer alto.
Generalmente, estas úlceras son causadas por la presencia de un cuerpo extraño (hilo de sutura) en la línea de sutura, disminución del aporte sanguíneo en la mucosa gastroyeyunal, compresión o edema en la anastomosis. Hasta la fecha, no hay estudios que valoren los factores de riesgo de úlcera marginal en pacientes sometidos a BAGUA, si bien la mayoría de los autores consideran que son muy similares a los de pacientes sometidos a RYGB (pacientes fumadores, presencia de Helicobacter pylori positivo no tratado, consumo crónico de AINE, no utilizar inhibidores de la bomba de protones tras la cirugía)12–15. Existen, sin embargo, unos detalles que, específicamente, pueden facilitar su presencia tras la técnica BAGUA como son:
- •
Presencia de un pouch más largo: la existencia de un reservorio más largo con el BAGUA, en comparación con el bypass convencional, hace que la anastomosis pueda estar expuesta a una mayor cantidad de secreción ácida (mayor número de células parietales en el pouch gástrico)7,8,13.
- •
Irritación biliopancreática: la confección de una sola anastomosis, a pesar de hacerse a unos 200-250cm del ángulo de Treitz, expone continuamente a la irritación de la misma a jugos pancreáticos y biliares, creando una condición ulcerogénica. Esta situación mantenida podría, incluso, crear un proceso inflamatorio crónico y conducir a la úlcera hacia una posible perforación. Esta hipótesis viene apoyada por el hecho de que la propia conversión a Y-Roux tras una úlcera intratable conduce a su tratamiento exitoso12,14,15.
- •
Tensión de la anastomosis: a pesar de que hay cirujanos que defienden el hecho de que al ser el pouch más largo puede restar tensión a la anastomosis, hay quienes opinan lo contrario. A diferencia de la configuración en Y-Roux, en la que la rama alimentaria se divide de la biliopancreática (permitiendo que ésta se desplace hace abajo con la gravedad sin tensión), en el montaje tipo BAGUA ambos lados del asa tiran hacia abajo creando, potencialmente, mayor tensión12. En cualquier caso, no hay estudios hasta la fecha que analicen la diferencia de tensión entre estos 2 procedimientos.
Musella et al. publican los datos de un estudio multicéntrico con 974 casos consecutivos, donde el porcentaje de úlcera de boca anastomótica es del 1,7% (de las cuales 4/14 precisaron tratamiento quirúrgico)16. En la revisión sistemática publicada por Parmar y Mahawar en 2018, con un total de 12.807 pacientes y 22 centros, el porcentaje de úlcera marginal varía entre el 0 y el 10%. Sin embargo, de los 22 centros, tan solo en 4 el porcentaje es superior al 5%, presentando el estudio una media de 2,7%17. Robert et al. presentan un ensayo clínico en 2019 en el que se compara eficacia y seguridad de BAGUA frente a RYGB, en el que no se observan diferencias estadísticamente significativas en relación con la úlcera marginal entre ambas técnicas (n=3; 13% BYGB vs. n=2; 5% BAGUA)18.
El dolor abdominal es el síntoma más común en este tipo de pacientes. Las náuseas y vómitos pueden estar presentes y la hemorragia importante es poco común19,20. Sin embargo, hasta un 28% de los pacientes con úlcera marginal son asintomáticos y se descubre accidentalmente durante endoscopia digestiva alta (EDA) de rutina.
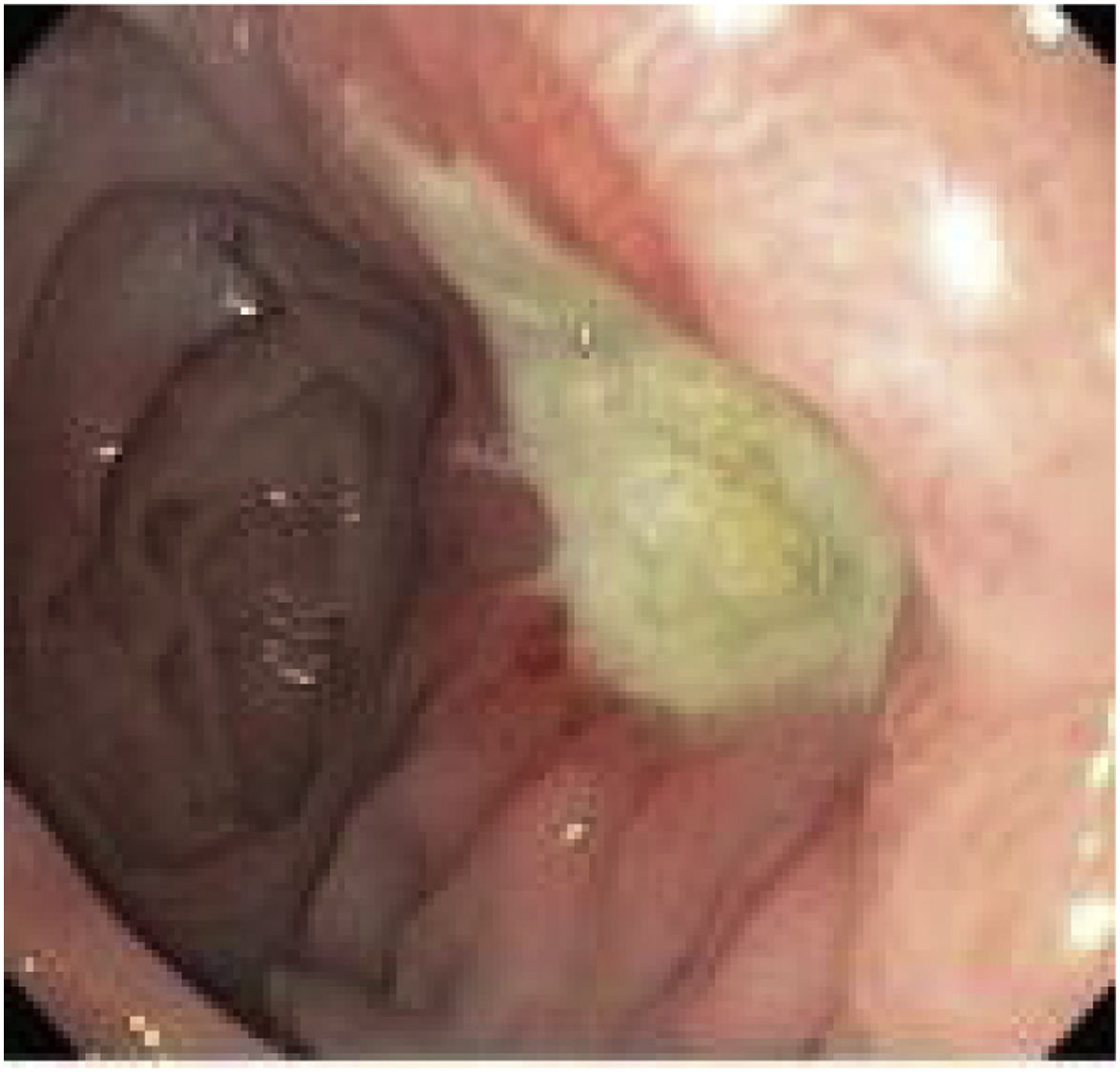
El diagnóstico es, fundamentalmente, endoscópico (fig. 2). El endoscopista puede retirar hilos de sutura cuando son visibles en la luz y si están asociados a una úlcera marginal21. Esta conducta tiene el potencial de facilitar la cicatrización y así aliviar cuadros de dolor abdominal. Las úlceras deben ser tratadas con inhibidores de la bomba de protones (IBP) asociados con sucralfato y el tiempo de cicatrización puede variar de 8 semanas hasta 6 meses22. Mahawar et al. proponen un algoritmo de tratamiento23: aconsejar e insistir en el abandono del tabaco en aquellos pacientes fumadores; estudiar y erradicar la presencia de Helicobacter pylori; así como evitar AINE de forma crónica tras la intervención. El tratamiento consiste en IBP junto a sucralfato y realizar endoscopia de control a los 3 meses. En caso de haber cicatrizado, aconsejan IBP de por vida, así como evitar factores de riesgo. En caso de que no haya cicatrizado, repetir nueva endoscopia a los 3 meses. Si sigue sin cicatrizar, plantear conversión quirúrgica15,23,24. Entre las opciones de tratamiento quirúrgico informadas previamente se incluyen: reparación primaria de la perforación (con o sin desbridamiento) junto a epiploplastia; conversión a Y-Roux con resección del pouch distal (técnica defendida por la mayoría de los autores); reversión del BAGUA a «anatomía normal»12.
Reflujo biliarLa principal controversia que muestra el BAGUA como técnica quirúrgica es, justamente, presentar una sola anastomosis y, por tanto, poder provocar un reflujo biliopancreático crónico que pueda tener consecuencias a medio-largo plazo. En una revisión publicada por Keleidari et al.25 el porcentaje de reflujo varía enormemente (entre el 7,8 y el 55,5%), lo que puede deberse a la amplia variabilidad que hay, tanto en los detalles quirúrgicos de la técnica, como en el diagnóstico del mismo.
En relación con la técnica, existen diferencias en cuanto al tamaño del reservorio, a la longitud del asa biliopancreática, el tamaño y tipo de anastomosis, la altura de la sutura gastroyeyunal para evitar el reflujo…, lo que dificulta la comparación entre técnicas. Con relación al diagnóstico, existen grandes diferencias entre estudios (desde quien solo diagnostica a aquellos pacientes sintomáticos, hasta aquellos que realizan de forma rutinaria en todos los pacientes gammagrafía y EDA). Así, Carbajo et al. en su primera serie de paciente intervenidos de BAGUA7 muestran un porcentaje de reflujo del 0%. En la segunda serie publicada, con un total de 1200 pacientes8, el porcentaje publicado de reflujo es del 2% (tan solo realizó pH-metría y EDA en los primeros 20 pacientes). Saarinen et al. en cambio, muestran un porcentaje de reflujo en su serie del 39,5%, al tener en cuenta a pacientes asintomáticos y realizar de forma rutinaria en todos EDA con biopsia, junto a gammagrafía de reflujo. Los autores presentan un porcentaje de reflujo biliar en el pouch gástrico en, aproximadamente, un tercio de los pacientes, con un caso de reflujo biliar esofágico26. Keleidari et al. realizaron otro estudio de cohorte en 122 pacientes en 2019. Intentaron comparar la tasa de incidencia de reflujo biliar entre BAGUA y RYGB a los 12 meses de la cirugía, siendo del 7,8% tras BAGUA y del 3,4% después de RYGB. Los autores concluyeron que no había una diferencia significativa en relación con el reflujo biliar al comparar ambas técnicas27.
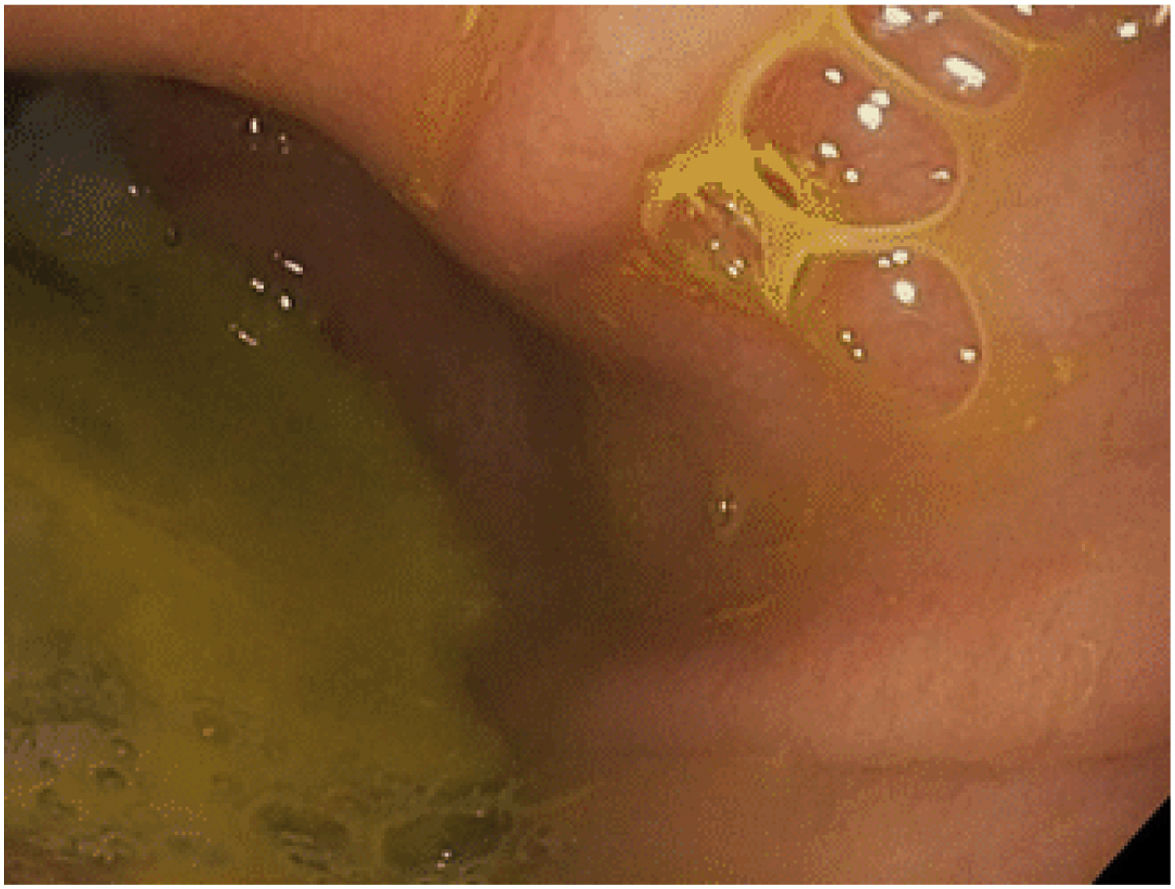
El diagnóstico clínico de reflujo biliar tras BAGUA sigue siendo difícil, excepto cuando el paciente presenta regurgitación y/o vómitos biliares (principalmente durante la noche). Otros síntomas menos típicos pueden incluir náuseas, plenitud abdominal… La primera prueba diagnóstica en estos pacientes debe ser una EDA donde se puede evidenciar la presencia de restos de bilis en el pouch gástrico y/o esófago, así como la existencia de algunos cambios mucosos que se deben biopsiar28 (fig. 3). Existen otra serie de procedimientos que pueden ayudar al diagnóstico, si bien no son muy comunes en la práctica habitual. La gammagrafía con ácido iminodiacético hepatobiliar, combinado con tecnecio-99 m, es una técnica no invasiva tan válida como la aspiración de fluidos gástricos en la detección del reflujo biliar en ayunas28-30. El bilitec se compone de un sistema que contiene una cámara de espectrofotometría de fibra óptica que mide la absorción de la luz a una longitud de onda de 470nm. La sonda se inserta por vía transnasal al esófago distal en el paciente en ayunas y se deja in situ durante 24h29,31. Se trata, sin embargo, de un sistema cuya aceptación clínica es limitada. La aspiración directa de líquido gástrico y esofágico permite el análisis químico de la concentración y composición del líquido y la determinación de la presencia de ácidos biliares29,32. La monitorización de impedancia intraluminal multicanal detecta el paso de un bolo a través del esófago. Generalmente se combina con pruebas de pH para evaluar el reflujo ácido y no ácido. La impedancia-pH intraluminal multicanal combinada es altamente sensible y reproducible para todos los tipos de reflujo, independientemente de la acidez o la composición29,33.
En relación con el desarrollo futuro de un carcinoma tras BAGUA, existen diferentes hipótesis a favor y en contra del riesgo de degeneración tras su realización34,35. En primer lugar, está demostrado que el reflujo biliopancreático es directamente responsable del adenocarcinoma esofágico en el modelo animal; además, según algunos autores, el reflujo biliar excesivo puede provocar metaplasia intestinal, esófago de Barrett y cáncer gástrico/esofágico en humanos. Sin embargo, otros autores están convencidos de que no existe una relación causal entre la BAGUA y el cáncer, basándose, por un lado, en la implicación de otros factores en la génesis del cáncer gástrico (hábitos alimentarios, tabaco, infección por Helicobacter pylori), así como por los casos notificados de cáncer que se produjeron en el estómago remanente después de RYGB (14 casos) y gastroplastia con banda vertical (n=9)34,36,37. Tan solo han sido publicados 2 casos de carcinoma gastroesofágico que, por sus características, se deben analizar con mucha cautela. El primero de ellos38 es de un varón de 52 años con IMC de 52kg/m2 que en el estudio previo a la cirugía presentaba una esofagitis grado C en la que no se realizó biopsia. Comenzó con disfagia 2 años tras la cirugía (BAGUA) y tras la EDA se diagnosticó de adenocarcinoma en unión esofagogástrica. El segundo caso39 es un varón de 54 años, fumador y bebedor moderado, intervenido de BAGUA con un IMC de 46,1kg/m2, en el que ni si quiera se había realizado EDA preoperatoria. No realiza seguimiento tras la cirugía, y 2 años más tarde es diagnosticado de un adenocarcinoma de esófago tras estudio por disfagia y vómitos. Ambos casos se desarrollan 2 años tras la cirugía bariátrica en pacientes que no han sido bien estudiados preoperatoriamente y en los que achacar la causa del desarrollo tumoral a la técnica quirúrgica posiblemente no sea lo más adecuado.
En cuanto al tratamiento, se debe comenzar de forma conservadora, utilizando para ello IBP, sucralfato, con o sin secuestradores de ácidos biliares, eliminación de factores de riesgo así como ciertos consejos dietéticos40. Cuando esto falla, se debe pensar en una nueva cirugía, donde la mayor parte de los autores abogan por una conversión a Y-Roux41–44. Si el motivo del reflujo biliar es un pouch corto, es cuestionable si es obligatorio revisar la anastomosis gastroyeyunal para tratar eficazmente el reflujo biliar, o si podría ser suficiente realizar una anastomosis yeyuno-yeyunal distalmente en la rama eferente, tras haber seccionado el asa aferente junto a la anastomosis gastroyeyunal. De hecho, esta segunda opción puede reducir el riesgo del procedimiento global, ya que se dejaría la anastomosis gastroyeyunal nativa íntegra36. Otros autores aconsejan la realización de una anastomosis yeyuno-yeyunal tipo Braun7. De cualquier manera, antes de la revisión, es importante conocer la medida de las asas antes de decidir si es necesario rehacer la anastomosis gastroyeyunal, o simplemente crear la enteroenterostomía para formar la «Y» de la Y-Roux. La simple adición de una enteroenterotomía puede causar o exacerbar la desnutrición si se desconoce la longitud de las asas. Otra opción menos realizada es la reversión a la anatomía original, que puede mostrar beneficios en términos de recuperación de peso45. Sin embargo, esta opción puede ser técnicamente desafiante y asociarse con un mayor riesgo de estenosis y fuga anastomótica gastro-gástrica. En la revisión sistemática sobre el manejo quirúrgico de la enfermedad por reflujo tras BAGUA, publicada en 2022 por Lee et al, un 1,6% de los pacientes requirieron revisión quirúrgica, realizándose conversión a Y-Roux en el 91,7% de los casos, y enteroenterotomía de Braun al 2,6%40.
PrevenciónDurante los últimos años ha habido falta de evidencia en relación con las prácticas perioperatorias relacionadas con el BAGUA46, los documentos de consenso de la IFSO publicados en 20189 y 202010 han facilitado una serie de aspectos en relación con dichas prácticas. Debemos tener en cuenta una serie de estrategias pre y postoperatorias, así como algunos detalles técnicos intraoperatorios, que pueden ayudar a evitar estas complicaciones crónicas.
En el preoperatorio, se debe insistir a los pacientes fumadores para que abandonen el hábito tabáquico. Se debe realizar estudio de Helicobacter pylori y, en caso positivo, erradicarlo. Siguiendo las recomendaciones de la IFSO, este tipo de cirugía debería evitarse en pacientes con esófago de Barret, o con gran hernia de hiato sintomática10.
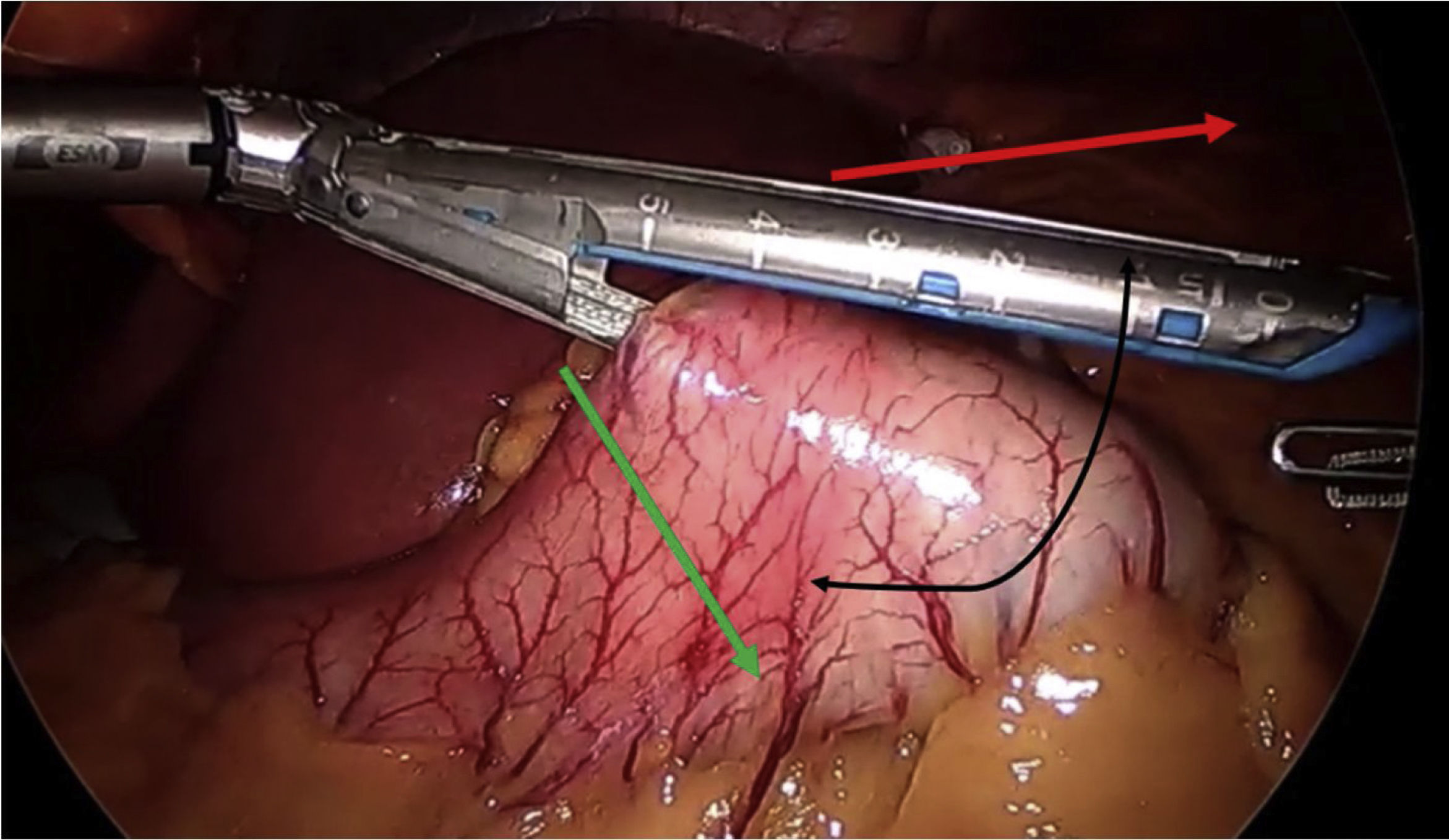
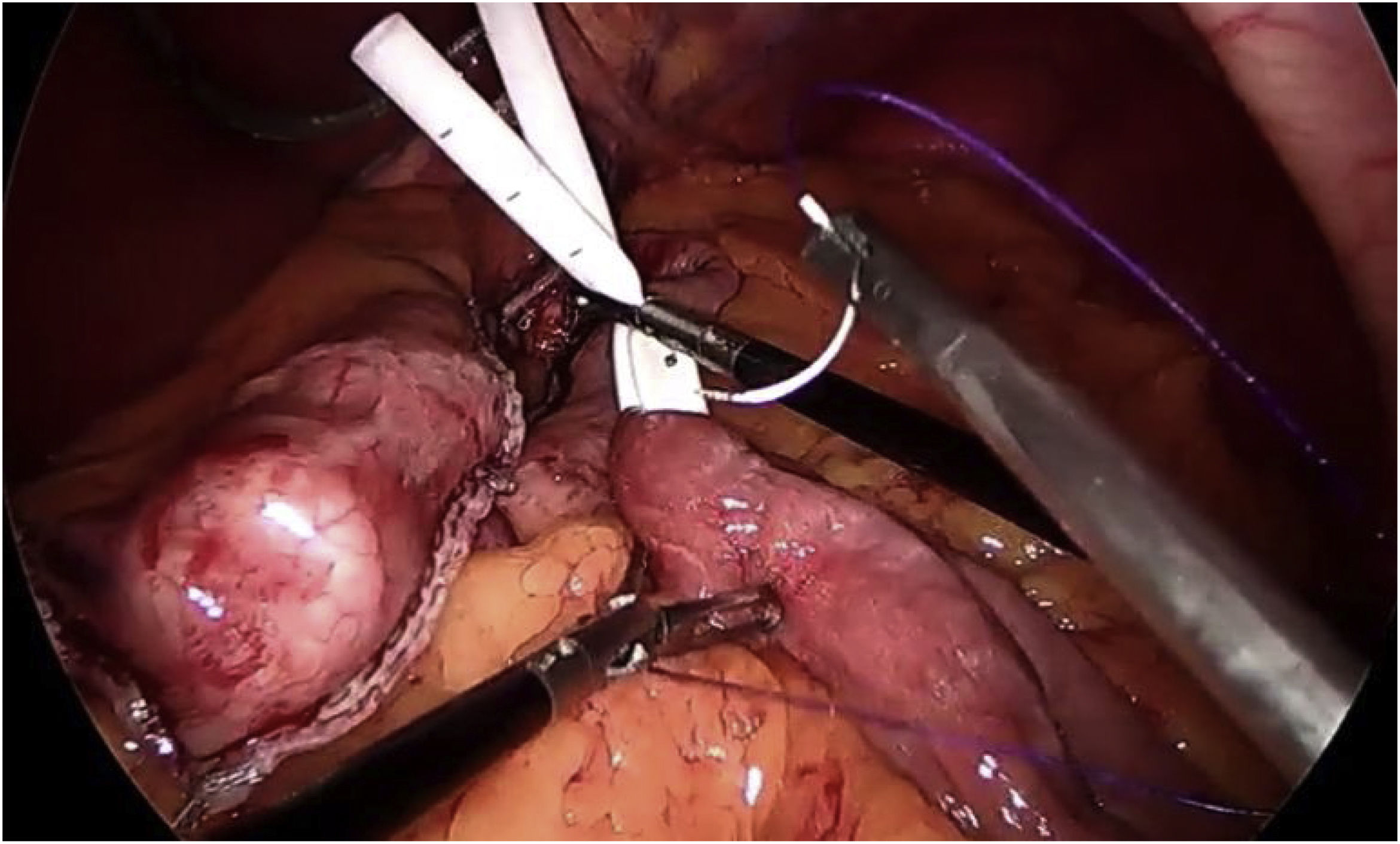
En cuanto a los detalles técnicos23, se debe crear un pouch largo, realizando la sección por debajo de la «pata de ganso», e introduciendo la primera endograpadora perpendicular a la entrada en curvatura menor (este gesto permite ganar entre 1 y 2cm de longitud) (fig. 4). La mayoría de los autores defienden utilizar sonda de Faucher entre 36 y 38Fr10 y realizar la sección evitando el twist del pouch. El Dr. Carbajo describe una sutura gastroyeyunal que asciende entre 8 y 10cm de la anastomosis con la idea de evitar el reflujo biliar7,8 (fig. 5). Se aconseja, además, disecar de forma controlada la curvatura menor para realizar el primer corte, evitando, de esta manera, que la esquina contralateral del pouch quede con una vascularización precaria.
Tras la cirugía, siguiendo las recomendaciones del documento de consenso, se deben evitar el consumo de AINE de forma crónica. La mayoría de los expertos defienden tomar IBP durante 6 meses y realizar endoscopias periódicas de control10.
ConclusionesEl BAGUA es una técnica que ha ganado popularidad durante los últimos años, convirtiéndose en la tercera técnica bariátrica más realizada a nivel mundial. Sin embargo, como consecuencia de su conformación, presenta una serie de complicaciones crónicas (úlcera de boca anastomótica y reflujo biliar) que debemos conocer y valorar. Hay una serie de estrategias preventivas pre, intra y postoperatorias que deben tenerse en cuenta para disminuir, en lo posible, su aparición.
Conflicto de interesesLos autores declaran que no tienen conflicto de intereses.