El retraso del vaciamiento gástrico (RVG) es un conjunto de síntomas (sensación de plenitud, dolor epigástrico, náuseas y vómitos) en ausencia de obstrucción mecánica1–5, que puede producirse tras cirugías en la región supramesocólica6, suele solventarse con procinéticos y aspiración, aunque ocasionalmente puede requerir tratamiento quirúrgico o intervencionista, prolongando la estancia hospitalaria y aumentando los costes sanitarios5,6
En cirugía pancreática, el RVG tras duodenopancreatectomía cefálica (DPC) ha sido ampliamente estudiado, presentando elevados porcentajes (11-60%)1–3,6, y generalmente asociado a fístula pancreática posoperatoria (FPPO)1,3,6. En 2007, el International Study Group of Pancreatic Surgery (ISGPS) publicó una clasificación del RVG tras cirugía pancreática dividida en tres categorías según gravedad, rápidamente aceptada a nivel internacional.
Hay pocos estudios sobre la incidencia de RVG tras pancreatectomía distal (PD), oscilando entre 5-24%5,6. Tampoco están claramente definidos cuales son los factores predisponentes. En este trabajo, se analiza la incidencia de RVG en una serie multicéntrica de PD, identificando los factores asociados.
Se trata de un estudio observacional retrospectivo de PD realizadas en ocho unidades de cirugía hepatobiliopancreática de medio-alto volumen (volumen medio 10-40 pancreatectomías/año, volumen alto >40 pancreatectomías/año)7, desde el 1 de enero de 2008 al 31 de diciembre de 2018. Se incluyó toda PD realizada por cualquier diagnóstico, excluyendo pacientes intervenidos de forma urgente, PD asociada a resección del tronco celiaco y pacientes menores de 18 años. Se definió RVG según la clasificación de la ISGPS1. Se estudiaron variables epidemiológicas, clínicas, séricas, diagnósticas, quirúrgicas, histológicas y complicaciones posoperatorias. Los datos cuantitativos se expresaron como mediana y rango intercuartílico (RIQ) y los cualitativos como frecuencias o porcentajes. Las diferencias entre grupos en el caso de variables cuantitativas se analizaron usando el test no paramétrico de la U de Mann-Whitney y entre porcentajes el test de la X2 de Pearson.
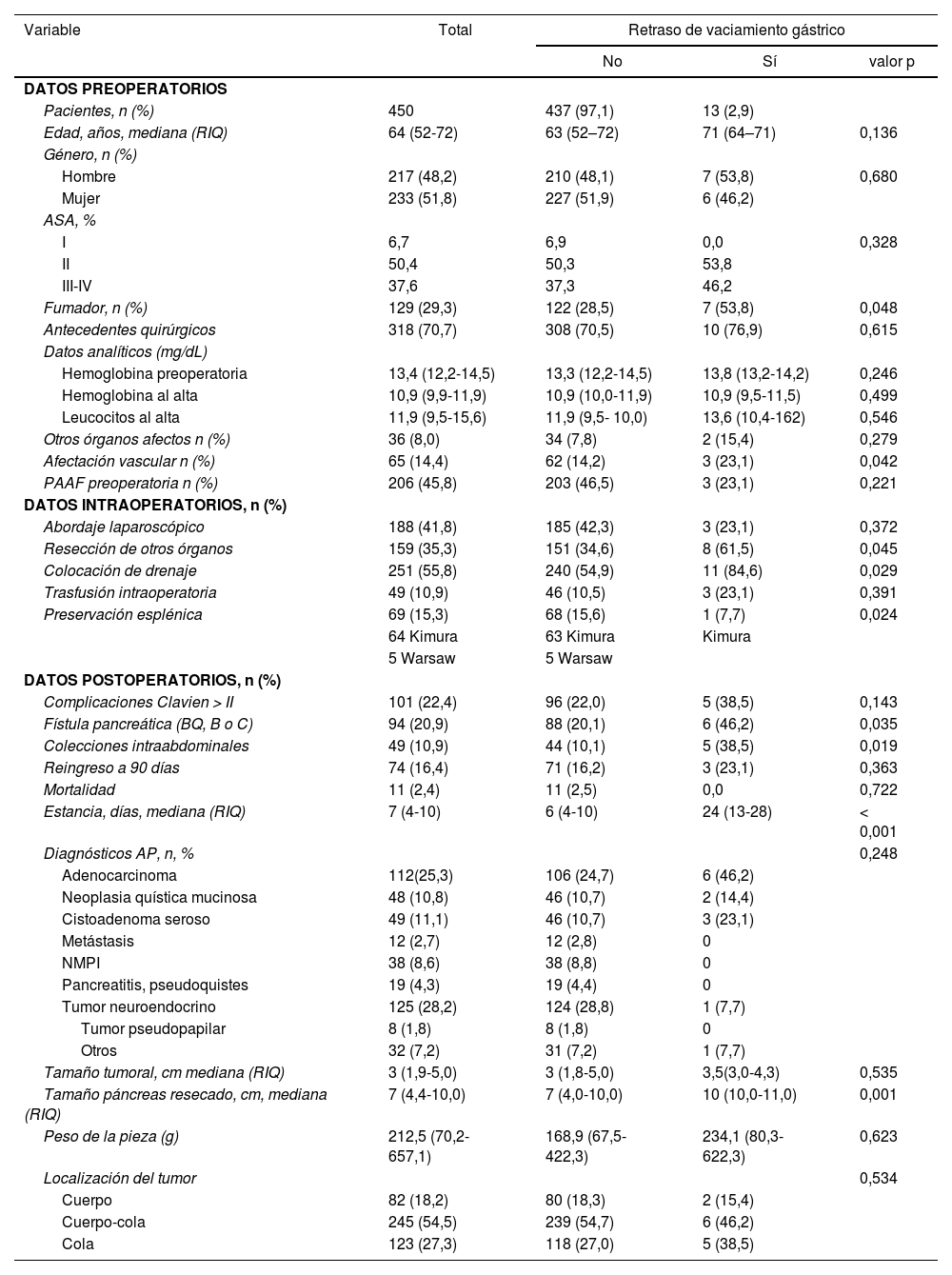
Se han estudiado 450 PD, en 41,8% de los casos el abordaje fue laparoscópico, mayoritariamente tumores neuroendocrinos y tumores quísticos pancreáticos. Este porcentaje fue de 24,2% entre 2008-2013, aumentando hasta 63,3% entre 2013-2018. La tasa de conversión fue de 8,5%. En tres de los ocho centros existían protocolos ERAS al inicio del periodo de estudio, incorporándose progresivamente en el resto de los centros. En siete de los ocho centros se colocaba de forma sistemática drenaje, con retirada precoz (<72 h) si los niveles de amilasa eran inferiores a tres veces la amilasa sérica de referencia de cada centro. Los datos pre, intra y postoperatorios están en la tabla 1. Trece pacientes presentaron RVG (2,9%): siete (53,8%) grado A, cinco (38,5%) grado B y uno (7,7%) grado C. La mediana de edad fue 71 años, y 53,8% eran hombres. Estos pacientes presentaron mayor estancia hospitalaria (6 vs. 24 días). Del mismo modo presentaban, con diferencia estadísticamente significativa: hábito tabáquico, afectación vascular esplénica, resección de órganos adyacentes, colocación de drenaje, presencia de FPPO, colecciones intraabdominales y mayor tamaño del páncreas resecado (tabla 1). En dichos pacientes hubo menor porcentaje de abordaje laparoscópico, mayor tasa de transfusión y de complicaciones mayores (Clavien-Dindo >II). Cinco pacientes mostraron colecciones intraabdominales. Un paciente se trató con drenaje percutáneo, dos con drenaje transgástrico y dos con antibioticoterapia. Un paciente precisó cirugía por perforación gástrica. Todos los casos se trataron con procinéticos, sonda nasogástrica (mediana de 12 días [6-22]) y nutrición parenteral. En un caso se realizó una gastroyeyunostomía para resolución del RVG.
Comparativa entre pacientes con/sin retraso de vaciamiento gástrico
| Variable | Total | Retraso de vaciamiento gástrico | ||
|---|---|---|---|---|
| No | Sí | valor p | ||
| DATOS PREOPERATORIOS | ||||
| Pacientes, n (%) | 450 | 437 (97,1) | 13 (2,9) | |
| Edad, años, mediana (RIQ) | 64 (52-72) | 63 (52–72) | 71 (64–71) | 0,136 |
| Género, n (%) | ||||
| Hombre | 217 (48,2) | 210 (48,1) | 7 (53,8) | 0,680 |
| Mujer | 233 (51,8) | 227 (51,9) | 6 (46,2) | |
| ASA, % | ||||
| I | 6,7 | 6,9 | 0,0 | 0,328 |
| II | 50,4 | 50,3 | 53,8 | |
| III-IV | 37,6 | 37,3 | 46,2 | |
| Fumador, n (%) | 129 (29,3) | 122 (28,5) | 7 (53,8) | 0,048 |
| Antecedentes quirúrgicos | 318 (70,7) | 308 (70,5) | 10 (76,9) | 0,615 |
| Datos analíticos (mg/dL) | ||||
| Hemoglobina preoperatoria | 13,4 (12,2-14,5) | 13,3 (12,2-14,5) | 13,8 (13,2-14,2) | 0,246 |
| Hemoglobina al alta | 10,9 (9,9-11,9) | 10,9 (10,0-11,9) | 10,9 (9,5-11,5) | 0,499 |
| Leucocitos al alta | 11,9 (9,5-15,6) | 11,9 (9,5- 10,0) | 13,6 (10,4-162) | 0,546 |
| Otros órganos afectos n (%) | 36 (8,0) | 34 (7,8) | 2 (15,4) | 0,279 |
| Afectación vascular n (%) | 65 (14,4) | 62 (14,2) | 3 (23,1) | 0,042 |
| PAAF preoperatoria n (%) | 206 (45,8) | 203 (46,5) | 3 (23,1) | 0,221 |
| DATOS INTRAOPERATORIOS, n (%) | ||||
| Abordaje laparoscópico | 188 (41,8) | 185 (42,3) | 3 (23,1) | 0,372 |
| Resección de otros órganos | 159 (35,3) | 151 (34,6) | 8 (61,5) | 0,045 |
| Colocación de drenaje | 251 (55,8) | 240 (54,9) | 11 (84,6) | 0,029 |
| Trasfusión intraoperatoria | 49 (10,9) | 46 (10,5) | 3 (23,1) | 0,391 |
| Preservación esplénica | 69 (15,3) | 68 (15,6) | 1 (7,7) | 0,024 |
| 64 Kimura | 63 Kimura | Kimura | ||
| 5 Warsaw | 5 Warsaw | |||
| DATOS POSTOPERATORIOS, n (%) | ||||
| Complicaciones Clavien > II | 101 (22,4) | 96 (22,0) | 5 (38,5) | 0,143 |
| Fístula pancreática (BQ, B o C) | 94 (20,9) | 88 (20,1) | 6 (46,2) | 0,035 |
| Colecciones intraabdominales | 49 (10,9) | 44 (10,1) | 5 (38,5) | 0,019 |
| Reingreso a 90 días | 74 (16,4) | 71 (16,2) | 3 (23,1) | 0,363 |
| Mortalidad | 11 (2,4) | 11 (2,5) | 0,0 | 0,722 |
| Estancia, días, mediana (RIQ) | 7 (4-10) | 6 (4-10) | 24 (13-28) | < 0,001 |
| Diagnósticos AP, n, % | 0,248 | |||
| Adenocarcinoma | 112(25,3) | 106 (24,7) | 6 (46,2) | |
| Neoplasia quística mucinosa | 48 (10,8) | 46 (10,7) | 2 (14,4) | |
| Cistoadenoma seroso | 49 (11,1) | 46 (10,7) | 3 (23,1) | |
| Metástasis | 12 (2,7) | 12 (2,8) | 0 | |
| NMPI | 38 (8,6) | 38 (8,8) | 0 | |
| Pancreatitis, pseudoquistes | 19 (4,3) | 19 (4,4) | 0 | |
| Tumor neuroendocrino | 125 (28,2) | 124 (28,8) | 1 (7,7) | |
| Tumor pseudopapilar | 8 (1,8) | 8 (1,8) | 0 | |
| Otros | 32 (7,2) | 31 (7,2) | 1 (7,7) | |
| Tamaño tumoral, cm mediana (RIQ) | 3 (1,9-5,0) | 3 (1,8-5,0) | 3,5(3,0-4,3) | 0,535 |
| Tamaño páncreas resecado, cm, mediana (RIQ) | 7 (4,4-10,0) | 7 (4,0-10,0) | 10 (10,0-11,0) | 0,001 |
| Peso de la pieza (g) | 212,5 (70,2-657,1) | 168,9 (67,5-422,3) | 234,1 (80,3-622,3) | 0,623 |
| Localización del tumor | 0,534 | |||
| Cuerpo | 82 (18,2) | 80 (18,3) | 2 (15,4) | |
| Cuerpo-cola | 245 (54,5) | 239 (54,7) | 6 (46,2) | |
| Cola | 123 (27,3) | 118 (27,0) | 5 (38,5) | |
RIQ: rango intercuartílico; ASA: American Society of Anesthesiologists Classification; BQ: bioquímica; AP: anatomía patológica; NPMI: neoplasia mucinosa papilar intraductal.
El RVG-PD ocurre en 2,9% de los pacientes de la serie, tasa inferior a la descrita en las series previamente publicadas5–10. En todos los estudios publicados de RVG-PD se observa un incremento de la estancia hospitalaria5–8, al igual que ocurre en este trabajo.
Los factores etiológicos del RVG tras DPC han sido ampliamente estudiados. Se han postulado alteraciones hormonales tras la resección duodenal, isquemia y denervación gástrica, la FPPO y alteraciones mecánicas6. De ellos, solo la gastropatía isquémica cuando hay isquemia gástrica en las PD asociadas a resección del tronco celiaco6,8,9 y la FPPO son aplicables a la PD.
Los factores etiológicos del RVG-PD no están clarificados, si bien se ha relacionado con edad >75 años6,9, diagnóstico de malignidad7, abordaje laparotómico5,7, FPPO5,6 clínicamente relevante (B/C), resección del tronco celiaco8,10 y complicaciones mayores (Clavien-Dindo >II), destacando la presencia de colecciones intraabdominales6,9. No hay mecanismos etiopatogénicos evidentes excepto para la FPPO, la gastropatía isquémica posresección del tronco celiaco y las colecciones abdominales, que expliquen por qué los factores citados incrementan la RVG. En este trabajo, solo la FPPO y las colecciones intraabdominales también se confirmaron como factor asociado a RVG, no así los otros parámetros, pero observando otros previamente no estudiados, como la afectación vascular esplénica o la longitud de páncreas resecado.
Las limitaciones de este estudio son su naturaleza retrospectiva y, al ser multicéntrico, la no existencia de protocolos comunes para el uso intraoperatorio y posterior retirada de la sonda nasogástrica e inicio de tolerancia. Del mismo modo, el número reducido de casos con RVG impide tener la potencia estadística suficiente para poder afirmar que factores influyen en la aparición de RVG. La fortaleza es ser una serie con un número de pacientes elevado. Como conclusión, resaltar que el RVG-PD también puede ocurrir y debemos tenerlo presente si un paciente tras PD inicia un cuadro clínico compatible con RVG.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflictos de interesesLos autores declaran no tener conflictos de intereses.
Servicio de Cirugía General, Hospital General Universitario Dr. Balmis, Alicante (España): Silvia Carbonell, José Manuel Ramia, Celia Villodre Tudela.
Servicio de Cirugía General, Complejo Hospitalario Universitario de Badajoz, Badajoz (España): Gerardo Blanco Fernández, Noelia De Armas Conde, Isabel Jaén Torrejimeno.
Servicio de Cirugía General, Hospital Universitario de Getafe, Getafe (España): Alberto Carabias Hernández, Alba Manuel Vázquez.
Servicio de Cirugía General, Hospital Universitario de Guadalajara, Guadalajara (España): Raquel Latorre Fragua.
Servicio de Cirugía General, Hospital Auxilio Mutuo, San Juan (Puerto Rico): Juan del Río Martín, Pedro J. Hernández Rivera, Texell Longoria Dubocq.
Servicio de Cirugía General, Clínica Universidad de Navarra, Pamplona (España): Sara Esteban Gordillo, Fernando Pardo Sánchez, Fernando Rotellar Sastre.
Servicio de Cirugía General, Hospital Clínico Universitario, Valencia (España): Marina Garcés Albir, Elena Muñoz Forner, Luis Sabater.
Servicio de Cirugía General, Hospital Universitario Miguel Servet, Zaragoza (España): Miguel Cantalejo Díaz, Helga K. Kälviäinen Mejía, Alejandro Serrablo Requejo, Mario Serradilla Martín.