El empleo de una sonda descompresiva nasogástrica es aceptado como uno de los cuidados perioperatorios básicos tras una cirugía de resección esofágica. Sin embargo, con el desarrollo de los programas de rehabilitación multimodal en este campo y sin una evidencia clara que sustente su empleo, la indicación sistemática de dicha medida puede resultar controvertida.
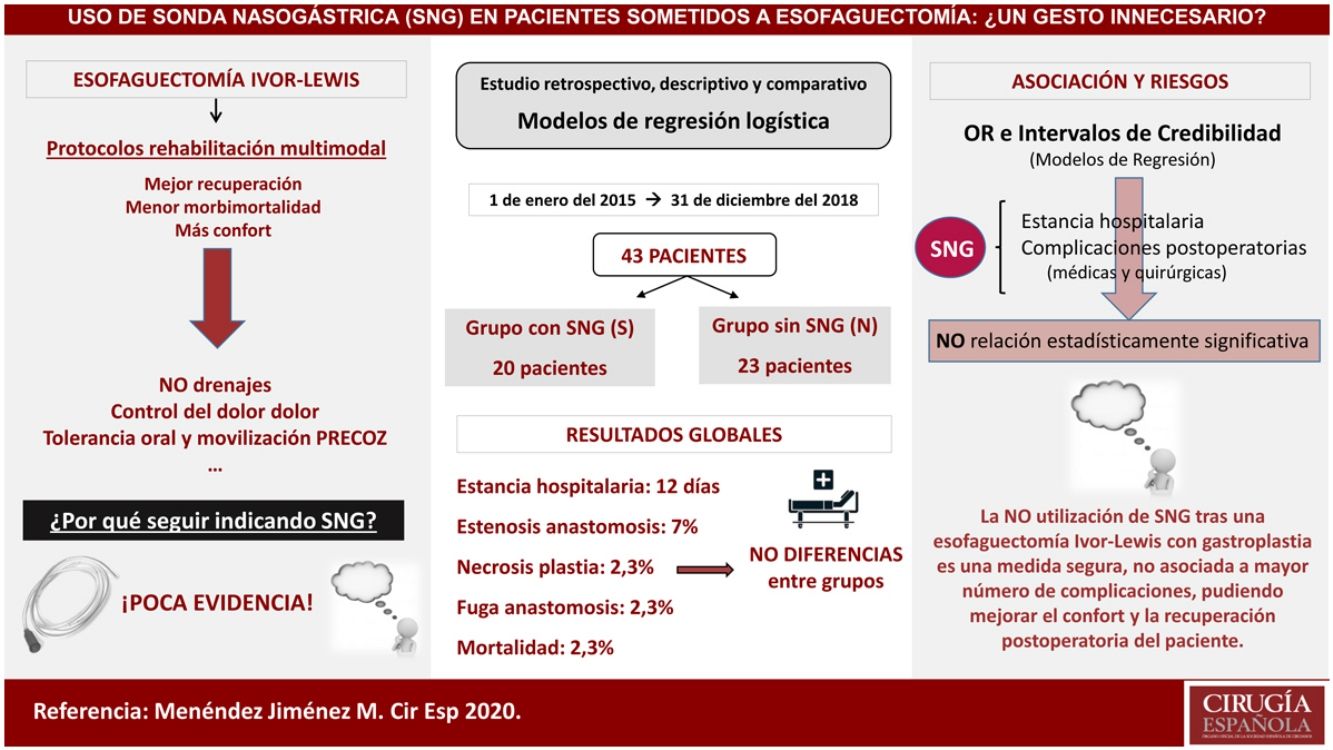
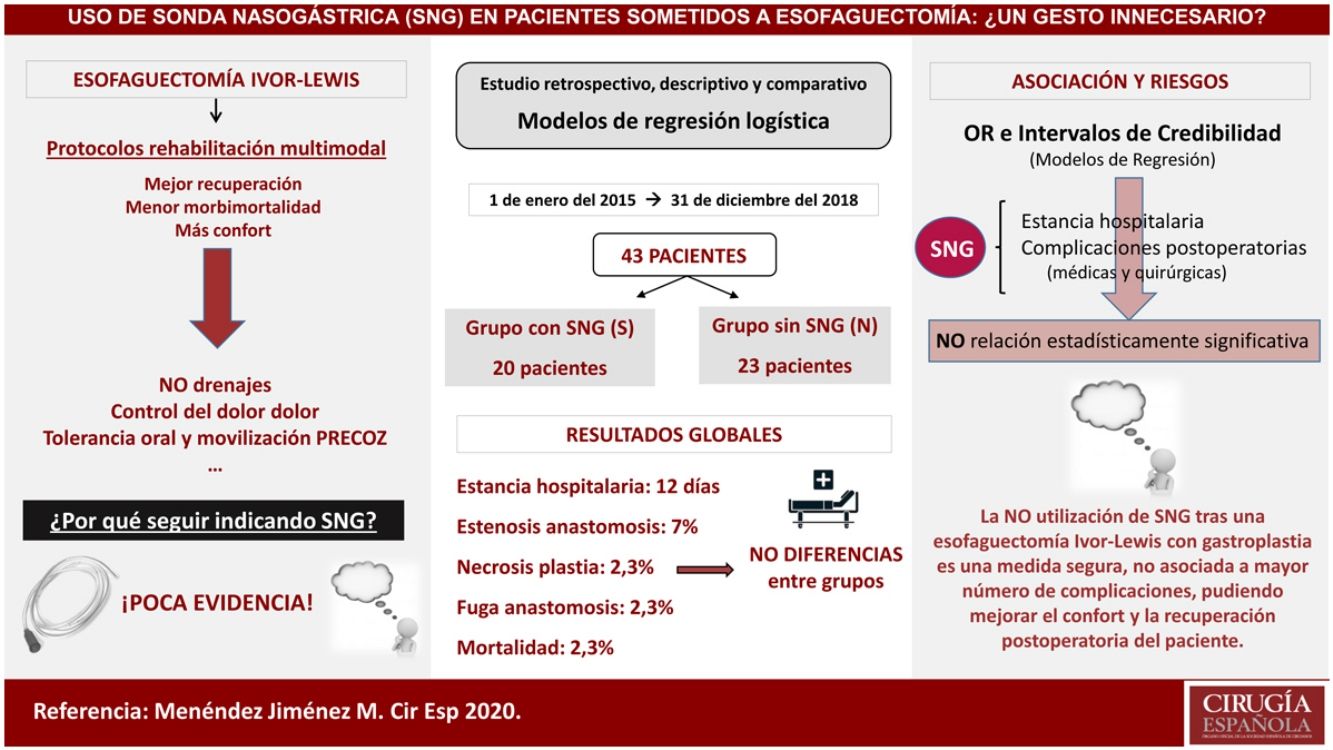
Material y métodosEstudio retrospectivo, descriptivo y comparativo de los casos intervenidos de esofaguectomía tipo Ivor-Lewis en nuestro centro desde enero de 2015 hasta diciembre de 2018 con colocación (Grupo S) o no de sonda (Grupo N) descompresiva en la plastia gástrica durante el postoperatorio. Se evaluaron variables epidemiológicas y diferencias entre los grupos en morbimortalidad postquirúrgica, estancia hospitalaria, inicio de la tolerancia oral y la necesidad de colocación de sonda nasogástrica.
ResultadosUn total de 43 pacientes fueron incluidos en este estudio con una mediana de edad de 61 años, siendo el 86% varones. El 46,5% eran hipertensos, el 25,5% presentaban enfermedad pulmonar y el 16,3% padecían diabetes mellitus. La mediana del tiempo de estancia hospitalaria fue de nueve días en el grupo S frente a 11,5 días del grupo N, sin diferencias en el inicio de la tolerancia oral. La tasa de dehiscencia anastomótica fue del 5% y del 0%, respectivamente. La mortalidad global fue del 2,3% en los primeros 90 días, sin diferencias entre los grupos y la necesidad de colocación de la sonda durante el postoperatorio se produjo únicamente en un paciente (4,3%) del grupo N.
ConclusionesLa no utilización de sonda nasogástrica durante el postoperatorio de una esofaguectomía tipo Ivor-Lewis es una medida segura y no está asociada a mayor número de complicaciones ni estancia hospitalaria, pudiendo mejorar la comodidad y la recuperación postoperatoria del paciente.
Nasogastric decompressive tube utilization has been accepted as one of the basic perioperative care measures after esophageal resection surgery. However, with the development of multimodal rehabilitation programs and without clear evidence to support their use, the systematic indication of this measure may be controversial.
Material and methodsRetrospective, descriptive and comparative study of patients who had undergone Ivor-Lewis esophagectomy in our center -from January 2015 to December 2018- with placement (Group S), or without placement (Group N) of a decompressive tube in gastroplasty during postoperative period. Epidemiological variables and differences between groups in post-surgical morbidity and mortality, hospital stay, onset of oral tolerance and the need for nasogastric tube placement were evaluated.
ResultsA total of 43 patients were included in this study, with a median age of 61 years, being 86% male. 46.5% were hypertensive, 25.5% had lung disease and 16.3% had diabetes mellitus. The median length of hospital stay was 9 days in group S versus 11.5 days in group N, with no differences in the onset of oral tolerance. Anastomotic dehiscence rate was 5% and 0% respectively. The overall mortality was 2.3% in the first 90 days, without differences between the groups. Placement of nasogastric tube during postoperative period was required only in 1 patient (4.3%) of the group N.
ConclusionsNon-use of nasogastric tube during postoperative period of an Ivor-Lewis esophagectomy is a safe measure, as it is not associated with a higher rate of complications or hospital stay. This fact may be able to improve patients’ comfort and postoperative recovery.
La esofaguectomía es el procedimiento de elección para el tratamiento de pacientes con tumores malignos que cumplen criterios de resecabilidad y operabilidad y de algunas patologías benignas que por localización o situación clínica así lo precisan. Son muchas las medidas y cuidados perioperatorios aplicados que intentan aumentar la seguridad de este procedimiento y reducir la elevada morbimortalidad asociada al mismo.
Con el desarrollo de los protocolos de rehabilitación multimodal algunas de las medidas aplicadas tradicionalmente han sido reevaluadas, modificándose su empleo con base en la evidencia científica más actual. Así, la optimización del estado nutricional, psicológico y físico junto a la corrección de la anemia son puntos básicos en la preparación de estos pacientes. Del mismo modo, el inicio de la tolerancia oral y la movilización de forma precoz durante el postoperatorio forman parte de este tipo de programas, así como el uso de drenajes, que, de forma rutinaria y por el momento, parece quedar restringido únicamente a los colocados en la cavidad pleural1,2. El empleo rutinario de una sonda nasogástrica (SNG) descompresiva, recomendado en los últimos documentos de consenso y guías clínicas publicadas por diferentes sociedades es un punto de controversia, donde la evidencia disponible actualmente que avala su uso aún es limitada1,2.
El objetivo de este estudio es evaluar y comparar los resultados obtenidos en pacientes sometidos a una esofaguectomía tipo Ivor-Lewis con base en el empleo o no de sonda descompresiva en la plastia durante el postoperatorio inmediato.
Material y métodoEstudio retrospectivo, descriptivo y comparativo de todos los pacientes intervenidos de esofaguectomía entre enero de 2015 y diciembre de 2018 en nuestro centro. Se incluyeron todos los pacientes diagnosticados de neoplasia esofágica maligna o enfermedad benigna complicada intervenidos de forma electiva en los que se realizó una esofaguectomía con abordaje abdominal y transtorácico tipo Ivor-Lewis, reconstrucción con gastroplastia y sin piloroplastia asociada. Se excluyeron pacientes intervenidos de forma urgente. La serie se dividió en dos grupos consecutivos: el grupo S (desde enero de 2015 a octubre de 2016), donde se incluyeron los pacientes en los que se colocó sonda descompresiva en la plastia durante el postoperatorio inmediato, y el grupo N, con aquellos casos en los que no se colocó ni empleó sonda descompresiva durante el periodo perioperatorio (desde noviembre de 2016 a diciembre de 2018). Las intervenciones fueron realizadas en el mismo centro por dos cirujanos con amplia experiencia en cirugía esofágica.
En el estudio preoperatorio, además del diagnóstico por el que se indicó la esofaguectomía, se recopilaron variables epidemiológicas y diferentes comorbilidades, tales como la edad, sexo, antecedentes personales o cirugías previas, clasificación ASA (American Society of Anesthesiologists), tipo y estadificación tumoral y tratamiento neoadyuvante.
Todos los pacientes fueron sometidos al acondicionamiento de la plastia gástrica tres semanas antes de la cirugía mediante embolización de las arterias esplénica y gástrica izquierda. Del mismo modo, todos los pacientes recibieron preparación mecánica del colon mediante el empleo de picosulfato de sodio en las 24 horas previas a la cirugía, además de la misma pauta de profilaxis antibiótica, medidas antitromboembólicas (heparina de bajo peso molecular y medias de compresión neumática) y profilaxis de náuseas y vómitos perioperatorios. En todos los casos se colocaron uno o dos drenajes torácicos aspirativos. No se puso drenaje abdominal ni se realizó ninguna técnica sobre el píloro para facilitar el vaciamiento de la plastia en ningún caso. A partir de enero de 2018, la realización de una yeyunostomía en el mismo acto quirúrgico se limitó a casos más seleccionados con desnutrición o mayor riesgo de problemas nutricionales, con base en los resultados obtenidos en nuestra unidad sobre ese aspecto3.
Se evaluó el tipo de abordaje, tiempo quirúrgico y la confección o no de una yeyunostomía de alimentación.
Durante el postoperatorio todos los pacientes fueron sometidos a la realización de un estudio radiológico con contraste oral y se analizó la presencia de náuseas o vómitos, el tiempo hasta el inicio de la tolerancia oral y/o enteral (en casos de yeyunostomía), la necesidad de colocación de sonda descompresiva y el tiempo de estancia hospitalaria y en la unidad de Reanimación. También se recogieron las complicaciones postoperatorias, la mortalidad en los primeros 90 días y la tasa de reingresos.
Las variables y resultados han sido descritos como mediana y rango intercuartil (RIC) en el caso de variables continuas y mediante frecuencias en el caso de variables categóricas.
Para determinar la posible asociación entre el empleo de SNG y los distintos tipos de complicaciones se han ajustado diferentes modelos de regresión logística incluyendo el empleo de la misma como variable predictora principal y el sexo, índice de masa corporal (IMC), riesgo anestésico según la escala ASA, diabetes mellitus, insuficiencia renal crónica, fumador o enfermedad pulmonar y el abordaje mínimamente invasivo como covariables por ser posibles factores de confusión.
Dado el elevado número de variables y el escaso tamaño muestral efectivo en la mayoría de los casos, los diferentes modelos se han ajustado mediante estadística bayesiana aplicando previas horseshoe a los coeficientes del modelo para evitar el sobreajuste3. En el caso de los días de estancia hospitalaria (variable continua) se ha desarrollado un modelo de regresión lineal. Sobre todos los modelos ajustados se han estimado intervalos de credibilidad al 95%. En el caso de que un intervalo de credibilidad sobre un OR (odd ratio) no incluyera el 1, se ha considerado el efecto de la variable correspondiente como significativo sobre la variable respuesta4.
ResultadosUn total de 43 pacientes fueron intervenidos de forma consecutiva realizando esofaguectomía tipo Ivor Lewis con gastroplastia en nuestro centro durante el período de estudio (entre enero del 2015 hasta diciembre del 2018), 20 en el grupo S y 23 en el grupo N.
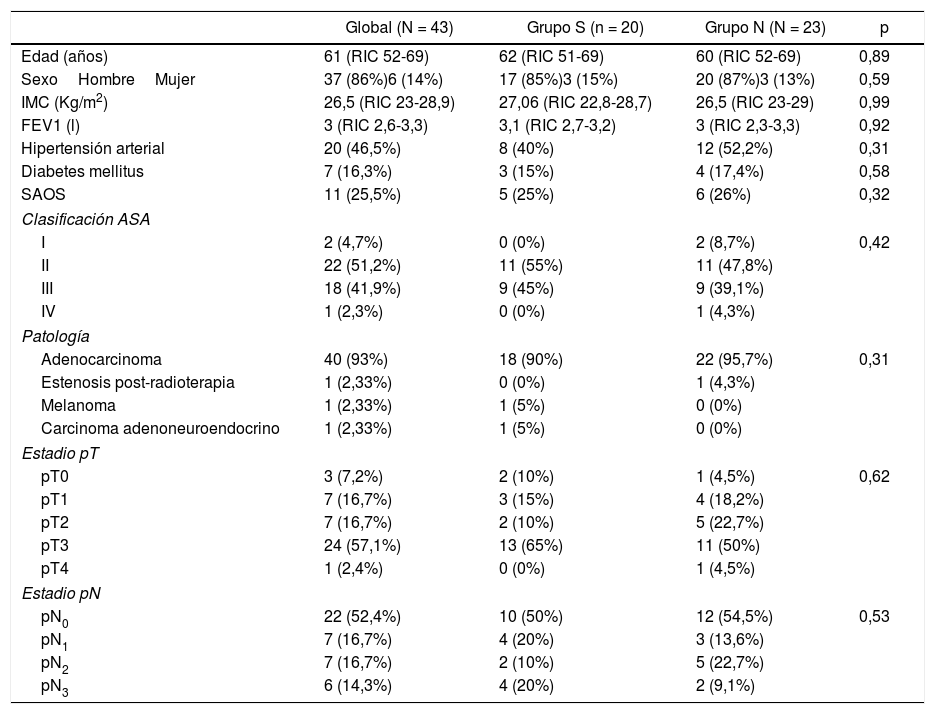
El 86% eran varones y la edad mediana del grupo fue de 61 años (RIC: 52-69). En la tabla 1 quedan reflejadas las características demográficas de los pacientes, no existiendo diferencias significativas entre ambos grupos en edad, sexo ni clasificación ASA, siendo la mayor parte ellos catalogados como ASA II-III. Las etiologías por las que se indicó la cirugía fueron en su mayor parte de origen tumoral (97,6%). Un 60,4% de los pacientes recibió tratamiento neoadyuvante con quimioterapia y un 4,7% tratamiento con quimioterapia más radioterapia neoadyuvante (tabla 1).
Estudio descriptivo de las características de los pacientes
| Global (N = 43) | Grupo S (n = 20) | Grupo N (N = 23) | p | |
|---|---|---|---|---|
| Edad (años) | 61 (RIC 52-69) | 62 (RIC 51-69) | 60 (RIC 52-69) | 0,89 |
| SexoHombreMujer | 37 (86%)6 (14%) | 17 (85%)3 (15%) | 20 (87%)3 (13%) | 0,59 |
| IMC (Kg/m2) | 26,5 (RIC 23-28,9) | 27,06 (RIC 22,8-28,7) | 26,5 (RIC 23-29) | 0,99 |
| FEV1 (l) | 3 (RIC 2,6-3,3) | 3,1 (RIC 2,7-3,2) | 3 (RIC 2,3-3,3) | 0,92 |
| Hipertensión arterial | 20 (46,5%) | 8 (40%) | 12 (52,2%) | 0,31 |
| Diabetes mellitus | 7 (16,3%) | 3 (15%) | 4 (17,4%) | 0,58 |
| SAOS | 11 (25,5%) | 5 (25%) | 6 (26%) | 0,32 |
| Clasificación ASA | ||||
| I | 2 (4,7%) | 0 (0%) | 2 (8,7%) | 0,42 |
| II | 22 (51,2%) | 11 (55%) | 11 (47,8%) | |
| III | 18 (41,9%) | 9 (45%) | 9 (39,1%) | |
| IV | 1 (2,3%) | 0 (0%) | 1 (4,3%) | |
| Patología | ||||
| Adenocarcinoma | 40 (93%) | 18 (90%) | 22 (95,7%) | 0,31 |
| Estenosis post-radioterapia | 1 (2,33%) | 0 (0%) | 1 (4,3%) | |
| Melanoma | 1 (2,33%) | 1 (5%) | 0 (0%) | |
| Carcinoma adenoneuroendocrino | 1 (2,33%) | 1 (5%) | 0 (0%) | |
| Estadio pT | ||||
| pT0 | 3 (7,2%) | 2 (10%) | 1 (4,5%) | 0,62 |
| pT1 | 7 (16,7%) | 3 (15%) | 4 (18,2%) | |
| pT2 | 7 (16,7%) | 2 (10%) | 5 (22,7%) | |
| pT3 | 24 (57,1%) | 13 (65%) | 11 (50%) | |
| pT4 | 1 (2,4%) | 0 (0%) | 1 (4,5%) | |
| Estadio pN | ||||
| pN0 | 22 (52,4%) | 10 (50%) | 12 (54,5%) | 0,53 |
| pN1 | 7 (16,7%) | 4 (20%) | 3 (13,6%) | |
| pN2 | 7 (16,7%) | 2 (10%) | 5 (22,7%) | |
| pN3 | 6 (14,3%) | 4 (20%) | 2 (9,1%) | |
(IMC: Índice de masa corporal, FEV1: Velocidad de flujo espiratorio en el 1° segundo, SAOS: Síndrome de apnea obstructiva del sueño, ASA: American Society of Anesthesiologists, AP: Anatomía patológica)
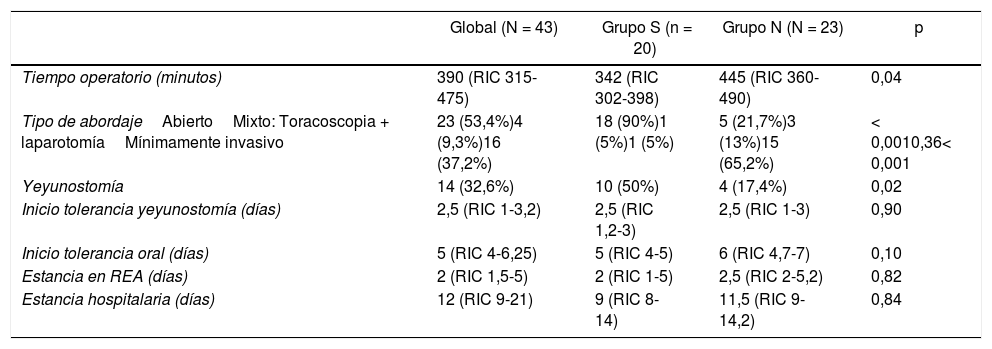
En el 53,4% de los pacientes se empleó un abordaje abierto, con un mayor porcentaje en el grupo S, y en un 37,2% un abordaje mínimamente invasivo, con mayor frecuencia en el grupo N (tabla 2), con un tiempo quirúrgico mayor en este último grupo. El número de yeyunostomías realizadas fue mayor en el grupo con SNG, acorde al cambio de actitud en el empleo de dicha técnica acontecido en enero de 2018 en nuestra unidad. El inicio de la nutrición enteral por la yeyunostomía se produjo en las primeras 48-72 horas postoperatorias en la mayor parte de los pacientes y la mediana de la tolerancia oral fue de cinco días tras la cirugía, sin diferencias significativas entre los grupos. En el grupo S la mediana del tiempo que los pacientes llevaron colocada la SNG fue de cuatro días (RIC: 2-6).
Características de la cirugía y curso postoperatorio
| Global (N = 43) | Grupo S (n = 20) | Grupo N (N = 23) | p | |
|---|---|---|---|---|
| Tiempo operatorio (minutos) | 390 (RIC 315-475) | 342 (RIC 302-398) | 445 (RIC 360-490) | 0,04 |
| Tipo de abordajeAbiertoMixto: Toracoscopia + laparotomíaMínimamente invasivo | 23 (53,4%)4 (9,3%)16 (37,2%) | 18 (90%)1 (5%)1 (5%) | 5 (21,7%)3 (13%)15 (65,2%) | < 0,0010,36< 0,001 |
| Yeyunostomía | 14 (32,6%) | 10 (50%) | 4 (17,4%) | 0,02 |
| Inicio tolerancia yeyunostomía (días) | 2,5 (RIC 1-3,2) | 2,5 (RIC 1,2-3) | 2,5 (RIC 1-3) | 0,90 |
| Inicio tolerancia oral (días) | 5 (RIC 4-6,25) | 5 (RIC 4-5) | 6 (RIC 4,7-7) | 0,10 |
| Estancia en REA (días) | 2 (RIC 1,5-5) | 2 (RIC 1-5) | 2,5 (RIC 2-5,2) | 0,82 |
| Estancia hospitalaria (días) | 12 (RIC 9-21) | 9 (RIC 8-14) | 11,5 (RIC 9-14,2) | 0,84 |
REA: Unidad de Reanimación.
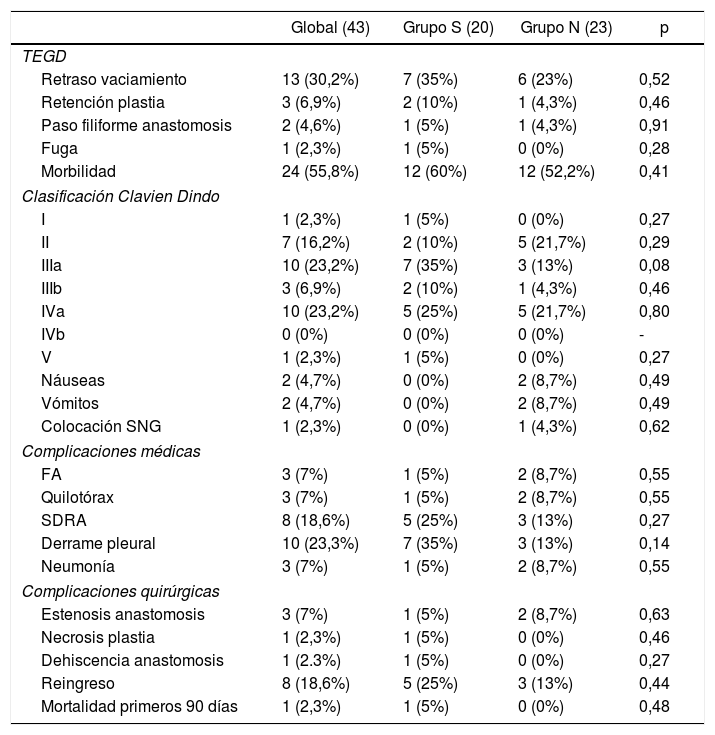
Un 34,9% de los pacientes presentaron algún tipo de alteración en el tránsito esofagogastroduodenal; un 40% en el grupo S y un 30,4% en el grupo N. Un 30,2% presentaron retraso en el vaciamiento de la plastia y en dos pacientes se evidenció dificultad del paso de contraste en la anastomosis, sin diferencias entre los grupos (tabla 3). Ningún paciente presentó paso de contraste a vía aérea ni incoordinación en la deglución.
Morbimortalidad postoperatoria y tasa de reingreso
| Global (43) | Grupo S (20) | Grupo N (23) | p | |
|---|---|---|---|---|
| TEGD | ||||
| Retraso vaciamiento | 13 (30,2%) | 7 (35%) | 6 (23%) | 0,52 |
| Retención plastia | 3 (6,9%) | 2 (10%) | 1 (4,3%) | 0,46 |
| Paso filiforme anastomosis | 2 (4,6%) | 1 (5%) | 1 (4,3%) | 0,91 |
| Fuga | 1 (2,3%) | 1 (5%) | 0 (0%) | 0,28 |
| Morbilidad | 24 (55,8%) | 12 (60%) | 12 (52,2%) | 0,41 |
| Clasificación Clavien Dindo | ||||
| I | 1 (2,3%) | 1 (5%) | 0 (0%) | 0,27 |
| II | 7 (16,2%) | 2 (10%) | 5 (21,7%) | 0,29 |
| IIIa | 10 (23,2%) | 7 (35%) | 3 (13%) | 0,08 |
| IIIb | 3 (6,9%) | 2 (10%) | 1 (4,3%) | 0,46 |
| IVa | 10 (23,2%) | 5 (25%) | 5 (21,7%) | 0,80 |
| IVb | 0 (0%) | 0 (0%) | 0 (0%) | - |
| V | 1 (2,3%) | 1 (5%) | 0 (0%) | 0,27 |
| Náuseas | 2 (4,7%) | 0 (0%) | 2 (8,7%) | 0,49 |
| Vómitos | 2 (4,7%) | 0 (0%) | 2 (8,7%) | 0,49 |
| Colocación SNG | 1 (2,3%) | 0 (0%) | 1 (4,3%) | 0,62 |
| Complicaciones médicas | ||||
| FA | 3 (7%) | 1 (5%) | 2 (8,7%) | 0,55 |
| Quilotórax | 3 (7%) | 1 (5%) | 2 (8,7%) | 0,55 |
| SDRA | 8 (18,6%) | 5 (25%) | 3 (13%) | 0,27 |
| Derrame pleural | 10 (23,3%) | 7 (35%) | 3 (13%) | 0,14 |
| Neumonía | 3 (7%) | 1 (5%) | 2 (8,7%) | 0,55 |
| Complicaciones quirúrgicas | ||||
| Estenosis anastomosis | 3 (7%) | 1 (5%) | 2 (8,7%) | 0,63 |
| Necrosis plastia | 1 (2,3%) | 1 (5%) | 0 (0%) | 0,46 |
| Dehiscencia anastomosis | 1 (2.3%) | 1 (5%) | 0 (0%) | 0,27 |
| Reingreso | 8 (18,6%) | 5 (25%) | 3 (13%) | 0,44 |
| Mortalidad primeros 90 días | 1 (2,3%) | 1 (5%) | 0 (0%) | 0,48 |
TEGD: Tránsito Esófago-gastro-duodenal, SNG: Sonda Nasogástrica, FA: Fibrilación auricular, SDRA: Síndrome de distrés respiratorio del adulto.
Se produjo algún tipo de complicación postoperatoria en el 60% del grupo S y en el 52,2% del grupo N (tabla 3). No hubo diferencias en el número de complicaciones postoperatorias, estancia hospitalaria ni mortalidad a los 90 días postoperatorios entre los grupos. Solo en un paciente del grupo N hubo que colocar una SNG durante el postoperatorio debido a un íleo paralítico.
En un paciente del grupo S se objetivó una fuga anastomótica (tabla 3), precisando de reintervención quirúrgica para su tratamiento.
Hubo una tasa global de reingresos del 18,6%, siendo más frecuentes en el grupo con sonda, pero sin diferencias significativas. La mortalidad a los 90 días en el grupo con SNG fue del 5% y del 0% en el grupo sin sonda.
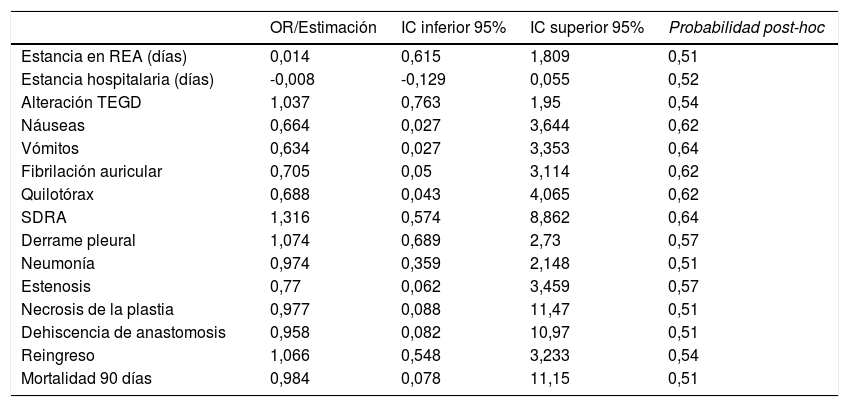
Los OR y los intervalos de credibilidad obtenidos para cada variable en los modelos de regresión creados no evidenciaron relación estadísticamente significativa entre el uso de SNG y ninguna de las complicaciones postoperatorias, mortalidad, reingreso y estancia hospitalaria y en la unidad de Reanimación (tabla 4).
Estimación de los riesgos de complicaciones postoperatorios asociados al uso de SNG
| OR/Estimación | IC inferior 95% | IC superior 95% | Probabilidad post-hoc | |
|---|---|---|---|---|
| Estancia en REA (días) | 0,014 | 0,615 | 1,809 | 0,51 |
| Estancia hospitalaria (días) | -0,008 | -0,129 | 0,055 | 0,52 |
| Alteración TEGD | 1,037 | 0,763 | 1,95 | 0,54 |
| Náuseas | 0,664 | 0,027 | 3,644 | 0,62 |
| Vómitos | 0,634 | 0,027 | 3,353 | 0,64 |
| Fibrilación auricular | 0,705 | 0,05 | 3,114 | 0,62 |
| Quilotórax | 0,688 | 0,043 | 4,065 | 0,62 |
| SDRA | 1,316 | 0,574 | 8,862 | 0,64 |
| Derrame pleural | 1,074 | 0,689 | 2,73 | 0,57 |
| Neumonía | 0,974 | 0,359 | 2,148 | 0,51 |
| Estenosis | 0,77 | 0,062 | 3,459 | 0,57 |
| Necrosis de la plastia | 0,977 | 0,088 | 11,47 | 0,51 |
| Dehiscencia de anastomosis | 0,958 | 0,082 | 10,97 | 0,51 |
| Reingreso | 1,066 | 0,548 | 3,233 | 0,54 |
| Mortalidad 90 días | 0,984 | 0,078 | 11,15 | 0,51 |
REA: Unidad de Reanimación, TECD: Tránsito Esófago-gástrico-duodenal, SDRA: Síndrome de Distrés Respiratorio del adulto.
Aunque las recomendaciones de grupos de expertos abogan por el uso de una SNG descompresiva después de una esofaguectomía y su retirada, si no hay contraindicación, a las 48 horas1,2,5, en este estudio se muestra que evitar su empleo durante el postoperatorio de una esofaguectomía tipo Ivor-Lewis y reconstrucción con gastroplastia es una medida segura que no incrementa la estancia hospitalaria ni la morbimortalidad postoperatoria.
El objetivo principal de los protocolos de rehabilitación multimodal es reducir la morbi-mortalidad postquirúrgica6,7, acortando la estancia hospitalaria8 y mejorando el estado pre9, intra10 y postoperatorio11 del paciente. En la mayoría de los protocolos publicados de recuperación intensificada en cirugía esofágica, el uso de una sonda descompresiva durante el postoperatorio es una medida constante, existiendo diferentes criterios para indicar su retirada, tales como la ausencia de distensión abdominal, dilatación de la plastia o elevado débito6. Estos protocolos justifican el uso de la SNG basándose en que la acumulación de fluidos y la distensión de la plastia debidas a la sección de los nervios vagos y desaparición del esfínter esofágico inferior durante la cirugía puede aumentar el riesgo de dehiscencia de la anastomosis y de neumonía por broncoaspiración, atribuyendo a la descompresión de la plastia con la sonda una disminución de los vómitos, dolor y aspiraciones bronquiales12. Sin embargo, la evidencia disponible en la actualidad que sustenta su empleo de forma sistemática es escasa y en ocasiones contradictoria. Así, a pesar de que algunos estudios controlados demostraron un mayor número de complicaciones en los pacientes sin sonda descompresiva tras una esofaguectomía13,14, otros trabajos sustentan que la retirada precoz de la misma durante el primer día postoperatorio no aumenta el riesgo de complicación como neumonía, dehiscencia anastomótica, parálisis recurrencial o sangrado gastrointestinal15. En un estudio chino, semejante al desarrollado en nuestro centro, en el que se incluían 90 pacientes, 45 en cada grupo, se evidenció que el grado de dolor faríngeo y el tiempo hasta la ingesta oral, hasta la expulsión de aires y de hospitalización fueron menores en el grupo que no llevaba sonda, sin mayor número de complicaciones ni vómitos postoperatorios16. En un reciente ensayo clínico prospectivo y multicéntrico17 con pacientes sometidos a esofaguectomía tipo Ivor Lewis en los que no se colocó SNG durante el postoperatorio, se ha evidenciado que el inicio de la tolerancia oral precoz no se relaciona con mayor número de complicaciones frente al inicio más tardío de dicha tolerancia.
Un reciente metaanálisis que incluye siete trabajos bien diseñados con 608 pacientes sometidos a esofaguectomía concluye que la retirada inmediata o precoz de la SNG no incrementa el número de dehiscencias anastomóticas, complicaciones pulmonares o mortalidad postoperatoria, como en el presente estudio, pero además con una reducción de la estancia hospitalaria18.
Aunque el empleo de una sonda no suele asociar graves complicaciones, existe cierta morbilidad que podría ocasionar su uso y colocación, como odinofagia u otalgia, lesiones en la mucosa nasal, sinusitis, gastritis y epistaxis. Algunos grupos refieren una mayor tasa de complicaciones respiratorias18 asociadas al empleo de SNG, debido a que la sonda impide el correcto vaciado de las secreciones bronquiales favoreciendo su acúmulo y sobreinfección, así como un aumento del disconfort del paciente, íleo postoperatorio y tiempo de hospitalización19,20. En este estudio no se encontraron diferencias en estos aspectos con relación al empleo de la SNG.
Una de las supuestas ventajas de la SNG es la disminución de las náuseas, vómitos y distensión abdominal, pero al igual que muestran los resultados de este estudio, otros trabajos recientes no encuentran diferencias significativas20–22 en este punto con el empleo de la misma.
La prevención de una posible dehiscencia anastomótica es uno de los pilares básicos que tradicionalmente ha sustentado el uso de la SNG en el postoperatorio de una esofagectomía. Sin embargo, en los últimos años dicha teoría ha sido puesta en duda, atribuyéndose al empleo de una SNG una mayor incidencia de fuga anastomótica según algunas series20. En este trabajo no se han encontrado diferencias significativas en la aparición de fuga anastomótica entre ambos grupos, siendo el porcentaje de dehiscencias (2,3%) acorde a lo publicado en la literatura23–25.
La necesidad de recolocar una SNG durante el postoperatorio de una esofaguectomía es infrecuente, y en caso de ser requerido su posicionamiento se puede realizar sin elevado número de complicaciones y con seguridad5,12,18. En la experiencia presentada un único caso requirió la colocación de SNG por íleo paralítico y vómitos persistentes, realizándose su colocación sin complicaciones asociadas.
Al igual que ocurre con la morbilidad, no se han evidenciado diferencias en las tasas de mortalidad postoperatoria con o sin el uso de SNG de forma rutinaria20, estando la mortalidad global presentada en este estudio acorde con las cifras aceptadas tras una esofaguectomía Ivor-Lewis26,27.
Algunas series han mostrado una reducción de los costes y de la estancia hospitalaria con la omisión del uso de SNG en pacientes sometidos a una esofaguectomía28,29. Sin embargo, en este trabajo no se han encontrado diferencias significativas en la estancia ni en reanimación ni intrahospitalaria global entre los grupos.
Evidentemente este estudio tiene algunas limitaciones que deben ser consideradas, como son el diseño retrospectivo no aleatorizado, el número limitado de casos, la escasa frecuencia de algunos eventos adversos estudiados, así como la existencia de otras variables de confusión no estudiados que podrían influir en los resultados de morbimortalidad y estancia hospitalaria de esta compleja cirugía.
Por tanto, con base en los resultados obtenidos parece que el uso sistemático de una SNG descompresiva tras una esofaguectomía puede evitarse de forma rutinaria sin aumentar el número de complicaciones ni la gravedad de las mismas. Ante la falta de evidencia clara en este aspecto, son necesarios ensayos clínicos prospectivos y aleatorizados con mayor tamaño muestral que aporten una mayor evidencia científica.
Originalidad del materialEl contenido de este artículo es original y no ha sido publicado previamente ni está enviado ni sometido a consideración en cualquier otra publicación, en su totalidad o en alguna de sus partes.
Este manuscrito con título «Uso de sonda nasogástrica en pacientes sometidos a esofaguectomía: Un gesto innecesario» fue presentado parcialmente en junio de 2019 como comunicación oral en el Congreso Nacional de Cirugía Esófago-gástrica, Bilbao, España.
Protocolos de investigación clínicaLos autores firmantes aceptamos que los contenidos del trabajo remitido se han elaborado respetando las recomendaciones internacionales sobre investigación clínica. Del mismo modo, se siguieron los protocolos establecidos por nuestro hospital para acceder a los datos para la investigación.
Conflicto de interesesLos autores declaran no tener conflicto de intereses con la investigación. La presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, comercial o entidades sin ánimo de lucro.