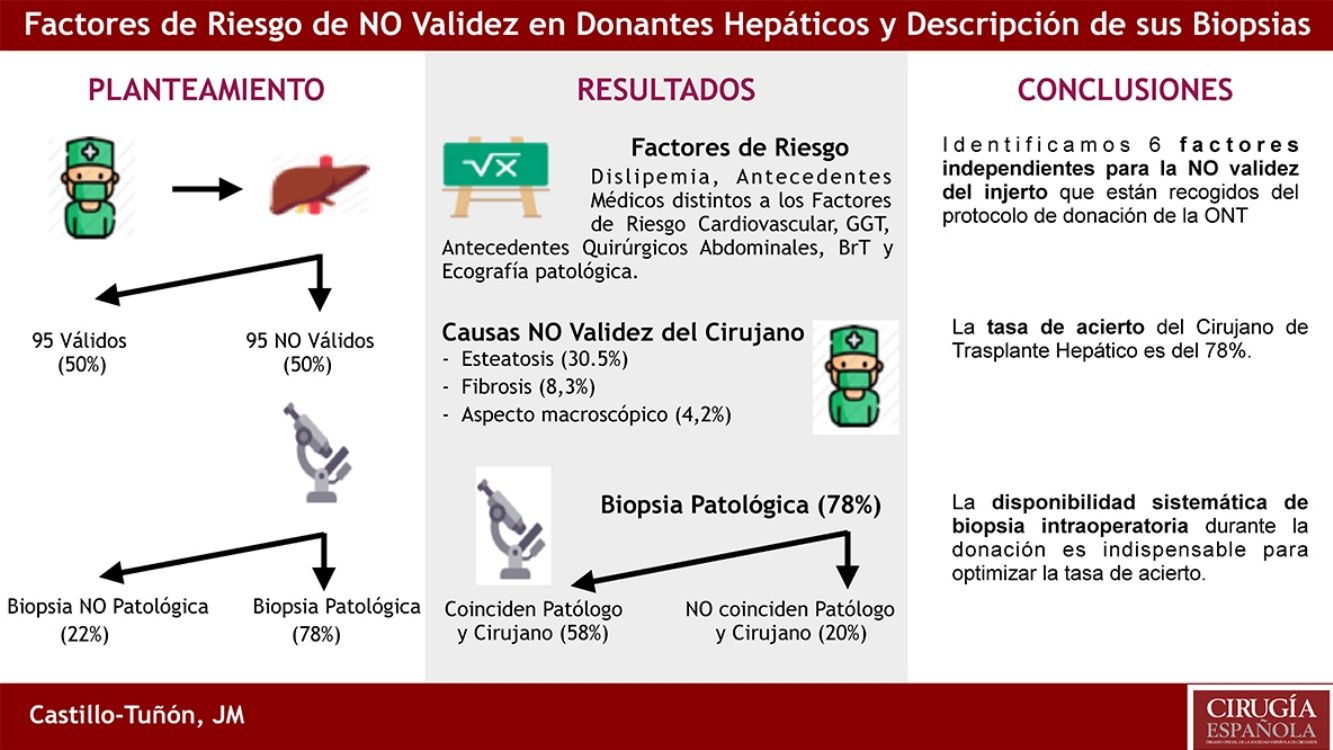
Entre las estrategias diseñadas para optimizar el número de injertos hepáticos existentes para trasplante, la implementación del proceso de valoración de injertos constituye una de las menos exploradas. El objetivo principal es identificar los factores de riesgo que presentan los donantes hepáticos para la «NO validez». Secundariamente analizamos la coincidencia entre la valoración del cirujano y la del anatomopatólogo en los donantes NO válidos.
Material y métodoEstudio retrospectivo realizado a partir de una base de datos prospectiva que analiza 190 donantes hepáticos, 95 válidos y 95 NO válidos. Se estudian las variables de cada uno de ellos correspondientes al protocolo de donación de la Organización Nacional de Trasplantes. Mediante el estudio multivariante determinamos los factores de riesgo independientes de NO validez. Cotejamos las causas de NO validez argumentadas con los hallazgos histopatológicos de dichos injertos.
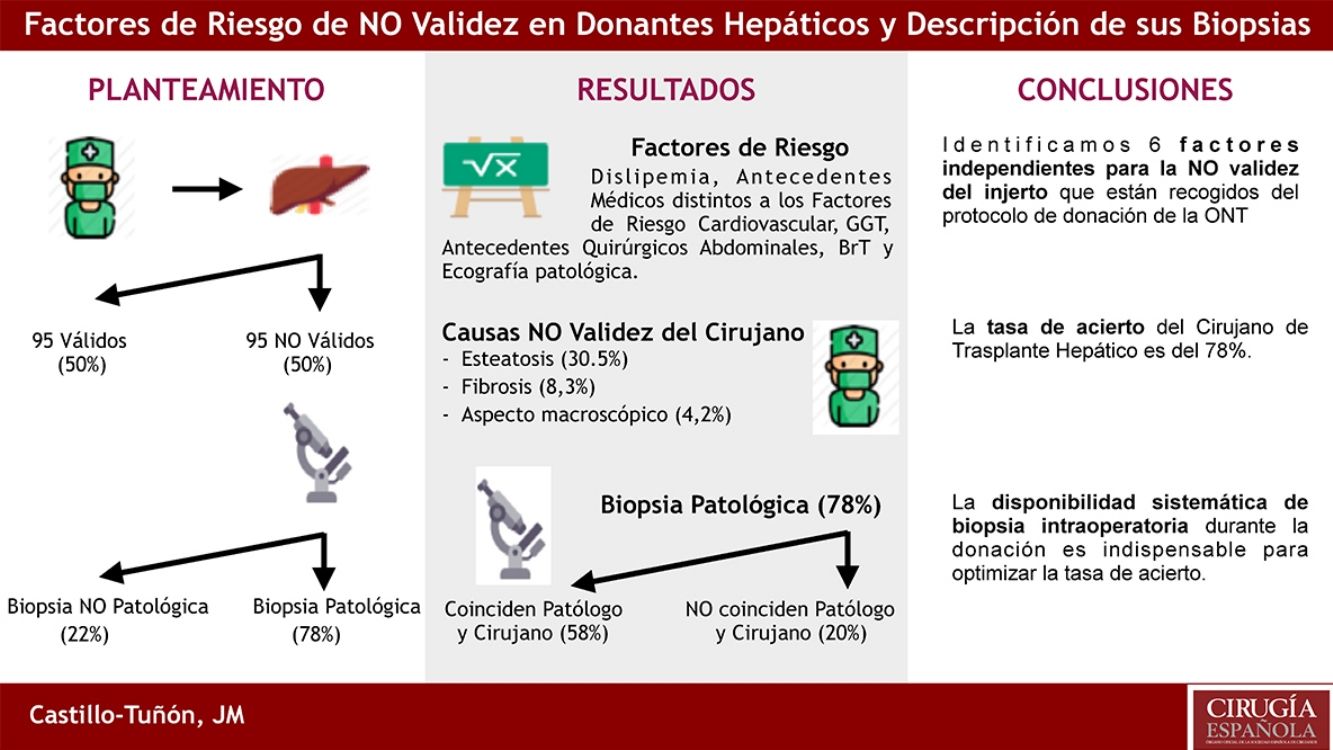
ResultadosLos factores de riesgo independientes de NO validez en el estudio multivariante (p < 0,05) fueron: dislipemia, antecedentes personales médicos distintos a factores de riesgo cardiovascular y quirúrgicos abdominales, GGT, BrT, y el resultado de la ecografía hepática previa. Las dos causas más frecuentes de NO validez fueron: esteatosis y fibrosis. El 78% de las biopsias confirmaron la NO validez del injerto (en 57,9% del total coincidían los hallazgos histológicos con los descritos por el cirujano). El 22% restante de las biopsias no presentaban hallazgos patológicos.
ConclusionesLa determinación de los factores de riesgo de NO validez contribuirá al diseño de futuros scores de valoración que constituyan herramientas útiles en el proceso de valoración de injertos hepáticos.
Among the strategies designed to optimize the number of existing liver grafts for transplantation, the implementation of the graft assessment process is one of the least explored. The main objective is to identify the risk factors presented by liver donors for «NO validity». Secondly, we analyzed the coincidence between the surgeon's assessment and that of the anatomo-pathologist in the invalid donors.
Material and methodRetrospective study conducted from a prospective database that analyzes 190 liver donors, 95 valid and 95 NOT valid. The variables of each of them corresponding to the donation protocol of the National Transplant Organization are studied. Through a multivariate study we determine the independent risk factors of NO validity. We checked the causes of NO validity argued with the histopathological findings of these grafts.
ResultsThe independent risk factors of non-validity in the multivariate study (P < .05) were: dyslipidemia, personal medical history other than cardiovascular and abdominal surgical risk factors, GGT, BrT, and the result of previous liver ultrasound. The 3 most frequent causes of NO validity were: steatosis, fibrosis and macroscopic appearance of the organ. 78% of the biopsies confirmed the NO validity of the graft (in 57.9% of the cases the histological findings coincided with those described by the surgeon). The 22.1% of the biopsies hadńt pathological findings.
ConclusionsThe determination of the risk factors of NO validity will contribute to the design of future assessment scores that are useful tools in the process of liver graft assessment.)
Los donantes con criterios expandidos1 (DCE) presentan mayor probabilidad de fallo o disfunción primaria del injerto, o bien, asocian menor supervivencia cuando lo comparamos con el donante ideal2-4. Éstos suponen una importante proporción de los donantes ofertados. En estos casos, la valoración in situ del injerto hepático puede llegar a ser un proceso realmente complejo. Dicha valoración tiene un componente subjetivo basado en la experiencia del cirujano de trasplante hepático (TH). En caso de duda, está indicada la biopsia hepática en frío. Desafortunadamente, no está disponible sistemáticamente durante la donación en todos los centros por distintos motivos. Según la Organización Nacional de Trasplantes (ONT), la tasa de injertos hepáticos implantados (donación en muerte encefálica [ME]) ha bajado en los últimos 9 años del 70 al 62%5 a expensas de una mortalidad en lista de espera del 3% y un drop-out del 9%6.
Dado que la decisión de validez/NO validez del injerto es compleja y está basada en criterios tan subjetivos como puede ser el aspecto y la palpación, nos planteamos identificar factores de riesgo para la NO validez de donantes hepáticos en ME empleando las variables recogidas en el protocolo de donación de la ONT. Secundariamente analizamos la anatomía patológica y la tasa de acierto del cirujano durante el proceso de valoración in situ.
Material y métodoEstudio retrospectivo unicéntrico de cohortes realizado a partir de una base de datos prospectiva. Analizamos 190 injertos hepáticos de donantes en ME (95 NO válidos y su consecutivo válido) entre 2012-2016. Todos fueron donantes que cumplían los criterios de la ONT y fueron valorados in situ por los mismos cirujanos de TH con más de 5 años de experiencia en donación hepática en un centro nacional de alto volumen.
Las variables estudiadas son todas las recogidas en el protocolo de donación de la ONT, documento oficial de obligado cumplimiento por parte de la coordinación que genera la oferta y que sirve para valorar la idoneidad del injerto por parte del equipo quirúrgico7. Entendemos como injerto válido aquel que ha sido valorado in situ siguiendo los criterios registrados en la «Guide to Quality and Safety of Organs Transplantation»8. En caso de duda realizamos biopsia hepática. Aquellos injertos que no superaron la evaluación in situ, fueron considerados «NO válidos». Las causas de la NO validez (esteatosis, colestasis, fibrosis, cirrosis, ateromatosis, isquemia y otras consideraciones relacionadas con el aspecto macroscópico) están recogidas en el protocolo de donación de la ONT9. El ítem «aspecto macroscópico» es subjetivo y no se corresponde con ninguna de las otras 6 causas de NO validez. Consideramos ecografía patológica si presenta hallazgos compatibles con esteatosis hepática, cirrosis, fibrosis o cualquier anormalidad morfológica10.
Dividimos nuestra serie en dos grupos:
- -
Injertos hepáticos NO válidos (n=95): Valorados in situ y considerados NO válidos. Recogimos la causa de NO validez dada por el cirujano de TH. Sólo incluimos aquellos con biopsia hepática para confirmar la NO validez de manera diferida porque en el hospital donante no disponían de patólogo por distintos motivos. Fueron examinadas por el Servicio de Anatomía Patológica del H. U. Virgen del Rocío (Sevilla), por un patólogo experto en histopatología hepática.
- -
Injertos hepáticos válidos (n=95): fueron incluidos los injertos válidos consecutivos a los 95 NO válidos. A todos se les realizó biopsia posreperfusión.
Comparamos las variables de los donantes de ambos grupos y estudiamos si existen diferencias estadísticamente significativas mediante estudio univariante. Las que presentaron significación estadística (p < 0,05) fueron incluidas en el estudio multivariante para determinar los factores independientes de NO Validez. Valoramos la edad (años), sexo (hombre/mujer), índice de masa corporal (kg/m2), hipertensión arterial (sí/no), diabetes mellitus (sí/no), dislipemia (hipercolesterolemnia y/o hipertrigliceridemia [sí/no]), antecedentes personales médicos distintos a factores de riesgo cardiovascular (antecedentes médicos del donante distintos a hipertensión, diabetes y dislipemia), antecedentes personales quirúrgicos (cirugías abdominales previas), ecografía («No realizada» si no hay disponible ningún informe, «Patológica» si los hallazgos se desvían de la normalidad y «Normal» si no evidencia hallazgos patológicos), anticuerpos anticore del virus de la hepatitis B (sí/no), anticuerpos frente al virus de la hepatitis C (sí/no), aspartato-aminotransferasa (UI/mL), alanino-aminotransferasa (UI/mL), gammaglutamil-transpeptidasa (UI/mL), bilirrubina total (mg/nL), sodio (mg/mL), uso de aminas (sí/no) y dosis (μg/kg/min). En relación a la esteatosis, decir que en nuestro centro y durante el periodo de estudio del presente artículo, consideramos como injertos NO válidos aquellos con una esteatosis > 30%.
Posteriormente, analizamos el grupo de injertos NO válidos. Enumeramos las causas macroscópicas de NO validez (juicio del cirujano de TH) y el resultado de las biopsias (diagnóstico del anatomopatólogo). Estimamos la tasa de acierto de cirujano de TH (no. de juicios del cirujano de TH que coinciden con el diagnóstico anatomopatológico/total de biopsias). Analizamos mediante estudio univariante si hubo diferencias entre el subgrupo con biopsia patológica y biopsia no patológica de los injertos NO válidos. Por último, cuantificamos la tasa de acierto por causa macroscópica específica de No Validez (no. de juicios específicos del cirujano de TH que coinciden con el diagnóstico anatomopatalógico/total de diagnósticos anatomopatológicos).
El estudio estadístico se realizó con el programa SPSS v22.0. Se determinó la distribución normal de la muestra mediante el empleo del test Kolmogorov-Smirnov, motivo por el cual las variables continuas quedan reflejadas con la media±desviación estándar y las comparamos mediante la t de Student. Expresamos las variables cualitativas en cifras absolutas (n) con el porcentaje entre paréntesis (%) y las comparamos mediante el test de χ2. El estudio multivariable lo realizamos mediante regresión logística. La significación estadística se estableció para una valor de p < 0,05 y el riesgo se estimó mediante los coeficientes de riesgo B y EXP (B).
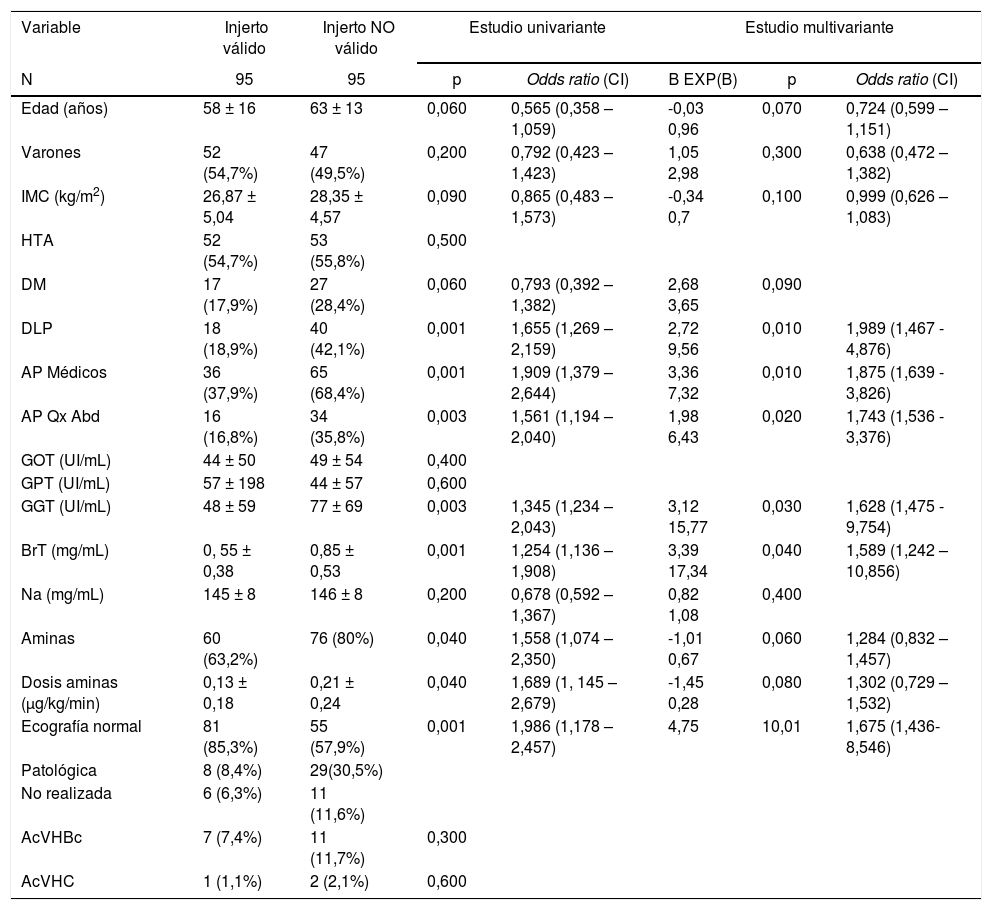
ResultadosCaracterísticas de los donantes válidos vs. NO válidosNo hubo ningún caso de fallo primario del injerto entre los 95 hígados dados como válidos una vez implantados. Encontramos diferencias significativas al comparar injertos válidos vs injertos NO válidos en el caso de la dislipemia (DLP): 18 (19%) vs. 40 (42%) respectivamente, p = 0,001; antecedentes médicos distintos a factores de riesgo cardiovascular (APM): 36 (38%) vs. 65 (68%) respectivamente, p = 0,001; antecedentes de cirugía abdominal (APQ): 16 (17%) vs 34 (36%) respectivamente, p = 0,003; GGT: 48±59 vs. 77±69 UI/mL respectivamente, p = 0,003; BrT: 0, 55±0,38 vs. 0,85±0,53 mg/mL respectivamente, p = 0,001; ecografía patológica en 8 (8%) donantes válidos vs. 29 (30%) donantes NO válidos, p = 0,001. Precisaron aminas para el mantenimiento 60 donantes válidos (63%) vs. 76 donantes NO válidos (80%), p = 0,04 con una dosis media de 0,13 ± 0,18 vs 0,21±0,24 μg/kg/min respectivamente, p = 0,04. El resto no mostraron diferencias estadísticamente significativas (tabla 1).
Estudio univariante y multivariante sobre los factores de riesgo de NO validez
| Variable | Injerto válido | Injerto NO válido | Estudio univariante | Estudio multivariante | |||
|---|---|---|---|---|---|---|---|
| N | 95 | 95 | p | Odds ratio (CI) | B EXP(B) | p | Odds ratio (CI) |
| Edad (años) | 58 ± 16 | 63 ± 13 | 0,060 | 0,565 (0,358 – 1,059) | -0,03 0,96 | 0,070 | 0,724 (0,599 – 1,151) |
| Varones | 52 (54,7%) | 47 (49,5%) | 0,200 | 0,792 (0,423 – 1,423) | 1,05 2,98 | 0,300 | 0,638 (0,472 – 1,382) |
| IMC (kg/m2) | 26,87 ± 5,04 | 28,35 ± 4,57 | 0,090 | 0,865 (0,483 – 1,573) | -0,34 0,7 | 0,100 | 0,999 (0,626 – 1,083) |
| HTA | 52 (54,7%) | 53 (55,8%) | 0,500 | ||||
| DM | 17 (17,9%) | 27 (28,4%) | 0,060 | 0,793 (0,392 – 1,382) | 2,68 3,65 | 0,090 | |
| DLP | 18 (18,9%) | 40 (42,1%) | 0,001 | 1,655 (1,269 – 2,159) | 2,72 9,56 | 0,010 | 1,989 (1,467 - 4,876) |
| AP Médicos | 36 (37,9%) | 65 (68,4%) | 0,001 | 1,909 (1,379 – 2,644) | 3,36 7,32 | 0,010 | 1,875 (1,639 - 3,826) |
| AP Qx Abd | 16 (16,8%) | 34 (35,8%) | 0,003 | 1,561 (1,194 – 2,040) | 1,98 6,43 | 0,020 | 1,743 (1,536 - 3,376) |
| GOT (UI/mL) | 44 ± 50 | 49 ± 54 | 0,400 | ||||
| GPT (UI/mL) | 57 ± 198 | 44 ± 57 | 0,600 | ||||
| GGT (UI/mL) | 48 ± 59 | 77 ± 69 | 0,003 | 1,345 (1,234 – 2,043) | 3,12 15,77 | 0,030 | 1,628 (1,475 - 9,754) |
| BrT (mg/mL) | 0, 55 ± 0,38 | 0,85 ± 0,53 | 0,001 | 1,254 (1,136 – 1,908) | 3,39 17,34 | 0,040 | 1,589 (1,242 – 10,856) |
| Na (mg/mL) | 145 ± 8 | 146 ± 8 | 0,200 | 0,678 (0,592 – 1,367) | 0,82 1,08 | 0,400 | |
| Aminas | 60 (63,2%) | 76 (80%) | 0,040 | 1,558 (1,074 – 2,350) | -1,01 0,67 | 0,060 | 1,284 (0,832 – 1,457) |
| Dosis aminas (μg/kg/min) | 0,13 ± 0,18 | 0,21 ± 0,24 | 0,040 | 1,689 (1, 145 – 2,679) | -1,45 0,28 | 0,080 | 1,302 (0,729 – 1,532) |
| Ecografía normal | 81 (85,3%) | 55 (57,9%) | 0,001 | 1,986 (1,178 – 2,457) | 4,75 | 10,01 | 1,675 (1,436- 8,546) |
| Patológica | 8 (8,4%) | 29(30,5%) | |||||
| No realizada | 6 (6,3%) | 11 (11,6%) | |||||
| AcVHBc | 7 (7,4%) | 11 (11,7%) | 0,300 | ||||
| AcVHC | 1 (1,1%) | 2 (2,1%) | 0,600 | ||||
IMC: Índice de masa corporal; HTA: Hipertensión arterial; DM: Diabetes mellitus; DLP: Dislipemia. AP médicos: Antecedentes médicos distintos a factores de riesgo cardiovascular; AP Qx: Antecedentes personales de cirugía abdominal; GOT: Aspartato-aminotransferasa; GPT: Alanino-aminotransferasa; GGT: Gammaglutamil-transpeptidasa; BrT: Bilirrubina total; Na: Sodio; AcVHBc: Anticuerpo anticore del virus de la hepatitis B; AcVHC: Anticuerpo frente al virus de la hepatitis C.
El estudio multivariante confirmó como factores independientes para la NO validez la BrT (OR: 4,963; IC 95%: 1,853-13,289; p = 0,04), dislipemia (OR: 4,767; IC 95%: 1,873-12,134; p = 0,01), ecografía hepática patológica (OR: 4,727; IC 95%: 1,714-13,035; p = 0,03), APQ (OR: 3,989; IC 95%: 1,591-10,001; p = 0,02), APM (OR: 2,734; IC 95%: 1,227-6,092; p = 0,01), y GGT (OR: 1,01; IC 95%: 1,004-1,017; p = 0,03).
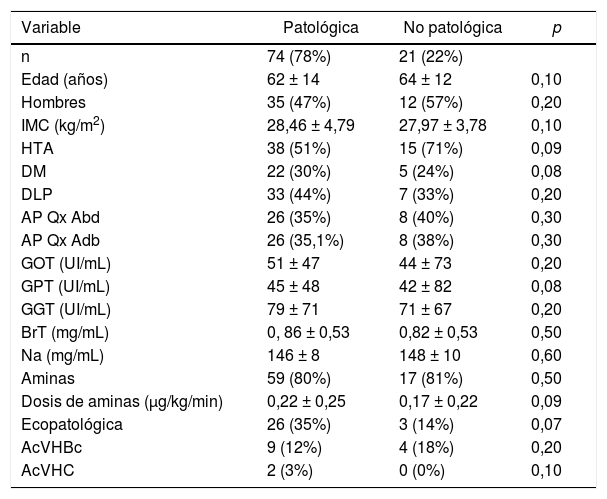
Estudio univariante del grupo de injertos NO válidos (biopsia patológica vs no patológica)Los 95 (100%) injertos NO válidos tuvieron biopsia con informe diferido (tabla 2).
Injertos NO válidos, comparación entre subgrupo con biopsia patológica y biopsia no patológica (estudio univariante)
| Variable | Patológica | No patológica | p |
|---|---|---|---|
| n | 74 (78%) | 21 (22%) | |
| Edad (años) | 62 ± 14 | 64 ± 12 | 0,10 |
| Hombres | 35 (47%) | 12 (57%) | 0,20 |
| IMC (kg/m2) | 28,46 ± 4,79 | 27,97 ± 3,78 | 0,10 |
| HTA | 38 (51%) | 15 (71%) | 0,09 |
| DM | 22 (30%) | 5 (24%) | 0,08 |
| DLP | 33 (44%) | 7 (33%) | 0,20 |
| AP Qx Abd | 26 (35%) | 8 (40%) | 0,30 |
| AP Qx Adb | 26 (35,1%) | 8 (38%) | 0,30 |
| GOT (UI/mL) | 51 ± 47 | 44 ± 73 | 0,20 |
| GPT (UI/mL) | 45 ± 48 | 42 ± 82 | 0,08 |
| GGT (UI/mL) | 79 ± 71 | 71 ± 67 | 0,20 |
| BrT (mg/mL) | 0, 86 ± 0,53 | 0,82 ± 0,53 | 0,50 |
| Na (mg/mL) | 146 ± 8 | 148 ± 10 | 0,60 |
| Aminas | 59 (80%) | 17 (81%) | 0,50 |
| Dosis de aminas (μg/kg/min) | 0,22 ± 0,25 | 0,17 ± 0,22 | 0,09 |
| Ecopatológica | 26 (35%) | 3 (14%) | 0,07 |
| AcVHBc | 9 (12%) | 4 (18%) | 0,20 |
| AcVHC | 2 (3%) | 0 (0%) | 0,10 |
IMC: Índice de masa corporal; HTA: Hipertensión arterial; DM: Diabetes mellitus. DLP: Dislipemia; AP médicos: Antecedentes médicos distintos a factores de riesgo cardiovascular; AP Qx: Antecedentes personales de cirugía abdominal; GOT: Aspartato-aminotransferasa; GPT: Alanino-aminotransferasa; GGT: Gammaglutamil-transpeptidasa; BrT: Bilirrubina total; Na: Sodio; AcVHBc: Anticuerpo anticore del virus de la hepatitis B; AcVHC: Anticuerpo frente al virus de la hepatitis C.
La tasa de acierto del cirujano de TH fue del 78% (en 74 casos de los 95 los hallazgos confirmaron la no validez). Hubo 21 (22%) injertos valorados como NO válidos cuya biopsia fue informada sin hallazgos patológicos.
Ningún valor mostró diferencias estadísticamente significativas entre los grupos comparados.
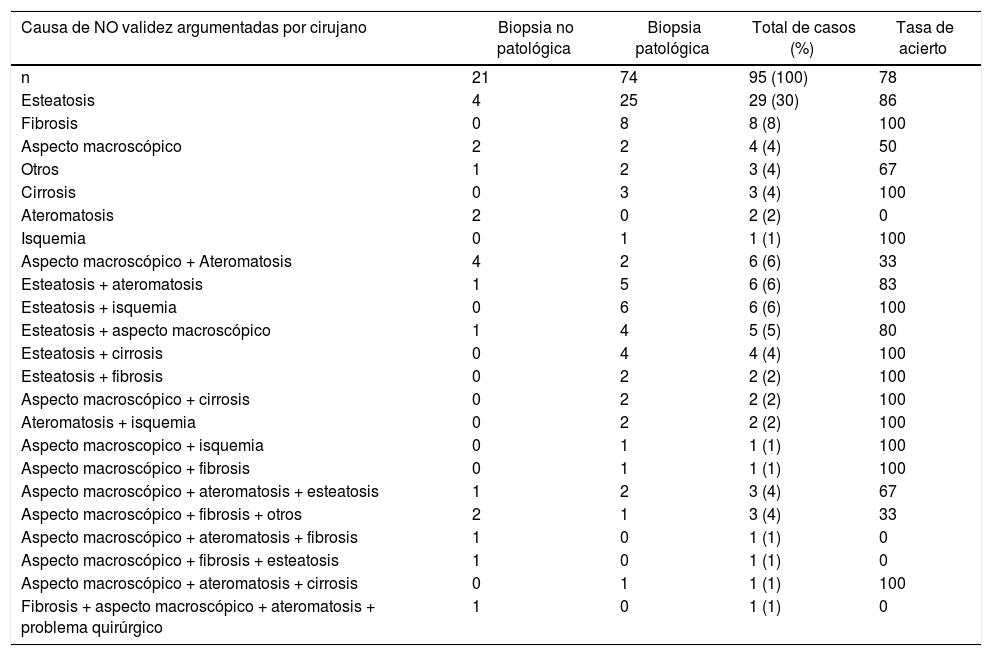
Relación de causas macroscópicas de NO validez argumentadas por el cirujano de TH y diagnóstico anatomopatológicoLas tres causas más frecuentes de NO validez referidas por el cirujano de trasplantes fueron: esteatosis n = 29 (30%), fibrosis n = 8 (8%) y aspecto macroscópico del órgano n = 4 (4%) (tabla 3).
Relación de causas macroscópicas de NO validez argumentadas por el Cirujano de TH y diagnóstico anatomopatológico
| Causa de NO validez argumentadas por cirujano | Biopsia no patológica | Biopsia patológica | Total de casos (%) | Tasa de acierto |
|---|---|---|---|---|
| n | 21 | 74 | 95 (100) | 78 |
| Esteatosis | 4 | 25 | 29 (30) | 86 |
| Fibrosis | 0 | 8 | 8 (8) | 100 |
| Aspecto macroscópico | 2 | 2 | 4 (4) | 50 |
| Otros | 1 | 2 | 3 (4) | 67 |
| Cirrosis | 0 | 3 | 3 (4) | 100 |
| Ateromatosis | 2 | 0 | 2 (2) | 0 |
| Isquemia | 0 | 1 | 1 (1) | 100 |
| Aspecto macroscópico + Ateromatosis | 4 | 2 | 6 (6) | 33 |
| Esteatosis + ateromatosis | 1 | 5 | 6 (6) | 83 |
| Esteatosis + isquemia | 0 | 6 | 6 (6) | 100 |
| Esteatosis + aspecto macroscópico | 1 | 4 | 5 (5) | 80 |
| Esteatosis + cirrosis | 0 | 4 | 4 (4) | 100 |
| Esteatosis + fibrosis | 0 | 2 | 2 (2) | 100 |
| Aspecto macroscópico + cirrosis | 0 | 2 | 2 (2) | 100 |
| Ateromatosis + isquemia | 0 | 2 | 2 (2) | 100 |
| Aspecto macroscopico + isquemia | 0 | 1 | 1 (1) | 100 |
| Aspecto macroscópico + fibrosis | 0 | 1 | 1 (1) | 100 |
| Aspecto macroscópico + ateromatosis + esteatosis | 1 | 2 | 3 (4) | 67 |
| Aspecto macroscópico + fibrosis + otros | 2 | 1 | 3 (4) | 33 |
| Aspecto macroscópico + ateromatosis + fibrosis | 1 | 0 | 1 (1) | 0 |
| Aspecto macroscópico + fibrosis + esteatosis | 1 | 0 | 1 (1) | 0 |
| Aspecto macroscópico + ateromatosis + cirrosis | 0 | 1 | 1 (1) | 100 |
| Fibrosis + aspecto macroscópico + ateromatosis + problema quirúrgico | 1 | 0 | 1 (1) | 0 |
Tasa de acierto: (Número de causa de NO validez con biopsia patológica x 100)/Total de casos. Expresada en tanto porcentual (%).
Desde el punto de vista anatomopatológico, el diagnóstico microscópico más frecuente de NO validez fue esteatosis n = 37 (39%), seguida de fibrosis n = 15 (16%) y cirrosis n = 8 (8%).
Los juicios con mayor tasa de acierto fueron la fibrosis, cirrosis, isquemia (100% casos). La esteatosis coincidió con el diagnóstico del patólogo en un 86% de los casos. Las causas más frecuentes de confusión para el cirujano fueron el aspecto macroscópico y la ateromatosis del injerto.
DiscusiónLa valoración in situ del injerto hepático durante el proceso de donación es una de las principales dificultades a las que se enfrenta el cirujano de TH. Se trata de una valoración subjetiva basada en la experiencia personal acumulada11. Hay estudios que demuestran la infravaloración sistemática del riesgo de fallo primario del injerto, especialmente en órganos de peor calidad. Incluso, que las decisiones tomadas por los cirujanos sobre los órganos de alto riesgo podrían basarse más en experiencias recientes que en la propia evidencia científica12. En un intento de asistir al cirujano de trasplantes en la valoración in situ se han desarrollado índices de riesgo de fallo primario13,14 o que valoran la supervivencia del paciente con datos del donante y del receptor15-18.
Sin embargo, nuestro objetivo es la identificación de factores de riesgo de NO validez al realizar la oferta la ONT empleando las variables recogidas en el protocolo de donación. La principal limitación de nuestro estudio es que no podemos comparar las anatomías patológicas, porque no disponemos de biopsia de los injertos válidos al iniciar la donación (todos tienen la biopsia posreperfusión una vez implantado). Desde el punto de vista metodológico, lo correcto habría sido calcular el tamaño muestral y comparar de manera prospectiva las variables del protocolo de donación de la ONT y una biopsia tomada al inicio de la extracción en ambos grupos. Otro aspecto limitante es que consideramos como injertos NO válidos aquellos con una esteatosis > 30%. Durante la etapa que realizamos este estudio, nuestro sistema de priorización autonómico no permitía el matching donante-receptor, de tal manera que el injerto se ofertaba a receptores con MELD alto. La evidencia científica recomienda el empleo de injertos con esteatosis moderada (31-60%) en receptores con MELD bajo19. Actualmente, aceptamos injertos con esteatosis moderada dado que en junio de 2019 cambió nuestro sistema de priorización y se permite seleccionar el receptor según las características del donante. Otra limitación es el uso de la opción «aspecto macroscópico» como motivo para la NO validez, recogida en el protocolo de donación de la ONT9. Pensamos que se trata de un factor de confusión, ya que hay variables como la esteatosis, cirrosis, etcétera, que se incluyen dentro de este juicio de NO validez. Es un argumento ambiguo. En la serie nacional estudiada22, tampoco se relaciona la causa de la NO validez con el diagnóstico anatomopatológico. En nuestro caso, la tasa de acierto más baja se relaciona con este hallazgo de manera aislada (tabla 3).
La literatura sobre el apoyo a la decisión del cirujano de trasplantes es escasa, y aún menos los estudios que tienen como fin determinar factores de riesgo de NO validez20,21. Recientemente, la ONT presentó en el informe de actividad de 2017 como factores de riesgo independientes de NO validez a la edad, la ecografía patológica y el antecedente de consumo de alcohol22. Sólo coincidimos en el caso de la ecografía patológica. Aportamos como variables independientes para la NO validez del injerto hepático la DPL, APM, APQ, GGT (valores normales: 10-50 UI/L) y BrT (valores normales: 0,1-1,20 mg/dL). En relación a la edad del donante, no encontramos significación estadística (p = 0,06) a diferencia del documento reportado por la ONT22 o la serie de Czerwiñski? et al.20. La edad del donante es siempre un tema que genera controversia. Es un factor de riesgo para el fallo primario del injerto y para la supervivencia del injerto validado por su inclusión en diferentes escalas pronósticas13,15-18. Paradójicamente, la edad media de los donantes hepáticos se ha incrementado durante los últimos años sin empeorar la supervivencia del paciente23,24. Según la ONT, la edad del donante hepático pasó de 50 años en 2001 a 61 años en 201725.
La causa macroscópica de NO validez del injerto argumentada por el cirujano observada de manera aislada fue la esteatosis (30%), al igual que en la memoria de la ONT (27%)22 o la serie de Shamsaeefar et al. (62,5%)21. Si sumamos todos los casos en los que aparece «esteatosis» en la tabla 2 (causa aislada + asociación de causas) registramos 55 (58%) casos. Este dato es preocupante, ya que se trata de una patología cada vez más común en países desarrollados que afecta al 20-30% de la población general26. El uso de injertos con esteatosis moderada o grave se asocia con una mayor incidencia de fallo primario y una tendencia de aumento en la mortalidad a un mes27,28. De hecho, hay estudios que demuestran que es un factor de riesgo independiente para la supervivencia del injerto junto con los factores del Donor Risk Index29. En nuestra serie, la esteatosis es la causa de NO validez que mejor identifica el cirujano junto con la fibrosis, la cirrosis o la mala perfusión (tabla 3). Quizás a corto plazo, la esteatosis deje de ser un factor condicionante para la NO validez gracias a las máquinas de perfusión ex situ30,31.
El segundo objetivo del presente estudio ha sido valorar la coincidencia entre el juicio del cirujano y el del anatomopatólogo para los donantes NO válidos. Se dio en 74 de los 95 casos estudiados (tasa de acierto del 78%). Czerwiñski? et al.20 tiene una tasa de acierto del 65%, inferior a la obtenida por nosotros. El escenario ideal para optimizar la tasa de acierto sería aquel en el que se pudiese tener estudio anatomopatológico in situ. En nuestro caso, el impacto de añadir el estudio anátomo patológico de manera sistemática a la decisión de aceptación del injerto podría haber incrementado un 22% los injertos trasplantados. A pesar de que el uso de la biopsia hepática al principio de la donación ahorra costes y mejora la eficiencia en la asignación de órganos32, no está disponible en todos los hospitales acreditados por la ONT como centro donante. Desafortunadamente, la ateromatosis es un hallazgo que no se corresponde con hallazgos histopatológicos que contraindiquen la viabilidad del injerto. De hecho, junto al «aspecto macroscópico» fue la causa más frecuente de confusión para nuestros cirujanos. No podemos afirmar que la ateromatosis esté relacionada con las variables independientes de NO validez del estudio multivariable.
Pensamos que disponer de esta herramienta podría ayudar a mejorar la toma de decisiones sobre la aceptación del injerto hepático. A partir de la identificación de variables independientes para la NO validez del injerto hepático, estamos desarrollando un algoritmo mediante técnicas de inteligencia artificial que nos permita predecir las posibilidades de NO validez como ya existe en el caso de injertos renales33.
ConclusiónIdentificamos 6 factores independientes para la NO validez del injerto que están recogidos del protocolo de donación de la ONT (bilirrubina total, dislipemia, ecografía hepática patológica, antecedentes médicos distintos a factores de riesgo cardiovascular, antecedentes quirúrgicos abdominales y GGT). La tasa de acierto del cirujano de TH, basada en su valoración subjetiva, es del 78%. Al emitir un juicio de NO validez debemos basarnos en hallazgos objetivos (esteatosis, cirrosis, fibrosis o mala perfusión) y evitar «aspecto macroscópico». La disponibilidad sistemática de biopsia intraoperatoria durante la donación es indispensable para optimizar la tasa de acierto.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores de este artículo declaran no tener conflictos de interés.