La pancreatitis del surco (PS) es una entidad poco frecuente que clínica y radiológicamente puede simular un carcinoma del área periampular. El objetivo de este trabajo es presentar una serie de 8 pacientes que fueron intervenidos quirúrgicamente con el diagnóstico preoperatorio de masa en cabeza pancreática, con un diagnóstico anatomopatológico definitivo de PS.
MetodosEn nuestra serie, 6 eran hombres y 2 mujeres y tenían una edad media de 51,9 años. Previamente a la cirugía, todos los pacientes presentaban dolor abdominal en epigastrio que requería analgesia a altas dosis. En la analítica preoperatoria, el CEA y el Ca 19.9 fueron normales en todos los pacientes. Los estudios de imagen mostraron lesiones sólidas intrapancreáticas en 6 de los 8 pacientes, y en los 2 restantes una masa mamelonada de 5 y 6cm, respectivamente, que estenosaba la luz duodenal. La ecoendoscopia fue negativa para células neoplásicas en todos los pacientes.
ResultadosLa evolución durante el postoperatorio inmediato fue satisfactoria, sin complicaciones. En nuestra serie, no ha fallecido ningún paciente. La evolución a largo plazo, en 7 de los 8 pacientes, ha sido excelente, con desaparición del dolor abdominal y mejoría del estado nutricional. El caso restante ha tenido frecuentes episodios de pancreatitis aguda recidivante y, a los 60 meses, ha presentado un seudoquiste que ha precisado una quistoyeyunostomía en Y de Roux.
ConclusionesLa PS debe incluirse en el diagnóstico diferencial de lesiones pancreáticas, que pueden incluir carcinoma del área periampular y otras causas de pancreatitis crónica.
Groove pancreatitis (PS) is an uncommon clinical situation and radiologically it can mimic carcinoma of the periampullary area. The aim of this paper is to study a series of 8 patients who underwent surgery with preoperative diagnosis of pancreatic head mass and subsequent pathological diagnosis of PS.
MethodsIn our series, 6 were men and 2 women, with an average age of 51,9 years. Before surgery, all patients had epigastric abdominal pain requiring analgesia at high doses. The preoperative analytical CEA and Ca 19.9 were normal in all patients. Imaging studies showed intrapancreatic solid lesions in 6 of the 8 patients, and in the remaining 2 one papillary mass of 5 and 6cm, respectively, that caused stenosis in the duodenal luz. EUS neoplastic cells were negative in all patients.
ResultsThe immediate postoperative evolution was satisfactory, there are no complications. In our series, no patients have died. The long-term follow-up, in 7 of the 8 patients, has been excellent with disappearance of abdominal pain and improvement of nutritional status. The remaining patient had frequent recurrent episodes of acute pancreatitis, and at 60 months, presented a pseudocyst that has required a Roux-en-Y cystojejunostomy.
ConclusionsPS must be included in the differential diagnosis of pancreatic lesions, which may include carcinoma of the periampullary area and other causes of chronic pancreatitis.
La pancreatitis del surco (PS) es una forma de pancreatitis crónica que se considera una lesión seudotumoral y se localiza en el área del surco, comprendida entre cabeza pancreática, duodeno y colédoco. Aunque es poco frecuente, clínica y radiológicamente puede simular un carcinoma del área periampular, de ahí la importancia de un diagnóstico correcto.
En la literatura se han descrito varios términos para denominar a la PS. La primera descripción se realizó en 1970, por Potet y Duclert1, que publicaron en 4 pacientes lo que ellos denominaron «distrofia quística del páncreas». En 1973, Becker y Bauchispeicheldruse2 utilizaron por primera vez el término PS en una serie de 117 pacientes. En 1982, Solte et al.3 incorporan el término «groove pancreatitis» para referirse a una forma especial de pancreatitis crónica caracterizada por una lámina fibrosa que se localiza en el espacio anatómico situado entre la cabeza pancreática, el duodeno y la vía biliar principal, y la describen en una serie de 30 pacientes. Posteriormente, en 1991, Becker y Mischke4 separan una forma «pura», que afecta solo al área del surco, y una forma «segmentaria», en la que, además de tejido cicatricial en el surco, hay afectación de la cabeza pancreática en su porción dorsocraneal y estenosis ocasional del conducto de Wirsung. En 2004, Adsay y Zambani5 la denominan «pancreatitis paraduodenal». Otros términos empleados han sido: quiste de pared duodenal y hamartoma de las glándulas de Brunner.
La PS aparece en la 4.ª-5.ª década de la vida y es más frecuente en varones6. La etiología es desconocida, aunque suele asociarse al alcohol, tabaco, úlcera péptica, resecciones gástricas previas, etc.6–9. Clínicamente, cursa con dolor abdominal posprandial recurrente, acompañado de náuseas y vómitos cuando predomina la afectación duodenal y, en raras ocasiones, con ictericia intermitente cuando también existe afectación del colédoco intrapancreático8–10. Los hallazgos radiológicos dependen del estadio evolutivo en que se encuentra la enfermedad11–15. En la mayoría de las ocasiones, el tratamiento es quirúrgico, ya que es difícil un diagnóstico preoperatorio preciso de la enfermedad, al poder parecer un proceso neoplásico5,7,9,16.
El objetivo de este trabajo es presentar una serie de 8 pacientes que fueron intervenidos quirúrgicamente con el diagnóstico preoperatorio de masa en cabeza pancreática que, en el estudio anatomopatológico definitivo, se confirmó que era una PS, así como realizar una revisión bibliográfica de esta entidad anatomoclínica.
MétodosDe enero de 2003 a diciembre de 2014 han sido intervenidos en nuestro hospital 8 pacientes con el diagnóstico anatomopatológico de PS. En nuestra serie, la edad media en el momento de la intervención ha sido de 51,9±8 años (rango: 39-70). De los 8 pacientes, 6 eran varones (75%) y 2 eran mujeres (25%). En la tabla 1 se refleja la clínica y los factores de riesgo que predisponían a los pacientes a desarrollar la enfermedad. Respecto al alcohol, 5 pacientes varones tenían un hábito etanólico moderado-severo de años de evolución. Las 2 mujeres de nuestra serie no eran bebedoras, pero reconocían tabaquismo importante (más de 20 cigarrillos/día). Además, una de ellas presentaba una quistoyeyunostomía en Y de Roux por un seudoquiste pancreático hacía más de 10 años.
Edad, sexo, datos clínicos y factores de riesgo de nuestra serie
| Caso | Edad | Sexo | Síntomas | Diabetes | Alcohol | Tabaco |
|---|---|---|---|---|---|---|
| 1 | 39 | H | Dolor difuso, pérdida de peso y esteatorrea | No | Sí | Sí |
| 2 | 41 | M | Dolor epigástrico y esteatorrea | No | No | Sí |
| 3 | 50 | H | Dolor epigástrico, vómitos y pérdida de peso | No | No | Sí |
| 4 | 70 | H | Dolor epigástrico, astenia | No | Sí | Sí |
| 5 | 40 | H | Dolor epigástrico, ictericia | No | Sí | Sí |
| 6 | 62 | H | Dolor en hipocondrio dcho., pérdida de peso | Sí | Sí | No |
| 7 | 55 | H | Dolor epigástrico, vómitos | No | Sí | No |
| 8 | 58 | M | Dolor epigástrico, vómitos | No | No | Sí |
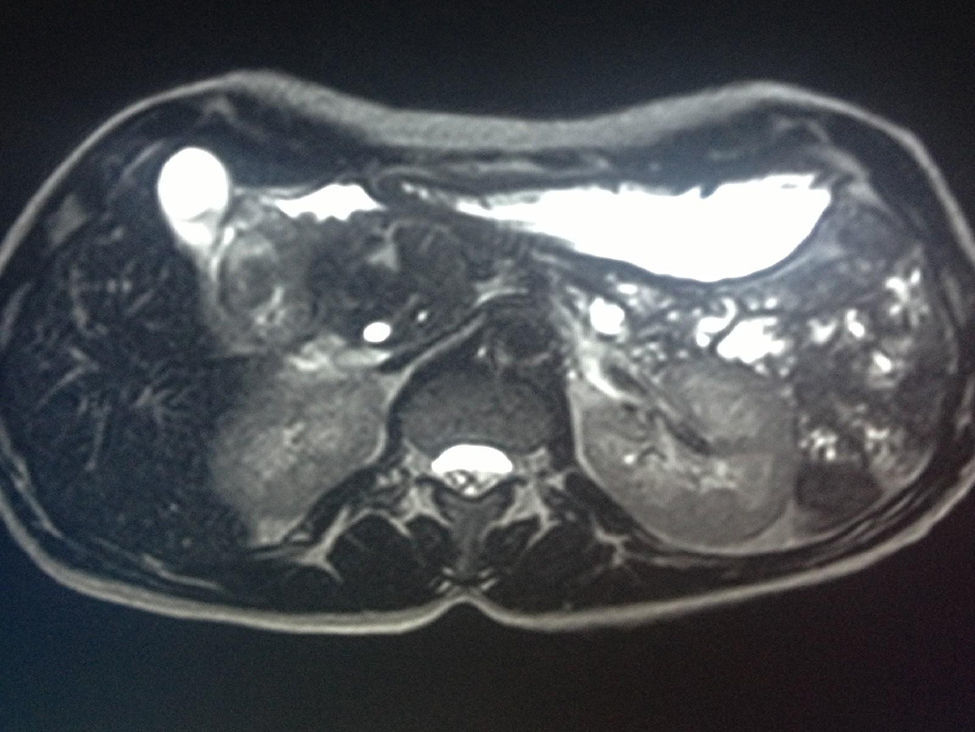
Respecto a los datos clínicos, todos los pacientes tenían dolor abdominal localizado en epigastrio y requerían analgesia a altas dosis. Dos de los 8 pacientes asociaban pérdida de peso de más de 10 kg en el último mes, uno de ellos por vómitos incoercibles y el otro por anorexia. En solo un paciente se acompañaba el dolor de ictericia progresiva, con valores de la bilirrubina directa de 15mg/dl. Los marcadores tumorales, CEA y Ca 19.9 fueron normales en todos los pacientes. Los hallazgos radiológicos en nuestra serie (TC toraco-abdominal, RMN, ecoendoscopia y PET-TAC) vienen expresados en la tabla 2 (figs. 1–3). En nuestra serie, en 4 pacientes se realizó una ecoendoscopia con PAAF: solo en un caso se objetivó un informe histológico que confirmaba el diagnóstico de PS. En ningún paciente existió presencia de células neoplásicas. En cuanto a la PET-TC, se realizó en 4 de los 8 pacientes: se observó en un caso un incremento metabólico en cabeza pancreática (SUV de 4,5) y, en los 3 casos restantes, la captación fue en la 2.ª porción duodenal (SUV de 4, 5 y 5,5, respectivamente).
Datos de las exploraciones de imagen de nuestra serie
| Caso | TAC | RMN | Ecoendoscopia | PET-TAC |
|---|---|---|---|---|
| 1 | Masa quística cefálica.Vía biliar dilatada | Dilatación del Wirsung | No | No |
| 2 | Masa mamelonada duodenal | Afilamiento colédoco distal, engrosamiento duodenal | Sí | Incremento pared duodenal. SUV: 4 |
| 3 | Pancreatitis focal.Calcificaciones | No | Sí | No |
| 4 | Masa multiquística cabeza pancreática | Masa cefálica.Dilatación del Wirsung | No | No |
| 5 | Masa en cabeza con infiltración duodenal.Vía biliar dilatada | Dilatación del colédoco | Sí | Incremento cabeza pancreática. SUV: 4,5 |
| 6 | Masa multiquística que infiltra arteria mesentérica superior | Dilatación del Wirsung.Colédoco normal | Sí | No |
| 7 | Masa duodenal, dilatación leve del Wirsung | No | No | Incremento en pared duodenal. SUV: 5 |
| 8 | Masa duodenal, dilatación gástrica | No | No | Incremento duodenal SUV: 5,5 |
En cuanto a la indicación quirúrgica, en 7 de los 8 pacientes se realizó por masa pancreática con sospecha de neoplasia. Solo un paciente (caso n.° 3) fue diagnosticado preoperatoriamente de PS. Se indicó en este la cirugía por dolor abdominal intratable de forma domiciliaria, con una pérdida de peso de 20 kg en un mes y múltiples ingresos hospitalarios. Respecto a la técnica quirúrgica, en 7 pacientes se realizó una duodenopancreatectomía cefálica (DPC) según técnica de Whipple. La paciente a la que se realizó duodenopancreatectomía total (caso n.° 8) presentaba antecedentes de cirugía pancreática previa. En concreto, una quistoyeyunostomía hacía 10 años por seudoquiste en cola pancreática y, además de la masa cefálica, durante la segunda intervención, se evidenciaron en cuerpo y cola pancreática unas nodulaciones fibróticas asociadas a una atrofia del parénquima pancreático.
ResultadosCaracterísticas anatomopatológicasDescripción macroscópicaTodos los casos presentaban similitudes anatomopatológicas. Se observó, en la sección, un importante engrosamiento de la pared duodenal en los múltiples cortes transversales realizados. El tejido pancreático de la cabeza mostró formaciones quísticas entre 0,3 y 0,5cm, inmersas en un estroma de aspecto fibroso-blanquecino, de límites imprecisos y de consistencia elástica.
Descripción microscópicaEl examen histológico mostró un engrosamiento de la submucosa duodenal, principalmente a expensas de una hiperplasia severa de las glándulas de Brunner. En la mucosa duodenal se identificó, en todos los casos, una extensa área de fibrosis caracterizada por proliferación de células fusiformes, sin atipias y dispuestas de forma desordenada, en haces irregulares, con positividad para la actina del músculo liso. En el seno de esta proliferación miofibroblástica, aparecen múltiples formaciones quísticas, así como conductos pancreáticos dilatados, sin revestimiento epitelial y secreción eosinofílica muy densa en la luz. (Aparecen islotes de tejido pancreático con inflamación crónica) (figs. 4 y 5a, b, c, d).
A) Quiste con secreción espesa situado en el plano muscular, bajo una mucosa muy gruesa con glándulas de Brunner prominentes. B) Conducto dilatado con secreción en el tejido pancreático atrófico. C) Proliferación miofibroblástica activa con eosinófilos y algunas mitosis. D) Tejido pancreático heterotópico en la pared duodenal.
La evolución durante el postoperatorio inmediato fue satisfactoria, sin ninguna complicación de interés. En nuestra serie, no ha fallecido ningún paciente.
Evolución a largo plazoEn 7 de los 8 pacientes, la evolución a largo plazo fue excelente, con desaparición del dolor abdominal y una mejoría espectacular del estado nutricional. Sin embargo, el caso n.°2 ha continuado con frecuentes crisis de dolor abdominal, a nivel de mesogastrio, asociado a distensión abdominal, lo que ha provocado una moderada desnutrición. Además, a los 60 meses tras la DPC, en los estudios radiológicos del abdomen, se ha detectado un seudoquiste de 10cm en la cola del páncreas que, al cabo, de 6 meses, ha obligado a una nueva intervención quirúrgica para realizar una quistoyeyunostomía en Y de Roux.
DiscusiónLa importancia de la PS radica en su dificultad diagnóstica y, por tanto,en discernir qué tratamiento es el más adecuado. Esto es debido a la encrucijada anatómica donde asienta, que es un espacio en el que participan la cabeza pancreática en su porción medial; lateralmente, la serosa de la segunda porción duodenal; en su borde posterior, la tercera porción del duodeno y la vena cava inferior, con la porción superior bordeada por el bulbo duodenal. Ocupan este espacio virtual el colédoco intrapancreático, el conducto de Wirsung, el conducto de Santorini y la papila. También hay que tener en cuenta la vascularización (arteria gastroduodenal y pancreatoduodenal superior), así como los ganglios linfáticos retroperitoneales y peripancreáticos10. Por tanto, la principal implicación clínica de la PS radica en la gran cantidad de procesos patológicos, tanto malignos como benignos, que pueden asentar en esta zona. El más importante de los procesos malignos es el adenocarcinoma de cabeza pancreática7,11, cuya diferenciación puede ser dificultosa preoperatoriamente, sobre todo cuando la tumoración presenta un gran componente fibrótico. Otros tumores malignos son el adenocarcinoma duodenal, el ampuloma, el colangiocarcinoma distal, los tumores neuroendocrinos pancreáticos funcionales o no funcionales, los tumores del estroma duodenal, los tumores carcinoides y el tumor papilar mucoso intraductal. Todos estos son tumores hipervasculares, cuyo diagnóstico preoperatorio es complicado. En cuanto al diagnóstico diferencial de procesos benignos, hay que realizarlo con otras causas de pancreatitis crónica (alcohol, autoinmune, hereditaria, etc.), quistes de colédoco, divertículo duodenal, etc.
La incidencia de la PS es desconocida8,9, aunque es muy rara en mujeres6. Más del 5% de las pancreatectomías realizadas con el diagnóstico preoperatorio de carcinoma son finalmente lesiones no tumorales13. La patogenia de la PS no esta bien definida6,14, aunque hay factores desencadenantes e independientes de otras causas, como el abuso en el consumo de alcohol15,16, que produce una alteración en la secreción del conducto de Santorini y un aumento de presión intraductal que facilita la formación de seudoquistes y la fuga de jugo pancreático en el área del surco17. Otros factores desencadenantes puede ser la presencia de páncreas heterotópico, las úlceras pépticas (gástricas y duodenales), las resecciones gástricas, los quistes de pared duodenal y de cabeza pancreática, etc.
Respecto al diagnóstico, los síntomas clínicos son inespecíficos, aunque, en ocasiones, hay dolor abdominal epigástrico con náuseas, vómitos y pérdida de peso, si predomina la obstrucción duodenal. Un dato que puede ayudar es la cronicidad de los síntomas, con una duración media de 3-6 meses, y la ictericia, que en el caso de la PS suele ser fluctuante18. Otro dato es la lipasa, que no suele estar elevada en la PS y que es un dato analítico diferenciador de otros tipos de pancreatitis6,13.
En cuanto al diagnóstico radiológico, va a depender del estadio evolutivo en que se encuentra la enfermedad. En la ecografía abdominal se observan pliegues duodenales prominentes, hiperecogénicos, con una capa muscular normal. En la forma segmentaria puede haber ecogenicidad heterogénea de la cabeza pancreática9,11,19. Según Wronski et al.19, un hallazgo ecográfico patognomónico es una hiperecogenicidad de la porción dorsocraneal de la cabeza pancreática con estructuras ductales anecoicas debido a la fibrosis cefálica y a la proliferación miomatosa. En la TAC, en la PS pura suele objetivarse una masa hipodensa en el surco, por el tejido fibrótico. También se pueden observar formaciones quísticas de distinto tamaño en pared duodenal medial. El conducto de Wirsung es normal. En la forma segmentaria se puede ver el conducto de Wirsung dilatado, así como la vía biliar intra- y extrahepática, con colédoco distal estenótico. No existe infiltración vascular, ni siquiera en los casos avanzados de enfermedad. Esta forma segmentaria es la que más problemas plantea de diagnóstico, al ser muy complicado diferenciarla del carcinoma pancreático11. La colangio-RMN es esencial y, para algunos autores, el mejor método diagnóstico11,12,20. El hallazgo más característico es una masa laminar hipointensa en T1 entre la cabeza pancreática y la 2.ª porción duodenal, con el resto del páncreas hiperintenso. En T2 puede ser hipo-, iso- o hiperintensa, dependiendo de la cronicidad del proceso. En fases iniciales, por el edema, es hiperintensa, mientras que cuando se ha establecido la fibrosis es hipointensa. Estos datos son similares al cáncer de páncreas si tiene componente fibrótico. En estadios avanzados, con atrofia del parénquima, se puede observar hipointensidad en la cabeza o en toda la glándula en T1, con quistes hiperintensos en T2 en el surco. Este engrosamiento de la pared duodenal y los cambios quísticos constituyen un hallazgo común en la PS, que es raro en los procesos malignos.
En lo referente al uso de la ecoendoscopia con toma de biopsia, hay escasa información de su utilidad en la PS, a pesar del creciente uso para el diagnóstico de otros procesos pancreáticos, y va a depender de la zona que se biopsia21. Se pueden observar cambios fibróticos, con hiperplasia de las células de Brunner, circunstancia que no permite descartar una neoplasia5. En nuestra serie, se realizó en 4 pacientes asociada a la PAAF y, solo en un caso, el informe histológico confirmó el diagnóstico de PS, sin que fuera concluyente en los 3 casos restantes.
Respecto a la CPRE, solo puede realizarse en aquellos pacientes que no presenten estenosis duodenal y permite la visualización del colédoco. Es difícil diferenciar una estenosis lenta y progresiva de la típica estenosis irregular de las neoplasias22.
No hay datos en la literatura de la utilidad dela PET-TAC en la PS. En nuestra serie fue realizada en 4 pacientes para hacer un estudio de extensión ante una alta sospecha de enfermedad neoplásica. En 3 de los 4 pacientes se objetivó un incremento metabólico en la pared duodenal, con un SUV máximo de 4,5 y 5,5, respectivamente. En el paciente restante, el incremento metabólico apareció en la cabeza pancreática, con un SUV máximo de 4,5. La interpretación preoperatoria de estos valores del SUV máximo es controvertida, ya que puede corresponder a una lesión benigna o maligna.
Respecto al tratamiento, al no disponer de series amplias, nos encontramos que es variable. Si se confirma el diagnóstico de PS, el manejo puede ser inicialmente conservador, con analgésicos, con nutrición enteral si no hay obstrucción duodenal y abstinencia en el consumo de alcohol y tabaco6,9,23–25. El tratamiento endoscópico consiste en el drenaje del conducto pancreático, dilatación de la estenosis y colocación de una prótesis, y se puede realizar bien en estadios iniciales de la enfermedad, antes de la instauración de la fibrosis23,bien como tratamiento «puente» a la cirugía. El inconveniente del tratamiento endoscópico es la alta tasa de recidivas y las complicaciones derivadas del procedimiento. Por tanto, la mayoría de los autores6,9,23,24 prefieren la cirugía, ya que controla mejor el dolor abdominal y provoca aumento del peso. En cuanto a la cirugía, se considera el tratamiento de elección en la PS, sobre todo si no hay control de síntomas o si hay dudas diagnósticas que indiquen malignidad23–25. Se ha demostrado que la DPC es el tratamiento definitivo de la PS, ya que mejora la sintomatología25. Las intervenciones no exeréticas tales como las derivaciones biliares o digestivas no son eficaces ya que se ha observado una alta tasa de recidivas24,26,27. En el 2009, Casetti et al.23 intervinieron a 58 pacientes, en los que realizaron DPC. En el estudio histológico de las piezas solo encontraron en un paciente un adenocarcinoma duodenal y, en otro paciente, un tumor neuroendocrino en la cabeza pancreática. En su experiencia, el 76% de los pacientes mejoraron de su dolencia. En el 2014, Egorov et al.27 publicaron una serie de 62 pacientes de los que solo 10 recibieron tratamiento médico y los 52 restantes fueron intervenidos. En 29 de los 52 pacientes se realizó una DPC y en los 23 restantes se aplicaron otras técnicas quirúrgicas derivativas. El control de los síntomas fue de un 85% en los pacientes tratados mediante DPC. En la evolución, un paciente presentó una malignización de la distrofia duodenal a los 5 años.
Respecto a nuestra serie, los 8 pacientes fueron tratados con cirugía: en 7 de ellos se realizó una DPC y en un paciente una duodenopancreatectomía total, por el antecedente de cirugía previa (quistoyeyunostomía) y por el aspecto fibrótico asociado a la presencia de nódulos en cuerpo y cola de páncreas. No hubo ninguna complicación grave y ningún caso de fallecimiento relacionado con el procedimiento quirúrgico. La sintomatología ha mejorado notablemente en 7 de los 8 pacientes (87,5%), y no hemos tenido ningún caso de malignización.
En conclusión, diferenciar la PS del ADC suele ser difícil por lo que, en la mayoría de las ocasiones, se indica la cirugía debido a la imposibilidad de un diagnóstico fiable de benignidad. Solo en los casos donde con datos clínicos y radiológicos tengamos la total seguridad de que se trata de una PS, el tratamiento es inicialmente médico, con reposo, nutrición enteral y abstinencia de alcohol y tabaco. Si con estas medidas conservadoras no hay una mejoría clínica evidente, entonces está indicada la cirugía. En este caso, la técnica quirúrgica más útil es la DPC.
Autoría/colaboradores- 1.
Diseño del estudio
- •
Francisco Sánchez Bueno y Gloria Torres Salmerón.
- •
- 2.
Adquisición y recogida de datos
- •
Francisco Sánchez Bueno, Gloria Torres Salmeron, Wilfredo Víctor Gutiérrez Zárate.
- •
- 3.
Análisis e interpretación de los resultados
- •
Francisco Sánchez Bueno, Gloria Torres Salmerón, Jesús de la Peña, Eduardo Ortiz, Matilde Fuster y María Antonia Claver.
- •
- 4.
Redacción del artículo
- •
Francisco Sánchez Bueno y Gloria Torres Salmerón.
- •
- 5.
Revisión crítica y aprobación de la versión final
- •
Francisco Sánchez Bueno y Pascual Parrilla Paricio.
- •
Declaramos que no hay conflicto de intereses en ninguno de los autores.