La duodenopancreatectomía (DPC) laparoscópica no es ampliamente aceptada y su uso es controvertido. Únicamente una correcta selección de los pacientes y un aprendizaje adecuado por grupos con experiencia en cirugía pancreática y laparoscopia podrán establecer cuál es su papel y sus hipotéticas ventajas.
MétodosDe 138 cirugías pancreáticas realizadas en un periodo de dos años (2017-2019) se realizaron 23 DPC laparoscópicas, incluyendo patología benigna y maligna. Se valora la eficacia y seguridad y se compara con 31 DPC abiertas en el mismo periodo.
ResultadosNo hubo casos de fístula pancreática B/C, biliar, ni retraso en vaciamiento gástrico en el grupo laparoscópico, pero apareció una hemorragia que obligó a una reintervención. El índice de conversión fue del 21% (cinco casos), uno por hemorragia y el resto por no progresión. Los convertidos no mostraron diferencias frente a los que se completó por laparoscopia. No existieron diferencias entre la DPC laparoscópica y abierta en tiempo quirúrgico, complicaciones postoperatorias, índice de reintervenciones, reingresos ni mortalidad. La resección R0 en los casos tumores fue del 85% por laparoscopia y del 69% en cirugía abierta sin significación estadística. La estancia postoperatoria fue inferior en el grupo DPC laparoscópica, ocho vs. 15 días.
ConclusionesEn un grupo seleccionado, la DPC laparoscópica puede realizarse de forma segura y eficaz si se realiza por grupos expertos en cirugía pancreática y en laparoscopia avanzada. Obtiene los mismos resultados que la cirugía abierta en el postoperatorio y es oncológicamente adecuada con menor estancia hospitalaria. Una selección adecuada de los pacientes, un programa establecido por pasos con una conversión laxa y precoz evita accidentes operatorios graves.
Laparoscopic pancreaticoduodenectomy (PD) is not widely accepted, and its use is controversial. Only correct patient selection and appropriate training of groups experienced in pancreatic surgery and laparoscopy will be able to establish its role and its hypothetical advantages
MethodsOut of 138 pancreatic surgeries performed in a two-year period (2017-2019), 23 were laparoscopic PD. We evaluate its efficacy and safety compared to 31 open PD.
ResultsThere were no cases of B/C pancreatic or biliary fistula, nor any cases of delayed gastric emptying in the laparoscopic group, but hemorrhage required one reoperation. The conversion rate was 21% (five cases): one due to bleeding, and the remainder for non-progression. The converted patients showed no differences compared to those completed by laparoscopy. There were no differences between laparoscopic and open PD in surgical time, postoperative complications, reintervention rate, readmissions or mortality. R0 resection in tumor cases was 85% for laparoscopy and 69% in open surgery without statistical significance. The postoperative hospital stay was shorter in the laparoscopic PD group (eight vs. 15 days).
ConclusionsIn a selected group, laparoscopic PD can be safely and effectively performed if carried out by groups who are experts in pancreatic surgery and advanced laparoscopy. The technique has the same postoperative results as open surgery and is oncologically adequate, with less hospital stay. Proper patient selection, a step-by-step program and a lax and early conversion prevents serious operating accidents.
La cirugía mínimamente invasiva, tanto laparoscópica como robótica, se ha extendido a lo largo de las últimas décadas en la mayoría de los campos de la cirugía1-3. En general ha demostrado su eficacia, mejorando la evolución y recuperación postoperatoria y manteniendo los resultados oncológicos conseguidos en la cirugía abierta.
Como era previsible, la cirugía pancreática ha seguido los mismos pasos. Debido a su idiosincrasia, dificultad técnica alta y posibles accidentes hemorrágicos, su aplicación ha sido dispar. Han existido dos velocidades de incorporación dependiendo de la localización de la lesión. Así, mientras la resección del cuerpo y cola del páncreas ha sido amplia y rápida, la DPC laparoscópica quedó abandonada de forma general y, hoy en día, solo se realiza por grupos reducidos4-6 después de la primera DPC laparoscópica practicada por Gagner y Pomp7 en 1994. Por ello, persisten dudas de cuál es el papel de la DPC laparoscópica y los resultados publicados hasta el momento resultan controvertidos8,9.
Estudios de cohortes sugieren que realizada por cirujanos experimentados y en centros con un elevado volumen, son seguras y mantienen los beneficios de la cirugía mínimamente invasiva10,11. Un metaanálisis demuestra menos pérdidas hemáticas y menor retraso en el vaciado gástrico junto con una disminución de la estancia media hospitalaria. Como contrapartida, existe un aumento significativo en los tiempos quirúrgicos11. Sin embargo, un reciente ensayo clínico multicéntrico, prospectivo y aleatorizado muestra un mayor número de complicaciones y de la mortalidad relacionada con la técnica laparoscópica12. En la actualidad persiste la incógnita sobre la conveniencia de utilizar estas técnicas de forma generalizada, tal y como se recogen en la reunión de consenso de Miami13.
Estas discrepancias sitúan la DPC laparoscópica como una técnica en desarrollo y estudio que requiere de nuevos trabajos para establecer cuál es su papel en cuanto a indicaciones, formación, seguridad y eficacia.
En este estudio se comparan los resultados a corto plazo de la DPC laparoscópica en un grupo seleccionado de pacientes con la DPC abierta, realizadas en el mismo período de tiempo por el mismo grupo quirúrgico, con el objetivo de valorar su viabilidad y seguridad en el postoperatorio inmediato.
Material y métodosDiseñoSe ha realizado un estudio prospectivo, no aleatorizado, en dos hospitales de tercer nivel del área metropolitana de Barcelona (Hospital Universitari Germans Trias i Pujol y Hospital Universitari Mútua de Terrassa), con una población de referencia conjunta de 1.200.000 habitantes, en el que se han analizado los resultados de las DPC laparoscópicas y se han comparado con los obtenidos en cirugía abierta durante el mismo período.
Criterios de inclusión y exclusiónSe han incluido todos los pacientes sometidos a una DPC electiva, indistintamente de la etiología benigna o maligna. Los criterios de exclusión han sido los pacientes que recibieron un tratamiento neoadyuvante, debido a la dificultad añadida que representa y a la posibilidad de requerir resecciones vasculares complejas, y aquellos en los que se realizó la resección por robot, entendiéndose como una técnica quirúrgica diferente.
Población de estudioDesde octubre de 2017 a diciembre de 2019 se realizaron 138 cirugías pancreáticas, de las cuales 98 fueron DPC. Se analizaron 54 casos que cumplían los criterios de inclusión, 23 sometidos a cirugía laparoscópica y 31 a cirugía abierta. En todos los casos se han seguido un protocolo de fast-track con una reintroducción precoz, en las primeras 24 h, de la dieta enteral.
Técnica quirúrgicaDuodenopancreatectomía laparoscópicaEl paciente se coloca en decúbito supino, con piernas abiertas, sobre un colchón de vacío. Se realiza el neumoperitoneo con aguja de Veress y se colocan cinco trócares de 12 mm en forma semicircular (supraumbilical, paraumbilical derecho e izquierdo y flancos derecho e izquierdo) y un sexto subxifoideo de 5 mm.
Se secciona el epiplon mayor y menor para proceder a la sección del antro gástrico mediante endograpadora. Se identifica la arteria hepática común que se sigue hasta la arteria gastroduodenal y la arteria pilórica que se seccionan entre Hem-o-lok®. Se diseca el hilio hepático y se realiza la linfadenectomía de la zona. Se identifica la vena mesentérica superior en el margen inferior pancreático y se diseca hasta la vena porta. Posteriormente se realiza una maniobra de Kocher amplia y se secciona la primera asa yeyunal mediante endograpadora para el descruzamiento duodenal. La transección pancreática se realiza mediante el bisturí monopolar. Se secciona el mesopáncreas mediante pinza bipolar hasta movilizar completamente el proceso uncinado y la cabeza pancreática de la vena mesentérica superior/porta. Finalmente se realiza la colecistectomía y se secciona la vía biliar principal, colocando la pieza quirúrgica en una bolsa de extracción.
La reconstrucción se realiza mediante asa única, en primer lugar, la pancreaticoyeyunostomía terminolateral con dos suturas barbadas continuas de 3/0 (Stratafix®), y una sutura ductomucosa con puntos sueltos de PDS 5/0 sobre un tutor abandonado de 6-8Fr. En casos en los que no se identifica el conducto de Wirsung se procede a realizar una pancreatogastrostomía. A unos 20 cm, en la misma asa yeyunal, se realiza la hepaticoyeyunostomía terminolateral con sutura continua barbada 3/0 (Stratafix®) salvo si la vía era fina, en cuyo caso se realiza con puntos sueltos de PDS 4/0. Finalmente, se realiza la anastomosis gastroentérica antecólica con endograpadora de 60 mm, cerrando el defecto con una continua de sutura barbada 2/0 (Stratafix®).
Se colocan dos drenajes, el derecho posterior a la hepaticoyeyunostomía y el izquierdo posterior a la gastroenteroanastomosis con extremo adyacente a la pancreaticoyeyunostomía.
Se realiza una incisión de Pfannenstiel para la extracción de la pieza que se cierra por planos con continuas de PDS 2/0.
Duodenopancreatectomía abiertaLa técnica abierta resulta muy similar a la laparoscópica, aunque ésta fue variando a lo largo del tiempo gracias a los avances que hacíamos con la técnica laparoscópica. El acceso se realiza mediante laparotomía subcostal y se sigue una secuencia de pasos igual que en cirugía laparoscópica. Se mantiene la reconstrucción sobre asa única y el tipo de anastomosis pancreática. La hepaticoyeyusotomía, que inicialmente se realizaba con puntos sueltos de PDS 4/0, pasó a realizarse siguiendo el mismo esquema que en la cirugía laparoscópica. Del mismo modo, la anastomosis gastroyeyunal, habitualmente realizada con puntos sueltos de Novosyn® 3/0, pasó a realizarse con endograpadora y Stratafix®. Finalmente, la laparotomía subcostal se cierra por planos con continuas de PDS 2/0.
Variables principalesLas variables principales estudiadas han sido: tiempo quirúrgico, estancia hospitalaria, tasa de conversión, morbilidad medida mediante la escala de Dindo-Clavien14 y la mortalidad asociada a los 90 días.
Por conversión se entiende cualquier incisión accesoria del grupo laparoscópico que no sea la propia de los trócares o el de la extracción de la pieza quirúrgica.
Se ha considerado laparoscopia asistida programada cuando se realizó la resección de forma laparoscópica y las anastomosis con una incisión subcostal derecha (15 cm).
Variables secundariasSe han considerado variables secundarias la fístula pancreática, la fístula biliar, la hemorragia postoperatoria, el retraso en el vaciamiento gástrico, el estado del margen de resección, el número de ganglios obtenidos y la tasa de reingresos a los 30 días.
Las fístulas pancreáticas, las hemorragias postoperatorias y el retraso del vaciamiento gástrico se han clasificado siguiendo las definiciones establecidas por el International Study Group of Pancreatic Surgery (ISGPS)15-17. Las fístulas biliares se han clasificado siguiendo las definiciones del International Study Group of Liver Surgery18.
En relación con el margen de resección, se ha considerado R0 si existía una distancia con el margen tumoral > 1 mm, R1 si la distancia con el margen tumoral era < 1 mm y R2 si existía tumor macroscópico en el margen de resección19.
Análisis estadísticoEl análisis estadístico se ha realizado siguiendo un análisis por intención de tratar mediante el software SPSS® (versión 24). La distribución de la normalidad se ha estudiado mediante el test de Kolmogórov-Smirnov y las diferentes variables mediante los test U de Mann-Whitney y Chi-Cuadrado. Las variables cuantitativas se expresan en media y rango y las cualitativas en número y porcentaje. Se han considerado diferencias estadísticamente significativas los valores de p < 0,05.
ResultadosEn el periodo establecido se han intervenido 98 DPC, de las cuales 54 cumplen con los criterios de inclusión y exclusión descritos. Estas 54 intervenciones se distribuyen en 31 DPC abiertas y 23 DPC laparoscópicas, incluyendo en este grupo tres procedimientos únicamente asistidos por laparoscopia.
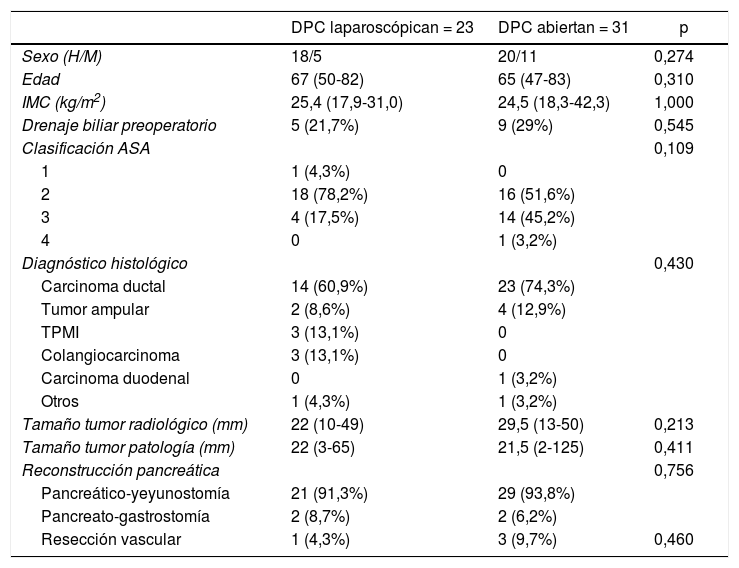
Características de los pacientesA pesar de haberse realizado una selección de los pacientes más adecuados para cirugía laparoscópica, no se han encontrado diferencias significativas entre las características de los grupos. No existen diferencias en la distribución de sexos, edad, índice de masa corporal, clasificación de la American Society of Anesthesiologists (ASA), drenaje biliar preoperatorio, tamaño tumoral, diagnóstico histológico, tipo de reconstrucción pancreática o necesidad de resección vascular (tabla 1). Cabe destacar que la necesidad de resección vascular se valoró de forma intraoperatoria, tratándose en el caso laparoscópico de una resección lateral parcial con endograpadora y las resecciones en cirugía abierta completas anastomosis termino-terminal.
Características basales y variables demográficas de la muestra
| DPC laparoscópican = 23 | DPC abiertan = 31 | p | |
|---|---|---|---|
| Sexo (H/M) | 18/5 | 20/11 | 0,274 |
| Edad | 67 (50-82) | 65 (47-83) | 0,310 |
| IMC (kg/m2) | 25,4 (17,9-31,0) | 24,5 (18,3-42,3) | 1,000 |
| Drenaje biliar preoperatorio | 5 (21,7%) | 9 (29%) | 0,545 |
| Clasificación ASA | 0,109 | ||
| 1 | 1 (4,3%) | 0 | |
| 2 | 18 (78,2%) | 16 (51,6%) | |
| 3 | 4 (17,5%) | 14 (45,2%) | |
| 4 | 0 | 1 (3,2%) | |
| Diagnóstico histológico | 0,430 | ||
| Carcinoma ductal | 14 (60,9%) | 23 (74,3%) | |
| Tumor ampular | 2 (8,6%) | 4 (12,9%) | |
| TPMI | 3 (13,1%) | 0 | |
| Colangiocarcinoma | 3 (13,1%) | 0 | |
| Carcinoma duodenal | 0 | 1 (3,2%) | |
| Otros | 1 (4,3%) | 1 (3,2%) | |
| Tamaño tumor radiológico (mm) | 22 (10-49) | 29,5 (13-50) | 0,213 |
| Tamaño tumor patología (mm) | 22 (3-65) | 21,5 (2-125) | 0,411 |
| Reconstrucción pancreática | 0,756 | ||
| Pancreático-yeyunostomía | 21 (91,3%) | 29 (93,8%) | |
| Pancreato-gastrostomía | 2 (8,7%) | 2 (6,2%) | |
| Resección vascular | 1 (4,3%) | 3 (9,7%) | 0,460 |
ASA: American Society of Anesthesiologists; DPC: duodenopancreatectomía cefálica; H/M: hombres/mujeres; IMC: índice de masa corporal; TPMI: tumor papilar mucinoso intarductal.
Entre paréntesis, rango intercuartil y porcentajes.
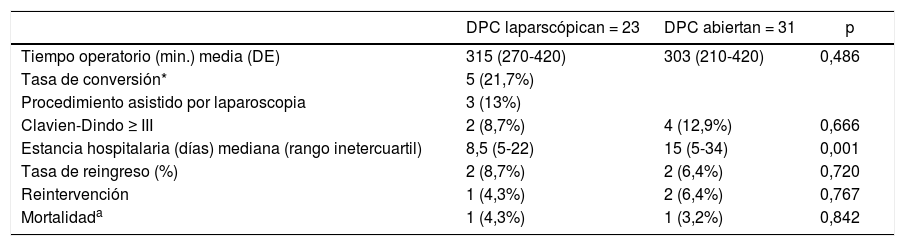
Se han identificado diferencias significativas en la estancia hospitalaria. En el grupo de cirugía laparoscópica la media ha sido de 8,5 días (5-22) en comparación con 15 días (5-34) en el grupo de cirugía abierta (p = 0,001).
No se han obtenido diferencias significativas en el tiempo operatorio, 315 (270-420) y 303 (210-420) minutos respectivamente (p = 0,486); tampoco en las complicaciones mayores, dos (8,7%) y cuatro casos (12,9%) (p = 0,666); ni en la mortalidad, un caso en cada grupo, 4,3 y 3,2%, respectivamente (p = 0,842) (tabla 2).
Resultados de las variables principales
| DPC laparscópican = 23 | DPC abiertan = 31 | p | |
|---|---|---|---|
| Tiempo operatorio (min.) media (DE) | 315 (270-420) | 303 (210-420) | 0,486 |
| Tasa de conversión* | 5 (21,7%) | ||
| Procedimiento asistido por laparoscopia | 3 (13%) | ||
| Clavien-Dindo ≥ III | 2 (8,7%) | 4 (12,9%) | 0,666 |
| Estancia hospitalaria (días) mediana (rango inetercuartil) | 8,5 (5-22) | 15 (5-34) | 0,001 |
| Tasa de reingreso (%) | 2 (8,7%) | 2 (6,4%) | 0,720 |
| Reintervención | 1 (4,3%) | 2 (6,4%) | 0,767 |
| Mortalidada | 1 (4,3%) | 1 (3,2%) | 0,842 |
DE: desviación estándar; DPC: duodenopancreatectomía cefálica
Entre paréntesis, rango intercuartil y porcentajes.
Se han convertido cinco de los 23 casos de cirugía laparoscópica, que corresponde a una tasa de conversión del 21,7%. Solamente uno fue por una complicación, una hemorragia crítica a nivel de la vena porta, mientras que en los otros cuatro casos se convirtió por falta de progresión, entendiéndose como la imposibilidad de avanzar en la técnica quirúrgica durante más de 20 minutos. Otros tres pacientes (13%) fueron planteados de forma preoperatoria como procedimientos asistidos, sin que se presentaran complicaciones hasta el momento de la asistencia.
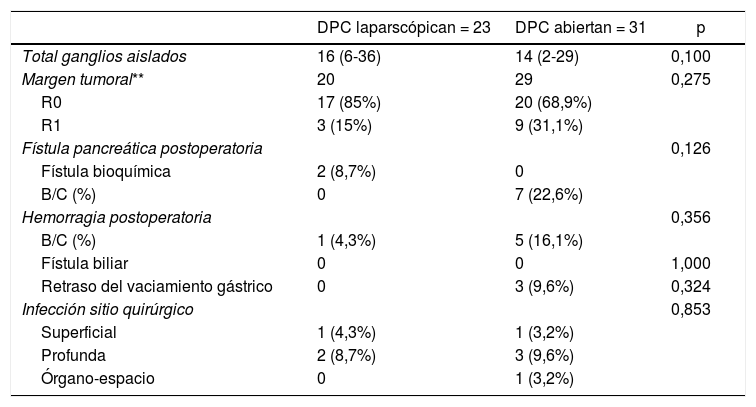
Variables secundariasNo han existido diferencias estadísticamente significativas en el índice de fístula pancreática grado B/C; ningún caso en el grupo laparoscópico y siete (22,6%) en el grupo abierto (p = 0,126). En el grupo laparoscópico dos casos (8,7%) presentaron fístula bioquímica.
No existieron diferencias en los apartados: fístula biliar, ningún paciente en ambos grupos, hemorragia postoperatoria, un caso (4,3%) en DPC laparoscópica y cinco (16,1%) en DPC abierta (p = 0,356), retraso del vaciamiento gástrico, ninguno y tres (9,6%), respectivamente (p = 0,324), ni en infección quirúrgica (p = 0,853). Reingresaron dos casos en ambos grupos, 8,7 y 6,4%, respectivamente (p = 0,720). En el grupo de cirugía abierta un reingreso fue por hemorragia requiriendo de un DIVAS urgente y el otro debido a una fístula pancreática grado C, con hemorragia asociada, que requirió de reintervención. En el grupo laparoscópico ambos reingresos fueron por infección profunda del sitio quirúrgico, presentando exudado purulento por la herida quirúrgica y requiriendo de drenaje. En relación con las reintervenciones fue un caso en el grupo laparoscópico, debido a una hemorragia, y dos casos el grupo abierto (4,3 vs. 6,4%, p = 0,767), uno por hemorragia y el otro por fístula grado C asociado a hemorragia (tabla 2).
En el grupo de pacientes neoplásicos (n = 49), no se han identificado diferencias significativas en la tasa de R0, 17 de los 20 casos (85%) en DPC laparoscópica y 20 de los 29 casos (68,9%) en DPC abierta (p = 0,075), ni en número de ganglios obtenidos 16 (6-36) y 14 (2-29) respectivamente (p = 0,100) (tabla 3).
Resultados de las variables secundarias
| DPC laparscópican = 23 | DPC abiertan = 31 | p | |
|---|---|---|---|
| Total ganglios aislados | 16 (6-36) | 14 (2-29) | 0,100 |
| Margen tumoral** | 20 | 29 | 0,275 |
| R0 | 17 (85%) | 20 (68,9%) | |
| R1 | 3 (15%) | 9 (31,1%) | |
| Fístula pancreática postoperatoria | 0,126 | ||
| Fístula bioquímica | 2 (8,7%) | 0 | |
| B/C (%) | 0 | 7 (22,6%) | |
| Hemorragia postoperatoria | 0,356 | ||
| B/C (%) | 1 (4,3%) | 5 (16,1%) | |
| Fístula biliar | 0 | 0 | 1,000 |
| Retraso del vaciamiento gástrico | 0 | 3 (9,6%) | 0,324 |
| Infección sitio quirúrgico | 0,853 | ||
| Superficial | 1 (4,3%) | 1 (3,2%) | |
| Profunda | 2 (8,7%) | 3 (9,6%) | |
| Órgano-espacio | 0 | 1 (3,2%) | |
DPC: duodenopancreatectomía cefálica.
Entre paréntesis, rango intercuartil y porcentajes.
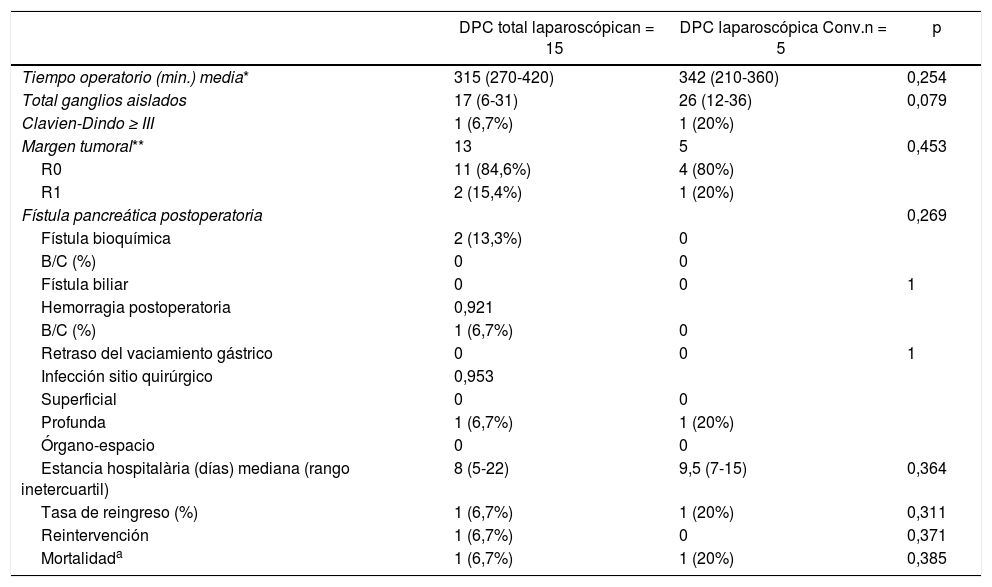
Analizados por separado aquellos en que se completó la DPC por laparoscopia de aquellos que fueron convertidos, no se observaron diferencias en las diferentes variables analizadas, destacando una estancia hospitalaria muy similar, 8 (5-22) y 8,5 (7-19) días, respectivamente (tabla 4).
Análisis comparativo entre abordaje laparoscópico y conversión
| DPC total laparoscópican = 15 | DPC laparoscópica Conv.n = 5 | p | |
|---|---|---|---|
| Tiempo operatorio (min.) media* | 315 (270-420) | 342 (210-360) | 0,254 |
| Total ganglios aislados | 17 (6-31) | 26 (12-36) | 0,079 |
| Clavien-Dindo ≥ III | 1 (6,7%) | 1 (20%) | |
| Margen tumoral** | 13 | 5 | 0,453 |
| R0 | 11 (84,6%) | 4 (80%) | |
| R1 | 2 (15,4%) | 1 (20%) | |
| Fístula pancreática postoperatoria | 0,269 | ||
| Fístula bioquímica | 2 (13,3%) | 0 | |
| B/C (%) | 0 | 0 | |
| Fístula biliar | 0 | 0 | 1 |
| Hemorragia postoperatoria | 0,921 | ||
| B/C (%) | 1 (6,7%) | 0 | |
| Retraso del vaciamiento gástrico | 0 | 0 | 1 |
| Infección sitio quirúrgico | 0,953 | ||
| Superficial | 0 | 0 | |
| Profunda | 1 (6,7%) | 1 (20%) | |
| Órgano-espacio | 0 | 0 | |
| Estancia hospitalària (días) mediana (rango inetercuartil) | 8 (5-22) | 9,5 (7-15) | 0,364 |
| Tasa de reingreso (%) | 1 (6,7%) | 1 (20%) | 0,311 |
| Reintervención | 1 (6,7%) | 0 | 0,371 |
| Mortalidada | 1 (6,7%) | 1 (20%) | 0,385 |
Conv.: conversión; DPC: duodenopancreatectomía cefálica.
Entre paréntesis (rango intercuartil y porcentajes).
Si bien el desarrollo de la cirugía mínimamente invasiva en cirugía general ha sido desigual podríamos decir que la incorporación de la cirugía pancreática es reciente, lenta y sin una amplia difusión.
Es evidente que en los últimos años la pancreatectomía corporocaudal laparoscópica se ha generalizado y se ha aceptado. Sin embargo, la DPC laparoscópica se utiliza de forma puntual debido, por un lado, a que la agresión de la resección es importante e independiente de la vía de abordaje y, por otro, a la proximidad de grandes vasos con posibles hemorragias difíciles de controlar.
Muchos grupos quirúrgicos no la incorporan en su práctica diaria, su aprendizaje es difícil, con tiempos quirúrgicos largos y con supuestamente problemas intraoperatorios graves que cuestionan su aplicación. En estas condiciones es difícil asegurar cuál va a ser su futuro12.
Estudios previos, han mostrado resultados controvertidos en términos de seguridad y eficacia20,21 pero, en la mayoría, los buenos resultados dependerán del volumen de DPC realizadas en el centro, tanto abiertas como laparoscópicas, situando el corte en un número de procedimientos mayor a 20 por año13,22. En nuestro caso, la ventaja de la colaboración de dos centros de referencia en cirugía pancreática con los mismos criterios, mismos protocolos y que comparten grupo quirúrgico permite obtener una serie amplia de más de 50 casos de DPC en poco más de 24 meses.
Esta serie demuestra que es posible realizar la DPC laparoscópica con una seguridad similar a la cirugía abierta. Mantiene los criterios de una cirugía oncológica adecuada y conserva los beneficios de la cirugía mínimamente invasiva con una menor estancia postoperatoria.
Creemos que estos resultados se deben, en parte, a que el grupo quirúrgico tiene amplia experiencia en cirugía pancreática abierta y en cirugía laparoscópica avanzada, así como al desarrollo de la técnica por fases. Antes de iniciar el programa de DPC laparoscópica, como curva de aprendizaje, se habían realizado la mayoría de los pasos de forma parcial y progresiva en varios pacientes. Además, una vez iniciado el programa, aquellos primeros pacientes que se previeron complejos, se programaron para DPC asistida por laparoscopia, donde la reconstrucción se realizó abierta.
Por otro lado, una política de conversión precoz y flexible si no se avanza de forma adecuada antes de que aparezca una complicación, nos parece fundamental. En nuestro trabajo, solo un caso se convirtió por una complicación hemorrágica por lesión de la vena mesentérica que se resolvió sin problemas, debido a la experiencia en cirugía abierta, mientras que en los otros casos el motivo fue la falta de progresión con conversión no urgente.
Siguiendo esta estrategia y con una estandarización clara, los tiempos quirúrgicos no muestran diferencias significativas y se mantiene en unas cinco horas que nos parecen adecuadas, estando muy por debajo de las 10 horas descritas en algunas series y que consideramos demasiado largas tanto para el paciente como para el equipo quirúrgico23.
La fase reconstructiva es la que penaliza el tiempo quirúrgico. La utilización de suturas barbadas y amplia experiencia en sutura laparoscópica acorta mucho el tiempo. En series robóticas se cita como una ventaja la facilidad en el procedimiento de anastomosis y suturas, queda por saber el papel en el futuro de la cirugía con robot24-26.
La técnica quirúrgica en los dos grupos está bien establecida y es similar, en cirugía abierta se ha utilizado la sutura barbada continua en la pancreaticoyeyunostomía que habíamos diseñado para la cirugía laparoscópica y que se ha utilizado en los dos grupos.
Somos conscientes que es un estudio prospectivo no randomizado en el que la comparación no es estricta y los casos en los que se realizó por laparoscopia fueron seleccionados y posiblemente más fáciles. Sin embargo, comparando los datos demográficos, antecedentes y tamaño del tumor, no se han demostrado diferencias significativas. Incluso así, creemos que es imprescindible seleccionar solo aquellos casos que se consideren favorables para cirugía laparoscópica. Hemos descartado los casos borderline resecables que recibieron tratamiento neoadyuvante al considerarlos, a priori, más complejos.
Estudios comparativos entre la DPC laparoscópica y la cirugía abierta, muestran una tasa de conversión en el grupo laparoscópico entre el 0 y el 23%24,25,27. Nuestra serie se sitúa en el margen superior que creemos es debido a nuestra política de conversión precoz ante la no progresión, mientras que los tiempos quirúrgicos son algo inferiores al margen inferior debido en parte al mismo planteamiento.
No hemos encontrado diferencias en las complicaciones generales de los grupos utilizando la clasificación de Dindo-Clavien, pero tampoco si las dividimos por las específicas de este tipo de cirugía como es la fístula pancreática, fístula biliar, retraso de vaciamiento gástrico y hemorragia. Valorando los números absolutos existe una tendencia a ser menores en el grupo laparoscópico, hecho que debería confirmarse si se amplía la serie y se mantiene esta tendencia.
Al igual que en el presente estudio, otras series comparativas no muestran diferencias en las pérdidas hemáticas. Ocurre un hecho similar cuando se analizan las complicaciones específicas pancreáticas22,24. La tasa de reintervención varía del tres al 24% para el grupo laparoscópico y entre dos y el 11% para la DPC abierta, situándose en nuestra serie en el margen inferior21,25. En todas las publicaciones la mortalidad fue ligeramente mayor en el grupo laparoscópico21, un caso (4,3%) en nuestra serie, sin diferencias con el grupo por laparotomía y asumible para este procedimiento.
Existen tres estudios randomizados realizados hasta la fecha, PLOT, PADULAP y LEOPARD-2, los dos primeros muestran un beneficio de la cirugía mínimamente invasiva. Sin embargo, la preocupación surgió tras el ensayo LEOPARD-2 en el que existe una importante diferencia en la mortalidad a 90 días (10% en el grupo DPC laparoscópica vs. 2% en la DPC abierta) hecho que provocó el cierre prematuro del estudio12,26,28.
En contrapartida, hay que destacar dos estudios unicéntricos de grupos con amplia experiencia en DPC laparoscópica. El primero del grupo holandés, que utiliza tanto técnica laparoscópica, robótica como híbrida, y donde los resultados muestran un mayor tiempo operatorio, menor pérdida hemática y menor estancia hospitalaria en la cirugía mínimamente invasiva24. El segundo un estudio de la Mayo Clínic de Rochester, con 113 casos laparoscópicos vs. 225 abiertos donde los tiempos operatorios son muy similares entre ambos grupos, en torno a 360 minutos y con una tasa de conversión del 4% y una mortalidad del 1%25. Dichos resultados son parecidos en cuanto a tiempo quirúrgico con nuestra serie, con menor conversión y mortalidad y van en contra del estudio LEOPARD-212.
En los pacientes oncológicos la resección por laparoscopia ha demostrado que consigue una tasa de resección R0 muy alta, asociada con una amplia exéresis de los ganglios con una media que se sitúa en 16 ganglios, similar a la obtenida en cirugía abierta de 14, y que puede considerarse óptima. Estos resultados confirman que la resección en bloque planteada por los planos vasculares adecuados es posible y factible. Debe tenerse en cuenta que los pacientes son seleccionados y a priori factibles, pero incluso así, en un caso necesitamos realizar una resección venosa para asegurar la resección R0.
No sabemos cuál es la evolución de aquellos pacientes que se inician por laparoscopia y deben convertirse; existen discrepancias en un posible efecto nocivo de esta conversión que puede ir más allá de indicar dificultades29. Sabemos que la necesidad de una conversión rápida con pasos no deseados puede empeorar una situación difícil y deberíamos huir de esta secuencia. En nuestra serie, la evolución de los pacientes convertidos ha sido similar a aquellos en quienes se completó el procedimiento por laparoscopia. Es un hecho más que reafirma nuestra conducta de conversión ante no progresión. Es fundamental para nosotros no modificar y empeorar la historia natural de una cirugía agresiva como es la DPC.
El papel actual de la cirugía en el paciente con una neoplasia de cabeza de páncreas es realizar una resección estandarizada R0 con mínima morbimortalidad, manteniendo el estado físico y nutricional, conseguir una recuperación rápida para que pueda someterse a un tratamiento adyuvante eficaz30. Con este planteamiento la DPC abierta está bien establecida y su desarrollo ha llegado al límite, queda por demostrar si el abordaje laparoscópico con los mismos criterios oncológicos tiene las ventajas propias de la cirugía mínimamente invasiva y será beneficioso en el futuro.
Nuestro estudio presenta la limitación de ser un estudio retrospectivo, con pacientes seleccionados, no aleatorizado y con n todavía reducida. Por ello, se requieren nuevos estudios para esclarecer en los próximos años; en qué situaciones puede realizarse con seguridad, si es factible, cuáles son sus resultados y si son comparables con la cirugía abierta; si es eficaz y quién podrá realizarla; si es reproducible, resulta un reto interesante. Conseguir un número suficiente de pacientes con la colaboración de diferentes unidades y cirujanos implicados debe permitir responder a estas preguntas.
ConclusionesEn un grupo seleccionado de pacientes, la DPC por laparoscopia es segura y eficaz si se realiza por expertos en cirugía pancreática y laparoscopia avanzada. Un programa establecido por pasos, con una selección adecuada de los pacientes y una conversión laxa y precoz evita accidentes operatorios.
En comparación con la cirugía abierta obtiene los mismos resultados en el postoperatorio inicial y es oncológicamente adecuada en los casos tumorales con menor estancia hospitalaria.
Se sugiere, que el aumento de casos y experiencia puede hacer que la tendencia a una menor tasa de complicaciones postoperatorias sea significativa. Sin embargo, se requieren estudios multicéntricos y prospectivos para confirmarlo.