Determinar los niveles séricos de lípidos, lipoproteínas y otros marcadores relacionados con la nefropatía y la enfermedad vascular periférica en una población de pacientes con diabetes tipo 2 estratificados según su nivel de afectación renal.
MétodosEstudio transversal en 72 pacientes diabéticos tipo 2 en seguimiento en consultas externas. Los pacientes fueron divididos en 4 grupos en función de su índice de filtración glomerular estimado (eGFR, ml/min) y cociente albúmina/creatinina (ACR, mg/g) (eGFR>60 y ACR<30 [n=23], eGFR>60 y ACR>30 [n=12], eGRF30-60 [n=23] y eGFR<30 [n=14]). En todos ellos se recogieron variables clínicas y antropométricas y se cuantificaron los niveles séricos en ayunas de lípidos y apolipoproteínas, así como parámetros de función renal y hematimétricos. Se realizó un estudio de regresión logística por pasos hacia delante para determinar variables asociadas independientemente a la presencia de disfunción renal.
ResultadosEn el análisis univariante encontramos que a mayor deterioro de la función renal mayor prevalencia de hipertensión, hábito de fumar y triglicéridos y menores de hemoglobina (p<0,05). En el estudio multivariante solo los niveles de triglicéridos (OR: 1,019, IC 95%: 1,004-1,034) y hemoglobina (OR: 0,516, IC 95%: 0,292-0,914) se asociaron independientemente (p<0,05) a la presencia de disfunción renal (eGFR<60ml/min). La introducción de la enfermedad arterial periférica en el modelo de regresión no modificó estas asociaciones.
ConclusiónNuestros resultados confirman la relación entre triglicéridos y nefropatía diabética, independientemente de la presencia de enfermedad arterial periférica.
To determine lipid serum levels, lipoproteins and other markers related to nephropathy and peripheral arterial disease (PAD) in a type 2 diabetes population stratified according to their level of renal dysfunction.
MethodsA cross-sectional study was conducted on 72 type 2 diabetic patients followed-up in outpatient clinics. Patients were divided into 4 groups according to their estimated glomerular filtration rate (eGFR, mL/min) and albumin/creatinine ratio (ACR, mg/g) (eGFR>60 and ACR<30 [n=23], eGFR>60 and ACR>30 [n=12], eGFR30-60 [n=23] and eGFR<30 [n=14]). Clinical and anthropometric characteristic of all patients were recorded. Fasting lipids and apolipoproteins, as well as renal and hematology parameters were measured. Finally, a multivariate Wald stepwise logistic regression statistic analysis was performed to determine variables independently associated with the presence of renal dysfunction.
ResultsThe univariate statistical analysis showed that the higher renal dysfunction, the higher the prevalence of hypertension, smoking habit and triglycerides levels, and the lower hemoglobin levels (P<.05). The multivariate statistical analysis showed that only triglycerides levels (OR: 1.019, 95% CI: 1.004-1.034) and hemoglobin levels (OR: 0.516 95% CI: 0.292-0.914) were independently associated to the presence of renal dysfunction (eGFR<60mL/min.). The further inclusion of the presence of PAD in the statistical model did not modify those associations.
ConclusionThe results confirm the relationship between triglycerides levels and diabetic nephropathy, independently of the presence of PAD.
La insuficiencia renal crónica (IRC), definida por una tasa de filtrado glomerular estimada (eGFR) <60ml/min, es un factor de riesgo independiente de muerte y morbilidad cardiovascular, como se ha demostrado en varios metaanálisis1,2. En estudios poblacionales se ha demostrado igualmente que la IRC es un equivalente de enfermedad coronaria arteriosclerótica, más aún que la propia diabetes tipo 23. Las recientes guías de práctica clínica europeas reconocen los sujetos con eGFR<60ml/min como de alto riesgo y los de <30ml/min como de muy alto riesgo4. Además, la prevalencia de IRC en nuestra población no es despreciable; el estudio EPIRCE indica una frecuencia del 6,8% en sujetos entre 40 y 64 años y del 21% para aquellos individuos >64 años5.
La nefropatía diabética, inicialmente reconocida por albuminuria6, es la primera causa de IRC y de entrada de diálisis en el mundo occidental7; cuando las 2 condiciones están presentes el riesgo vascular aumenta notablemente respecto de la población general8. La presencia de albuminuria y/o eGFR reducido eleva al doble el riesgo de enfermedad vascular en la diabetes9. Uno de los factores que influyen en este aumento de la enfermedad vascular es la dislipidemia, caracterizada en la IRC por elevación de los triglicéridos (Tg) y reducción del colesterol de las HDL; cuando coexiste síndrome nefrótico o diabetes, entonces suele elevarse igualmente el colesterol de las LDL10.
La enfermedad arterial periférica (EAP), tanto sintomática como silente, está presente en la nefropatía diabética y en la insuficiencia renal. Cuando utilizamos un índice tobillo/brazo (ITB) inferior a 0,9 el 25% de los pacientes con diabetes tipo 2 tienen ya EAP11; en nuestra serie de pacientes con diabetes tipo 2 y con más de 6 años de evolución constatamos una frecuencia de EAP con este criterio diagnóstico de un 27%12,13, si bien solo un 10% presentaban claudicación intermitente, algo sobradamente conocido14,15. En un subanálisis del estudio MERITO, de entre las complicaciones crónicas de la diabetes solo la afectación renal mantuvo su asociación con un ITB<0,9 tras el ajuste por edad, duración de la diabetes y hábito de fumar16. La diabetes es una de las principales causas de amputación no traumática de la extremidad inferior en pacientes que siguen tratamiento en hemodiálisis17.
Se ha comunicado que los pacientes con formas más graves de nefropatía diabética, sobre todo aquellos con IRC, tienen Tg en ayunas y posprandiales más elevados que los sujetos controles18,19. Nuestro grupo ha mostrado que la presencia de EAP sintomática o asintomática está asociada a una elevación de los Tg en ayunas y posprandiales20,21. Sin embargo, dado que la mayor parte de los pacientes con EAP están asintomáticos, no podemos conocer si la asociación entre los Tg en ayunas y la IRC puede estar sesgada por la presencia de un ITB<0,9.
Por todo ello, los objetivos del presente trabajo son, en primer lugar, determinar los niveles séricos de lípidos, lipoproteínas y otros marcadores relacionados con la nefropatía diabética; en segundo lugar conocer la prevalencia de EAP en esta población y, en tercer lugar, evaluar la posible interacción entre Tg en ayunas, EAP e IRC por nefropatía diabética.
Material/pacientes y métodosSe realizó un estudio de tipo transversal en 72 pacientes con diabetes mellitus tipo 2 procedentes de la consulta de Nefrología del Hospital Universitario Virgen de la Victoria de Málaga y de la consulta de Medicina Interna del Hospital de Puertollano, Ciudad Real. El estudio fue aprobado por el Comité de Ética de la Investigación del Hospital Virgen de la Victoria. Todos los pacientes firmaron el consentimiento informado.
Los pacientes cumplieron los siguientes criterios de inclusión: diabetes tipo 2, edad >50 años y diagnóstico de DM>2 años; los criterios de exclusión fueron: negativa al consentimiento informado, diabetes tipo 1 y enfermedad renal crónica en fase de sustitución de la función renal, diagnóstico previo reciente (<6 meses) de evento isquémico en cualquier territorio, enfermedad concomitante grave, obesidad mórbida (IMC>35kg/m2), cirugía bariátrica o consumo de orlistat o sibutramina.
Se recogieron variables clínicas, antropométricas, comorbilidades y medicamentos en activo. La EAP se consideró cuando elITB fue <0,915. La presencia de claudicación intermitente se evaluó mediante un cuestionario validado22. Se tomaron muestras de sangre tras ayunas de 12h al objeto de determinar variables bioquímicas y hematimétricas por técnicas automatizadas en laboratorios clínicos. La tasa de filtrado glomerular se estimó mediante la fórmula MDRD423. Los pacientes fueron estratificados según su eGFR y la presencia de micro-macroalbuminuria en 4 grupos (grupo 1: eGFR>60min y AC <30; grupo 2: eGFR>60min y AC>30; grupo 3: 30<eGFR<60ml/min; grupo 4: eGFR<30ml/min).
La determinación del perfil lipídico y lipoproteico consistió en la cuantificación del contenido en mg/dl de colesterol y Tg en suero y en las fracciones VLDL, LDL y HDL. Este procedimiento se realizó conforme al procedimiento recomendado por el NCEP24.
Apolipoproteína A1 (APOA1), apolipoproteína B (APOB) y cistatina C (Spinreact, Barcelona, España) fueron cuantificados a partir de muestras previamente almacenadas a –80°C mediante ensayos comerciales automatizados en una analizador nefelométrico RADIM DELTA (RADIM, Pomezia, Italia).
Para analizar variables cuantitativas respecto de los grupos de disfunción renal empleamos un modelo lineal general univariante, corrigiendo por el efecto de las variables «edad» y «sexo», seguido de un test post hoc de Bonferroni para variables que se ajustaron a una distribución normal (nivel de significación: p<0,05) o un test de post hoc U-Mann-Whitney con penalización de Bonferroni (p<0,05/n grupos) para variables que no se ajustaban a la distribución normal. En el caso de variables cualitativas se realizó un estudio de frecuencias en tablas de doble entrada mediante el estadístico Chi-cuadrado de Pearson. Se utilizó el paquete estadístico SPSS 20.0 (IBM, Armonk [NY], EE. UU.).
Al objeto de determinar qué variables están asociadas con la presencia de disfunción renal utilizamos un análisis de regresión logística binaria por pasos hacia delante (Wald), tomando eGFR<60ml/min como variable dependiente y el resto de variables con relevancia clínica o asociadas con p<0,05 en análisis univariante como variables independientes.
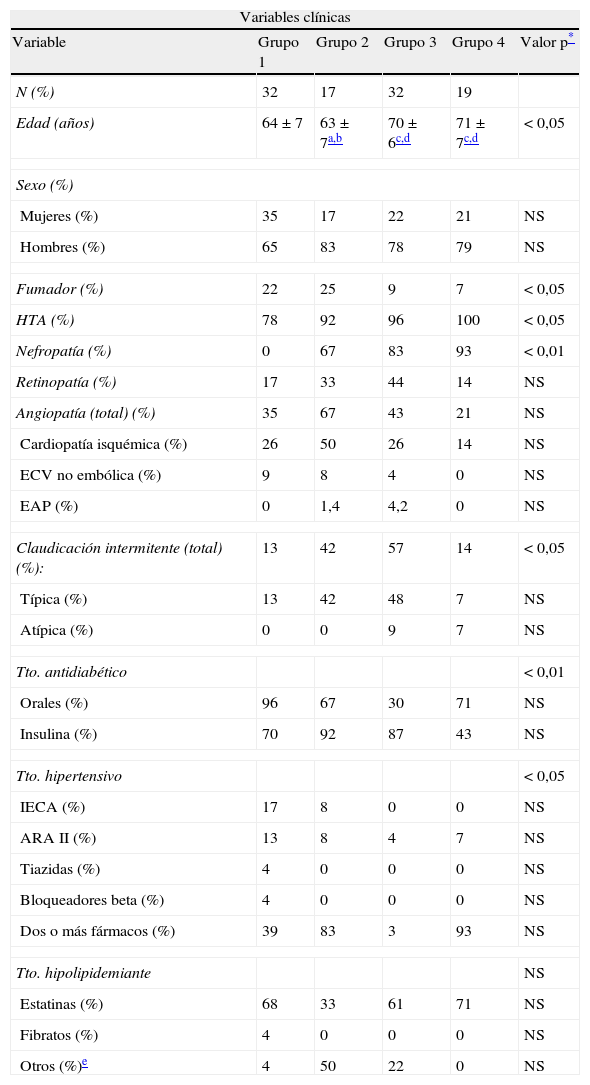
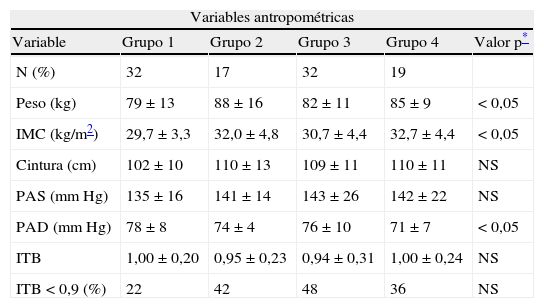
ResultadosLas tablas 1 y 2 muestran datos clínicos y antropométricos, segregados por grupos de acuerdo con el grado de disfunción renal.
Variables clínicas
| Variables clínicas | |||||
| Variable | Grupo 1 | Grupo 2 | Grupo 3 | Grupo 4 | Valor p* |
| N (%) | 32 | 17 | 32 | 19 | |
| Edad (años) | 64±7 | 63±7a,b | 70±6c,d | 71±7c,d | <0,05 |
| Sexo (%) | |||||
| Mujeres (%) | 35 | 17 | 22 | 21 | NS |
| Hombres (%) | 65 | 83 | 78 | 79 | NS |
| Fumador (%) | 22 | 25 | 9 | 7 | <0,05 |
| HTA (%) | 78 | 92 | 96 | 100 | <0,05 |
| Nefropatía (%) | 0 | 67 | 83 | 93 | <0,01 |
| Retinopatía (%) | 17 | 33 | 44 | 14 | NS |
| Angiopatía (total) (%) | 35 | 67 | 43 | 21 | NS |
| Cardiopatía isquémica (%) | 26 | 50 | 26 | 14 | NS |
| ECV no embólica (%) | 9 | 8 | 4 | 0 | NS |
| EAP (%) | 0 | 1,4 | 4,2 | 0 | NS |
| Claudicación intermitente (total) (%): | 13 | 42 | 57 | 14 | <0,05 |
| Típica (%) | 13 | 42 | 48 | 7 | NS |
| Atípica (%) | 0 | 0 | 9 | 7 | NS |
| Tto. antidiabético | <0,01 | ||||
| Orales (%) | 96 | 67 | 30 | 71 | NS |
| Insulina (%) | 70 | 92 | 87 | 43 | NS |
| Tto. hipertensivo | <0,05 | ||||
| IECA (%) | 17 | 8 | 0 | 0 | NS |
| ARA II (%) | 13 | 8 | 4 | 7 | NS |
| Tiazidas (%) | 4 | 0 | 0 | 0 | NS |
| Bloqueadores beta (%) | 4 | 0 | 0 | 0 | NS |
| Dos o más fármacos (%) | 39 | 83 | 3 | 93 | NS |
| Tto. hipolipidemiante | NS | ||||
| Estatinas (%) | 68 | 33 | 61 | 71 | NS |
| Fibratos (%) | 4 | 0 | 0 | 0 | NS |
| Otros (%)e | 4 | 50 | 22 | 0 | NS |
Características clínicas de los pacientes de estudio estratificados según su nivel de afectación renal (grupo 1: eGFR>60ml/min y AC<30; grupo 2: eGFR>60ml/min y AC>30; grupo 3: 30<eGFR<60ml/min; grupo 4: eGFR <30ml/ min).
NS: estadísticamente no significativo (p>0,05).
Test post hoc estadísticamente significativo (Bonferroni [p<0,05]/U Mann-Whitney/n [p<0,01]) comparado con el grupo 3.
Test post hoc estadísticamente significativo (Bonferroni [p<0,05]/U Mann-Whitney/n [p<0,01]) comparado con el grupo 4.
Test post hoc estadísticamente significativo (Bonferroni [p<0,05]/U Mann-Whitney/n [p<0,01] comparado con el grupo 1.
Variables antropométricas
| Variables antropométricas | |||||
| Variable | Grupo 1 | Grupo 2 | Grupo 3 | Grupo 4 | Valor p* |
| N (%) | 32 | 17 | 32 | 19 | |
| Peso (kg) | 79±13 | 88±16 | 82±11 | 85±9 | <0,05 |
| IMC (kg/m2) | 29,7±3,3 | 32,0±4,8 | 30,7±4,4 | 32,7±4,4 | <0,05 |
| Cintura (cm) | 102±10 | 110±13 | 109±11 | 110±11 | NS |
| PAS (mmHg) | 135±16 | 141±14 | 143±26 | 142±22 | NS |
| PAD (mmHg) | 78±8 | 74±4 | 76±10 | 71±7 | <0,05 |
| ITB | 1,00±0,20 | 0,95±0,23 | 0,94±0,31 | 1,00±0,24 | NS |
| ITB<0,9 (%) | 22 | 42 | 48 | 36 | NS |
NS: valor de p no significativo.
Características antropométricas de los pacientes de estudio estratificados según su nivel de afectación renal (grupo 1: eGFR>60ml/min y AC <30; grupo 2: eGFR>60ml/min y AC>30; grupo 3: 30<eGFR<60ml/min; grupo 4: eGFR<30ml/min). No se hallaron diferencias estadísticamente significativas en los test post hoc.
Solo la edad, el hábito tabáquico, la hipertensión arterial y la claudicación intermitente, fueron más prevalentes (o mayor en caso de edad) cuanto peor fue la función renal (p<0,05). También se encontraron diferencias significativas en el tratamiento antidiabético y antihipertensivo.
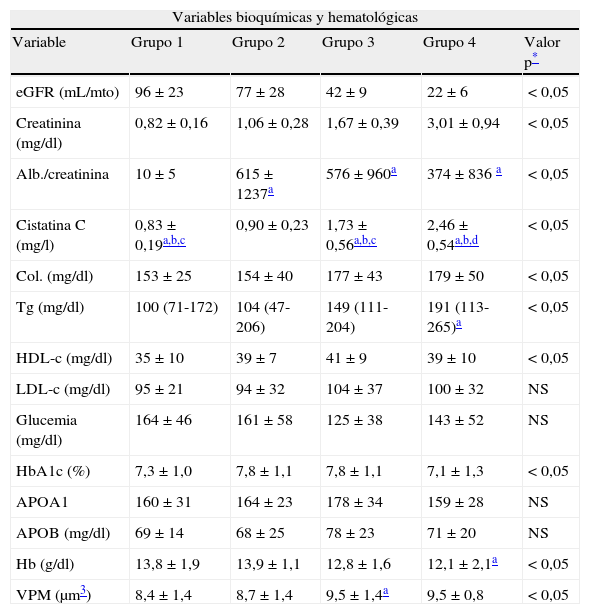
La tabla 3 muestra las variables bioquímicas y hematológicas. El análisis univariante mostró diferencias estadísticamente significativas en los niveles de cistatina C entre todos los grupos (p<0,01), Tg basales (grupo 1=100 [71-172] mg/dl) vs. grupo 4=191 [113-265] mg/dl) (p<0,01), hemoglobina sanguínea (Hb; g/dl) (grupo 1: 13,8±1,9 vs. grupo 4: 12,1±2,1, p<0,05) y volumen plaquetario medio (VPM; μm3) (grupo 1: 8,4±1,4 vs. grupo 4; 9,5±0,8).
Variables bioquímicas y hematológicas
| Variables bioquímicas y hematológicas | |||||
| Variable | Grupo 1 | Grupo 2 | Grupo 3 | Grupo 4 | Valor p* |
| eGFR (mL/mto) | 96±23 | 77±28 | 42±9 | 22±6 | <0,05 |
| Creatinina (mg/dl) | 0,82±0,16 | 1,06±0,28 | 1,67±0,39 | 3,01±0,94 | <0,05 |
| Alb./creatinina | 10±5 | 615±1237a | 576±960a | 374±836 a | <0,05 |
| Cistatina C (mg/l) | 0,83±0,19a,b,c | 0,90±0,23 | 1,73±0,56a,b,c | 2,46±0,54a,b,d | <0,05 |
| Col. (mg/dl) | 153±25 | 154±40 | 177±43 | 179±50 | <0,05 |
| Tg (mg/dl) | 100 (71-172) | 104 (47-206) | 149 (111-204) | 191 (113-265)a | <0,05 |
| HDL-c (mg/dl) | 35±10 | 39±7 | 41±9 | 39±10 | <0,05 |
| LDL-c (mg/dl) | 95±21 | 94±32 | 104±37 | 100±32 | NS |
| Glucemia (mg/dl) | 164±46 | 161±58 | 125±38 | 143±52 | NS |
| HbA1c (%) | 7,3±1,0 | 7,8±1,1 | 7,8±1,1 | 7,1±1,3 | <0,05 |
| APOA1 | 160±31 | 164±23 | 178±34 | 159±28 | NS |
| APOB (mg/dl) | 69±14 | 68±25 | 78±23 | 71±20 | NS |
| Hb (g/dl) | 13,8±1,9 | 13,9±1,1 | 12,8±1,6 | 12,1±2,1a | <0,05 |
| VPM (μm3) | 8,4±1,4 | 8,7±1,4 | 9,5±1,4a | 9,5±0,8 | <0,05 |
NS: valor de p no significativo.
Los valores son media±DE o mediana (rango intercuartílico) (según ajuste a una distribución normal). Variables bioquímicas séricas y variables hematológicas de los pacientes de estudio estratificados según su nivel de afectación renal (grupo 1: eGFR>60ml/min y AC<30; grupo 2: eGFR>60ml/min y AC>30; grupo 3: 30<eGFR <60ml/min; grupo 4: eGFR<30ml/min).
Test post hoc estadísticamente significativo (Bonferroni [p<0,05]/U Mann-Whitney/n [p<0,01]) comparado con el grupo 1.
Test post hoc estadísticamente significativo (Bonferroni [p<0,05]/U Mann-Whitney/n [p<0,01]) comparado con el grupo 3.
Al estratificar a los pacientes en 2 grupos (eGFR<60ml/min) se observó que los niveles séricos de Tg fueron estadísticamente superiores (p<0,05) en los pacientes con eGFR<60ml/min (U Mann-Whitney; 100 [70-130] mg/dl vs. 151 [108-194] mg/dl; p<0,01). En el caso de la prevalencia de EAP, estimada por un ITB<0,9, también se observó una mayor prevalencia, aunque no significativa, de EAP en pacientes con eGFR<60ml/min (29 vs. 43%; p=0,14).
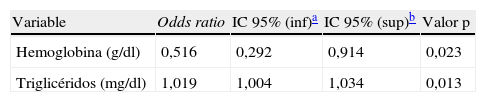
Finalmente, la tabla 4 muestra que solo los Tg y la concentración de hemoglobina se asocian independientemente a presencia de nefropatía. La adición de la presencia de EAP (ITB<0,9) no alteró dicha asociación.
Variables asociadas de forma independiente a la disfunción renal
| Variable | Odds ratio | IC 95% (inf)a | IC 95% (sup)b | Valor p |
| Hemoglobina (g/dl) | 0,516 | 0,292 | 0,914 | 0,023 |
| Triglicéridos (mg/dl) | 1,019 | 1,004 | 1,034 | 0,013 |
Resultados del estudio de regresión logística binaria por pasos hacia delante. Valor p <0,05 para las variables que se asocian independientemente a la presencia de afectación renal (variable dependiente: eGFR<60ml/mto.; n=72). Variables incluidas en el modelo: sexo, hábito tabáquico, años de duración de la diabetes mellitus tipo 2, tratamiento hipolipidemiante, perímetro de cintura (cm), índice de masa corporal (kg/m2), presión arterial sistólica y diastólica (mmHg), hemoglobina (g/dl), plaquetas (uds×109/l), volumen plaquetario medio (μm3), niveles séricos de apoliproteína B (mg/dl), apoliproteína A1 (mg/dl), proteína C reactiva ultrasensible (mg/l) y las variables del perfil lipídico (mg/dl).
Nuestro estudio recoge información clínica y analítica de 72 pacientes con diabetes tipo 2 remitidos a consultas externas por hipertensión, albuminuria y/o descenso del filtrado glomerular. En su conjunto se caracteriza por incluir a varones en la 7.ª década de la vida, y con una muy elevada tasa de retinopatía y nefropatía diabéticas, casi en su totalidad hipertensos con 2 o más fármacos para el control de las cifras tensionales y en su mayoría exfumadores. Como resultado de todo ello más de un 30% de los sujetos tenían diagnosticada previamente enfermedad cardiovascular. A grandes rasgos estas cifras no son diferentes de las de otro estudio similar publicado en nuestro país de pacientes con diabetes de tipo 2 derivados a una consulta de nefrología25, por lo que pensamos que nuestros resultados pueden ser extrapolables a otros ámbitos sanitarios.
Nuestro estudio confirma que la prevalencia de EAP en este grupo de pacientes es mucho mayor a la reportada hasta ahora, alrededor de un 50% en comparación con un 14%25. Los motivos de esta discrepancia son evidentes; mientras que Morales-Fernández et al. describen el antecedente de vasculopatía, en nuestro estudio hemos buscado sistemáticamente la presencia de claudicación intermitente mediante un cuestionario validado22 y cuantificando el cociente de presiones sistólicas tobillo/brazo. En nuestro estudio el diagnóstico de EAP reportado por el paciente fue tan solo del 5,6%.
Respecto de las variables analíticas, además de las diferencias esperables entre los grupos en niveles de creatinina, eGFR, albuminuria, niveles de cistatina C y hemoglobina, queremos destacar el progresivo incremento en la cifra de Tg en ayunas, desde el grupo 1 (función renal preservada sin albuminuria) hasta el grupo 4 (eGFR<30ml/min) (p<0,01). Resulta importante señalar que estas comparaciones intergrupos deben ser tomadas con cautela, debido al bajo tamaño muestral. Teniendo en cuenta esta limitación, este hallazgo no fue ninguna sorpresa, ya que varios estudios analizando la presencia de dislipidemia en la IRC o en varios estadios de la nefropatía diabética habían mostrado unos niveles superiores de los Tg en ayunas respecto de sujetos controles10,18,19,26. Las causas de esta elevación de los Tg parecen ser múltiples, pero una parte de ellas puede estar en la propia enfermedad diabética caracterizada por una elevación de la síntesis de VLDL27; en la microalbuminuria se ha postulado una disminución de la masa y actividad de LPL28; más recientemente se ha postulado como lo más característico de la enfermedad renal crónica un enriquecimiento de apo C-III que enlentece el catabolismo de las lipoproteínas ricas en Tg y es capaz de desencadenar una respuesta proinflamatoria con disfunción endotelial y daño vascular29.
Llama la atención también no evidenciar diferencias entre los 4 grupos respecto de los niveles de colesterol total, colesterol de LDL ni colesterol de HDL. A este respecto, es de destacar que más del 70% de la muestra recibía estatinas, solas o en combinación con ezetimiba o con ácidos omega-3, lo que claramente justifica que la media de colesterol de LDL de la población estudiada se encuentre sobre los 100mg/dl.
Nuestro estudio muestra que solo 2 variables estuvieron asociadas con disfunción renal, definida como un eGFR<60ml/min, los niveles de hemoglobina, de forma negativa, y la concentración de Tg en ayunas. Sin embargo, la EAP (ITB<0,9), como habíamos supuesto, no se asoció con disfunción renal en el análisis multivariante; más aún, la incorporación de esta variable al modelo de regresión no debilitó la asociación de Tg con la disfunción renal. Esta ausencia de asociación debe tomarse con precaución. Aunque el método de cribado de la EAP es el ITB, este tiene una menor sensibilidad cuando hay calcificación arterial, una condición muy frecuente en la diabetes tipo 2 evolucionada30–32. Así, hasta un 25% de sujetos con diabetes tipo 2 que tenían claudicación intermitente típica y un ITB>0,9 mostraron ondas monofásicas en el examen con doppler color, indicativas de EAP13.
Nuestro estudio tiene ciertas limitaciones; por un lado el tamaño muestral, aún escaso; en segundo lugar el diagnóstico de EAP basado solo en la medición del ITB.
Finalmente, podemos concluir que en pacientes con nefropatía diabética la prevalencia de EAP cuando se combina un cuestionario validado de claudicación intermitente y la medición del ITB es muy elevada. Además, confirmamos la relación entre disfunción renal y concentración de los Tg séricos en ayunas, asociación que no se debilita con la presencia de EAP, con el nivel de muestra alcanzado y la metodología empleada. Se hace necesario en los pacientes con ITB normal proceder a un examen doppler color para confirmar este último hallazgo.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEste trabajo de investigación se realizó con una Beca Almirall 2009 (SEA/FEA).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
AgradecimientosLos autores de este trabajo quieren agradecer a los pacientes su colaboración en este estudio.