En general, las guías de práctica clínica tanto europeas con americanas han abordado el control de la dislipidemia aterogénica de forma poco convincente e incluso superficial, en gran medida por las limitaciones terapéuticas disponibles. En consecuencia, esta dislipidemia está infradiagnosticada, infratratada e infracontrolada. Dada la reciente aparición de la guía 2019 de la European Atherosclerosis Society y de la European Society of Cardiology sobre el control de las dislipidemias, parece oportuno examinar su posicionamiento con respecto a la dislipidemia aterogénica y/o sus principales componentes, el aumento en las lipoproteínas ricas en triglicéridos y la disminución del colesterol de las lipoproteínas de alta densidad.
In general, both European and American clinical guidelines have addressed the management of atherogenic dyslipidaemia in an unconvincing and even superficial way, largely because of the available therapeutic limitations. Consequently, this type of dyslipidaemia is underdiagnosed, under-treated, and under-controlled. Given the recent presentation of the 2019 guidelines of the European Atherosclerosis Society and the European Society of Cardiology on the management of dyslipidaemias, it seems appropriate to examine its position with respect to atherogenic dyslipidaemia and/or its main components, the increase in triglyceride-rich lipoproteins, and the decrease of high-density lipoprotein cholesterol.
Los componentes principales de la dislipidemia aterogénica (DA) están bien identificados y son fácilmente reconocibles; sin embargo, esta dislipidemia está infradiagnosticada, infratratada y en consecuencia infracontrolada1. En el estudio EDICONDIS-ULISEA2, uno de cada 6 pacientes tratados en las unidades de lípidos y riesgo vascular de nuestro país presentaba una DA. Es posible que esta prevalencia esté infraestimada, ya que más de una tercera parte de los pacientes tenía un descenso de la concentración de colesterol de las lipoproteínas de alta densidad (HDL) o un incremento de triglicéridos, y que, por tanto, muchos de estos presentaran el fenotipo lipídico completo en otro momento evolutivo. Más recientemente, en el estudio EURIKA con población europea, sin enfermedad cardiovascular, de al menos 50 años de edad con uno o más factores de riesgo3, aproximadamente el 21% presentaba una trigliceridemia≥2,3mmol/L (200mg/dL), el 22% niveles bajos del colesterol HDL (<1mmol/L [40mg/dL] en el varón y<1,3mmol/L [50mg/dL] en la mujer), y casi el 10% presentaba ambas alteraciones lipídicas. Asimismo, reveló que alrededor del 55% de los pacientes con niveles altos de triglicéridos, bajos de colesterol HDL o ambos, no recibía ningún tipo de tratamiento hipolipidemiante.
Las guías de práctica clínica se han convertido en un instrumento fundamental para nuestra actividad asistencial. En 1990 el Institute of Medicine4 las definió como «el conjunto de recomendaciones desarrolladas de manera sistemática, para ayudar a los clínicos y a los pacientes en el proceso de la toma de decisiones, sobre cuáles son las intervenciones más adecuadas para resolver un problema clínico en unas circunstancias sanitarias específicas». Por lo tanto, deben considerarse herramientas complementarias que en modo alguno deben sustituir el juicio clínico. A título de ejemplo, las guías de prevención cardiovascular americanas del 20135 y las europeas del 20126 utilizando prácticamente las mismas evidencias científicas emiten recomendaciones diferentes. Por lo que respecta a la DA, las guías de práctica clínica han abordado el control de esta dislipidemia de forma poco convincente7, en gran medida por las limitaciones terapéuticas disponibles.
Muy recientemente se ha publicado la guía 2019 de la European Atherosclerosis Society (EAS) y de la European Society of Cardiology (ESC) sobre el control de la dislipidemia8, por lo que parece oportuno examinar su posicionamiento con respecto a la DA y/o sus principales componentes, el aumento en las lipoproteínas ricas en triglicéridos y la disminución del colesterol HDL. Para ello, hemos llevado a cabo una búsqueda exhaustiva de los términos «atherogenic dyslipidaemia», «apolipoprotein B», «apolipoprotein B-containing lipoproteins», «HDL cholesterol», «non-HDL cholesterol», «remnant cholesterol», «triglycerides», and «triglyceride-rich lipoproteins» en todas las secciones de la mencionada guía 2019.
Lípidos, lipoproteínas y aterosclerosisEn consonancia con la recomendación conjunta EAS/ESC del 20169, la guía del 2019 proporciona datos adicionales procedentes de los estudios observacionales, clínicos aleatorizados y genéticos de aleatorización mendeliana que muestran de forma inequívoca el efecto causal del colesterol vehiculizado por las lipoproteínas de baja densidad (LDL) en el desarrollo de la enfermedad cardiovascular de origen aterosclerótico. Sin embargo, también ponen de manifiesto la importancia de las lipoproteínas que contienen la apolipoproteína (apo) B en la fisiopatología de la aterosclerosis. Entre estas, la capacidad aterogénica de las lipoproteínas ricas en triglicéridos depende fundamentalmente de 2 factores10: su composición apoproteica, especialmente en apo C-III, y su tamaño. En este sentido, existe una relación inversa entre el tamaño de las partículas lipoproteicas y su capacidad para atravesar el endotelio y penetrar en la íntima arterial, de forma que las lipoproteínas que contienen apo B con un diámetro inferior a 70nm, incluidas las lipoproteínas ricas en triglicéridos pequeñas y sus partículas remanentes, pueden cruzar la barrera endotelial, especialmente en presencia de disfunción endotelial, quedar retenidas en la pared arterial y conducir al depósito de lípidos11,12. En un elegante estudio experimental Argmann et al.13 demostraron que las lipoproteínas de muy baja densidad (VLDL) y las VLDL oxidadas son tan potentes como las LDL y LDL oxidadas para aumentar la acumulación de ésteres de colesterol en las células musculares lisas. No debemos olvidar que, desde un punto de vista conceptual, la DA se define como el desequilibrio entre las lipoproteínas proaterogénicas que contienen apo B (contenidas en las lipoproteínas ricas en triglicéridos) y las lipoproteínas antiaterogénicas que contienen apo A-I (contenidas en HDL)14.
Si bien los datos epidemiológicos asocian las concentraciones bajas de colesterol HDL con el riesgo de episodios cardiovasculares15, fruto de los estudios genéticos que no respaldan el papel protector del colesterol HDL en humanos16, y de los ensayos de intervención farmacológicas destinados a incrementar la concentración de colesterol HDL que tampoco han demostrado beneficios cardiovasculares17–21, la guía considera que el colesterol HDL bajo no es un objetivo terapéutico. En cambio, subraya el resurgir de las lipoproteínas ricas en triglicéridos y sus partículas remanentes para las cuales los niveles de triglicéridos son el principal biomarcador22,23. Las lipoproteínas ricas en triglicéridos y sus remanentes contienen triglicéridos y colesterol, y su poder aterogénico probablemente resulte del enriquecimiento en colesterol de estas partículas lipoproteicas. Este es el denominado «colesterol remanente» y estimado en la práctica clínica como el colesterol total menos la suma del colesterol LDL y HDL.
Es preciso poner de manifiesto que los estudios observacionales y de aleatorización mendeliana apoyan la causalidad del colesterol remanente transportado por las lipoproteínas ricas en triglicéridos en la enfermedad cardiovascular, incluso con independencia del colesterol HDL24,25. Además, los niveles posprandiales elevados de colesterol remanente se asocian con un mayor riesgo de mortalidad por todas las causas en prevención tanto primaria26 como secundaria27. Estos hallazgos refuerzan el papel de la lipidemia posprandial en la aterogénesis, ya que, durante un día normal, las personas están más tiempo en situación posprandial que en ayunas28,29. Por otra parte, la aterogeneicidad del colesterol remanente se relaciona también con la inflamación30, ya que los estudios de Copenhague muestran que las concentraciones plasmáticas de proteína C reactiva>2mg/dL se acompañan por lo general de concentraciones de triglicéridos≥1,7mmol/L (150mg/dL)31.
Los estudios que han analizado el impacto de las mutaciones en los genes implicados en el metabolismo de las lipoproteínas ricas en triglicéridos han consolidado su asociación con el riesgo cardiovascular. Así, las variantes con pérdida de función en los genes que codifican la apo A-V y la lipoproteinlipasa (LpL) se asocian con niveles de triglicéridos plasmáticos más altos de por vida y un mayor riesgo de enfermedad cardiaca coronaria32–35, mientras que los polimorfismos genéticos con pérdida de función en APOC3 y ANGPTL4 se asocian con triglicéridos plasmáticos disminuidos desde el nacimiento y reducción del riesgo de enfermedad cardiaca coronaria36–39. Un reciente estudio de aleatorización mendeliana ha demostrado que las variantes de LpL que comportan reducción de triglicéridos y las variantes del receptor LDL que conllevan descenso del colesterol LDL tuvieron el mismo efecto sobre el riesgo de enfermedad cardiovascular por cambio de unidad de apo B, lo que indica que todas las lipoproteínas que contienen apo B tienen el mismo efecto sobre el riesgo cardiovascular40. Estos estudios apuntan que el efecto causal de las lipoproteínas ricas en triglicéridos y sus remanentes en la enfermedad cardiovascular está determinado fundamentalmente por la concentración circulante de partículas que contienen apo B, más que por el contenido de triglicéridos en sí.
Determinación de lipoproteínasDado el papel causal de las lipoproteínas que contienen apo B en el inicio y la progresión de la aterogénesis, la guía cataloga como «ideal» la medición directa de la concentración de lipoproteínas aterogénicas que contienen apo B para estimar el riesgo y orientar las decisiones terapéuticas. Debido a que todas las lipoproteínas que contienen apo B, incluidas las VLDL, las partículas remanentes y las LDL, tienen una sola molécula de apo B, la cuantificación de esta apoproteína estima de forma directa el número total de partículas aterogénicas en plasma.
En general, las concentraciones de colesterol LDL, no HDL y apo B muestran una elevada correlación, y proporcionan una información muy similar acerca del riesgo cardiovascular41,42. Sin embargo, en determinadas circunstancias, como en sujetos con hipertrigliceridemia, diabetes, obesidad o niveles de colesterol LDL muy bajos, los valores calculados o el nivel de colesterol LDL medido directamente puede subestimar tanto la concentración de colesterol transportado por las LDL como, lo que es más relevante, subestimar la concentración total de lipoproteínas que contienen apo B, infravalorando así el riesgo de enfermedad cardiovascular. Por ello, en estas situaciones clínicas, la guía recomienda la medición tanto de apo B como del colesterol no HDL como parte del perfil lipídico de rutina para la evaluación del riesgo en los pacientes con niveles elevados de triglicéridos. Debido a que la apo B proporciona una estimación precisa de la concentración total de partículas aterogénicas en todas las circunstancias, es la medida preferida para refinar aún más la estimación del riesgo cardiovascular.
Por otra parte, se recomienda la determinación del colesterol HDL en primer lugar para poder estimar el colesterol LDL mediante la fórmula de Friedewald43 y, en segundo lugar, para mejorar la estimación del riesgo utilizando el systematic coronary risk estimation (SCORE).
Objetivos terapéuticos lipídicosLa presente guía focaliza los objetivos terapéuticos en la concentración de colesterol LDL como la principal diana de tratamiento, y se ha incorporado un mayor nivel de exigencia sobre la base de las nuevas evidencias clínicas. Al mismo tiempo, recomienda un tratamiento muy activo de la dislipidemia en los pacientes de alto/muy alto riesgo cardiovascular, incluidos aquellos con hipercolesterolemia familiar y diabetes.
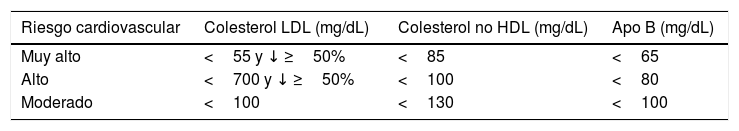
También define unos objetivos secundarios en colesterol no HDL y en apo B para los individuos de riesgo muy alto, alto y moderado, tal y como muestra la tabla 1. Por el contrario, no establece objetivos específicos para el colesterol HDL o los triglicéridos. Para estos últimos, puntualiza que una concentración<1,7mmol/L (150mg/dL) indica un riesgo más bajo y niveles más altos indican la necesidad de buscar otros factores de riesgo.
Objetivos terapéuticos según la guía europea 2019 para el control de las dislipidemias
| Riesgo cardiovascular | Colesterol LDL (mg/dL) | Colesterol no HDL (mg/dL) | Apo B (mg/dL) |
|---|---|---|---|
| Muy alto | <55 y ↓ ≥50% | <85 | <65 |
| Alto | <700 y ↓ ≥50% | <100 | <80 |
| Moderado | <100 | <130 | <100 |
Apo: apolipoproteína; HDL: lipoproteína de alta densidad; LDL: lipoproteína de baja densidad.
Fuente: Mach et al.8.
La guía reitera que todas las medidas que puedan mejorar la sensibilidad a la insulina como la pérdida ponderal y el ejercicio físico regular facilitan la corrección de la hipertrigliceridemia e incrementan las concentraciones de colesterol HDL. Como no podía ser de otra forma, incide en el impacto negativo de la ingesta de alcohol en los niveles de triglicéridos, particularmente en los individuos con hipertrigliceridemia. Además, recuerda que los efectos perjudiciales de una dieta alta en hidratos de carbono en los casos de trigliceridemia ocurren principalmente cuando se consumen alimentos ricos en hidratos de carbono refinados, mientras que son mucho menos prominentes si la dieta se basa principalmente en alimentos ricos en fibra y de bajo índice glucémico tal y como se indica para la diabetes y el síndrome metabólico44. También se señala que el consumo habitual de cantidades significativas (>10% de energía) de fructosa en la dieta contribuye a la elevación de triglicéridos, sobre todo en personas con hipertrigliceridemia u obesidad abdominal, efectos que son dosis-dependiente. En este sentido, invoca que la sacarosa, un disacárido que contiene glucosa y fructosa, representa una fuente importante de fructosa en la dieta.
Por último, refrenda la importancia de dejar de fumar, hecho que también puede contribuir a la elevación del colesterol HDL, siempre que se evite el aumento de peso.
Fármacos hipolipidemiantesEn este apartado, solo haremos referencia a los aspectos incluidos en la guía que se refieren a los fármacos hipolipidemiantes aprobados actualmente en Europa, y de estos el efecto en los componentes de la DA.
- 1)
Como es bien sabido, las estatinas reducen las concentraciones de triglicéridos entre un 10-20%; y en la práctica las más potentes como atorvastatina, rosuvastatina y pitavastatina suelen presentar un mayor efecto reductor de los triglicéridos, especialmente a dosis altas y en pacientes con hipertrigliceridemia basal. En cuanto al efecto sobre el colesterol HDL, el incremento en sus niveles oscila entre el 1 y el 10% según la dosis.
- 2)
El inhibidor de la absorción del colesterol intestinal, ezetimiba, muestra un aumento significativo del 3% en colesterol HDL y una reducción significativa del 8% en la trigliceridemia en comparación con el placebo.
- 3)
Los secuestradores de ácidos biliares no tienen efecto en el colesterol HDL, y los triglicéridos pueden aumentar en algunos pacientes.
- 4)
Los inhibidores de PCSK9, además de su potente efecto en colesterol LDL, reducen los niveles de triglicéridos alrededor de un 25% y aumentan los de colesterol HDL y apo A-I en un 10 y 5%, respectivamente.
- 5)
La lomitapida, inhibidor de la proteína microsomal transferidora de triglicéridos, reduce en los pacientes con hipercolesterolemia familiar homocigota (HFHo) las concentraciones de colesterol total, LDL, apo B y triglicéridos con o sin otro hipolipidemiante, incluida la aféresis. En pacientes sin HFHo con hipercolesterolemia moderada e hipertrigliceridemia, la lomitapida también tiene efectos favorables en colesterol LDL y triglicéridos. Sin embargo, los pacientes tanto con como sin HFHo experimentaron una reducción en colesterol HDL y apo A-1.
- 6)
En cuanto a los fibratos, estos consiguen una reducción de hasta un 50% del nivel de triglicéridos y un aumento del colesterol HDL≤20%. La magnitud del efecto depende en gran medida de los niveles basales, y son notablemente menores (∼ 5 y ∼ 20%, respectivamente) en los estudios de intervención a largo plazo en pacientes con diabetes tipo 2 sin DA. Recientemente, ha aparecido el pemafibrato, un nuevo modulador selectivo de PPAR-α, que a dosis relativamente bajas tiene una marcada eficacia en la reducción de las lipoproteínas ricas en triglicéridos45. Deberemos esperar los resultados del Pemafibrate to Reduce Cardiovascular Outcomes by Reducing Triglycerides in Patients with Diabetes (PROMINENT)46, estudio clínico controlado con objetivos cardiovasculares diseñado que evalúa la eficacia del pemafibrato en unos 10.000 pacientes diabéticos con DA de alto riesgo cardiovascular.
- 7)
Los ácidos grasos omega 3 reducen los triglicéridos en función de la dosis utilizada (2-4g/día), con un efecto marginal en las otras lipoproteínas. En el Reduction of Cardiovascular Events with Icosapent Ethyl–Intervention Trial (REDUCE-IT) el uso de altas dosis de etilo de icosapento (4g/día) en comparación con placebo se acompañó de una reducción significativa del riesgo relativo del 25% de episodios cardiovasculares graves47. En estos momentos 2 estudios, el Outcome Prevention on Cardiovascular Events by Antihyperlipidemic Therapy With N3-fatty Acid in Japan (OCEAN3) y el Outcomes Study to Assess STatin Residual Risk Reduction with EpaNova in HiGh CV Risk PatienTs with Hypertriglyceridemia (STRENGTH), están en desarrollo para determinar si la reducción de las lipoproteínas ricas en triglicéridos y sus remanentes en pacientes tratados con estatinas proporcionan una reducción adicional del riesgo cardiovascular.
Por lo que respecta a los triglicéridos, la guía hace referencia al evinacumab, un anticuerpo monoclonal anti-ANGPTL3 que disminuye las concentraciones de colesterol LDL, triglicéridos y lipoproteína(a) [Lp(a)] en pacientes con HFHo48. En 2 recientes estudios de fase 1 con sujetos hipertrigliceridémicos los resultados con el mismo fármaco fueron similares a los observados con las mutaciones de pérdida de función en ANGPTL349. Asimismo, aporta información de un nuevo oligonucleótido antisentido frente a ANGPTL3, IONIS-ANGPTL3-LRx, que reduce los triglicéridos un 85%. Finalmente, detalla los resultados de seguridad y eficacia del volanesorsen, un oligonucleótido antisentido de segunda generación dirigido contra el ARNm de apo C-III, mostrando una reducción de los triglicéridos en un 70% y de la apo C-III en un 80-90%. Más recientemente, se han descrito los efectos beneficiosos del volanesorsen como complemento a la dieta en adultos con síndrome de quilomicronemia familiar genéticamente confirmado, revelando el brazo de tratamiento activo una disminución a los 3 meses del 84% en los niveles de apo C-III y del 77% en los niveles de triglicéridos50.
En cuanto al colesterol HDL, la guía se centra en los péptidos miméticos de apo A-I y las formas recombinantes de HDL con potencial para la remodelación de partículas de HDL in vivo y una mayor actividad cardioprotectora51. Por otro lado, hace referencia al volanesorsen, que además de su efecto hipotrigliceridemiante, conduce a una elevación del 40% en colesterol HDL en sujetos con hipertrigliceridemia.
Recomendaciones para el tratamiento farmacológico de las hipertrigliceridemiasEn el abordaje terapéutico de las hipertrigliceridemias, la guía recomienda el tratamiento con estatinas como el fármaco de elección para reducir el riesgo cardiovascular en los individuos de alto riesgo con triglicéridos>2,3mmol/L (>200mg/dL). Esta recomendación se basa en el subanálisis del estudio Treating New Targets (TNT) efectuado por Vallejo-Vaz et al.52 que concluye que el colesterol de las lipoproteínas ricas en triglicéridos es un marcador de riesgo cardiovascular independiente y proporciona evidencia del beneficio cardiovascular de las estatinas en los pacientes en prevención secundaria con lipoproteínas ricas en triglicéridos con alto contenido en colesterol.
En pacientes de alto/muy alto riesgo con niveles de triglicéridos entre 1,5-5,6mmol/L (135-499mg/dL) a pesar del tratamiento con estatinas, la guía considera el uso los ácidos grasos poliinsaturados n-3 (etilo de icosapento 4g/día) en combinación con una estatina fruto de los resultados del estudio REDUCE-IT47. Con posterioridad, cuando los autores hacen un subanálisis de los resultados en función de los terciles de triglicéridos, concluyen que los beneficios cardiovasculares del etilo de icosapento están relacionados principalmente con el riesgo basal y otros efectos no relacionados con los triglicéridos53. Finalmente, la guía considera en pacientes de prevención primaria o de alto riesgo, ambos con el colesterol LDL en niveles objetivo y triglicéridos>2,3mmol/L (>200mg/dL), el uso de fenofibrato o bezafibrato en combinación con estatinas.
Control de las dislipidemias en diferentes situaciones clínicasHiperlipidemia familiar combinadaSe subrayan 3 aspectos de esta dislipidemia mixta que cursa con niveles elevados de colesterol LDL, triglicéridos o ambos: su elevada prevalencia, que es una causa frecuente de cardiopatía isquémica precoz, y que presenta una superposición con los fenotipos lipídicos de la diabetes tipo 2 y síndrome metabólico. Sigue proponiendo la combinación de apo B>120mg/dL y triglicéridos>1,5mmol/L (133mg/dL) con antecedentes familiares de enfermedad cardiovascular prematura para su identificación. La guía reitera que el tratamiento con estatinas disminuye el riesgo cardiovascular en los individuos con y sin hipertrigliceridemia.
Disbetalipoproteinemia familiarLa guía aconseja que el tratamiento y control de los pacientes con disbetalipoproteinemia familiar debe realizarse en una clínica de lípidos o unidad especializada, e indica que la mayoría de los casos responden bien al tratamiento con una estatina o, si predomina la hipertrigliceridemia, mediante un fibrato; refiere que a menudo se puede necesitar un tratamiento combinado de estatina y fibrato.
Causas genéticas de hipertrigliceridemiaTal y como hemos mencionado con anterioridad, la concentración plasmática de triglicéridos es el biomarcador de las lipoproteínas ricas en triglicéridos y las partículas remanentes. La guía acentúa que la mayoría de las hipertrigliceridemias suelen ser multigénicas o poligénicas, con acumulación de ADN de variantes comunes con escaso impacto y ADN de variantes raras con gran repercusión en la trigliceridemia. Además, en individuos susceptibles la hipertrigliceridemia se agrava con la concurrencia de factores ambientales como el estilo de vida, el sobrepeso y el consumo de alcohol.
Las hipertrigliceridemias monogénicas graves causantes del síndrome de quilomicronemia son debidas a mutaciones de pérdida de función en los genes que regulan el catabolismo de las lipoproteínas ricas en triglicéridos como el de la LpL, APOC2, APOA5, LMF1, GPIHBP1 y GPD1, siendo las más comunes las mutaciones de LPL y en segundo lugar las de GP1HBP154.
Para la deficiencia de LpL, el fabricante de la terapia génica con tiparvovec, vector asociado al subtipo 1 de adenovirus portador de la variante de ganancia de función LpL p.S447X, decidió no solicitar la renovación de la autorización de comercialización en 201755. Recientemente, se han publicado los resultados al año de tratamiento con esta terapia génica del primer paciente con déficit de LpL56.
En esta sección, la guía incluye un apartado dedicado a la prevención de la pancreatitis aguda en los casos de hipertrigliceridemia severa. En este punto, insiste en la importancia de la restricción calórica y contenido de grasa dietética, y la abstinencia de alcohol. Se debe iniciar la terapia con fibratos (fenofibrato), con ácidos grasos n-3 (2-4g/día) como terapia complementaria y cita que la lomitapida puede considerarse en casos graves57. En pacientes con diabetes, se debe iniciar la insulinoterapia para lograr un buen control glucémico. En el contexto agudo, la plasmaféresis puede reducir rápidamente la trigliceridemia58. En último lugar, recuerda la reciente aprobación por la European Medicines Agency (EMA) del volanesorsen como complemento de la dieta en pacientes adultos con quilomicronemia familiar que tienen un alto riesgo de pancreatitis.
Otros trastornos genéticos del metabolismo de las lipoproteínasDe entre las hipolipidemias genéticas destacan la hipobetalipoproteinemia, la abetalipoproteinemia, la enfermedad de Tangier (analfalipoproteinemia) y la deficiencia de lecitin-colesterol-acil-transferasa que cursan con niveles muy bajos o inexistentes de colesterol HDL. Se detectan niveles muy altos de colesterol HDL en pacientes con deficiencia de la proteína transferidora de ésteres de colesterol.
La deficiencia de lipasa ácida lisosomal o enfermedad por almacenamiento de ésteres de colesterol es una causa rara de colesterol LDL elevado y HDL bajo, acompañado de hepatomegalia y esteatosis microvesicular. El tratamiento con estatinas disminuye los niveles de colesterol LDL y, por lo tanto, podría prevenir la enfermedad cardiovascular en estos pacientes, pero no detiene la progresión del daño hepático. La terapia enzimática de sustitución con sebelipasa alfa podría ofrecer una solución de tratamiento en un futuro cercano59.
Dislipidemia del síndrome metabólico y de la diabetes tipo 2La guía reitera que este modelo de dislipidemia se acompaña de un conjunto de alteraciones lipoproteicas, entre las que se incluye la elevación de triglicéridos, apo B y LDL pequeñas y densas y niveles bajos de colesterol HDL y apo A-I. Asimismo, refrenda que el colesterol no HDL o la apo B son buenos marcadores de las lipoproteínas ricas en triglicéridos y sus remanentes, y son un objetivo terapéutico secundario (tabla 1).
Finalmente, resalta el hecho bien conocido de que la DA es uno de los principales factores de riesgo cardiovascular en las personas con diabetes tipo 2, obesidad abdominal y resistencia a la insulina o intolerancia a la glucosa.
Los beneficios clínicos derivados del tratamiento de la DA que se observa frecuentemente en la diabetes aún son motivo de debate, ya que los efectos del fenofibrato en el objetivo principal de los estudios Fenofibrate Intervention and Event Lowering in Diabetes (FIELD)60 y Action to Control Cardiovascular Risk in Diabetes (ACCORD) fueron negativos61. En un subanálisis del estudio FIELD, el fenofibrato redujo los episodios cardiovasculares un 27% en aquellos con triglicéridos elevados (2,3mmol/L [200mg/dL])62. El estudio ACCORD confirmó que los pacientes que tenían niveles de triglicéridos en el tercio superior (2,3mmol/L [200mg/dL]) y un nivel de colesterol HDL en el tercio inferior (≤0,4mmol/L (34mg/dL]), se beneficiaban de la adición de fenofibrato a simvastatina61. La prolongación del seguimiento clínico de los participantes del ACCORD confirmó el efecto beneficioso del fenofibrato en los sujetos con DA al inicio del estudio63. De acuerdo con estos hallazgos, 3 metaanálisis de fibratos en prevención cardiovascular prácticamente coetáneos corroboraron que los beneficios cardiovasculares de los fibratos acontecen fundamentalmente en los pacientes con DA o sus componentes64–66.
Según los datos disponibles, la guía indica que los pacientes diabéticos con DA pueden obtener beneficios clínicos de la terapia reductora de triglicéridos como complemento del tratamiento con estatinas67,68. En este sentido el estudio PROMINENT con pemafibrato será decisivo para confirmarlo46.
Por lo que respecta a la diabetes tipo 1, el perfil lipídico de estos pacientes con un correcto control glucémico suele ser normal, debido al efecto de la insulina en la actividad de LpL en el tejido adiposo y el músculo esquelético. Sin embargo, a pesar de la aparente «normalidad» del perfil lipídico, hay cambios cualitativos en la composición de las HDL y LDL potencialmente aterogénicos.
Lípidos y enfermedad renal crónicaEn las etapas iniciales de la enfermedad renal crónica, la DA es la dislipidemia característica, incluyendo un predominio de partículas de LDL pequeñas y densas. Asimismo, los estudios indican que el riñón desempeña un papel clave en el catabolismo de Lp(a) y que sus niveles aumentan en asociación con la enfermedad renal. Todas estas alteraciones lipoproteicas pueden revertir mediante el trasplante renal o la remisión de la nefrosis.
TrasplanteLas alteraciones del metabolismo lipídico son frecuentes en los pacientes sometidos a un trasplante de médula ósea, corazón, pulmón o hígado y comportan un mayor riesgo cardiovascular y de vasculopatía arterial de trasplante. Además, los fármacos inmunosupresores pueden tener efectos adversos en el metabolismo lipídico y conducir a aumentos en colesterol total, VLDL y triglicéridos, y en el tamaño y la densidad de las partículas de LDL. Para el tratamiento y control de la dislipidemia en los receptores de trasplantes, la guía recomienda seguir la misma pauta que para los pacientes de alto/muy alto riesgo cardiovascular.
Enfermedad vascular retinianaLa guía reconoce que los cambios ateroscleróticos de las arterias retinianas se correlacionan con las concentraciones de colesterol total, LDL, triglicéridos y apo B, así como con la enfermedad cardiaca coronaria, y que el fenofibrato reduce la progresión de la retinopatía diabética.
Lagunas en las evidenciasLa guía finaliza con esta sección en la que resalta aquellos aspectos no suficientemente cubiertos por la evidencia científica. En este sentido, reseña la ausencia de estudios comparativos basados en los resultados de colesterol LDL versus apo B como métodos primarios de medición para el cribado, diagnóstico y control.
Asimismo, reclama la necesidad de más evidencias clínicas en alusión a la asociación aparentemente adversa de niveles extremadamente altos de colesterol HDL con objetivos clínicos cardiovasculares, y destaca el desconocimiento del impacto clínico de las terapias que modifican la función de las partículas de HDL.
ConclusionesLa complejidad de la fisiopatología de la DA dificulta trasladar a la clínica su impacto en la prevención cardiovascular. En este contexto, es esencial promover el conocimiento de la DA y el riesgo asociado, así como difundir los conocimientos existentes y la implementación de medidas para su correcta identificación, tratamiento y control. En la tabla 2 se exponen los puntos clave del posicionamiento de la guía europea 2019 para el control de las dislipidemias8 con respecto a la DA y/o sus principales componentes. Destacar que los niveles elevados de triglicéridos se asocian con un mayor riesgo de episodios cardiovasculares graves y mortalidad, hecho que se agrava aún más con niveles concurrentes elevados de colesterol LDL o bajos de colesterol HDL. El colesterol no HDL, que depende principalmente de los niveles de lipoproteínas ricas en triglicéridos, debería ser el objetivo terapéutico principal en el control de los pacientes con DA. La cuantificación de la apo B es la medida más precisa y estable del riesgo cardiovascular, pero su limitada disponibilidad es la principal barrera para un uso rutinario más amplio.
Puntos clave de la guía europea 2019 para el control de las dislipidemias8 respecto a la dislipidemia aterogénica y/o sus componentes
| • Las concentraciones elevadas de colesterol LDL y triglicéridos comportan un incremento del riesgo de episodios cardiovasculares; esto se agrava en presencia de niveles bajos de colesterol HDL• Los triglicéridos son el principal biomarcador de las lipoproteínas ricas en triglicéridos y sus partículas remanentes |
| • El colesterol no HDL debería ser el objetivo terapéutico principal en el control de los pacientes con DA• Determinar el colesterol HDL y los triglicéridos para estimar el riesgo cardiovascular residual |
| • La estrategia terapéutica de los pacientes con DA debe seguir la guía europea y centrarse en los pacientes de alto/muy alto riesgo cardiovascular y aquellos con síndrome metabólico• Los resultados de los subanálisis de los estudios de intervención con fibratos y del estudio REDUCE-IT47 con ácidos grasos ω-3 apoyan el tratamiento combinado en los pacientes con triglicéridos elevados y/o DA |
DA: dislipidemia aterogénica; HDL: lipoproteínas de alta densidad; LDL: lipoproteínas de baja densidad.
El tratamiento de la DA debe cumplir con las recomendaciones europeas actuales y centrarse en los pacientes de alto/muy alto riesgo cardiovascular y aquellos con síndrome metabólico. Las estatinas reducen el riesgo cardiovascular en todos los pacientes, pero las diferencias específicas del paciente con DA pueden requerir un enfoque individualizado.
Conflicto de interesesEste es un grupo de trabajo de la Sociedad Española de Arteriosclerosis y recibe financiación de Mylan.