La dislipidemia aterogénica se caracteriza por un incremento de los niveles plasmáticos de triglicéridos totales (TG) y un descenso del colesterol de las lipoproteínas de alta densidad (cHDL). Junto a estas 2alteraciones lipídicas que definen la dislipidemia aterogénica, encontramos un aumento de las lipoproteínas ricas en TG y portadoras de apolipoproteína B (apoB) y habitualmente un aumento moderado, en ocasiones con valores cercanos a la normalidad, de la concentración de colesterol de las lipoproteínas de baja densidad (cLDL), con predominio de partículas LDL pequeñas y densas1.
La dislipidemia aterogénica tiene una gran importancia al estar asociada a diferentes enfermedades que en la población general son actualmente muy prevalentes y se acompañan de un alto riesgo cardiovascular (RCV), como el sobrepeso (37%), la obesidad (17%), la diabetes (14%) y el síndrome metabólico (30%)2,3. Además, la dislipidemia aterogénica es por sí misma un indicador de alto RCV en los sujetos con diabetes; en este sentido, se asocia con un mayor riesgo de isquemia miocárdica o enfermedad coronaria angiográfica silentes en pacientes con diabetes de tipo 2 y niveles de cLDL <130mg/dL4.
De hecho, en la población española la prevalencia de dislipidemia aterogénica es elevada: está presente en el 34% de los diabéticos, el 21% de los pacientes de alto riesgo con cLDL controlado, y en entre el 21 y el 34% de los pacientes con antecedentes de enfermedad vascular de alguna localización (coronaria, cerebral o arterial periférica)5.
DiagnósticoLa dislipidemia aterogénica se caracteriza por hipertrigliceridemia, que es consecuencia del aumento del conjunto de las lipoproteínas ricas en TG, incluyendo sus partículas remanentes, y por la elevación moderada de las LDL; es decir, el conjunto de las lipoproteínas aterogénicas que contienen apoB. Todas estas lipoproteínas aterogénicas podemos cuantificarlas mediante las concentraciones de colesterol-no-HDL (c-no-HDL) o de apoB. Por otro lado, existe una diminución del cHDL.
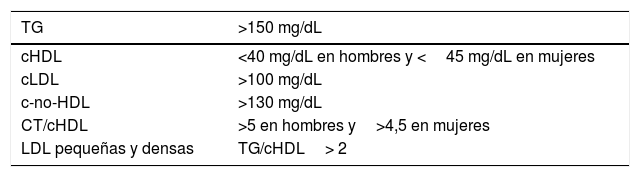
Junto a estas alteraciones, la presencia de un aumento de las partículas LDL pequeñas y densas, calculadas indirectamente por el índice TG/cHDL, y el aumento de los cocientes aterogénicos, especialmente CT/cHDL, forman el conjunto de los hallazgos en esta dislipidemia6, cuyo resumen viene expuesto en la tabla 1.
Dislipidemia aterogénica
| TG | >150 mg/dL |
|---|---|
| cHDL | <40 mg/dL en hombres y <45 mg/dL en mujeres |
| cLDL | >100 mg/dL |
| c-no-HDL | >130 mg/dL |
| CT/cHDL | >5 en hombres y>4,5 en mujeres |
| LDL pequeñas y densas | TG/cHDL> 2 |
cHDL: colesterol de las lipoproteínas de alta densidad; cLDL: colesterol de las lipoproteínas de baja densidad; LDL: lipoproteínas de baja densidad; TG: triglicéridos.
El c-no-HDL representa esencialmente la suma del colesterol de las lipoproteínas que contienen apoB, es decir, las lipoproteínas aterogénicas con capacidad de depositarse en la pared arterial. Por ello, en los pacientes con dislipidemia aterogénica se ha recomendado que el objetivo terapéutico más adecuado es el c-no-HDL o la apoB, ya que ambos parámetros se correlacionan mejor con el RCV que el cLDL7.
El c-no-HDL ha demostrado ser un factor sólido de RCV, que puede en la clínica habitual sustituir a la apoB, al ser más económico y fácil de calcular ya que solo requiere la resta del cHDL al colesterol total, parámetros analíticos disponibles en todos los laboratorios clínicos de los centros de atención sanitaria. En la actualidad, se recomienda medir, siempre que clínicamente se pueda, la apoB, en especial en los casos con dislipidemia aterogénica y en las alteraciones con ella relacionadas, hipertrigliceridemia, obesidad, síndrome metabólico, diabetes y enfermedad cardiovascular clínica8.
Las evidencias científicas sobre la asociación entre los niveles elevados de cLDL y el aumento del riesgo de enfermedad cardiovascular son fuertes e indiscutibles. Sin embargo, aun con un adecuado control del cLDL, queda un considerable porcentaje de sujetos que mantienen un elevado riesgo vascular atribuible a otras alteraciones lipídicas, como la hipertrigliceridemia y el descenso de cHDL. El mayor RCV se encuentra cuando coexisten alteraciones en las 3fracciones lipídicas: aumento del cLDL y triglicéridos y descenso del cHDL9.
En su metaanálisis, con 62.154 pacientes incluidos en 8 estudios, Anderson et al.9 demostraron que el c-no-HDL tenía mejor correlación con el RCV que el cLDL; además, los sujetos que alcanzaban los objetivos terapéuticos de cLDL, pero no de c-no-HDL tenían un incremento de riesgo del 32% en comparación con aquellos que conseguían ambos objetivos. Datos similares han sido aportados por Boekholdt et al.10.
Asimismo, un reciente estudio ha puesto de manifiesto que la progresión de la placa de ateroma estaba más estrechamente asociada con las concentraciones de c-no-HDL que con las de cLDL. En este sentido, los niveles más bajos de c-no-HDL y TG mostraron una asociación significativa con la regresión de la placa a través de las diferentes categorías de RCV11.
Por ello, debemos considerar que en los pacientes con dislipidemia aterogénica el principal predictor de riesgo y, por ello, el objetivo primario de control es el c-no-HDL12. Por otro lado, se ha establecido que el RCV que tienen los sujetos con dislipidemia aterogénica es doble o triple que el de la población general y, en la mayoría de los casos, tienen un alto RCV13,14.
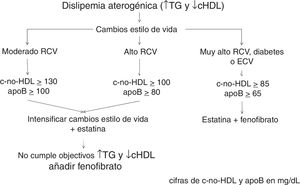
El cálculo del c-no-HDL basado en el colesterol total menos el cHDL se establece como objetivo dependiendo del RCV: sus valores se han establecido como los del objetivo de cLDL más 30mg/dL.
En consecuencia, el objetivo de c-no-HDL y apoB será: en moderado RCV <130mg/dL y <100mg/dL, respectivamente; en alto RCV <100mg/dL y <80mg/dL, respectivamente y en muy alto RCV <85mg/dL y <65mg/dL, respectivamente (tabla 2).
Objetivos lipídicos en la dislipidemia aterogénica
| Primario | ||
|---|---|---|
| Objetivo primario | c-no-HDL (mg/dL) | ApoB (mg/dL) |
| Riesgo CV moderado | <130 | <100 |
| DM1 <35 años o DM2 <50 años, duración <10 años | ||
| SCORE 1-4 | ||
| Alto riesgo CV | <100 | <80 |
| 1 FRCV grave (CT> 310 mg/dL, cLDL> 190 mg/dL, PA ≥180/110mmHg | ||
| HF sin otro FRCV | ||
| DM sin LOD, con ≥10 años de evolución o con 1 FRCV | ||
| ERC FGe 30-59 mL/min | ||
| SCORE 5-9 | ||
| Muy alto riesgo CV | <85 | <65 |
| ECV documentada: clínica (SCA, IAM, angor, revascularización, ictus o TIA, EAP) o imagen inequívoca (placa>50% con cualquier método de im) | ||
| DM con lesión órgano diana o 1 de los 3 FRCV mayores o DM1>20 años | ||
| ERC-FGe <30 ml/min/ | ||
| SCORE ≥10 | ||
| HF con ECV o con 1 FRCV mayor | ||
| Objetivos secundarios | TG (mg/dL) | cHDL (mg/dL) |
|---|---|---|
| Tras conseguir el objetivo primario | <150 | >40 H>45 M |
ApoB: apolipoproteína B; c-no-HDL: colesterol unido a las lipoproteínas aterogénicas (colesterol total menos colesterol de las lipoproteínas de alta densidad); cHDL: colesterol de las lipoproteínas de alta densidad; CT: colesterol total; CV: cardiovascular; DM: diabetes mellitus; DM1 diabetes mellitus de tipo 1; EAP: enfermedad arterial periférica; ERC: enfermedad renal crónica; EVC: enfermedad cardiovascular; FGe: filtrado glomerular estimado; FRCV: factor de riesgo cardiovascular; H: hombres; HF: hipercolesterolemia familiar; IAM. infarto agudo de miocardio; LOD: lesión de órgano diana; M: mujeres; PA: presión arterial; SCA: síndrome coronario agudo; SCORE: puntuación de riesgo de muerte cardiovascular de las sociedades europeas; TG: triglicéridos; TIA: isquemia cerebral transitoria.
La hipertrigliceridemia es un factor independiente de RCV: se consideran concentraciones óptimas las de TG <150mg/dL15. Por tanto, el objetivo terapéutico, aunque no ha sido claramente establecido, puede considerarse <150mg/dL.
Las concentraciones plasmáticas de cHDL <40mg/dL en hombres y <45mg/dL en mujeres son también consideradas como un factor independiente de RCV y, en consecuencia, serían deseables cifras superiores a las mencionadas15,16.
En el análisis del estudio PROVE IT-TIMI 22, estudio prospectivo en 4.162 pacientes hospitalizados por síndrome coronario agudo que fueron tratados con estatinas (pravastatina o atorvastatina), se observó que aquellos que controlaban el cLDL por debajo de 70mg/dL obtuvieron una reducción de un 16% de los episodios cardiovasculares recurrentes, mientras que en el grupo con reducción de cLDL (<70mg/dL) y de TG por debajo de 150mg/dL el descenso de episodios cardiovasculares fue del 28%17.
Puntos de consenso en la evaluación clínica de la dislipidemia aterogénicaCon base en los datos disponibles y en las evidencias clínicas más importantes señaladas, con respecto al RCV asociado a la dislipidemia aterogénica, los puntos clave son:
- –
La hipertrigliceridemia es un factor independiente de RCV, que resulta exacerbado en presencia de niveles elevados de cLDL o bajos de cHDL. Es uno de los elementos clave del riesgo vascular residual de origen lipídico.
- –
Para evaluar el RCV global es imprescindible la determinación de los TG y el cHDL.
- –
Los marcadores de mayor utilidad para valorar el riesgo atribuible a la dislipidemia aterogénica son el c-no-HDL (con valor superior al del cLDL) o la apoB y los TG. Los TG son un marcador de lipoproteínas remanentes ricas en TG y, de forma indirecta, del colesterol de estas lipoproteínas. La división de la concentración de TG por 5 si los valores están expresados en mg/dL y por 2,2 si están expresados en mmol/L nos permite calcular el colesterol de las lipoproteínas remanentes ricas en TG. Un valor>30mg/dL (>0,3 mmol/L) indica que existe un exceso de dicho colesterol.
- –
El c-no-HDL es el objetivo terapéutico adecuado para el control del RCV en pacientes con dislipidemia aterogénica. La apoB es el marcador idóneo, tiene una buena correlación con el c-no HDL, pero puede existir falta de disponibilidad generalizada para un empleo rutinario. Ambos parámetros tienen una gran estabilidad para calcular el RCV en la dislipidemia aterogénica y en las alteraciones relacionadas.
La dislipidemia aterogénica es un elemento trascendental que contribuye de manera clara al riesgo residual que queda tras el tratamiento con estatinas. Esta dislipidemia se encuentra infradiagnosticada, infratratada e infracontrolada, lo que es particularmente relevante en los pacientes de alto RCV y en aquellos con obesidad abdominal, síndrome metabólico y diabetes18.
Es preciso considerar el abordaje de esta entidad sobre la base de las evidencias científicas disponibles a fin de mejorar su tratamiento y la adherencia de los pacientes.
Cambios en el estilo de vidaLa incorporación de una dieta saludable, del ejercicio físico regular junto a la cesación del hábito tabáquico son las primeras medidas para reducir el RCV en todos los pacientes.
La dieta mediterránea, con disminución del total calórico en caso de aumento de peso u obesidad abdominal, se acompaña de claros beneficios cardiovasculares y de una mayor longevidad. Además de los efectos beneficiosos en el perfil lipídico, tiene efectos positivos en la hipertensión y la hiperglucemia. Hay que moderar el consumo de alcohol o evitarlo en casos de hipertrigliceridemia moderada o grave.
El ejercicio físico aeróbico es también primordial en la dislipidemia aterogénica y en la prevención y el tratamiento del síndrome metabólico, la hiperglucemia, la diabetes y la enfermedad cardiovascular.
Tratamiento farmacológicoDebido a que en la mayoría de los casos los pacientes con dislipidemia aterogénica tienen un riesgo alto o muy alto de enfermedad cardiovascular, es preciso asociar, a los cambios en el estilo de vida, diferentes fármacos hipolipidemiantes.
EstatinasSe iniciará tratamiento con estatinas, eligiendo el tipo y la dosis necesaria para conseguir el objetivo terapéutico en función de la reducción requerida en cLDL. Los beneficios del tratamiento con estatinas son bien conocidos y están demostrados con claridad. Una reducción de 1 mmol/L (aproximadamente 39mg/dL) de cLDL se relaciona con una reducción de la incidencia de episodios cardiovasculares graves del 21% y de accidentes coronarios en un 23%19.
Un hecho relevante es que el tratamiento con estatinas durante 10 años en sujetos con bajo RCV se relacionó con una reducción del 23% de episodios de infarto de miocardio no mortal con estatinas de baja potencia, si bien la reducción fue del 53% con el uso de estatinas más potentes, incluyendo una reducción significativa de los episodios cardiovasculares20,21. En los pacientes con dislipidemia aterogénica el uso de estatinas es la primera aproximación farmacológica, ya que una disminución de 1 mmol/L (39mg/dL) del colesterol de los remanentes se relaciona también con una importante reducción de los episodios cardiovasculares, de forma similar a lo observado con la reducción del cLDL22.
FibratosCuando mediante un tratamiento con estatinas se ha conseguido el objetivo cLDL, aún persiste un inaceptable riesgo elevado de episodios cardiovasculares debido a la presencia de los principales componentes de la dislipidemia aterogénica (hipertrigliceridemia y diminución del cHDL). La administración de fibratos en estas condiciones corrige estas alteraciones lipídicas y tiene beneficios cardiovasculares adicionales. Los fibratos han demostrado beneficio en estudios de prevención primaria, secundaria y en población diabética, sobre todo en los subgrupos con dislipidemia aterogénica o alguno de sus componentes, con reducción del 28-30% de los episodios cardiovasculares23,24.
En caso de contraindicación o intolerancia a los fibratos y con elevación de TG, los ácidos grasos omega-3 pueden resultar beneficiosos en estos pacientes25.
Los cambios lipídicos inducidos por los fibratos se explican por modificaciones en la expresividad de diferentes genes involucrados en el metabolismo lipídico a través de los receptores α activados de proliferación de los peroxisomas, con reducción de los TG del 20-50%, del cLDL del 5-20% (con disminución de las partículas LDL pequeñas y densas) y aumento de cHDL del 5-20%. Estos efectos son dependientes de las concentraciones basales11 y vienen recogidos en la tabla 326.
Efectos lipídicos de los fibratos
| Mecanismos | |
|---|---|
| Reducción de TG | Aumenta la lipólisis (aumenta la actividad LPL, la síntesis de apoA-V y disminuye la síntesis de apoC-III)Aumenta el aclaramiento plasmático de las lipoproteínas ricas en TGReduce la disponibilidad de ácidos grasos (disminuyendo la síntesis de novo y aumentando la oxidación) y, por tanto, la síntesis de TG y de VLDL |
| Aumento de HDL | Aumenta la síntesis de apoA-I y apoA-IIDisminuye la actividad de la CETP y, por tanto, la transferencia de colesterol a las VLDL y de TG a las HDL |
| Cambios en el fenotipo de partículas LDL | Induce un cambio de partículas de LDL pequeñas y densas, especialmente aterogénicas, a mayor tamaño y menor densidad |
apoA-I: apolipoproteína A-I; apoA-II apolipoproteína A-II; apoC-III: apolipoproteína C-III; apoA-V: apolipoproteína A-V; CETP: proteína transportadora de ésteres de colesterol; HDL: lipoproteínas de alta densidad; LDL: lipoproteínas de baja densidad; LPL: lipoproteinalipasa; TG: triglicéridos; VLDL: lipoproteínas de muy baja densidad.
El fibrato más seguro para asociar a una estatina es el fenofibrato: su adición consigue un mayor efecto hipocolesterolemiante y el control del c-no-HDL, TG y cHDL.
A diferencia de lo que ocurre con el gemfibrocilo, la combinación de fenofibrato y estatina ha mostrado un excelente perfil de seguridad en todos los estudios clínicos, que incluyen un gran número de pacientes y un prolongado periodo de tratamiento. Además, los efectos de la asociación fenofibrato-estatina sobre la elevación de las enzimas musculares o hepáticas, o sobre el aumento transitorio de la creatinina, no difieren de lo observado en régimen de monoterapia y así es comprobable la reversibilidad de los efectos.
En el estudio FIRST, que comparaba los efectos de los fibratos en sujetos tratados con atorvastatina sobre el grosor íntima-media carotídea, se observó su reducción significativa en el grupo tratado con fibratos, especialmente en los sujetos con triglicéridos>170mg/dL y en aquellos que en situación basal tenían mayor grosor de la íntima-media arterial27.
Otro trabajo que apoya el beneficio del tratamiento con fenobibrato unido a estatinas en sujetos con síndrome metabólico es un estudio prospectivo a 5 años, con un elevado número de pacientes, en el que se demostró una reducción del objetivo compuesto (enfermedad isquémica coronaria, enfermedad isquémica cerebral y muerte cardiovascular) de un 36% en el grupo al que se añadió fenofibrato respecto del placebo28.
Las principales evidencias clínicas del tratamiento con fenofibrato se incluyen en la tabla 416,29.
Evidencias del tratamiento con fibratos
| Considerar el tratamiento con fibratos para la prevención primaria de la ECV en los pacientes de alto riesgo cardiovascular y en los de prevención secundaria con dislipemia aterogénica, que presentan cLDL o un c-no-HDL normales, en general, tras el tratamiento con una estatina | Evidencia clase BRecomendación IIb |
| En el paciente diabético en tratamiento con estatinas, tanto en prevención primaria como secundaria, se empleará fenofibrato si los TG son superiores a 200 mg/dL con o sin cHDL bajo | Evidencia clase B Recomendación IIa |
| La combinación fenofibrato-estatina es la de mayor seguridad entre las combinaciones disponibles de fibrato-estatina por la menor probabilidad de efectos adversos graves | Evidencia clase A Recomendación IIa |
| El fenofibrato aporta cambios en el tamaño de las partículas LDL y HDL, mejora la disfunción endotelial, tiene efectos antiinflamatorios, disminuye la trombogénesis y desempeña un papel protector de la retinopatía diabética | Evidencia clase C Recomendación: considerar en su uso |
c-no-HDL: colesterol unido a las lipoproteínas aterogénicas (colesterol total menos colesterol de las lipoproteínas de alta densidad); cHDL: colesterol de las lipoproteínas de alta densidad; cLDL: colesterol de las lipoproteínas de baja densidad; ECV: enfermedad cardiovascular; TG: triglicéridos.
Los resultados de los estudios clínicos con fenofibrato indican, además de los cambios en el perfil lipídico, otras acciones de protección vascular como el aumento de la expresión del óxido nítrico y la disminución del estrés oxidativo. Los fibratos ejercen una acción antiinflamatoria al atenuar la producción de citocinas inflamatorias. El fenofibrato complementa esta acción antiinflamatoria al reducir significativamente la proteína C reactiva, el ligando CD40, la proteína quimiotáctica-1 de monocitos y el factor estimulante de los macrófagos. Además, disminuye las concentraciones plasmáticas de fibrinógeno hasta en un 20%, los complejos trombina-antitrombina y el inhibidor del activador del plasminógeno-1. Otro importante efecto extralipídico es el enlentecimiento de la progresión de la retinopatía diabética, de forma independiente del control glucémico y lipídico. Además, estos estudios indican que el fenofibrato juega un papel protector en la nefropatía y la neuropatía diabéticas29.
Basado en estos hechos se establece el algoritmo de la figura 1 en el tratamiento de la dislipidemia aterogénica y en el control del RCV que conlleva.
Puntos de consenso en el tratamiento de la dislipidemia aterogénica- –
Los cambios del estilo de vida, una dieta hipolipidemiante con las calorías adecuadas para el control del peso, ejercicio físico y la supresión del hábito de fumar son muy eficaces en todos los pacientes y el primer paso en el abordaje de la dislipidemia aterogénica.
- –
Tras los cambios en el estilo de vida, el tratamiento inicial seguro y eficaz en la prevención cardiovascular son las estatinas.
- –
Los pacientes con hipertrigliceridemia y cHDL bajo, es decir, con dislipidemia aterogénica, se benefician de la terapia combinada de estatina con fenofibrato.
- –
Las guías de práctica clínica y la Agencia Europea del Medicamento señalan al fenofibrato para el tratamiento de hiperlipidemia mixta junto a una estatina cuando los TG y el cHDL no se encuentran adecuadamente controlados.
- –
Las evidencias sobre el beneficio clínico y la seguridad de la asociación estatina y fenofibrato son sólidas. La combinación de ambos fármacos en un solo comprimido simplifica la posología y puede facilitar el cumplimiento a largo plazo.
Este es un grupo de trabajo de la Sociedad Española de Arteriosclerosis y recibe financiación de Mylan.