Los avances en el conocimiento de la biología humana han hecho patente la complejidad de la patogenia de las enfermedades crónicas; sin embargo, sabemos que la salud no depende solo de los avances científicos y tecnológicos, sino que cada vez es más evidente el importante papel que representa, en el ámbito personal y comunitario, un estilo de vida saludable. La modificación del estilo de vida, particularmente de la dieta, es la piedra angular de la estrategia poblacional para la prevención cardiovascular y la base de la intervención individual para reducir la potencia de los factores de riesgo. Para lograr una modificación favorable de los hábitos dietéticos, es importante proporcionar tanto a la población diana como a los profesionales de la salud consejos claros, realistas y viables basados en las últimas evidencias científicas, de modo que las personas involucradas se doten de herramientas imprescindibles para mejorar su salud. Nuestro propósito es actualizar los conocimientos sobre la relación entre dieta y riesgo cardiovascular (RCV) y proporcionar al profesional sanitario una guía sencilla para trasladar las recomendaciones dietéticas sobre los principales grupos de alimentos y patrones dietéticos a la práctica clínica, definiendo unas líneas de actuación para ser trasmitidas a las personas que reciban consejo para la prevención cardiovascular que permitan optar por un patrón de alimentación saludable.
El año 2018 se publicó un documento de la Sociedad Española de Arteriosclerosis (SEA) sobre el estilo de vida y la prevención cardiovascular1, cuyos capítulos sobre dieta se actualizan aquí, considerando que los consejos dietéticos deben ser los mismos para el control de los factores de RCV y para la prevención de la enfermedad vascular arteriosclerótica, como se refleja en el reciente documento de recomendaciones de la SEA para el control global del riesgo vascular2 y en las guías de la American Heart Association (AHA) 20213. Un aspecto considerado en anteriores documentos1,4 es la modificación del concepto tradicional de unidad nutricional básica de la dieta, que eran los nutrientes, para ser ahora los alimentos, que poseen matrices complejas en las que los diferentes componentes que las integran ejercen acciones sobre diferentes vías metabólicas de forma sinérgica o antagónica y son los responsables del efecto global de la ingesta de un determinado alimento sobre la salud cardiovascular. Las variadas mezclas de distintos alimentos y sus formas culinarias integran un patrón alimentario concreto, que se considera la manera más adecuada de valorar la relación entre nutrición y salud o enfermedad.
Los conocimientos sobre la relación entre dieta y RCV están lejos de proporcionar los niveles de evidencia que se han conseguido con los ensayos clínicos con fármacos. En general los estudios clínicos aleatorizados (ECA) de intervención nutricional con objetivos de eventos clínicos son escasos, aunque de suma importancia, como el estudio PREDIMED5, un ensayo clínico pionero de prevención primaria cardiovascular, y recientemente el estudio CORDIOPREV de prevención secundaria6; ambos ECA han proporcionado evidencias del máximo nivel sobre los beneficios para la salud cardiovascular de una dieta de tipo mediterráneo enriquecida con alimentos paradigmáticos de este patrón dietético, como el aceite de oliva virgen extra (AOVE) o los frutos secos. Sin embargo, para la mayoría de alimentos y patrones dietéticos no se dispone de ECA con objetivos de eventos clínicos, por lo que debemos apoyarnos en los datos de estudios epidemiológicos de tipo observacional, sobre todo de seguimiento de grandes cohortes, y las revisiones sistemáticas y metaanálisis que sintetizan los resultados de los diferentes estudios. Por otra parte, explorar la utilidad de la dieta en la prevención cardiovascular tiene bastantes debilidades, en especial si se compara con los estudios con fármacos. Y es que no existen métodos fiables para saber con precisión lo que una persona come día a día a lo largo de los años, por la dificultad en la recogida de datos y su subjetividad; las diferencias en la composición de los alimentos en distintas épocas; la conducta frecuentemente cambiante que tienen los seres humanos a lo largo del tiempo; la falta de herramientas para garantizar la adherencia, excepto cuando se dispone de biomarcadores objetivos circulantes o en orina, lo cual no sucede para la mayoría de alimentos, etc. Sin embargo, para el estudio de la relación entre estilo de vida y RCV disponemos de una información muy valiosa, de la que carecen los ensayos farmacológicos. Se trata del conocimiento proporcionado por la tradición histórica, que permite conocer el impacto sobre la salud del estilo de vida a largo plazo de distintas poblaciones. Además, han aumentado exponencialmente los ECA que investigan la relación entre nutrición y marcadores subrogados de RCV. Algunos de ellos son de naturaleza clínica, como el peso corporal o la presión arterial (PA), y otros son bioquímicos, como el perfil lipídico, el control glucémico, el estado proinflamatorio o el estrés oxidativo, que son marcadores muy útiles de RCV y del estado de salud en general. Un novedoso estudio metaepidemiológico compara datos de estudios prospectivos y ECA con una similar exposición nutricional (de patrones dietéticos o ingesta de nutrientes) y objetivos clínicos (de enfermedad o factores de riesgo), apareando metaanálisis con el mayor grado de evidencia de ambos tipos de estudios, y concluye que las diferencias entre estudios prospectivos y ECA en los resultados agregados son menores7. Esta concordancia entre niveles de evidencia de los 2 principales métodos que la ciencia nutricional utiliza para evaluar la relación entre dieta y salud tiene un gran interés y aplicabilidad práctica; por ejemplo, si un ECA demuestra que un determinado alimento reduce la colesterolemia o la PA, podemos confiar en que su consumo a largo plazo reducirá la incidencia de enfermedades cardiovasculares (ECV).
En los últimos años varios documentos de consenso y recomendaciones de sociedades científicas han analizado la compleja relación entre la dieta y el RCV en general3 y con enfermedades cardiometabólicas, como dislipemia8, diabetes mellitus tipo 2 (DM2)9,10 e hipertensión arterial (HTA)11. El presente documento de la SEA analiza los aspectos novedosos de la compleja relación entre dieta y ECV, algunos de los cuales modifican las recomendaciones tradicionales para la prevención cardiovascular. Un buen ejemplo es que en la mayoría de estudios de cohortes no se observa una relación significativa entre el colesterol de la dieta y el RCV, por lo que se aconseja, más que limitar el aporte de colesterol a un determinado nivel8, integrar alimentos ricos en colesterol, pero también en otros nutrientes bioactivos, como son los huevos, en un patrón de dieta saludable. Así, entre los adultos sanos, particularmente en aquellos que consumen más pescado y fibra dietética, la mayor ingesta de huevos puede contribuir a mejorar el perfil lipídico12. Una serie de metaanálisis recientes confirma que el consumo de cereales integrales se asocia a un menor riesgo de DM2, mortalidad por enfermedad cardiaca coronaria (ECC), accidente vascular cerebral (AVC) y por todas las causas13; un resultado controvertido de esta serie de revisiones sistemáticas es que, cuando comparan dietas de alto y de bajo índice y carga glucémica en estudios prospectivos o ECA, no se aprecian cambios de la potencia de los factores de riesgo cardiometabólico ni de eventos cardiovasculares clínicos. Sin embargo, otro metaanálisis reciente de datos de 10 grandes cohortes contradice estos resultados al mostrar un aumento significativo de la incidencia de DM2, ECV, varios tipos de cáncer y mortalidad total con las dietas de mayor índice glucémico, en sentido inverso a los observados con un mayor consumo de cereales integrales y fibra, también analizados en este metaanálisis14. De todos modos, en el contexto de una dieta variada y saludable como la mediterránea, no hay motivos para desaconsejar el consumo de alimentos tan básicos como el pan confeccionado con harina refinada, el arroz blanco o las patatas, que nunca se consumen aisladamente, cuando su índice glucémico sería elevado, sino siempre con alimentos (el pan), o con sofritos, otras salsas o verduras (el arroz blanco y las patatas).
Otros aspectos valorados son la relación inversa entre el consumo de café y el riesgo de DM2 y el aumento de riesgo con el consumo de bebidas edulcoradas artificialmente15. Los efectos beneficiosos del café (sin azúcar) sobre la PA y el RCV, han hecho que su consumo diario sea recomendado dentro del estilo de vida para el tratamiento de la HTA12. Actualmente muchos consumidores adictos a las bebidas azucaradas, pero preocupados por el exceso de energía aportado por el azúcar añadido, las sustituyen por bebidas similares pero endulzadas con edulcorantes acalóricos, creyendo que son inocuas. Sin embargo, las evidencias sobre la relación del consumo de bebidas edulcoradas artificialmente y el RCV señalan una mayor incidencia de ECV y DM216 y un aumento de la mortalidad cardiovascular y total17, que también se observa en pacientes con DM218 y determina que este tipo de bebidas no sea recomendable.
Recientemente se ha incrementado notablemente la investigación epidemiológica en relación a los efectos sobre la salud del consumo de los alimentos llamados «ultraprocesados» según la clasificación NOVA; del mismo modo, ha aumentado la controversia sobre sus eventuales efectos adversos19. Si bien evidencias recientes confirman la asociación de su mayor consumo global con el riesgo de mortalidad total y por ECV20, no todos estos alimentos son perjudiciales21, ya que existen alimentos clasificados como ultraprocesados (cereales integrales de desayuno, yogures de frutas y otros postres lácteos) cuyo consumo se asocia a protección del riesgo de la DM222. En este sentido, por su riqueza en azúcares simples y menor contenido en fibra que la fruta natural, los zumos de fruta (sin azúcar añadido) se habían considerado perjudiciales y casi equiparado a las bebidas azucaradas industriales; sin embargo, datos recientes de estudios nutricionales con una mayor precisión sobre la exposición (por ejemplo, que sean 100% zumo de fruta sin azúcar añadido) señalan que su consumo es saludable y puede ayudar a cumplir la recomendación a la población de ingerir 5 raciones de frutas y verduras al día para una mejor salud cardiovascular y general, especialmente en la población infantil y de edad avanzada23.
Un tema actual, pero en continua evolución, es el de las dietas personalizadas y las dietas de precisión, conceptos con frecuencia intercambiables. Se sabe que las respuestas de los factores de riesgo (como el colesterol) o del riesgo vascular en sí (como el de tener un episodio cardiovascular) a los cambios de la dieta pueden variar considerablemente en diferentes individuos. Esto es debido en gran medida a interacciones con el genotipo de cada persona, pero también con su fenotipo, metabolismo y variables del estilo de vida, comportamiento, estado socioeconómico y exposición al medio ambiente24. Está claro que las recomendaciones nutricionales individualizadas (adaptadas a cada individuo) serán más eficaces para reducir la potencia de los factores de riesgo y el riesgo de enfermar que el consejo dietético genérico. Se trata de una ciencia incipiente, pero la nutrición de precisión podría tener una gran importancia futura para mejorar el RCV de grandes segmentos de la población. Aunque tal vez no seamos conscientes de ello, ya la estamos utilizando en enfermedades relativamente frecuentes de base genética: dieta sin leche en la intolerancia a la lactosa, dieta sin gluten en los celíacos, etc.25. Por tanto, existen ya dietas personalizadas fáciles de aconsejar para casos muy concretos.
Un reto que se ha planteado en los últimos años es la modificación del modelo alimentario, propugnando que los hábitos dietéticos sean saludables para la población, pero que también sean sostenibles para el planeta, siendo el paradigma una alimentación de base vegetal, con abundantes frutas, verduras, legumbres, cereales integrales y frutos secos y, sobre todo, reduciendo el consumo de carnes, a la vez que se escogen como base de la dieta alimentos de proximidad y de temporada, como en la dieta mediterránea26,27. A nivel de información al consumidor, se ha establecido en varios países europeos, incluida España, el sistema de información nutricional Nutri-Score, basado en el etiquetado frontal de los paquetes de alimentos con 5 letras y colores posibles en función de una calidad decreciente del «A» verde al «E» rojo28. El algoritmo usado para la clasificación de los alimentos tiene en cuenta su contenido por 100g en elementos o nutrientes nocivos (energía total, azúcares simples, ácidos grasos saturados [AGS] y sal) y de componentes saludables (proteína, fibra y proporciones de verduras y frutas), pero no considera el grado de procesamiento. De todos modos, el Nutri-Score es complementario con la clasificación NOVA de alimentos procesados. El algoritmo del Nutri-Score, creado en 2017, se actualizó en 2023 para permitir una discriminación mejor entre distintos productos y alinearse con las guías nutricionales para la población de los países involucrados29. La etiqueta frontal Nutri-Score de los alimentos envasados resalta su calidad nutricional, lo que ayuda al consumidor poco ducho en nutrición a escoger los alimentos más saludables en el momento de la compra. Los resultados de un reciente estudio epidemiológico español muestran que la clasificación mediante el Nutri-Score de la dieta habitual de una gran cohorte se asocia fuertemente con mortalidad total, cardiovascular y por cáncer, lo cual apoya su uso en salud pública nutricional30. Sin embargo, el Nutri-Score ha sido rechazado por algunos investigadores en nutrición españoles por no otorgar la mejor nota al AOVE, clasificado con una vergonzosa «C» en el primer algoritmo, si bien en la reevaluación más reciente ha mejorado y se le atribuye una «B».
En nuestro ámbito cultural, la dieta mediterránea tradicional, con el uso del AOVE como grasa culinaria, consumo preferente de alimentos naturales de origen vegetal, pescado y marisco, junto con una reducción de carnes rojas y procesadas, y evitando los ultraprocesados, es el patrón alimentario a la vez más saludable y sostenible31.
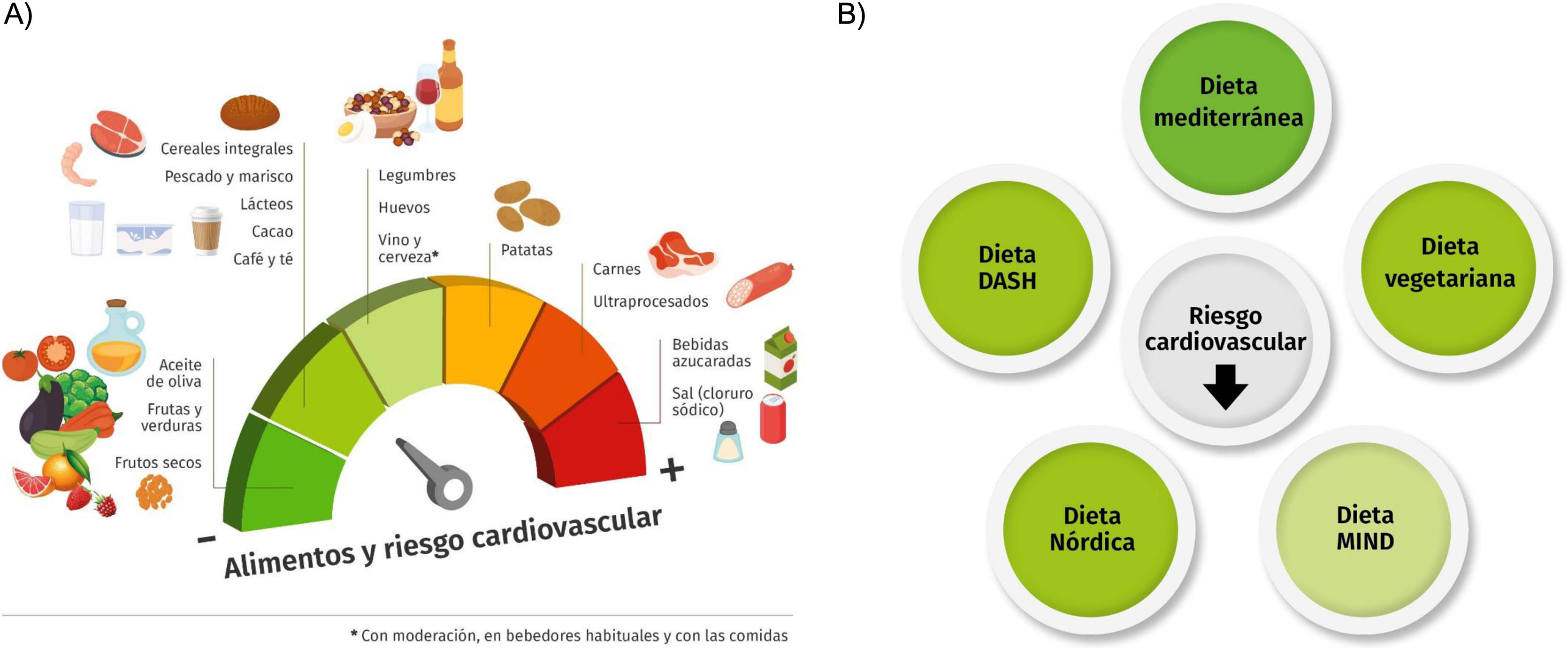
En este documento llevamos a cabo una revisión actualizada que pretende aportar evidencias útiles y jerarquizadas por niveles sobre nutrición y salud cardiovascular y general, si bien es necesario reconocer que es difícil basar recomendaciones en las categorías de evidencia clínica de uso habitual. No obstante, hemos sintetizado la evidencia disponible sobre la asociación entre alimentos y patrones dietéticos y el RCV (fig. 1) y elaborado recomendaciones utilizando ECA, cuando los hubiera, estudios observacionales sobre evidencias clínicas o marcadores subrogados y sus metaanálisis, y consensos de expertos. En síntesis, se efectúan 3 tipos de recomendaciones, incorporadas a cada capítulo: evidencia fuerte, basada en ECA, metaanálisis de grandes estudios observacionales y revisiones sistemáticas de los mismos (umbrella meta-analysis) que incorporen criterios de calidad; evidencia moderada, apoyada en estudios prospectivos de cohortes y sus metaanálisis, pero con evidencias de heterogeneidad, y en estudios de casos y controles; y evidencia débil, justificada por consensos y opiniones de expertos y estudios de cohortes pequeños o con gran heterogeneidad. En conclusión, esta guía actualizada sobre nutrición y prevención cardiovascular se dirige tanto a la población diana como a los profesionales de la salud para ayudarles a tomar decisiones bien informadas sobre las mejores opciones dietéticas para reducir el RCV, considerando que las recomendaciones son útiles a la vez en prevención primaria y secundaria de las ECV.
A) Asociación entre el consumo de diferentes alimentos y el riesgo cardiovascular. La intensidad del color refleja el nivel de evidencia, de mayor a menor en la reducción del riesgo (paneles de color verde) y de menor a mayor en el aumento del riesgo (paneles de color rojo). B) Asociación entre la adherencia a patrones alimentarios y el riesgo cardiovascular: Dieta mediterránea: evidencia fuerte; Dieta DASH: evidencia moderada; Dieta vegetariana: evidencia moderada; Dieta nórdica: evidencia moderada; Dieta MIND: evidencia débil.
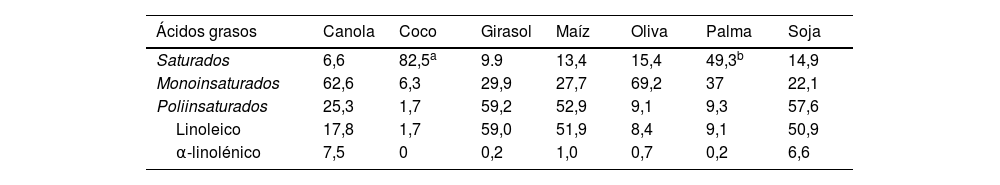
Los aceites contienen un 100% de grasa en forma de triglicéridos, si bien la composición de los ácidos grasos varía notablemente según el tipo de aceite. Estos alimentos derivan de semillas oleaginosas, como maíz, girasol, colza y soja, o de frutas como coco, palma y aceituna, y son alimentos usados a diario como grasas culinarias por grandes segmentos de la población mundial, siendo una fuente relevante de energía para sus consumidores. Algunos aceites, como los llamados tropicales por su origen (de coco y de palma), son muy ricos en AGS; otros, como los de canola (un derivado de la colza), oliva y girasol del tipo alto en oleico, contienen proporciones altas de ácidos grasos monoinsaturados (AGM); los aceites de maíz, girasol y soja son ricos en ácidos grasos poliinsaturados (AGP) n-6, particularmente ácido linoleico (C18:2 n-6), en tanto que los aceites de canola y soja contienen alrededor de un 7% de AGP n-3 (C18:3 n-3, ácido α-linolénico, el omega-3 vegetal)32 (tabla 1). Los aceites producidos por el molido de la mayoría de semillas y frutas no son aptos para el consumo; para ser comestibles y aceptables para el consumidor, deben ser refinados mediante métodos físicos o químicos, incluyendo extracción, decolorado y desodorizado, procedimientos que retienen las moléculas lipofílicas asociadas a la fracción grasa, como vitamina E y fitoesteroles, pero con los que se pierden importantes componentes hidrofílicos, como los polifenoles. El AOVE, que se obtiene por un simple prensado en frio y es, por tanto, un zumo puro de oliva, constituye una notable excepción entre los aceites culinarios, ya que contiene compuestos fenólicos muy bioactivos, sobre todo secoiridoides (oleocantal, oleuropeina, oleaceína) y alcoholes fenólicos (hidroxitirosol)34. Por tanto, el contenido en polifenoles es mucho mayor en el aceite de oliva virgen que en el refinado; la Agencia Europea de Seguridad Alimentaria (EFSA) autorizó una alegación de salud sobre los beneficios cardiovasculares del aceite de oliva con un contenido superior a 250mg/kg de polifenoles (la alegación se refiere a la protección de las LDL de la oxidación); dicho contenido es dependiente de la variedad de aceitunas empleadas para la elaboración del aceite y de su grado de maduración35.
Contenido medio de ácidos grasos de los aceites culinarios de uso habitual (gramos por 100g)
| Ácidos grasos | Canola | Coco | Girasol | Maíz | Oliva | Palma | Soja |
|---|---|---|---|---|---|---|---|
| Saturados | 6,6 | 82,5a | 9.9 | 13,4 | 15,4 | 49,3b | 14,9 |
| Monoinsaturados | 62,6 | 6,3 | 29,9 | 27,7 | 69,2 | 37 | 22,1 |
| Poliinsaturados | 25,3 | 1,7 | 59,2 | 52,9 | 9,1 | 9,3 | 57,6 |
| Linoleico | 17,8 | 1,7 | 59,0 | 51,9 | 8,4 | 9,1 | 50,9 |
| α-linolénico | 7,5 | 0 | 0,2 | 1,0 | 0,7 | 0,2 | 6,6 |
Es bien sabido que los AGS de la dieta aumentan el colesterol total y el colesterol de las lipoproteínas de baja densidad (cLDL), lo que conlleva un incremento del RCV asociado, mientras que los AGM y, sobre todo, los AGP tienen el efecto contrario36. Por tanto, el consumo frecuente de aceites ricos en AGS como los de coco y palma o el de los ricos en AGP como los de maíz y soja podría asociarse a efectos sobre el RCV perjudiciales o beneficiosos, respectivamente. Sin embargo, exceptuando el caso paradigmático del AOVE, no hay evidencias epidemiológicas o de estudios clínicos en relación a los efectos del consumo de distintos aceites sobre la incidencia de ECV. Sí hay datos de estudios clínicos sobre marcadores intermedios como los lípidos circulantes, con resultados predecibles cuando se sustituyen aceites insaturados por los de coco y palma: aumento discreto del cLDL, pero también del colesterol de las lipoproteínas de alta densidad (cHDL)37.
El aceite de oliva, la grasa culinaria característica de la dieta mediterránea, se distingue de los demás aceites no solo por disponer de una variedad virgen asequible, sino porque sus propiedades cardioprotectoras y otros efectos saludables se han evaluado en numerosos estudios de cohortes y estudios clínicos, con objetivos tanto de marcadores intermedios como de ECV. La fracción grasa está constituida principalmente por el AGM ácido oleico (C18:1 n-9), con pequeñas cantidades de tocoferoles (vitamina E) y fitoesteroles, mientras que la fracción acuosa, que se pierde con el refinado, contiene los compuestos fenólicos a los que son atribuibles gran parte de los efectos cardioprotectores del aceite de oliva virgen34. Cuando se intercambian por AGS o hidratos de carbono, los AGM disminuyen el cLDL y aumentan el cHDL36. Un metaanálisis reciente de 27 ECA comparando los efectos lipídicos del aceite de oliva con los de otros aceites vegetales sugiere que el aceite de oliva reduce menos el colesterol total, cLDL y triglicéridos que otros aceites, pero aumenta más el cHDL38. También existen evidencias de efectos beneficiosos del aceite de oliva y sus polifenoles sobre la función endotelial, inflamación y oxidación de las LDL39.
Los resultados de un reciente metaanálisis de 24 estudios prospectivos que evaluaron la exposición al aceite de oliva en relación con la incidencia de distintas enfermedades sugieren una asociación beneficiosa entre su consumo (aceite de oliva de tipo indeterminado en general), con una razón de riesgo (RR): 0,84; IC 95%: 0,76-0,94 por cada 25g/día adicionales, para la ECV; de 0,78; IC 95%: 0,69-0,87, también por 25g/día, para la DM2; y de 0,89; IC 95%: 0,85-0,93 por 25g/día, para la mortalidad por cualquier causa, pero sin asociación con el riesgo de cáncer40. Un reciente estudio prospectivo de una gran cohorte española señala que el aceite de oliva virgen, pero no el aceite común, se asocia con menor riesgo de mortalidad total y por ECV41.
Puesto que el AOVE fue uno de los alimentos claves suplementados en una de las ramas del ECA PREDIMED, que evaluó los efectos de la dieta mediterránea sobre la prevención primaria CV en individuos de alto riesgo, se dispone de evidencia científica de primer nivel sobre los efectos saludables de este aceite. Así, tras la intervención nutricional durante unos 5 años, los resultados principales demostraron que los participantes asignados a la dieta mediterránea suplementada con AOVE experimentaron una reducción media del 31% de la incidencia de ECV5. Otro ECA pionero español que evaluó los efectos de una dieta mediterránea suplementada con AOVE en comparación con una dieta baja en grasa, fue el estudio CORDIOPREV realizado en pacientes con cardiopatía isquémica establecida, que demostró una reducción de ECV entre el 25 y el 29% tras 7 años de seguimiento6. Por tanto, hay evidencias firmes del efecto cardioprotector del AOVE en el contexto de la dieta mediterránea.
MargarinasEstos alimentos son emulsiones estructuradas de agua en aceite que son estables, pueden untarse y proporcionan una sensación agradable en la boca. Su elaboración consiste en transformar un alimento líquido como el aceite en un semisólido fácil de untar. Antiguamente esto se conseguía mediante hidrogenación parcial de aceites insaturados (transformando los dobles enlaces de los ácidos grasos en simples, es decir, creando AGS), con lo cual también se originaban ácidos grasos trans (AGT). La evidencia científica aparecida en la década de los 90, en relación con el impacto nocivo de los AGT sobre los lípidos y el RCV, condujo a un notable cambio en la elaboración de margarinas, partiendo de materiales de base más saludables (aceites vegetales insaturados como soja, girasol o canola) en combinación con tecnologías que permitían la producción de productos bajos en AGS y prácticamente desprovistos de AGT (transesterificación en vez de hidrogenación), además de un mayor contenido de ácidos grasos esenciales de las series n-6 (ácido linoleico) y n-3 (ácido α-linolénico). La composición nutricional de las margarinas contemporáneas es variable respecto a la proporción de grasa y agua, que oscila entre un 20 y un 80% según sean menos o más ricas en grasa y energía. Contienen hasta un 50% de los ácidos grasos en forma de AGP, de los cuáles un 10-20% son n-3, con solo un 20-25% AGS y <1% AGT. El proceso actual de elaboración de las margarinas permite que mantengan la vitamina E ligada a la fracción grasa del aceite original y además suelen estar fortificadas con vitaminas A y D42. Al estar producidas a partir de aceites de semillas, las margarinas y otras grasas de untar de uso común, como la mayonesa, pueden ser una fuente importante de AGP n-6 (linoleico) y n-3 (α-linolénico), sobre todo en España, donde el consumo de estos ácidos grasos esenciales es más bien bajo32.
Niveles de evidencia sobre grasas comestibles y el riesgo cardiovascular
| Evidencia | Grado |
|---|---|
| • En estudios epidemiológicos, el consumo de aceite de oliva en general se asocia a una reducción de la incidencia de ECV, DM2 y mortalidad por cualquier causa | Evidencia moderada |
| • En estudios clínicos y en el contexto de la dieta mediterránea, el aceite de oliva virgen extra ha demostrado ser eficaz en la prevención de la ECV | Evidencia fuerte |
Recomendaciones
En base a la composición y efectos cardiometabólicos de los aceites vegetales de uso común, existen pocas dudas de que la variedad virgen del aceite de oliva es la más saludable, por lo que se recomienda su uso diario tanto en la cocina como en la mesa. Si se desea utilizar aceites ricos en AGP como los de maíz, soja y girasol, hay que usarlos en crudo para aderezar y no para cocinar o freír, ya que el estrés térmico causa auto-oxidación de los AGP mediada por radicales libres de oxígeno, generando aldehídos, AGT y otras moléculas pro-inflamatorias y aterogénicas43,44. En cambio, el aceite de oliva resiste bien las temperaturas de fritura debido a que contiene pocos AGP. Sin embargo, no hay que freír a temperaturas a las que el aceite humea (se quema) y degrada: 160°C para el AOVE, 215°C para el aceite de oliva virgen y 240°C para el aceite refinado. El AOVE pierde polifenoles con la fritura, pero sigue siendo rico en estos potentes antioxidantes45. Por su riqueza en AGP, las margarinas tampoco deben usarse para cocinar o freír, solo para untar.
Verduras, frutas y tubérculosLas verduras (incluyendo hortalizas), frutas y tubérculos engloban una amplia gama de alimentos vegetales caracterizados por un alto contenido de agua, rondando el 80% de su peso, así como un bajo aporte calórico y una composición de nutrientes muy similar, con algunas diferencias, como un mayor aporte de hidratos de carbono en frutas y tubérculos. Otra característica principal es el aporte de micronutrientes como vitaminas A, B, C y E, ácido fólico, minerales, compuestos fenólicos y, no menos importante, una alta cantidad de fibra. Por un lado, el aporte de vitaminas y minerales no sodio les confiere propiedades beneficiosas en enfermedades asociadas al envejecimiento, como la ECV entre otras. Además, los hidratos de carbono complejos y la fibra que contienen estos alimentos proporcionan un notable beneficio cardiometabólico.
En el consumo de estos alimentos hay que tener en cuenta los métodos culinarios de preparación ya que, en muchos casos, su incorporación en guisos, cocidos o en sofrito modifica tanto las propiedades organolépticas como su composición, ya que el cocinado implica pérdida de vitaminas hidrosolubles como las del grupo B y C, minerales e incluso compuestos fenólicos, que se disuelven en el líquido de cocción o pueden ser destruidos por el calor, sobre todo, en las frituras. Por ello, es importante favorecer su consumo de forma cruda, en ensaladas, gazpacho o salmorejo, tener en cuenta algunas recomendaciones en la preparación culinaria, como no pelar la verdura si es posible, cortar en porciones grandes, evitar tiempos prolongados de remojo o hervido, favorecer cocinado al vapor, etc. o bien evitar frituras prolongadas a alta temperatura o recalentamientos repetidos.
Verduras y frutasEn relación al consumo de verduras, son múltiples las evidencias científicas que asocian su consumo con efectos saludables a nivel cardiometabólico y de la mortalidad por ECV y por cualquier causa. Un metaanálisis reciente que incluía 81 cohortes prospectivas con más de 4 millones de participantes y un seguimiento medio de 11 años, concluía que la categoría superior del consumo de verduras en comparación con la inferior se asociaba a una reducción significativa del riesgo de ECV total, ECC y AVC, con descensos del 9, 12 y 18%, respectivamente46. En esta revisión sistemática, el consumo de ajos, zanahorias, crucíferas y vegetales de hoja verde se asociaba a mayor beneficio CV. Un reciente análisis de metaregresión de estudios de cohortes concluyó que el aumento del consumo de verduras desde cero a un nivel teórico mínimo de 306-372g/día se asociaba con reducciones del 23% del riesgo de ECC y AVC y del 26% del riesgo de DM247.
La función nutricional de las frutas es muy similar a la de las verduras, si bien se distinguen por ser alimentos más energéticos debido a su elevado aporte de hidratos de carbono, fundamentalmente en forma de azúcares simples como la sacarosa y la fructosa. Del mismo modo que las verduras, las frutas poseen una elevada cantidad de fibra, aunque esta se reduce al ser peladas o mondadas y, sobre todo, si se consumen como jugos. Los nutrientes de la fruta tienen efectos beneficiosos a nivel de factores de riesgo cardiometabólico, entre los que destaca el impacto sobre las cifras de PA y el riesgo de desarrollar HTA, ya que un consumo de 200g/día de fruta reduce de forma significativa hasta en un 8% el riesgo de HTA, apuntando a un probable efecto dosis/respuesta; en cambio, con las verduras no se encontró ninguna asociación48. Está claro que el consumo de fruta incide de forma positiva en la salud. En este sentido, un metaanálisis de estudios observacionales muestra como el incremento de 100g/día en el consumo de fruta se asoció de forma lineal con una reducción entre un 8 y un 13% del riesgo de ECV; para la mortalidad por todas las causas, se encontró una reducción significativa con el consumo de hasta 200g/día de fruta, sin mayor beneficio con consumos superiores49.
Dadas sus similares características composicionales y efectos saludables, en muchos estudios prospectivos y revisiones sistemáticas se han evaluado los efectos sobre variables de salud del consumo conjunto de verduras y frutas. En un metaanálisis reciente realizado a partir de 22 estudios prospectivos, en comparación con un consumo bajo de verduras y frutas, un alto consumo se asociaba a una reducción del 28% (IC 95%: 15-39) del riesgo de muerte por ECV50. Otro metaanálisis concluye que, en comparación con el consumo de 2 raciones/día de verduras y frutas, la ingesta de 5 raciones/día se asocia a un descenso del 12% de riesgo de muerte por ECV y del 13% del riesgo de mortalidad total51. El consumo diario de 3 raciones de verduras y 2 raciones de fruta se asociaba con la menor mortalidad, y por encima de estas dosis no había una reducción adicional del riesgo. Como en otros estudios, el mayor consumo de verduras y frutas también se relacionaba con efectos beneficiosos sobre la mortalidad por cáncer y por otras causas. El estudio PURE, que evalúa el estilo de vida y la morbimortalidad por diversas enfermedades en 80 países de los 5 continentes, corrobora que una dieta con un alto consumo de verduras y frutas es un factor esencial para reducir la mortalidad por ECV y por cualquier causa52. Sin embargo, una revisión sistemática (umbrella review) de 11 y 13 metaanálisis sobre consumo de verduras y frutas, respectivamente, concluye, con un nivel de evidencia moderado, que un mayor consumo de estos alimentos carece de efecto sobre la incidencia de DM215. En todo caso, hay abundantes evidencias que señalan el consumo de verduras y frutas como un componente clave en un patrón de dieta cardiosaludable.
Zumos y jugos de frutas y verdurasEn español el zumo es el líquido extraído directamente de frutas o verduras tras triturarlas, exprimirlas o desmenuzarlas; el zumo suele conservar la pulpa, que contiene la fibra, por lo que tiene una textura espesa y un sabor intenso. Por otra parte, el jugo es el producto de filtrar el zumo para quitar pieles, semillas y pulpa; en el jugo hay poca fibra, por lo que es más líquida que el zumo, y puede contener más azúcar. Desafortunadamente esta distinción no existe en inglés, idioma en el cual una sola palabra (juice) nombra ambos conceptos. Esto puede explicar en parte las controversias y discrepancias en la literatura médica, mayoritariamente en inglés, sobre los presuntos efectos beneficiosos o perjudiciales de los zumos o jugos. Otro motivo para los resultados dispares de estudios prospectivos a este respecto es que, excepto si se especifica zumo puro de fruta (100% fruit juice), la exposición dietética puede ser una mezcla de zumo o jugo puro y con azúcar añadido. Tradicionalmente se ha considerado que es más saludable consumir la fruta entera que el zumo; no obstante, el zumo conserva todos los nutrientes y compuestos bioactivos (fundamentalmente carotenoides, vitamina C y polifenoles) presentes en la fruta, si bien aporta menor cantidad de fibra y es una bebida rica en azúcares (los intrínsecos de la fruta) que proporciona similares calorías que las bebidas azucaradas comerciales, por lo que algunos autores lo han equiparado con las mismas en cuanto a perjuicio para la salud53.
Aunque la evidencia sobre los efectos saludables o no de los zumos/jugos de fruta es más limitada que la disponible sobre las bebidas azucaradas, varios estudios de grandes cohortes y metaanálisis han proporcionado datos al respecto, con resultados dispares. Así, hay tanto datos que sugieren que un alto consumo de zumos/jugos de fruta se asocia a mayor mortalidad total53,54, como que su efecto es neutro sobre la mortalidad51,55,56, o el riego de ECV56,57 e incluso que se asocia a reducción del riesgo de ECV total58, ECC55 y AVC46,58, si bien con un grado de evidencia generalmente bajo. Aparte de estudios prospectivos, la revisión sistemática de D’Elia et al.58 también analiza 35 ECA que comparaban los efectos sobre factores de riesgo cardiometabólico de zumos de fruta puros con una bebida control; los resultados demuestran que los zumos de fruta reducen la PA sistólica y diastólica y mejoran la función endotelial, sin cambios del peso corporal, el perfil lipídico o el metabolismo de la glucosa. En base a la revisión de 10 estudios de cohortes, este metaanálisis también sugiere que el consumo de zumo de fruta no se asocia al riesgo de DM258. Considerando todos los datos disponibles, como hace la reciente y exhaustiva revisión de Rossi et al.59, el consumo de zumos puros de verduras, hortalizas y frutas carece de efectos adversos y puede tener efectos beneficiosos sobre el riesgo cardiometabólico, que varían en función del tipo de zumo (de cítricos y otras frutas, de tomate, zanahoria o remolacha, etc.). Estas 2 revisiones58,59 hacen hincapié en que el consumo de zumos puros no se asocia a obesidad.
Ya que la población (española y global) está lejos de cumplir la recomendación de consumir 5 raciones de verduras y frutas al día, una conclusión fehaciente de la evidencia científica sobre los efectos saludables de los zumos es que el consumo de uno a 2 vasos pequeños de zumo de frutas o verduras (150 a 200ml) puede contribuir al cumplimiento de la recomendación de 5 raciones al día23. Esto sería particularmente útil y práctico en niños y personas mayores. En conclusión, actualmente no se justifica desaconsejar un consumo moderado de zumos de fruta sin azúcar añadido dentro de una dieta equilibrada, ni clasificar estas bebidas como las carbónicas azucaradas.
TubérculosLos tubérculos (patata, boniato, batata, yuca, remolacha, etc.) son engrosamientos de las raíces de ciertas plantas en cuyas células se acumulan sustancias de reserva con valor nutricional. Los tubérculos contienen un elevado porcentaje de agua, de hasta el 75%, pero también un 18% de hidratos de carbono complejos, 2-3% de proteínas, 2% de fibra, principalmente soluble, y micronutrientes como potasio, calcio, magnesio y cinc, así como vitaminas predominantemente del grupo B. También son ricos en vitamina C, aunque esta se pierde fácilmente por oxidación al procesarlas o por almacenamiento prolongado. Los métodos culinarios más aconsejados para su preparación son el vapor, el horneado o la cocción, siendo aconsejable que se cocinen con la piel para mantener en la medida de lo posible sus propiedades nutricionales. El principal tubérculo presente en nuestra dieta es la patata, que aporta 86kcal/100g. A nivel cardiometabólico, se ha atribuido a su consumo un mayor riesgo de HTA y DM2, principalmente derivado de la ingesta asociada de otros alimentos poco saludables, como aquellos ricos en grasas saturadas, o a los métodos de preparación, como la fritura comercial (con aceites de composición problemática o sometidos a recalentamientos frecuentes). En este sentido, un metaanálisis de estudios de cohortes muestran un incremento del riesgo de desarrollar DM2 de hasta el 10% asociado al consumo de patatas (sobre todo, de patatas fritas)60. Lo cierto es que la mayoría de estudios muestran un efecto neutro del consumo de patatas a nivel cardiometabólico y de otras enfermedades; así, un metaanálisis reciente que analizaba 20 estudios de cohortes no mostró ninguna asociación significativa entre su consumo y el riesgo de muerte por ECV, cáncer o por cualquier causa, siempre y cuando se preservara un método de preparación favoreciendo la cocción o el horneado61. Otro metaanálisis de 19 estudios prospectivos enfocado al riesgo de DM2 y de diabetes gestacional concluye que solo ingestas de patatas superiores a 100g/día aumentan el riesgo, mientras que los consumos inferiores tienen un efecto neutro o incluso de reducción de riesgo62.
Las patatas son un alimento básico en muchas culturas, ampliamente disponible, de bajo costo, versátil y sostenible, pero han tenido una reputación inmerecida como alimentos poco saludables, que se ha basado en gran parte por formar parte integral de la poco saludable «dieta occidental», en la que suelen consumirse fritas63, y por tener un elevado índice glucémico, un índice discutible de la calidad de los hidratos de carbono con respecto al cual metaanálisis recientes han aportado resultados divergentes en cuanto a su efecto sobre el riesgo de mortalidad por cualquier causa y la incidencia de ECC o DM213,14. En todo caso, dada su saludable composición nutricional y el hecho de que en nuestra dieta suelen consumirse con salsas y en platos combinados con verduras, las patatas no son un alimento a evitar sino una opción alimentaria saludable en cualquier patrón dietético variado y equilibrado, como la dieta mediterránea.
Niveles de evidencia sobre las verduras, las frutas y los tubérculos, y el riesgo cardiovascular
| Evidencia | Grado |
|---|---|
| • El consumo de 5 porciones diarias de verduras y frutas reduce la mortalidad global, por ECV y por cáncer, y la incidencia de ECV | Evidencia fuerte |
| • El efecto beneficioso de verduras y frutas es dosis/dependiente hasta 3 raciones de verduras y 2 de frutas al día, no aumentando más a partir de estas cantidades | Evidencia fuerte |
| • Para poder cumplir con las 5 raciones diarias de verduras y frutas, una o más raciones pueden ser zumos no azucarados, que tienen propiedades nutritivas y efectos saludables cardiometabólicos similares a los de los productos originales | Evidencia moderada |
| • El consumo de hasta 100 g diarios de patatas cocidas o asadas, preferentemente acompañadas de verduras, no incrementa el riesgo de ECV o de DM2 | Evidencia moderada |
Recomendaciones
Las evidencias existentes indican que el consumo diario de verduras y frutas es crucial por su impacto beneficioso sobre la salud, ya que reduce el riesgo de mortalidad por cualquier causa y la incidencia de ECV y de determinados procesos neoplásicos. Estos alimentos constituyen uno de los pilares básicos del modelo de la dieta mediterránea, el más saludable y arraigado en nuestra tradición culinaria. Existe un efecto dosis/respuesta de modo que los beneficios sobre la salud son máximos con un consumo diario de 3 raciones de verdura y 2 de fruta. Se recomienda un plato diario de verduras crudas (ensalada) y 2 platos de verduras hervidas, asadas o fritas en aceite de oliva virgen con poca sal, que pueden acompañarse de patatas u otros tubérculos en cantidad de hasta 100g/día. En niños y personas mayores, una o 2 raciones de verduras o frutas convencionales pueden sustituirse por zumos, preferiblemente elaborados en fresco en casa, pero que también pueden ser industriales, siempre sin azúcar añadido.
Legumbres y cerealesLegumbresLas legumbres son semillas con una alta densidad energética y un excelente valor nutricional, consumidas por la humanidad desde hace miles de años y parte integral de cualquier dieta de base vegetal, como la mediterránea. Poseen matrices complejas muy ricas en nutrientes y fitoquímicos, destinadas a sostener el crecimiento de la futura planta y proteger su ADN y así facilitar la perpetuación de la especie. Las legumbres más consumidas en la dieta española son las lentejas, las alubias, los garbanzos y los guisantes, siendo de un menor consumo las habas y la soja, una legumbre oleaginosa. En su composición predominan los hidratos de carbono complejos (almidón: 20-27%), con un alto contenido en fibra y un bajo índice glucémico, y son una buena fuente de proteína vegetal (5-9%), si bien esta tiene un valor biológico menor que la de origen animal, al carecer de algunos aminoácidos esenciales como la metionina. El contenido graso de las legumbres convencionales (no oleaginosas) es escaso (0,5-2,5%) y, entre los micronutrientes, destaca su riqueza en vitaminas del grupo B, ácido fólico, calcio, potasio y hierro no hemo; también contienen fitoquímicos bioactivos como saponinas y fitoesteroles, que reducen la absorción intestinal del colesterol, y potentes antioxidantes del tipo de los polifenoles64.
Según los datos de un reciente metaanálisis de 25 estudios prospectivos comparando extremos de ingesta de legumbres, el mayor consumo se asociaba a una reducción moderada del riesgo de ECV (RR: 0,94; IC 95%: 0,89-0,99) y de ECC (RR: 0,90; IC 95%: 0,85-0,96), sin resultados significativos con respecto al AVC65. En esta revisión se pudo efectuar un análisis dosis/respuesta sobre el riesgo de ECC, encontrando un aumento no lineal de la respuesta hasta un consumo de 400g/semana, que se asociaba a alrededor de un 20% de reducción del riesgo. También existen evidencias de un metaanálisis de 32 cohortes de que el mayor consumo de legumbres se asocia a una reducción del 6% de la mortalidad por cualquier causa y de un 9% de la mortalidad por AVC, sin efecto sobre las muertes por ECV, ECC o cáncer66. En un análisis lineal dosis/respuesta, cada 50g de aumento de legumbres se asociaba a un 6% de reducción de la mortalidad por cualquier causa. Otro metaanálisis reciente de 31 estudios de cohortes no encuentra ninguna asociación entre el consumo de legumbres y la incidencia de ECV o DM267. Por otra parte, 2 estudios prospectivos españoles basados en la cohorte del estudio PREDIMED obtuvieron resultados contradictorios para los grupos con mayor consumo de legumbres: aumento de la mortalidad total y por ECV, pero disminución de las muertes por cáncer68 y reducción de la incidencia de DM269. La discordancia de resultados de los metaanálisis65–67 y los de los subestudios PREDIMED68,69 pone de manifiesto la necesidad de más estudios que ayuden a dilucidar mejor el efecto del consumo de legumbres sobre la salud cardiovascular y la DM2.
El aparente beneficio cardiovascular de las legumbres que sugieren la mayoría de estudios epidemiológicos se sustentaría en evidencias de ECA sobre su impacto en factores de riesgo cardiometabólico. La revisión sistemática de Thorisdottir et al.67 también analizaba 15 ECA de dietas de legumbres frente a dietas control evaluando efectos sobre factores de riesgo, y concluía que las legumbres reducían modestamente el cLDL, la glucemia y el HOMA-IR y carecían de efecto sobre el cHDL, los triglicéridos y la insulinemia en ayunas. Con respecto a la PA, el efecto de las legumbres es controvertido, habiéndose descrito un beneficio solo en individuos con sobrepeso u obesidad70.
A pesar de los hallazgos cuestionables de los metaanálisis citados, con dudas sobre si sus efectos sobre ECV y DM2 son neutros o beneficiosos, ningún gran estudio prospectivo ha descrito que el consumo de legumbres sea nocivo para la salud. Por el menor tamaño muestral del subestudio PREDIMED, el mayor riesgo de mortalidad total y por ECV de las legumbres debe considerarse como una excepción no confirmada68. Las evidencias de ECA también apuntan a un beneficio cardiometabólico de las legumbres67. Estos alimentos suelen conservarse como semillas desecadas, en cuyo caso su preparación culinaria requiere rehidratación mediante remojo durante 8-12h; su consumo principal se realiza tras cocción o como guarnición en caso de consumo en forma fresca. En base a las evidencias apuntadas y a la excelente densidad nutricional de las legumbres, se recomienda un consumo mínimo de 2 raciones semanales (200g) y, a ser posible, 4 raciones por semana.
Niveles de evidencia sobre legumbres y el riesgo cardiovascular
CerealesLos cereales, las semillas comestibles de las gramíneas, como el trigo, el arroz, el maíz, la cebada, la avena, el centeno, etc., son la principal fuente de energía de la población humana a nivel planetario. Esto es así por su riqueza en hidratos de carbono complejos (65-75% de su peso) y un contenido moderado en proteínas (3-16%), si bien son biológicamente incompletas por ser deficitarias en lisina y, en el caso del maíz, en triptófano. Además, los cereales contienen poca grasa (1-6,5%, mayoritariamente insaturada) y, como otras semillas, cuando son de grano completo o integrales, son ricas en fibra, vitaminas del grupo B, vitamina E, minerales no sodio (potasio, calcio, magnesio, fósforo, hierro, cinc y silicio) y otros fitoquímicos con actividad antioxidante (polifenoles)64. Los cereales integrales conservan, en la misma proporción que el grano intacto, los 3 componentes del cereal (salvado, endospermo y germen). El refinado industrial de los cereales da lugar a productos ricos en almidón y proteínas, con una buena digestibilidad y un sabor agradable tras el cocinado (arroz blanco), o la elaboración de derivados de la harina (pan blanco), pero en este proceso se pierden la mayoría de vitaminas, minerales y fitoquímicos saludables, que se encuentran en la capa protectora externa (salvado) o el germen (embrión).
El consumo de cereales tiene un efecto favorable sobre la salud, especialmente si son de grano entero. Así, un metaanálisis de 48 ECA que comparaban cereales refinados frente a integrales para evaluar efectos en variables de control glucémico concluyó que estos conseguían reducciones significativas de la glucemia, insulinemia, hemoglobina glucosilada (HbA1c) y HOMA-IR71. En concordancia con este efecto beneficioso sobre el metabolismo de la glucosa, la umbrella review de Neuenschwander et al.15 de 12 metaanálisis que evaluaban la asociación del consumo de cereales integrales con el riesgo de DM2 concluye con un alto grado de evidencia que el incremento en la ingesta de 30 g/día de cereales integrales y de 10 g/día de fibra procedente de estos alimentos se relaciona con una reducción del riesgo de DM2 de un 13 y un 15%, respectivamente. En esta misma revisión, un mayor consumo de cereales refinados en 14 metaanálisis tenía un efecto neutro sobre la incidencia de DM2. Con respecto al control lipídico, un metaanálisis en red de 55 ECA comparando distintos cereales y salvados concluyó que solo el salvado de avena y la avena integral, que se caracterizan por su riqueza en fibra soluble (beta-glucanos), tenían efecto hipocolesteromiante, con descensos medios del cLDL de alrededor de 10mg/dl72. El consumo de cereales integrales también se ha asociado a un menor riesgo de ECV incidente, como indica un metaanálisis de estudios observacionales en el cual, por cada aumento de 30g/día, el riesgo de ECV, ECC, AVC y mortalidad por cualquier causa se reducía en un 8, 6, 2 y 6%, respectivamente, con un efecto dosis/respuesta en el que un mayor consumo se asociaba con una mayor reducción del riesgo73. Del mismo modo, el ya citado metaanálisis de estudios observacionales de Bhandari et al.50 mostraba como un alto consumo de cereales integrales se asociaba a una reducción del 13% del riesgo de muerte por ECV (HR: 0,87; IC 95%: 0,80-0,95).
Un componente esencial de los cereales de grano entero es la fibra alimentaria, a la que pueden atribuirse en parte los efectos beneficiosos de su consumo regular. Está constituida por hidratos de carbono resistentes a la digestión y absorción en el intestino delgado, que fermentan de forma parcial o total en el colon. Su naturaleza química es heterogénea (polisacáridos, oligosacáridos, lignina y sustancias análogas) y puede ser soluble o insoluble. Su presencia es importante en los cereales integrales (en el trigo y maíz es mayoritariamente insoluble, mientras que en la avena y cebada es sobre todo soluble). Los cereales integrales contienen hasta 20g/100g de fibra insoluble, eficaz para combatir el estreñimiento y regular el tránsito intestinal, mientras que la forma soluble favorece el control del colesterol y la glucemia. Al aumentar la saciedad, ambos tipos de fibra ayudan a controlar el peso corporal; un metaanálisis de ECA en pacientes con DM2 concluye que el consumo de fibra modula favorablemente la microbiota, el perfil lipídico, la proteína C-reactiva y la adiposidad74. Existen evidencias de alto nivel de que la fibra de cereales integrales se asocia fuertemente a una menor incidencia de DM2, con una HR: 0,75; IC 95%: 0,65-0,86 por aumento de 10g/día, en contraposición con la falta de efecto de la fibra de las verduras15. También hay evidencia de un metaanálisis reciente de 64 estudios prospectivos que asocian el consumo elevado de fibra con una reducción significativa de mortalidad por todas las causas, por ECV y por cáncer en un 23, 26 y 22%, respectivamente75. Los completos metaanálisis de Reynolds et al.13 confirman los efectos beneficiosos de la fibra sobre factores de riesgo cardiometabólico y mortalidad por todas las causas, ECV y cáncer. Estos autores sugieren que la consistencia entre los hallazgos de ECA y de estudios prospectivos, junto con las relaciones dosis/respuesta, apoyan una relación causal entre el consumo de fibra y los efectos favorables sobre mortalidad e incidencia de ECV, DM2 y cáncer. El metaanálisis reciente de Jenkins et al.14 confirma los efectos beneficiosos de los cereales de grano entero y la fibra. Por tanto, numerosas evidencias señalan que la fibra de la dieta, y particularmente la de los cereales es un componente esencial de una dieta cardiosaludable.
La quinoa, la chía y el alforfón (trigo sarraceno) son seudocereales cuyas semillas son de los pocos alimentos vegetales ricos en proteínas de alta calidad que, a diferencia de los cereales, contienen todos los aminoácidos esenciales, en una proporción entre el 12 y el 20%. También contienen péptidos bioactivos y más grasa que los cereales (alrededor de un 5%), predominando los AGP como el ácido linoleico. Además, son ricos en fibra y micronutrientes saludables, como vitaminas, minerales no sodio, fitoesteroles, polifenoles y otros antioxidantes. Su consumo ayuda al control de peso por su efecto saciante y tiene efectos favorables sobre los factores de riesgo cardiometabólico, si bien por ahora su consumo limitado hace que no se disponga de datos epidemiológicos sobre sus efectos en la salud cardiovascular; además, los seudocereales carecen de gluten, por lo que son recomendables en los pacientes celíacos76.
Niveles de evidencia sobre cereales y el riesgo cardiovascular
| Evidencia | Grado |
|---|---|
| • El consumo de cereales integrales y de la fibra derivada de los mismos favorece un mejor control glucémico y se asocia a una reducción del riesgo de DM2 | Evidencia fuerte |
| • El consumo de una dieta rica en cereales integrales o su fibra mejora el perfil lipídico, ayuda en el control del peso corporal y se asocia a una reducción del riesgo de ECV total, ECC, AVC y de la mortalidad por ECV y cáncer | Evidencia moderada |
Recomendaciones
Para promover la salud CV y ayudar a reducir los factores de riesgo cardiometabólico, particularmente el control glucémico, el consumo recomendado de cereales es de unas 4 raciones/día, incluyendo pan en todas las comidas del día, pasta 2-3 veces/semana y arroz 2-3 veces/semana. Se aconseja consumir pan integral, pero en la dieta mediterránea se suele consumir pan blanco y raramente se usan el arroz o la pasta integrales; sin embargo, no consumimos los cereales refinados de forma aislada, sino con otros alimentos (el pan), en platos combinados (como la paella) o mezclados con sofrito, lo que aumenta su palatabilidad y reduce su índice glucémico, a la vez que permite consumir más verduras y hortalizas. Es interesante la sabia costumbre de nuestra dieta de asociar cereales y legumbres en la misma comida (por ejemplo, arroz con lentejas), lo que supone completar los aminoácidos deficitarios en cada alimento, resultando en una mezcla completa de proteínas de alto valor biológico. El consumo de ambos tipos de alimentos muestra un beneficio contrastado a nivel cardiovascular y además aporta fibra, otro componente esencial de una dieta saludable.
Huevos, carnes y pescadoHuevosLa elaboración de platos con huevos, especialmente de gallina (fritos en aceite de oliva, revueltos, en tortilla de patatas o como acompañamiento de ensaladas) forma parte de la cultura gastronómica mediterránea. En la composición de los huevos destacan la ovoalbúmina, proteína de alto valor biológico que contiene todos los aminoácidos esenciales, minerales (selenio, fósforo, yodo y cinc), vitaminas (A, D, B2, B12, ácido pantoténico y niacina) y otros carotenoides, como la luteína y su isómero la zeaxantina, cuya ingesta se asocia a mejoras en la sensibilidad a la insulina, el estrés oxidativo y la inflamación y son pigmentos estructurales de la retina, muy importantes para la salud ocular. Los huevos también contienen péptidos inhibidores de la alfa-glucosidasa, de la dipeptidil-peptidasa y de la enzima convertidora de angiotensina, con potencial efecto antidiabético y antihipertensivo77. Los huevos son una importante fuente de colina, nutriente esencial implicado en la formación de las membranas celulares y del que hay que asegurar un adecuado aporte dietético en mujeres gestantes, ya que su carencia puede provocar defectos en el tubo neural del feto. La grasa del huevo supone un 11% de la porción comestible, está en la yema y se compone básicamente de triglicéridos y colesterol, conteniendo unos 200-230mg de colesterol por unidad (350-385mg/100g), con un aporte de AGS de 3g/100g, inferior al de grasa insaturada: AGM (5g/100g) y AGP (1,2g/100g)32.
Por su riqueza en colesterol, el consumo de huevos se ha relacionado tradicionalmente con un incremento del colesterol total y del cLDL, y ha sido una de las razones para su restricción en las recomendaciones dietéticas para la prevención cardiovascular. No obstante, existe una amplia variabilidad en la absorción intestinal del colesterol. que oscila entre el 29 y el 80%, dependiente de la actividad del receptor Niemann-Pick C1-like-1 presente en los enterocitos, que modula la captación de colesterol78. El consumo de huevos ocasiona un discreto incremento del colesterol total y cLDL, con una producción predominante de LDL grandes y poco aterogénicas, así como un aumento del cHDL que parece coincidir con mejoras en su funcionalidad, no incrementando los cocientes aterogénicos, como el cLDL: cHDL, ni la trigliceridemia8,79.
Un estudio que agrupó a 177.000 participantes de 3 grandes cohortes comprendiendo 50 países no encontró ninguna asociación significativa de la ingesta de huevos con el incremento de los lípidos en sangre, la PA, la incidencia de ECV o la mortalidad cardiovascular80. Otro estudio de amplia base poblacional realizado en China observó que el consumo de un huevo diario en comparación con el no consumo se asociaba a menor riesgo de ECV (HR: 0,89; IC 95%: 0,87-0,92) y de AVC isquémico (HR: 0,90; IC 95%: 0,85-0,95) y hemorrágico (HR: 0,74; IC 95%: 0,67-0,82)81. Un metaanálisis de 23 estudios prospectivos no encontró ninguna relación significativa entre el consumo de huevos y un mayor RCV (HR: 0,99; IC 95%: 0,93-1,06)82, y estos resultados fueron similares a los de otro metaanálisis que analizó 24 estudios observacionales83 y a los datos mostrados en una reciente revisión de la AHA en su documento de recomendaciones sobre el colesterol de la dieta8. En la cohorte española del estudio EPIC con 40.621 individuos seguidos durante 18 años, tampoco se encontró una asociación significativa con la mortalidad por ECV y por todas las causas cuando se comparó el cuartil de mayor consumo con el de menor consumo de huevos84.
No obstante, no todos los resultados son homogéneos En el seguimiento de 6 cohortes norteamericanas, se observó una asociación directa entre la ingesta de huevos y el riesgo de ECV y mortalidad por todas las causas, con razones de riesgo de 1,06; IC 95%: 1,03-1,10 y 1,08; IC 95%: 1,04-1,11, respectivamente, por cada medio huevo adicional por día; sin embargo, la relación dejó de ser significativa tras ajustar por el consumo dietético de colesterol85. Otro metaanálisis describió que el mayor consumo de huevos se asociaba a un discreto incremento de la mortalidad por ECV y por todas las causas, pero en el análisis de subgrupos por áreas geográficas, el aumento del riesgo por el consumo de huevos se encontró en cohortes estadounidenses, con cifras límite en las europeas y sin riesgo en las asiáticas86. También se ha descrito que el consumo de huevos se asocia a menor riesgo de ECV. Así, en otro gran metaanálisis reciente que analizó 39 estudios prospectivos con cerca de 2 millones de individuos, se observó una reducción de la incidencia de ECV con el consumo de hasta un huevo al día, con una RR: 0,94; IC 95%: 0,89-0,9987.
En un análisis agregado de cohortes estadounidenses aparece una relación entre la ingesta de huevos y el incremento de riesgo de DM2, pero esta asociación no se presenta en otros estudios europeos y asiáticos88, lo que plantea que las formas culinarias de preparación de los huevos o los alimentos que los acompañan (p. ej., distintos tipos de aceite, patatas fritas) puedan influir en los resultados divergentes en distintas cohortes89.
En resumen, parece que en la población general una mayor ingesta de huevos tiene un efecto neutro o de beneficio modesto sobre el RCV, en tanto que en participantes con DM2 los estudios observacionales suelen mostrar un incremento del RCV, mientras que los ensayos clínicos no demuestran ningún efecto adverso90. No existen pues, suficientes argumentos para restringir el consumo de unos alimentos tan nutritivos y versátiles como los huevos con el objeto de reducir el RCV o mejorar el control metabólico11, y se pueden disfrutar como parte de una dieta saludable8,91.
Niveles de evidencia sobre huevos y el riesgo cardiovascular
| Evidencia | Grado |
|---|---|
| • El consumo de huevos no es perjudicial y puede formar parte de una dieta saludable. No hay suficientes argumentos para restringir su consumo con el objeto de reducir el RCV o mejorar el control metabólico | Evidencia moderada |
| • Tanto la población general sana como las personas con factores de riesgo, ECC previa o DM2 pueden consumir hasta un huevo al día sin incrementar su RCV | Evidencia débil |
Como el pescado y los huevos, las carnes son alimentos ricos en proteínas de alto valor biológico, pero aportan una cantidad relativamente elevada de AGS, predominantemente palmítico (C16:0) y esteárico (C18:0), si bien de igual modo son una fuente importante de AGM32. Contienen además colesterol, pero también otros nutrientes beneficiosos (vitaminas como la B12 y la niacina y minerales, como hierro, potasio, fósforo, selenio y cinc). El contenido graso de las diferentes carnes es variable, siendo menor en las llamadas carnes blancas (aves de corral y conejo), que no tienen color rojo por contener poca mioglobina, que en las carnes rojas y menor en el cerdo que en la ternera o el cordero. Además, el contenido graso está muy influido por su origen anatómico, siendo en el caso del cerdo menor en el lomo que en la costilla o la panceta. En el cordero es menor en la pierna que en las chuletas, y en la ternera el contenido graso de la falda o vacío cuadruplica el del solomillo. Otro factor determinante es el tipo de alimentación del animal, lo que modifica tanto la cantidad como la calidad de su grasa. El ganado bovino alimentado con pasto contiene menos grasa intramuscular que el alimentado con pienso, pero además la calidad de la grasa varía entre especies, ya que los cambios inducidos por la dieta son menores en rumiantes que en animales con estómago único, como el cerdo y las aves, porque en el rumen la acción microbiana convierte los ácidos grasos insaturados de la dieta en AGS. La carne magra de cerdo presenta un elevado porcentaje de AGM (ácido oleico), que constituye el 44% de los ácidos grasos totales de la grasa de cerdo blanco y el 49% en el caso del cerdo ibérico, ambos alimentados con pienso, siendo el contenido mayor (55%) en el cerdo ibérico alimentado con bellota (que aporta a su dieta una mayor riqueza de grasa insaturada).
En la dieta omnívora se consumen 2 tipos de carne roja, la carne roja «natural» (no procesada) y los derivados de carne (carne procesada), como salchichas, beicon, fiambres y embutidos, que en estudios epidemiológicos suelen tener efectos distintos sobre la salud cardiovascular y la diabetes. Las carnes procesadas contienen las mismas proporciones de AGS y colesterol que las rojas no procesadas, pero son menos saludables porque se han elaborado mediante salazón, curado, fermentación, ahumado u otros procesos con el fin de preservarlas y potenciar su sabor, por lo que suelen contener sal y aditivos del tipo de los nitritos, nitratos y nitrosaminas32.
Las evidencias de estudios epidemiológicos recientes sobre el consumo de carnes y el riesgo de ECV, DM2 y mortalidad son controvertidas. Tras analizar 43 estudios observacionales de ECV y 27 de DM2, una revisión sistemática y un metaanálisis muestran que el consumo de carne roja no procesada (por un incremento de 100g/día) se asocia con un aumento del riesgo de ECV del 11%; IC 95%: 5-16 y el de carne roja procesada (por incremento de 50g/día) con un aumento mayor, del 26%; IC 95%:18-35, con asociaciones similares con el riesgo de DM292. En relación al riesgo específico de ECC, otro metaanálisis concluye que el consumo de carne roja no procesada (por aumento de 50g/día) se asocia a un aumento del RR del 9%; IC 95%: 6-12, mientras que por un aumento de consumo equivalente, la carne procesada se asocia a un incremento del riesgo del 18%: IC 95%: 12-25, en tanto que la carne blanca no incrementa el riesgo93. Los hallazgos de otro metaanálisis indican que la ingesta de carne blanca no aumenta el riesgo de ECV, de mortalidad cardiovascular o de DM294.
En todo caso, según las conclusiones de un metaanálisis reciente de 37 estudios prospectivos95 y la umbrella review de 29 revisiones y metaanálisis97, podemos afirmar que existe una evidencia débil de la asociación entre el consumo de carne roja no procesada y el riesgo de ECV, DM2 y mortalidad por estas causas, que impide hacer recomendaciones firmes. La revisión de Hill et al.96 sugiere que la ingesta de carne procesada se relaciona de forma consistente con un mayor riesgo de DM2, pero encuentra una evidencia débil de una asociación entre este tipo de carne y el riesgo de ECV. Por otra parte, el consumo de carne roja tiene un efecto despreciable sobre el perfil lipídico97, el control glucémico98 o la inflamación97,98. En el procesado industrial de la carne es común la cocción a alta temperatura, que puede producir aminas heterocíclicas e hidrocarburos aromáticos policíclicos, que incrementan el RCV99; estas moléculas nocivas también se producen en el braseado, sobre todo si existe ennegrecimiento de la carne.
Al valorar las fuentes de proteínas de la dieta, hay que considerar que la sustitución isocalórica de carne roja y carne procesada por otras fuentes de proteína animal como el pescado azul, yogur, queso o huevos se asocia con un 15-24% de reducción del riesgo de ECC100. Del mismo modo, reemplazar la carne roja y/o procesada por carne de aves de corral se asocia inversamente con el RCV101, lo cual sugiere que es una alternativa más saludable al consumo de carnes rojas o procesadas. En definitiva, un patrón alimentario con menor ingesta de carne roja parece reducir el RCV, especialmente si se sustituye por otras fuentes de proteína animal100,101 y en particular de proteína vegetal, como los frutos secos y las legumbres102, a la vez que contribuye a la sostenibilidad ambiental debido a la notable huella de carbono y consumo de agua derivados de la producción de carne roja103.
Niveles de evidencia sobre carnes y el riesgo cardiovascular
| Evidencia | Grado |
|---|---|
| • El consumo de carne procesada (salchichas, fiambres, embutidos, etc.) se relaciona con mayor riesgo de ECV, DM2 y mortalidad por cualquier causa, por lo que se desaconseja su consumo excepto de modo ocasional | Evidencia moderada |
| • La carne no procesada debe consumirse de forma moderada, hasta un máximo de 3-4 veces por semana, de preferencia aves de corral, carnes rojas magras y carnes blancas, retirando la grasa visible antes de cocinarlas. Con el objeto de mejorar la sostenibilidad de la dieta y reducir su huella de carbono, es conveniente reducir el consumo de carnes e incrementar el de alimentos ricos en proteínas de origen vegetal | Evidencia débil |
El pescado y el marisco son la fuente dietética fundamental de AGP n-3 de cadena larga, que incluyen el ácido eicosapentaenoico (EPA, C20:5n-3) y el ácido docosahexaenoico (DHA, C22:6n-3), que abundan en la carne del pescado azul (sardina, anchoa, atún, arenque, caballa, salmón, trucha, etc.), mientras que la carne del pescado blanco (bacalao, merluza, rape, lenguado, gallo, etc.) y el marisco contienen cantidades inferiores32. Estos ácidos grasos se acumulan en el hígado de los peces, siendo el de bacalao la materia prima habitual para obtener el aceite de pescado, un concentrado de AGP n-3. En general el pescado salvaje contiene más AGP n-3 que el procedente de piscifactoría, que depende del tipo de alimentación que reciba y varía en función de la estacionalidad, con mayor contenido graso en verano.
Los beneficios del consumo de pescado, especialmente el azul, suelen atribuirse a su riqueza en AGP n-3, que inducen múltiples efectos cardiometabólicos favorables104, resumidos en la tabla 2, pero otros nutrientes del pescado y marisco (aminoácidos como la taurina, minerales como potasio, magnesio, calcio, fósforo, selenio, yodo, hierro y cinc, y vitaminas como la riboflavina y vitamina D) también pueden contribuir a su efecto sobre la salud cardiovascular.
Efectos cardiometabólicos beneficiosos de los AGP n-3
| - Reducción de los triglicéridos circulantes (en dosis farmacológicas de >3g/día)- Disminución de la producción de LDL pequeñas y densas y aumento de LDL grandes y ricas en colesterol (menos aterogénicas) |
| - Mejoría de la función endotelial- Reducción de la presión arterial (en dosis farmacológicas)- Efecto antitrombótico- Reducción de la agregación plaquetaria- Aumento de la estabilidad de la placa de ateroma |
| - Efecto antiinflamatorio |
| - Disminución de la resistencia a la insulina |
AGP: ácidos grasos poliinsaturados; LDL: lipoproteínas de baja densidad
Es importante distinguir entre los efectos cardiovasculares de los suplementos de aceite de pescado o de dosis farmacológicas de AG n-3 y los del consumo de pescado y marisco como alimentos naturales.
Los suplementos de AGP n-3, en formulaciones farmacológicas de combinaciones variables de EPA y DHA o como aceite de pescado, se han utilizado en numerosos estudios clínicos con el objetivo de reducir el RCV, pero en general no se han demostrado efectos beneficiosos. Una notable excepción fue el estudio REDUCE-IT105, un gran ensayo clínico aleatorizado efectuado en pacientes con hipertrigliceridemia moderada (triglicéridos entre 135 y 499mg/dl) de alto riesgo CV por tener ECV establecida o DM2 y factores de riesgo adicionales tratados con estatinas y con un cLDL bien controlado. En este estudio un suplemento de AGP n-3 en forma de icosapento de etilo, un éster etílico de EPA altamente purificado, en dosis de 4g/día, comparado con placebo (aceite mineral) redujo un 25% la incidencia de ECV (HR: 0,75; IC 95%: 0,68-0,83) tras un seguimiento de 4,9 años105. En este estudio se constató una reducción media del 20% de los triglicéridos, que no se relacionó con la reducción de eventos de ECV. Otros grandes estudios clínicos que emplearon formulaciones mixtas de EPA/DHA, en dosis de 1 a 4g/día, observaron reducción de los triglicéridos, pero no del riesgo de ECV106. Estos resultados discordantes a pesar de una similar reducción de la trigliceridemia son atribuibles a diferencias de acción entre EPA y DHA sobre la membrana celular y la función endotelial; una mayor concentración de EPA durante el tratamiento con icosapento de etilo se asocia a efectos antioxidantes, antiinflamatorios y de estabilización de la placa superiores a los del DHA que, más allá de la disminución de la trigliceridemia, pueden influir en la reducción del riesgo CV104,106. El EPA, pero no el DHA, también se ha mostrado eficaz para reducir el riesgo de ECV en pacientes con DM2107. Un efecto adverso insospechado del tratamiento con dosis altas de AG n-3, incluido el icosapento de etilo, es la aparición de fibrilación auricular, con mayor frecuencia si se usan dosis >1g/día108. Excepto en casos especiales de alto RCV residual, en los cuales puede estar indicado el icosapento de etilo, no se aconsejan los suplementos de AG n-3 para la prevención CV.
En relación con la ingesta de la fuente natural de EPA/DHA, una reciente revisión sistemática de 24 estudios observacionales muestra que el mayor consumo de pescado no frito se relaciona directamente con un menor RCV y de infarto de miocardio109, y un metaanálisis reciente concluye que una ingesta semanal de 2 a 3 raciones de pescado (150g/ración) reduce moderadamente el RCV (RR: 0,93; IC 95%: 0,91-0,96)110. El seguimiento de 3 grandes cohortes de pacientes con antecedentes de ECV observó menor riesgo CV (HR: 0,84; IC 95%: 0,73-0,96) y de mortalidad total (HR: 0,82; IC 95%: 0,74-0,91) entre aquellos con una ingesta de 2 raciones (unos 175g) semanales de pescado frente a los que consumían menos de 50g al mes. El consumo de pescado azul, pero no de otras clases de pescado, se asoció de forma significativa con menor riesgo de ECV, con una reducción del 6% por cada incremento de 5g de ingesta en pacientes con ECV previa, pero no en población sana111. De la misma forma, un metaanálisis reciente también muestra que el beneficio cardiovascular de la ingesta de pescado es atribuible solo al pescado azul, con una relación inversa entre su consumo y la mortalidad cardiovascular (RR: 0,83; IC 95%: 0,70-0,98) y por cualquier causa (RR: 0,97; IC 95%: 0,94-0,99), sin efecto del pescado blanco112. Otro metaanálisis confirma que la mayor ingesta de AGP n-3 a partir de pescado azul se asocia a una disminución de la mortalidad cardiovascular (RR: 0,87; IC 95%: 0,85-0,89)113. En la mayoría de estudios prospectivos y metaanálisis el consumo de pescado se asocia a una discreta reducción del riesgo de ECV total y ECC, pero los datos sobre AVC son contradictorios.
Recientemente, un gran estudio con datos agregados de más de 180.000 participantes de 29 cohortes internacionales ha descrito una asociación inversa entre las concentraciones circulantes de EPA y DHA (un biomarcador objetivo de su ingesta) y el riesgo de AVC isquémico, con un 18 y 14% de reducción comparando mayores y menores concentraciones de EPA y DHA, respectivamente114. Un beneficio nada desdeñable podría obtenerse cuando el pescado sustituye a la carne como plato principal en las comidas, lo que otorga a la dieta una fuente saludable de proteínas y contribuye a una reducción notable del riesgo coronario100. Todas estas evidencias avalan la recomendación de consumir al menos 2 raciones semanales de pescado, preferentemente azul3.
La presencia en los peces de contaminantes (como metil-mercurio, dioxinas y bisfenoles policlorados) ha sido un motivo de preocupación sobre la seguridad de su consumo, dado que el efecto protector del pescado sobre el RCV parece verse mitigado por la exposición a los bisfenoles policlorados115. No obstante, en el seguimiento de la cohorte del estudio PREDIMED, el beneficio del consumo de pescado compensaba con creces el riesgo potencial de los contaminantes116, que abundan más en peces como la caballa, el pez espada, el cazón, el atún rojo y el tiburón.
Niveles de evidencia sobre pescado, marisco y el riesgo cardiovascular
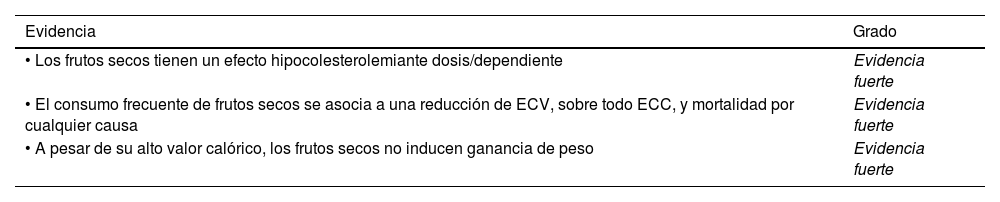
| Evidencia | Grado |
|---|---|
| • Es recomendable la ingesta de pescado o marisco al menos 3 veces por semana, 2 de ellas en forma de pescado azul, para reducir el riesgo de ECV total y mortalidad cardiovascular y por cualquier causa. La sustitución de carne por pescado como plato principal en las comidas proporciona un beneficio proporcionalmente mayor | Evidencia moderada |
| • Aunque el pescado (especialmente los peces de mayor tamaño y depredadores) puede contener contaminantes como el metil-mercurio, en el contexto de una dieta de tipo mediterráneo el beneficio del consumo de pescado parece exceder el riesgo potencial de la exposición a contaminantes. No obstante, las mujeres embarazadas y los niños deben evitar consumir pescado potencialmente contaminado, como el atún rojo, el cazón, el pez espada y la caballa | Evidencia moderada |
| • No es aconsejable el consumo de preparados comerciales de aceites de pescado, que pueden contener otros aditivos y grasas añadidas | Evidencia moderada |
La función natural de la leche es alimentar las crías de los mamíferos y sustentar su crecimiento, por lo que contiene todos los nutrientes esenciales además de variadas hormonas anabólicas. La leche y derivados (productos lácteos) son alimentos complejos, que aportan (por 100ml) macronutrientes como hidratos de carbono (5g), proteínas y grasas (unos 3g cada uno) y minerales como potasio, fósforo, magnesio y calcio117. La mayor parte de la grasa láctea está formada por unos AGS característicos de cadena impar, los ácidos pentadecanoico (C15:0) y heptadecanoico (C17:0). Además de ser la fuente dietética más importante de calcio (116mg/100ml), los lácteos aportan micronutrientes como la vitamina D, cuyo déficit se ha asociado con diversas enfermedades, desde problemas de salud mental al cáncer, aunque la única evidencia científica clara es la que lo relaciona con la osteoporosis. Sin embargo, en estudios de intervención la suplementación con vitamina D no ha mostrado beneficios cardiovasculares frente a placebo118,119. Respecto al calcio, su suplementación tampoco ha evidenciado efecto sobre la ECV o la mortalidad por todas las causas120.
Otro beneficio potencial sobre la salud cardiovascular de los lácteos se deriva de la presencia de péptidos vasoactivos, con efecto antihipertensivo debido a la inhibición de la enzima convertidora de angiotensina121. Un metaanálisis establece una relación entre el consumo total de lácteos y un bajo riesgo de HTA122, que en otro metaanálisis de estudios de cohortes aparece para la ingesta de lácteos bajos en grasa, leche y lácteos fermentados, con reducciones medias de riesgo de 14, 6 y 5%, respectivamente123. Por otra parte, diversos estudios epidemiológicos han concluido que las concentraciones plasmáticas de los ácidos grasos C15:0 y C17:0, específicos de la leche, se asocian con una reducción del riesgo de ECC y DM2124. Un metaanálisis de 16 estudios prospectivos muestra que las concentraciones circulantes o en tejido adiposo de C15:0 y C17:0 y de un ácido graso trans que se encuentra en los lácteos de forma natural, el trans-palmitoleico, se relaciona de forma inversa con el riesgo de DM2125 y otro metaanálisis de estudios observacionales encuentra que la concentración más elevada de esos 2 AGS de cadena impar se asocia a un menor RCV126. Estos biomarcadores están siendo utilizados para estudiar la influencia del consumo de la grasa láctea sobre la salud cardiometabólica127.
Independientemente de su contenido graso, los lácteos influyen poco sobre la colesterolemia y la adiposidad122,128, y hay evidencias consistentes de que, sean enteros o bajos en grasa, su consumo no incrementa el RCV e incluso puede reducirlo117. Tras un seguimiento de más de 9 años, el estudio multinacional PURE mostró que la ingesta de más de 2 raciones de lácteos diarios frente al no consumo se asoció con un menor riesgo de mortalidad total y por ECV129. Un metaanálisis reciente que incluye 55 estudios de cohortes confirma la asociación inversa entre el consumo de lácteos totales, comparando mayor con menor consumo, y el riesgo de HTA y concluye que el riesgo de ECC se reduce un 4% y el de ictus un 10%130. Parece que, a nivel de salud cardiovascular, en comparación con los lácteos bajos en grasa o desnatados, los lácteos enteros no tienen efectos desfavorables131.
El mayor consumo de lácteos totales se asocia a un menor riesgo de DM2, aunque es importante tener en cuenta la presencia de azúcares añadidos en muchos de ellos, que podrían contrarrestar dicha protección. Un metaanálisis reciente de estudios prospectivos revela que el consumo de lácteos totales y yogur se asocia con una reducción del riesgo de DM2 del 3 y 7% por aumentos de 200g/d y 50g/d, respectivamente122.
El menor riesgo de DM2 con la ingesta de yogur se explica en parte porque este derivado lácteo promueve modificaciones favorables en la microbiota de individuos obesos y pacientes con DM2, con mejoría de la respuesta glucémica y la resistencia a la insulina. Además, los yogures aumentan la concentración de péptido similar al glucagón (GLP)-1, que tiene un efecto anorexígeno y puede representar un papel en sus efectos protectores sobre la obesidad y la DM2. Además, el consumo de yogur y otros lácteos fermentados se asocia inversamente con el riesgo de ECC, AVC y varios tipos de cáncer, aparte de promover la salud de los huesos, en buena parte por su capacidad de mejorar la digestión de la lactosa y contrarrestar su intolerancia132.
El consumo de queso no altera el perfil lipídico, como sería de esperar por su elevado contenido en AGS. Los quesos fermentados contienen andrastina, un metabolito fúngico con capacidad hipocolesteromiante, ya que inhibe la farnesil transferasa, enzima que modula la síntesis del colesterol. En una revisión sistemática de metaanálisis de estudios de cohortes, se concluye que el mayor consumo de queso comparado con el consumo menor se relaciona inversamente con el riesgo de mortalidad por cualquier causa, mortalidad por ECV e incidencia de ECV, ECC, AVC y DM2, con unas RR que oscilan entre −7 y −8%133. En todo caso, los quesos curados contienen cantidades apreciables de sal, por lo que no serían recomendables en pacientes hipertensos.
En relación con la mantequilla, un metaanálisis encuentra que su consumo se relaciona débilmente con la mortalidad por todas las causas (RR: 1,01; IC 95%: 1,00-1,03), pero no se asocia significativamente con un mayor RCV (RR: 1,00; IC 95%: 0,98-1,02)134. No obstante, la sustitución de grasa láctea como mantequilla o nata por grasa de origen vegetal insaturada sí se relaciona con un menor RCV135.
La heterogeneidad de los productos lácteos puede dificultar extraer conclusiones, pues los beneficios atribuibles a los lácteos en general pueden ser diferentes para cada lácteo específico, dada la gran cantidad de productos disponibles, desde lácteos enteros a leches fermentadas, pasando por yogures de distinto tipo o leches con composiciones grasas muy diferentes. De forma común con el objeto de mejorar la salud cardiovascular y el perfil metabólico, en el pasado se aconsejaba el consumo de productos lácteos desnatados o bajos en grasas, recomendación para reducir el aporte dietético de AGS presentes en los lácteos enteros, pero la existencia en los lácteos de otros nutrientes e incluso de algunos AGS o AGT con propiedades beneficiosas otorga al consumo del alimento (en este caso el lácteo entero) un beneficio como matriz alimentaria superior al de los nutrientes que lo integran analizados de forma independiente, y no parece una buena estrategia restringir o eliminar los lácteos enteros de la dieta con el objeto de reducir el RCV136. Al margen de su menor contenido calórico, el consumo de lácteos bajos en grasa o desnatados no muestra mejores resultados cardiovasculares en relación con los lácteos enteros en los distintos estudios evaluados131.
En resumen, existen evidencias de moderada a alta calidad indicativas de que la ingesta total de productos lácteos, quesos y yogur ejerce un efecto neutro o discretamente saludable sobre el riesgo de ECV y podemos afirmar que, independientemente de su contenido graso, su consumo no incrementa el RCV o de DM2. Por tanto, no existen argumentos de peso para restringir la ingesta de lácteos enteros con el objeto de disminuir la incidencia de ECV o DM2, aunque deben desaconsejarse los lácteos con azúcares añadidos. Para una mejor prevención cardiovascular, es aconsejable reducir el consumo de grasa láctea concentrada, como sería la mantequilla y la nata, y sustituirla como grasa culinaria por otras fuentes de grasas insaturadas, como en nuestro medio es el AOVE.
Niveles de evidencia sobre lácteos y el riesgo cardiovascular
| Evidencia | Grado |
|---|---|
| • Los productos lácteos, enteros o desnatados y fermentados o no fermentados, tienen un efecto neutro o de reducción moderada del RCV | Evidencia moderada |
| • No parece adecuado limitar el consumo de lácteos enteros con el objeto de reducir la incidencia de DM2 o de ECV | Evidencia moderada |
| • Es recomendable consumir al menos 2 raciones diarias de lácteos enteros o desnatados, aunque es desaconsejable el consumo de lácteos con azúcares añadidos | Evidencia moderada |
| • El consumo de lácteos, especialmente el yogur, se asocia a una reducción del riesgo de DM2 | Evidencia moderada |
| • El consumo de queso no se asocia a un incremento del RCV | Evidencia moderada |
Los frutos secos (almendras, avellanas, nueces, pistachos, anacardos, macadamias, piñones, pecanas, etc.) son frutas peculiares por su alto contenido en grasa, que suele superar el 50% de la energía, pero está formada principalmente por ácidos grasos insaturados, sea AGM tipo oleico (en las almendras, avellanas y otros) o AGP n-6 tipo linoleico (piñones, pecanas y nueces) y n-3 como el ácido α-linolénico (nueces), mientras que contienen pocos AGS. Los cacahuetes no son frutos de árbol sino legumbres, pero su composición y alto contenido en ácidos grasos insaturados los asimila a los frutos secos, tanto desde el punto de vista nutricional como por sus efectos biológicos. Aparte de su riqueza en grasa, los frutos secos, como todas las semillas, contienen abundante fibra, potasio, calcio, magnesio y otros compuestos fitoquímicos de gran actividad biológica, como los fitoesteroles y polifenoles. Estos se encuentran en buena medida en la piel, por lo que es aconsejable consumir los frutos secos crudos, sin pelar ni tostar. También son una fuente importante de proteína vegetal, sobre todo las almendras y los pistachos137.
El interés por los frutos secos se inició por evidencias epidemiológicas consistentes de que su consumo habitual reducía el riesgo de ECV y la mortalidad. Un metaanálisis reciente que resume la evidencia de 89 artículos, incluyendo datos de 23 metaanálisis previos, compara el consumo de una ración al día de frutos secos (28g) con el no consumo y encuentra una asociación con el 21% de reducción del riesgo de ECV (comprendiendo incidencia y mortalidad por ECC, fibrilación auricular y mortalidad por AVC) y una reducción del 22% de la mortalidad por cualquier causa138. Aunque se observó una reducción de la mortalidad por DM, no hubo asociación con su incidencia. Otro metaanálisis de estudios observacionales confirma la falta de asociación del consumo de frutos secos con la incidencia de DM139, a pesar de un probable efecto de aumentar la sensibilidad a la insulina, si bien no se han observado mejorías de la glucemia o la HbA1c140. Aunque los datos de ECA sobre consumo de frutos secos y PA son controvertidos, hay evidencias consistentes de estudios prospectivos de su asociación con menor riesgo de HTA141. El estudio PREDIMED de prevención primaria de la ECV ha proporcionado una evidencia científica de primer nivel sobre el beneficio de consumir frutos secos, al demostrar una reducción del 28% en la incidencia de ECV (infarto de miocardio, AVC o muerte por estas causas) tras 5 años de intervención con una dieta mediterránea suplementada con AOVE o frutos secos (30g al día: 15g de nueces, 7,5g de almendras y 7,5g de avellanas) en personas de alto RCV5.
El efecto cardioprotector puede adscribirse en parte a los efectos lipídicos de los frutos secos. Efectivamente, se ha demostrado en diversos ECA, tanto en voluntarios sanos como en pacientes hipercolesterolémicos, que el consumo diario de una cantidad razonable de frutos secos tiene un claro y consistente efecto reductor de la colesterolemia. Los frutos secos más estudiados han sido las almendras y las nueces, pero también se han publicado resultados positivos de estudios con otros, como los cacahuetes, de modo que el efecto hipocolesterolemiante puede considerarse como «de clase». La reducción del colesterol total y cLDL se relaciona con las cifras basales, siendo más eficaz cuanto más alto es el colesterol al inicio. También hay una dependencia del índice de masa corporal, de modo que las personas delgadas responden más que las obesas137. Un metaanálisis reciente de 120 ECA evaluando los efectos lipídicos de distintos frutos secos revela un efecto hipocolesterolemiante consistente de dosis oscilando entre 30 y 60g/día, con una reducción media de cLDL de 4,25mg/dl (IC 95%, 2,71-5,42), sin cambios del cHDL y descenso medio de los triglicéridos de 5,31mg/dl (IC 95%: 2,66-7,08), además de una reducción media de apoB (determinada en 39 estudios) de 3,01mg/dl (IC 95%: 1,58-4,44), de nuevo, sin cambios de la PA142. La riqueza de los frutos secos en AGP, fitoesteroles y fibra son factores determinantes de su efecto hipocolesteromiante. El consumo de nueces, pero no de otros frutos secos, se ha asociado con mejoría de la disfunción endotelial y reducción de marcadores circulantes de inflamación, lo cual se explicaría por su composición diferencial con otros frutos secos: abundancia del AGP n-3 vegetal (ácido alfa-linolénico), arginina (precursor del óxido nítrico) y polifenoles muy bioactivos137.
Ya que los frutos secos son muy ricos en grasa y tienen un alto valor calórico, existe la preocupación de que su consumo frecuente se asocie a aumentos indebidos del peso corporal. Actualmente existen suficientes evidencias de ECA de que los frutos secos, sea añadidos a la dieta habitual (sin ningún consejo para equilibrar las calorías reduciendo el consumo de otros alimentos) o en sustitución de otra fuente de grasa dietética, no inducen ganancia de peso. Además, en estudios prospectivos los consumidores habituales de frutos secos tienden a estar más delgados y ganar menos peso durante el seguimiento que los no consumidores141. La explicación principal de esta aparente contradicción es la alta capacidad saciante de los frutos secos, por la que (mientras se coman durante el día o como aperitivo) las calorías ingeridas se compensan limitando lo que se consume en la comida siguiente. También, dependiendo en gran parte de la masticación y fragmentación subsiguiente de los frutos secos, hay una parte de la grasa (hasta un 20%) que no se absorbe por el intestino al estar contenida en membranas celulares dentro de partículas sólidas, lo cual hace que la energía absorbida sea menor que la predecible por su composición, a la vez que implica una cierta pérdida fecal de grasa que puede asociarse a heces más blandas de lo habitual137,143.
Niveles de evidencia sobre frutos secos y el riesgo cardiovascular
| Evidencia | Grado |
|---|---|
| • Los frutos secos tienen un efecto hipocolesterolemiante dosis/dependiente | Evidencia fuerte |
| • El consumo frecuente de frutos secos se asocia a una reducción de ECV, sobre todo ECC, y mortalidad por cualquier causa | Evidencia fuerte |
| • A pesar de su alto valor calórico, los frutos secos no inducen ganancia de peso | Evidencia fuerte |
Recomendaciones
Consumir con frecuencia (a diario o al menos 3 veces por semana) un puñado de frutos secos (equivalente a una ración de 30g) es muy recomendable para el control del colesterol y la salud en general. Se recomienda consumirlos crudos y sin pelar (no tostados ni salados) si es factible, ya que la mayor parte de los antioxidantes están en la piel. Para mantener el efecto saciante se aconseja su ingesta durante el día, no como postre después de cenar. Esta recomendación puede hacerse a todas las personas de cualquier edad (a partir de los 5 años); la única contraindicación es la infrecuente alergia a los frutos secos (la más conocida es la alergia a los cacahuetes en la infancia).
Cacao y chocolateEl cacao, el ingrediente básico del chocolate, comparte con otras semillas una composición favorable en nutrientes y compuestos fitoquímicos. Contiene un 40-50% de grasa en forma de manteca de cacao, formada por 33% ácido oleico, 33% ácido esteárico y 25% ácido palmítico. También contiene polifenoles, que constituyen un 10% del peso seco de la semilla, tratándose de uno de los alimentos naturales más ricos en compuestos fenólicos. Su principal derivado para el consumo es el chocolate, del cual hay muchas variedades que contienen diversos ingredientes. El chocolate negro es el que tiene una proporción mayor de cacao y menor de lácteos y azúcares; en su composición cabe destacar un 50% de hidratos de carbono complejos, un 35% de grasa y hasta un 7% de proteínas, además de abundante potasio y magnesio, fitoesteroles y polifenoles143. Estos son del tipo de los flavonoides, particularmente flavanoles, muy bioactivos porque aumentan la producción y biodisponibilidad del óxido nítrico, reducen el estrés oxidativo en el endotelio vascular y promueven la vasodilatación y el flujo sanguíneo145. Si bien una buena parte de la grasa del cacao está formada por AGS, predomina el ácido esteárico, que carece de efecto hipercolesterolemiante36.
Una reciente revisión sistemática de metaanálisis que analizaron datos de estudios prospectivos de grandes cohortes con exposición a distintos alimentos concluye que existe una evidencia consistente de reducción significativa del riesgo relativo de ECV (ECC, infarto de miocardio y AVC) que oscila entre el 4 y el 10% por cada 10g/día de ingesta de chocolate146. Los resultados de otro metaanálisis de estudios prospectivos evaluando dosis/respuesta de chocolate con riesgo de enfermedades crónicas confirman una asociación inversa con el riesgo de ECC y AVC para dosis de hasta 20g/día, sin mayor beneficio a partir de esta dosis147. Otro metaanálisis reciente de estudios de cohortes con cerca de 900.000 participantes analiza exposición al chocolate en relación al riesgo de mortalidad y encuentra una modesta asociación inversa de mayor consumo con mortalidad por cualquier causa, por ECV y por cáncer, con unas RR significativas entre −5 y −10%148. Excepcionalmente para un alimento, se ha efectuado un ECA de consumo de un extracto de cacao rico en flavanoles (500mg por dosis) comparado con placebo con el objetivo primario de incidencia de ECV, el estudio COSMOS, que incluyó cerca de 21.500 participantes en prevención primaria149. Tras intervención durante una media de 3,6 años, la incidencia de ECV en el grupo que recibió el extracto de cacao fue similar a la del grupo placebo (RR: 0,90; IC 95%; 0,78-1,02; p=0.11). Sin embargo, se constató un efecto beneficioso del extracto de cacao para uno de los objetivos secundarios (mortalidad por ECV), con una HR: 0,73; IC 95%: 0,54-0,98. Los resultados son alentadores y sugieren que tal vez con un seguimiento más largo se habría conseguido una reducción significativa del riesgo de ECV. Un subestudio del COSMOS efectuado en unos 18.300 participantes sin DM2 en situación basal no demostró ningún efecto del extracto de cacao sobre la incidencia de DM2 (HR: 1,04; IC 95%: 0,91-1,20; p=0,58)150.
Se han efectuado numerosos ECA con bebidas de cacao, chocolate negro (que contiene al menos un 50% de cacao) o productos similares para evaluar su efecto sobre variables de riesgo cardiometabólico, demostrando un efecto consistente de mejoría de la función endotelial y reducción de la PA y la colesterolemia, con aumento del cHDL; también se ha descrito una mejoría del control glucémico, la resistencia a la insulina y la inflamación144. Un metaanálisis reciente revisa 31 ECA evaluando los efectos de productos de cacao sobre la PA y demuestra un mayor efecto antihipertensivo con el chocolate que con las bebidas de cacao y en los individuos hipertensos que en los normotensos151. De modo notable, algunos de estos estudios clínicos han utilizado flavonoides aislados del cacao en vez de chocolate, observándose el mismo efecto beneficioso sobre la PA y la función endotelial, lo cual señala estos fitoquímicos como un componente bioactivo principal del cacao. A pesar de su riqueza energética, no hay evidencias de que el consumo frecuente de chocolate negro engorde; al contrario, hay estudios que sugieren una asociación inversa entre los flavonoides del cacao y la adiposidad152 y la incidencia de DM2153.
No obstante, muchos chocolates y otros productos derivados del cacao que se encuentran en el mercado poseen una baja concentración de cacao, además de contener azúcares simples añadidos y otros aceites vegetales, que los hace poco recomendables para la salud cardiovascular.
Niveles de evidencia sobre la relación entre cacao/chocolate y el riesgo cardiovascular
| Evidencia | Grado |
|---|---|
| • El cacao/chocolate negro (con al menos un 50% de cacao) tiene efectos hipocolesterolemiantes y antihipertensivos | Evidencia fuerte |
| • El consumo frecuente de cacao/chocolate rico en cacao se asocia a reducción de ECV total, ECC, AVC y mortalidad por cualquier causa | Evidencia moderada |
Recomendaciones
Puede consumirse chocolate negro con frecuencia, en dosis de hasta 20g/día, para reducir la colesterolemia, la PA y el RCV en el contexto de una dieta saludable. No hay que temer que el consumo habitual de chocolate negro cause un aumento indebido de peso.
Café y téEl café y el té son 2 de las bebidas más ampliamente consumidas a nivel mundial; ambas son ricas en polifenoles muy bioactivos como antioxidantes y antiinflamatorios, que les confieren su característico sabor amargo. La infusión de café mantiene de las semillas originales unas concentraciones relativamente altas de potasio, magnesio y niacina y, aparte de la cafeína (un alcaloide con propiedades excitantes), contiene otros polifenoles principalmente ácido clorogénico, con efectos antioxidantes, antihipertensivos y de regulación del metabolismo hidrocarbonado154. La riqueza en estos componentes bioactivos del café parece responsable de sus potenciales beneficios sobre la salud cardiovascular y general155.
La exposición al café con o sin cafeína se ha investigado extensamente en estudios prospectivos en relación con la incidencia de ECV, DM2 y la salud en general y en ECA para efectos sobre factores de RCV, casi siempre mostrando efectos beneficiosos156. Existe una relación inversa no lineal (curva en U) entre el consumo de café y la mortalidad por ECV, cáncer, y todas las causas. En un metaanálisis reciente, en comparación con la ausencia de consumo de café, la ingesta media de 3,5 tazas al día, pero no dosis superiores, se asoció a una reducción del RR de mortalidad por todas las causas de un 15% (IC 95%: 11-18)157. En la misma línea, un gran estudio prospectivo basado en la cohorte del UK Biobank muestra menor riesgo de mortalidad por ECV y por todas las causas entre los consumidores de hasta 5 tazas de café al día, relación en forma de U que aparece entre los que lo toman sin o con azúcar, pero la asociación fue menos consistente si el café se consumía con edulcorantes artificiales; los beneficios aparecieron con los diferentes tipos de café: instantáneo, molido y descafeinado158. Un metaanálisis reciente de 32 estudios de cohortes concluye que, en general, el consumo de café no se asocia al riesgo de ECC, si bien en análisis de subgrupos podría empeorar el riesgo en varones y mejorarlo en mujeres159. Otro metanálisis de 30 estudios prospectivos describe una relación directa del consumo de café con menor riesgo de DM2, sin discordancia entre el café con cafeína y el descafeinado160; además, existen evidencias de que, en individuos con DM2, el consumo habitual de café reduce la mortalidad por ECV en un 32% y por cualquier causa en un 40% en comparación con el no consumo161.
El café puede aumentar la PA de modo agudo, pero no hay evidencia de que su consumo moderado habitual favorezca la aparición de HTA, e incluso se ha asociado a un menor riesgo de HTA en algunos estudios. Por el contrario, el consumo ocasional de café puede aumentar temporalmente la PA. En población con HTA, el consumo de café (una a 3 tazas al día) puede reducir el riesgo de mortalidad total162, aunque un gran estudio prospectivo japonés muestra que, en personas con HTA grado 2-3, el consumo de 2 ó más tazas de café al día, en comparación con el no consumo, se asocia a un mayor riesgo de mortalidad por ECV (RR: 2,05; IC 95%: 1,17-3,59); en cambio, esta relación no existe en sujetos normotensos o con HTA grado 1163. En todo caso, las recientes recomendaciones internacionales sobre la modificación del estilo de vida para el tratamiento de la HTA proponen un consumo diario de 2-3 tazas al día de café o té sin azúcar11.
En otro análisis de la gran cohorte prospectiva del UK Biobank se observó que el café bebido de forma habitual en cantidades moderadas se asociaba a una disminución del riesgo de arritmias supraventriculares, con un 3% de reducción por cada taza diaria adicional164. En las cohortes españolas del estudio prospectivo SUN y del estudio clínico PREDIMED, el consumo de café con cafeína (1-7 tazas a la semana) se asoció con una reducción conjunta del riesgo de fibrilación auricular del 40%165.
El café no filtrado contiene cafestol, un diterpeno que aumenta el colesterol, pero esto no ocurre con el café filtrado o instantáneo166. Un estudio noruego muestra que el consumo de café filtrado se asocia a una menor mortalidad por ECV y total que el café sin filtrar, si bien ambas preparaciones de café parecen ofrecer protección en comparación con el no consumo167.
Las infusiones de té son ricas en polifenoles del tipo de los flavonoides, específicamente catequinas, y también contienen cafeína. Para producir té negro, las hojas de la planta Camellia sinensis se oxidan en un ambiente controlado, mientras que el té verde se elabora a partir de hojas intactas. El consumo habitual de té se ha relacionado con una mejor salud cardiovascular; un metaanálisis muestra que el consumo habitual de ambas variedades de té se relaciona con un menor RCV y de mortalidad por todas las causas168. En otro análisis de la cohorte del UK Biobank, el consumo de té en cantidades desde 2 tazas hasta 10 o más al día se asoció a reducciones del riesgo de mortalidad por todas las causas, incluyendo la ECV, que oscilaba entre el 9 y el 13% comparado con los no bebedores de té169. También hay evidencia de un metaanálisis de 55 ECA de que el consumo diario de té verde reduce moderadamente la PA y el colesterol total y LDL, aumenta el cHDL y mejora el perfil glucémico170.
En definitiva, el consumo habitual de dosis moderadas de hasta 5 tazas por día de café (filtrado o instantáneo, completo o descafeinado) o té (verde o negro) en dosis de hasta más de 10 tazas por día es beneficioso para la salud cardiovascular; además, el consumo moderado de café se asocia de modo inverso con el riesgo de DM2 y el té reduce la potencia de los factores de RCV. Por estos motivos, ambas bebidas son recomendables tanto en personas sanas como en aquellas con factores de riesgo. Estas bebidas son acalóricas, excepto si se consumen con un exceso de azúcar, que siempre hay que limitar o suprimir en caso de exceso de peso, DM2 o dislipemia aterogénica.
Niveles de evidencia sobre la relación entre café, té y el riesgo cardiovascular
Bebidas alcohólicasLas bebidas alcohólicas son las que contienen etanol (alcohol etílico). Según su elaboración se diferencian entre las producidas por fermentación, como el vino, la cerveza o la sidra, cuyo contenido alcohólico no supera los 15°, y las que se obtienen por destilación, como los aguardientes (whisky, coñac, ginebra, vodka o ron) y los licores con sabor a frutas, hierbas o especias (alcohol entre 20 y 60°). Los efectos de las bebidas alcohólicas sobre la salud han sido motivo de controversia y debate, con defensores y detractores de su consumo, aún moderado. En todo caso, está claro que el consumo excesivo es perjudicial, ya que tiene una asociación causal con numerosos problemas de salud, desde accidentes a hepatopatía alcohólica, pancreatitis crónica, miocardiopatía o enfermedades neurodegenerativas. Numerosos estudios epidemiológicos y el análisis sistemático del Global Burden of Disease Study 2020171 sugieren que el consumo moderado de bebidas alcohólicas de cualquier tipo reduce la mortalidad total y, particularmente, la mortalidad cardiovascular en alrededor de un 20% en comparación con no bebedores, pero esta aumenta a partir de un nivel de entre 20 y 30g de etanol al día, lo que se representa con la típica curva en J. Este informe indica que el beneficio del consumo moderado de alcohol es apreciable a nivel global en adultos de ambos sexos a partir de una edad de 40 años, pero en individuos más jóvenes, particularmente en varones, predomina el consumo excesivo de alcohol y aumenta la mortalidad derivada, por lo que entre los 15 y los 39 años se considera perjudicial cualquier cantidad de alcohol171. Una reciente revisión sistemática de 56 estudios de cohortes con más de 1,5 millones de participantes confirma la relación entre el consumo moderado de bebidas alcohólicas y la reducción de la mortalidad cardiovascular, que es notoria en al caso del vino (un 25% menor en comparación con cerveza o licores)172. Esta revisión también sugiere una asociación entre el consumo moderado de bebidas alcohólicas y menor incidencia de infarto de miocardio. Un gran estudio prospectivo con más de 300.000 participantes derivado de los datos del UK Biobank sugiere también una asociación entre el consumo moderado de bebidas alcohólicas y una reducción del riesgo de DM2, pero solo si se toman con las comidas, como el vino173, lo cual señala la importancia de considerar el patrón de bebida, no solo la cantidad absoluta. Precisamente otra publicación derivada de la misma cohorte concluye que el consumo de vino (comparado con cerveza y bebidas espirituosas), tomarlo con las comidas (en comparación con la misma cantidad, pero sin comida) y repartir el consumo semanal en 3 o 4 días (en vez de a diario o por atracón) se asocia a menor mortalidad e incidencia de ECV174. Por otra parte, si bien es un tema en disputa, se sigue postulando que el alcohol, incluso en cantidades moderadas, es un agente carcinogénico, sobre todo para la mucosa bucal y el esófago, donde este efecto se potencia por sinergia con el tabaco175.
Hasta ahora no se ha completado ningún ECA que haya valorado los efectos del consumo moderado de alcohol sobre eventos duros como mortalidad o incidencia de ECV. Recientemente se ha iniciado el estudio University of Navarra Alumni Trialist Initiative (UNATI), un estudio aleatorizado de 2 grupos paralelos y controlado de intervención nutricional. Se incluirán 10.000 adultos, varones de >50 años y mujeres de >55 años, con diagnóstico de ECV, DM2, cáncer o depresión, a los que se les recomendará un consumo moderado de vino tinto (hasta 2 copas al día los varones y hasta una copa al día las mujeres) con las comidas o mantener una abstinencia de todas las bebidas alcohólicas, y a los que se seguirá un mínimo de 4 años para evaluar efectos sobre mortalidad total y cardiovascular e incidencia de ECV, DM2 y cáncer176.
En el pasado se consideraba que el tipo de bebida alcohólica no era un factor determinante de su efecto saludable, que se atribuía a su contenido en etanol, pero la conclusión de evidencias más recientes es que los efectos saludables de las bebidas fermentadas (vino y cerveza) son mayores que los de los destilados y licores177,178, si bien sigue habiendo controversias179. En este contexto, numerosos ECA han analizado los efectos a corto plazo de los diferentes tipos de bebidas sobre los factores de RCV176–178,180. Como las bebidas alcohólicas contienen etanol y otros compuestos, principalmente polifenoles, una parte de los efectos saludables de estas bebidas se atribuyen a su contenido alcohólico y otra parte a los efectos de los componentes no alcohólicos. Así, se considera que el etanol aumenta significativamente el cHDL, mejora el metabolismo de la glucosa y reduce el fibrinógeno180–182, mientras que las bebidas con mayor contenido en polifenoles como el vino, especialmente el tinto, y la cerveza tendrían un mayor efecto sobre los parámetros de oxidación e inflamación relacionados con la arteriosclerosis, así como sobre la angiogénesis177,182,183.
Actualmente está aumentando en gran medida el consumo de vino y cerveza desalcoholizados que, al carecer de etanol, no se asocian a aumentos del cHDL, pero también tienen un efecto beneficioso sobre el sistema cardiovascular, al reducir la PA y aumentar las células endoteliales y progenitoras circulantes, implicadas en la regeneración del endotelio vascular184,185. En los últimos años, parte de los efectos del consumo de bebidas alcohólicas, especialmente del vino tinto, sobre la salud se han atribuido también a cambios favorables de la microbiota intestinal, atribuibles a su alto contenido en polifenoles186–188. Finalmente, cabe señalar que un único ECA realizado en Israel ha evaluado el efecto sobre factores de RCV del consumo moderado de vino a largo plazo189,190. En este estudio se administraron diariamente de forma aleatoria a 3 grupos de diabéticos bien controlados 150ml de vino tinto, 150ml de vino blanco o 150ml de agua durante 2 años. En los participantes que recibieron vino tinto aumentaron el cHDL y la apoA1 y los 2 grupos que recibieron vino mostraron una mayor sensibilidad a la insulina, pero solo cuando eran metabolizadores lentos de alcohol.
En resumen, aunque sigue siendo un tema controvertido, el consumo moderado de bebidas alcohólicas fermentadas (vino y cerveza) se asocia a mejoría de factores de RCV, principalmente aumento del cHDL (por el alcohol) y disminución de la inflamación y estrés oxidativo (por los polifenoles), y a una reducción moderada de la mortalidad total y cardiovascular y la incidencia de ECV y DM2.
Niveles de evidencia sobre el consumo moderado de bebidas alcohólicas y el riesgo cardiovascular
| Evidencia | Grado |
|---|---|
| • Las bebidas alcohólicas aumentan el cHDL | Evidencia fuerte |
| • En comparación con la abstención o el consumo excesivo de bebidas alcohólicas, su consumo moderado se asocia a una reducción de la incidencia de ECV, DM2 y mortalidad total y cardiovascular | Evidencia moderada |
| • Beber vino con moderación durante las comidas es la forma menos perjudicial de consumir bebidas alcohólicas | Evidencia moderada |
Recomendaciones
El consumo de bebidas alcohólicas debe ser siempre con las comidas y en el marco de una dieta saludable como la dieta mediterránea. Actualmente existen evidencias de que el consumo de bebidas alcohólicas se asocia a efectos similares (saludables o adversos según la cantidad y el patrón de bebida) en ambos sexos. Sin embargo, ya que las mujeres son más sensibles al alcohol por tener una absorción más rápida, las recomendaciones de consumo serían hasta entre 2 y 3 copas al día (máximo 30g de alcohol) para los varones, y hasta entre una y 2 copas al día (máximo 15g) para las mujeres. Por su demostrada capacidad de beber en exceso, los jóvenes deberían abstenerse de consumir bebidas alcohólicas. Los varones de más de 65 años tampoco deberían sobrepasar los 20g de alcohol al día.
Bebidas azucaradas y edulcoradasBebidas azucaradasEn la dieta occidental se tiende a consumir una cantidad excesiva de hidratos de carbono simples, como sacarosa, glucosa, fructosa y lactosa. Una fuente importante de azúcares añadidos a la dieta son las bebidas azucaradas, no tan solo refrescos, sino también lácteos y zumos industriales, cuya ingesta proporciona poca sensación de saciedad (y temporalmente más corta) que se asocia a una reducción compensatoria incompleta del consumo subsiguiente de energía en la dieta; su palatabilidad favorece también un mayor consumo, con el consiguiente incremento del aporte calórico a la dieta (tabla 3). Por sus características y elaboración, las bebidas azucaradas entran de lleno en la clasificación de los alimentos ultraprocesados perjudiciales para la salud191 (ver sección «Alimentos ultraprocesados»).
Cantidad de calorías y porcentaje sobre calorías diarias recomendadas de algunas bebidas
Existen evidencias fuertes de estudios de cohortes y ECA que apoyan un papel etiológico del consumo habitual de bebidas azucaradas en la obesidad, un factor de riesgo independiente de enfermedades cardiometabólicas y enfermedades relacionadas, como la ECV y la DM2, además de algunos tipos de cáncer y la mortalidad total192. Dado el papel de las bebidas azucaradas en la actual pandemia de obesidad y su impacto sobre otras enfermedades crónicas, hay políticas activas dirigidas a disminuir su consumo a nivel global; una iniciativa importante es el aumento de los impuestos sobre estas bebidas que, al aumentar su costo, repercuten en una reducción de las ventas en los países donde se ha implementado esta medida193. En este documento se comentan únicamente los efectos comprobados de la adición excesiva de azúcares externos a las bebidas, no al contenido natural de ellos en los alimentos.
Existe una evidencia científica creciente sobre el efecto nocivo de una exposición excesiva a bebidas azucaradas, sustentada en estudios observacionales, revisiones y metaanálisis15,17,56,194–196, y aparece en consensos y guías de práctica clínica internacionales. Según el metaanálisis más reciente, que sintetiza los datos de 70 estudios prospectivos56, el nivel superior de consumo de bebidas azucaradas comparado con el inferior se asocia significativamente con el riesgo de HTA, DM2, ECC, AVC, mortalidad total y ECV fatal, con RR oscilando entre 1,09 (AVC) y 1,27 (DM2), existiendo una relación lineal dosis/respuesta entre el consumo y la incidencia de estas enfermedades.
Evitar el consumo de bebidas azucaradas es una de las 10 recomendaciones de la AHA sobre dieta y prevención de ECV en su artículo de posicionamiento de 20214. El documento de consenso previo de Pérez-Martínez et al. sobre el estilo de vida en la prevención y el tratamiento del síndrome metabólico de 2017194 ya apuntaba en la misma dirección, al igual que las actuales recomendaciones de la American Diabetes Association, en las cuales, además del efecto nocivo de las bebidas azucaradas sobre el metabolismo de la glucosa, obesidad, síndrome metabólico y DM2, se señala su papel etiopatogénico en el hígado graso no alcohólico, un factor de riesgo de cirrosis y cáncer hepático197,198. Un metaanálisis reciente vincula el consumo de bebidas azucaradas con el riego de varios tipos de cáncer, especialmente de mama, hepatocelular, colorrectal y de próstata, si bien las evidencias son limitadas199. En resumen, el consumo de bebidas azucaradas es un indicador fundamental de una dieta insalubre.
Bebidas edulcoradasEl reto de sustituir las bebidas azucaradas en la población general es enorme. Más del 50% de los norteamericanos consumen al menos una bebida azucarada al día, con un exceso de 178 calorías diarias en los varones y 118 en las mujeres. La conducta repetitiva de su consumo hace que se cree un hábito en el que el retorno al consumo de agua como fuente principal de líquido sea difícil, ya que uno se acostumbra al placer adicional del sabor de las bebidas con azúcar añadido.
Como alternativa al consumo de bebidas azucaradas, los edulcorantes se presentan como fuentes de sabor dulce sin aporte calórico. La combinación de una ventaja calórica sobre los azucares tradicionales y ciertas asociaciones con un mejor manejo metabólico han extendido su uso de forma habitual, especialmente dada su condición de «aditivos» que les han permitido prescindir de estudios de seguridad alimentaria por parte de las principales agencias sanitarias, como la Food and Drug Administration de Estados Unidos y la EFSA. Esto unido a estudios observacionales sobre un efecto favorable en pérdida de peso y porcentaje de grasa corporal los han situado en una posición dominante entre los consumidores de refrescos, que actualmente ya los consumen más que las versiones originales con azúcar. La percepción general por la población sobre el consumo de estos edulcorantes es que son productos seguros, e incluso saludables, cuando se comparan con aquellos con azúcares añadidos. De hecho, un reciente metaanálisis apoya la inocuidad de estos edulcorantes, al menos sobre el peso corporal y los factores de riesgo cardiometabólicos, si bien con un nivel de evidencia bajo o moderado200. Sin embargo, recientemente se han presentado evidencias plausibles de una posible asociación entre los edulcorantes y la obesidad, el síndrome metabólico, la DM2 y la ECV16.
Por ejemplo, los resultados de un ECA reciente indican que determinados edulcorantes (sacarina, aspartamo, estevia y sucralosa) pueden alterar la microbiota intestinal y la tolerancia a la glucosa en las personas sanas201. Un gran estudio observacional prospectivo francés que incluyó cerca de 100.000 participantes seguidos durante 9 años mostró una asociación estadísticamente significativa entre el consumo de diferentes edulcorantes (aspartamo, acesulfame potásico y sucralosa) y el riesgo de ECV202. En esta línea, otro estudio reciente de 3 grandes cohortes prospectivas seguidas durante 3 años describió una asociación entre un edulcorante particular (el eritritol) y eventos cardiovasculares mayores, definidos como la combinación de muerte por ECV, ECC y AVC203. Los autores identificaron como posible patogenia del efecto dañino del edulcorante el aumento de la activación plaquetaria, que persistía incluso 2 días después de la exposición al edulcorante. De hecho, los datos de grandes estudios de cohortes y varios metaanálisis de estudios prospectivos sugieren que un mayor consumo tanto de bebidas azucaradas como de bebidas edulcoradas artificialmente (aunque estas con un menor nivel de evidencia) se asocia con el riesgo de ECV, particularmente AVC, DM2 y mortalidad por todas las causas17,56,192,195,196,202–205.
En conclusión, las evidencias actuales apoyan los efectos nocivos del consumo de bebidas azucaradas, mientras que hallazgos recientes sobre los edulcorantes artificiales hacen dudar de la oportunidad de las recomendaciones anteriores de sustituir las bebidas azucaradas por las edulcoradas artificialmente. Si bien tienen un impacto beneficioso sobre la ingesta calórica, hay una evidencia creciente sobre los efectos lesivos de los edulcorantes, lo cual abre un debate interesante sobre la necesidad de realizar estudios de seguridad, no solo con estos aditivos en bebidas, sino con otros presentes en la alimentación actual, como los colorantes, saborizantes, etc. Las bebidas azucaradas forman parte de la dieta habitual de muchos individuos a nivel global y pueden suponer hasta un 20% del consumo calórico diario. La sustitución de este tipo de bebidas por agua sería esencial para reducir la ingesta energética y el riesgo de obesidad, DM2 y enfermedades relacionadas. Si el paciente no acepta dicha sustitución, el consumo de bebidas con edulcorantes artificiales ofrece un menor aporte calórico, aunque en este caso se le debe informar de los datos recientes que muestran una asociación de su consumo con el desarrollo de ECV, DM2 y mortalidad por cualquier causa, por lo que son tan poco recomendables como las bebidas azucaradas a las que pretenden sustituir.
Niveles de evidencia sobre el consumo de bebidas azucaradas y edulcoradas artificialmente, y el riesgo cardiovascular
| Evidencia | Grado |
|---|---|
| • El consumo frecuente de bebidas con azúcares añadidos favorece la resistencia a la insulina, la obesidad, el síndrome metabólico y la incidencia de DM2, a la vez que incrementa el RCV | Evidencia fuerte |
| • Debe evitarse el consumo de bebidas con azúcares añadidos, no solo refrescos sino también zumos industriales y bebidas lácteas. La sustitución del consumo de bebidas azucaradas por agua o infusiones no azucaradas sería importante para reducir el aporte energético y el RCV, obesidad, síndrome metabólico y DM2 | Evidencia moderada |
| • Las últimas evidencias sugieren un incremento de la mortalidad cardiovascular y por cualquier causa, y del riesgo de AVC, ECC y DM2 con un mayor consumo de refrescos edulcorados artificialmente, por lo que no parece adecuado recomendar su consumo | Evidencia moderada |
El sodio es un mineral esencial que interviene en la regulación de la osmolaridad de la mayor de parte de los fluidos extracelulares y es esencial para la homeostasis celular. Al igual que otros minerales, como el calcio, la vitamina D y hormonas como la tiroxina, el sodio presenta una curva en J en relación a su función fisiológica, de tal manera que tanto su deficiencia como su exceso son nocivos para la fisiología celular. Numerosos estudios epidemiológicos han mostrado una asociación directa y dosis dependiente entre el exceso de consumo de sal (cloruro sódico) y el desarrollo de efectos perjudiciales para la salud, particularmente aumento de la PA sistólica y AVC146.
De acuerdo con la evidencia disponible, la Organización Mundial de la Salud (OMS) publica en 2023 el primer informe mundial sobre la reducción de la ingesta de sodio, recomendando para adultos reducir el aporte dietético de sodio a menos de 2g/día (equivalente a 5g/día de sal), con cifras menores para la población infantil206. La HTA se puede prevenir con una ingesta reducida de sal207 y la restricción de sodio dietético es un componente esencial de las recomendaciones de estilo de vida para el tratamiento de la HTA12.
Una parte importante de la sal que consumimos procede de alimentos preparados, puesto que la industria alimentaria y de bebidas tiene intereses creados en usar cantidades excesivas de sal común u otras sales sódicas (nitritos, citratos, alginatos, glutamatos, etc.) para preservar los alimentos, potenciar su sabor y aumentar la sed, lo que con frecuencia induce a consumir bebidas industriales. En base a algunos estudios observacionales, a veces promocionados por la industria alimentaria, se ha postulado la presencia de mayor RCV con una dieta con menor ingesta de sal, y la existencia de una curva en J que podría definir la relación existente entre la ingesta de sal y las ECV. Estos hallazgos han sido rebatidos por problemas metodológicos, sobre todo una inadecuada estimación de la ingesta de sal en base a análisis puntuales de sodio urinario y probable causalidad inversa, y en absoluto justifica la afirmación de que una menor cantidad de sodio podría incrementar el RCV208,209. El marcador más fiable de la ingesta de sal es la excreción de sodio en orina de 24h, preferentemente en análisis repetidos; con idéntico método se puede medir la excreción de potasio como antagonista del sodio. En un estudio emblemático utilizando datos individuales agregados de 6 grandes cohortes prospectivas norteamericanas de personas sanas, se determinaron sodio y potasio en orina de 24h varias veces durante un seguimiento medio de 8,8 años210. Comparando extremos de sodio y potasio urinario, las HR de ECV para el nivel superior del biomarcador fueron de 1,60 (IC 95%: 1,19-2,14) en el caso de la excreción de sodio y de 0,69 (IC 95%: 0,51-0,91) para el potasio. Se constató un efecto dosis/respuesta, de modo que cada incremento diario de 1g de excreción de sodio se asociaba a un aumento del 18% del RCV, mientras que cada aumento diario de 1g de excreción de potasio se asociaba con un 18% de reducción del riesgo210. Los hallazgos de este estudio subrayan los efectos nocivos de la ingesta excesiva de sodio y favorables de la ingesta de potasio.
Otros estudios hacen hincapié en los efectos beneficiosos de disminuir el sodio de la dieta. Un metaanálisis de ECA corrobora la relación directa entre la reducción del sodio dietético y la disminución de la PA, mayor en las poblaciones de mayor edad y en aquellas con una PA más alta. Asimismo, demuestra que los estudios a corto plazo subestiman el efecto sobre la PA de la reducción de sodio211. Un amplio estudio prospectivo realizado en 176.570 adultos del UK Biobank muestra que las personas que no añaden de forma habitual o casi nunca sal a las comidas tienen un 23, 26 y 37% riesgo menor de presentar ECV, ECC e insuficiencia cardiaca, respectivamente, que aquellas que lo hacen siempre o muy a menudo212. Los participantes con menor frecuencia de sal añadida a las comidas que seguían una dieta tipo DASH, pobre en sodio y rica en potasio por su abundancia en vegetales y de eficacia comprobada para reducir la PA213 (ver sección correspondiente), fueron los que mostraron un menor RCV212. Otros estudios aportan evidencias consistentes de que la reducción de sal de la dieta disminuye la PA, el RCV, la enfermedad renal crónica y la mortalidad por todas las causas214. Según un gran estudio epidemiológico norteamericano, el consumo excesivo de sodio es considerado como el primero de 10 factores nutricionales responsables de mortalidad por enfermedades cardiometabólicas (ECC, AVC y DM2)215. En concordancia con las recomendaciones de la OMS206, la World Hypertension League ha elaborado un documento de consenso para reducir de forma global el aporte dietético de sodio, en promedio superior a 2g/día (equivalente a 5g/día de sal) a nivel mundial216.
Un tema relevante es el diferente comportamiento individual de la PA frente a la ingesta de sal, que puede aumentar mucho en algunos individuos y muy poco en otros. Esta heterogeneidad permite clasificar a las personas como sal-sensibles o sal-resistentes, respectivamente. Se postula que los primeros tienen una hipersensibilidad del sistema renina-angiotensina, de modo que la ingesta mantenida de sal induce una vasoconstricción renal y una mayor reabsorción tubular de sodio, favoreciendo el incremento de PA. Esta sensibilidad a la sal aumenta progresivamente con la edad, es más frecuente en hipertensos y su heredabilidad es mayor en la raza negra. Se sugiere que la sensibilidad a la sal tiene una base genética, pero no hay suficientes datos para atribuirla a variabilidad en genes conocidos. Saber si un individuo es sensible o resistente a la sal es clínicamente relevante, ya que la sensibilidad a la sal constituye en sí un factor de riesgo independiente y potente de morbimortalidad cardiovascular tanto como lo es la propia HTA217. El diagnóstico requiere evaluar la respuesta de la presión en medidas repetidas tras períodos de sobrecarga y restricción de sal. En todo caso, el mejor enfoque de cara a la salud pública sería implementar programas de salud para limitar su ingesta a nivel poblacional206,216.
Debe recomendarse una dieta baja en sal (<5g/día) para toda la población y con mayor justificación en pacientes hipertensos y sus familiares, recordando que para calcular la cantidad de sal total hay que multiplicar por 2,5 el contenido de sodio de los alimentos. Medidas especialmente eficaces para este fin son limitar el consumo de alimentos ricos en sal, como precocinados, enlatados, salazones, embutidos y bebidas carbónicas. Para la elaboración culinaria de los alimentos y mejorar su palatabilidad existen condimentos de bajo contenido en sodio (tabla 4), que pueden ser alternativas saludables a la sal. Por su riqueza en compuestos fenólicos, las especias y hierbas alimentarias son fuentes de antioxidantes y están integradas en la cocina tradicional de patrones alimentarios saludables, como es el de la dieta mediterránea.
Una opción plausible para reducir la ingesta de sal es su sustitución por sales con mayor riqueza en potasio. Un ECA realizado en China en 20.995 personas con antecedentes de AVC o con más de 60 años e HTA de un medio rural, seguidos durante 4,7 años, demostró que, en relación al grupo control que continuó con el uso de sal común, en el grupo que utilizó un sustituto de la sal (75% de cloruro sódico y 25% de cloruro potásico) se redujo un 14% la incidencia de AVC, un 13% la de ECV total y un 12% la mortalidad total, sin que se detectara hiperpotasemia218. Un reciente metaanálisis concluye que la mayoría de los estudios realizados sobre el reemplazo de la sal común por sustitutos ricos en potasio están realizados en población asiática e incluyeron participantes con RCV alto y muy alto, por lo que la evidencia de la recomendación para su uso generalizado en otras poblaciones es limitada219.
En los países desarrollados, alrededor del 80% de la sal de la dieta proviene de comidas procesadas y de comida rápida. En estos países, la estrategia para reducir la ingesta de sodio debe centrarse en persuadir a los responsables de las industrias alimentarias para que reduzcan la cantidad de sodio que añaden a sus productos, de forma gradual y sostenida, además de recomendar a los consumidores no añadir sal a los alimentos. Durante el procesamiento de los alimentos pueden añadirse ingredientes con el objeto de mejorar su palatabilidad y perdurabilidad, siendo una fuente relevante de aporte sódico a la dieta por parte de alimentos dispuestos para su consumo inmediato, que habitualmente no identificamos con un alto contenido en sodio. Por ejemplo, muchos helados y goma de mascar llevan ascorbato sódico (E-301), y habitualmente las galletas y otros dulces, contienen sorbato sódico (E-201). También hay que tener en cuenta que para muchas personas el pan constituye la principal fuente dietética de sodio, por lo que es recomendable seleccionar variedades bajas en sal.
Niveles de evidencia sobre el consumo de sal y el riesgo cardiovascular
| Evidencia | Grado |
|---|---|
| • El consumo excesivo de sodio se asocia de manera directa con HTA, ECV y mortalidad por causas cardiometabólicas Debe recomendarse una dieta baja en sal (<5 g/día); para calcular la cantidad de sal total hay que multiplicar por 2,5 el contenido de sodio de los alimentos | Evidencia fuerte |
| • Medidas eficaces para reducir la ingesta de sodio dietético son limitar el consumo de precocinados, enlatados, salazones, embutidos, bebidas carbónicas y otros ultraprocesados | Evidencia fuerte |
El procesado es la manipulación mediante las que los alimentos crudos se adecuan para su consumo o almacenamiento, utilizando procedimientos para mejorar su calidad nutricional, conservación, seguridad y palatabilidad. Desde tiempo inmemorial, el procesado es habitual en la mayoría de alimentos que consumimos e incluye cualquier actuación que se inicia con la preparación y concluye con el cocinado. Con el troceado se dañan los tejidos y se ponen en contacto enzimas y sustratos que normalmente estaban separados por membranas, lo que puede inducir reacciones oxidativas, como el pardeado de muchas frutas y verduras, especialmente manzanas, champiñones, berenjenas, etc. También se favorecen reacciones de degradación de glucosinolatos que generan isotiocianatos, compuestos con propiedades antitumorales. Con el corte, los tejidos quedan expuestos al oxígeno atmosférico, lo que favorece la oxidación lipídica y el enranciamiento por reacciones espontáneas y pérdida de humedad32. Con respecto a la preparación culinaria y a su conservación, se dispone de múltiples métodos, siendo los fundamentales la aplicación de frío o calor y la deshidratación. Otros procesos que se utilizan en mayor o menor grado, como la fermentación, salazón, salmuera, encurtido, curado, ahumado o almibarado, tienen por objeto conseguir mayor perdurabilidad y mejora de las cualidades organolépticas de los alimentos. Finalmente, el envasado también puede afectar la calidad de los alimentos.
Recientemente, ha habido un inusitado interés científico sobre las características del procesado de los alimentos, inherente a su producción industrial en masa en la civilización occidental, y las eventuales consecuencias de su consumo para la salud. En este sentido se ha desarrollado el concepto de alimentos ultraprocesados, derivado de la clasificación NOVA, que ha experimentado varios cambios en los últimos años e intenta sistematizar el grado de procesamiento de los alimentos y sus componentes220. Según la definición NOVA, los alimentos ultraprocesados son formulaciones industriales producidas a través de una secuencia de cambios físicos, químicos o térmicos que modifican las características naturales de los alimentos; muchos ultraprocesados suelen poseer un elevado contenido de grasa total, azúcares simples y sodio, aparte de una alta densidad energética, y habitualmente incluyen sustancias que no son de uso común en el cocinado de los alimentos, como proteínas hidrolizadas, almidones modificados y aceites hidrogenados con aporte de grasas trans de origen industrial. En general los alimentos ultraprocesados son pobres en proteínas, fibra y micronutrientes191. El objetivo de la industria alimentaria es conseguir productos de bajo coste listos para su consumo inmediato que, además de la comodidad de su preparación, aporten una presentación atractiva, palatabilidad agradable y condiciones de conservación que permitan su almacenamiento y consumo por tiempo prolongado, empleando para ello saborizantes, edulcorantes, colorantes, estabilizantes, emulsionantes, aglutinantes, aglomerantes, etc.
Los alimentos y bebidas calificados como ultraprocesados incluyen diferentes productos de amplio consumo (tabla 5), que tienen en común su producción industrial191. Es obvio que la mayoría de estos alimentos y bebidas se engloban en el conocido concepto de comida «basura» (junk food) o «rápida» (fast food) y forman parte de los alimentos tradicionalmente desaconsejados por ser nocivos para la salud3. Por esto, muchos expertos son escépticos sobre el valor añadido del concepto de ultraprocesados en la ciencia nutricional221–226.
Alimentos ultraprocesados de origen industrial
| - Cereales de desayuno- Pasteles y bombones- Chocolates y caramelos- Helados- Margarinas y otras grasas de untar- Yogures de frutas- Bebidas carbonatadas, lácteas, de frutas y de cacao- Platos precocinados de vegetales, queso, carne o pescado- Hamburguesas y embutidos- Patatas fritas de bolsa y otros aperitivos industriales- Pizza- Sopas y postres industriales |
Fuente: Adaptado de Monteiro et al.190.
En la alimentación de países occidentales ha habido un claro incremento del consumo de estos alimentos, que reemplazan en la dieta habitual a otros frescos o mínimamente procesados y que, dada su habitual alta densidad energética, representen un importante aporte calórico, si bien hay controversias sobre su influencia en el aumento de peso225. En EE. UU., hasta un 60% de la energía total de la dieta procede de alimentos ultraprocesados226. Los datos de España no son tan alarmantes, pero indican un aumento progresivo del aporte de estos alimentos a la dieta habitual, representando alrededor de un 30% de la energía diaria de la población total según las últimas estimaciones, con un consumo mayor en niños y jóvenes y en personas con sobrepeso227. A pesar de sus limitaciones y de que por ahora no hay evidencias de la causalidad de estos alimentos en el riesgo de enfermedades crónicas no transmisibles226, la definición NOVA de ultraprocesados se ha usado en numerosos estudios de epidemiología nutricional y metaanálisis derivados, con resultados generalmente consistentes respecto a su influencia nociva sobre la salud. Los datos de la revisión sistemática más reciente (de 45 metaanálisis, con cerca de 10 millones de participantes) sobre la exposición a alimentos ultraprocesados y sus efectos sobre variables de salud228 muestran evidencias (en general, de bajo grado) de la asociación de un mayor consumo con la mortalidad por cualquier causa y por ECV, y la incidencia de ECV, DM2, obesidad, HTA y síndrome metabólico, con razones de riesgo oscilando entre 1,20 y 1,50. Un reciente análisis de 3 grandes cohortes de EEU confirma la asociación entre un mayor consumo de alimentos ultraprocesados y un aumento del 16-17% del riesgo de mortalidad total y por ECV20. En un análisis de mediación, este estudio sugiere que los biomarcadores de función hepática y de inflamación mediatizan en buena parte la mortalidad por cualquier causa y por ECV, respectivamente.
No obstante, existe una amplia heterogeneidad en el conjunto de alimentos considerados como ultraprocesados por la clasificación NOVA191,220 y si bien, en el caso de la DM2, su consuno total se asocia a un mayor riesgo, existen subgrupos específicos de estos alimentos (cereales integrales, yogur y otros postres lácteos) que, en vez de ser perjudiciales, muestran protección frente al riesgo de DM222. Una de las críticas a la consideración global de los ultraprocesados es precisamente establecer el mismo calificativo para alimentos con alta densidad energética y elevado contenido de grasas hidrogenadas y azúcares simples que para aquellos que aportan un mayor contenido en fibra y micronutrientes, que no solo no ejercen un efecto perjudicial sino que son saludables, por lo que evitarlos puede ser contraproducente y contribuir a una alimentación deficiente, sobre todo en poblaciones con inseguridad alimentaria21,226.
El procesado de los alimentos es cada vez más universal, y existen procedimientos que mantienen su capacidad nutricional y otros que favorecen su deterioro y la generación de productos nocivos. Por ello es recomendable elegir los alimentos frescos o los congelados, mínimamente procesados, evitando el consumo de los que han soportado temperaturas altas y en especial los cárnicos procesados. Por otra parte, no es prudente consumir aquellos que contienen sal, nitratos, grasas y/o azúcares añadidos, porque existe un elevado riesgo de que las grasas de adición sean parcialmente hidrogenadas y ricas en AGT. Por tanto, es aconsejable evitar los alimentos ultraprocesados y, en su lugar, promover el consumo de alimentos frescos, sin procesar o mínimamente procesados.
Niveles de evidencia sobre el consumo de alimentos procesados y ultraprocesados, y el riesgo cardiovascular
| Evidencia | Grado |
|---|---|
| • El procesado hace perder a los alimentos nutrientes beneficiosos, en especial cuando han soportado temperaturas altas | Evidencia fuerte |
| • La ingesta frecuente de alimentos ultraprocesados favorece la mortalidad por cualquier causa y el desarrollo de factores de riesgo cardiometabólico, ECV y DM2 | Evidencia moderada |
| • Deben evitarse en lo posible los alimentos ultraprocesados y, en su lugar, promover el consumo de alimentos frescos, sin procesar o mínimamente procesados | Evidencia moderada |
En las últimas décadas, el análisis de patrones dietéticos se ha afianzado como el método más preciso para investigar la relación entre la dieta y la salud. Este tipo de análisis evalúa el efecto del conjunto de la dieta en lugar de examinar el papel de los nutrientes o alimentos individuales. Al abarcar todos los alimentos y bebidas y sus componentes nutricionales, con las posibles sinergias y antagonismos entre ellos, los patrones dietéticos se adaptan mejor al estudio de las asociaciones entre dieta y salud o enfermedad229,230. La investigación sobre componentes de la dieta y patrones alimentarios capaces de influir en la prevención cardiovascular y los mecanismos subyacentes ha crecido exponencialmente en este cuarto del siglo XXI; por ejemplo, hasta finales de 1999 había 357 entradas de dieta mediterránea en PubMed, y desde esta fecha hasta el presente hay 11.314 entradas (1.320 solo en el año 2023). Por otra parte, hay una plétora de estudios epidemiológicos que usan índices de calidad de la dieta para averiguar si la adherencia a ciertos patrones alimentarios (por ejemplo, a la dieta mediterránea) o el seguimiento de las guías dietéticas al uso se asocia a un menor riesgo de enfermar o de morir prematuramente.
Son múltiples los factores personales y culturales que condicionan que cada persona tenga su propio modelo de alimentación. No obstante, las poblaciones que viven en el mismo entorno cultural y geográfico están influidas por circunstancias que homogenizan sus recursos y la predilección por los alimentos, con lo que varios entornos geográficos han configurado un modelo alimentario tradicional y razonablemente común, si bien cuestionable en el presente debido a la creciente disponibilidad de alimentos naturales o procesados procedentes de cualquier remoto lugar del mundo, que modifican los patrones de consumo tradicionales hacia una alimentación más rica en productos procesados listos para su consumo inmediato. A continuación, revisaremos brevemente algunos de los principales patrones alimentarios definidos en el mundo occidental. Por su escasa penetración en nuestro entorno, no se comentan los patrones dietéticos prevalentes en partes de Asia, como la India, Japón, Tailandia, etc.
Dieta mediterráneaEn nuestro entorno el modelo alimentario geográfico y cultural prevalente ha sido la dieta mediterránea, un patrón alimentario de base vegetal que incluye abundantes verduras, frutas, legumbres y frutos secos; aceite de oliva como principal grasa culinaria; pescado y marisco, carne de ave sin grasa y lácteos fermentados (yogur y queso); vino con moderación durante las comidas; y escaso consumo de carnes rojas y procesadas, alimentos procesados en general, dulces y bebidas azucaradas231. Se trata del patrón dietético más estudiado y mejor conocido a nivel mundial. Hasta tiempos relativamente recientes este ha sido el patrón alimentario tradicional de los países mediterráneos, pero la adherencia en esta zona geográfica analizada en los últimos 10 años ha sido baja o moderada, independientemente del sexo o la edad, indicando una pérdida progresiva de la dieta mediterránea tanto en adultos232 como en niños y adolescentes233. Está claro que actualmente hay un amplio margen de mejora de la dieta mediterránea en nuestro entorno.
Existen evidencias consistentes del beneficio de este modelo de dieta para la salud, en especial por su asociación con reducción de la incidencia de ECV y DM2 y sus factores de riesgo; menor mortalidad cardiovascular e incidencia de cáncer y de enfermedades neurodegenerativas; y mejoría de la función cognitiva, con abundantes datos derivados de estudios prospectivos31 y sus metaanálisis234,235, aparte de los proporcionados por 2 ECA emblemáticos efectuados en España, los estudios PREDIMED5 y CORDIOPREV6, cuyos hallazgos se resumen más adelante. La exhaustiva umbrella review de Dinu et al.234 contiene una síntesis cuantitativa de 19 metaanálisis de ECA efectuados para evaluar los efectos de la dieta mediterránea sobre factores intermedios y concluye, con un grado de evidencia bajo, que este patrón dietético puede ser más eficaz que una dieta control para reducir el peso corporal y la adiposidad, disminuir el colesterol total y aumentar el cHDL, mejorar el control glucémico y reducir la inflamación, pero carece de efectos valorables sobre la PA y el cLDL.
El beneficio cardiovascular de una mayor adherencia a la dieta mediterránea en estudios de cohortes tiende a ser más prominente en comparación con otras dietas o alimentos saludables. Así, en el reciente metaanálisis de Rosato et al.235 de 29 estudios observacionales, en las comparaciones de mayor con menor adherencia a la dieta mediterránea se encontró una RR: 0,81; IC 95%: 0,74-0,88 para ECV total, 0,70; IC 95%: 0,62-0,80 para ECC y 0,73; IC 95%: 0,59-0,91 para AVC. En otros metaanálisis de estudios prospectivos, una mayor adherencia a la dieta mediterránea se asociaba a una reducción del riesgo de DM2 de un 17% (IC 95%, 10-23%)236 y cada aumento en 2 puntos de una puntuación de dieta mediterránea se asociaba a 10% de reducción (IC 95%: 9-11%) de la mortalidad total, con un efecto beneficioso más acusado, es decir, mayor longevidad, en los países mediterráneos237.
La dieta mediterránea ha sido examinada en 2 grandes ECA con objetivo de ECV incidente llevados a cabo enteramente en España. El primer ensayo clínico, el PREDIMED, efectuado en cerca de 7.500 participantes con RCV elevado, pero en prevención primaria, demostró que una dieta mediterránea suplementada con AOVE o frutos secos, en comparación con la recomendación de limitar todo tipo de grasa dietética, reducía la incidencia de ECV en un 30% tras cerca de 5 años de seguimiento5. El reconocimiento de las evidencias de primer nivel proporcionadas por el estudio PREDIMED se ha traducido en las recomendaciones hechas por distintas sociedades científicas, como la AHA3, la AHA junto con la American Stroke Association238, y la European Society of Cardiology (ESC)239, en las que se considera la dieta mediterránea como el primer modelo alimentario eficaz en prevención cardiovascular y para fomentar la salud cerebral, aunque se reconoce que tiene solo un impacto modesto sobre los factores de riesgo intermedios. Merece destacarse también el más reciente ECA CORDIOPREV, también realizado en España. que incluyó a 1.002 pacientes que habían sufrido un infarto agudo de miocardio y observó una reducción del 28% en el riesgo de sufrir nuevos episodios cardiovasculares con una dieta mediterránea suplementada con AOVE durante 7 años en comparación con una dieta baja en grasa (HR: 0,72; IC 95%: 0,54-0,96)6.
Precisamente por ser un patrón alimentario bien conocido entre nosotros, la dieta mediterránea es el más fácil de difundir y preconizar en nuestra población, lo que simplifica la recomendación por parte de los profesionales de la salud. No obstante, su definición precisa no está exenta de dificultades, sobre todo por las diferencias culturales entre distintos pueblos del Mediterráneo. Quien propuso la definición más aceptada fue Walter Willett, junto con sus colegas de la Universidad de Harvard y reputados epidemiólogos nutricionales griegos, quienes tan pronto como en 1995 tuvieron el acierto de representar la dieta en forma de pirámide, con los alimentos más saludables en estratos más bajos y los presuntamente más perjudiciales en la punta de la pirámide, lo cual es una forma práctica y comprensible para su difusión240. Un grupo de investigadores en nutrición de los países mediterráneos reinterpretaron la pirámide inicial de dieta mediterránea añadiéndole componentes del estilo de vida mediterráneo, como la biodiversidad y la sostenibilidad de los alimentos consumidos, las prácticas culinarias, el ejercicio físico regular, el descanso adecuado, la convivialidad y la comensalidad (comer sentados junto con familia o amigos)231 (fig. 2).
Pirámide de la Dieta Mediterránea
Fuente: Reproducido con permiso de Bach-Faig et al.233.
La dieta Dietary Approaches to Stop Hypertension (DASH), enfoque dietético para detener la hipertensión, descrita hace casi 3 décadas241, es un patrón dietético que promueve la ingesta de fruta, verduras, legumbres, cereales integrales y frutos secos asociada a la disminución de alimentos ricos en AGS como las carnes y lácteos enteros, dulces y bebidas azucaradas. Se ha comprobado que este patrón de dieta, bajo en sal y con predominio de hidratos de carbono complejos, es particularmente útil en el control de la PA. Una dieta DASH con restricción adicional de sal mejoró su efecto antihipertensivo242.
Un metaanálisis de 30 ECA muestra que una dieta tipo DASH reduce la PA sistólica y diastólica, con un mayor efecto antihipertensivo en participantes con ingestas de sodio >2.400mg/día que en aquellos con ingestas más bajas de sodio243. La combinación de una dieta DASH y una baja ingesta de sodio se traduce en mayor reducción de la PA sistólica y diastólica (−8,9/−4,5mmHg), que la implementación por separado de cada una de las intervenciones dietéticas244. La dieta DASH también es eficaz sobre otros factores de riesgo cardiometabólico, con reducciones significativas del peso corporal (−1,59kg), índice de masa corporal (−0,64kg/m2), colesterol total (−5,12mg/dl) y cLDL (−3,53mg/dl), pero carece de efecto sobre el cHDL, triglicéridos o glucemia245.
Como era de esperar por sus efectos sobre los factores de riesgo, la dieta DASH también se ha asociado a reducción de enfermedades crónicas. Un metaanálisis de estudios prospectivos sugiere que este patrón dietético se asocia a una reducción significativa de alrededor del 20% de ECV, T2DM, cáncer, enfermedades neurodegenerativas y mortalidad total246. Los datos de un gran estudio prospectivo sueco con un seguimiento medio de 22 años sugieren que la dieta DASH se relaciona con un menor riesgo de insuficiencia cardiaca, con una RR: 0,83; IC 95%: 0,78-0,89, para el quintil superior de adherencia comparado con el inferior247. En cambio, en el seguimiento de una cohorte de individuos con antecedentes de infarto agudo de miocardio, la mayor adherencia a una dieta DASH no mostró reducción de la mortalidad cardiovascular y total248; los autores argumentan que el mayor uso de fármacos antihipertensivos por pacientes en prevención secundaria puede haber influido en la falta de resultados favorables de la dieta.
Dentro de las pautas dietéticas y de estilo de vida para optimizar el control de la HTA y mejorar la salud cardiovascular, se recomiendan tanto la dieta DASH baja en sodio como la dieta mediterránea, con un nivel similar de evidencia11. Del mismo modo, por sus efectos beneficiosos sobre los factores de riesgo y la incidencia de ECV, la AHA recomienda la dieta DASH, junto con las dietas mediterránea y vegetariana, para la prevención cardiovascular3.
Dietas vegetarianasLas dietas vegetarianas, cuya base es una alimentación exenta de productos de origen animal, son cada vez más populares, por razones personales, ideológicas o culturales, y también por su sostenibilidad y menor huella de carbono. Este patrón dietético incluye varios modelos, desde la dieta vegana, absolutamente restrictiva en productos animales, hasta la lacto-ovo-vegetariana o la pesco-vegetariana, que permiten el consumo de los alimentos que les dan su nombre. En las dietas vegetarianas destaca el mayor aporte de fibra que en las dietas convencionales, pero hay limitaciones, en especial en las más estrictas. La principal es el riesgo de carencia de vitamina B12, que se encuentra en la carne, pescado y productos lácteos, por lo cual debe suplementarse de forma habitual en las personas que siguen estas dietas. También puede haber déficit de cinc y hierro; éste debe suplementarse en niños y mujeres embarazadas que siguen dietas estrictas249.
La adherencia a una dieta vegetariana basada en alimentos vegetales mínimamente procesados se ha asociado con una disminución de factores de riesgo cardiometabólico y un riesgo reducido de desarrollar múltiples enfermedades crónicas, incluyendo HTA, ECV, DM2, cáncer y demencia249. En un metaanálisis reciente de 20 ECA, en comparación con dietas omnívoras, las dietas vegetarianas mejoran el riesgo cardiometabólico en participantes de alto RCV, con reducciones significativas del peso corporal, cLDL y HbA1c, pero no de la PA sistólica250. Con respecto al perfil lipídico, un metaanálisis reciente de 30 ECA concluye que, en comparación con dietas omnívoras, las dietas vegetarianas reducen el colesterol total, cLDL y apoB en un promedio de 13, 12 y 13mg/dl, respectivamente251.
Un metaanálisis de estudios prospectivos sugiere, si bien con un bajo nivel de evidencia, que la dieta vegetariana/vegana ejerce protección sobre la mortalidad por ECC, beneficio que no aparece sobre la mortalidad cerebrovascular y por todas las causas252. Otro metaanálisis reciente de 13 estudios de cohortes con cerca de 850.000 participantes concluye que las dietas vegetarianas se asocian a menor riesgo de ECV total (RR: 0,85; IC 95%: 0,79-0,92) y ECC (RR: 0,79; IC 95%: 0,71-0,88), pero no de AVC253.
Es de suma importancia definir qué patrones dietéticos vegetarianos proporcionan mejores resultados de salud y qué componentes son perjudiciales. En contraposición a los alimentos vegetales naturales, frescos y de temporada, en los últimos años se ha incrementado la elaboración industrial de productos vegetales ultraprocesados, que pueden contener azúcares simples y grasas hidrogenadas (repostería, dulces, bebidas azucaradas, verduras enlatadas en salmuera, aceites tropicales, etc.), cuyos efectos sobre la salud son opuestos a los de las dietas vegetarianas tradicionales249. La AHA recomienda la dieta vegetariana, mínimamente procesada, junto a la dieta DASH y la mediterránea para cumplir los objetivos nutricionales de reducción del RCV3.
Dieta MINDHace algo más de una década un grupo de expertos en nutrición y demencia evaluaron los efectos de la dieta como medida preventiva del deterioro cognitivo asociado a la edad y desarrollaron un sistema de puntuación nutricional basado en la dieta mediterránea y la dieta DASH, al que denominaron Mediterranean-DASH Diet Intervention for Neurodegenerative Delay (MIND)254. Entre los componentes de la dieta MIND se proponen 10 grupos de alimentos saludables (verduras de hojas verdes, otras verduras, nueces, bayas, cereales integrales, pescado, mariscos, aves, aceite de oliva y vino) y 5 grupos de alimentos considerados como no saludables (carnes rojas, mantequilla/margarina, quesos, bollería/dulces y comida rápida). En realidad, la única diferencia importante entre las dietas MIND y mediterránea es que la primera considera preferentemente el consumo de vegetales de hoja verde, como la lechuga y las espinacas, y de bayas o frutas del bosque, como fresas y arándanos.
En el estudio inicial, una mayor adherencia a la dieta MIND se asoció a mejoría del deterioro cognitivo relacionado con la edad254. Una revisión sistemática de distintos tipos de estudios, entre los que predominaban los estudios epidemiológicos de diseño transversal, señala que la dieta MIND se asocia con mejoría del perfil cardiometabólico, como la circunferencia de cintura, la PA, el control glucémico, el perfil lipídico y la inflamación, pero los efectos sobre la incidencia de ECV no fueron concluyentes255. Los datos de una gran cohorte prospectiva norteamericana respaldan la dieta MIND como una estrategia para reducir el riesgo cardiometabólico tanto en prevención primaria como en pacientes con enfermedad cardiovascular aterosclerótica establecida256. Con respecto al objetivo por el que fue diseñada la dieta MIND, las evidencias recientes son contradictorias. En un metaanálisis reciente de 11 cohortes prospectivas con cerca de 225.000 participantes y más de 5.200 casos de demencia incidente, el tercil superior de la puntuación de la dieta MIND se asoció con una reducción del riesgo de demencia, con una HR agregada de 0,83 (IC 95%: 0,76-0,90)257. Sin embargo, un ECA que reclutó 604 individuos sanos con una edad media de 70 años, pero con sobrepeso, dieta subóptima e historia familiar de demencia, y los distribuyó en 2 grupos de intervención nutricional con discreta reducción calórica, uno a dieta MIND y otro a dieta control durante 3 años, no observó ningún cambio de la función cognitiva o de la estructura cerebral evaluada mediante resonancia magnética en una submuestra de participantes258. Por tanto, carecemos de evidencias de primer nivel sobre la eficacia de la dieta MIND para frenar el deterioro cognitivo.
Dieta nórdicaLa dieta nórdica establece un patrón de alimentación que resalta las fuentes de alimentos locales en los países nórdicos, de temporada, orgánicos y cultivados de forma sostenible, y limita los alimentos procesados, carnes rojas y azúcares refinados. Los alimentos básicos que comprende son los cereales integrales (en particular, el centeno, la cebada y la avena), las frutas (especialmente las bayas), los tubérculos (como la remolacha, la zanahoria y los nabos), los pescados grasos (como el salmón, el atún y la caballa), las legumbres y los lácteos bajos en grasa. Incluye una amplia gama de alimentos locales y silvestres como algas marinas, musgos, hierbas campestres o bayas de especial riqueza en antioxidantes, como los arándanos rojos, en lugar de cítricos o frutas tropicales que no son de su entorno259.
El concepto de dieta nórdica no es más que el redescubrimiento del patrón dietético tradicional de los países nórdicos, considerando que era saludable por su riqueza en productos vegetales y pescado graso y se asociaba a una mayor sostenibilidad medioambiental. La aportación de la dieta al calentamiento global depende tanto de la producción y procesado de los alimentos, como de su transporte, por lo que los alimentos de proximidad son los más adecuados. En estudios de cohortes prospectivos, una mayor adherencia a la dieta nórdica se ha asociado a una reducción del riesgo de ECV, DM2260 y ECC261.
Otros patrones saludables de alimentaciónEn los últimos años han cobrado auge ciertos patrones de alimentación, con una menor base de evidencia científica que los comentados anteriormente, pero con cierto interés desde el punto de vista de la protección cardiovascular. La dieta atlántica se circunscribe a ciertas regiones de España (específicamente Galicia, Cantabria y País Vasco), y norte de Portugal, y de forma más extensiva a la Bretaña Francesa y algunas zonas del Reino Unido, que constituyen la gran reserva actual natural del Atlántico. Dicho modelo otorga especial protagonismo al consumo elevado de pescado (de mar y de río), marisco (moluscos y crustáceos), verduras y hortalizas, lácteos, y cereales integrales. A diferencia de la dieta mediterránea, se caracteriza por un mayor consumo de carne y pescado y el consumo de AOVE y frutos secos tiene menor protagonismo. En el año 2010 se publicaron las primeras evidencias que sugerían el beneficio de la dieta atlántica al demostrar que se asociaba inversamente con la incidencia de infarto de miocardio no fastal262. En la misma línea, en un estudio reciente incluyendo 4 cohortes y 35.917 participantes de países del sur, centro, este y oeste de Europa, la dieta atlántica se asoció con una menor mortalidad por todas las causas, cardiovascular y por cáncer263. Por tanto, con la cautela necesaria, se trata de un modelo de dieta que se podría recomendar en esas áreas geográficas.
Otro modelo alimentario de interés que ha surgido en los últimos años son las dietas con tiempo restringido conocidas popularmente como «dietas intermitentes». En este contexto, el ayuno intermitente se ha desarrollado como una alternativa menos exigente que el ayuno continuo para perder peso264. Estos regímenes incluyen periodos alternos de ayuno o restrictivos y periodos de alimentación normal que permiten comer lo que se desee. Pueden clasificarse en función de si el periodo de referencia es la semana (ayuno en días alternos; ayuno durante 2 días consecutivos o no consecutivos, con una alimentación normal durante los 5 días restantes (la dieta 5:2); o una dieta muy baja en calorías durante 5 días seguidos de períodos de al menos 10 días sin restricciones. En el segundo tipo de ayuno intermitente, el período de referencia es el día y solo se come durante un periodo específico del mismo (normalmente de 8 o 10 h). Tras un ayuno de 8 a 12 h, el hígado empieza a catabolizar los ácidos grasos para producir cuerpos cetónicos, que el organismo usa como fuente de energía alternativa a la glucosa para mantener la función de los órganos vitales. Por el riesgo de hipoglucemia, el ayuno intermitente puede ser peligroso en pacientes diabéticos. Las evidencias actuales sugieren que el ayuno intermitente no es más eficaz que la restricción calórica convencional para perder peso, aunque demuestra tener un beneficio cardiometabólico sobre ciertos marcadores intermedios, reversible en cuanto se revierte a una alimentación normal265. En todo caso, faltan evidencias clínicas derivadas de ECA que confirmen su beneficio a largo plazo.
Niveles de evidencia sobre dietas saludables y el riesgo cardiovascular
| Evidencia | Grado |
|---|---|
| • La dieta mediterránea reduce la incidencia de ECV (IAM y AVC) y de DM2 | Evidencia fuerte |
| • La dieta DASH reduce la presión arterial, el cLDL y la incidencia de ECV | Evidencia moderada |
| • La dieta vegetariana mejora el riesgo cardiometabólico y se asocia a menor mortalidad por ECC | Evidencia moderada |
| • La dieta MIND mejora el riesgo cardiometabólico y se asocia con un menor riesgo de demencia | Evidencia débil |
| • La dieta nórdica se asocia a reducción del riesgo de ECV y DM2 | Evidencia moderada |
Recomendaciones
Un patrón de alimentación saludable se caracteriza por ser de base vegetal, con un bajo contenido en AGS, colesterol, sodio y azúcares simples, y un alto contenido en fibra, minerales no sodio y ácidos grasos insaturados. Las diferentes dietas saludables analizadas tienen muchos componentes en común, de lo que son ejemplos la dieta mediterránea, DASH, MIND y vegetariana, que hacen hincapié en el consumo de frutas, verduras, cereales integrales, legumbres y frutos secos, con pescado (excepto en la mayoría de dietas vegetarianas) y disminución de lácteos enteros y carnes. Las evidencias consistentes de efectos beneficiosos para la salud de numerosos estudios prospectivos y de los 2 ECA emblemáticos de prevención cardiovascular, PREDIMED5 y CORDIOPREV6, hacen de la dieta mediterránea la base de la prevención y tratamiento de las ECV en las culturas mediterráneas.
La nutrición de «precisión» y «personalizada» en el siglo xxiEs bien conocido que las respuestas de los factores de RCV o del riesgo de ECV en sí a los cambios dietéticos pueden variar ostensiblemente en diferentes individuos en base a interacciones entre su fenotipo, genotipo, fisiología y microbiota, además de otras variables de su estilo de vida, comportamiento, estado socioeconómico y exposición ambiental. De ello nace el concepto emergente de «nutrición de precisión», que ha experimentado un importante avance en su conocimiento científico en la última década y cuyo objetivo es desarrollar recomendaciones dietéticas adaptadas a las circunstancias y características biológicas distintivas de cada persona24,266,267. El concepto de nutrición de precisión se superpone en parte al de «nutrición personalizada», que parte de unas premisas similares y propone que las recomendaciones nutricionales individualizadas (adaptadas a cada individuo) serán más eficaces para reducir la potencia de los factores de RCV y el riesgo de enfermar que el consejo dietético genérico268.
La nutrición de precisión se apoya tanto en la nutrigenética (que estudia la influencia de la variabilidad genética en la respuesta a la dieta) como en la nutrigenómica (que examina el impacto de la nutrición sobre la expresión génica). El conocimiento de que el genoma humano es sensible al entorno nutricional, que lo modifica mediante procesos epigenómicos, transcriptómicos, proteómicos y metabolómicos, es muy relevante para la nutrición de precisión, pero su desarrollo necesita técnicas «ómicas» de alto rendimiento complejas y poco disponibles269. Por otra parte, la nutrigenética concierne los polimorfismos genéticos mediante la identificación de variantes de nucleótido simple (SNPs), para lo cual los estudios de asociación de genoma completo (GWAs) han supuesto un avance importante al permitir identificar nuevas variantes con potencial interés sobre la expresión de la ECV. Una reciente publicación contiene un listado de 16 SNPs con una frecuencia relativamente alta en la población, su efecto nocivo para la salud, la intervención nutricional recomendable para limitarlo y unas muy útiles instrucciones dietéticas para el portador25. Se trata de medicina personalizada práctica; hay SNPs perjudiciales bien conocidos tanto en medicina general, como el LCT-CC, asociado a la deficiencia de lactasa, como en el entorno cardiovascular, siendo el APOE4 el mejor exponente. A este escenario se están incorporando otros marcadores genéticos, como son las variaciones en el número de copias de ADN o los microARNs endógenos270–272, cuya expresión es susceptible de ser modulada por la dieta, lo cual puede influir de modo variable sobre alteraciones cardiometabólicas. Otra área de interés que también ha tenido un importante desarrollo en los últimos años es la epigenética nutricional, que podría ayudar a explicar los mecanismos no dependientes de la secuencia genética por los que los nutrientes y otros factores ambientales contribuyen a modular la expresión génica y el desarrollo de enfermedad. De esta forma un modelo de alimentación personalizada podría retrasar o incluso revertir estos cambios epigenéticos y, por lo tanto, modificar la expresión de la enfermedad273. Actualmente se están realizando múltiples estudios para conocer cómo los nutrientes regulan la expresión génica, centrados entre otros en análisis «ómicos» que, junto con la aplicación de técnicas bioinformáticas y la inteligencia artificial, permitirán integrar toda la información necesaria en grandes megabases de datos dirigidas al diseño de dietas personalizadas274.
Debe destacarse también el papel que puede representar la asociación entre alteraciones del sistema circadiano y la ECV. Estudios recientes sugieren que la interrupción o desincronización interna de dicho sistema puede contribuir a manifestaciones clínicas como obesidad, dislipidemia, HTA, DM2 y ECV. Un aspecto interesante es que estos ritmos circadianos están modulados por factores genéticos. Así, los estudios sobre polimorfismos en genes reloj y sus interacciones con la dieta abren una puerta al desarrollo de nuevas terapias basadas en la crononutrición275. Por ello, la caracterización cronobiológica del individuo también puede ser útil para aplicar una dieta adecuada en función de las características genéticas de cada persona.
En los últimos años el concepto de nutrición de precisión ha ganado especial relevancia en el campo de la salud. Se han efectuado ya varios ECA comparando estas dietas con las recomendaciones nutricionales genéricas y sus resultados indican que los hábitos alimentarios mejoran notablemente en los participantes asignados a recibir nutrición de precisión276. Un ECA reciente comparando nutrición de precisión con recomendaciones generales de dieta saludable muestra solo una leve mejoría de algunos factores de RCV con la dieta de intervención durante 18 semanas277. Identificar y promover la dieta y el estilo de vida óptimos para cada persona en función de sus rasgos genéticos puede ser fundamental a la hora de prevenir y tratar enfermedades crónicas, en especial la ECV, pero todos los expertos señalan que, excepto en el caso del consejo dietético para contrarrestar el efecto nocivo de unos cuantos SNPs bien conocidos, como APOE4271, la nutrición personalizada y de precisión está aún en fases muy iniciales de desarrollo y se necesita mucha más evidencia científica antes de poderla aplicar a una cierta escala, más allá de la experimentación266–268.
Sostenibilidad de los patrones alimentariosEn las últimas décadas se ha alertado sobre el impacto que tiene el sector alimentario como uno de los principales responsables del calentamiento global, situándose por encima del 20% de la producción mundial de gases con efecto invernadero y siendo, por tanto, un factor clave en el deterioro de la sostenibilidad planetaria. A ello hay que sumar el consumo de agua y la sobreutilización de la tierra que, junto con la producción, procesado y trasporte de los alimentos, por el excesivo consumo de energía fósil, amenazan la estabilidad climática. Se estima que aproximadamente el 80% de dicho efecto es atribuible al sector ganadero, siendo la producción de carnes rojas y derivados el proceso asociado a la alimentación que más erosiona los sistemas naturales del planeta278–280. En los últimos años, diversos movimientos promovidos por organizaciones como la EAT-Lancet Commission26, que se alinean con los objetivos de la Agenda 2030 para el Desarrollo Sostenible de la OMS, plantean la necesidad urgente de transformar el sistema alimentario, adoptando un nuevo modelo que, además del concepto tradicional de que sea saludable para la población humana, también lo sea para el propio planeta. En este sentido, científicos de todo el mundo, liderados por Walter Willett de la Unversidad de Harvard, han propuesto un modelo de Alimentación Saludable Planetaria, capaz de preservar el ecosistema planetario y reducir las enfermedades no transmisibles, entre ellas la ECV26. Dicho modelo de alimentación sería una dieta flexivegetariana, a expensas de alimentos de origen vegetal, con frutas y verduras variadas, legumbres, cereales integrales, frutos secos y solo pequeñas cantidades de proteína animal. Este modelo de alimentación limitaría al máximo el consumo de carnes rojas y sus derivados, los alimentos ultraprocesados, cárnicos o no, y la gran mayoría de los precocinados, que contienen productos como azúcar añadido o grasas trans y que son una fuente muy importante de producción de gases de efecto invernadero. Una alternativa sencilla para empezar a luchar contra el calentamiento global es favorecer el consumo de alimentos de temporada y de proximidad, evitando los que se producen en lugares lejanos y deben transportarse largas distancias. Con ello se pretenden evitar en torno a 11 millones de muertes prematuras anuales y disponer en el año 2050 de seguridad alimentaria y una dieta saludable y sostenible en todo el planeta281. Desde el punto de vista práctico y dado la complejidad de trasladar estas recomendaciones a nuestro entorno de forma sencilla y eficaz, la dieta debe ser flexible y adaptable a las condiciones geográficas de cada población, a las tradiciones culinarias propias y a las preferencias personales.
En nuestro entorno partimos de los principios de la dieta mediterránea, precisamente mencionada por la EAT-Lancet Commission como dieta de referencia por su beneficio para la salud a la vez que su bajo impacto ambiental26, que ya fue glosada hace 3 décadas como un patrón alimentario responsable con el medio ambiente282. Merece destacar la publicación reciente de una pirámide de dieta mediterránea enfocada a la sostenibilidad283 y empiezan a aparecer evidencias de como la adherencia a dicho patrón alimentario se traduce en un menor impacto ambiental, sobre todo por un menor consumo de carne284,285. En nuestro entorno, las fuentes animales de proteínas son aún un componente sustancial de la dieta habitual, siendo su reducción un objetivo prioritario de la dieta saludable planetaria26,281,286–288. Se considera que, para luchar contra la emergencia climática y potenciar la salud del planeta, también debería reducirse el consumo de pescado, ya que genera cantidades importantes de gases de efecto invernadero, en especial cuando su origen es la pesca de arrastre, el transporte desde mares alejados en barcos frigoríficos y las piscifactorías de recirculación288. No obstante, la adaptación a un modelo de dieta planetaria no es sencillo. Recientemente se ha calculado lo que gasta una persona al día en alimentarse, y el incremento que supondría adaptarse al modelo de alimentación saludable planetaria según la región geográfica. Los resultados son muy variables, por ejemplo, en África subsahariana sería del 70% y en el sur de Asia del 65%, mientras que en otras áreas sería menos costoso (Norteamérica un 4% y Europa/Asia Central un 10%)289. El reto de producir alimentos de forma sostenible para los 9.000 millones de habitantes del planeta previstos para la mitad de siglo es enorme, al tener que controlar la emisión de gases de efecto invernadero, conservar reservas decrecientes de agua, preservar una biodiversidad menguante y terminar con el hambre en un mundo en pleno cambio climático.
En definitiva, como profesionales de la salud, se nos presenta un escenario retador, dado que por una parte debemos instruir a la población sobre la dieta del futuro, con una amplia base de productos vegetales y una reducción sustancial de proteína animal, y por otra debemos promover una investigación que permita conocer científicamente los beneficios o perjuicios de dicha dieta y, dentro de sus parámetros, cual es el modelo que se adapta mejor a cada región geográfica.
La adherencia a la dieta: tácticas para mejorarlaEn el año 2003, la OMS definió la adherencia a un tratamiento como el grado en que un paciente, con su implicación activa, toma la medicación, o adopta una dieta, o modifica sus hábitos de vida siguiendo fielmente las recomendaciones acordadas con el profesional sanitario290.
El impacto de una baja adherencia es que compromete la efectividad de la terapia, repercutiendo tanto en una deficiente prevención primaria o secundaria de la ECV, como en el incremento de los costes para el sistema de salud. Se ha comprobado, que la adherencia tiende a disminuir con el paso del tiempo290. En consecuencia, el incremento y el mantenimiento de la adherencia son retos a abordar desde el inicio en las actuaciones que se emprendan para mejorar la salud cardiovascular. Dada la efectividad del cambio dietético general en disminuir la potencia de los factores de riesgo (PA, glucemia, cLDL, triglicéridos, marcadores de inflamación o de oxidación, etc.), las recomendaciones dietéticas y la adherencia a las mismas son tanto o más importantes que las prescripciones farmacológicas. En cualquier caso, los efectos beneficiosos de la dieta sobre los factores de riesgo son de gran utilidad en la prevención cardiovascular.
En este contexto, para conseguir un alto grado de adherencia a la dieta se han propuesto varias estrategias, que se describieron en el documento de la SEA 2018 sobre estilo de vida y prevención cardiovascular1. Atendidas las nuevas perspectivas que se plantean en el documento actual (SEA 2024), que proponen incrementar la adherencia a la dieta prescrita, se precisa contar con referentes que permitan valorar el grado de adherencia a las recomendaciones291. Para valorar la adherencia en nuestro entorno, se establece como patrón de consumo la dieta mediterránea, cuyos efectos cardioprotectores en la prevención primaria y secundaria de la ECV han sido ampliamente demostrados en 2 grandes ECA realizados en España5,6. En la valoración de la adherencia de la dieta mediterránea pueden utilizarse cuestionarios con puntuaciones variadas292. El utilizado con más frecuencia en nuestro entorno es el de 14 puntos, el Mediterranean Diet Adherence Screener (MEDAS) diseñado para el estudio PREDIMED293 (tabla 6), validado en varios países y avalado por la AHA294. De acuerdo con el MEDAS, la adherencia a la dieta mediterránea se clasifica en 3 categorías: alta o muy alta, con 10 puntos o superior; moderada a regular, de 6 a 9 puntos; y bajo, con 5 puntos o inferior de los 14 puntos posibles (tabla 6)5,293. Otros cuestionarios muy utilizados para valorar la adherencia a la dieta mediterránea son el propuesto por Trichopoulou et al., de 9 variables295 y el diseñado por Panagiotakos et al., de 11 alimentos con 5 posibilidades de frecuencia para cada uno296. El grado de adherencia es especialmente relevante para establecer el beneficio cardiovascular porque, en los individuos clasificados con una mayor puntuación en la adherencia a la dieta mediterránea en estudios prospectivos, el porcentaje de reducción del RCV es más elevado tanto en prevención primaria como secundaria297; en el caso del estudio PREDIMED, el beneficio cardiovascular de la dieta mediterránea tuvo lugar en el contexto de un incremento de 2 puntos del MEDAS5.
Puntuación de adherencia a la Dieta Mditerránea (MEDAS) - Estudio PREDIMED
| 1. ¿Usa el aceite de oliva como principal grasa culinaria?Sí=1 punto |
| 2. ¿Cuánto aceite de oliva consume en total al día (incluyendo el usado para freír, comidas fuera de casa, ensaladas, etc.)?4 o más cucharadas=1 punto |
| 3. ¿Cuántas raciones de verdura u hortalizas consume al día? (las guarniciones o acompañamientos=½ ración) una ración=200g2 o más (al menos una de ellas en ensalada o crudas)=1 punto |
| 4. ¿Cuántas piezas de fruta (incluyendo zumo natural) consume al día?3 o más al día=1 punto |
| 5. ¿Cuántas raciones de carne roja, hamburguesa, salchichas o embutidos consume al día? (ración: 100-150g)Menos de una al día=1 punto |
| 6. ¿Cuántas raciones de mantequilla, margarina o nata consume al día? (porción individual: 12g)Menos de una al día=1 punto |
| 7. ¿Cuántas bebidas carbonatadas y/o azucaradas (refrescos, colas, tónicas, bitter) consume al día?Menos de una al día=1 punto |
| 8. ¿Bebe usted vino? ¿Cuánto consume a la semana?7 o más vasos a la semana=1 punto |
| 9. ¿Cuántas raciones de legumbres consume a la semana? (un plato o ración de 150g)3 o más a la semana=1 punto |
| 10. ¿Cuántas raciones de pescado-marisco consume a la semana? (plato pieza o ración: 100-150g de pescado o 4-5 piezas o 200g de marisco)3 o más a la semana=1 punto |
| 11. ¿Cuántas veces consume repostería comercial (no casera) como galletas, flanes, dulce o pasteles a la semana?Menos de 2 a la semana=1 punto |
| 12. ¿Cuántas veces consume frutos secos a la semana? (ración 30g)3 o más a la semana=1 punto |
| 13. ¿Consume usted preferentemente carne de pollo, pavo o conejo en vez de ternera, cerdo, hamburguesas o salchichas?(carne de pollo: una pieza o ración de 100-150g)Sí=1 punto |
| 14. ¿Cuántas veces a la semana consume los vegetales cocinados, la pasta, el arroz u otros platos adrezados con salsa de tomate, ajo, cebolla o puerro elaborada a fuego lento con aceite de oliva (sofrito)?2 o más a la semana=1 punto |
Para incrementar la adherencia a las recomendaciones de la dieta hay que atender a las características del paciente, del profesional y del sistema de salud. La Guía de prevención cardiovascular de la ESC 2021 propone las medidas siguientes239:
- a)
En la atención al paciente, es sabido que la consulta se centra en la comunicación y en la conexión entre el profesional y el paciente. Para mejorar la adherencia se precisa:
- -
Estar atento al paciente.
- -
Escucharle con atención.
- -
Identificar y resolver las barreras y dificultades (ya sean culturales, étnicas, religiosas, socio-económicas, etc.) que puedan dificultar el seguimiento de las recomendaciones.
- -
Señalar los objetivos de acuerdo con el paciente.
- -
Conectar con la historia de la persona afectada.
- -
Explorar las emociones.
- -
En algunos casos, especialmente en las consultas de pacientes de edad avanzada, se puede incluir en la sesión de consulta a un familiar o allegado. Un aspecto a tener en cuenta es que las mujeres, en comparación con los varones, tienen un bajo conocimiento de su propio RCV y, en consecuencia, una menor percepción de la necesidad de tratarse. Esta realidad justifica que se aconseje la realización de mayores esfuerzos para mejorar la concienciación, la evaluación de riesgos y el tratamiento de las mujeres.
En relación con los instrumentos para obtener información clínica del paciente, se dispone de:
- 1.
El principio OARS (preguntas abiertas, afirmación, escucha reflexiva y resumen) ayuda a los pacientes a presentar sus percepciones, y a los médicos a resumir.
- 2.
El principio SMART (Específico, Medible, Alcanzable, Realista, Oportuno) pueden ayudar a establecer metas para el cambio de comportamiento.
- b)
También se dispone de instrumentos para facilitar la adherencia a la dieta como indicaciones verbales, material escrito, uso de Internet, dispositivos portátiles, aplicaciones de teléfonos inteligentes e incluso clases de cocina.
- c)
En los profesionales de la salud se deben tener en cuenta sus conocimientos de nutrición y capacidad de transmitirlos, la oportunidad (física, social o ambiental) y la percepción de la motivación del paciente para cambiar su comportamiento. Para la motivación al cambio, se recomiendan enfoques conductuales multidisciplinares que combinen los conocimientos y habilidades de diferentes cuidadores. En la valoración de la motivación al cambio es útil la identificación de la actitud de las personas a través de las fases de cambio conductual. Con esta finalidad se puede utilizar el Modelo de Prochaska y Diclemente, que permite identificar los pacientes menos receptivos al cambio y estimular el estudio de las causas de la escasa receptividad298.
- d)
La sociedad puede contribuir en la reducción de las ECV con una mayor sensibilización enfocada en los beneficios de la dieta saludable.
Es fundamental implementar la prescripción dietética aprovechando cualquier momento en que el paciente acuda a la consulta para el control de sus factores de riesgo. Es aconsejable que, tras realizar la estratificación del RCV del paciente, se valore su grado de adherencia a un patrón dietético saludable con la realización de una encuesta tipo MEDAS (tabla 6), que permite identificar aspectos mejorables de sus hábitos dietéticos por un lado y acordar un plan de modificación adaptado a sus necesidades y preferencias por otro lado4,297,299. En consultas sucesivas hay que valorar el cumplimiento de los cambios propuestos e incentivar la adherencia; para ello es importante resaltar los beneficios producidos con los cambios dietéticos sobre parámetros antropométricos (peso, perímetro de la cintura) o bioquímicos (perfil glucémico, lipídico, etc.), PA o calidad de vida en general, que redundarán en una reducción del RCV. En la figura 3 se reproduce el algoritmo propuesto en el documento de consenso SEA/SEMEGEN 2019 para la prescripción de la modificación del estilo de vida en la prevención cardiovascular4.
La falta de adherencia es una de las principales causas del fracaso de las recomendaciones dietéticas. Por lo tanto, el reto es incrementar y mantener la adherencia, y vencer las dificultades para motivar el cambio en cada paciente, no solo para que adopte la dieta conveniente sino también el estilo saludable de vida para mejorar la salud en general y la salud cardiovascular en especial.
Estas reflexiones se orientan a alcanzar una alta adherencia a la dieta puesto que se asocia a reducción de la potencia de los factores de RCV y a la disminución de los episodios cardiovasculares, tanto en población de alto riego, como en el estudio PREDIMED5,300 como en pacientes con ECV previa, como en el estudio CORDIOPREV6,301. Huelga decir que para conseguir cambios beneficiosos se precisa la implicación del profesional sanitario, el paciente y la comunidad.
Niveles de evidencia sobre la adherencia a un patrón dietético saludable
| Evidencia | Grado |
|---|---|
| • Una alta adherencia a un patrón dietético saludable ejerceo un efecto beneficioso sobre los factores de RCV y la disminución de la ECV, tanto en población general o de alto riesgo como en pacientes con una ECV previa | Evidencia fuerte |
| • Un incremento de 2 puntos en la puntuación MEDAS se asocia con una disminución significativa del riesgo cardiovascular | Evidencia fuerte |
Este documento aspira a proporcionar a los profesionales sanitarios una actualización del conocimiento sobre la relación entre dieta y RCV, basado en las últimas evidencias disponibles, con el objeto de establecer unas recomendaciones dietéticas capitales sobre los principales grupos de alimentos y patrones dietéticos que puedan ser trasladadas a las personas que reciban consejo para la prevención cardiovascular.
Un aspecto considerado es la modificación del concepto tradicional de unidad nutricional básica de la dieta, que pasan de ser los nutrientes a los alimentos, integrados en un patrón alimentario, que en nuestro entorno es la dieta mediterránea tradicional, con probados beneficios en la reducción del RCV. En las tablas 7 y 8 se resumen las principales recomendaciones de ingesta de alimentos para la prevención cardiovascular así como la frecuencia deseable de su consumo. Las figuras 1A y B ilustran la relación entre los principales grupos de alimentos y patrones alimentarios, respectivamente, y el RCV.
Principales recomendaciones de consumo de alimentos para la prevención cardiovascular
| Grasas comestibles de origen vegetal |
| - Usar aceite de oliva virgen extra en la cocina y en la mesa |
| Verduras y frutas |
| - Cinco porciones diarias de verduras y frutas (una o más porciones pueden ser zumos sin azúcar añadido) |
| Tubérculos |
| - Patatas al gusto del consumidor, preferentemente con verduras o en guisos |
| Cereales |
| - En cada comida, al menos una ración de cereales (pan, arroz o pasta), de preferencia sin refinar |
| Carnes |
| - Carne no procesada hasta un máximo de 3 veces por semana, de preferencia aves de corral, carnes rojas magras y carnes blancas, retirando la grasa visible antes de cocinarlas |
| Huevos |
| - Su consumo no es perjudicial y hasta un huevo al día puede formar parte de una dieta saludable |
| Pescado |
| - Pescado o marisco, fresco o congelado, al menos 3 veces por semana, 2 de ellas en forma de pescado azul |
| Lácteos |
| - Al menos 2 raciones diarias de lácteos, enteros o desnatados, fermentados o no fermentados, sin azúcares añadidos |
| Frutos secos |
| - Un puñado de frutos secos (equivalente a unos 30g), preferentemente crudos, a diario o al menos 3 veces por semana, evitando los salados |
| Cacao y chocolate |
| - Cacao o chocolate negro (con una riqueza en cacao de al menos 50%) sin limitaciones |
| Café y té |
| - Hasta 5 tazas al día de café (filtrado o instantáneo, completo o descafeinado) o té en cualquier cantidad (verde o negro), limitando al máximo tanto el azúcar añadido como los edulcorantes artificiales |
| Bebidas alcohólicas |
| - Si se es bebedor habitual, vino con moderación durante las comidas |
| Bebidas azucaradas y edulcoradas |
| - Evitar tanto las bebidas con azúcares añadidos como las edulcoradas artificialmente, no solo refrescos, sino también zumos industriales y bebidas lácteas |
| Sal |
| - Reducir la ingesta de sal en la cocina y en la mesa, y limitar el consumo de precocinados, enlatados, salazones, embutidos, bebidas carbónicas y otros alimentos ultraprocesados |
| Alimentos procesados |
| - Evitar los alimentos ultraprocesados en la dieta y en su lugar consumir alimentos frescos, sin procesar o mínimamente procesados |
Frecuencia deseable en la forma y cantidad de consumo de alimentos
| Frecuencia de consumo | Diario | Tres veces por semanamáximo | Desaconsejadou ocasional |
|---|---|---|---|
| Grasas comestibles | Aceite de oliva virgen | Margarina para untar | Freír con aceites de semillas, margarina o mantequilla |
| Cereales | Pan, de preferencia integral. Pasta, arroz, maíz, otros | Bollería, repostería, galletas, etc. | |
| Frutas y verduras | Cinco raciones combinando los distintos tipos de frutas y verduras, incluyendo zumos naturales (sin azúcar) | Jugos de fruta comercialesFruta en almíbar | |
| Legumbres | Alubias, garbanzos, lentejas, etc., cocidas | Cocinadas con grasas tipo chorizo, beicon, etc. | |
| Tubérculos | Patatas y boniato, cocidos con verduras | Patatas fritas comerciales | |
| Frutos secos y cacahuetes | Crudos o tostados (30-45g) | Salados | |
| Huevos | No se desaconsejan los huevos enteros | ||
| Pescado y mariscoa | Azul o blancoMarisco (crustáceos y moluscos)Conservas al natural o en aceite de oliva | Conservas en aceites vegetales | Frituras comerciales, salazones, ahumados |
| Carnesb | Volatería y conejo | Carnes rojas magras | Carnes procesadas, embutidos |
| Productos lácteos | Leche y yogur enteros o desnatados (sin azúcar).Quesos de cualquier tipo | Mantequilla, nata | Quesos curados en pacientes hipertensos |
| Chocolate | Negro con cacao ≥70% | Negro con cacao<70% | Chocolate con leche y blanco |
| Café y té | Té sin limitación y café hasta 5 diarios, sin azúcar ni edulcorantes artificiales | ||
| Bebidas azucaradas o con edulcorantes artificiales | Evitar | ||
| Bebidas alcohólicas | Limitar a 30g de alcohol en los varones bebedores y 15g en las mujeres. Preferentemente bebidas fermentadas (vino, cerveza) con las comidas | No bebedores | |
| Sal | Entre 2,5-4g diarios | Salazones | |
| Preparación de los alimentosc | Preferiblemente cocidos, a la plancha o rehogados | Fritos en aceite de oliva virgen | Evitar ahumados, procesados y fritos con aceites de semillas |
DM: diabetes mellitus.
Una de las grandes limitaciones para implementar las recomendaciones de este documento estriba en la falta de «cultura nutricional o alfabetización alimentaria» en nuestro entorno. Por un lado, es crítico educar a los profesionales sanitarios sobre el impacto que tiene la alimentación como herramienta para la prevención y tratamiento de las ECV y el mantenimiento de la salud en general, mejorando su capacitación para tomar decisiones en su práctica clínica habitual. Los conocimientos sobre alimentación saludable deberían incorporase a la enseñanza de las ciencias de la salud de modo que cada profesional sanitario pueda transmitirlos al paciente en la práctica clínica. Por otro lado, también deberían plantearse estrategias que contribuyan a que la población tome decisiones informadas y a que adopten dietas saludables y hábitos de consumo responsables y sostenibles.