La Sociedad Española de Arteriosclerosis (SEA) tiene entre sus objetivos contribuir al conocimiento, prevención y tratamiento de las enfermedades vasculares, que son la primera causa de muerte en España y conllevan un elevado grado de discapacidad y gasto sanitario. La arteriosclerosis es una enfermedad multifactorial y su prevención exige un abordaje global que contemple los factores de riesgo asociados. Este documento resume la evidencia actual e incluye recomendaciones a seguir ante el paciente con enfermedad vascular establecida o con un elevado riesgo vascular (RV): se revisan los síntomas y signos a evaluar, los procedimientos de laboratorio e imagen a solicitar rutinariamente o en situaciones especiales, e incluye la estimación del RV, criterios diagnósticos de las entidades que son factores de riesgo vascular (FRV), y plantea recomendaciones generales y específicas para su tratamiento. Por último, se presentan aspectos poco referenciados en la literatura, como son, por ejemplo, la organización de una consulta de RV.
One of the objectives of the Spanish Society of Arteriosclerosis is to contribute to the knowledge, prevention and treatment of vascular diseases, which are the leading cause of death in Spain and entail a high degree of disability and health expenditure. Atherosclerosis is a multifactorial disease and its prevention requires a global approach that takes into account the associated risk factors. This document summarises the current evidence and includes recommendations for patients with established vascular disease or at high vascular risk: it reviews the symptoms and signs to evaluate, the laboratory and imaging procedures to request routinely or in special situations, and includes the estimation of vascular risk, diagnostic criteria for entities that are vascular risk factors, and general and specific recommendations for their treatment. Finally, it presents aspects that are not usually referenced in the literature, such as the organisation of a vascular risk consultation.
La medicina es una ciencia en perpetuo cambio. En los últimos años hemos asistido a un continuo avance en el diagnóstico y tratamiento de la enfermedad vascular aterosclerótica (EVA) y de sus factores de riesgo, por lo que es necesaria una actualización permanente de las guías terapéuticas.
La Sociedad Española de Arteriosclerosis (SEA) tiene entre sus objetivos contribuir al mejor conocimiento y control de los factores de riesgo vascular (FRV) en nuestro país, en especial de la dislipemia, a través de su red de Unidades de Lípidos. Por ello, la SEA ha decidido elaborar unos estándares para el control global del RV, una forma de resumir la evidencia científica y las recomendaciones nacionales e internacionales sobre los principales FRV. Como ya se indicó en la primera versión de estos estándares, el documento nació con la intención de ser revisado y actualizado de forma periódica, por lo que, en esta tercera edición, se han introducido cambios en todos los apartados. Simplemente, destacar entre otros, la desaparición del diagnóstico de hiperlipemia familiar combinada, la incorporación de las nuevas evidencias del efecto beneficioso del aceite de oliva en la prevención vascular (estudio Coronary diet intervention with olive oil and cardiovascular prevention [CordioPrev]), lo adecuado de seguir una dieta saludable no solo para el individuo sino para el planeta, el papel de los alimentos funcionales, la incorporación de los planes de tratamiento de los nuevos fármacos aprobados en nuestro país, como el ácido bempedoico, el icosapento de etilo (IPE) o la polipíldora, la indicación de semaglutida en el tratamiento de la obesidad, la incorporación de las recientes guías de la Sociedad Europea de Hipertensión (ESH) 2023 o los avances en el cribado y la prevención de la fibrilación auricular (FA). El objetivo de este documento es seguir siendo de utilidad a todos los clínicos que de una u otra forma atendemos a pacientes de riesgo vascular (RV), tanto desde la atención primaria como de la hospitalaria, en prevención primaria o secundaria, y, en general, a todos aquellos miembros que pertenecen a las sociedades que integran el Comité Español Interdisciplinario para la Prevención Vascular (CEIPV). Este documento va también dirigido a los profesionales en formación, no exclusivamente a los de las profesiones sanitarias, y en particular a los investigadores básicos interesados en el proceso de la arteriosclerosis.
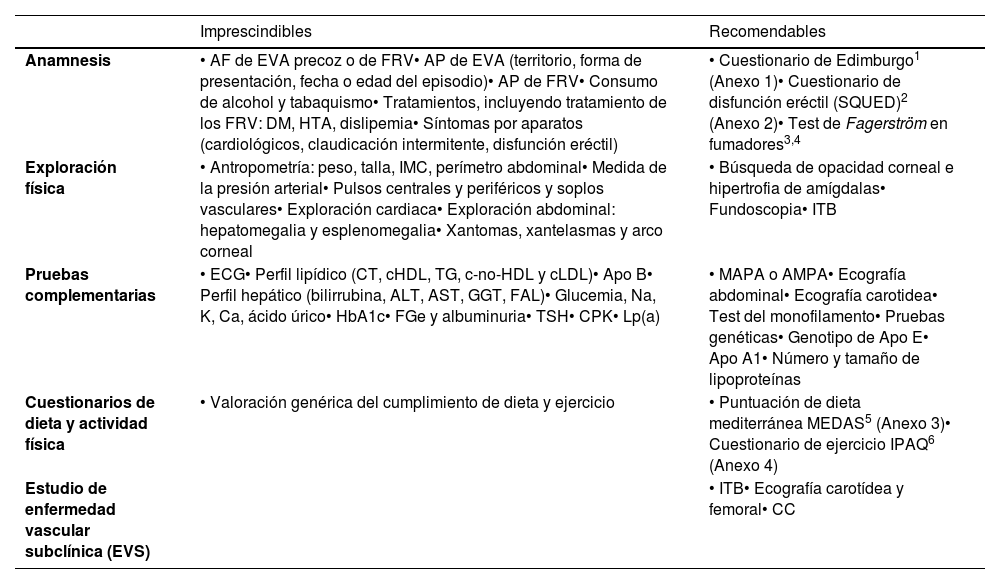
Anamnesis, exploración y pruebas complementarias en consultaLa historia clínica convencional y la recogida ordenada de síntomas y signos del paciente suponen el procedimiento común para establecer un diagnóstico clínico. La tabla 1 muestra de forma resumida los elementos que deben practicarse en una consulta que aborde el RV.
Anamnesis, exploración y pruebas complementarias para la estimación del RV
| Imprescindibles | Recomendables | |
|---|---|---|
| Anamnesis | • AF de EVA precoz o de FRV• AP de EVA (territorio, forma de presentación, fecha o edad del episodio)• AP de FRV• Consumo de alcohol y tabaquismo• Tratamientos, incluyendo tratamiento de los FRV: DM, HTA, dislipemia• Síntomas por aparatos (cardiológicos, claudicación intermitente, disfunción eréctil) | • Cuestionario de Edimburgo1 (Anexo 1)• Cuestionario de disfunción eréctil (SQUED)2 (Anexo 2)• Test de Fagerström en fumadores3,4 |
| Exploración física | • Antropometría: peso, talla, IMC, perímetro abdominal• Medida de la presión arterial• Pulsos centrales y periféricos y soplos vasculares• Exploración cardiaca• Exploración abdominal: hepatomegalia y esplenomegalia• Xantomas, xantelasmas y arco corneal | • Búsqueda de opacidad corneal e hipertrofia de amígdalas• Fundoscopia• ITB |
| Pruebas complementarias | • ECG• Perfil lipídico (CT, cHDL, TG, c-no-HDL y cLDL)• Apo B• Perfil hepático (bilirrubina, ALT, AST, GGT, FAL)• Glucemia, Na, K, Ca, ácido úrico• HbA1c• FGe y albuminuria• TSH• CPK• Lp(a) | • MAPA o AMPA• Ecografía abdominal• Ecografía carotidea• Test del monofilamento• Pruebas genéticas• Genotipo de Apo E• Apo A1• Número y tamaño de lipoproteínas |
| Cuestionarios de dieta y actividad física | • Valoración genérica del cumplimiento de dieta y ejercicio | • Puntuación de dieta mediterránea MEDAS5 (Anexo 3)• Cuestionario de ejercicio IPAQ6 (Anexo 4) |
| Estudio de enfermedad vascular subclínica (EVS) | • ITB• Ecografía carotídea y femoral• CC |
AF: antecedentes familiares; ALT: alanina aminotransferasa; AMPA: automedida de la presión arterial; AP: antecedentes personales; Apo A1: apolipoproteína A1; Apo B: apolipoproteína B; Apo E: apolipoproteína E; AST: aspartato aminotransferasa; Ca: calcio; CC: calcio coronario; cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; c-no-HDL: colesterol no HDL; CPK: creatina-fosfoquinas; CT: colesterol total; DM: diabetes mellitus; ECG: electrocardiograma; EVA: enfermedad vascular aterosclerótica; FAL: fosfatasa alcalina; FGe: filtrado glomerular estimado; FRV: factores de riesgo vascular; GGT: gamma glutamil transferasa; HbA1c: hemoglobina glicosilada; HTA: hipertensión arterial; IMC: índice de masa corporal; IPAQ: International Physical Activity Questionnaire; ITB: índice tobillo-brazo; K: potasio; Lp(a): lipoproteína (a); MAPA: monitorización ambulatoria de PA; MEDAS: Mediterranean Diet Adherence Screener; Na: sodio; SQUED: Screening Questionnaire for Erectile Dysfunction; TG: triglicéridos; TSH: hormona estimulante de tiroides.
Es necesario el conocimiento de los antecedentes familiares (AF) de primer grado, tanto en lo que se refiere a enfermedades prevalentes relacionadas con la EVA como a los FRV, sobre todo en los casos con sospecha de hipercolesterolemia familiar (HF) o de EVA prematura. Los AF tienen mayor valor cuando aparecen en familiares de primer grado (padre, madre, hijos o hermanos) y a edades tempranas de la vida, por debajo de los 55 años en el varón y por debajo de los 65 en la mujer.
Antecedentes personalesAdemás de los antecedentes personales (AP) convencionales (alergias, intervenciones quirúrgicas, etc.) se debe indagar específicamente en los antecedentes de EVA y en los diversos FRV mayores (diabetes mellitus [DM], hipertensión arterial [HTA], dislipemia, tabaquismo y obesidad). En caso de estar presentes se debe anotar la edad de inicio y los tratamientos que reciben o han recibido, independientemente de su indicación. En el caso de la terapia hipolipemiante, se debería indicar el tipo de tratamiento, su intensidad y los meses o años de este (o la fecha de inicio). Las reacciones adversas o la intolerancia a los medicamentos y la existencia de embarazo o posibilidad del mismo deben igualmente ser conocidas. Se debe cuantificar la potencia y la cronología de los FRV (número de cigarrillos al día y años de fumador, niveles máximos de colesterol unido a lipoproteínas de baja densidad [cLDL], hemoglobina glicosilada [HbA1c], presión arterial sistólica [PAS] y peso o índice de masa corporal [IMC]). Asimismo, debe registrarse la presencia de patologías sistémicas con carga inflamatoria de bajo grado, como la psoriasis, la enfermedad por virus de la inmunodeficiencia humana (VIH), la artritis reumatoide o el lupus eritematoso sistémico, la enfermedad pulmonar obstructiva crónica (EPOC) y las neoplasias, pues por sí mismas o por su tratamiento aumentan el RV. También deben recogerse en las mujeres los antecedentes de HTA o DM gestacional, síndrome de ovario poliquístico (SOP), la fecha de inicio de la menopausia y las terapias hormonales recibidas.
Anamnesis actual y por aparatosEs necesario indagar sobre el motivo de consulta, que en las de RV suele ser una falta de control de uno o más de los FRV. Se debe inquirir sobre los síntomas asociados con episodios isquémicos en los tres territorios vasculares principales, que hayan podido pasar desapercibidos o no estén diagnosticados aún (déficits neurológicos transitorios, dolor torácico con el esfuerzo, palpitaciones, disnea o claudicación intermitente), síntomas cardinales de la DM, cefalea o mareos asociados con elevación de las cifras de presión arterial (PA), y síntomas relacionados con procesos que causan HTA secundaria (tabla 2). Si el paciente ha sido instruido, sería aconsejable anotar las automedidas de la PA ambulatoria (AMPA).
Síntomas y signos sugestivos de hipertensión arterial secundaria
| Síntomas y signos |
|---|
| • Elevación paroxística de la PA, o HTA establecida con crisis añadidas, y la triada clásica de cefalea, sudoración y palpitaciones (feocromocitoma)• Empeoramiento rápidamente progresivo de una HTA preexistente• Aparición de HTA de novo, con aumento de la PAS y de la PAD en pacientes >65 años• Presencia de soplos abdominales como sospecha de HTA vasculorrenal• Ronquidos e hipersomnia (SAHOS)• Calambres musculares, debilidad (hipopotasemia por hiperaldosteronismo)• Edemas, astenia, tenesmo y polaquiuria (enfermedad renal)• Obesidad central, facies luna llena, equimosis, estrías (síndrome de Cushing)• Fármacos o drogas de abuso (alcohol, AINE, cocaína, anfetamina, regaliz, corticoides tópicos, etc.)• Ausencia de historia familiar de HTA• HTA grado 2 o grado 3 (PA ≥160/100 mmHg) en sujetos jóvenes (<35-40 años)• Aparición de HTA en niños• HTA resistente/refractaria: requiere más de tres o cinco fármacos para su control, respectivamente• Respuesta paradójica a betabloqueantes |
Debe registrarse el peso, la talla, el perímetro abdominal y calcularse el IMC. La PA debe medirse de acuerdo con las recomendaciones de la tabla 3, tanto en consulta como en domicilio9. La exploración cardiocirculatoria básica es obligada, en especial la presencia de soplos y la presencia y simetría de los pulsos arteriales; la interpretación de los hallazgos dependerá del contexto: una ausencia de pulsos pedios puede indicar en un anciano claudicante una enfermedad arterial periférica (EAP), mientras que una asimetría de pulsos en un joven hipertenso puede señalar coartación de la aorta. Debe recogerse el hallazgo de hepatomegalia y/o esplenomegalia. La presencia de xantomas, su morfología y su localización, en muchos casos constituyen un factor diagnóstico de primer nivel.
Condiciones básicas para una adecuada medida de la PA en la consulta
| Condiciones básicas |
|---|
| • La PA se medirá con un aparato oscilométrico validado de brazo• El paciente estará cómodamente sentado y en un ambiente relajado durante cinco minutos antes de iniciar la medida de la PA• Se realizarán y registrarán tres medidas separadas 1-2 minutos; se realizará alguna medida adicional si entre alguna de las lecturas hay una diferencia en la PAS >10 mmHg; se considerará como resultado la media de las dos últimas lecturas• En pacientes con arritmias, particularmente fibrilación auricular, se realizarán medidas adicionales y se considerará el uso de la técnica auscultatoria clásica en el caso de no disponer de un aparato oscilométrico validado al efecto• El manguito estándar, útil para la mayoría de los pacientes, medirá 12-13 cm de ancho y 35 cm de largo; se dispondrá de manguitos de talla más grande para brazos con una circunferencia >32 cm y de talla más pequeña para brazos de circunferencia <26 cm• El brazo donde se realiza la medida estará apoyado, relajado y el manguito a la altura del corazón• Cuando se utilice la técnica auscultatoria se usarán las fases I y V de los ruidos de Korotkoff para identificar la PAS y la PAD, respectivamente• La PA se medirá en ambos brazos en la primera visita para detectar posibles diferencias; se utilizará como referencia el brazo donde la PA sea más elevada• Tras las medidas en sedestación, se medirá la PA tras 1-3 minutos de bipedestación para detectar hipotensión ortostática (caída ≥20 o 10 mmHg en la PAS o PAD, respectivamente); esta maniobra se realizará en la primera visita a todos los pacientes y también en visitas sucesivas en pacientes de edad avanzada, con diabetes o con otras condiciones en las que la hipotensión ortostática es frecuente |
PA: presión arterial; PAD: presión arterial diastólica; PAS: presión arterial sistólica.
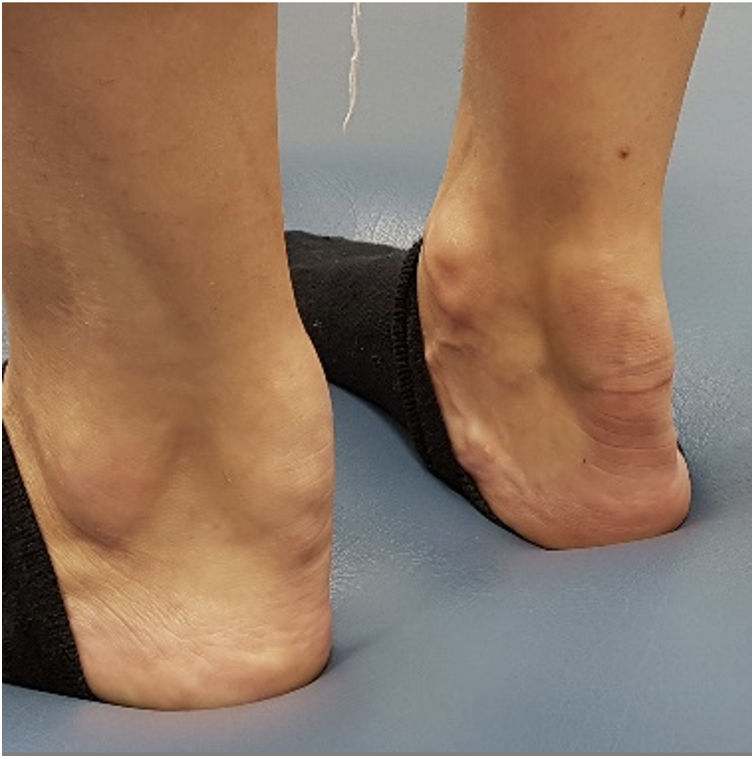
Como ejemplo orientativo, los xantomas tendinosos sugieren HF, los tuberoeruptivos indican quilomicronemia y los xantomas estriados palmares son característicos de la disbetalipoproteinemia. La presencia de xantomas de consistencia pétrea adheridos a superficies óseas es sugestiva de xantomatosis cerebro-tendinosa (fig. 1)10.
Pruebas complementariasLa evaluación del RV y el diagnóstico de las dislipemias requieren de un análisis de sangre. Las condiciones óptimas para su extracción, su procesamiento y su evaluación han sido publicadas en forma de consenso por las Sociedades Europeas de Arteriosclerosis (EAS) y medicina del laboratorio11 y pueden consultarse en el Anexo 5.
De acuerdo con el documento de consenso elaborado por 15 sociedades científicas españolas12, se debe contar con un perfil lipídico básico: colesterol total (CT), triglicéridos (TG), colesterol unido a lipoproteínas de alta densidad (cHDL), cLDL (estimado por la fórmula de Friedewald, Samson o Martin Hopkins o por método directo) y el cálculo del colesterol no HDL (c-no-HDL), que es una medida del colesterol aterogénico no influida por la concentración de TG. Las últimas guías europeas de prevención cardiovascular (2021) lo incluyen en el cálculo del RV13.
La determinación de la apolipoproteína B (Apo B) puede contribuir al cribado de disbetalipoproteinemia14. Adicionalmente, indica el número total de lipoproteínas aterogénicas y es un excelente marcador de eventos. Su determinación está recomendada por las guías europeas de cardiología, sobre todo, en pacientes con DM, obesidad visceral, síndrome metabólico (SM) o cuando existen niveles bajos de cLDL, circunstancias en las que la estimación del cLDL es menos fiable. La cuantificación de la concentración de lipoproteína(a) (Lp[a]) debe realizarse al menos una vez en la vida y lo ideal es hacerlo en la primera visita12. En pacientes con elevación importante de Lp(a), si existe una insuficiente respuesta farmacológica, la estimación del cLDL podría corregirse con la fórmula: cLDL corregido por Lp(a) (mg/dL)=cLDL (mg/dL) – [Lp(a) (mg/dL) x 0,3]12. Esta corrección es muy dependiente de la isoforma de Lp(a) y debe utilizarse únicamente de forma estimativa15. La elevación de la Lp(a) tiene un papel relevante en el incremento del RV que muestran algunos pacientes con HF, y en sujetos con enfermedad isquémica prematura, o recurrente, a pesar de que presenten un buen control del resto de FRV16. Los pacientes con Lp(a) muy elevada (> 180mg/dL) tienen un RV equivalente al de aquellos con hipercolesterolemia familiar heterocigota (HFHe).
En la primera visita debe solicitarse un hemograma convencional y pruebas de bioquímica en sangre que incluyan el perfil glucémico (glucemia en ayunas, HbA1c), la función renal y hepática, así como los niveles de creatina fosfoquinasa (CPK), sodio (Na), potasio (K), calcio (Ca), ácido úrico y hormona estimulante de tiroides (TSH). En la orina, preferentemente de la primera hora de la mañana, se debe solicitar la determinación del cociente albuminuria/creatinina urinaria. La medición de proteínas en orina es necesaria para descartar el síndrome nefrótico. Puesto que el riesgo de hepatotoxicidad por los tratamientos es excepcional17, no se recomienda el control sistemático de transaminasas durante la terapia con estatinas, excepto cuando haya un aumento de dosis (European Atherosclerosis Society/European SocietyCardiology [EAS/ESC] 2019)18. Un electrocardiograma (ECG) en reposo aporta información de valor en pacientes que son evaluados por HTA y puede mostrar signos compatibles con isquemia o necrosis miocárdica, crecimiento ventricular izquierdo o alteraciones del ritmo como la FA.
Anamnesis, exploración y pruebas complementarias en consulta: recomendablesAnamnesis: cuestionario de Edimburgo y cuestionario de disfunción eréctilDebe realizarse una anamnesis específica sobre el hábito de fumar, incluyendo el estudio de Fagerström en los fumadores (ver más adelante, en el apartado «Paciente fumador»). Ante la sospecha de claudicación intermitente, el cuestionario de Edimburgo, validado en nuestro país (Anexo 1), permite reforzar el diagnóstico clínico de la EAP1. El cuestionario para la valoración de disfunción eréctil (SQUED) se muestra en el Anexo 2.
Exploración físicaEn los pacientes con cHDL muy bajo, deberá buscarse de forma específica la presencia de opacidad corneal (déficit de lecitina colesterol aciltransferasa [LCAT] o la hipertrofia amigdalar [enfermedad de Tangier]). La fundoscopia aporta información valiosa en el examen del paciente con DM, en las quilomicronemias primarias (lipemia retinalis) y en las lesiones de órgano diana (LOD) de la HTA imprescindible en la HTA de grado 3 (PAS ≥ 180mmHg y/o PA diastólica (PAD) ≥ 110mmHg).
Pruebas complementarias adicionalesLa SEA entiende aconsejable medir el tamaño y la concentración de las lipopartículas cuando exista:
- •
Sospecha de desajuste entre la concentración de lípidos y el número de partículas, situación común en la DM, obesidad y en el SM.
- •
EVA precoz o recurrente, sin FRV que la justifiquen.
- •
Trastornos lipídicos raros o complejos, como concentraciones extremas de cHDL.
- •
Situaciones clínicas en las que no se pueden aplicar técnicas analíticas clásicas, como cuando existen concentraciones muy bajas de cLDL19.
La separación de lipoproteínas por ultracentrifugación podría ser de interés para la confirmación de la disbetalipoproteinemia (cociente colesterol de lipoproteínas de muy baja densidad [cVLDL]/TG en mg/dL >0,3)20 y para conocer la composición de las lipoproteínas plasmáticas, pero dado su elevado coste y complejidad, su uso queda bastante limitado. La determinación de la apolipoproteína A1 (Apo A1) se recomienda en el estudio de la hipercolesterolemia en la infancia. Un índice Apo B/Apo A1 superior a 0,82 ha mostrado mayor sensibilidad y especificidad en la detección de los portadores de una variante genética asociada a HF21.
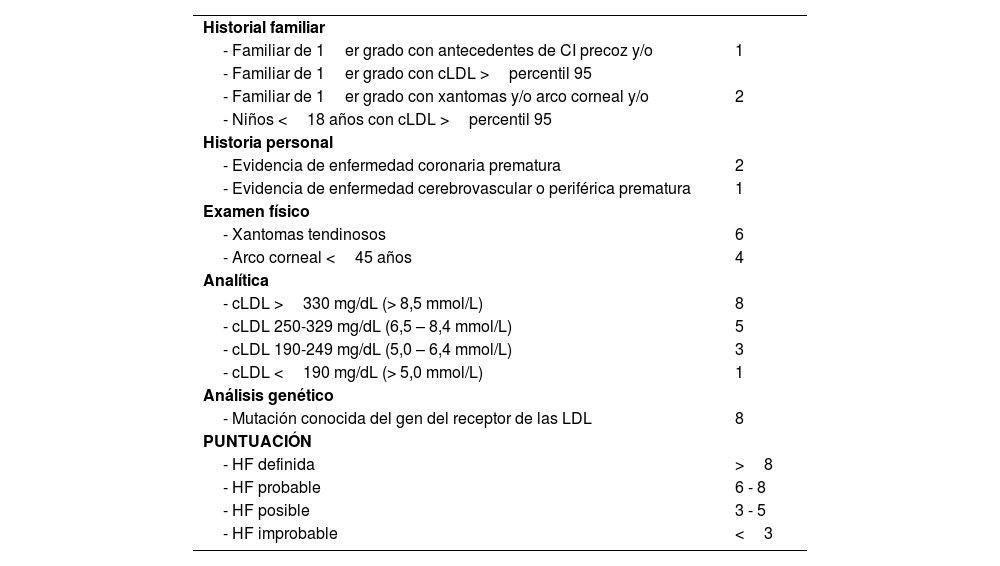
Ante la sospecha de HF debe utilizarse la escala clínica y bioquímica de la Dutch Lipid Clinic NetworkDiagnostic criteria for Familial Hypercholesterolemia (Anexo 6)22 y confirmarse con el diagnóstico genético. La existencia de procedimientos de secuenciación masiva y la comercialización de paneles genéticos para hipercolesterolemia permite el diagnóstico de la misma, la diferenciación entre formas heterocigotas, heterocigotas compuestas, dobles heterocigotas y homocigotas (estas tres últimas podrían agruparse como «bialélicas»). Entre todas estas formas puede haber solapamiento clínico y analítico)23 o el hallazgo de otras enfermedades con las que puede compartir fenotipo (déficit de lipasa ácida lisosomal o beta-sitosterolemia)24. El genotipo de apolipoproteína E (Apo E) se debe solicitar cuando existe sospecha de disbetalipoproteinemia. Las pruebas genéticas deben solicitarse solo ante la sospecha de una dislipemia monogénica25. Actualmente, los estudios genéticos que evalúan el riesgo de hipercolesterolemia poligénica grave tienen un escaso impacto para el diagnóstico y el tratamiento de los pacientes con dislipemias primarias y no deben ser solicitados con fines clínicos de forma rutinaria26. Entre las pruebas complementarias adicionales, la monitorización ambulatoria de la PA (MAPA) durante 24 horas debería solicitarse a todos los pacientes con HTA o sospecha de esta, estando especialmente indicada cuando haya discordancia entre las tomas de PA en consulta y ambulatorias, cuando exista una elevada variabilidad en su medición, cuando se sospeche HTA nocturna (p. ej., apneas del sueño) y en casos de HTA resistente13. La AMPA durante cinco a siete días, puede reemplazar a la MAPA, en especial durante el seguimiento, si se comprueba una buena concordancia entre ambas.
Estudio de la enfermedad vascular subclínicaLas pruebas que comentamos en este apartado se efectúan con la única intención de re-estratificar el RV de un sujeto, ya que conciernen a un paciente sin EVA establecida, ni síntomas que hagan sospecharla. Se refieren a un periodo de la historia natural del proceso aterosclerótico durante el cual, en ausencia de síntomas y signos, existen alteraciones estructurales vasculares demostrables. Por definición, solo puede conocerse su existencia mediante pruebas diagnósticas específicas. Tanto los FRV, como la enfermedad ateromatosa, tienen carácter sistémico, por lo que el hallazgo de afectación vascular en un territorio también aporta información del estado de la enfermedad en los demás territorios. Las técnicas exploratorias disponibles deben ser no invasivas y su utilización se plantea para la obtención de información complementaria en la estimación del RV, para redefinir los objetivos lipídicos y para orientar las decisiones terapéuticas27. También se ha propuesto la utilización de alguna de estas exploraciones para el cribado sistemático, y las más habituales para diagnosticar la EVA subclínica son las siguientes.
Índice tobillo/brazoEl índice tobillo/brazo (ITB) es el cociente de las presiones sistólicas del tobillo frente al brazo para cada miembro inferior. Un valor inferior a 0,9 indica la existencia de una estenosis mayor de 50% entre la aorta y las arterias distales de la pierna, con alta especificidad (90%) y una sensibilidad aceptable (79%)28; lo que permite identificar EAP significativa que puede cursar de modo silente o con síntomas mal definidos. Los valores ≥ 1,4 suelen indicar la presencia de calcificación arterial, una situación que también se asocia con un incremento del riesgo de complicaciones vasculares, especialmente frecuente en pacientes con DM. Por su sencillez, el ITB puede realizarse de forma sistemática en la evaluación del estado vascular del paciente, siempre que se disponga de un mini doppler portátil y de 15 minutos para su determinación.
La medición del ITB no está justificada en pacientes de bajo riesgo por su escasa rentabilidad29, mientras que esta es máxima cuando se efectúa en sujetos con los dos principales FRV asociados con EAP, como son la DM y el tabaquismo. En series españolas, hasta 25% de pacientes con DM tipo 2 (DM2) sin claudicación, tienen ITB < 0,930. En aquellos con DM de larga evolución y alta probabilidad de microangiopatía (que pueden identificarse con el estudio de monofilamento), el ITB tiene escasa sensibilidad para detectar casos de EAP debido a la elevada frecuencia de calcificación arterial que enmascara su medida.
Ecografía carotídea y femoralAunque la cuantificación del grosor íntima-media (GIM) carotídeo medido por ecografía ha sido ampliamente utilizado para evaluar la evolución del proceso arteriosclerótico e incluso del beneficio del tratamiento de la hipercolesterolemia, en la actualidad su uso no está recomendado para la re-estratificación del RV. No así la existencia de una placa carotídea27.
Se considera placa carotídea al engrosamiento focal mayor de 50% de la pared del vaso que lo rodea, o a un GIM mayor a 1,5mm que protruye en la luz adyacente31. No solo se valora su presencia sino también el número, el tamaño, la irregularidad y la ecodensidad, características que se asocian también con el riesgo de complicaciones vasculares en los territorios cerebral y coronario.
La presencia de placas femorales detectadas por resonancia magnética nuclear predice episodios adversos de EAP de extremidades inferiores32. La evidencia del valor de su detección por ecografía para mejorar la estratificación del RV se está evaluando en varios estudios observacionales en curso33.
Calcio coronarioLa tomografía axial computarizada (TAC) torácica permite la cuantificación del calcio coronario (CC), que se expresa en unidades Agatston34. La principal indicación sería de un individuo >40 años, asintomático y de riesgo intermedio35. La presencia de CC indica una fase avanzada de arteriosclerosis coronaria y predice mejor el riesgo de episodios isquémicos que la presencia de placas carotideas o femorales36,37. Cuando no existe calcificación alguna (Agatston=0), la probabilidad de lesión obstructiva coronaria es casi nula; mientras que el riesgo de complicaciones vasculares es mayor cuanto mayor es el grado de calcificación38. Existe un relativo consenso entre sociedades científicas en considerar un CC >100 uu Agatston como modificador de riesgo, sugiriendo, en estas circunstancias, el inicio de tratamiento con estatinas de alta intensidad, con o sin ácido acetilsalicílico a baja dosis35. Un CC >400 uu Agatston se relaciona con alta probabilidad de lesiones hemodinámicamente significativas y podría justificar la solicitud de un cateterismo cardiaco.
La angiografía por TAC muestra enfermedad coronaria estenótica subclínica, con la ventaja adicional de informar sobre el volumen de placa, el volumen del núcleo lipídico/necrótico y el máximo diámetro de la estenosis39. La información que aporta es independiente de la suministrada por el CC, que continúa identificando a pacientes con un riesgo superior aún en ausencia de estenosis40.
Rigidez de la pared arterialLa rigidez de la aorta, medida como la velocidad de la onda de pulso (VOP) carótido-femoral, es un marcador de riesgo independiente, pero en la actualidad no está recomendada como procedimiento de rutina debido a las dificultades técnicas y su reducida reproducibilidad13,41.
Cuestionarios de dieta y actividad física: escalas recomendadasMás allá de averiguar sobre datos generales de la dieta, como si esta es rica en carbohidratos o grasas saturadas o de alteraciones del patrón alimentario, la dieta puede ser evaluada con un simple cuestionario de 14 preguntas: Mediterranean Diet Adherence Screener (MEDAS) sobre adherencia a la dieta mediterránea (Anexo 3), que ha sido validado en el ensayo prevención con dieta mediterránea (PREDIMED) y se asocia con la presencia de FRV y con el RV42. Además, debe cuantificarse el consumo de alcohol, que puede hacerse anotando el número (volumen en mL) de cervezas, vino y/o de licor a la semana o cuantificando los gramos del alcohol ingeridos por semana, estimando una graduación de 6, 12 y 40 grados, respectivamente, mediante la fórmula (volumen en mL x graduación x 0,8)/100. La actividad física puede evaluarse de una forma semicuantitativa durante el trabajo (1=no trabaja o sedentario; 2=camina regularmente durante el trabajo; 3=camina regularmente y levanta pesos y 4=importante actividad física) como durante el tiempo de ocio (1=no realiza ejercicio; 2=camina al menos cuatro horas en semana; 3=camina >cuatro horas en semana y 4=entrenamiento vigoroso)43. Por último, es también posible cuantificar de forma simple la actividad física usando el cuestionario International Physical Activity Questionnaire (IPAQ), también validado6 y disponible online44 (Anexo 4).
Indicación de pruebas especialesAlgunos biomarcadores han sido ampliamente investigados como predictores del RV (homocisteína, fosfolipasa A2 asociada con lipoproteína, factores trombogénicos y fibrinolíticos) y no han sido incorporados a la rutina clínica por no aportar información adicional relevante del RV. En su conjunto, estos biomarcadores no tienen justificación clínica ya que no aumentan la capacidad predictora de episodios respecto del Systematic Coronary Risk Evaluation (SCORE) europeo13. Más controvertido es el papel del más estudiado de todos ellos, la proteína C reactiva (PCR) ultrasensible, que en diversos estudios ha mostrado su capacidad para predecir el RV. Su determinación en estudios epidemiológicos permite detectar pacientes que pueden presentar un riesgo residual independiente de los parámetros lipídicos, si bien presenta el inconveniente de una elevada variabilidad intraindividual que dificulta su utilización en la práctica clínica45.
En presencia de síntomas o signos sugestivos, o ante la sospecha de enfermedad, se deben solicitar las pruebas complementarias pertinentes, ergometría en caso de dolor torácico, o pruebas de imagen ante sospecha de HTA secundaria, test hormonales, etc.
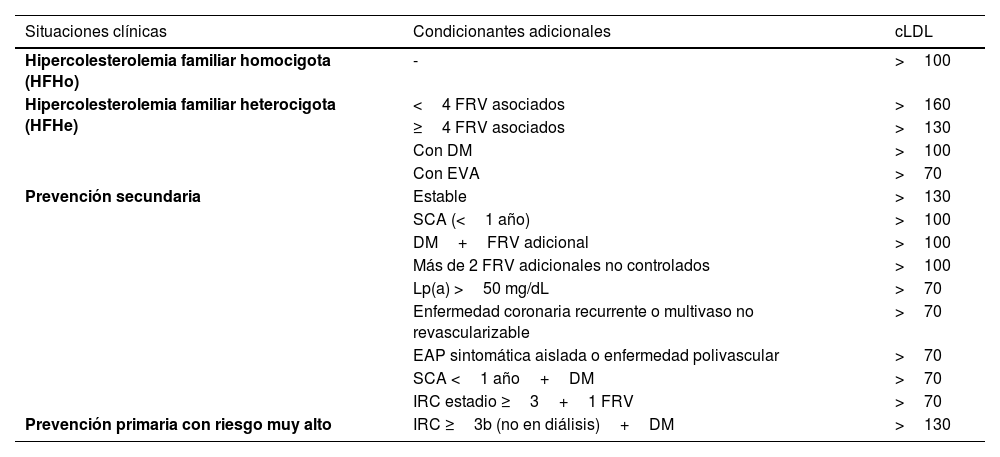
Diagnóstico del riesgo vascularRecogida de diagnósticos en la historia clínica: criterios diagnósticosTodo paciente atendido en una consulta de RV debe tener en su historia clínica un listado de diagnósticos estandarizados, que incluyen los recogidos en la tabla 4. Además, deben añadirse todos los diagnósticos derivados de las enfermedades que pudiera tener, tanto cardiovasculares como no cardiovasculares8,46–54.
Criterios diagnósticos
| Diagnóstico | Definición | ||
|---|---|---|---|
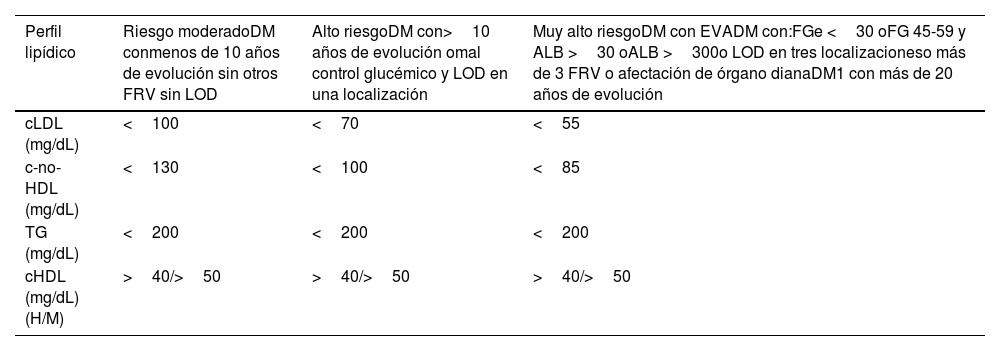
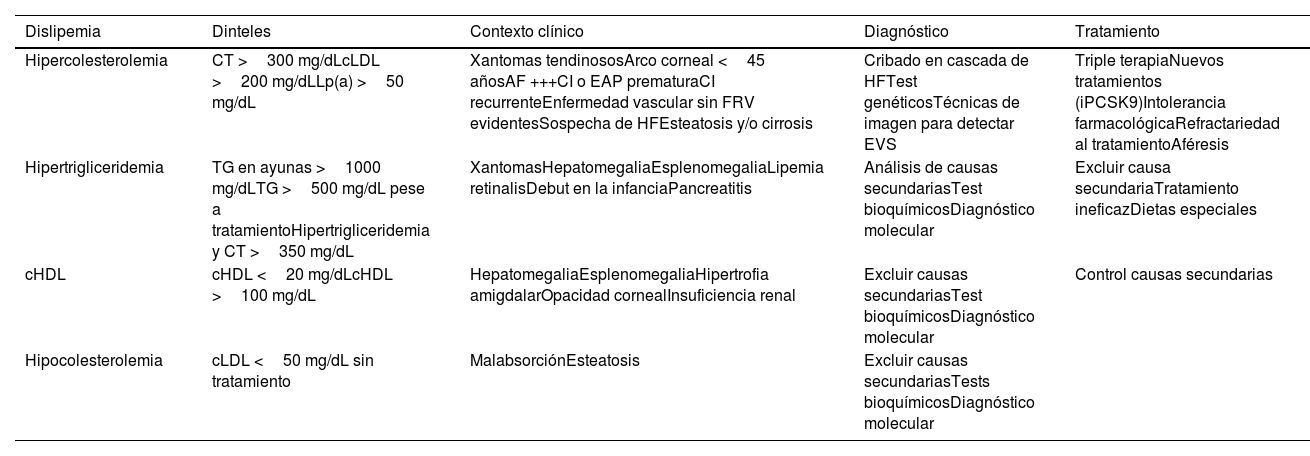
| HipercolesterolemiaNo existe una cifra óptima de CT o cLDL, dado que cuanto más baja su concentración, mejor. Se consideraría como colesterol elevado a aquellos valores a partir de los cuales se recomiende tratamiento hipolipemiante, los cuales dependen del riesgo basal de cada persona (Tabla 10) | • En prevención secundaria (enfermedad coronaria, cerebrovascular o arterial periférica) o si existen placas obstructivas en carótidas o coronarias: cLDL >55 mg/dL o c-no-HDL >85 mg/dL• En DM2, con LOD, EVS o con 3 o más FRV: cLDL >55 mg/dL o c-no-HDL 85 mg/dL• En DM2, sin LOD, sin EVS y con menos de 3 FRV: cLDL >70 mg/dL o c-no-HDL >100 mg/dL• En pacientes con ERC grado 3, sin LOD ni EVS: cLDL >70 mg/dL o c-no-HDL >100 mg/dL• En pacientes con ERC grado 3, con LOD o EVS: cLDL >55 mg/dL o c-no-HDL >85 mg/dL• En pacientes con ERC grados 4 o 5: cLDL >55 mg/dL o c-no-HDL >85 mg/dL• En pacientes sin enfermedad cardiovascular, DM ni ERC cLDL >116 mg/dL en función de si el riesgo es bajo o moderado de acuerdo con SCORE2 | ||
| Hipertrigliceridemia | • TG deseables <150 mg/dL• Hipertrigliceridemia:∘ Leve: 150 – 499 mg/dL∘ Moderada: 500 - 1.000 mg/dL∘ Grave: >1.000 mg/dL | ||
| Hiperlipemia mixta | Concentraciones elevadas tanto de cLDL o c-no-HDL como de TG | ||
| Hipercolesterolemia familiar | Según las tablas de la Dutch Lipid Clinic Network Diagnostic criteria for Familial Hypercholesterolemia (Anexo 6) | ||
| Dislipemia aterogénica | Hipertrigliceridemia (TG >150 mg/dL) y cHDL bajo (<40 mg/dL en varones y <45 mg/dL en mujeres). Aumento del número de partículas LDL pequeñas y densas | ||
| Abeta/hipobetaliproteinemia | Apo B inferior al percentil 10, según edad, raza y sexo | ||
| Hipoalfalipoproteinemia | cHDL inferior al percentil 10, según edad, raza y sexo | ||
| Hiperlipoproteinemia (a) | Lp(a) ≥50 mg/dL o ≥120 nmol/L | ||
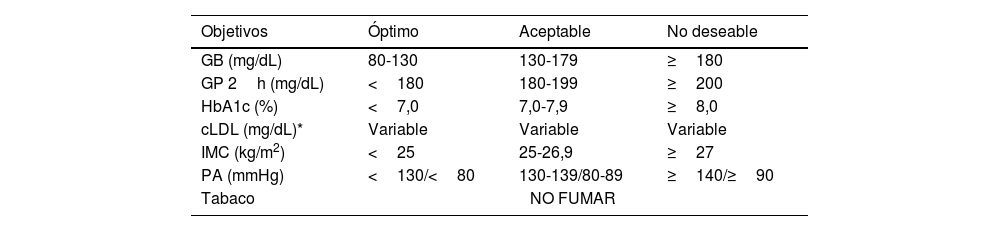
| HTA (medidas en consulta) | • PA óptima: PAS <120 y PAD <80 mmHg• Normal: PAS 120-129 y PAD 80-84 mmHg• Normal-alta PAS 130-139 o PAD 85-89 mmHg• HTA grado I: PAS 140-159 y/o PAD 90-99 mmHg• HTA grado II: PAS 160-179 y/o PAD 100-109 mmHg• HTA grado III: PAS ≥180 y/o PAD ≥110 mmHg• HTA sistólica aislada: PAS ≥140 y PAD <90 mmHgEl diagnóstico se establece tras comprobar los valores de PA en al menos dos medidas en dos o más visitas separadas varias semanas.Cuando la PAS y la PAD se ubiquen en distintas categorías, se aplicará la categoría superior.La HTA sistólica aislada se clasifica en grados (1, 2 o 3) según el valor de la PA sistólica | ||
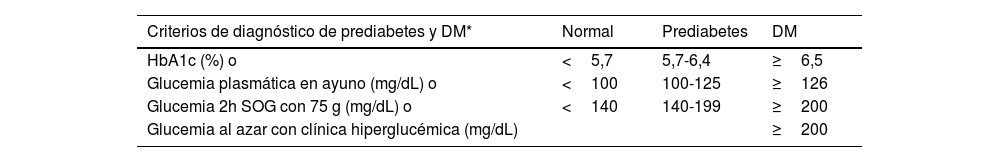
| DM | • Glucemia en ayunas de al menos 8 horas ≥126 mg/dL (7,0 mmol/L)*, o• Glucemia 2 horas tras una SOG de 75 g ≥200 mg/dL (11,1 mmol/L)*, o• HbA1c ≥6,5% (48 mmol/mol), o• Paciente con síntomas clásicos de hiperglucemia con un valor de glucemia ≥200 mg/dL, independientemente de la situación de ayuno (11,1 mmol/L)* | ||
| Prediabetes | Presencia de:• Glucemia en ayunas alterada: glucemia en ayunas entre 100 mg/dL (5,6 mmol/L) y 125 mg/dL (6,9 mmol/L), o• Intolerancia a la glucosa: glucemia 2 horas tras SOG de 75 g, entre 140 mg/dL (7,8 mmol/L) y 199 mg/dL (11,0 mmol/L), o• HbA1c entre 5,7 y 6,4% (39–47 mmol/mol) | ||
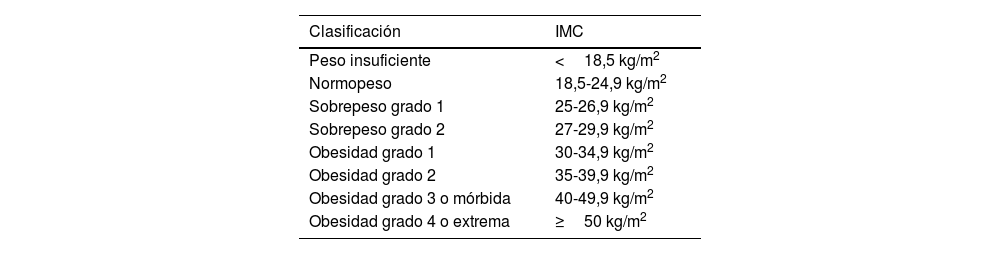
| Obesidad | IMC ≥30,0 kg/m2• Obesidad grado I: 30,0-34,9 kg/m2• Obesidad grado II: 35,0-39,9 kg/m2• Obesidad grado III: ≥40 kg/m2 | ||
| Sobrepeso | IMC ≥25,0 kg/m2 y <30,0 kg/m2• Grado I: 25,1-27,5 kg/m2• Grado II: 27,6-30,0 kg/m2 | ||
| Normopeso | IMC 18,50-24,9 kg/m2 | ||
| Bajo peso | IMC <18,5 kg/m2• Delgadez extrema <16,0 kg/m2• Delgadez moderada 16,0-16,9 kg/m2• Delgadez leve 17,0-18,4 kg/m2 | ||
| Síndrome metabólico | Se requieren 3 de los siguientes 5 criterios:• Perímetro abdominal elevado (≥94 cm en varones y ≥80 cm en mujeres de origen europeo)• TG ≥150 mg/dL (1,7 mmol/L) o en tratamiento con fármacos que reduzcan los TG• cHDL <40 mg/dL (1,0 mmol/L) en varones o <50 mg/dL (1,3 mmol/L) en mujeres o en tratamiento con fármacos dirigidos a aumentar el cHDL• PA ≥130/85 mmHg o en tratamiento con fármacos dirigidos a reducir la PA• Glucemia en ayunas ≥100 mg/dL o en tratamiento con fármacos antidiabéticos | ||
| Fumador actual52 | Es la persona que ha fumado por lo menos un cigarrillo en los últimos seis meses. Dentro de este grupo se puede diferenciar:• Fumador diario: es la persona que ha fumado por lo menos un cigarrillo al día, durante los últimos seis meses• Fumador ocasional: es la persona que ha fumado menos de un cigarrillo al díaCuantificación del consumo de tabaco (índice paquetes/año): (N° cigarrillos fumados al día x N° años de fumador)/20) | ||
| Ex fumador | Es la persona que habiendo sido fumador se ha mantenido en abstinencia completa al menos los últimos seis meses | ||
| Nunca fumador | Es la persona que nunca ha fumado o ha fumado menos de 100 cigarrillos en toda su vida | ||
| Fumador pasivo | Es la persona que no fuma, pero que respira habitualmente el humo de tabaco ajeno o humo de segunda mano o humo de tabaco ambiental | ||
| Lesión de órgano diana | • Rigidez arterial: presión de pulso (en el anciano) ≥60 mmHg o VOP >10 m/s• Hipertrofia ventricular izquierda:∘ en el ECG (índice Sokolow–Lyon >3,5 mV; RaVL >1,1 mV; producto voltaje por duración Cornell >2440 mV*ms), o∘ ecocardiográfica (masa de ventrículo izquierdo >115 g/m2 en varones o >95 g/m2 en mujeres por área de superficie corporal)• Cociente albuminuria/creatinina >30 mg/g o albuminuria >30 mg/24 h | ||
| EVS | Presencia de:• ITB <0,9 (para algunos autores un valor >1,4 es también patológico), o• Al menos una placa en arteria coronaria epicárdica, carótida o femoral, o• Cuantificación de CC: Agatston ≥100 unidades | ||
| FG (mL/min/1,73 m2) en la ERC | Grado | FG | Definición |
| G1 | ≥90 | Normal | |
| G2 | 60-89 | Ligero descenso del FG | |
| G3a | 45-59 | Descenso ligero-moderado del FG | |
| G3b | 30-44 | Descenso moderado del FG | |
| G4 | 15-29 | Descenso grave del FG | |
| G5 | <15 | Fallo renal (prediálisis) | |
| Categorías de albuminuria (cociente albuminuria/ creatinina en mg/g) en la ERC | A1 | <30 | Normal |
| A2 | 30-300 | Moderadamente elevada | |
| A3 | >300 | Muy elevada | |
* En ausencia de hiperglucemia inequívoca los resultados deben repetirse con un segundo análisis.
Apo B: apolipoproteína B; CC: calcio coronario; cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; c-no-HDL: colesterol-no-HDL; CT: colesterol total; DM: diabetes mellitus; DM2: diabetes mellitus tipo 2; ECG: electrocardiograma; ERC: enfermedad renal crónica; EVA: enfermedad vascular aterosclerótica; EVS: enfermedad vascular subclínica; FG: filtrado glomerular; FRV: factores de riesgo vascular; GIM: grosor íntima-media; HbA1c: hemoglobina glicosilada; HDL: lipoproteínas de alta densidad; HTA: hipertensión arterial; IMC: índice de masa corporal; ITB: índice tobillo-brazo; LDL: lipoproteínas de baja densidad; LOD: lesión de órgano diana; Lp(a): lipoproteína (a); PA: presión arterial; PAD: presión arterial diastólica; PAS: presión arterial sistólica; RaVL: voltaje de la onda R en la derivación; SCORE2: Systematic Coronary Risk Estimation 2; SOG: sobrecarga oral de glucosa; TG: triglicéridos; VOP: velocidad de onda de pulso.
Nota: Definición adaptada de las Sociedades Europeas de HTA y de Cardiología.
Uno de los primeros pasos que se deben realizar al evaluar a pacientes sin EVA con FRV, es el cálculo del RV, ya que hay determinadas decisiones que se tomarán en un sentido u otro según el nivel o valor del RV, como, por ejemplo, el momento de iniciar tratamiento hipolipemiante y su objetivo terapéutico.
El riesgo (absoluto) es la probabilidad de que ocurra un determinado episodio vascular en un periodo de tiempo definido en base a los FRV que tiene el paciente que pertenece a un determinado grupo poblacional. Por lo tanto, no hay un sistema universal de cálculo del RV. Las guías europeas de prevención cardiovascular13 y las de control de la dislipemia27 a las que se adhiere la SEA a través del CEIPV, recomiendan el uso del sistema SCORE255 para valorar el RV en su versión para países de bajo riesgo, en situación de prevención primaria, es decir, para individuos que aún no han tenido episodios vasculares.
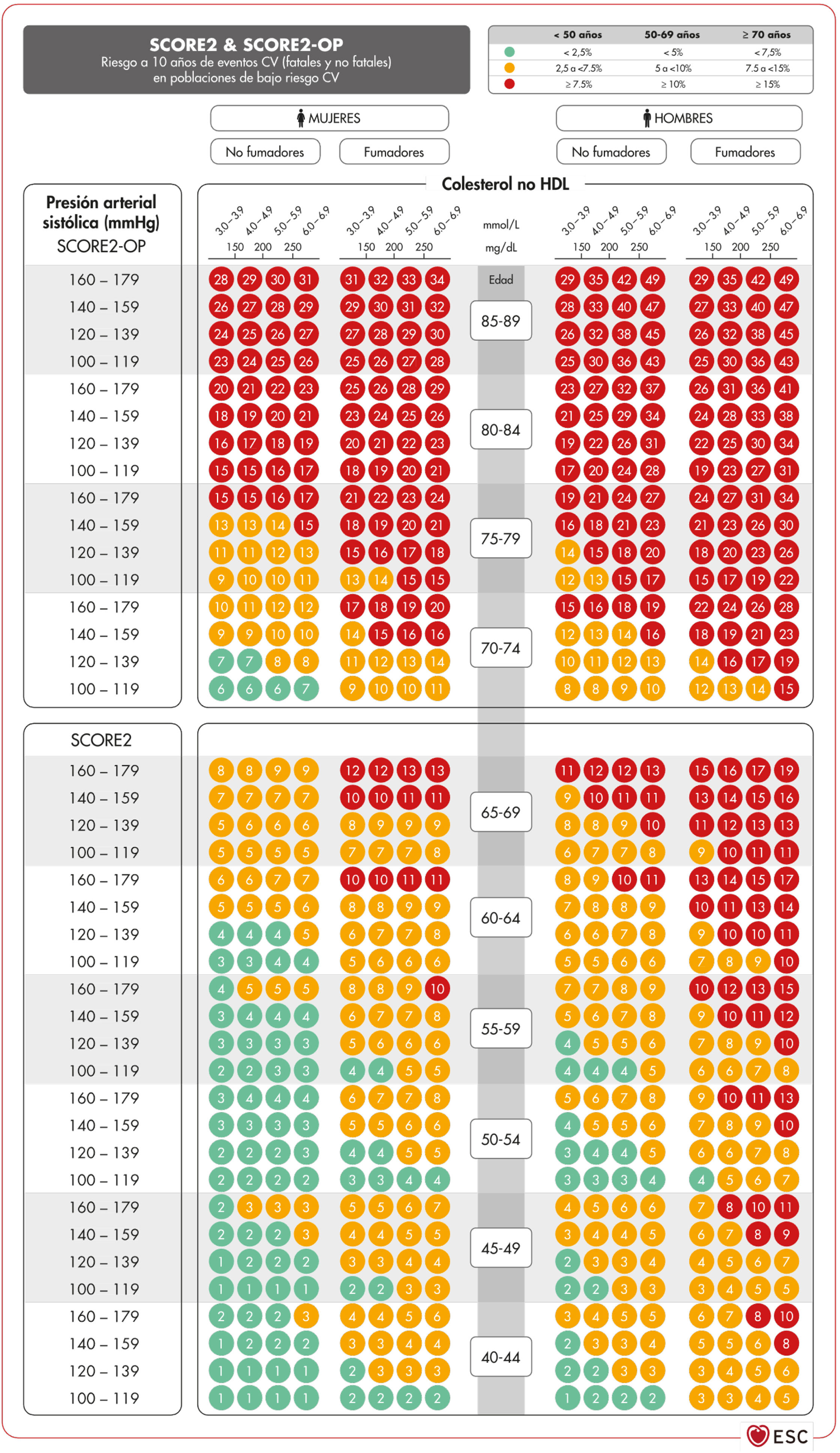
Cálculo de riesgo vascular: proyectos Systematic Coronary Risk Evaluation2 (SCORE2) y Systematic Coronary Risk Estimation 2-Older Persons (SCORE2-OP)El SCORE256,57 recoge el riesgo tanto de padecer una complicación vascular como de muerte vascular en los siguientes 10 años. Para obtener las tablas del sistema SCORE2, se realizó un análisis de 45 cohortes de 43 países, incluyendo 677.684 personas y 30.121 episodios CV. Las variables que predicen el riesgo de complicaciones mortales y no mortales son sexo, edad, tabaquismo (dicotómica), PAS, y en este nuevo índice el parámetro lipídico incluido es el c-no-HDL. No se incluye la DM dado que se considera a priori una condición de alto riesgo. Sin embargo, recientemente se han publicado tablas específicas de riesgo para los pacientes con DM58. La ecuación de riesgo está modulada por la incidencia de eventos vasculares de cada país por lo que los índices finales están distribuidos en cuatro zonas: riesgo bajo (en la que se incluye España), moderado, alto y muy alto; mostrando un claro gradiente este-oeste. Los valores son aplicables hasta los 70 años, habiéndose desarrollado por separado unas tablas específicas para personas de edad superior que alcanza hasta los 89 años (Systematic Coronary Risk Estimation 2-Older Persons [SCORE2-OP])57 a partir de otras cohortes, pero con el mismo análisis matemático que SCORE2 (fig. 2)13.
Tablas SCORE2 y SCORE2-OP para países de bajo riesgo cardiovascular13.
CV: cardiovascular; HDL: lipoproteína de alta densidad; SCORE2: Systematic Coronary Risk Estimation 2; SCORE2-OP: Systematic Coronary Risk Estimation 2-Older Persons.
Fuente: Visseren F.L.J., et al., 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice: Developed by the Task Force for cardiovascular disease prevention in clinical practice with representatives of the European Society of Cardiology and 12 medical societies with the special contribution of the European Association of Preventive Cardiology (EAPC), European Heart Journal 2021; 42 (34): 3227–3337 doi:10.1093/eurheartj/ehab484. Traducido y reproducido con permiso de Oxford University Press en nombre de la European Society of Cardiology. OUP y European Society of Cardiology no se responsabilizan ni responden en modo alguno de la exactitud de la traducción. El licenciatario es el único responsable de la traducción en esta publicación/reimpresión13.
Con base en estos nuevos índices SCORE2 y SCORE2-OP el RV a 10 años se distribuye en tres categorías en tres franjas de edad:
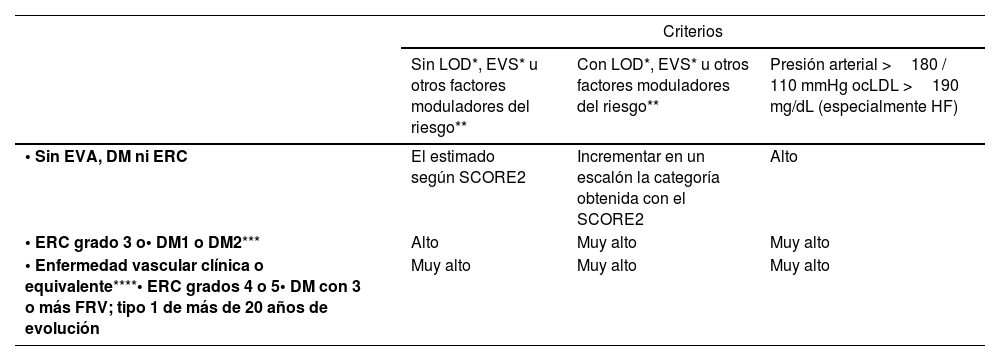
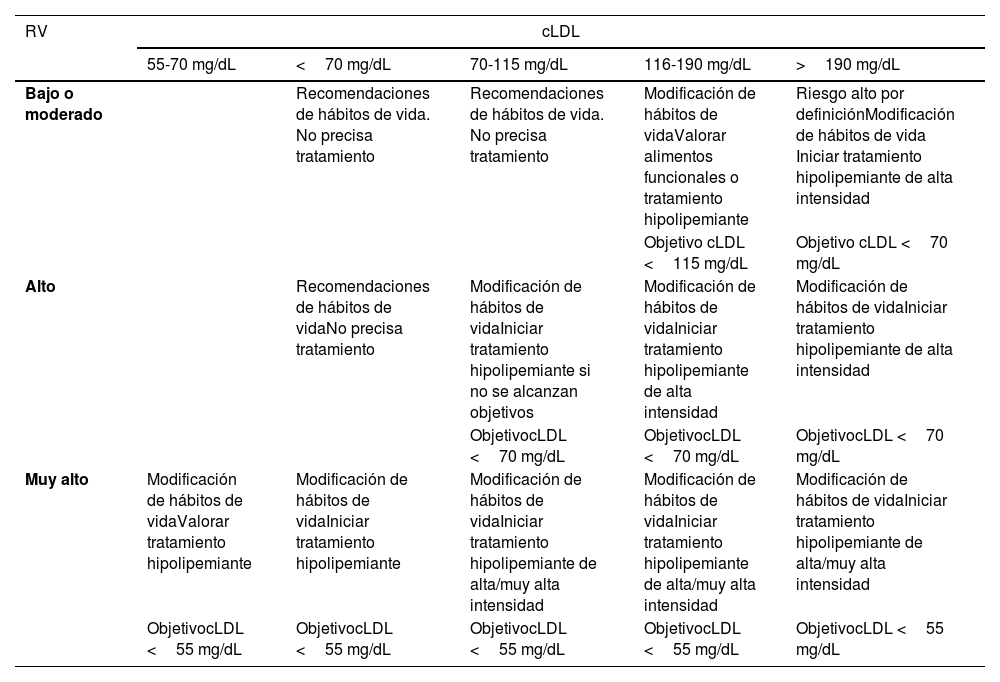
Cálculo global del riesgo vascularEl cálculo general del RV debe realizarse mediante una valoración global del paciente que incluya no exclusivamente el valor del riesgo calculado con SCORE2, sino integrando factores modificadores del riesgo, datos de LOD y la presencia de EVA (tabla 5)8,13,18.
Estimación del riesgo vascular global
| Criterios | |||
|---|---|---|---|
| Sin LOD*, EVS* u otros factores moduladores del riesgo** | Con LOD*, EVS* u otros factores moduladores del riesgo** | Presión arterial >180 / 110 mmHg ocLDL >190 mg/dL (especialmente HF) | |
| • Sin EVA, DM ni ERC | El estimado según SCORE2 | Incrementar en un escalón la categoría obtenida con el SCORE2 | Alto |
| • ERC grado 3 o• DM1 o DM2*** | Alto | Muy alto | Muy alto |
| • Enfermedad vascular clínica o equivalente****• ERC grados 4 o 5• DM con 3 o más FRV; tipo 1 de más de 20 años de evolución | Muy alto | Muy alto | Muy alto |
El incremento del riesgo depende del número e intensidad de los factores moduladores. En general se precisa de varios de ellos o de una extrema gravedad de estos para elevar la categoría de riesgo al mismo nivel que lo hacen la presencia de EVS o LOD. Los factores moduladores serían:
• Obesidad o sedentarismo
• Individuos en situación de exclusión social
• Intolerancia a la glucosa o glucemia en ayunas alterada
• Elevación de TG, Apo B, Lp(a)
• AF de EVA precoz
• Enfermedades que supongan aumento de estrés inflamatorio-metabólico: enfermedades autoinmunes, SAHOS, EPOC, AR, SM, lupus eritematoso sistémico, psoriasis, cáncer, VIH
• Enfermedades psiquiátricas graves
• Hígado graso no alcohólico
Los pacientes con DM1 menores de 35 años o tipo 2 menores de 50 años, y con menos de 10 años de evolución, pueden tener un riesgo CV moderado
Se considera EVA o equivalente a las siguientes condiciones:
• EVA clínica establecida:
∘ Episodio coronario (SCA, angina estable, procedimiento de revascularización)
∘ Episodio cerebrovascular: ictus o AIT
∘ EAP sintomática
∘ Aneurisma de aorta abdominal
∘ EVA evidente por técnicas de imagen, es decir, presencia de placa de ateroma significativa:
■ Mediante angiografía o TAC coronario (enfermedad multivaso con obstrucción >50% de dos arterias epicárdicas)
■ Mediante ecografía carotidea o femoral (estenosis >50%)
AF: antecedentes familiares; AIT: accidente isquémico transitorio; Apo B: apolipoproteína B; AR: artritis reumatoide; cLDL: colesterol unido a lipoproteínas de baja densidad; CV: cardiovascular; DM: diabetes mellitus; DM1: diabetes mellitus tipo 1; DM2: diabetes mellitus tipo 2; EAP: enfermedad arterial periférica; EPOC: enfermedad pulmonar obstructiva crónica; ERC: enfermedad renal crónica; EVA: enfermedad vascular aterosclerótica; EVS: enfermedad vascular subclínica; FE: fracción de eyección; FRV: factores de riesgo vascular; HF: hipercolesterolemia familiar; HTA: hipertensión arterial; IC: insuficiencia cardíaca; LOD: lesión de órgano diana; Lp(a): lipoproteína (a); RV: riesgo vascular; SAHOS: síndrome de apnea-hipopnea obstructiva del sueño; SCA: síndrome coronario agudo; SCORE2: Systematic Coronary Risk Estimation 2; SM: síndrome metabólico; TAC: tomografía computarizada; TG: triglicéridos; VIH: virus de la inmunodeficiencia humana.
Se aconseja seguir la estrategia de las guías europeas de prevención cardiovascular y de control de dislipemia, así como las de HTA, que clasifican a los sujetos en cuatro categorías de riesgo: bajo, moderado, alto y muy alto.
Hay situaciones que cualifican directamente a un riesgo alto o muy alto: HTA de grado 3, hipercolesterolemia con cLDL >190mg/dL, DM, LOD, enfermedad renal crónica (ERC) estadio 3 o mayor o EVA establecida. En el resto de las situaciones utilizaremos el sistema SCORE2 con los puntos de corte indicados en el apartado anterior. La presencia de modificadores de riesgo supone incrementar una categoría de riesgo en caso de valores próximos a una categoría superior.
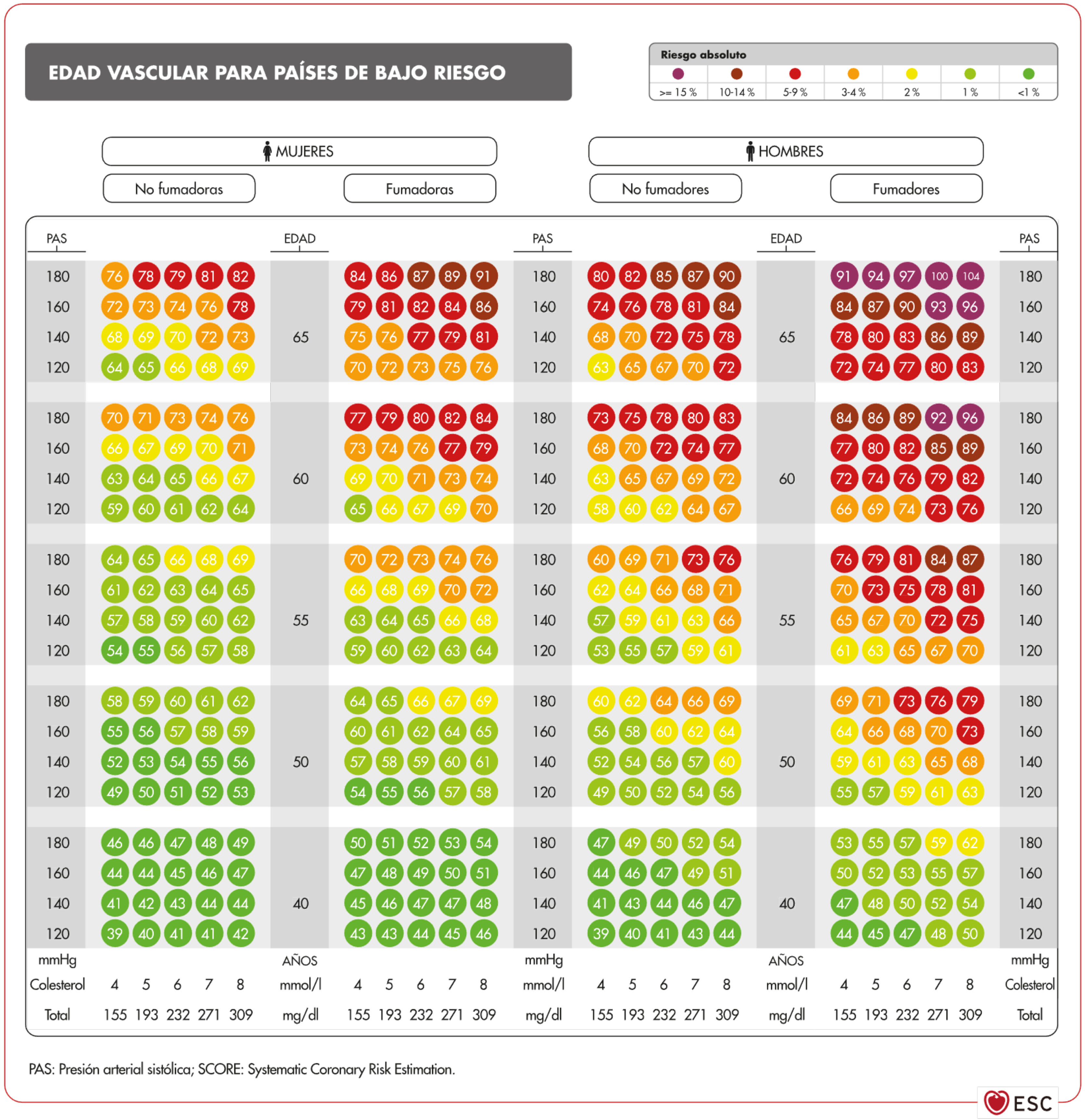
Edad vascular y riesgo relativoEn los adultos jóvenes con elevación importante de múltiples FRV se puede calcular la edad vascular (fig. 3)59. Comunicar al paciente este dato suyo es una forma de transmitir la información de su estado de RV que se puede entender mejor que el valor matemático del riesgo absoluto. Las personas deben ser conscientes de su estado de riesgo para que adopten las medidas terapéuticas de estilos de vida y, si es el caso, farmacológicas.
Tabla de la edad vascular según SCORE para países de bajo riesgo cardiovascular59.
Fuente: Cuende J.O., et al., How to calculate vascular age with the SCORE project scales: a new method of cardiovascular risk evaluation, European Heart Journal, 2010, 31, Issue 19, 2351–2358, doi:10.1093/eurheartj/ehq205. Traducido y reproducido con permiso de Oxford University Press en nombre de la European Society of Cardiology. OUP y la European Society of Cardiology no se responsabilizan en modo alguno de la exactitud de la traducción. El licenciatario es el único responsable de la traducción en esta publicación/reimpresión59.
Mediante la tabla de edad vascular derivada del SCORE se puede informar del riesgo absoluto y de la edad vascular. El cálculo de esta última no requiere calibración por lo que puede ser aplicado a cualquier población general, no existiendo diferencias territoriales.
Tanto la edad vascular como el riesgo relativo se pueden emplear a cualquier edad, y tienen más utilidad clínica para sujetos con un riesgo absoluto a corto plazo no elevado. La consideración exclusiva del riesgo absoluto puede conducir a infravalorar FRV controlables con importantes efectos en el riesgo a lo largo de la vida.
Derivado del concepto de edad vascular está la velocidad de envejecimiento vascular60, que relaciona la edad vascular y la cronológica.
Riesgo vascular en pacientes con hipercolesterolemia familiarPara pacientes con HF, que no aplican para las tablas habituales de cálculo del RV, se han creado varias herramientas específicas. Una de ellas está basada en los datos de seguimiento de la cohorte española Spanish Familial Hypercholesterolemia Cohort Study (SAFEHEART)61. Esta ecuación tiene en cuenta diversos factores como la edad, tabaquismo, los niveles de cLDL en tratamiento, el IMC, la PA y los niveles de Lp(a) y permite matizar el riesgo en esta población. El registro de la SEA aporta otro instrumento de estratificación del RV en pacientes con HF en tratamiento con estatinas basado en la presencia de otros FRV (sexo masculino, obesidad, HTA, DM), niveles máximos de cLDL y estudio genético positivo para HF62. Por último, en pacientes con fenotipo de HF, se ha desarrollado una herramienta para el cálculo de riesgo: el Catalan Primary Care System Database - Familial Hypercholesterolemia phenotype (SIDIAP-FHP) con mejor capacidad predictiva tanto en prevención primaria como en secundaria63.
Recomendaciones generales para el control del riesgo vascularRecomendaciones generales a la población para reducir su riesgo vascularEl grupo de trabajo de Nutrición y Estilo de Vida de la SEA dispone de un detallado documento de consenso64, que aporta evidencias útiles y jerarquizadas, que sirven de herramienta a los profesionales de la salud para ayudar a sus pacientes, partiendo del concepto de que las recomendaciones saludables deben ser las mismas para el control de cualquier FRV y para la prevención primaria y secundaria de la EVA. En él se resume la evidencia acumulada sobre componentes del estilo de vida como la dieta y el ejercicio físico64. Además, se hace un especial hincapié, no en el consumo de nutrientes aislados, sino en el de alimentos y, sobre todo, en el de los patrones alimentarios más importantes para la prevención vascular. Este concepto de patrón alimentario se ha afianzado en los últimos años, como modelo para examinar la relación entre nutrición y salud y para servir de herramienta educativa para la población, modificando el paradigma tradicional de que la unidad nutricional básica de la dieta no son los nutrientes (p. ej., los ácidos grasos), sino los alimentos que los contienen (aceites, frutos secos, carnes rojas, productos lácteos, etc.), ya que en sus matrices existen multitud de componentes capaces de interaccionar sinérgicamente o de modo antagónico sobre vías metabólicas determinantes para la salud vascular. En esta guía recopilamos las principales recomendaciones del referido documento64.
Las diferentes dietas saludables tienen muchos componentes en común, algunos de ellos recomendables, como las frutas, las verduras, los frutos secos, las legumbres y el pescado, mientras que otros se deben restringir, como algunos alimentos ricos en grasa saturada, los que tienen azúcar añadido, abundante sal o han sido procesados. Hay una fuerte evidencia de que los patrones alimentarios de base vegetal, bajos en ácidos grasos saturados, colesterol y Na, con un alto contenido en fibra, K y ácidos grasos insaturados, son beneficiosos y reducen la expresión de los FRV. En este contexto destacan la dieta mediterránea, la dieta Dietary Approaches to Stop Hypertension (DASH), la dieta vegano-vegetariana y el índice de alimentación saludable alternativo (AHEI), todos de base vegetal y con abundantes hidratos de carbono complejos. Los datos de grandes estudios de cohortes y, en el caso de la dieta mediterránea, el estudio clínico aleatorizado PREDIMED, indican que la adherencia a estos patrones de alimentación confiere un claro beneficio vascular65. Por el contrario, la dieta baja en grasas está actualmente en entredicho por su escaso potencial de protección vascular. Con relación a las grasas comestibles, el aceite de oliva virgen es la grasa culinaria más eficaz en la prevención de la EVA66. La intervención nutricional durante unos cinco años, en el estudio PREDIMED, demostró que los participantes asignados a la dieta mediterránea suplementada con aceite de oliva virgen extra o con frutos secos experimentaron una reducción media de 30% de episodios vasculares mayores65, aparte de otros efectos beneficiosos, entre ellos la reducción del riesgo de DM2 y de FA67. Recientemente, se han publicado los resultados del estudio CordioPrev68, un ensayo clínico aleatorizado incluyendo 1.002 pacientes con enfermedad coronaria establecida, que recibieron una intervención dietética con dieta mediterránea rica en aceite de oliva virgen frente a una dieta baja en grasa rica en hidratos de carbono complejos, durante siete años. El evento cardiovascular adverso mayor del estudio se produjo en 198 participantes, 87 en el brazo de la dieta mediterránea (17,3%) y 111 en el de la dieta baja en grasas (22,2%), lo que supuso una disminución de la tasa de eventos de 26% en los participantes que siguieron la dieta mediterránea (hazard ratio [HR] de los diferentes modelos de 0,719 (intervalo de confianza (IC) de 95%, 0,541–0,957) a 0,753 (0,568–0,998). Estos efectos fueron más evidentes en los varones, donde la diferencia entre dietas fue de 33% en favor de la dieta mediterránea. Los resultados son relevantes para la práctica clínica, apoyando el uso de la dieta mediterránea para prevenir la recurrencia de la enfermedad vascular. Es importante destacar que las margarinas actuales carecen en su mayoría de ácidos grasos trans y aportan ácidos grasos poliinsaturados n-6 y n-3.
El consumo de pescado o marisco al menos tres veces por semana, dos de ellas en forma de pescado azul, reduce el RV. Por ello, incentivar su consumo es un importante componente de las modificaciones de estilo de vida para la prevención de la EVA. Un beneficio nada desdeñable podría obtenerse cuando sustituye a la carne como plato principal en las comidas. Aun así, el documento antes indicado destaca que, por su riqueza en contaminantes marinos, los niños y mujeres en edad fértil no deben consumir pescado graso de gran tamaño (atún rojo, pez espada, tiburón), o la caballa porque contienen más contaminantes que especies más pequeñas. Las evidencias sobre las carnes indican que el consumo de carne blanca o carne magra (sin grasa visible), tres a cuatro raciones por semana, no incrementa el RV, a diferencia del consumo de carnes procesadas (tocino, salchichas, embutidos) que contienen aditivos perjudiciales, como sal y nitratos, que aumenta la mortalidad total y el riesgo de desarrollo de DM2 y EVA. Sin embargo, en los últimos años se está planteando la necesidad de transformar el sistema alimentario, adoptando un nuevo modelo que sea saludable para la población humana, y también para el propio planeta. Las carnes rojas y sus derivados son una fuente muy importante de calentamiento global, de sobreutilización de la tierra y de consumo de agua. Del mismo modo, los ultraprocesados, cárnicos o no, y la gran mayoría de los precocinados, contienen productos como azúcares añadidos o grasas trans y deben estar alejados de nuestra dieta. Por ello deben evitarse y aumentar el consumo de alimentos ricos en proteínas vegetales frente a los de proteína animal69.
Con relación a los lácteos, es deseable consumir al menos dos raciones diarias (leche, leche fermentada, queso, yogur, etc.), por su importante papel nutricional en el metabolismo del Ca y por su riqueza en proteínas de alta calidad biológica. Es preferible elegir el consumo de lácteos desnatados y se desaconseja el consumo habitual de aquellos con azúcares añadidos. Para la prevención vascular es recomendable reducir el consumo de grasa láctea concentrada, como la mantequilla y la nata. En la última década las recomendaciones sobre el consumo de huevos y la salud han sido discrepantes, en gran medida por falta de evidencia. Sin embargo, la evidencia científica actual sugiere que su consumo no es perjudicial en el contexto de una dieta saludable. Tanto la población general sana, como las personas con FRV, EVA previa o DM2, pueden consumir hasta un huevo al día sin temor por su salud cardiometabólica. En los pacientes con DM2 tampoco parece haber suficientes argumentos para restringir su consumo con el objeto de reducir el RV o mejorar el control metabólico, aunque algunas series que limitan su ingesta a un máximo de tres a la semana70.
Las legumbres y cereales de grano completo son semillas que contienen múltiples nutrientes saludables y su consumo frecuente se asocia con reducción de FRV y de EVA. Para promover la salud vascular y disminuir la colesterolemia es recomendable consumir una ración de legumbres al menos cuatro veces por semana. El consumo recomendado de cereales integrales es de unas cuatro raciones/día, incluyendo pan en todas las comidas del día, pasta dos a tres veces/semana y arroz dos a tres veces/semana. En cuanto al consumo de frutas y verduras, con las evidencias existentes, se recomienda el consumo de cuatro a cinco raciones diarias entre frutas y verduras dado que reduce la mortalidad global y vascular. Además, el efecto beneficioso de frutas y verduras es dosis dependiente y es más evidente sobre la enfermedad cerebrovascular que sobre la coronaria. El consumo de tubérculos (sobre todo, patatas) no se asocia con un aumento del RV excepto si son fritas en aceites no recomendables y saladas.
El consumo frecuente de frutos secos se asocia con la reducción de EVA, sobre todo enfermedad coronaria, y mortalidad por cualquier causa65. Consumir con frecuencia (a diario o al menos tres veces por semana) un puñado de frutos secos (equivalente a una ración de 30g) es muy recomendable para el control del colesterol y la salud en general. Se aconseja consumirlos crudos y sin pelar (no tostados ni salados) si es factible, ya que la mayor parte de los antioxidantes están en la piel. Para mantener el efecto saciante y evitar ganar peso, deben consumirse durante el día, no como postre. Entre los frutos secos que se recomienda consumir se incluyen las avellanas, nueces, almendras, pistachos, anacardos, macadamias, piñones, etc. Si bien los cacahuetes no son realmente frutos de un árbol sino legumbres, su composición general y alto contenido en ácidos grasos insaturados los asimila a los frutos secos, tanto desde el punto de vista nutricional como por sus efectos biológicos.
El cacao es una semilla con abundantes nutrientes y el consumo de su principal derivado, el chocolate, mejora los FRV y se asocia con reducción de la EVA y DM2. Hay información que indica que tiene efectos hipocolesterolemiantes y antihipertensivos, mejorando la resistencia a la insulina, de forma que puede consumirse chocolate negro ≥ 70% sin azúcar añadido en el contexto de una dieta saludable. Además, se aconseja hacerlo durante el día y no por la noche después de cenar, cuando el efecto saciante no se puede compensar ingiriendo menos alimentos en la comida siguiente.
Las bebidas azucaradas forman parte de la dieta habitual de muchas personas y pueden suponer hasta 20% del consumo calórico diario, favoreciendo un aumento de EVA, de obesidad y de DM2. La sustitución de este tipo de bebidas por agua sería muy importante para reducir el consumo energético y el riesgo de estas patologías y sus complicaciones. Si el paciente no acepta dicha sustitución, podemos recurrir a las bebidas con edulcorantes artificiales, si bien su consumo provoca alteraciones en la microbiota intestinal, e incremento de la resistencia a la insulina que puede favorecer el desarrollo de DM2 y aumentar el RV71.
El consumo de bebidas alcohólicas de cualquier tipo aumenta el cHDL y su ingesta moderada (de bebidas fermentadas no destiladas), en comparación con la abstención o el consumo excesivo, se asocia con una reducción de la EVA y la mortalidad vascular. Se puede permitir su consumo moderado siempre con las comidas y en el marco de una dieta saludable como la dieta mediterránea, siendo diferentes las recomendaciones para hombres y mujeres, ya que estas son más sensibles a los efectos del alcohol. No se debe promover el consumo de alcohol en las personas que habitualmente no lo hacen. El café (tanto el normal como el descafeinado) y el té son ricos en polifenoles y hay evidencias de alto nivel de que su consumo habitual se asocia con reducción de RCV y de desarrollar DM2.
Existen numerosos alimentos funcionales y nutracéuticos dirigidos a reducir el RV, principalmente por reducción de la colesterolemia. Recientemente, desde la SEA se ha elaborado un documento de posicionamiento sobre su utilidad identificando los siguientes escenarios clínicos en los que se podrían utilizar estos productos72:
- •
Tratamiento hipolipemiante en sujetos con intolerancia a estatinas.
- •
Tratamiento hipolipemiante «a la carta» en personas en prevención primaria.
- •
Prevención vascular a largo plazo en personas sin indicación de tratamiento hipolipemiante.
- •
Pacientes con tratamiento hipolipemiante optimizado que no alcanzan objetivos terapéuticos.
La SEA subraya que no se dispone de estudios de morbimortalidad vascular con nutracéuticos o con alimentos funcionales, y que hay pocos datos de seguridad a largo plazo o son limitados. Ambos aspectos deben ser discutidos con el paciente antes de proceder a recomendar su uso. Del mismo modo entiende que los nutracéuticos que disponen de un mayor número de evidencias científicas son los fitoesteroles y la levadura roja de arroz. Asimismo, existen evidencias consistentes de que los ácidos grasos omega-3 a dosis farmacológicas disminuyen los TG plasmáticos.
El consumo excesivo de sal se asocia con EVA y mortalidad de causa cardiometabólica. Debe recomendarse una dieta baja en sal (< 5g/día) a nivel poblacional y con mayor justificación en pacientes hipertensos y sus familiares, recordando que para calcular la cantidad de sal total hay que multiplicar por 2,5 el contenido de NA de los alimentos. Medidas especialmente eficaces para este fin son limitar el consumo de alimentos ricos en sal, como precocinados, enlatados, salazones, embutidos y bebidas carbónicas. Una alternativa a la sal es utilizar zumo de limón, ajo o hierbas aromáticas.
Es razonable pensar, y así lo muestran evidencias recientes, que no exista un modelo estándar de dieta saludable, sino que la respuesta biológica varía entre las personas, especialmente por diferencias individuales en el genoma y en el microbioma. En los próximos años, la nutrición personalizada y de precisión, junto con otras ciencias como la cronobiología, en la que cada uno adopte la dieta que le sea personalmente más beneficiosa serán un reto de la comunidad científica73. Finalmente, uno de los problemas más complejos de la relación entre las personas y su dieta es la adherencia, que depende de factores muy diferentes, como los propios del paciente, la familia, el equipo de salud que le acompaña y el propio sistema sanitario. Por ello, es fundamental poner en marcha las estrategias para conseguirlo.
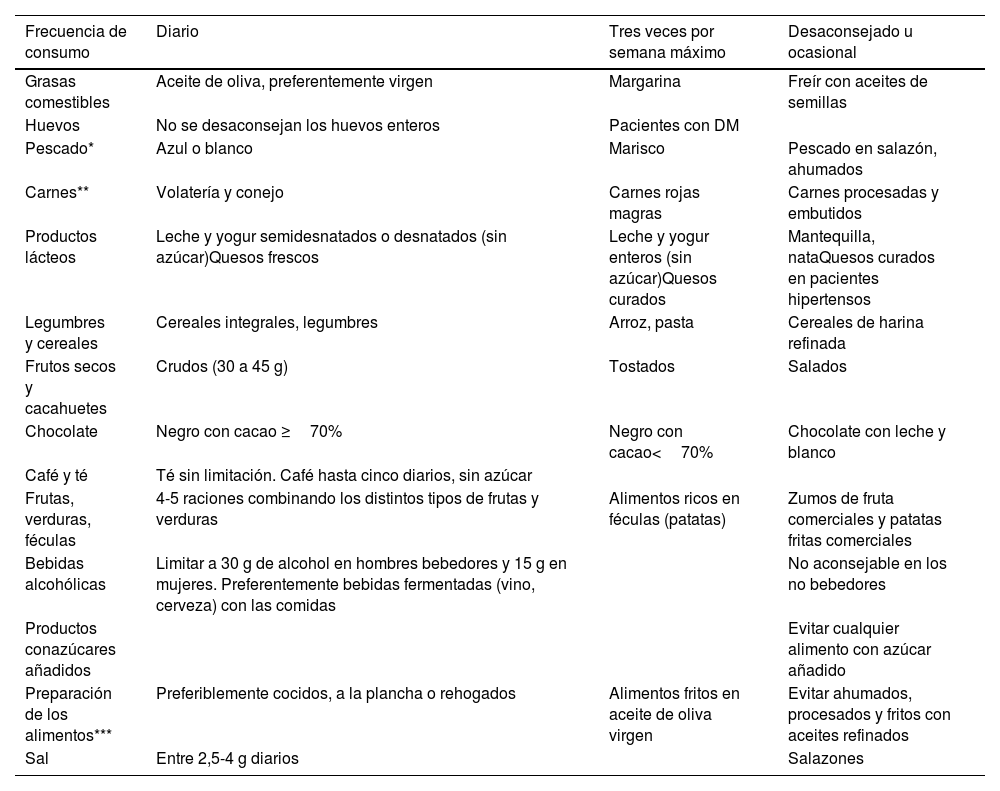
La tabla 6 recogida de dicho documento64, incluye de forma práctica la frecuencia en la forma y en la cantidad de consumo de alimentos.
Frecuencia en la forma y en la cantidad de consumo de alimentos
| Frecuencia de consumo | Diario | Tres veces por semana máximo | Desaconsejado u ocasional |
|---|---|---|---|
| Grasas comestibles | Aceite de oliva, preferentemente virgen | Margarina | Freír con aceites de semillas |
| Huevos | No se desaconsejan los huevos enteros | Pacientes con DM | |
| Pescado* | Azul o blanco | Marisco | Pescado en salazón, ahumados |
| Carnes** | Volatería y conejo | Carnes rojas magras | Carnes procesadas y embutidos |
| Productos lácteos | Leche y yogur semidesnatados o desnatados (sin azúcar)Quesos frescos | Leche y yogur enteros (sin azúcar)Quesos curados | Mantequilla, nataQuesos curados en pacientes hipertensos |
| Legumbres y cereales | Cereales integrales, legumbres | Arroz, pasta | Cereales de harina refinada |
| Frutos secos y cacahuetes | Crudos (30 a 45 g) | Tostados | Salados |
| Chocolate | Negro con cacao ≥70% | Negro con cacao<70% | Chocolate con leche y blanco |
| Café y té | Té sin limitación. Café hasta cinco diarios, sin azúcar | ||
| Frutas, verduras, féculas | 4-5 raciones combinando los distintos tipos de frutas y verduras | Alimentos ricos en féculas (patatas) | Zumos de fruta comerciales y patatas fritas comerciales |
| Bebidas alcohólicas | Limitar a 30 g de alcohol en hombres bebedores y 15 g en mujeres. Preferentemente bebidas fermentadas (vino, cerveza) con las comidas | No aconsejable en los no bebedores | |
| Productos conazúcares añadidos | Evitar cualquier alimento con azúcar añadido | ||
| Preparación de los alimentos*** | Preferiblemente cocidos, a la plancha o rehogados | Alimentos fritos en aceite de oliva virgen | Evitar ahumados, procesados y fritos con aceites refinados |
| Sal | Entre 2,5-4 g diarios | Salazones |
DM: diabetes mellitus
Publicado con permiso del editor. Fuente original: adaptada de Pérez-Jiménez F, et al.64
Una manera de evaluar la adherencia a la dieta mediterránea se puede obtener utilizando el cuestionario MEDAS (Anexo 3).
La actividad física es, según la Organización Mundial de la Salud (OMS), cualquier movimiento corporal producido por los músculos esqueléticos y que exija gasto de energía. Cuando se realiza de forma regular y mantenida protege del RV y mejora sus FRV. Su práctica debe adaptarse a las particularidades propias de cada individuo, partiendo del principio de que poco es mejor que nada y considerando que abarca actividades como las que se realizan durante el trabajo, las formas de transporte activas, las tareas domésticas o las recreativas. A su vez, el ejercicio físico es una variedad de la actividad física pero que se realiza de forma planificada, estructurada, repetitiva y con un objetivo relacionado con la mejora o el mantenimiento de la aptitud física. Ambos se deben hacer de forma pausada y moderada, más que intensa y concentrada.
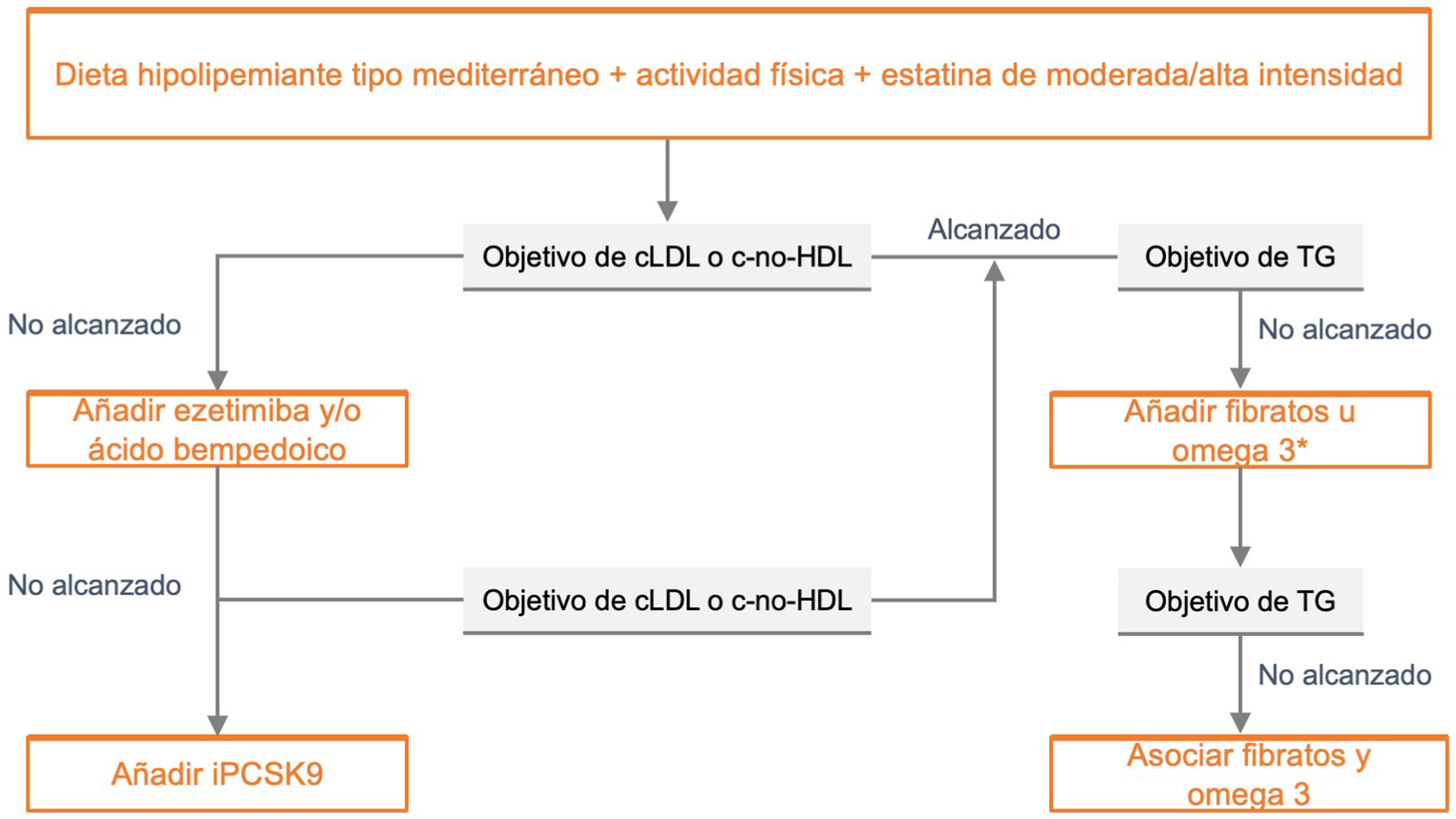
Recomendaciones farmacológicas generales en pacientes en prevención primariaLas recomendaciones de manejo clínico del RV en pacientes sin EVA, DM ni ERC se recogen en la figura 4.
Recomendaciones de manejo clínico del riesgo vascular en pacientes sin enfermedad vascular establecida, diabetes mellitus, ni insuficiencia renal crónica.
DM: diabetes mellitus; ECV: enfermedad cardiovascular; ERC: enfermedad renal crónica; FA: fibrilación auricular; HTA: hipertensión arterial; PA: presión arterial; RV: riesgo vascular; SM: síndrome metabólico.
Se ha demostrado que el tratamiento con dosis bajas de ácido acetilsalicílico reduce el riesgo de complicaciones vasculares, principalmente en personas de mediana edad, a expensas de la reducción de los infartos de miocardio no fatales, sin afectar al riesgo de ictus, ni a la mortalidad. Sin embargo, parte del beneficio del ácido acetilsalicílico es contrarrestado por sus efectos adversos, sobre todo los relacionados con su potencial hemorrágico, de ahí que el balance de riesgos y beneficios de las dosis bajas de este no estén claramente establecidos en prevención primaria.
Las guías norteamericanas de la US Preventive Service Task Force (USPSTF)74 recomiendan iniciar el uso de ácido acetil salicílico a dosis bajas (≤ 100mg/día) para la prevención primaria de la EVA en adultos de 50 a 59 años que tengan un riesgo de morbimortalidad vascular mayor o igual a 10% a 10 años, que no tengan aumentado el riesgo de hemorragia, tengan una expectativa de vida de al menos 10 años, y estén dispuestos a tomar este tratamiento diariamente durante por lo menos 10 años. La decisión de iniciar tratamiento en adultos de entre 60 y 69 años con un RV mayor o igual a 10% a 10 años debe ser individualizada74.
Sin embargo, las guías europeas para la prevención cardiovascular de 2021 no recomiendan sistemáticamente el tratamiento antiagregante para pacientes sin EVA debido al aumento del riesgo de sangrado13. En este sentido, recientemente se han publicado varios ensayos clínicos con ácido acetil salicílico en prevención primaria, tanto en pacientes con y sin DM, no encontrando un beneficio claro en su utilización en la prevención primaria de la EVA75–77, y en especial cuando se controlan adecuadamente los FRV presentes.
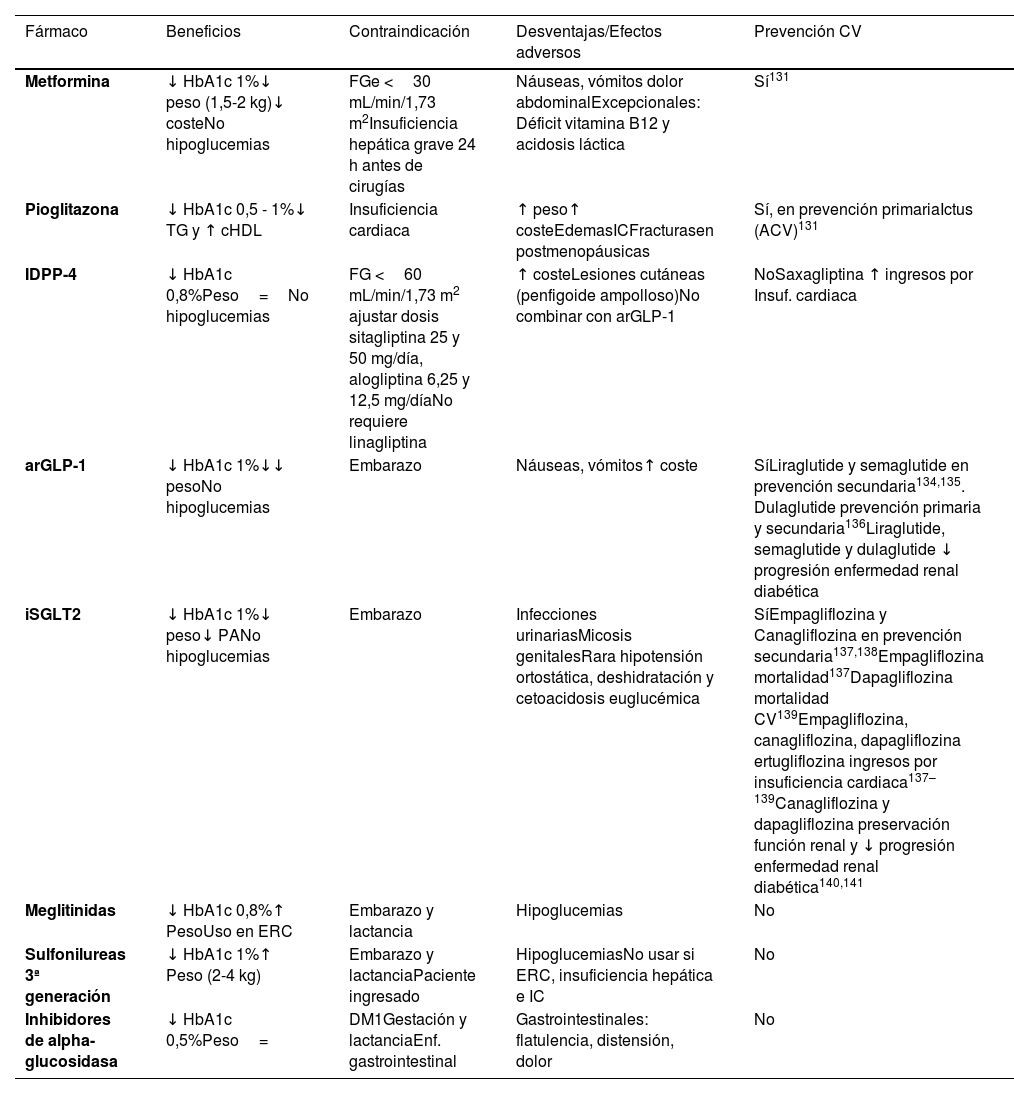
Tratamiento hipolipemianteEn numerosos ensayos clínicos y metaanálisis78, las estatinas han demostrado reducir los episodios vasculares en pacientes sin EVA, incluso con concentraciones no elevadas de colesterol. La reducción del riesgo relativo de EVA es independiente del RV basal siendo de aproximadamente 22% por cada mmol/l de reducción de cLDL. Sin embargo, para que el tratamiento sea eficiente es importante seleccionar a los pacientes con un alto RV basal para que la reducción absoluta del RV sea mayor (tabla 5). Otros fármacos como ezetimiba, inhibidores de proproteína convertasa de proteínas subtilisina/kexina 9 (iPCSK9) o ácido bempedoico han demostrado reducir los eventos vasculares de modo equivalente a las estatinas en proporción con su acción hipolipemiante, por lo que consideramos que la terapia en prevención primaria debe diseñarse también en función de los objetivos de cLDL a alcanzar según el RV del paciente, especialmente en pacientes con HF, teniendo en cuenta todo el arsenal terapéutico disponible. Las indicaciones de tratamiento hipolipemiante en prevención primaria se exponen en el apartado «Recomendaciones terapéuticas específicas».
Suplementos vitamínicosMuchos estudios observacionales prospectivos de casos y controles han descrito asociaciones inversas entre la ingesta o las concentraciones séricas de vitaminas (A, grupo B, C, D y E) y el riesgo de EVA. Sin embargo, los datos de estudios prospectivos y los ensayos clínicos de intervención con suplementos vitamínicos y minerales no han demostrado ningún beneficio vascular79. Por lo tanto, no está indicado el empleo de suplementos vitamínicos para la prevención de la EVA.
Recomendaciones generales en pacientes con enfermedad vascular subclínica y en prevención secundariaLos pacientes con EVS diagnosticada mediante la presencia de placas en arteria carótida o femoral o mediante la determinación de CC, tienen un riesgo de complicaciones vasculares intermedio entre los sujetos en prevención primaria y secundaria, si bien en numerosas guías los clasifican como prevención secundaria. En estas circunstancias, su manejo no diferiría del de aquellos en prevención secundaria, si bien las evidencias de eficacia real del tratamiento preventivo son limitadas en estas poblaciones80. En cualquier caso, su nivel de riesgo debe estimarse en función de lo recogido en la tabla 5.
En los pacientes en prevención secundaria, además de las medidas higiénico-dietéticas previamente comentadas (ver apartado «Recomendaciones generales a la población para reducir su riesgo vascular») y de los tratamientos indicados para el control de los FRV, existen una serie de tratamientos que han demostrado reducir el riesgo de nuevos episodios vasculares (tabla 7).
Medidas farmacológicas que han demostrado reducir la tasa de complicaciones vasculares ateroscleróticas en sujetos en prevención secundaria
| Tratamiento | Indicaciones potenciales |
|---|---|
| Antiagregantes | • Aspirina a dosis bajas o clopidogrel en pacientes con enfermedad coronaria, cerebrovascular o arterial periférica sintomática• Aspirina más clopidogrel tras un AIT o ictus leve81,82• Aspirina y dipiridamol en sujetos con ictus o AIT previos• Aspirina más un iP2Y12 en sujetos con SCA o con colocación de stent, mantenido al menos 12 meses |
| Hipolipemiantes | • Estatinas asociadas o no a ezetimiba o ácido bempedoico para reducir el cLDL al menos un 50% y por debajo de 55 mg/dL. iPCSK9 si no se consiguen las reducciones adecuadas con el tratamiento hipolipemiante previo, y de acuerdo con los criterios de la Tabla 8• Ezetimiba y ácido bempedoico, en pacientes con intolerancia a las estatinas y en aquellos en los que no se alcancen objetivos con otras terapias hipocolesterolemiantes• IPE purificado 4 g/día en hipertrigliceridemias >150 mg/dL que persisten a pesar del tratamiento con estatinas en pacientes de alto RV83. Su efecto protector es independiente de su efecto sobre los TG |
AIT: accidente isquémico transitorio; cLDL: colesterol unido a lipoproteínas de baja densidad; IPE: icosapentanoico de etilo; iPCSK9: inhibidor de la convertasa de proteínas subtilisina/kexina 9; SCA: síndrome coronario agudo; iP2Y12: inhibidor del quimiorreceptor para adenosín difosfato; TG: triglicéridos.
El ácido acetil salicílico es el antiagregante plaquetario más estudiado en la prevención vascular a largo plazo en pacientes con infarto agudo de miocardio, ictus isquémico o EAP sintomática. En un metaanálisis de 16 estudios clínicos con más de 17.000 pacientes, el tratamiento con ácido acetil salicílico redujo significativamente los episodios vasculares graves (coronarios y cerebrovasculares) y la mortalidad total84. Asimismo, la terapia con este se asoció con un exceso significativo de sangrados graves y desarrollo de anemia incluso sin sangrado aparente; no obstante, los beneficios vasculares del ácido acetil salicílico superaron claramente el riesgo de sangrado.
El clopidogrel tiene un efecto similar al ácido acetil salicílico en pacientes con infarto de miocardio o ictus isquémico, pero puede ser superior a esta en sujetos con EAP sintomática. La asociación de ácido acetil salicílico y clopidogrel en prevención secundaria disminuye significativamente los episodios cardiovasculares graves en comparación con el ácido acetil salicílico en monoterapia, pero con un incremento significativo del riesgo de sangrado.
En pacientes con accidente cerebrovascular (ACV) isquémico no cardioembólico o ataque isquémico transitorio (AIT), el ácido acetil salicílico se puede usar en monoterapia o asociada a dipiridamol, y también se puede utilizar el clopidogrel en monoterapia. En sujetos con un AIT o ictus menor, el beneficio del doble tratamiento antiagregante durante un máximo de 90 días supera los riesgos de aumento de sangrado81,82. La protección ocurre durante los primeros 21 días, por lo que este es el intervalo más recomendable para el doble tratamiento85.
El tratamiento estándar para un paciente que ha sufrido un síndrome coronario agudo (SCA), con o sin la colocación de stents, es la doble antiagregación plaquetaria (ácido acetil salicílico con un inhibidor de quimiorreceptor para adenosín difosfato [iP2Y12] durante 12 meses. En pacientes con alto riesgo de sangrado, el tiempo con la doble antiagregación se puede acortar hasta uno a tres meses.
La utilización de antiagregantes en pacientes con EVS cuenta con escasa evidencia que la soporte. En sujetos con ITB bajo, pero sin claudicación intermitente, el tratamiento con antiagregantes no ha demostrado ser eficaz80.
La evidencia es también muy limitada en sujetos con estenosis carotidea asintomática >50%, si bien la Sociedad Europea de Cirugía Vascular (ESVS) recomienda el uso de ácido acetil salicílico a dosis de 75-325mg o, en caso de intolerancia, clopidogrel, con el objetivo de reducir la tasa de complicaciones coronarias o complicaciones en otros lechos vasculares86.
Existe interés en identificar un umbral de CC a partir del cual el beneficio de antiagregar supere los riesgos de sangrado por lo que es previsible el desarrollo de ensayos clínicos al respecto87,88. Es razonable que una puntuación alta de CC contribuya a la decisión de antiagregar cuando la indicación para un paciente se sitúe en el límite de la duda, en especial si no existe riesgo aumentado de sangrado.
HipolipemiantesNumerosos ensayos clínicos y metaanálisis78 han demostrado que el tratamiento con fármacos hipolipemiantes (resinas, estatinas, ezetimiba, iPCSK9, ácido bempedoico) en pacientes con EVA establecida disminuye los episodios vasculares graves y la mortalidad.
Los datos de las guías27 indican que los pacientes con EVS establecida (enfermedad coronaria multivaso demostrada mediante la obstrucción >50% en al menos dos arterias epicárdicas en TAC coronario o angiografía, o mediante la presencia de placas carotídeas) deben considerarse de muy alto RV y ser tratados como si hubieran tenido previamente un episodio vascular. Las recomendaciones de tratamiento hipolipemiante en estos sujetos se recogen en el apartado «Recomendaciones terapéuticas específicas». Los pacientes con enfermedad coronaria multivaso (especialmente si no es revascularizable), o con afectación de múltiples lechos arteriales, tienen un riesgo de complicaciones vasculares especialmente elevado, por lo que puede considerarse un tratamiento hipolipemiante más intensivo (p. ej., objetivo de cLDL <40mg/dL)89,90.
Otros fármacosSi bien diferentes fármacos han demostrado reducir la tasa de complicaciones vasculares en pacientes en prevención primaria y secundaria, se revisan aquí aquellos que presumiblemente la reducen a través de acciones sobre la placa de ateroma. En pacientes en prevención secundaria o con DM de alto riesgo en tratamiento con estatinas (cLDL medio de 75mg/dL y TG entre 150-499mg/dL), el tratamiento con 4 g de IPE redujo en 25% el riesgo de episodios vasculares graves83. Este fármaco ha demostrado también reducir la progresión de la placa de ateroma en pacientes con hipertrigliceridemia tratados con estatinas91.
La utilización en un mismo comprimido de ácido acetil salicílico, una estatina y un inhibidor del enzima convertidor de la angiotensina facilita la adherencia al tratamiento en pacientes en prevención secundaria92 y ha demostrado reducir la tasa de complicaciones vasculares con respecto al tratamiento estándar de la enfermedad93.
Por último, intervenciones específicas sobre la inflamación han demostrado también reducir el número de complicaciones vasculares. El uso de un anticuerpo monoclonal anti-interleuquina-1β (anti-IL-1β), canakinumab, redujo significativamente la tasa de recurrencia de EVA, mostrando beneficio pese al incremento de infecciones severas y fatales94. La colchicina es un fármaco con acciones anti-inflamatorias que a dosis de 0,5mg al día o cada 12 horas, ha demostrado reducir en 32% la tasa de complicaciones vasculares, sin diferencias significativas en los efectos secundarios95.
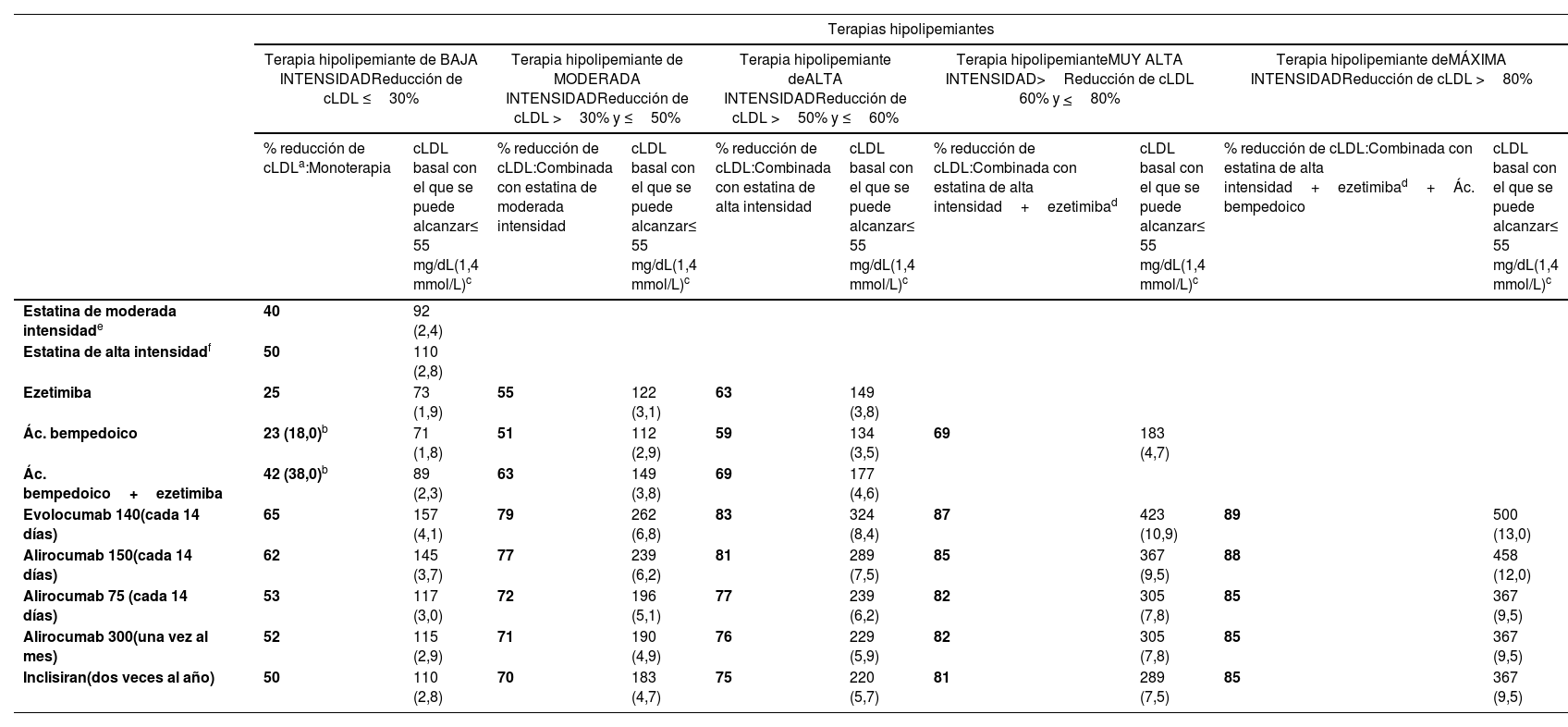
Recomendaciones terapéuticas específicasPaciente con dislipemiaPaciente con hipercolesterolemiaLa dieta de tipo mediterráneo, rica en productos vegetales y pobre en grasas de origen animal es recomendable para la prevención cardiovascular en la población general, y muy en especial para pacientes con hipercolesterolemia, tal como recogen las recomendaciones sobre alimentación de la SEA (tabla 6). La indicación para iniciar tratamiento hipolipemiante se basa tanto en la concentración basal de cLDL como en el RV basal. El tratamiento hipolipemiante debe dirigirse a alcanzar los objetivos de cLDL indicados en los apartados siguientes. Para alcanzar dichos objetivos, en la mayoría de las ocasiones se requiere de combinaciones de fármacos, por lo que se hace énfasis en el uso de terapias hipolipemiante de alta intensidad, en las que las estatinas deben estar incluidas, según la tabla 8.
Terapias hipolipemiantes, en monoterapia o combinación, según su intensidad hipocolesterolemiante
| Terapias hipolipemiantes | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Terapia hipolipemiante de BAJA INTENSIDADReducción de cLDL ≤30% | Terapia hipolipemiante de MODERADA INTENSIDADReducción de cLDL >30% y ≤50% | Terapia hipolipemiante deALTA INTENSIDADReducción de cLDL >50% y ≤60% | Terapia hipolipemianteMUY ALTA INTENSIDAD>Reducción de cLDL 60% y <80% | Terapia hipolipemiante deMÁXIMA INTENSIDADReducción de cLDL >80% | ||||||
| % reducción de cLDLa:Monoterapia | cLDL basal con el que se puede alcanzar≤ 55 mg/dL(1,4 mmol/L)c | % reducción de cLDL:Combinada con estatina de moderada intensidad | cLDL basal con el que se puede alcanzar≤ 55 mg/dL(1,4 mmol/L)c | % reducción de cLDL:Combinada con estatina de alta intensidad | cLDL basal con el que se puede alcanzar≤ 55 mg/dL(1,4 mmol/L)c | % reducción de cLDL:Combinada con estatina de alta intensidad+ezetimibad | cLDL basal con el que se puede alcanzar≤ 55 mg/dL(1,4 mmol/L)c | % reducción de cLDL:Combinada con estatina de alta intensidad+ezetimibad+Ác. bempedoico | cLDL basal con el que se puede alcanzar≤ 55 mg/dL(1,4 mmol/L)c | |
| Estatina de moderada intensidade | 40 | 92 (2,4) | ||||||||
| Estatina de alta intensidadf | 50 | 110 (2,8) | ||||||||
| Ezetimiba | 25 | 73 (1,9) | 55 | 122 (3,1) | 63 | 149 (3,8) | ||||
| Ác. bempedoico | 23 (18,0)b | 71 (1,8) | 51 | 112 (2,9) | 59 | 134 (3,5) | 69 | 183 (4,7) | ||
| Ác. bempedoico+ezetimiba | 42 (38,0)b | 89 (2,3) | 63 | 149 (3,8) | 69 | 177 (4,6) | ||||
| Evolocumab 140(cada 14 días) | 65 | 157 (4,1) | 79 | 262 (6,8) | 83 | 324 (8,4) | 87 | 423 (10,9) | 89 | 500 (13,0) |
| Alirocumab 150(cada 14 días) | 62 | 145 (3,7) | 77 | 239 (6,2) | 81 | 289 (7,5) | 85 | 367 (9,5) | 88 | 458 (12,0) |
| Alirocumab 75 (cada 14 días) | 53 | 117 (3,0) | 72 | 196 (5,1) | 77 | 239 (6,2) | 82 | 305 (7,8) | 85 | 367 (9,5) |
| Alirocumab 300(una vez al mes) | 52 | 115 (2,9) | 71 | 190 (4,9) | 76 | 229 (5,9) | 82 | 305 (7,8) | 85 | 367 (9,5) |
| Inclisiran(dos veces al año) | 50 | 110 (2,8) | 70 | 183 (4,7) | 75 | 220 (5,7) | 81 | 289 (7,5) | 85 | 367 (9,5) |
% de reducción de cLDL por estatinas moderada intensidad y alta intensidad por definición. El % de reducción de cLDL por otros fármacos se tomó de Toth P., et al.92
La eficacia de las terapias combinadas se calculó de acuerdo con la siguiente fórmula: %A+%B (1−%A)+%C [1−(%A+%B (1−%A))]; donde % A es la reducción teórica de cLDL inducida por el fármaco A, %B por el fármaco B y %C por el fármaco C93
Atorvastatina 10-20-40; rosuvastatina 5-10; simvastatina 20-40; pravastatina 40; lovastatina 40; fluvastatina 80; pitavastatina 2-4
Atorvastatina 80; rosuvastatina 20-40
Eficacia teórica del tratamiento hipolipemiante con monoterapia y terapia combinada. Reducción promedio de cLDL por monoterapia hipolipemiante y terapias combinadas y cLDL basal adecuado para ser reducido al objetivo de cLDL de 55 mg/dL (1,4 mmol/L) por diferentes terapias91
Estatinas de baja intensidad con efecto hipolipemiante inferior al 30-40%: simvastatina 10; pravastatina 10-20; lovastatina 10-20; fluvastatina 40; pitavastatina 1 (no incluídas en la tabla)
Ác: ácido; cLDL: colesterol unido a lipoproteínas de baja densidad.
Hace referencia a pacientes en prevención primaria, sin DM, con función renal preservada, sin HF y un RV según las tablas de SCORE inferior a 5% en 10 años sin que coexistan factores moduladores del riesgo, ni EVS, ni LOD (tabla 5). En esta situación clínica, si el cLDL fuera menor de 115mg/dL se consideraría ideal y no habría que realizar ninguna acción concreta. Por el contrario, si el cLDL fuera superior a 190mg/dL el paciente se consideraría de alto riesgo por definición y debería descartarse una HF. La concentración de cLDL recomendada, en estas circunstancias, sería un cLDL <70mg/dL y debería valorarse juntamente con el paciente el tratamiento hipolipemiante para alcanzar dicho objetivo.
Si el cLDL se encontrara entre 115 y 190mg/dL, el tratamiento se basará en cambios terapéuticos del estilo de vida (CTEV) que incluiría una: alimentación según los estándares de la dieta mediterránea. Podría estar indicado el uso de alimentos funcionales enriquecidos en fitosteroles y fibra para descender el colesterol junto a incremento de la actividad física, abstención tabáquica y pérdida de peso si fuera necesaria. La prescripción de fármacos para disminuir el colesterol no está universalmente aceptada en este grupo de población y deberá considerarse de forma individualizada si un paciente presenta dos de los siguientes FRV: edad (hombres >45 años; mujeres >50 años); IMC >30kg/m2; tabaquismo; HTA; AF de EVA precoz; dislipemia aterogénica; SM; o Lp(a) >50mg/dL o presenta una HF con un fenotipo más leve.
Paciente de alto riesgo vascularEl objetivo terapéutico es reducir el cLDL <70mg/dL y al menos 50% de descenso de los valores basales de cLDL.
El tratamiento inicial se basará en la aplicación de CTEV. Si persisten cifras de cLDL >70mg/dL, se recomienda tratamiento hipocolesterolemiante de alta intensidad que garantice un descenso de cLDL de al menos 50% (tabla 8). El tratamiento inicial debe ser con estatinas y en caso de no alcanzar objetivos asociado, con ezetimiba o ácido bempedoico. La combinación debe valorarse de inicio en pacientes con cifras basales de cLDL >140mg/dL.
Paciente de muy alto riesgo vascularEl objetivo terapéutico es un cLDL <55mg/dL y un descenso de al menos 50% de los valores basales.
El tratamiento inicial se basará en la aplicación de CTEV y simultáneamente tratamiento hipocolesterolemiante de alta/muy alta intensidad que garantice un descenso de cLDL de al menos un 50% y permita alcanzar el objetivo terapéutico (tabla 8). La práctica común de iniciar tratamiento con estatinas y posteriormente añadir otros hipolipemiantes en una segunda fase se ha mostrado insuficiente por varios motivos: en una proporción importante de pacientes no se alcanzan reducciones de >50%, lo que sumado a la inercia terapéutica y falta de adherencia se traduce en que la mayoría de los pacientes no alcanzan los objetivos terapéuticos. Por este motivo es razonable considerar desde el inicio el uso de terapia oral combinada (estatinas+ezetimba/ácido bempedoico), lo que facilita conseguir los objetivos terapéuticos en un menor tiempo, favorecer la adherencia y reducir el riesgo de efectos secundarios de la dosis máxima de estatinas. La combinación es obligatoria de inicio en pacientes con cifras basales de cLDL superiores a 110mg/dL. La utilización de iPCSK9 estaría recomendada según las indicaciones que se enumeran en la tabla 9, en particular en pacientes que requieran reducciones de cLDL superiores a 60%. Debemos tener en cuenta que la obtención de concentraciones de cLDL inferiores a las que marca los objetivos beneficia a los pacientes. No se han detectado efectos adversos asociados a valores extremadamente bajos de cLDL. Además, se ha demostrado que con descensos muy importantes de cLDL se reducen las lesiones ateromatosas y se hacen más estables.
Criterios de la SEA para la utilización de iPCSK9
| Situaciones clínicas | Condicionantes adicionales | cLDL |
|---|---|---|
| Hipercolesterolemia familiar homocigota (HFHo) | - | >100 |
| Hipercolesterolemia familiar heterocigota (HFHe) | <4 FRV asociados | >160 |
| ≥4 FRV asociados | >130 | |
| Con DM | >100 | |
| Con EVA | >70 | |
| Prevención secundaria | Estable | >130 |
| SCA (<1 año) | >100 | |
| DM+FRV adicional | >100 | |
| Más de 2 FRV adicionales no controlados | >100 | |
| Lp(a) >50 mg/dL | >70 | |
| Enfermedad coronaria recurrente o multivaso no revascularizable | >70 | |
| EAP sintomática aislada o enfermedad polivascular | >70 | |
| SCA <1 año+DM | >70 | |
| IRC estadio ≥3+1 FRV | >70 | |
| Prevención primaria con riesgo muy alto | IRC ≥3b (no en diálisis)+DM | >130 |
cLDL: colesterol unido a lipoproteínas de baja densidad; DM: diabetes mellitus; EAP: enfermedad arterial periférica; EVA: enfermedad vascular aterosclerótica; FRV: factores de riesgo vascular; IRC: insuficiencia renal crónica; Lp(a): lipoproteína (a); SCA: síndrome coronario agudo.
Adaptado de Ascaso JF, et al.96
Un resumen de las indicaciones del tratamiento con fármacos hipolipemiantes de acuerdo con el riesgo estimado en la tabla 5 se muestra en la tabla 10.
Indicaciones de tratamiento hipolipemiante según RV y concentración de cLDL
| RV | cLDL | ||||
|---|---|---|---|---|---|
| 55-70 mg/dL | <70 mg/dL | 70-115 mg/dL | 116-190 mg/dL | >190 mg/dL | |
| Bajo o moderado | Recomendaciones de hábitos de vida. No precisa tratamiento | Recomendaciones de hábitos de vida. No precisa tratamiento | Modificación de hábitos de vidaValorar alimentos funcionales o tratamiento hipolipemiante | Riesgo alto por definiciónModificación de hábitos de vida Iniciar tratamiento hipolipemiante de alta intensidad | |
| Objetivo cLDL <115 mg/dL | Objetivo cLDL <70 mg/dL | ||||
| Alto | Recomendaciones de hábitos de vidaNo precisa tratamiento | Modificación de hábitos de vidaIniciar tratamiento hipolipemiante si no se alcanzan objetivos | Modificación de hábitos de vidaIniciar tratamiento hipolipemiante de alta intensidad | Modificación de hábitos de vidaIniciar tratamiento hipolipemiante de alta intensidad | |
| ObjetivocLDL <70 mg/dL | ObjetivocLDL <70 mg/dL | ObjetivocLDL <70 mg/dL | |||
| Muy alto | Modificación de hábitos de vidaValorar tratamiento hipolipemiante | Modificación de hábitos de vidaIniciar tratamiento hipolipemiante | Modificación de hábitos de vidaIniciar tratamiento hipolipemiante de alta/muy alta intensidad | Modificación de hábitos de vidaIniciar tratamiento hipolipemiante de alta/muy alta intensidad | Modificación de hábitos de vidaIniciar tratamiento hipolipemiante de alta/muy alta intensidad |
| ObjetivocLDL <55 mg/dL | ObjetivocLDL <55 mg/dL | ObjetivocLDL <55 mg/dL | ObjetivocLDL <55 mg/dL | ObjetivocLDL <55 mg/dL | |
cLDL: colesterol unido a lipoproteínas de baja densidad; RV: riesgo vascular.
En pacientes con dislipemia aterogénica, el objetivo principal es conseguir un cLDL y un c no-HDL en objetivos terapéuticos según el nivel de riesgo, utilizando además de una alimentación saludable97, tratamiento con estatinas o combinaciones terapéuticas de alta intensidad (fig. 5). Una vez alcanzado este objetivo, en pacientes en prevención secundaria que, a pesar de un tratamiento hipolipemiante óptimo, mantengan una concentración de TG >150mg/dL, se debe valorar la utilización de IPE 4g/día fundamentalmente en aquellos con DM.
Esquema terapéutico para el manejo de la dislipemia y prevención vascular en la diabetes mellitus.
*El objetivo secundario es un valor de TG < 200 mg/dL y es opcional el tratamiento farmacológico (ver apartado «Paciente con hipertrigliceridemia»).
CV: cardiovascular; cLDL: colesterol unido a lipoproteínas de baja densidad; c-no-HDL: colesterol no HDL; DM: diabetes mellitus; HDL: lipoproteína de alta densidad; iPCSK9: inhibidores de proproteína convertasa subtilisina/kexina tipo 9; TG: triglicéridos.
Salvo en hipertrigliceridemias severas, la aproximación terapéutica consiste en la reducción del RV mediante el control del cLDL, con especial atención en estos casos al control del c-no-HDL.
Triglicéridos entre 200 y 500mg/dLEn estos pacientes se debe actuar según lo mencionado anteriormente para su nivel de RV y sus cifras de cLDL y c-no-HDL. Según las recomendaciones de la EAS, en los pacientes de muy alto riesgo, en los que después de controlar el cLDL con estatinas junto a ezetimiba / ácido bempedoico persiste una concentración de TG >150mg/dL, se debe considerar el uso de IPE. A pesar de las recomendaciones de la EAS/ESC 2019 en estas situaciones, los resultados del reciente estudio Prominent, no favorecen el uso de fibratos para la reducción del RV98.
Triglicéridos entre 500 y 1.000mg/dLActuar según lo mencionado anteriormente para su nivel de RV y sus cifras de c-no-HDL (aplicando los mismos criterios que los del cLDL más 30mg/dL).
Si tras la aplicación de las medidas terapéuticas recomendadas persisten cifras de TG >500mg/dL, valorar la asociación de fenofibrato y/o ácidos grasos omega-399, dirigidas a reducir el riesgo de pancreatitis.
Triglicéridos >1.000mg/dLEs prioritario disminuir los TG con dieta para prevenir una pancreatitis reduciendo la ingesta de alcohol, hidratos de carbono y, en las formas resistentes, la cantidad total de grasa a menos de 30 g diarios. En los casos graves y persistentes, en general afectos del síndrome de quilomicronemia familiar (SQF) o multifactorial (SQM), se debe valorar la introducción de aceite TG de cadena media (TCM).
Iniciar tratamiento con fenofibrato y/o ácidos grasos omega-3 (> 3g al día) y valorar su asociación ante un inadecuado control.
Paciente con dislipemias genéticasHipercolesterolemia familiarLos pacientes con HF se consideran por definición de riesgo alto y deben alcanzar un cLDL <70mg/dL, o <55mg/dL en caso de EVA asociada. Además de la dieta y el estilo vida saludable, la mayor parte de los pacientes deben recibir una combinación de estatinas de alta potencia con ezetimiba100 valorando también la triple terapia con ácido bempedoico. De acuerdo a su riesgo basal (que como ya se ha comentado previamente, debe estratificarse) estos pacientes pueden ser tratados con iPCSK9 (tabla 9). Es necesario proceder a un tratamiento precoz para evitar el desarrollo de complicaciones vasculares futuras. Los pacientes con la forma homocigota de la enfermedad deben recibir, además de la terapia hipolipemiante convencional (estatinas altas dosis y ezetimiba), iPCSK9 si tiene al menos un alelo defectuoso (no nulo). Si bien la LDL aféresis se ha considerado el estándar de oro terapéutico en estos pacientes, las nuevas recomendaciones de la EAS 2023101 recomiendan valorar terapias hipocolesterolemiantes que actúan por vías independientes a la del receptor LDL, como la lomitapida o el evinacumab. La lomitapida es una pequeña molécula que se administra por vía oral e inhibe la proteína trasferidora de TG a nivel microsomal (MTP) limitando la formación de lipoproteínas de muy baja densidad (VLDL). Reduce el cLDL en más de 50%. Debe controlarse la ingesta de grasa, suplementarse la dieta con vitamina E y ácidos grasos y controlar el incremento de grasa hepática. El evinacumab es un anticuerpo monoclonal anti-proteína 3 del tipo angiopoyetina (ANGPTL3), inhibidor de la lipoproteína lipasa (LPL) y lipasa endotelial, cuyo déficit se asocia a hipolipemia generalizada. Se administra por perfusión endovenosa una vez al mes. El objetivo de cLDL recomendado en los niños es <115mg/dL y en adultos inferior a 70 o 55mg/dL dependiendo de la presencia de EVA.
DisbetalipoproteinemiaEsta es una rara hiperlipemia caracterizada por elevación de las lipoproteínas de densidad intermedia, que se traduce en una hiperlipemia mixta grave, la presencia de xantomas estriados palmares y un elevado riesgo de EVA precoz, con una especial predilección por la EAP. Suele estar causada por la combinación de un genotipo E2/E2 en el gen de la Apo E y uno o varios factores ambientales (hipotiroidismo, obesidad, etc.). Debe ser sospechada en cualquier hiperlipemia mixta con niveles bajos de Apo B (< 120mg/dL)102. El tratamiento va dirigido a controlar el factor ambiental coexistente, en especial la obesidad, y a utilizar estatinas combinadas o no con ezetimiba y/o fibratos. Dadas las características de la dislipemia, el objetivo principal es controlar el c-no-HDL103.
Síndrome de quilomicronemia (SQ)Consiste en el acumulo de quilomicrones en el torrente sanguíneo debido a una falta de actividad de la LPL- lo que conduce a un insuficiente catabolismo de los TG con un aumento grave de la concentración de estos104. Existe un grupo de quilomicronemias de base genética grave, el SQF105,106, y otro mucho más frecuente, debido a la asociación de variantes genéticas menos patogénicas con factores agravantes, el SQM107. El SQF es una enfermedad minoritaria, ya que afecta a 1/1.000.000 de la población. Se debe a variantes recesivas con pérdida de función, de carácter homocigoto o heterocigoto compuesto, de los genes de la LPL, de la apolipoproteína C2 (Apo C2), la apolipoproteína A5 (Apo A5), el factor 1 de maduración de la lipasa (LMF1), la proteína 1 de unión a las lipoproteínas de alta densidad anclada en el glicosilfosfatidilinositol (GPIHBP1) o el glicerol 3-fosfato deshidrogenasa 1 (G3PDH1)108,109. La quilomicronemia aparece aún sin factores agravantes y las concentraciones de TG se mantienen muy altas de forma crónica, en general >10 mmol/l (885mg/dL)110. La complicación más grave es la pancreatitis aguda, que es tanto más frecuente y recidivante, cuanto mayor es la concentración de TG, y puede aparecer en los primeros años de la vida111. La pancreatitis puede evolucionar a pancreatitis crónica con insuficiencia pancreática y DM pancreopriva. También pueden aparecer xantomas eruptivos que afectan a la superficie de extensión de las extremidades y al tronco, hepatoesplenomegalia y lipemia retinalis112.
El SQM es debido a la asociación de distintos factores genéticos de menor patogenicidad, asociado a entidades responsables de hipertrigliceridemia secundaria113. Existe un riesgo de pancreatitis, pero es menor que en el SQF por la menor gravedad y persistencia de la hipertrigliceridemia114. La respuesta a la dieta, la actividad física y a los fármacos hipotrigliceridemiantes suele ser buena. El SQM suelen aparecer en la edad adulta o media de la vida.
En ambas situaciones el tratamiento se basa en una dieta con importante restricción de la cantidad total de grasa (< 30g al día), utilización de aceite rico en TCM, fibratos y ácidos grasos n-3 a dosis superiores a los 3g al día, si bien en el SQF la respuesta a fibratos y omega 3 puede ser muy pobre o estar ausente al no ser estimulable la actividad de LPL. En la actualidad se dispone de volanesorsén, un oligonucleótido antisentido que bloquea la síntesis de la apolipoproteína C3 (Apo C3), proteína involucrada en el metabolismo de las lipoproteínas ricas en TG, dificultando, entre otros efectos su aclaramiento del plasma. Produce una reducción de TG superior a 50%. Debe monitorizarse el número de plaquetas dado que puede provocar trombopenia. Hay varios fármacos en distintas fases de ensayo clínico para esta rara entidad de los que habrá información a corto-medio plazo.
HipoalfalipoproteinemiaLas causas más comunes de hipoalfalipoproteinemia son las ligadas a la hipertrigliceridemia y a la denominada dislipemia aterogénica. Las formas primarias son excepcionales y comprenden la enfermedad de Tangier, el déficit de LCAT y variantes genéticas a nivel del gen de Apo A1115. No existen tratamientos específicos para estas entidades, y el manejo de estos sujetos debe ir encaminado al control estricto de los restantes FRV y alteraciones orgánicas adicionales, como la afectación renal en algunas de las patologías116.
HipobetalipoproteinemiaSe trata de pacientes con valores muy bajos de lipoproteínas que contienen Apo B. Se presentan en la clínica con valores muy bajos (inferior al percentil 10) de cLDL. Incluyen entidades como la abetalipoproteinemia (déficit de MTP), hipobetalipoproteinemia (alteración en los genes de Apo B homo o heterocigota), déficit de iPCSK9, y de proteína 4 del tipo angiopoyetina [ANGPTL4]), enfermedad por retención de quilomicrones (déficit de la GTPasa 1B relacionada con Ras asociada a la secreción [SAR1B]). En las formas con déficit total de Apo B se producen manifestaciones clínicas graves, incluyendo malabsorción intestinal, hígado graso, anemia hemolítica y trastornos neurológicos por déficits vitamínicos y de ácidos grasos esenciales. Se tratan con suplementos de estos elementos deficitarios. Las formas moderadas de hipobetalipoproteinemiano suelen dar complicaciones y en general se deben considerar benignas y asociadas a menor RV. En las debidas a menor síntesis de Apo B se ha comunicado un incremento en el riesgo de padecer hígado graso117.
Paciente con hipertensión arterialSe recomienda una medida adecuada de la PA para confirmar el diagnóstico de HTA tabla 3. Una diferencia de PA entre ambos brazos, medida de forma simultánea, >15 - 20mmHg se asocia a un aumento del riesgo de EVA.
En la primera visita es necesario medir la PA en decúbito supino, tras cinco minutos de reposo, y posteriormente en bipedestación, tras uno a tres minutos. La hipotensión ortostática se define como una reducción de la PA sistólica en bipedestación >20mmHg, y se ha de tener en cuenta al inicio o intensificación del tratamiento antihipertensivo.
La MAPA y la AMPA se correlacionan más estrechamente con el pronóstico y la LOD que la medida clínica, por lo que su uso es altamente recomendado9,118.
Además de su valor en el diagnóstico en sujetos no tratados, y en la identificación de sujetos con HTA de bata blanca (PA clínica elevada, con valores de PA en la MAPA normales), la MAPA es también un instrumento útil para monitorizar los efectos del tratamiento, evaluar la adherencia y detectar sujetos con HTA enmascarada (sujetos con PA normal en la consulta y valores elevados durante la MAPA).
La tabla 11 muestra las categorías de la PA según las cifras obtenidas mediante la medida de la PA clínica y la tabla 12 definición de HTA según los valores umbrales de PA clínica, ambulatoria o automedida en el domicilio.
Clasificación de la presión arterial en adultos
| Categoría | PAS (mmHg) | PAD (mmHg) |
|---|---|---|
| Óptima | <120 | <80 |
| Normal | 120-129 | 80-84 |
| Normal alta | 130-139 | 85-89 |
| Hipertensión grado 1 | 140-159 | 90-99 |
| Hipertensión grado 2 | 160-179 | 100-109 |
| Hipertensión grado 3 | ≥180 | ≥110 |
| Hipertensión sistólica aislada | ≥140 | <90 |
El diagnóstico de HTA se establecerá tras la comprobación de los valores de PA en dos o más medidas tomadas en cada una de dos o más visitas.
Cuando la PAS y la PAD se encuentren en distintas categorías se aplicará la categoría superior.
La HTA sistólica aislada se clasifica en grados (1, 2 o 3) según el valor de la PAS.
HTA: hipertensión arterial; PAD: presión arterial diastólica; PAS: presión arterial sistólica.
Definiciones de hipertensión arterial según los valores de presión arterial clínica, ambulatoria o automedida en domicilio
| Categoría | PAS (mmHg) | PAD (mmHg) |
|---|---|---|
| PA en la consulta | ≥140 | ≥90 |
| PA ambulatoria | ||
| • Diurna (o en vigilia) | ≥135 | ≥85 |
| • Nocturna (o durmiendo) | ≥120 | ≥70 |
| • 24 horas | ≥130 | ≥80 |
| PA en el domicilio | ≥135 | ≥85 |
PA: presión arterial; PAD: presión arterial diastólica; PAS: presión arterial sistólica.
Adaptado de Mancia G, et al.8
Los valores de PA obtenidos mediante la MAPA permiten identificar cuatro fenotipos:
- •
Normotensión arterial: valores de PA normales en la clínica y en la MAPA.
- •
HTA de bata blanca: valores de PA clínica elevados, pero con niveles de PA normales en la MAPA.
- •
HTA enmascarada: niveles de PA clínica normales, pero valores elevados en la MAPA.
- •
HTA establecida: valores de PA elevados en la clínica y en la MAPA.
Los valores de PA obtenidos mediante AMPA también se correlacionan mejor con la afectación de órgano diana y con la incidencia de EVA, pero la MAPA aporta información sobre la PA nocturna, que tiene una fuerte correlación con el pronóstico. Su elevación es especialmente prevalente en determinadas situaciones clínicas, como la HTA resistente, o en la HTA asociada a DM o ERC avanzada, y la asociada al síndrome de apnea-hipopnea obstructiva del sueño (SAHOS).
Inicio del tratamiento antihipertensivoLa decisión de iniciar el tratamiento farmacológico dependerá no solo del nivel de PA, sino también del RV global en función de otros FRV asociados, de la presencia de lesión subclínica de órganos diana (tabla 4), que predice la mortalidad cardiovascular de forma independiente a la puntuación del SCORE13,119, especialmente en el grupo de riesgo moderado, y de la presencia de EVA o enfermedad renal establecida.
El tratamiento inicial se decidirá en función de los niveles de PA (grados 1-3) (tabla 11) y en función del estadio de la HTA (1-3):
- •
Estadio 1: la HTA no complicada, sin LOD, sin DM, sin EVA y sin ERC estadio ≥ 3, es decir, sujetos con filtrado glomerular estimado (FGe) >60mL/min/1,73m2).
- •
Estadio 2: HTA en presencia de LOD, o DM o ERC estadio 3.
- •
Estadio 3: presencia de EVA, o ERC estadios 4 (FGe <15-29mL/min/1,73 m2) o 5 (FGe <15mL/min/1,73 m2).
El tratamiento inicial debe incluir siempre los cambios de estilo de vida, como único tratamiento inicial en los sujetos con HTA grado 1 en estadio 1 con riesgo bajo o moderado120,121. En aquellos con HTA de grado 1 pero de alto riesgo o con LOD (HTA estadio 2), se debería iniciar el tratamiento farmacológico precozmente, una vez confirmado el diagnóstico de HTA.
En los pacientes con HTA de grado 2 (PAS entre 160-179mmHg y/o PAD de 100-109mmHg) y en aquellos con HTA de grado 3 (PAS ≥ 180mmHg o PAD ≥ 110mmHg), debe añadirse el tratamiento farmacológico desde el inicio, y la mayoría de ellos requerirán tratamiento antihipertensivo combinado con al menos dos antihipertensivos. Aproximadamente, 10-12% de los hipertensos tratados requerirán más de tres antihipertensivos122.
El principal beneficio del tratamiento antihipertensivo deriva de la reducción de la PA121, independientemente del fármaco utilizado, pudiendo iniciarse el tratamiento con diuréticos tiazídicos, o similares (indapamida, clortalidona), inhibidores de la enzima convertidora de angiotensina (IECA) o antagonistas de los receptores AT1 de la angiotensina II (ARA-II), antagonistas del Ca o betabloqueadores. La posición de estos últimos como fármacos de primera línea ha sido cuestionada, debido a su menor efectividad en la prevención del ictus o sus posibles efectos metabólicos desfavorables (aunque esto puede no ser aplicable a todos los betabloqueadores), excepto en las situaciones clínicas con indicación específica para estos agentes (enfermedad coronaria, insuficiencia cardiaca [IC] con fracción de eyección [FE] reducida, etc.). También pueden estar indicados como tratamiento inicial en hipertensos jóvenes con un patrón hipercinético y tendencia a la taquicardia, o en mujeres en edad fértil, en las que el uso de inhibidores del sistema renina-angiotensina (SRA) debe emplearse con precaución por su contraindicación desde las fases iniciales de la gestación.
Un reciente metaanálisis ha mostrado que una reducción de 5mmHg de la PAS reduce los episodios cardiovasculares graves aproximadamente en 10%, tanto en prevención primaria como en prevención secundaria123.
Objetivo terapéutico del tratamiento antihipertensivoLas nuevas guías ESH 2023 aconsejan las siguientes metas terapéuticas, en función de la edad8 (tabla 13):
- •
Edad 18-64 años: PAS <130mmHg y PAD entre 70-80mmHg.
- •
Edad 65-79 años: PAS entre 130-139mmHg y <130mmHg, si se tolera. PAD entre 70-80mm Hg.
- •
Edad >80 años: PAS <150mmHg, e inferior a 140mmHg si se tolera. PAD entre 70-80mmHg. En sujetos con HTA sistólica aislada, suele ser necesario intensificar el tratamiento si la PAS es >160mmHg, aunque la PAD sea <70mmHg.
Objetivos terapéuticos de la PAS clínica en algunos subgrupos de hipertensos
| Condiciones clínicas | PAS |
|---|---|
| Edad <65 años | 120<130 mmHg |
| Edad ≥65 años | 130<140 mmHg* |
| DM | 120<130 mmHg** |
| CI | 120<130 mmHg |
| ERC | 120<130 mmHg |
| Post ictus/AIT | 120<130 mmHg |
Si se tolera bien
AIT: accidente isquémico transitorio; DM: diabetes mellitus; CI: Cardiopatía isquémica; ERC: enfermedad renal crónica; PAS: presión arterial sistólica.
Adaptado de Mancia G, et al.8
No se aconseja una PAS <120mmHg o una PAD <70mmHg.
Tratamiento de la hipertensión arterial en pacientes con comorbilidadesHipertensión arterial y diabetes mellitusLa prevalencia de HTA en los pacientes con DM es de hasta 80%, siendo el doble de la observada en población no diabética de la misma edad y características. La coexistencia de HTA y DM incrementa el riesgo de desarrollar EVA con una mayor incidencia de cardiopatía isquémica (CI), IC, EAP, ictus y mortalidad cardiovascular.
Se recomienda iniciar el tratamiento con una combinación de un inhibidor del SRA más un antagonista del Ca o un diurético tiazídico o tiazida-like, excepto cuando el FGe sea <30mL/min/1,73 m2, en cuyo caso estaría indicado el diurético de asa. No se aconseja el uso de una combinación de dos inhibidores del SRA.
Se recomienda iniciar el tratamiento farmacológico cuando la PAS sea ≥ 140mmHg o la PAD ≥ 90mmHg, y el objetivo terapéutico será una PAS de <130mmHg, pero no inferior a 120mmHg, con una PAD <80mmHg, pero no <70mmHg.
Hipertensión arterial y enfermedad renal crónicaLa prevalencia de HTA en estos pacientes es de 67-92%, y representa su comorbilidad más frecuente. Por otra parte, la presencia de HTA puede acelerar el daño renal, además de incrementar el RV. Como en todos los sujetos con HTA el tratamiento farmacológico debe acompañarse de cambios de estilo de vida, haciendo especial énfasis en la reducción en la ingesta de Na. Los diuréticos de asa deben sustituir a los diuréticos tipo tiazida o tiazida-like cuando el FGe sea <30mL/min/1,73 m2.
Un ensayo clínico publicado en 2021 ha mostrado que en sujetos con ERC avanzada (FGe de 23±4,2mL/min/1,73 m2), la clortalidona a dosis de 12,5-50mg mejora el control de sujetos con HTA mal controlada en relación con placebo a las 12 semanas de seguimiento124.
Debido a que el descenso de la PA disminuye la presión de perfusión, no es infrecuente una reducción del FGe entre 10-20% al inicio del tratamiento. Se debe hacer una cuidadosa monitorización de los electrolitos.
El objetivo terapéutico es una PAS <130mmHg, pero no por debajo de 120mmHg y una PAD <80mmHg, pero no <70mmHg.
Se recomienda como tratamiento inicial un inhibidor del SRA más un antagonista del Ca o un diurético. No se recomienda el uso simultáneo de IECA y ARA-II.
Hipertensión arterial y enfermedad coronaria estableLa HTA es un FRV mayor de CI. Numerosos ensayos clínicos han demostrado los beneficios del tratamiento antihipertensivo en la reducción de la incidencia de CI, tanto en prevención primaria como en la secundaria.
Excepto en algunos casos, como ancianos frágiles o mayores de 80 años, en general se recomienda como tratamiento inicial la terapia doble con un inhibidor del SRA (IECA o ARA-II) más un betabloqueador o antagonista del Ca, aunque pueden ser utilizadas otras combinaciones como antagonista del Ca dihidropiridínico más betabloqueador. En un segundo escalón, si no se controla la HTA, el paciente debe ser tratado con triple terapia, en general añadiendo un diurético a alguna de las combinaciones anteriores.
Si presentan angina sintomática, se recomienda una combinación de betabloqueadores y antagonistas del Ca dihidropiridínicos.
Se aconseja el inicio del tratamiento farmacológico cuando la PA sea ≥ 130/80mmHg, y el objetivo terapéutico sería una PAS de 130mmHg o inferior si es tolerado, pero no <120mmHg, y una PAD <80mmHg, pero no <70mmHg. En sujetos de 65 o más años, un objetivo terapéutico de PAS entre 130-140mmHg puede ser adecuado.
Hipertensión arterial e insuficiencia cardiacaEl antecedente de HTA está presente en 75% de los pacientes con IC crónica. Se recomienda el tratamiento antihipertensivo cuando la PA clínica sea ≥ 140/90mmHg, tanto en pacientes con IC con FE reducida como en los que presentan IC con FE preservada. En los pacientes con IC y FE reducida, se recomienda el tratamiento con un inhibidor del SRA (IECA o ARA-II), un betabloqueador y un diurético, asociado a un inhibidor del cotransportador de Na y glucosa tipo 2 (SGLT2) y a un antagonista de los receptores mineralcorticoides, si no presenta contraindicaciones. Si no se logra el control de la HTA a pesar del tratamiento anterior, se podría añadir un antagonista del Ca dihidropiridínico.
En los pacientes con IC y FE preservada, se recomiendan para el control de la HTA el uso de IECA o ARA-II, betabloqueadores, antagonistas del Ca y tiazidas o diuréticos tiazida-like asociados al uso de iSGLT2.
Hipertensión arterial y fibrilación auricularLa HTA es el FRV modificable más común para la aparición de FA. La coexistencia de HTA y FA aumentan de forma importante el riesgo de ictus isquémico y hemorrágico. Todos los fármacos antihipertensivos de primera línea estarían indicados para el control de la HTA, pero el uso de inhibidores del SRA y los betabloqueadores podrían ser considerados en la FA para prevenir su recurrencia. El umbral para el inicio del tratamiento antihipertensivo y el objetivo terapéutico serían los mismos que para la población general.
En los pacientes con FA y PAS >160mmHg, se recomienda mejorar el control de la HTA antes de iniciar el tratamiento anticoagulante.
Hipertensión arterial e ictusEl ictus es una causa mayor de mortalidad, incapacidad y demencia, y está asociado de forma independiente con el incremento de eventos vasculares mayores en ambos sexos105. Dado que el ictus es un grupo heterogéneo, en cuanto a causas y hemodinámica subyacente, el control de la HTA en estos pacientes es complejo y supone un auténtico reto. El objetivo terapéutico es una PA <130/80 mmHg125. Este objetivo de PA <130/80mmHg es el recomendado en el AIT, tal como aconseja un reciente documento de la American Heart Association (AHA), pues reduce 22% el riesgo de recurrencia del ictus126.
HTA resistente e HTA refractariaExisten diversas causas del mal control de la HTA en la práctica clínica, que deberían ser tenidas en cuenta antes de etiquetar a una paciente de HTA resistente (fig. 6)127.
La HTA resistente representa aproximadamente 10-12% de los hipertensos tratados122. Una HTA se considera resistente cuando no se ha conseguido reducir la PA <140/90mmHg a pesar de dosis óptimas (o las dosis máximas toleradas) de tres fármacos y un plan terapéutico que incluya un diurético (típicamente IECA o ARA-II más un antagonista del Ca y un diurético).
Se debe confirmar el mal control mediante MAPA (preferible) o AMPA y se han de excluir las causas de pseudorresistencia (p. ej., mala adherencia) y la HTA secundaria.
En los últimos años se ha descrito un nuevo fenotipo HTA refractaria, cuando no se alcanza una PA <140/90mmHg a pesar del uso de ≥ 5 antihipertensivos128,129. Es poco frecuente (1,4%), y también necesita de la realización de una MAPA de 24 horas para su confirmación, así como descartar las causas de pseudorresistencia, como se ha mencionado anteriormente en la HTA resistente. Un reciente estudio prospectivo130 ha mostrado que los pacientes con HTA refractaria, confirmada por MAPA-24 horas, presentan un riesgo más elevado de eventos cardiovasculares mayores y de mortalidad.
Seguimiento del paciente con hipertensión arterialTras el inicio del tratamiento farmacológico antihipertensivo, es importante efectuar un seguimiento de este al menos una vez dentro de los dos primeros meses, para evaluar el efecto sobre la PA, detectar los posibles efectos adversos y descubrir una posible mala adherencia. Posteriormente, se recomienda una visita de seguimiento a los tres meses para verificar el control de la PA y evaluar la adherencia.
La deficiente adherencia es una causa frecuente de falta de control de la PA. Para su evaluación y detección, juegan un papel fundamental las enfermeras, farmacéuticos comunitarios y otros profesionales sanitarios, que son también de gran ayuda para la educación, apoyo y seguimiento a largo plazo de los pacientes hipertensos, por lo que han de formar parte de la estrategia global para la mejora del control de la PA. La simplificación del tratamiento y la reducción del número de comprimidos, ayudarán sin duda a una mejor adherencia y a un mejor control de la PA a mediano y largo plazo.
En los sujetos con PA normal-alta, aunque no sean tratados farmacológicamente, se recomiendan cambios de estilo de vida, y un seguimiento periódico (al menos una visita anual) para medir la PA clínica y ambulatoria, así como para reevaluar su RV.
Paciente con hiperglucemia (prediabetes y diabetes mellitus)Clasificación y pruebas diagnósticasSe considera hiperglucemia a presentar al menos, dos valores de glucosa plasmática en ayunas ≥ 100mg/dL, y DM a cifras, en dos ocasiones, de glucemia plasmática en ayunas ≥ 126mg/dL. Además del criterio de glucemia en ayunas, la preDM y la DM pueden diagnosticarse si se cumple al menos uno de los criterios de HbA1c, los valores al azar de glucemia, o los valores de glucemia plasmática a las dos horas de la prueba de la sobrecarga oral de glucosa (SOG) descritos en la tabla 14131.
Criterios diagnósticos de prediabetes y de diabetes mellitus de la American Diabetes Association (ADA)131
| Criterios de diagnóstico de prediabetes y DM* | Normal | Prediabetes | DM |
|---|---|---|---|
| HbA1c (%) o | <5,7 | 5,7-6,4 | ≥6,5 |
| Glucemia plasmática en ayuno (mg/dL) o | <100 | 100-125 | ≥126 |
| Glucemia 2h SOG con 75 g (mg/dL) o | <140 | 140-199 | ≥200 |
| Glucemia al azar con clínica hiperglucémica (mg/dL) | ≥200 |
La prueba de SOG se realiza administrando 75g de glucosa en un adulto o 1,75g/kg de peso (máximo 75g) en niños en condiciones estandarizadas. Es una prueba muy útil para confirmar el diagnóstico de DM en pacientes que por los valores de glucemia en ayuno o de HbA1c no quedan diagnosticados, pero tienen una alta probabilidad de serlo: sujetos obesos, SM, DM gestacional o con criterios de preDM51,131. La medición de los valores de HbA1c debe realizarse utilizando un método estandarizado con el estudio DTCC y de referencia131.
Recomendamos realizar despistajes de DM en sujetos asintomáticos con el fin de hacer un diagnóstico precoz (tabla 15). En este caso para facilitar el diagnóstico utilizaremos los valores en ayuno de glucemia y HbA1c, no siendo necesario utilizar la SOG para el despistaje.
Sujetos a los que realizar despistaje de la diabetes mellitus51
| Edad ≥35 años | Edad <35 años |
|---|---|
| En todos los casos | Con el diagnóstico de prediabetes oCon antecedentes de DM gestacional oVIH oSi presentan IMC ≥25 kg/m2, en asiáticos ≥23 kg/m2, con al menos uno de los siguientes:• DM en familiares de primer grado• Pertenencia a un grupo étnico de alto riesgo de DM (afroamericanos, latinos, etc.)• Historia de ECV• HTA (≥140/90 mmHg o en tratamiento)• cHDL <35 mg/dL, TG >250 mg/dL, o ambos• SOP• Vida sedentaria• Otras condiciones asociadas a resistencia a la insulina (acantosis nigricans, hígado graso no alcohólico, hiperlipemia familiar combinada, etc.) |
DM: diabetes mellitus; ECV: enfermedad cardiovascular; cHDL: colesterol unido a lipoproteínas de alta densidad; HTA: hipertensión arterial; IMC: índice de masa corporal; SOP: síndrome de ovario poliquístico; VIH: virus de la inmunoeficiencia humana.
Los pacientes con DM recién diagnosticados tienen elevado RV sin necesariamente tener LOD o enfermedad vascular. En este grupo de pacientes para valorar el RV debemos utilizar el SCORE-2 DM58.
Objetivos de control en la prediabetes y la diabetes mellitusLos objetivos generales de control se presentan en la tabla 16.
Objetivos generales de control de la prediabetes y diabetes mellitus
| Objetivos |
|---|
| • Establecer, conseguir y mantener un buen control metabólico• Prevenir las complicaciones de la DM• Preservar la vida del paciente y aliviar los síntomas de la hiperglucemia• Capacitar al paciente para conseguir una buena calidad de vida (personal, familiar, laboral y social)• Individualizar el valor de HbA1c |
DM: diabetes mellitus; HbA1c: hemoglobina glicosilada.
Para obtener un buen control glucémico, en primer lugar, es necesario individualizar el objetivo de HbA1c131. Para fijar el valor de HbA1c tendremos en cuenta: el grado de motivación, la presencia de complicaciones crónicas o de comorbilidades graves, edad del paciente, supervivencia estimada y el tiempo de evolución (fig. 7). En pacientes jóvenes, sin complicaciones crónicas, ni comorbilidades, con tiempos de evolución cortos y larga supervivencia estimada, buscaremos intensificar el tratamiento para alcanzar HbA1c de entre 6-7%131. Para tratar adecuadamente a los pacientes con DM, es necesario no solo controlar la glucemia y buscar un valor individualizado de HbA1c, sino que debemos controlar los valores de PA, lípidos, dejar de fumar y buscar un peso óptimo. Es lo que se conoce como tratamiento global de la DM. Este tratamiento siempre será individualizado y precoz. Los objetivos específicos de IMC, tabaquismo, PA, y bioquímicos del tratamiento de la DM vienen recogidos en la tabla 17.
Objetivos específicos clínicos y bioquímicos del tratamiento en el adulto diabético
| Objetivos | Óptimo | Aceptable | No deseable |
|---|---|---|---|
| GB (mg/dL) | 80-130 | 130-179 | ≥180 |
| GP 2h (mg/dL) | <180 | 180-199 | ≥200 |
| HbA1c (%) | <7,0 | 7,0-7,9 | ≥8,0 |
| cLDL (mg/dL)* | Variable | Variable | Variable |
| IMC (kg/m2) | <25 | 25-26,9 | ≥27 |
| PA (mmHg) | <130/<80 | 130-139/80-89 | ≥140/≥90 |
| Tabaco | NO FUMAR | ||
cLDL en función del riesgo CV: DM de muy alto riesgo cLDL <55 mg/dl, DM de alto riesgo cLDL <70 mg/dl, DM de moderado riesgo cLDL <115 mg/dl (ver Tabla 21).
cLDL: colesterol unido a lipoproteínas de baja densidad; DM: diabetes mellitus; HbA1c: hemoglobina glicosilada; IMC: índice de masa corporal; GB: glucemia basal, GP: glucemia postprandial; PA: presión arterial, IMC: índice de masa corporal.
El tratamiento de la preDM y de la DM se basa en cambios en el estilo de vida, dietoterapia y utilización de fármacos para conseguir los objetivos terapéuticos comentados.
Dieta y cambios en el estilo de vidaEl tratamiento debe ir orientado a cumplir con todos los objetivos globales expuestos. La terapia de la preDM y de la DM2 es la dieta, los cambios en el estilo de vida y la actividad física13,131,132. Como la mayor parte de los afectados presenta obesidad, el tratamiento dietético es similar al descrito en el apartado del paciente obeso.
La modificación en el estilo de vida en la DM es una intervención esencial para mejorar no solo el control glucémico, sino también las comorbilidades asociadas, como la dislipemia, la obesidad y la HTA. Los cambios hacia un estilo de vida saludable deben incluir los siguientes aspectos: cese del tabaquismo y moderación de la ingesta alcohólica, pérdida de peso (> 5%) en caso de sobrepeso u obesidad, asesoramiento personalizado nutricional y actividad con una supervisión continua. Se recomienda la ingesta de hidratos de carbono procedentes de las verduras, frutas, cereales integrales, legumbres y productos lácteos sobre otras fuentes13,132. Limitar especialmente los alimentos procesados que contienen grasas añadidas, azúcares o Na. Recomendamos el consumo de ácidos grasos poliinsaturados n-3 presentes en el pescado, especialmente en el azul (sardina, salmón, atún, caballa, jurel, etc.). En resumen, una dieta tipo mediterránea rica en ácidos grasos monoinsaturados (aceite de oliva virgen y frutos secos) puede ser útil para el control global del RV en estos pacientes13,132.
Por otro lado, diferentes estudios recogidos en metaanálisis sobre los efectos de intervenciones en los estilos de vida en personas con preDM han encontrado una prevención eficaz para el desarrollo de DM131. Estos estudios avalan el uso de una dieta tipo mediterránea, en sujetos con preDM133.
Las recomendaciones generales de la actividad física en personas con preDM o DM vienen recogidas en la siguiente tabla 18.
Recomendaciones generales de la actividad física en personas con prediabetes y DM
| Recomendaciones generales |
|---|
| • Realizar como mínimo 150 minutos por semana de actividad aeróbica moderada a intensa, repartidos en al menos tres días a la semana. Evitar pasar más de dos días sin actividad física |
| • Realizar de dos a tres sesiones por semana de ejercicios de resistencia en días no consecutivos |
| • Disminuir el tiempo diario dedicado a actividades sedentarias |
| • Para los adultos mayores, realizar de dos a tres veces por semana ejercicios de flexibilidad y equilibrio |
DM: diabetes mellitus.
En sujetos con preDM, la ADA recomienda el tratamiento con metformina, en aquellos con IMC >35kg/m2, antecedentes de DM gestacional, en los sujetos con glucemia en ayunas ≥ 110mg/dL y HbA1c ≥ 6,1% y en obesos con depósito de grasa visceral131.
Los objetivos del tratamiento del paciente con DM son prevenir y retardar las complicaciones macro y microvasculares, así como reducir la elevada morbimortalidad vascular. El máximo beneficio en la prevención cardiovascular del paciente con DM se obtiene interviniendo de forma simultánea en todos los FRV: tabaco, dislipemia, HTA e hiperglucemia13,131.
Centrándonos en el tratamiento farmacológico de la hiperglucemia, una vez establecido el valor objetivo de HbA1c, la elección de los fármacos dependerá de la edad, grado y tipo de obesidad, eficacia y tolerancia de los fármacos, coste, comorbilidades (prevención secundaria, IC o enfermedad renal diabética) (fig. 7).
En la tabla 19 presentamos los principales fármacos utilizados para el tratamiento de la hiperglucemia en la DM y su indicación.
Principales fármacos utilizados en el tratamiento de la DM
| Fármaco | Dosis | Indicación |
|---|---|---|
| Metformina | 850 mg x 3Titular de forma gradual | DM2DM1 obesoDM gestacional |
| Pioglitazona | 30-45 mg/día | DM2DM2 e hígado graso |
| iDPP4 | Sitagliptina 100 mg/díaVidagliptina 50 mg x 2Saxagliptina 5 mg/díaLinagliptina 5 mg/díaAlogliptina 25 mg/día | DM2 |
| arGLP-1 | Exenatida 5μg sc x 2 1er mes, 10μg sc x 2 2° mesLiraglutida 0,6 mg/día, 1,2 mg/día 2ª semana y si es necesario 1,8 mg/díaExenatida LAR, 2 mg/semanaLixisenatide, 10μg/día 2 semanas, aumentar hasta 20μg/díaDulaglutida 0,75 mg/semana aumentar 1,5 mg/semanaSemaglutida 0,25 mg/semana durante 4 semanas y subir a 0,5 mg/semana Máximo 1 mg/semana | DM2 obeso en prevención secundariaDM2 con IMC ≥30 kg/m2 |
| iSGLT2 | Dapagliflozina 10 mg/díaEmpagliflozina 10 y 25 mg/díaCanagliflozina 100 y 300 mg/díaErtugliflozina 5 y 15 mg/día | DM2DM2 con ICDM2 en prevención secundariaEnfermedad renal en DM2 |
| Meglitinidas | Repaglinida 0,5-4 mg antes de las tres comidas principalesNateglinida 120 mg, en las tres comidas principales | DM2 con ERC |
| Sulfonilureas3ª generación | Iniciar con dosis bajas e ir incrementado la dosis | DM2 |
| Inhibidores de alfa- glucosidasa | Acarbosa o miglitol 50 mg x 3/día, al inicio dela comida. Máximo 100 mg x 3/día | DM2 |
arGLP-1: agonistas del receptor de GLP-1; iDDP-4: inhibidores de la dipeptidil peptidasa 4; DM: diabetes mellitus; DM1: diabetes mellitus tipo 1; DM2: diabetes mellitus tipo 2; ERC: enfermedad renal crónica; IC: insuficiencia cardiaca; IMC: índice de masa corporal; insuf.: insuficiencia; iSGLT2: inhibidores del cotransportador sodio y glucosa tipo 2; sc: subcutánea.
En la tabla 20 resumimos los principales beneficios, contraindicaciones, efectos adversos y capacidad de prevención cardiovascular independiente de su efecto hipoglucemiante.
Beneficios, contraindicaciones, principales efectos adversos y capacidad de prevención vascular de los principales fármacos hipoglucemiantes utilizados en el tratamiento de la diabetes mellitus
| Fármaco | Beneficios | Contraindicación | Desventajas/Efectos adversos | Prevención CV |
|---|---|---|---|---|
| Metformina | ↓ HbA1c 1%↓ peso (1,5-2 kg)↓ costeNo hipoglucemias | FGe <30 mL/min/1,73 m2Insuficiencia hepática grave 24 h antes de cirugías | Náuseas, vómitos dolor abdominalExcepcionales: Déficit vitamina B12 y acidosis láctica | Sí131 |
| Pioglitazona | ↓ HbA1c 0,5 - 1%↓ TG y ↑ cHDL | Insuficiencia cardiaca | ↑ peso↑ costeEdemasICFracturasen postmenopáusicas | Sí, en prevención primariaIctus (ACV)131 |
| IDPP-4 | ↓ HbA1c 0,8%Peso=No hipoglucemias | FG <60 mL/min/1,73 m2 ajustar dosis sitagliptina 25 y 50 mg/día, alogliptina 6,25 y 12,5 mg/díaNo requiere linagliptina | ↑ costeLesiones cutáneas (penfigoide ampolloso)No combinar con arGLP-1 | NoSaxagliptina ↑ ingresos por Insuf. cardiaca |
| arGLP-1 | ↓ HbA1c 1%↓↓ pesoNo hipoglucemias | Embarazo | Náuseas, vómitos↑ coste | SíLiraglutide y semaglutide en prevención secundaria134,135. Dulaglutide prevención primaria y secundaria136Liraglutide, semaglutide y dulaglutide ↓ progresión enfermedad renal diabética |
| iSGLT2 | ↓ HbA1c 1%↓ peso↓ PANo hipoglucemias | Embarazo | Infecciones urinariasMicosis genitalesRara hipotensión ortostática, deshidratación y cetoacidosis euglucémica | SíEmpagliflozina y Canagliflozina en prevención secundaria137,138Empagliflozina mortalidad137Dapagliflozina mortalidad CV139Empagliflozina, canagliflozina, dapagliflozina ertugliflozina ingresos por insuficiencia cardiaca137–139Canagliflozina y dapagliflozina preservación función renal y ↓ progresión enfermedad renal diabética140,141 |
| Meglitinidas | ↓ HbA1c 0,8%↑ PesoUso en ERC | Embarazo y lactancia | Hipoglucemias | No |
| Sulfonilureas 3ª generación | ↓ HbA1c 1%↑ Peso (2-4 kg) | Embarazo y lactanciaPaciente ingresado | HipoglucemiasNo usar si ERC, insuficiencia hepática e IC | No |
| Inhibidores de alpha- glucosidasa | ↓ HbA1c 0,5%Peso= | DM1Gestación y lactanciaEnf. gastrointestinal | Gastrointestinales: flatulencia, distensión, dolor | No |
ACV: accidente cerebrovascular; arGLP-1: agonistas del receptor de GLP-1; cHDL: colesterol unido a lipoproteínas de alta densidad; CV: cardiovascular; DM: diabetes mellitus; DM1: diabetes mellitus tipo 1; ERC: enfermedad renal crónica; HbA1c: hemoglobina glicosilada; IC: insuficiencia cardíaca; IDDP-4: inhibidores de la dipeptidil peptidasa 4; FG: filtrado glomerular; FGe: filtrado glomerular estimado; iSGLT2: inhibidores del cotransportador de sodio y glucosa tipo 2; PA: presión arterial; TG: triglicéridos.
En la figura 8 se presentan las pautas terapéuticas en función de la presencia o no de ECV, del IMC, de enfermedad renal diabética y de IC. El fármaco de primera elección en pacientes con DM2 sigue siendo la metformina131. Aunque en sujetos en prevención secundaria vascular, DM de alto o muy alto RV o IC podrían utilizarse en el primer escalón los iSGLT2 o los agonistas del receptor del péptido similar al glucagón 1 (arGLP-1).
Pautas terapéuticas en función de la situación vascular, del índice de masa corporal, de la enfermedad renal diabética y de la presencia de insuficiencia cardiaca.
8A) Pauta terapéutica en pacientes con diabetes mellitus tipo 2, con enfermedad vascular o con alto/muy alto riesgo vascular, o con insuficiencia cardiaca o con enfermedad renal diabética.
*en caso de utilizar metformina en primer escalón.
8B) Pauta terapéutica en pacientes con diabetes mellitus tipo 2 y moderado/bajo riesgo vascular, sin enfermedad vascular aterosclerótica establecida, sin insuficiencia cardiaca o sin enfermedad renal diabética.
*utilizar iDDP4 en caso de riesgo alto de hipoglucemia y en sujetos con fragilidad, demencia, ancianos.
arGLP-1: agonistas del receptor del péptido similar al glucagón 1; DM: diabetes mellitus; ECV: enfermedad cardiovascular; HbA1c: hemoglobina glicosilada; iSGLT2: inhibidores del cotransportador de sodio y glucosa tipo 2; SU: sulfonilureas; iDPP-4: inhibidores de la dipeptidil peptidasa-4; IMC: índice de masa corporal.
Como segundo escalón terapéutico, elegiremos el fármaco atendiendo a si el paciente está en prevención primaria o secundaria, presencia de obesidad, enfermedad renal diabética o IC (fig. 8)131.
Existen numerosos estudios de intervención que demuestran la capacidad de los iSGLT2137–139 o los arGLP-1 en la prevención vascular134–136 y progresión de la enfermedad renal diabética140,141. Por tanto, deben constituir los fármacos de uso prioritario en el tratamiento de la DM2.
En función del valor de la HbA1c, el tratamiento inicial de la hiperglucemia variará. Si la HbA1c es menor de 7,5% optaremos por una monoterapia, si está entre 7,5-9% con doble terapia y en casos de glicadas mayores de 9% con clínica cardinal optaremos por la insulinización.
La insulinización en la DM2 con una insulina de acción prolongada o basal estará indicada si falla la triple asociación (tercer escalón terapéutico, fig. 8), siempre después de haber ensayado un arGLP-1. En los casos en los que existe una clara clínica de hiperglucemia con HbA1c elevada también será necesario insulinizar, como hemos comentado en el párrafo anterior. La dosis total diaria para comenzar la insulinización es de 0,1 - 0,3 U/kg de peso, con modificación de la dosis cada tres días hasta conseguir objetivos. Debe valorarse en cada ocasión la necesidad real de aumentar la dosis, ya que en sujetos con obesidad e insulinorresistencia dosis elevadas pueden aumentar el peso y, con ello, la resistencia a la insulina, sin mejoría del control glucémico131.
Prevención cardiovascular en la diabetes mellitusTratamiento y prevención de la enfermedad vascular aterosclerótica en la persona con diabetes mellitusLa prevención cardiovascular en la DM requiere una intervención precoz, intensiva y mantenida de todos los FRV: dislipemia, PA, tabaquismo y obesidad abdominal (tabla 21)13,131,132.
Tratamiento y prevención de la EVA en la persona con diabetes mellitus
| FRV | Objetivo | Tratamiento |
|---|---|---|
| Control de la hiperglucemia | HbA1c <7% | Dieta hipoglucemianteiSGLT2 o arGLP-1 |
| HTA | PAS 120–129 mmHg y PAD 70–80 mmHgEn presencia de albuminuria, PA más baja si se tolera, aunque hay discrepancias en este punto | Reducción ingesta de sal <3 g/24 hSi macroalbuminuria o insuficiencia renal, restringir el consumo de proteínas a 0,6-0,8 g/kg/24 hReducir el alcohol (máximo tolerado 30 g/día)Consumo moderado de café (2 tazas/24 h)IECA o ARA-II |
| Tabaco | No fumar ni activa, ni pasivamente | |
| Obesidad | IMC <30 kg/m2 | Estrategia dietoterapia |
| Dislipemia | Primario: descenso de cLDL según el riesgo del paciente (ver Tabla 21)Secundario TG <150 mg/dL | Estatinas asociadas o no a ezetimiba para alcanzar objetivos terapéuticos, iPCSK9 en prevención secundaria según recomendaciones de la SEA (Tabla 8)Fibratos u omega 3 si necesario reducir una hipertrigliceridemia grave |
ARA-II: antagonistas de los receptores AT1 de la angiotensina II; arGLP-1: agonistas del receptor del péptido similar al glucagón 1; cLDL: colesterol unido a lipoproteínas de baja densidad; DM: diabetes mellitus; HbA1c: hemoblogina glicosilada; EVA: enfermedad vascular arteriosclerótica; FRV: factores de riesgo vascular; IECA: inhibidor de la enzima convertidora de la angiotensina I; IMC: índice de masa corporal; iPCSK9: inhibidor de la convertasa de proteínas subtilisina/kexina 9; iSGLT2: inhibidores del cotransportador de sodio y glucosa tipo 2; SEA: Sociedad Española de Arteriosclerosis; TG: triglicéridos; PA: presión arterial.
En general, las personas con DM2 son consideradas de alto RV13,142. Las personas con DM2 y múltiples FRV (dislipemia, HTA, tabaquismo) o EVS o LOD, o que estén en prevención secundaria, son de muy alto RV13. El objetivo primario para la prevención es obtener un valor de cLDL o de c-no-HDL recogido en la tabla 22, según la clasificación de riesgo del paciente13.
Objetivo primario de cLDL o c-no-HDL para la prevención vascular en las personas con diabetes mellitus13
| Perfil lipídico | Riesgo moderadoDM conmenos de 10 años de evolución sin otros FRV sin LOD | Alto riesgoDM con>10 años de evolución omal control glucémico y LOD en una localización | Muy alto riesgoDM con EVADM con:FGe <30 oFG 45-59 y ALB >30 oALB >300o LOD en tres localizacioneso más de 3 FRV o afectación de órgano dianaDM1 con más de 20 años de evolución |
|---|---|---|---|
| cLDL (mg/dL) | <100 | <70 | <55 |
| c-no-HDL (mg/dL) | <130 | <100 | <85 |
| TG (mg/dL) | <200 | <200 | <200 |
| cHDL (mg/dL) (H/M) | >40/>50 | >40/>50 | >40/>50 |
ALB: albuminuria; cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; c-no-HDL: colesterol-no-HDL; FGe: filtrado glomerular estimado; FG: filtrado glomerular; FRV: factores de riesgo vascular; H: hombres; M: mujeres; LOD: lesión de órgano diana.
Para obtener estos objetivos será necesario utilizar estatinas de alta intensidad, en la mayor parte de los casos asociadas a ezetimiba. En la figura 5 queda recogido la estrategia y el esquema del tratamiento de la dislipemia en la persona con DM con el fin de conseguir una prevención vascular efectiva. Una vez obtenido el valor de cLDL o c-no-HDL debemos buscar un objetivo secundario de TG <200mg/dL en los pacientes con DM y SM13,51,143.
Paciente con obesidad y síndrome metabólicoPaciente con síndrome metabólicoEn la tabla 23 se define el SM 51. Entre las alteraciones metabólicas relacionadas con el SM destacan51:
- •
Dislipemia, fundamentalmente hipertrigliceridemia, descenso del cHDL y presencia de partículas cLDL pequeñas y densas, con aumento plasmático de los ácidos grasos libres. A este conjunto de alteraciones se le conoce como dislipemia aterogénica.
- •
Hiperglucemia o DM
- •
HTA
Criterios diagnósticos del síndrome metabólico
| Criterios diagnósticos* | Descripción |
|---|---|
| Obesidad abdominal | Perímetro de cintura (por encima de las crestas iliacas) elevado según sexo y etnia (≥94 H y ≥80 M caucásicos) |
| Glucemia en ayunas (mg/dL) | ≥100 o tratamiento previo específico |
| TG plasmáticos (mg/dL) | ≥150 o tratamiento previo específico |
| cHDL (mg/dL) | <40 en H o <50 en M o en tratamiento específico |
| PA (mmHg) | Sistólica ≥130 o diastólica ≥85 o con tratamiento antihipertensivo |
Estas alteraciones, junto con la obesidad abdominal, son los parámetros que se han establecido para el diagnóstico de SM. Además, otras muchas alteraciones no utilizadas para el diagnóstico tienen un gran interés, como la hiperuricemia, la gota, la hipercoagulabilidad y los defectos de la fibrinólisis que con frecuencia cursan con una elevación del inhibidor del activador del plasminógeno-1 (PAI-1), la esteatosis hepática no alcohólica y el hiperandrogenismo. La relevancia clínica del SM se relaciona con su prevalencia, 20-40% de la población general y 80-85% de los sujetos con DM2. Los pacientes con SM tienen un riesgo elevado de desarrollar EVA y DM2.
Datos de diferentes metaanálisis indican que las personas con SM duplican su riesgo de episodios vasculares e incrementan en 1,5 veces la mortalidad por todas las causas, comparado con aquellos sin SM51. Estudios recientes encuentran un incremento en el riesgo relativo de desarrollar DM2 de entre cinco a 10 veces. Otras complicaciones no menos importantes relacionadas con el SM son SAHOS, insuficiencia respiratoria o síndrome de hipoventilación alveolar idiopática y diversos tipos de cáncer (mama, útero, colon, esófago, páncreas, riñón, próstata, etc.).
El tratamiento del SM debe buscar controlar todos los componentes del síndrome (tablas 24 y 25). En la tabla 25 exponemos el tratamiento farmacológico del SM. El pilar del tratamiento se basa en el cambio del estilo de vida buscando una reducción ponderal y un control de la dislipidemia aterogénica51,132,144.
Tratamiento del síndrome metabólico
| Tratamientos | |
|---|---|
| Dieta | De tipo mediterránea (saturadas <7% del aporte calórico total, colesterol <200 mg/día, evitar grasas trans)Rica en fibraLimitar consumo de Na (5-6 g/día)Alimentos con índice glucémico bajo. Evitar azúcares simplesAumentar frutas, vegetales y cereales integralesAceite de oliva como grasa culinaria principalEvitar alimentos procesados |
| Actividad física | Moderada-intensa30 minutos/día (preferible 45-60 min)Continua/intermitenteAl menos cinco días/semanaAdaptada a edad y estado cardiovascular del paciente |
min: minutos; Na: sodio; SM: síndrome metabólico.
Tratamiento de otros componentes del síndrome metabólico
| Componentes | Objetivo | Objetivos secundarios | Tratamiento |
|---|---|---|---|
| Dislipemia | cLDL en función de los FRV asociados*Si hipertrigliceridemia c-no-HDL (30 mg/dL superior al objetivo de LDL) o apoB | cHDL mg/dL>40 H y >50 MTG <150 mg/dL | Medidas higiénico-dietéticasEstatinas, ezetimiba, ácidos omega 3 y/o fibratos si precisa (solo si hipertrigliceridemia grave) |
| Hipertensión y microalbuminuria | PA 120 <130/<80 mmHg | Medidas higiénico-dietéticasIECA o ARA-II ±otros fármacos | |
| Otros FRV | Abandono tabacoValorar antiagregación en sujetos de muy alto riesgo (aspirina) |
El SM no es un equivalente coronario, pero sí es un modulador del riesgo (Tabla 4) en la valoración del riesgo para establecer el objetivo de LDL.
ApoB: apolipoproteína B; ARA-II: antagonistas de los receptores AT1 de la angiotensina II; cLDL: colesterol unido a lipoproteínas de baja densidad; cHDL: colesterol unido a lipoproteínas de alta densidad; c-no-HDL: colesterol-no-HDL; H: hombres; IECA: inhibidor de la enzima convertidora de la angiotensina I; IPE: icosapento de etilo; FRV: factores de riesgo vascular; M: mujeres; PA: presión arterial; SM: síndrome metabólico; TG: triglicéridos.
La obesidad se define como un IMC ≥ 30kg/m2145. La clasificación de los pacientes en función de su valor de IMC viene recogida en la tabla 26.
Clasificación de las personas según el IMC. Definición de delgadez y obesidad
| Clasificación | IMC |
|---|---|
| Peso insuficiente | <18,5 kg/m2 |
| Normopeso | 18,5-24,9 kg/m2 |
| Sobrepeso grado 1 | 25-26,9 kg/m2 |
| Sobrepeso grado 2 | 27-29,9 kg/m2 |
| Obesidad grado 1 | 30-34,9 kg/m2 |
| Obesidad grado 2 | 35-39,9 kg/m2 |
| Obesidad grado 3 o mórbida | 40-49,9 kg/m2 |
| Obesidad grado 4 o extrema | ≥50 kg/m2 |
IMC: índice de masa corporal.
El perímetro de la cintura permite diagnosticar el tipo de obesidad (obesidad abdominal) y el riesgo cardiometabólico. El valor del perímetro abdominal difiere según grupos étnicos145.
La obesidad es muy prevalente en nuestro país. Según la Encuesta Europea de Salud en España (EESE), en 2020, 16,5% de hombres y 15,5% de mujeres padecían obesidad y 44,9% de hombres y 30,6% de mujeres sobrepeso La obesidad es el principal FRV para desarrollar DM2 y tiene, especialmente la obesidad abdominal, un alto RV145.
El tratamiento de la obesidad es complejo y debe ser individualizado145. Se basa en estrategias de dietoterapia (fig. 9)146, cambios en el estilo de vida, psicoterapia y fármacos (tablas 27 y 28)145.
Indicaciones de dietas de muy bajo contenido calórico
| Indicaciones | Contraindicaciones |
|---|---|
| • Pacientes con IMC >35 kg/m2 en los que ha fracasado el tratamiento convencional y además presentan:∘ Necesidad de una pérdida de peso rápida, p. ej., insuficiencia respiratoria severa o cirugía ortopédica∘ Patología grave asociada a la obesidad que responde a la reducción ponderal, como la DM2, HTA, dislipemia o SAHOS | • IMC <30 kg/m2• Embarazo y lactancia• Patología severa sistémica o de órgano, salvo en situaciones que se vean francamente agravadas por el sobrepeso, en las que se recomienda valoración individual de la relación riesgo-beneficio• DM1• Alteraciones psiquiátricas: trastorno de la conducta alimentaria (TCA), depresión grave, psicosis, adicción a drogas o alcohol• Trastornos hidroelectrolíticos e hipotensión ortostática• Enfermedades con pérdidas proteicas: enfermedad de Cushing, lupus eritematoso sistémico, proteinuria, neoplasias, malabsorción, enfermedad inflamatoria intestinal, etc.• Enfermedades agudas cardiovasculares, arritmias cardíacas, ictus• Cirugía mayor o trauma en los últimos tres meses |
DM1: diabetes mellitus tipo 1; IMC: índice de masa corporal; HTA: hipertensión arterial; SAHOS: síndrome de apnea-hipopnea obstructiva del sueño.
Tratamiento farmacológico de la obesidad
| Liraglutida | |
|---|---|
| PosologíaSaxenda® 6 mg/mL solución inyectable en pluma precargadaAl iniciar el tratamiento la dosis se debe aumentar semanalmente:1ª semana 0,6 mg/día; 2ª semana 1,2 mg/día; 3ª semana 1,8 mg/día; 4ª semana 2,4 mg/díaMantenimiento 3 mg/día | |
| Mecanismo de acciónAnálogo de GLP-1 | |
| Efectos clínicosPérdida de peso del 8% mantenido a tres añosDisminución progresión prediabetes a DM | |
| Efectos adversosNáuseas y vómitos | |
| ContraindicacionesEmbarazo y lactanciaNeoplasia endocrina múltiple (MEN-2)Carcinoma medular tiroidesEnfermedad renal avanzadaEnfermedad hepática avanzada | |
| Semaglutida | |
| PosologíaOzempic (Wegovy®) | |
| Escalado de la dosis | Dosis semanal |
| Semana 1 a 4 | 0,25 mg |
| Semana 5 a 8 | 0,5 mg |
| Semana 9 a 12 | 1 mg |
| Semana 13 a 16 | 1,7 mg |
| Dosis de mantenimiento | 2,4 mg |
| Mecanismo de acciónAnálogo de GLP-1 | |
| Efectos clínicosPérdida de peso del 14,9% a las 68 semanas | |
| Efectos adversosNáuseas y vómitos | |
| ContraindicacionesEmbarazo y lactanciaNo se recomienda en insuficiencia renal grave (TFGe <30 mL/min/1,73 m2), incluidos pacientes con enfermedad renal terminal.No se recomienda en insuficiencia hepática grave y se debe usar con precaución en pacientes con insuficiencia hepática leve o moderada. | |
| Orlistat | |
| PosologíaOrlistat 120 mg/2-3 veces día en las comidas principales (requiere prescripción médica)Orlistat 60 mg/2-3 veces día en las comidas principales (no requiere prescripción médica) | |
| Efectos clínicos↓ 37% progresión a DM2Dosis 120 mg/3 veces día ↓ 3,1% peso inicial al año↓ PAS, PAD, CT, cLDL | |
| Efectos adversos15-25% gastrointestinalesPuede ↓ absorción de vitaminas liposolublesNefrolitiasis por oxalatos (Orlistat ↑ niveles de oxalato en orina y debe usarse con precaución en pacientes con historia de nefrolitiasis por oxalatos) | |
| ContraindicacionesSíndrome de malabsorción crónicaColestasisEmbarazo, lactancia | |
| Naltrexona/Bupropión | |
| PosologíaNaltrexona/Bupropión 8 mg/90 mg comprimidos de liberación prolongadaAl iniciar el tratamiento, la dosis se debe aumentar durante 4 semanas:-Semana 1: un comprimido por la mañana-Semana 2: un comprimido por la mañana y otro por la noche-Semana 3: dos comprimidos por la mañana y uno por la noche-Semana 4 y posteriores: dos comprimidos por la mañana y dos por la nocheLa última dosis se recomienda que se tome por la tarde para evitar la aparición de insomnio si se ingiere a la hora de cenar. | |
| Efectos clínicos50% de los pacientes pierden ≥5% del peso | |
| Efectos adversosNáuseas | |
| ContraindicacionesEmbarazo y lactanciaHTA no controladaPacientes que padezcan en la actualidad trastornos convulsivos o presenten antecedentes de convulsionesNeoplasia conocida en el sistema nervioso centralSíndrome de abstinencia al alcohol o benzodiacepinasAntecedentes de trastorno bipolarCualquier tratamiento simultáneo que contenga bupropión o naltrexonaDiagnóstico actual o previo de bulimia o anorexia nerviosaDependencia a los opiáceos de administración prolongada o a los agonistas opiáceos (p. ej., metadona) o con un síndrome agudo de abstinencia a los opiáceosTratamiento simultáneo con inhibidores de la monoaminoxidasa (IMAO). Entre la interrupción de la administración de IMAO y el inicio del tratamiento con naltrexona/bupropión deben haber transcurrido un mínimo de 14 díasInsuficiencia hepática graveInsuficiencia renal terminal | |
cLDL: colesterol unido a lipoproteínas de baja densidad; CT: colesterol total; DM: diabetes mellitus; DM2: diabetes mellitus tipo 2; GLP-1: péptido similar al glucagón tipo 1; HTA: hipertensión arterial; PAS: presión arterial sistólica; PAD: presión arterial diastólica; TFGe: tasa de filtración glomerular estimada.
La intervención dietética tiene como principal objetivo reducir la ingesta. Diferentes patrones dietéticos son efectivos en la pérdida de peso. Los planes deben adaptarse a las características clínicas y preferencias del paciente (fig. 9). En general una dieta tipo mediterránea debe ser la base del tratamiento en nuestro medio.
Una reducción calórica diaria entre 500-1.000kcal puede producir una pérdida ponderal de entre 0,5 - 1kg/semana. Las reducciones de peso entre 7-10% producen beneficios para la salud y cambios metabólicos significativos.
Además, es importante prescribir ejercicio físico adecuado a cada paciente y el soporte psicológico con modificación de la conducta alimentaria.
El tratamiento farmacológico en la obesidad debe ser individualizado. La selección de los fármacos dependerá de la edad, presencia o no de DM y contraindicaciones (tabla 28).
El tratamiento quirúrgico de la obesidad se reserva para un grupo de pacientes tras el fracaso terapéutico de otras opciones conservadoras147. La cirugía bariátrica (tabla 29) está indicada en la obesidad mórbida o en obesidad grave con múltiples complicaciones no controladas médicamente y que han fracasado con otras estrategias terapéuticas. Es un tratamiento efectivo no exento de complicaciones. Las indicaciones y contraindicaciones quedan recogidas en la tabla 29.
Tratamiento quirúrgico de la obesidad
| Indicaciones y contraindicaciones | |
|---|---|
| Indicaciones de cirugía bariátrica | • IMC ≥40 kg/m2• IMC ≥35 kg/m2 con una o más comorbilidades graves:∘ DM2∘ HTA∘ Dislipemia∘ Trastornos respiratorios secundarios a obesidad∘ Hígado graso no alcohólico∘ Artrosis∘ Incontinencia urinaria |
| Requisitos | • Edad 18 a 60 años. En mayores se debe individualizar• Descartar endocrinopatías• Historia de obesidad mórbida de al menos cinco años• Respuesta inadecuada al tratamiento médico-nutricional• Fracaso o respuesta insuficiente del tratamiento médico–nutricional• Capacidad de adherencia a las recomendaciones y cambios en el estilo de vida posteriores a la cirugía• El paciente debe entender el tratamiento al que va a ser sometido y las consecuencias a largo plazo• Valoración psiquiátrica en caso de antecedente relevante o sospecha de enfermedad mental |
| Contraindicaciones | • Patología psiquiátrica grave: esquizofrenia, depresión mayor, retraso mental• Inestabilidad psiquiátrica• TCA• Abuso de alcohol u otras drogas |
DM2: diabetes mellitus tipo 2; HTA: hipertensión arterial; IMC: índice de masa corporal; TCA: trastorno de la conducta alimentaria.
En 2020, 22% de la población mundial era fumadora, incluyendo a 37% de los hombres y 8% de las mujeres. Cada año mueren en el mundo más de ocho millones de personas a causa del tabaco y de estos, 1,2 millones se deben al tabaquismo pasivo148. El tabaquismo es una adicción letal y la primera causa de mortalidad evitable, ya que duplica el riesgo de muerte por EVA y la multiplica por cinco en los menores de 50 años. Fumar tabaco favorece la formación y la rotura de las placas de ateroma; además, promueve la inflamación, la oxidación y la disfunción endotelial que predispone al espasmo arterial, a la trombosis y a la obstrucción vascular. El tabaco es perjudicial en todas sus formas, de una forma proporcional a la cantidad fumada149. Dejar de fumar es, entre todas las medidas preventivas, la más rentable en cuanto a la disminución del RV. El beneficio se observa en los primeros meses de la abstinencia. En España, en el periodo 2009 a 2012 la población fumadora disminuyó 3,13% y en el periodo 2009 a 2017 a 4,81%150. Sin embargo, el tabaco se sigue promocionando y una vez adquirido el hábito de fumar, su interrupción es compleja, ya que el número de intentos fallidos antes del abandono del tabaco oscila según distintos informes entre cinco y 14151. En todos los fumadores y en cualquier interacción con los profesionales sanitarios se debe aconsejar el abandono del tabaco, lo cual aumenta en más de 50% la probabilidad de que el paciente abandone el hábito. Se considera que una persona ha dejado de fumar cuando han transcurrido seis meses desde que se fumó el último cigarrillo.
En la tabla 30 se muestran las recomendaciones sobre las estrategias para tratar el tabaquismo contenidas en las guías europeas de prevención cardiovascular13.
Recomendaciones sobre las estrategias para tratar el tabaquismo
| Recomendación | Clase | Nivel |
|---|---|---|
| Cualquier consumo de tabaco debe ser interrumpido, dado que el uso de tabaco se asocia de forma intensa e independiente con el desarrollo de enfermedad vascular | I | A |
| Se debe ayudar a los fumadores a abandonar el tabaco, ofreciéndoles sustitutos de nicotina y fármacos (vareniclina y bupropión solos o en combinación), cuando sea necesario | IIa | A |
| El cese del tabaquismo es recomendable a pesar de la ganancia de peso, dado que dicha ganancia no reduce el beneficio vascular derivado de su abandono | I | B |
| Debe evitarse el tabaquismo pasivo | I | B |
Adaptado de Visseren, et al.13
Toda visita médica de control del RV debería incluir los siguientes apartados:
- •
Anamnesis sobre el hábito de fumar:
- ∘
¿Ha sido fumador en algún periodo de su vida (ha fumado con regularidad al menos un cigarrillo al mes)? (No/Sí)
- ∘
¿Cuántos cigarrillos fuma al día?
- ∘
Si ha dejado de fumar, ¿cuántos meses han transcurrido desde que lo dejó?
- ∘
¿Cuántos intentos serios de dejar de fumar ha realizado a lo largo de su vida?
- ∘
- •
Aconsejar con convencimiento de la necesidad de dejar de fumar. Información sobre los beneficios de dejar de fumar y las estrategias facilitadoras. También sobre el potencial incremento de peso (3 a 5kg de promedio) y su importancia menor a la del beneficio preventivo vascular y de mejora del estado de salud general.
- •
Valoración del grado de adicción mediante el test de Fagerström152 o mediante un cuestionario abreviado de solo dos preguntas153 (Anexo 7) para orientar sobre la necesidad de utilizar medidas farmacológicas y de sustitución de la nicotina. Cuanto menos tiempo transcurre desde que el paciente se despierta por la mañana hasta que se fuma el primer cigarrillo y cuanto mayor es el número de cigarrillos que fuma al día, mayor es la dependencia a la nicotina.
- •
Valoración de la actitud del paciente frente al tabaquismo. Se pueden realizar tres preguntas clave:
- ∘
¿Cree que el tabaco le perjudica?
- ∘
¿Le gustaría dejar de fumar?
- ∘
¿Cree que podrá dejarlo?
- ∘
- •
Si el paciente ha respondido afirmativamente a las tres preguntas anteriores, hay que asistirlo mediante una estrategia planificada, incluyendo la fijación de la fecha, terapia conductual/motivacional y apoyo farmacológico o de consultas de tabaco específicas. Si no lo ha hecho habrá que informarlo, motivarlo e insistir.
- •
Establecer un programa de seguimiento.
Además de las terapias mediadas por la comunicación en la visita médica, incluyendo el consejo y la entrevista motivacional, pueden utilizarse los sustitutos de nicotina y distintos fármacos154. Los sustitutos de nicotina, tanto en forma de chicles, parches, spray nasales o inhaladores, son eficaces y aumentan la probabilidad de abandono del tabaquismo4. Aunque el abandono del tabaquismo en los individuos que responden a la terapia de sustitución con nicotina suele producirse en las primeras cuatro semanas, prolongar el tratamiento hasta ocho a 12 semanas se asocia a una mayor probabilidad de remisión a largo plazo155. El bupropión es un antidepresivo sobre el que existe una amplia base de ensayos clínicos que han demostrado su eficacia para dejar de fumar, ya que incrementa en más de 50% las posibilidades de éxito. Su principal inconveniente es un riesgo pequeño (1/1.000) de convulsiones, sin aumentar el riesgo de EVA o enfermedad neuropsiquiátrica. El tratamiento puede prolongarse 12 semanas, si bien cabe prolongarlo hasta 52 semanas en los pacientes con alto riesgo de recurrencias. La vareniclina es un agonista parcial de los receptores de la nicotina sobre el que también existe una amplia base de ensayos clínicos que han demostrado que su uso incrementa en más de dos veces la probabilidad de abandonar el tabaco con éxito. Su principal efecto secundario es la aparición de náuseas, que puede mitigarse con un aumento progresivo de las dosis y evitando las dosis más altas156. Sin embargo, en julio de 2021 la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) recomendó que no se iniciasen nuevos tratamientos con este fármaco, ya que se había detectado una impureza en los comprimidos de vareniclina que obligó a retirar tres lotes de este medicamento, y, por ello, no se podía garantizar a los pacientes su continuidad. La citisina es un alcaloide vegetal que, como la vareniclina, es un agonista parcial de los receptores de la nicotina, que median la dependencia a la nicotina a través de la liberación de dopamina y disminuye los síntomas de la abstinencia tabáquica y también el grado de satisfacción asociado al fumar157. Su eficacia para lograr el abandono del tabaco podría ser algo inferior que la de la vareniclina, pero con una tolerancia algo superior158. La citisina tiene una pauta posológica compleja y su prescripción está restringida a facultativos vinculados a programas de deshabituación tabáquica. Está contraindicada en los pacientes con episodios isquémicos recientes, arritmias con relevancia clínica, embarazo y lactancia. Los futuros ensayos clínicos deberán evaluar la eficacia de la citisina en comparación con la vareniclina y otros fármacos, y también las pautas posológicas más adecuadas.
Existe todavía una información insuficiente sobre el uso de cigarrillos electrónicos y los productos de calentamiento de tabaco. El uso de estos últimos se está incrementando159, por encima del uso de los cigarrillos electrónicos, y en ello parece haber influido la aprobación, en 2020, de la Food and Drug Administration (FDA) de EE. UU. como un producto del tabaco de riesgo modificado160. Sin embargo, se ha observado que cambiar del tabaco convencional de combustión a los productos de nicotina o tabaco sin combustión disminuye de forma significativa el riesgo vascular, si bien supone aún un alto riesgo en comparación con el abandono del tabaco161. Quedan todavía muchas cuestiones por resolver sobre los cigarrillos electrónicos y los productos de tabaco calentado y entre ellas, la más importante, sus efectos sobre la salud a largo plazo.
Paciente con fibrilación auricularLa FA es la arritmia más frecuente, afectando a más de 40 millones de personas en el mundo162. Debido al aumento de la longevidad y a la intensificación en el diagnóstico, se estima que su prevalencia global será de 15,9 millones en el año 2050, siendo más de la mitad de ellos pacientes ≥ 80 años163. La prevalencia de la FA depende de las características de la población relacionadas con la edad, el sexo, la raza y la zona geográfica.
Edad y sexo. La franja etaria en la que más prevalencia de FA se observa es en pacientes mayores de 75 años, siendo de 9%, duplicándose (hasta 18%) en mayores de 85 años164,165. En pacientes entre 55 y 75 años la prevalencia oscila entre 1 y 6% mientras que en pacientes menores a 55 años es de 0,1%165. La prevalencia es similar en ambos sexos, pero algo superior en los hombres (1,1 vs. 0,8%)165.
Raza, etnia y zona geográfica. Los adultos de raza negra y los hispanos tienen un riesgo más bajo de FA que los blancos no hispanos166. Esta diferencia se acentúa en edades más avanzadas. Los países desarrollados presentan una prevalencia mayor de FA en comparación con los países en desarrollo, siendo las más altas en Norteamérica y las más bajas en Asia y África subsahariana162.
Factores de riesgo que facilitan la aparición o recurrencia de la fibrilación auricularEl riesgo de la FA a lo largo de la vida aumenta con el incremento de la carga de FRV. Identificarlos, prevenirlos y tratarlos es clave para reducir la prevalencia de la FA y su carga de morbilidad.
Hipertensión arterialUna PA alta e incontrolada puede modificar la estructura de la pared miocárdica, favoreciendo el desarrollo de una FA e incrementando la posibilidad de hacerla recurrente. El riesgo relativo que tienen los pacientes hipertensos de presentar FA es de 1,50 con respecto a los normotensos167. Por otra parte, la HTA aumenta el riesgo de ACV lacunar y hemorrágico. Por lo tanto, el control de la PA debería ser una parte integral del tratamiento de pacientes con FA167.
Diabetes mellitusAunque se conoce la influencia de la DM en el remodelado miocárdico y su predisposición al desarrollo de una FA, el control glucémico intensivo no disminuye la tasa de FA de nueva aparición. Aquellos pacientes con diabetes y mayor variabilidad glucémica presentan un riesgo relativo de 1,2 de desarrollar FA168. Por el contrario, una DM de larga evolución predispone a un mayor riesgo de ACV y de fenómenos tromboembólicos en pacientes con FA. No obstante, el tratamiento con metformina en pacientes con DM parece estar asociado con un menor riesgo a largo plazo de FA169. En este sentido, pese a que los estudios con iSGLT2 han demostrado una reducción del volumen auricular izquierdo, hay datos contradictorios sobre si reducen la incidencia de FA170.
Obesidad y síndrome metabólicoLa obesidad incrementa la probabilidad de desarrollar una FA de forma paralela al aumento del IMC171. Este hecho puede ser debido al aumento de la presión y volumen de la aurícula izquierda. La reducción ponderal, del orden de 10-15kg, disminuye la recurrencia de la FA171. Asimismo, la mejora de la capacidad cardiorrespiratoria puede reducir aún más la carga de FA en los pacientes obesos con FA172. El SM incluye la presencia de HTA, DM y obesidad, entidades que como hemos visto se relacionan con la presencia de FA, por lo que la unión de éstas acentúa el riesgo173.
Insuficiencia cardiacaLa prevalencia de FA en pacientes con IC es ligeramente superior en aquellos con fracción de eyección ventricular izquierda (FEVI) deprimida con respecto a preservada (46 vs. 34%)174.
Síndrome de la apnea-hipopnea obstructiva del sueñoLa remodelación auricular secundaria a la hipoxia relacionada con el SAHOS impulsa la fibrosis y enlentecimiento de la conducción, lo que conlleva a una mayor prevalencia de FA175. El riesgo de FA en estos pacientes aumenta según la gravedad del síndrome de SAHOS176. En aquellos pacientes tratados con ventilación mecánica la incidencia y recurrencia de FA es menor.
Enfermedad renal crónicaLa incidencia de FA es más frecuente en pacientes con microalbuminuria y/o filtrado glomerular (FG) inferior a 60mL/min/1,73 m2, siendo mayor en aquellos en estadios terminales o diálisis, provocando estos últimos mayor mortalidad y eventos tromboembólicos177.
Diagnóstico de la fibrilación auricular y estrategias de cribadoEl diagnóstico de FA se realiza al objetivar irregularidad en los intervalos RR con ausencia de ondas P durante al menos 30 segundos en un ECG. Se distinguen cinco patrones temporales basados en la presentación, duración y la resolución espontánea de los episodios de FA:
- •
FA diagnosticada por primera vez.
- •
FA paroxística: aquella que revierte espontáneamente/con intervención en <7 días.
- •
FA persistente: se mantiene durante >7 días.
- •
FA persistente de larga duración: continúa >1 año tras adoptar una estrategia de control de ritmo.
- •
FA permanente: aquella FA asumida por paciente y médico, no adoptándose nuevas médicas para restaurar o mantener el ritmo sinusal.
La recurrencia de FA tras un primer episodio cardiovertido se encuentra en alrededor del 70%, influyendo varios factores como la disfunción del ventrículo izquierdo y el diámetro de la aurícula izquierda, y su progresión a FA persistente es 8 a 25% durante el primer y quinto año178,179. Los términos «FA aislada» (en cada paciente existe una causa para FA), «FA valvular/no valvular» (puede crear confusión) y «FA crónica» (definición contradictoria) se encuentran en desuso180. Según su componente clínico, la FA puede ser sintomática, asintomática u oculta (que se hace evidente tras un evento agudo o realización de ECG).
Control integral del paciente con fibrilación auricularEl manejo integral del paciente con FA incluye la información, la educación y el autocuidado del paciente, así como el control de los FRV. Para ello, podemos usar la vía CC to ABC (Atrial Fibrillation Better Care). Tras confirmar la FA mediante ECG, se ha propuesto la caracterización mediante el esquema 4S-AF, en el que se estratifica según el riesgo de ictus (mediante el CHA2DS2-VASc), gravedad de los síntomas (asintomática, leve, moderada, grave), carga de FA (según el patrón temporal) y gravedad del sustrato. Posteriormente seguiremos el ABC donde valoraremos la anticoagulación (A), control de los síntomas (B) y las comorbilidades (C)180. No obstante, hay situaciones que requieren que un paciente con FA sea derivado a un servicio de urgencias hospitalario especializado, como son la inestabilidad hemodinámica, la FC elevada e incontrolable, la bradicardia sintomática, la angina severa, la disnea intensa e irreversible o la presencia de AIT o ACV.
CribadoLa FA clínica asintomática se ha asociado de forma independiente con un mayor riesgo de ACV y mortalidad en comparación con la FA sintomática, por lo que se recomienda la realización de cribado a pacientes con HTA, AOS, IC o mayores de 65 años mediante la palpación de pulso o ECG de 12 derivaciones180. Pese a que el ECG reglado es considerado el método de diagnóstico convencional, en los últimos años se ha subrayado el papel de las nuevas tecnologías, como las aplicaciones móviles y los relojes inteligentes. Diferentes estudios como el Apple Heart y el Huawei Heart describieron una alta capacidad para describir episodios autolimitados de FA181,182. Para la evaluación inicial y el tratamiento de todos los pacientes con FA se recomienda la realización de ecocardiografía transtorácica, donde podemos evaluar la función y estructura cardiaca.
Prevención y medidas no farmacológicasLa reducción intensa de peso con un control integral de los FRV concomitantes resulta en menos recurrencias y síntomas de FA. El consumo excesivo de alcohol es un factor de riesgo de FA y sangrado en pacientes anticoagulados mientras que la abstinencia de alcohol reduce la recurrencia en bebedores habituales con FA183. El consumo habitual de cafeína podría estar asociado con un menor riesgo de FA, pero la ingesta de cafeína puede aumentar los síntomas de palpitaciones no relacionadas con la FA. El ejercicio físico (> 150min a la semana de ejercicio moderado o >75min de ejercicio vigoroso) ha demostrado beneficios vasculares. Si bien es cierto que la incidencia de FA parece estar aumentada en los atletas de elite, se debe aconsejar a los pacientes la realización de ejercicios de intensidad moderada para prevenir la incidencia o recurrencia de FA, evitando ejercicios de resistencia excesivo (maratones o triatlones) especialmente en mayores de 50 años184.
Control del ritmo o de la frecuencia cardiaca. Fármacos antiarrítmicos, ablación por catéter y cirugía de la fibrilación auricularLa terapia temprana de control del ritmo se asocia a un menor riesgo de eventos en pacientes con FA temprana y en aquellos pacientes con riesgo elevado185, mientras que en la FA de larga duración el control de frecuencia es la terapia más recomendada186. Tanto las estrategias de control de la frecuencia como las de control del ritmo tienen como objetivo aliviar las consecuencias fisiopatológicas de la FA y los síntomas. En aquellos pacientes con FA de nueva aparición se puede observar una restauración espontánea en alrededor de 75% durante las primeras 24-48 horas, por lo que no iniciar tratamiento durante las primeras 24 horas en aquellos pacientes hemodinámicamente estables sin síntomas puede ser una alternativa. La elección de la terapia de control de ritmo dependerá de las características del paciente, los síntomas y la FEVI.
Mientras que en pacientes inestables optamos por la cardioversión eléctrica, en aquellos estables el tratamiento dependerá del tiempo de aparición (mayor o menor a 48 horas) o la anticoagulación previa, debiendo discutir la posible posibilidad de cardioversión eléctrica con el paciente si esta fuese posible (en tratamiento anticoagulante, en los que se haya descartado la presencia de trombo en la aurícula y la orejuela izquierdas o con duración menor a 48 horas).
Control de la frecuenciaEl objetivo de frecuencia cardiaca (FC) establecido para los pacientes con FA es de <100 lpm.
- •
Betabloqueantes: son los fármacos de primera línea para el control de frecuencia debido a su rápido efecto, sobre todo en aquellos pacientes con FEVI deprimida, aumento inapropiado de la frecuencia ventricular durante el ejercicio e infarto reciente.
- •
Calcioantagonistas no dihidropiridínicos: son una alternativa eficaz en ausencia de IC con FEVI deprimida. Al igual que los betabloqueantes son eficaces reduciendo la frecuencia tanto en reposo como en ejercicio.
- •
Digoxina: debe ser usada con precaución debido a su posible asociación con un aumento de mortalidad concentración dependiente187.
- •
Amiodarona: Es útil en combinación tras el fracaso de la terapia previa, debiendo evitarse en aquellos con patología tiroidea.
Se recomienda el tratamiento para el control del ritmo con objetivo de mejorar los síntomas y calidad de vida en pacientes sintomáticos con FA180. Mientras que la cardioversión eléctrica directa sincronizada es el método preferido para pacientes con FA y deterioro hemodinámico, en pacientes estables su uso y el de la cardioversión farmacológica es indistinto.
- •
Flecainida y propafenona (clase Ic): están indicadas en pacientes sin cardiopatía isquémica (CI), hipertrofia o disfunción sistólica del ventrículo izquierdo y deben usarse con precaución debido a su efecto proarritmogénico (menor con propafenona) y bradicárdico. Su efecto es rápido (trea a cinco horas) en más de 50% de los casos. El uso de «la pastilla de bolsillo» con flecainida o propafenona es seguro y recomendado en aquellos pacientes con FA paroxística tras entrenamiento188.
- •
Amiodarona: la elección de amiodarona intravenosa se realiza en pacientes con IC con FEVI deprimida, siendo el fármaco que asocia una menor tasa de recurrencias, pero disponiendo de un efecto cardioversor tardío (ocho a 12 horas) y menor que otros antiarrítmicos189. Debemos tener precaución si se asocia a otro fármaco que prolongue el QT e interrumpirse cuando este sea >500ms. El vernakalant intravenoso posee un efecto cardioversor más rápido que la amiodarona (una hora)180. No debe usarse en pacientes hipotensos, con CI reciente, IC en clase funcional III - IV, estenosis aortica grave o prolongación de QT.
- •
Dronederona: pese a que puede ser un fármaco utilizado para el control de ritmo no debe usarse en pacientes con IC reciente descompensada, clase funcional III - IV de la NYHA, FA permanente, ni en concomitancia con dabigatran u otros fármacos que prolonguen el QT190.
- •
Sotalol: es útil ante la prevención de recurrencias, estando contraindicado en HVI, IC con FEVI deprimida, hipopotasemia y alargamiento del QT por su riesgo de arritmias ventriculares y torsades de pointes. La dronederona y el sotalol no deben administrarse con aclaramientos de creatinina inferiores a 30mL/min.
Del mismo modo, se puede emplear la cirugía para el control del ritmo. Esta se basa en la creación de cicatrices de aislamiento en las aurículas con el propósito de evitar los fenómenos de reentrada que inician y perpetúan la arritmia, permitiendo la reconducción del estímulo normal desde el nodo sinusal hasta el nodo auriculoventricular. Las técnicas actuales, basadas en dispositivos de transmisión de energía, permiten realizarla mediante toracoscopia con incisión mínima. En algunos estudios se muestra más efectiva que la ablación por catéter, aunque con mayor probabilidad de efectos secundarios y, en ocasiones, precisa de la implantación posterior de un marcapasos191. En la FA persistente sintomática podría indicarse la cirugía si la ablación por catéter ha fallado. También puede considerarse su empleo en pacientes con FA que vayan a ser sometidos a cirugía cardiaca.
Tratamiento anticoagulante para la prevención del ictusLa anticoagulación es el tratamiento de elección para la prevención del ictus isquémico, teniendo en cuenta que el riesgo es similar en la FA persistente y en la paroxística180,192. Clásicamente los fármacos antivitamina K (AVK), en un rango de international normalized ratio (INR) de 2-3, han sido los de elección, ya que producen una reducción en la tasa de ictus del 60-80%. La indicación de anticoagulación oral viene establecida por modelos pronósticos que han incorporado la edad y comorbilidades del paciente, siendo la escala más utilizada Congestive Heart Failure, Hypertension, Age, Diabetes, Previous Stroke (CHA2DS2-VASc) (tabla 31), de tal forma que los pacientes con una puntuación de 0 (1 en caso de mujeres) no precisan de terapia anticoagulante oral. La anticoagulación estaría indicada en varones con CHA2DS2-VASc ≥ 1 o mujeres ≥ 2. Esta recomendación se aplica a pacientes con FA no valvular, siempre que no exista un riesgo elevado de complicaciones hemorrágicas, estimado según la escala Hypertension, Abnormal renal/liver function, Stroke, Bleeding history or predisposition, international normalized ratio, Elderly (> 65 years), Drugs/alcohol concomitantly, Hipertensión, Función renal/hepática anormal, Accidente cerebrovascular, Antecedentes o predisposición a hemorragias, Índice internacional normalizado, Ancianos (> 65 años), Fármacos/alcohol concomitantes (HAS-BLED) (tabla 32).
Escala de riesgo trombótico CHADS2-VASc en fibrilación auricular
| FRV | Valor ponderal |
|---|---|
| IC congestiva | 1 |
| Hipertensión | 1 |
| Edad ≥75 años | 2 |
| DM | 1 |
| Ictus/AIT/embolismo periférico previo | 2 |
| Enfermedad vascular (arteriopatía periférica, CI, placa aórtica) | 1 |
| Edad entre 65 y 74 años | 1 |
| Sexo femenino | 1 |
| Puntuación máxima | 9 |
Interpretación: Bajo riesgo=0; Riesgo moderado=1; Riesgo alto ≥2
AIT: accidente isquémico transitorio; CHADS2-VASc: Congestive Heart Failure, Hypertension, Age, Diabetes, Previous Stroke; CI: cardiopatía isquémica; FA: fibrilación auricular FRV: factores de riesgo; IC: insuficiencia cardiaca.
Escala HAS-BLED de riesgo hemorrágico en fibrilación auricular
| FRV | Valor ponderal |
|---|---|
| Hipertensión, PA mal controlada | 1 |
| Función renal/hepática anormal | 1 o 2 |
| Ictus | 1 |
| Tendencia o predisposición al sangrado | 1 |
| INR inestable | 1 |
| Edad avanzada (>65 años, condición frágil) | 1 |
| Medicamentos (aspirina o AINE), o consumo excesivo de alcohol | 1 o 2 |
| Puntuación máxima | 9 |
AINE: antiinflamatorio no esteroideos FA: fibrilación auricular; FRV: factores de riesgo vascular; HAS-BLED: Hypertension, Abnormal renal/liver function, Stroke, Bleeding history or predisposition, Labile international normalized ratio, Elderly (>65 years), Drugs/alcohol concomitantly; INR: International Normalized Ratio; PA: presión arterial.
En la última década, se han realizado cuatro grandes estudios aleatorizados con anticoagulantes orales de acción directa (ACOD): dabigatrán (RELY), rivaroxabán (ROCKET-AF), apixabán (ARISTOTLE) y edoxabán (ENGAGE-AF) así como metaanálisis, que han demostrado una eficacia igual o superior a la de los AVK, con menor incidencia de complicaciones hemorrágicas, especialmente hemorragia intracraneal, por lo que en la actualidad constituyen la alternativa de elección en el tratamiento inicial de la FA (fig. 10)193. Los estudios en «vida real» confirman, asimismo, un menor riesgo hemorrágico de los ACOD en comparación con los AVK194. Además, los ACOD, en combinación con monoterapia antiagregante, pueden ser una alternativa segura y eficaz a la triple terapia en pacientes con FA sometidos a intervencionismo coronario percutáneo195. Por todo ello, las guías clínicas y metaanálisis más recientes consideran los ACOD como la opción preferente para la prevención del ictus en pacientes con FA180,192,196.
Algoritmo para el tratamiento antitrombótico en la fibrilación auricular.
ACOD: anticoagulantes orales de acción directa; AVK: antivitamina K; CHA2DS2-VASc: Congestive Heart Failure, Hypertension, Age, Diabetes, Previous Stroke; HAS-BLED: Hypertension, Abnormal renal/liver function, Stroke, Bleeding history or predisposition, international normalized ratio, Elderly (> 65 years), Drugs/alcohol concomitantly.
Aunque las guías europeas sitúan a los ACOD por encima de los AVK, su utilización está restringida en nuestro país. Según un informe de posicionamiento terapéutico, solo se autoriza el uso de estos fármacos, en términos generales, en los pacientes con mal control terapéutico, con antecedentes de hemorragia intracraneal o con riesgo de ella197.
En todo caso, es importante involucrar al paciente en el proceso de decisión sobre las diferentes opciones de anticoagulación y considerar la polimedicación y comorbilidades que pueden favorecer la aparición de hemorragias. Es siempre importante tener en cuenta la edad, fragilidad, peso y función renal, ya que pueden influir en la elección del tipo de anticoagulante y su dosis.
Anticoagulación en pacientes que requieren cardioversiónEs importante iniciar precozmente la anticoagulación de los pacientes programados para cardioversión, dado que este procedimiento está asociado con el riesgo de tromboembolismo. Los pacientes que se han mantenido en FA durante más de 48 horas deben comenzar la anticoagulación al menos 3 semanas antes de la cardioversión, y después, continuar durante cuatro semanas (siempre que no requieran anticoagulación indefinida). Las directrices actuales recomiendan una anticoagulación adecuada con un AVK o con dabigatrán (tanto antes como después del procedimiento). Otros ACOD están siendo estudiados en ensayos clínicos prospectivos198.
Organización y funcionamiento de la consulta de riesgo vascular: profesionales y dispositivos. Criterios de calidadEn los últimos años diferentes e importantes estudios a nivel nacional e internacional han confirmado un deficiente control global de los FRV incluso en prevención secundaria tanto en pacientes coronarios como con ictus o EAP199–206. Ello puede atribuirse a diversos factores, entre los que cabe destacar la deficiente adherencia al tratamiento, la inercia terapéutica y también los modelos organizativos que, en general, se muestran poco capaces de mejorar estos resultados.
El control multidisciplinar del RV tiene unas claras ventajas207:
- •
Homogeneizar entre los diferentes niveles asistenciales el abordaje y el tratamiento de los FRV, y así dar continuidad asistencial en la prevención vascular.
- •
Mejorar la detección de todos los FRV en pacientes de alto RV que facilite la intervención terapéutica más adecuada y precoz para cada paciente.
- •
Optimizar los recursos sanitarios, evitando duplicidades de visitas y exploraciones complementarias.
- •
Definir y consensuar criterios de derivación, para generar un flujo bidireccional que facilite, en la mayoría de los casos, el retorno del paciente a la atención primaria tras efectuar las evaluaciones e intervenciones que requirieron la derivación a la atención especializada. Así se garantiza que esta información llegue al médico de atención primaria y que el paciente reciba mensajes sanitarios unificados desde ambos niveles asistenciales.
- •
Promover la docencia e investigación en RV.
Una consulta de RV, como una unidad organizativa dentro del ámbito de atención programada, precisa de:
- •
Profesionales de distintas especialidades (Medicina Interna, Endocrinología, Cardiología, Nefrología, Neurología, Endocrinología, Bioquímica Clínica), en coordinación con otros profesionales del ámbito de Atención Primaria (Medicina de Familia, Enfermería, Nutricionistas) y de otros profesionales como Unidades de Deshabituación tabáquica o profesionales de salud mental, para facilitar la implementación de estrategias globales de prevención vascular.
- •
Protocolos unificados basados en las guías de práctica clínica para el control global de los principales FRV.
- •
Unos requisitos estructurales básicos208. Ello incluye la posibilidad de realizar una adecuada medida de la PA con dispositivos validados (tabla 33).
Tabla 33.Recursos de una consulta hospitalaria para el control global de los principales factores de riesgo vascular
Arquitectura Recursos materiales Recursos informáticos Consulta para cada profesional sanitario y por turno de trabajoEspacio para enfermería para la medida de la PA, educación sanitaria y revisión de la adherencia al tratamiento.Sistema de climatización en el centro y los consultorios Mobiliario completo en la consulta: mesa de despacho y camilla de exploraciónFonendoscopio, oftalmoscopio, linterna, báscula, tallímetro y cinta métricaDispositivos de medida de la PA validados211Aconsejable disponer de:• Dispositivo de medida de PA semiautomático para que de forma programada se puedan hacer varias medidas automáticas (en general 3) sin presencia de observador. Se aconseja que en la primera visita las tres medidas automáticas se hagan de forma simultánea en ambos brazos• Acceso a la MAPA• Doppler portátil para la determinación del ITB• Electrocardiógrafo Historia clínica, digital o no, según modelo del servicio de salud, accesible al área sanitaria de referenciaAcceso online a escalas de riesgo y cuestionariosPrescripción electrónica, según modelo del servicio de saludPosibilidad de consulta online por Atención Primaria ITB: índice tobillo-brazo; MAPA: monitorización ambulatoria de la presión arterial PA: presión arterial.
Adaptado de Felip Benach A.208
Como herramienta básica para medir la calidad asistencial se han de establecer unos indicadores (tabla 34) que permitan detectar los aspectos de posible mejora para optimizar el control global de los FRV, y que han de ser utilizados como un sistema de autoevaluación209.
Indicadores para medir la calidad asistencial en el control global del paciente con alto riesgo vascular
| Indicadores | ||
|---|---|---|
| Estructura o actividad | Proceso o calidad | Resultado |
| • Número total de pacientes derivados a consulta de RV• Número de sesiones del equipo de RV• Número de sesiones de consultoría realizadas con Atención Primaria• Número de visitas telemáticas realizadas por los integrantes de la consulta de RV Consulta virtual, sesiones de consultoría, telemedicina• Producción científica: comunicaciones y publicaciones compartidas por varios miembros del grupo | • Número derivaciones a consulta de RV que cumplen criterios derivación previamente definidos y consensuados/número total de derivaciones• Número pacientes con primera visita en la consulta de RV con tiempo de respuesta dentro de márgenes establecidos/número total de primeras visitas• Número pacientes visitados con codificación de diagnósticos (según CIE-10/número total de pacientes visitados)• Número de pacientes en prevención primaria y no DM que tienen estimado su riesgo por alguna escala/número total de pacientes en prevención primaria y no DM atendidos en la consulta de RV | • Número pacientes visitados que cumplen objetivos de control de FRV según su categoría de riesgo/número total de pacientes visitados• Adecuación consumo de recursos (exploraciones complementarias)/número total de pacientes visitados• Número episodios de consulta de RV cerrados por alta a Atención Primaria con informe asistencia consensuado/número altas consulta de RV |
CIE-10: Clasificación Internacional de Enfermedades, 10ª revisión; DM: diabetes mellitus; FRV: factores de riesgo vascular; RCV: riesgo cardiovascular.
Adaptado de Armario P, et al.207
Las consultas donde se atiende a pacientes de RV deben adecuarse al sistema organizativo del servicio de salud correspondiente, público o privado. La incorporación en los últimos años de elementos como la digitalización de las historias clínicas, con la posibilidad de añadir indicadores y extraer información, la prescripción electrónica que facilita conocer el grado de adherencia al tratamiento, y las opciones de telemedicina (tanto para la interacción entre paciente-médico como médico-médico) pueden facilitar el acceso a la información clínica del paciente y al mejor control de los FRV.
En este sentido, la creación de alertas en los laboratorios clínicos, también pueden contribuir a mejorar la detección, tratamiento y seguimiento de determinados FRV (dislipemia, DM) desde Atención Primaria, así como facilitar el contacto efectivo entre profesionales de Atención Primaria y Hospitalaria, mediante teleconsultas basadas en criterios de derivación consensuados210.
La pandemia por COVID-19ha provocado cambios sustanciales en la atención médica, entre los que se incluyen un creciente protagonismo de las consultas telemática, que han aquedado incorporadas junto a las presenciales en múltiples ámbitos asistenciales. En las consultas de RV se han propuesto criterios para la elección de consultas presenciales o telemáticas como los descritos en la tablas 34 y 35. Para facilitar el diagnóstico y manejo de las dislipemias mediante e-consultas en las unidades de RV se ha propuesto igualmente cuales deben ser los parámetros mínimos necesarios12.
Criterios de elección del tipo de consulta
| Preferencia consulta presencial | Preferencia consulta telemática |
|---|---|
| Sospecha de problemas potencialmente graves o urgentes, tener que dar malas noticias. Cambios clínicos, descompensación o empeoramiento del paciente, necesidad de entrevista con acompañantes, primera visita | Situación clínica estable |
| Dificultades en la comunicación con el paciente(idioma, hipoacusia, problemas cognitivos) | Sin dificultades en la comunicación |
| Requiere exploración física | No requiere exploración física |
| Requiere adiestramiento en autoexamen físico:• Peso• Medida de PA• AMPA | Está adiestrado en autoexamen físico |
| Requiere pruebas complementarias a corto plazo:• Analítica• ECG• Radiología• Índice tobillo-brazo• VOP• MAPA | Requiere pruebas complementarias a medio o largo plazo (gestionar las peticiones vía administrativa) |
| Requiere adiestramiento en educación sanitaria más personalizada o cambios de tratamientos importanteso titulación de los mismos. | No va a requerir, a priori, cambios de tratamiento |
| ECV descontrolada | No ECV o en situación estable |
| Presencia de múltiples comorbilidades | No comorbilidades importantes |
AMPA: automedida de la presión arterial; ECG: electrocardiograma; ECV: enfermedad cardiovascular; MAPA: Monitorización Ambulatoria de la Presión Arterial; PA: presión arterial; VOP: velocidad onda del pulso.
Adaptado de Gijón-Conde T, et al.212
Los pacientes con RV elevado son remitidos a consultas por norma general para el control de alguno de los FRV, fundamentalmente la HTA, la DM y la dislipemia, ya sea en el ámbito de la prevención primaria o en el de la secundaria. En este sentido, es frecuente que se deriven a las consultas de RV pacientes con EVA establecida (coronaria, cerebrovascular o arterial periférica), a veces jóvenes, en los que no se identifican FRV (para el estudio diagnóstico de trombofilia); o bien que desconocían o no controlaban adecuadamente los FRV detectados durante la valoración hospitalaria.
No es habitual recibir pacientes para deshabituación tabáquica, aun siendo este un FRV mayor; esta tarea suele recaer en unidades especializadas de Neumología o de AP. En cualquier caso, cada Servicio Público de Salud suele establecer sus propios criterios de derivación a unidades especializadas, en función de sus propias agendas, de la disponibilidad de recursos y del nivel asistencial (hospitales comarcales frente a hospitales de referencia de tercer nivel).
Las principales causas de derivación para pacientes con DM quedan reflejadas en la tabla 36. Los criterios de derivación para pacientes con HTA según la guía práctica de la Sociedad Española de Hipertensión - Liga Española para la Lucha contra la Hipertensión Arterial (SEH-LELHA) publicada en 2022 son los siguientes213:
- •
Sospecha de HTA secundaria.
- •
Edad de comienzo <40 años con HTA grado 2-3 (PAS ≥ 160mmHg o PAD ≥ 100mmHg).
- •
Crisis hipertensivas repetidas en pacientes con PA previa normal o con HTA bien controlada.
- •
Indicación de estudios complementarios no disponibles en Atención Primaria, particularmente indicación de exploraciones vasculares avanzadas que puedan influir en decisiones terapéuticas.
- •
HTA resistente (HTA no controlada con tres fármacos de acción complementaria en dosis adecuadas, uno de ellos un diurético), especialmente después de descartar pseudo-resistencia por fenómeno de bata blanca con MAPA y de descartar falta de adherencia al tratamiento no farmacológico o farmacológico.
- •
HTA de difícil control en relación con intolerancias medicamentosas múltiples, contraindicaciones múltiples, falta constante de cumplimiento o variabilidad extrema de cifras de PA.
Causas de derivación de pacientes con diabetes mellitus
| Diabetes melllitus |
|---|
| • DM1• DM gestacional.• Diabetes no filiada correctamente• Mal control glucémico, diabetes inestable, hipoglucemias• Comorbilidades (p. ej., obesidad mórbida)• Enfermedad microvascular grave (polineuropatía pie diabético, IRC, retinopatía avanzada) |
DM: diabetes mellitus; DM1: diabetes mellitus tipo 1; IRC: insuficiencia renal crónica.
La SEA ha publicado los criterios de derivación de pacientes con dislipemia a sus unidades de lípidos (tabla 37)214.
Criterios de derivación a unidades de lípidos de la Sociedad Española de Aterosclerosis
| Dislipemia | Dinteles | Contexto clínico | Diagnóstico | Tratamiento |
|---|---|---|---|---|
| Hipercolesterolemia | CT >300 mg/dLcLDL >200 mg/dLLp(a) >50 mg/dL | Xantomas tendinososArco corneal <45 añosAF +++CI o EAP prematuraCI recurrenteEnfermedad vascular sin FRV evidentesSospecha de HFEsteatosis y/o cirrosis | Cribado en cascada de HFTest genéticosTécnicas de imagen para detectar EVS | Triple terapiaNuevos tratamientos (iPCSK9)Intolerancia farmacológicaRefractariedad al tratamientoAféresis |
| Hipertrigliceridemia | TG en ayunas >1000 mg/dLTG >500 mg/dL pese a tratamientoHipertrigliceridemia y CT >350 mg/dL | XantomasHepatomegaliaEsplenomegaliaLipemia retinalisDebut en la infanciaPancreatitis | Análisis de causas secundariasTest bioquímicosDiagnóstico molecular | Excluir causa secundariaTratamiento ineficazDietas especiales |
| cHDL | cHDL <20 mg/dLcHDL >100 mg/dL | HepatomegaliaEsplenomegaliaHipertrofia amigdalarOpacidad cornealInsuficiencia renal | Excluir causas secundariasTest bioquímicosDiagnóstico molecular | Control causas secundarias |
| Hipocolesterolemia | cLDL <50 mg/dL sin tratamiento | MalabsorciónEsteatosis | Excluir causas secundariasTests bioquímicosDiagnóstico molecular |
AF: antecedentes familiares; cHDL: colesterol unido a lipoproteínas de alta densidad; CI: cardiopatía isquémica; cLDL: colestero unido a lipoproteínas de baja densidad; CT: colesterol total; EAP: enfermedad arterial periférica; EVS: enfermedad vascular subclínica; HF: hipercolesterolemia familiar; Lp(a): lipoproteína (a); iPCSK9: inhibidor de proproteina convertasa subtilisina/kexina tipo 9 TG: triglicéridos. +++ Positivos.
Adaptado de Sánchez-Chaparro MA, et al.214
En el contexto del RV, el principal tipo de DM a considerar es la de tipo 2, asociada con la dislipemia, obesidad, HTA y SM; por ello, la causa más habitual va a ser la falta de un control glucémico adecuado, a pesar de que en los últimos años el arsenal terapéutico en el campo de la DM2 es enorme215,216.
En el caso de la HTA, en nuestro país el motivo más común de remitir pacientes a una unidad de HTA es descartar la causa de HTA secundaria, seguido de mal control terapéutico e HTA resistente174, definiendo esta última como la incapacidad de controlar la PA (< 140 / 90mmHg) pese a tres fármacos, uno de ellos un diurético7.
Para el caso de la dislipemia, las causas más comunes de remitir a los pacientes son el mal control en los niveles de colesterol o TG séricos, el tratamiento y diagnóstico de la HF, los efectos adversos de la medicación, en especial la intolerancia a las estatinas (fundamentalmente por toxicidad muscular) o la necesidad de tratamientos combinados, especialmente con iPCSK9214.
Criterios de alta del paciente con riesgo vascularEs obvio que, una vez alcanzado el diagnóstico definitivo y controlado el FRV que motivó la consulta, los pacientes deben ser remitidos desde la unidad especializada para su seguimiento por atención primaria. Sin embargo, no es infrecuente que los pacientes sean revisados en las consultas por diversos motivos; entre otros, no alcanzar los objetivos terapéuticos, la necesidad de procedimientos no convencionales (cirugía bariátrica, aféresis de cLDL o perfusión en hospitales de día de terapia lisosomal sustitutiva), la necesidad de prescribir y dispensar determinados fármacos por la farmacia hospitalaria (como es el caso de los fármacos iPCSK9), la polimedicación con elevado riesgo de interacciones farmacológicas (p. EJ., en sujetos con infección por VIH y trasplantados) y aquellos que sufran efectos adversos derivados de la medicación, como por ejemplo las hipoglucemias. Los pacientes con hiperlipemias monogénicas deberían mantener el contacto (al menos anual en ausencia de complicaciones o comorbilidades) con las Unidades de Lípidos para seguimiento compartido con Atención Primaria. Ello refuerza la adherencia a medicación y estilos de vida saludables y favorece la incorporación ágil de las novedades terapéuticas para este grupo de pacientes. Algunos pacientes con HTA secundaria se mantienen hipertensos pese al tratamiento etiológico de su enfermedad, lo que sugiere el efecto prolongado de la HTA sobre el árbol vascular (remodelado) o bien que alguno de ellos pueda tener además una HTA esencial217.
En cualquier caso, sería conveniente que cada Unidad estableciera sus propios criterios de alta, en función de su actividad clínica y su relación con primaria.
FinanciaciónEl presente trabajo ha sido financiado por Laboratorios Ferrer. Los autores del documento son responsables del contenido del mismo. Laboratorios Ferrer no ha intervenido en el diseño, redacción, y/o contenidos del manuscrito.
Conflicto de interesesLaboratorios Ferrer ha proporcionado apoyo para la realización de la edición y soporte administrativo en relación con la actualización del documento «Estándares SEA 2024 para el Control Global del Riesgo Vascular». Laboratorios Ferrer no ha intervenido ni en su redacción, ni en su contenido.
Algunos autores han recibido honorarios de diferentes laboratorios farmacéuticos incluyendo a Laboratorios Ferrer por su participación en conferencias y asesorías, que se detallan en el apartado correspondiente. Los autores no han recibido ninguna remuneración para realizar este informe ni declaran otro conflicto de intereses directos en relación con este trabajo.
Arrobas-Velilla T declara no tener ningún conflicto de intereses.
Armario P declara no tener ningún conflicto de intereses.
Baeza-Trinidad R declara no tener ningún conflicto de intereses.
Calmarza P declara no tener ningún conflicto de intereses.
Cebollada J ha recibido honorarios por conferencias, presentaciones, manuscrito o eventos educativos de Astra-Zeneca, Daiichi-Sankyo, Pfizer, Ferrer y Amgen.
Civera-Andrés M declara no tener ningún conflicto de intereses.
Cuende Melero JI ha recibido honorarios por conferencias de Daiichi-Sankyo España.
Díaz-Díaz JL ha recibido honorarios por conferencias, presentaciones, manuscrito o eventos educativos de Sanofi, MSD, Amgen, Viatris y Ferrer; soporte para reuniones de Viatris, Sanofi, Amgen, MSD y Ferrer; y participación en Advisory Boards de Amgen, Sanofi y Ferrer.
Espíldora-Hernández J declara no tener ningún conflicto de intereses.
Fernández Pardo J ha recibido honorarios por presentaciones de Servier, Mylan y Daiichi-Sankyo.
Guijarro C ha recibido honorarios por consultoría de Sanofi, Amgen y Daiichi Sankyo, por conferencias, presentaciones, agencias de conferenciantes, redacción de manuscritos o actos educativos de Rubio, Sanofi, Amgen, Ferrer, Daiichi Sankyo, Amarin, Servier y Novartis, apoyo para reuniones de Laboratorios Ferrer y por Advisory Boards de Sanofi, Amgen y Daiichi Sankyo.
Jericó C ha recibido honorarios por conferencias, presentaciones, agencias de conferenciantes, redacción de manuscritos o actos educativos de Amarin, Amgen, Daichii-Sankyo, Novo Nordisk, Sanofi y Viatris.
Laclaustra M declara no tener ningún conflicto de intereses.
Lahoz C declara no tener ningún conflicto de intereses.
López-Miranda J ha recibido honorarios por consultoría de Amgen y Sanofi; por conferencias, presentaciones, agencias de conferenciantes, redacción de manuscritos o actos educativos de Amgen, Sanofi, MSD, Ferrer, Novartis y Laboratorios Esteve; y soporte a reuniones de Amgen y Sanofi.
Martínez-Hervás S declara no tener ningún conflicto de intereses.
MasanaL ha recibido honorarios de consultoría de Amryt, Amarin, Daiichi-Sankyo, Ferrer, Novartis, Sanofi, Ultragenix; y por conferencias, presentaciones, agencias de conferenciantes, redacción de manuscritos o actos educativos y soporte a reuniones por Amarin, Amryt, Daiichi-Sankyo, Novartis, Sanofi, Ferrer, MSD, Ultragenix, Viatris.
Mostaza JM ha recibido honorarios por conferencias, presentaciones, asesorías o eventos educativos de Sanofi, Amgen, Novartis, Daiichi-Sankyo, Servier, Viatris, Ultragenix y Ferrer.
Muñiz-Grijalvo O ha recibido honorarios por conferencias y actividades educativas de Amgen, Sanofi, MSD, Sobi, Viatris, Amarin y Daichii-Sankyo así como honorarios por consultoría, Advisory Boards y soporte a reuniones de Amgen, Sanofi, Sobi y Ultragenix.
Páramo JA declara no tener ningún conflicto de intereses.
Pascual V ha recibido honorarios por conferencias y actividades educativas de Adamed, Amarin, Almirall, Astra-Zeneca, Daichii-Sankyo, Esteve, Ferrer, Novartis, Sanofi-Events, Servier y Viatris.
Pedro-Botet J ha recibido honorarios por Advisory Boards de Amgen,Daiichi-Sankyo, Ferrer, Mylan (Viatris) y Sanofi y conferencias de Amarin Pharma, Amgen, Daiichi-Sankyo, Esteve, Ferrer, Organon, Mylan (Viatris), Sanofi y Servier.
Pérez-Martínez P ha recibido honorarios por conferencias, presentaciones, agencias de conferenciantes, redacción de manuscritos o actos educativos de Amgen, Ferrer, Esteve, Daiichi-Sankyo y Viatris.
Pintó X ha recibido honorarios por consultoría de Menarini, Ultragenyx y Viatris; por conferencias, presentaciones, agencias de conferenciantes, redacción de manuscritos o actos educativos de Novartis, Daiichi-Sankyo, Sobi, Almirall y Ferrer; y por la participación en una Junta de Supervisión de la Seguridad de los Datos o en Advisory Boards de Amgen, Sanofi y Novartis.
Puzo J ha recibido honorarios por conferencias y ponentes de Amgen, Sanofi y Beckman Coulter, y por liderazgo en junta, sociedad, comité o grupos de defensa por SEQC (Sociedad Española de Medicina de Laboratorio).
Real JT declara no tener ningún conflicto de intereses.
ValdivielsoP ha recibido honorarios por consultoría, por experto testimonio, por conferencias, presentaciones, manuscrito o eventos educativos de Amgen, Sanofi, Novartis, Ferrer y Daiichi-Snakyo y soporte para reuniones por Amgen; Novartis; Ferrer; MSD; Daiichi-Sankyo; Sanofi y subvenciones o contratos de Ferrer, SOBI y Lipigon, Ionis y Capenergy.
Los autores no tienen otras afiliaciones relevantes o participación financiera con ninguna organización o entidad con un intereses o conflicto financieros con el tema o los materiales discutidos en el manuscrito, aparte de los divulgados.
CVI: claudicación vascular intermitente
Figura sujeta a derechos de autor. Fuente original: Manzano L, Mostaza JM, Suárez C, Cairols M, Redondo R, Valdivielso P, et al. Modificación de la estratificación del riesgo vascular tras la determinación del índice tobillo-brazo en pacientes sin enfermedad arterial conocida. Estudio MERITO. Med Clin (Barc) 2007; 128:241–6.218
La población diana es la población general de varones.
- 1.
Durante los últimos seis meses, ¿con qué frecuencia le ha sido posible la penetración?
- -
Ni lo intentó
- -
Nunca
- -
Menos de la mitad de las veces
- -
Aproximadamente la mitad de las veces
- -
Más de la mitad de las veces
- -
Casi siempre o siempre
- -
- 2.
Durante los últimos seis meses, ¿con qué frecuencia le ha sido posible mantener la erección hasta finalizar el acto sexual?
- -
Ni lo intentó
- -
Nunca
- -
Menos de la mitad de las veces
- -
Aproximadamente la mitad de las veces
- -
Más de la mitad de las veces
- -
Casi siempre o siempre
- -
- 3.
Cuando intentó el acto sexual, ¿con qué frecuencia fue satisfactorio para usted?
- -
Ni lo intentó
- -
Nunca
- -
Menos de la mitad de las veces
- -
Aproximadamente la mitad de las veces
- -
Más de la mitad de las veces
- -
Casi siempre o siempre
El rango de puntuación se encuentra entre 0 y 15 puntos. Una puntuación igual o inferior a 12 sugiere disfunción eréctil. Las puntuaciones que corresponden a cada opción de respuesta son las siguientes.
- -
Ni lo intentó (0)
- -
Nunca (1)
- -
Menos de la mitad de las veces (2)
- -
Aproximadamente la mitad de las veces (3)
- -
Más de la mitad de las veces (4)
- -
Casi siempre o siempre (5)
- -
Publicado con el permiso del editor. Fuente original: Martín-Morales A, Meijide Rico F, García González JI, Manero Font M, García-Losa M, Artés Ferragud M; ESTIMA. Desarrollo y validación psicométrica de un nuevo cuestionario de screening para la disfunción eréctil (cuestionario SQUED). Actas Urol Esp. 2007 Feb;31(2):106-12 Copyright © 2007 Asociación Española de Urología. Publicado por Elsevier España,S.L.U. Todos los derechos reservados.2
| 1. ¿Usa usted el aceite de oliva como principal grasa para cocinar?Sí=1 punto |
| 2. ¿Cuánto aceite de oliva consume en total al día (incluyendo el usado para freír, comidas fuera de casa, ensaladas, etc.)?Cuatro o más cucharadas=1 punto |
| 3. ¿Cuántas raciones de verdura u hortalizas consume al día?(las guarniciones o acompañamientos=½ ración) 1 ración=200g.Dos o más (al menos una de ellas en ensalada o crudas)=1 punto |
| 4. ¿Cuántas piezas de fruta (incluyendo zumo natural) consume al día?Tres o más al día=1 punto |
| 5. ¿Cuántas raciones de carne roja, hamburguesa, salchichas o embutidos consume al día?(ración: 100 - 150 g)Menos de un al día=1 punto |
| 6. ¿Cuántas raciones de mantequilla, margarina o nata consume al día?(porción individual: 12 g)Menos de un al día=1 punto |
| 7. ¿Cuántas bebidas carbonatadas y/o azucaradas (refrescos, colas, tónicas, bitter) consume al día?Menos de un al día=1 punto |
| 8. ¿Bebe usted vino? ¿Cuánto consume a la semana?Siete o más vasos a la semana=1 punto |
| 9. ¿Cuántas raciones de legumbres consume a la semana?(un plato o ración de 150 g)3 o más a la semana=1 punto |
| 10. ¿Cuántas raciones de pescado-mariscos consume a la semana?(un plato pieza o ración: 100 – 150 g de pescado o 4-5 piezas o 200 g de marisco)Tres o más a la semana=1 punto |
| 11. ¿Cuántas veces consume repostería comercial (no casera) como galletas, flanes, dulce o pasteles a la semana?Menos de dos a la semana=1 punto |
| 12. ¿Cuántas veces consume frutos secos a la semana?(ración 30 g)Tres o más a la semana=1 punto |
| 13. ¿Consume usted preferentemente carne de pollo, pavo o conejo en vez de ternera, cerdo, hamburguesas o salchichas?(carne de pollo: 1 pieza o ración de 100 – 150 g)Sí=1 punto |
| 14. ¿Cuántas veces a la semana consume los vegetales cocinados, la pasta, arroz u otros platos adrezados con salsa de tomate, ajo, cebolla o puerro elaborada a fuego lento con aceite de oliva (sofrito)?Dos o más a la semana=1 punto |
| PUNTUACIÓN TOTAL<9=Baja adherencia≥ 9=Buena adherencia |
Reproducido de A Short Screener Is Valid for Assessing Mediterranean Diet Adherence among Older Spanish Men and Women. 141, Issue 6, 1140–5. Schröder H, Fitó M, Estruch R, Martínez-González MA, Corella D, Salas-Salvadó J, et al.. The Journal of Nutrition, 2011, doi.org/10.3945/jn.110.135566. Copyright (2024), con el permiso de Elsevier.42
| 1. Durante los últimos siete días, ¿en cuántos realizo actividades físicas intensas tales como levantar pesos pesados, cavar, ejercicios hacer aeróbicos o andar rápido en bicicleta? |
| Días por semana (indique el número) |
| Ninguna actividad física intensa (pase a la pregunta 3) |
| 2. Habitualmente, ¿cuánto tiempo en total dedicó a una actividad física intensa en uno de esos días? |
| Indique cuántas horas por día |
| Indique cuántos minutos por día |
| No sabe/no está seguro |
| 3. Durante los últimos siete días, ¿en cuántos días hizo actividades físicas moderadas tales como transportar pesos livianos, o andar en bicicleta a velocidad regular? No incluya caminar |
| Días por semana (indicar el número) |
| Ninguna actividad física moderada (pase a la pregunta 5) |
| 4. Habitualmente, ¿cuánto tiempo en total dedicó a una actividad física moderada en uno de esos días? Indique cuántas horas por día |
| Indique cuántos minutos por día |
| No sabe/no está seguro |
| 5. Durante los últimos siete días, ¿en cuántos días caminó por lo menos 10 minutos seguidos? |
| Días por semana (indique el número) |
| Ninguna caminata (pase a la pregunta 7) |
| 6. Habitualmente, ¿cuánto tiempo en total dedicó a caminar en uno de esos días? |
| Indique cuántas horas por día |
| Indique cuántos minutos por día |
| No sabe/no está seguro |
| 7. Durante los últimos siete días, ¿cuánto tiempo pasó sentado durante un día hábil? |
| Indique cuántas horas por día |
| Indique cuántos minutos por día |
| No sabe/no está seguro |
| VALOR DEL TEST1. Caminatas: 3’3 MET* x minutos de caminata x días por semana (Ej. 3’3 x 30 minutos x cinco días=495 MET)2. Actividad Física Moderada: 4 MET* X minutos x días por semana3. Actividad Física Vigorosa: 8 MET* X minutos x días por semanaA continuación, sume los tres valores obtenidos: Total=caminata+actividad física moderada+actividad física vigorosaCRITERIOS DECLASIFICACIÓN:Actividad Física Moderada:• Tres o más días de actividad física vigorosa por lo menos 20 minutos por día• Cinco o más días de actividad física moderada y/o caminata al menos 30 minutos por día• 5 o más días de cualquiera de las combinaciones de caminata, actividad física moderada o vigorosa logrando como mínimo un total de 600 MET*Actividad Física Vigorosa• Actividad Física Vigorosa por lo menos tres días por semana logrando un total de al menos 1500 MET*• Siete días de cualquier combinación de caminata, con actividad física moderada y/o actividad física vigorosa, logrando un total de al menos 3000 MET** Unidad de medida del testRESULTADO: NIVEL DE ACTIVIDAD (señale el que proceda)̈ NIVEL ALTÖ NIVEL MODERADÖ NIVEL BAJO O INACTIVO |
Cuestionario Internacional De Actividad Física (IPAQ) [Internet]. Junta de Andalucía. Disponible en: https://www.juntadeandalucia.es/export/drupaljda/salud_5af958727c664_cuestionario_actividad_fisica_ipaq.pdf44
| Fase pre-pre-analítica (solicitud de análisis):1. Las pruebas de lipoproteínas aterogénicas deben incluir la evaluación del riesgo conferido por las partículas de LDL, partículas remanentes, y, en casos seleccionados, Lp(a).Fase pre-analítica (toma de muestra)1. El ayuno no es necesario de forma rutinaria para evaluar el perfil lipídico.2. Considerar una muestra en ayunas cuando los TGS sin ayuno sean ≥ 400 mg/dL3. Tomar de dos a tres muestras de sangre en serie, con al menos una semana de diferencia, para permitir un promedio de variación biológica (más importante cuando los resultados de la prueba están cerca de los umbrales de decisión de tratamiento) |
| Fase analítica1. El seguimiento de cLDL medido o calculado y c-no-HDL de un paciente debe ser idealmente realizado con el mismo método (y preferiblemente el mismo laboratorio).2. Los médicos deben ser notificados cuando la prueba de laboratorio cambia de un método a otro.3. El cálculo de cLDL en pacientes con baja concentración de cLDL <70 mg/dL y/ o concentración de TGS 175–400 mg/dL, y en muestras que no están en ayunas puede ser inadecuado e introducir errores por encima de 10%.4. Es adecuado utilizar ensayos de cLDL directo para el cálculo del colesterol remanente y para la evaluación del cLDL en las situaciones anteriores y cuando la concentración de TGS es ≥ 400 mg/dL.5. El cLDL corregido con Lp(a) debe evaluarse al menos una vez en pacientes con Lp(a) alto sospechado o conocido, o si el paciente muestra una pobre respuesta a la terapia reductora de cLDL.6. Los ensayos de Apo B actualmente proporcionan la medición más precisa de la carga total de partículas aterogénicas. |
| Fase post-analítica (informe)1. Los laboratorios deben calcular e informar automáticamente del c-no-HDL en todos los perfiles de lípidos. También se podría informar en pacientes seleccionados sobre colesterol remanente. Colesterol remanente=CT- (cHDL+cLDL) (medido por método directo)2. Los informes de laboratorio deben señalar concentraciones anormales en función de los umbrales de decisión.3. Las concentraciones extremadamente altas, más allá de los límites de referencia, deben alertar a los médicos (comentario interpretativo sobre el informe de la prueba).Fase pos-pos-analítica (interpretación y uso de la prueba)1. cLDL es el objetivo principal de la terapia de reducción de lípidos.2. Cuando no se alcanza el objetivo de cLDL o no puede valorarse adecuadamente, debe utilizarse el C-no-HDL o apo B como objetivos de tratamiento secundario en pacientes con TGS 2-10 mmol/L (175–880 mg/dL), diabetes, obesidad o síndrome metabólico. |
Quantifying Atherogenic Lipoproteins: Current and Future Challenges in the Era of Personalized Medicine and Very Low Concentrations of LDL Cholesterol. A Consensus Statement from EAS and EFLM. Clin Chem Lab Med 2020; 58(4): 496–517.11
| Historial familiar | |
| - Familiar de 1er grado con antecedentes de CI precoz y/o | 1 |
| - Familiar de 1er grado con cLDL >percentil 95 | |
| - Familiar de 1er grado con xantomas y/o arco corneal y/o | 2 |
| - Niños <18 años con cLDL >percentil 95 | |
| Historia personal | |
| - Evidencia de enfermedad coronaria prematura | 2 |
| - Evidencia de enfermedad cerebrovascular o periférica prematura | 1 |
| Examen físico | |
| - Xantomas tendinosos | 6 |
| - Arco corneal <45 años | 4 |
| Analítica | |
| - cLDL >330 mg/dL (> 8,5 mmol/L) | 8 |
| - cLDL 250-329 mg/dL (6,5 – 8,4 mmol/L) | 5 |
| - cLDL 190-249 mg/dL (5,0 – 6,4 mmol/L) | 3 |
| - cLDL <190 mg/dL (> 5,0 mmol/L) | 1 |
| Análisis genético | |
| - Mutación conocida del gen del receptor de las LDL | 8 |
| PUNTUACIÓN | |
| - HF definida | >8 |
| - HF probable | 6 - 8 |
| - HF posible | 3 - 5 |
| - HF improbable | <3 |
CI: Cardiopatía isquémica; cLDL: colesterol de lipoproteínas baja densidad; HF: hipercolesterolemia familiar
Austin, M. A., C. M. Hutter, R. L. Zimmern, and S. E. Humphries, 2004, Genetic Causes of Monogenic Heterozygous Familial Hypercholesterolemia: A HuGE Prevalence Review: American Journal of Epidemiology, v. 160, no. 5, p. 407–420, doi:10.1093/aje/kwh236.22 Traducido y reproducido con permiso de Oxford University Press en nombre de la American Journal of Epidemiology. OUP y American Journal of Epidemiology no se responsabilizan en modo alguno de la exactitud de la traducción. El licenciatario es el único responsable de la traducción en esta publicación/reimpresión.
Heatherton TF, Kozlowski LT, Frecker RC, Rickert W, Robinson J. Measuring the heaviness of smoking: using self-reported time to the first cigarette of the day and number of cigarettes smoked per day. Br J Addict 1989; 84:791-800. https://doi.org/10.1111/j.1360-0443.1989.tb03059.x .153