En el remodelado vascular patológico juegan un papel clave las células vasculares y su interacción con las células inflamatorias y del sistema inmune. En este proceso intervienen una gran cantidad de genes y proteínas regulados de forma coordinada por un reducido número de factores de transcripción. En los últimos años las investigaciones sobre una pequeña subfamilia de factores de transcripción, la subfamilia NR4A, han tenido un gran impacto sobre nuestra comprensión de la biología vascular. Los receptores NR4A1 (Nur77), NR4A2 (Nurr1) y NR4A3 (NOR-1) son productos de genes de respuesta temprana cuya expresión es inducida por múltiples estímulos fisiopatológicos y físicos. Su amplia distribución en los diferentes tejidos y células los sitúan en el control de numerosos procesos como la diferenciación, la proliferación, la supervivencia y la apoptosis celular, así como la inflamación y el metabolismo de lípidos y carbohidratos. Esta revisión analiza el papel de estos receptores, particularmente de NOR-1, en el remodelado vascular patológico asociado a la aterosclerosis, el aneurisma de aorta abdominal y la hipertensión arterial pulmonar.
Vascular cells and their interaction with inflammatory cells and the immune system play a key role in pathological vascular remodeling. A large number of genes and proteins regulated in a coordinated manner by a small number of transcription factors are involved in this process. In recent years, research on a small subfamily of transcription factors, the NR4A subfamily, has had a major impact on our understanding of vascular biology. The NR4A1 (Nur77), NR4A2 (Nurr1) and NR4A3 (NOR-1) receptors are products of early response genes whose expression is induced by multiple pathophysiological and physical stimuli. Their wide distribution in different tissues and cells places them in the control of numerous processes such as cell differentiation, proliferation, survival and apoptosis, as well as inflammation and the metabolism of lipids and carbohydrates. This review analyzes the role of these receptors, particularly NOR-1, in pathological vascular remodeling associated with atherosclerosis, abdominal aortic aneurysm and pulmonary arterial hypertension.
Las enfermedades cardiovasculares (ECV) causan 18,6 millones de muertes al año (33,6% de la mortalidad global), cifra que aumenta año tras año y que las convierte en la primera causa de muerte a nivel mundial1. Si esta tendencia no se frena o invierte, más de mil millones de personas morirán de ECV en la primera mitad del siglo XXI. Entre estas enfermedades destacan las de componente isquémico, como la cardiopatía isquémica, la enfermedad arterial periférica y la enfermedad cerebrovascular, cuya causa común es la aterosclerosis.
La aterosclerosis es un proceso inflamatorio crónico, que progresa asintomáticamente favorecido por factores de riesgo como la hiperlipidemia, la hipertensión y la diabetes, y que se caracteriza por la progresiva acumulación en la íntima de lípidos, células inflamatorias, células musculares lisas vasculares (CMLV), proteínas de matriz extracelular (MEX) y depósitos de calcio que forman las lesiones o placas ateroscleróticas2,3. En la génesis, progresión y complicación de la arteriosclerosis juegan un papel clave las lipoproteínas de baja densidad (LDL)4. En fases tempranas la disfunción endotelial, causada por factores de riesgo como la dislipemia o la hipertensión, aumenta la permeabilidad vascular que facilita que las LDL se acumulen en la íntima, retenidas por la MEX. La hipótesis clásicamente aceptada considera que la oxidación de las LDL en el subendotelio aumenta su aterogenicidad y potencia la infiltración de células inflamatorias como los monocitos, favorecida por el incremento de la expresión de moléculas de adhesión y la producción de citoquinas con actividad quimiotáctica. En la pared vascular los monocitos se diferencian a macrófagos que captan las LDL oxidadas (LDLox) y se transforman en células espumosas, que secretan citoquinas y quemoquinas, y generan especies reactivas de oxígeno (ROS) que contribuyen a la oxidación de las LDL. Sin embargo, en los últimos años se atribuye también un papel a las LDL nativas como desencadenantes de la respuesta inmune adaptativa. De modo que los mecanismos proaterogénicos promovidos por las LDL irían más allá de la hipótesis oxidativa5. Como se comenta más adelante, además de los monocitos/macrófagos, en la aterosclerosis participan otras células inflamatorias como linfocitos T, mastocitos o neutrófilos. Por otra parte, las citoquinas y factores de crecimiento liberados en la pared arterial inflamada activan las CMLV, que migran, proliferan y sintetizan MEX formando una cubierta fibrosa que contribuye al crecimiento y a la estabilización de las lesiones2,3. En efecto, la capa fibrosa recubre el núcleo lipídico compuesto sobre todo por células espumosas y lípidos extracelulares, que cuando contiene un exceso de restos de células muertas forman un núcleo necrótico. La acumulación de LDLox y el estrés oxidativo puede causar la muerte de las CMLV por apoptosis, lo que debilita la capa fibrosa y hace que las placas sean vulnerables a la rotura aumentando el riesgo de complicaciones clínicas2,3.
Otra patología que comparte con la aterosclerosis mecanismos fisiopatológicos como la inflamación, el estrés oxidativo, la neovascularización, la apoptosis, y calcificación vascular, es el aneurisma de aorta abdominal (AAA)6,7. Como en la aterosclerosis, en el AAA también participan activamente diferentes células inflamatorias y del sistema inmune8. El AAA es una enfermedad degenerativa crónica que progresa de forma asintomática y que se caracteriza por una dilatación localizada y permanente de la aorta abdominal. Se considera aneurisma una dilatación superior al 50% del diámetro normal de la aorta abdominal. La pérdida de componentes de la MEX, por un aumento de la actividad proteolítica, y de CMLV, por apoptosis, debilita la pared vascular que puede llegar a romperse causando la muerte6,7. El AAA afecta unas 6 veces más a hombres que a mujeres (su incidencia en varones mayores de 65 años es del 5-8%), y actualmente la única opción terapéutica es la cirugía de reparación de los aneurismas de alto riesgo6,7.
También se produce un intenso remodelado vascular en otras patologías para las que el arsenal terapéutico es limitado y el tratamiento es únicamente sintomático, como la hipertensión arterial pulmonar (HAP), en la que un exceso de proliferación de las CMLV (hiperplasia) aumenta la resistencia de la vasculatura pulmonar y eleva la presión de la arteria pulmonar, que provoca insuficiencia del ventrículo derecho y puede llegar a causar la muerte9. La hiperplasia es también la principal característica de la «aterosclerosis acelerada» o restenosis, complicación responsable del fracaso de un porcentaje importante de las intervenciones de revascularización basadas en la angioplastia y las endoprótesis vasculares (stents).
En estas patologías se produce un intenso remodelado vascular en el que intervienen células vasculares y una diversidad de tipos y subtipos de células inflamatorias, y se activan múltiples vías de señalización que en último término alteran la expresión de un gran número de genes. En estos procesos juegan un papel crítico un número reducido de genes que codifican para factores de transcripción responsables de coordinar la expresión génica y determinar las respuestas celulares. Nuestro grupo identificó el receptor nuclear NOR-1 (Neuron-derived Orphan Receptor-1) como un nuevo factor de transcripción implicado en la aterosclerosis y la restenosis10, y más recientemente en el AAA11–13. En esta revisión discutiremos el papel de los receptores NR4A (Nuclear Receptor subfamily 4 group A), fundamentalmente de NOR-1, en el remodelado vascular asociado a enfermedades como la aterosclerosis, la HAP y el AAA.
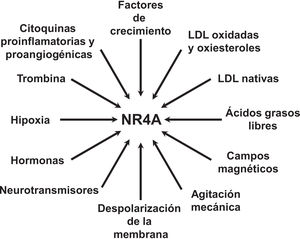
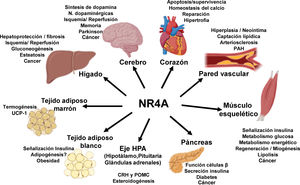
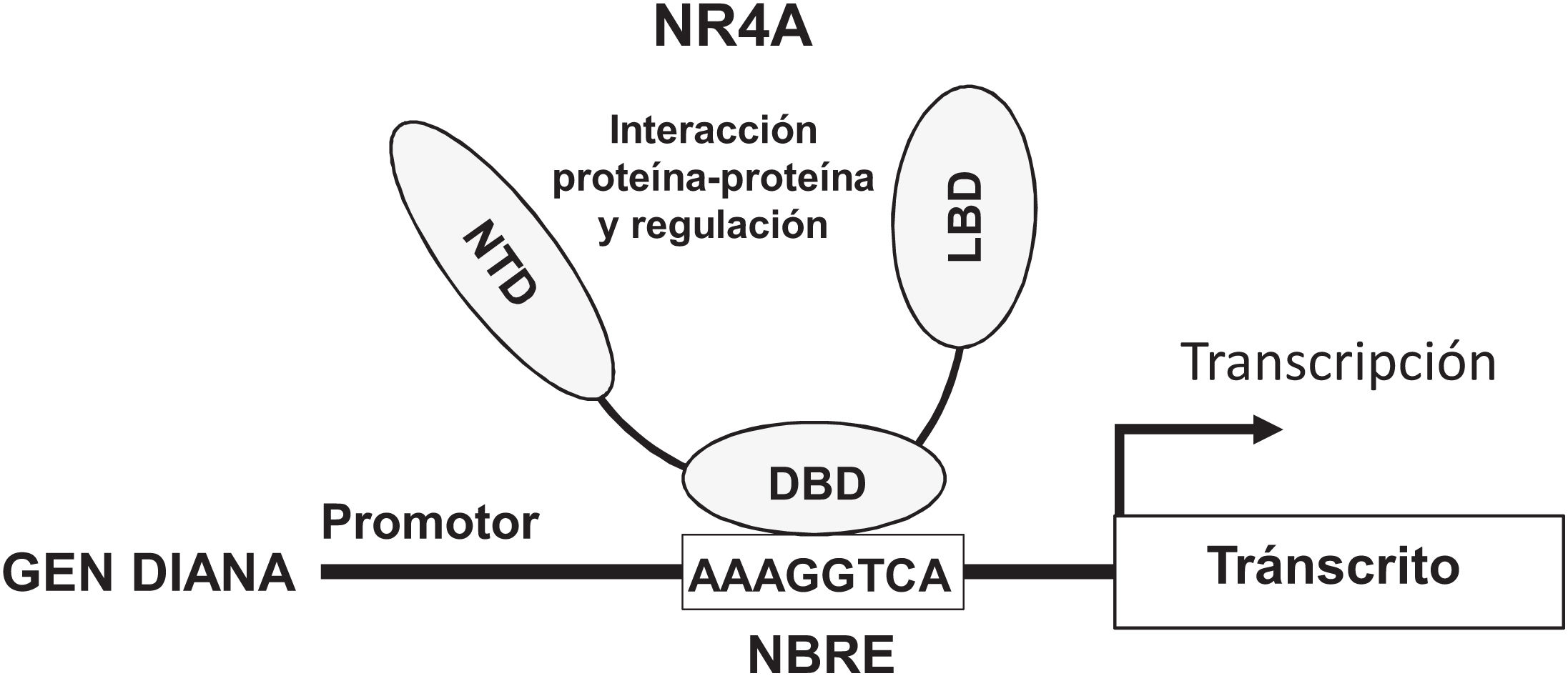
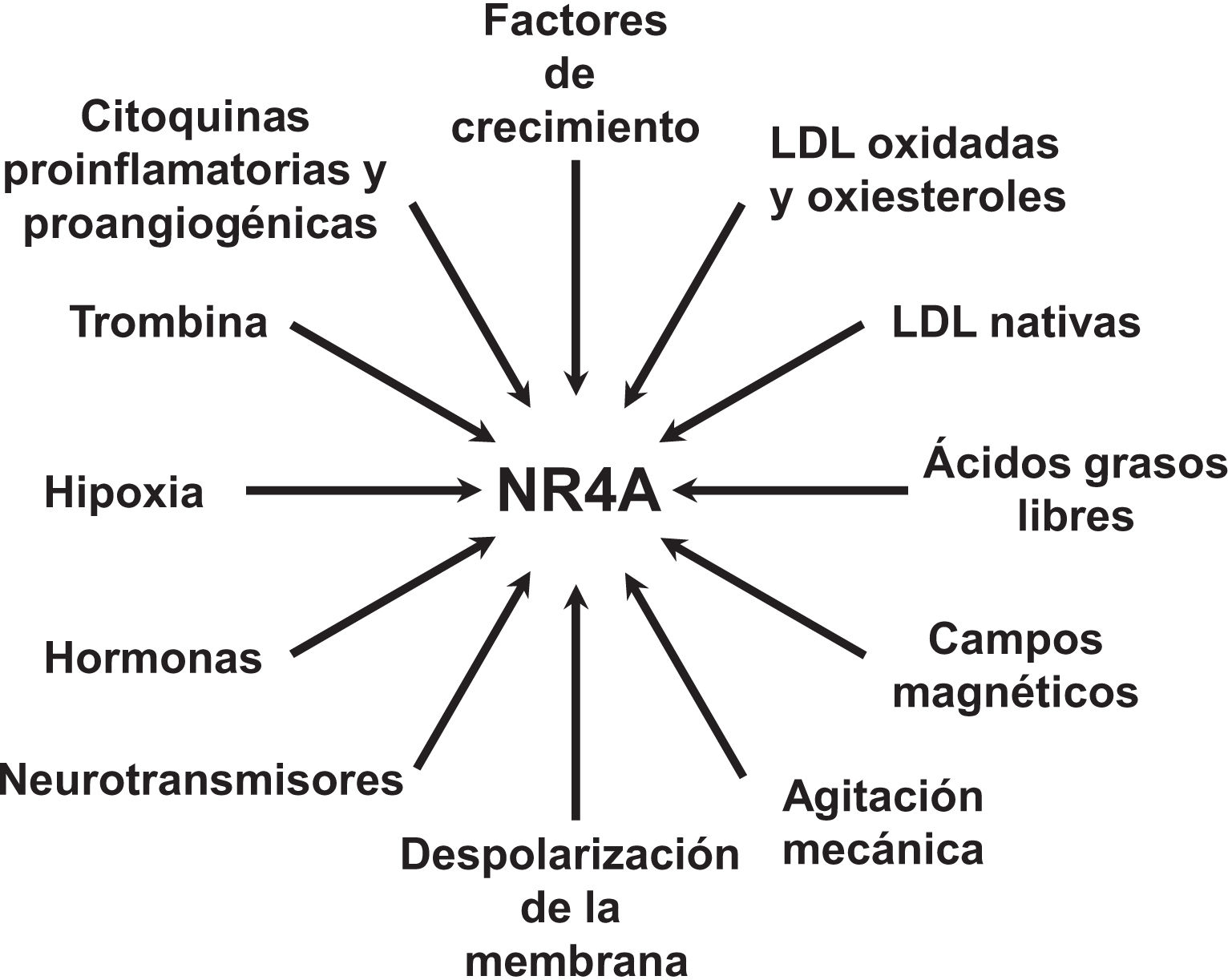
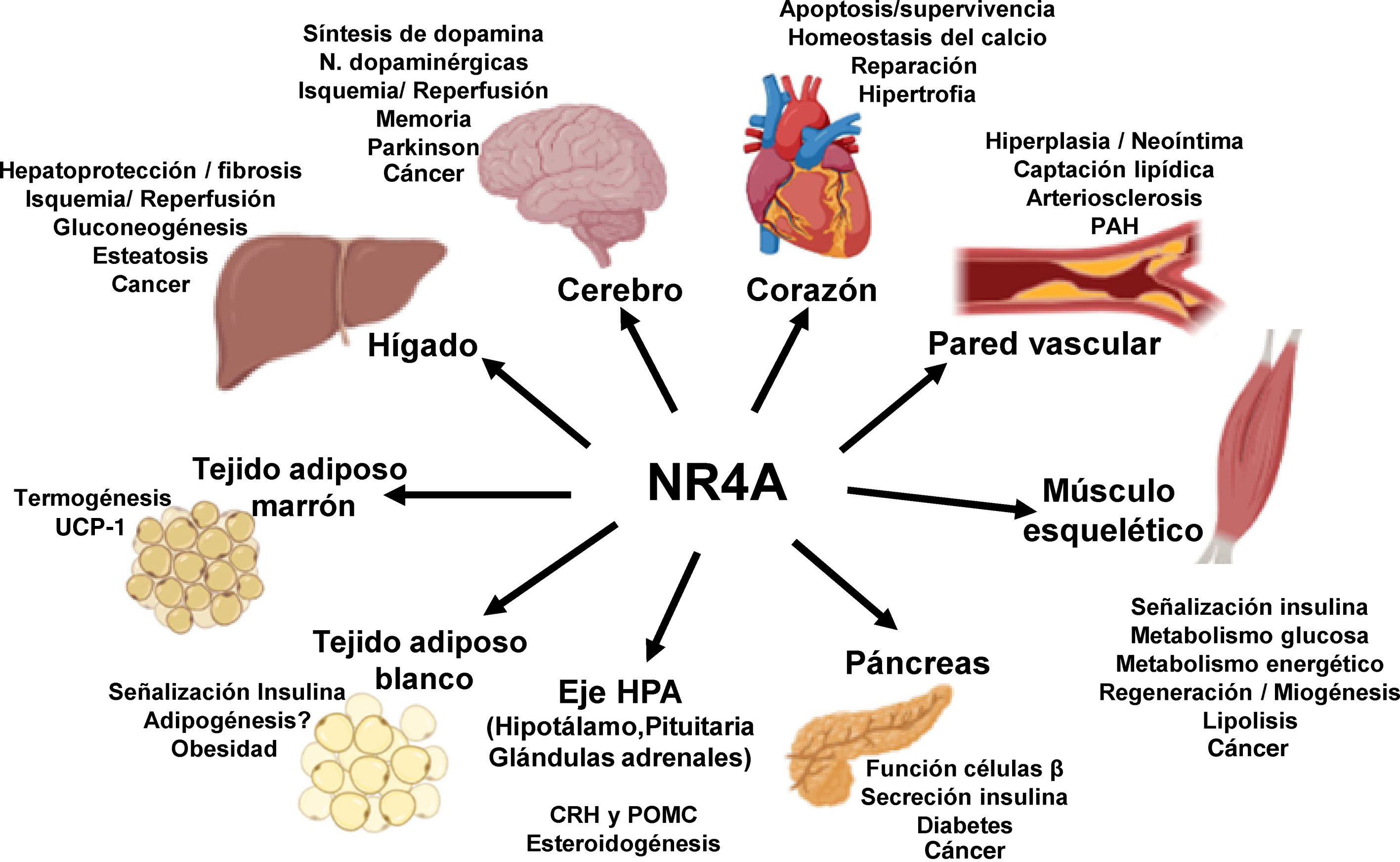
NOR-1: estructura y funciónNOR-1 (nombre sistemático NR4A3 [NR4A member 3], también denominado MINOR) es uno de los tres miembros de la subfamilia NR4A de receptores nucleares, a la que también pertenecen Nur77 (NR4A1) y Nurr1 (NR4A2). Los tres miembros presentan la estructura típica de los receptores nucleares con una elevada homología (94% de los aminoácidos idénticos) en la región de unión al ADN (DBD, DNA-Binding Domain), una homología moderada en el dominio de unión al ligando (LBD, Ligand-Binding Domain) y una baja homología en la región N-terminal14. Pese a las similitudes estructurales, los tres receptores no son funcionalmente equivalentes. Aunque pueden regular funciones celulares de forma redundante, en ocasiones éstas involucran a los tres receptores, y en algunos casos ejercen efectos antagónicos. Los receptores NR4A son factores de transcripción que se unen a elementos de respuesta específicos presentes en los promotores de sus genes diana regulando así su expresión. Pueden unirse al ADN como monómeros o dímeros. Como monómeros se unen a un elemento NBRE (Nerve growth Factor [NGFI-B] Response Element) octamérico cuya secuencia consenso es AAAGGTCA (fig. 1). En forma de homodímeros se unen al elemento NuRE (Nur-Response Element) formado por dos secuencias invertidas similares al NBRE14. NOR-1 presenta una menor afinidad por NuRE, y por tanto menor capacidad de activar la transcripción15. Además, Nurr1 y Nur77 (no así NOR-1) pueden formar heterodímeros con RXR. Asimismo, pueden regular la expresión génica de forma indirecta antagonizando a otros factores de transcripción a través de diferentes mecanismos16,17. Aunque comparten esta estructura típica de receptores nucleares, poseen algunas particularidades. La principal afecta al LBD, esencial para el reclutamiento de pequeñas moléculas lipofílicas (ligando) que actúan como activadores. Estudios cristalográficos han evidenciado que el LBD de los NR4A es atípico, ya que contiene aminoácidos hidrofóbicos cuyos radicales de gran tamaño ocupan el espacio que debería quedar libre para el «bolsillo» del ligando, lo que imposibilita su unión18,19. A pesar de ello, estudios posteriores sugirieron que la citosporona B (antifúngico aislado de especies del género Cytospora) se une con gran afinidad a la región LBD de NR4A1 induciendo su actividad transcripcional20. Citosporona B sería el primer ligando conocido de esta familia, lo que ha aumentó el interés en estos receptores como posibles dianas farmacológicas21. Estudios posteriores han sugerido que algunos ácidos grasos también podrían unirse al LBD de NR4A122. Sin embargo, parece poco probable que los receptores NR4A estén regulados por ligandos fisiológicos, por lo que se consideran receptores huérfanos que se comportan como factores de transcripción constitutivamente activos. Además, son genes de respuesta temprana cuya expresión aumenta de forma rápida y muy acentuada en respuesta a diferentes estímulos14, y se activan a través de varias modificaciones postraduccionales23–25. Los receptores NR4A se expresan en tejidos con elevada actividad metabólica como el cerebro, el corazón, el músculo esquelético, el tejido adiposo, los riñones y el hígado10,26. Además, en tejidos o células donde su expresión basal es baja, se inducen en respuesta a estímulos fisiopatológicos. Entre los estímulos capaces de inducir su expresión se encuentran hormonas27, factores de crecimiento10,28, citoquinas proangiogénicas y proinflamatorias16,29,30, LDL nativas y LDLox16,31,32, trombina33,34, privación de oxígeno (hipoxia)11,35,36, factores físicos como la agitación mecánica y los campos magnéticos37,38, y la despolarización de la membrana plasmática39 (fig. 2). Los receptores nucleares regulan prácticamente todos los aspectos de la biología de los metazoos. La subfamilia NR4A ejemplifica perfectamente la pluralidad de funciones de estos factores de transcripción. En efecto, la respuesta a esta gran variedad de estímulos y su amplia distribución en los diferentes tejidos y células sitúan a esta subfamilia en el control de múltiples procesos como la diferenciación, la proliferación, la supervivencia y la apoptosis celular, la inflamación, el desarrollo embrionario, y el metabolismo lipídico y glucídico40–42. Esta complejidad explica por qué estos receptores están implicados en enfermedades humanas de alta incidencia como las ECV14,21, la diabetes41, la obesidad43,44 o el cáncer45,46 (fig. 3). La generación de modelos animales modificados genéticamente ha contribuido a esclarecer el papel fisiopatológico de estos receptores nucleares. En lo que respecta a NOR-1, sin embargo, la información proporcionada por su deleción ha sido un tanto controvertida. Dos grupos independientes generaron ratones deficientes para NOR-1 de forma casi simultánea. Si bien uno de ellos determinó que la deleción de NOR-1 afectaba al desarrollo embrionario y era letal47, el otro obtuvo animales viables que fenotípicamente sólo presentaban defectos en el oído interno y alteraciones vestibulares48. Como se comenta más adelante, animales deficientes en NOR-1 se han utilizado en estudios en los que se evidencia su papel en el remodelado vascular.
Estructura y función de los receptores NR4A. Los receptores NR4A activan la transcripción a través de la unión por su DBD (DNA Binding Domain, dominio de unión al ADN) a secuencias específicas del promotor de sus genes diana. Una de las más comunes es el elemento octamérico NBRE (Nerve Growth factor-Induced clone B [NGFI-B] Response Element) cuya secuencia consenso es AAAGGTCA. El NTD (N-terminal Domain, dominio amino-terminal) es importante para la regulación de la actividad de estos factores de transcripción, por ejemplo, mediante modificaciones postraduccionales como la fosforilación, y para la interacción con cofactores y con otros factores de transcripción. El LBD (Ligand Binding Domain, dominio de unión a ligando) es también un dominio multifuncional necesario para la dimerización y la interacción con otras proteínas.
Nuestro grupo demostró por primera vez que NOR-1 se encuentra sobreexpresado en placas ateroscleróticas de pacientes con cardiopatía isquémica y en lesiones vasculares inducidas en el modelo porcino por la administración de una dieta aterogénica o mediante daño mecánico causado por angioplastia coronaria transluminal percutánea10,49. Además, los tres receptores NR4A se inducen fuertemente en respuesta a estímulos proaterogénicos en los diferentes tipos celulares implicados en la aterosclerosis14,30–36. Sin embargo, los resultados de los primeros estudios experimentales sobre el papel de NOR-1 en el remodelado vascular generaron cierta controversia, debido al mayor engrosamiento de la íntima observado en un modelo murino de ligación de la arteria carótida en el que se suprimió la actividad transcripcional de los tres receptores50. Subsiguientes estudios, sin embargo, permitieron aclarar que estos receptores no son redundantes, y que ejercen efectos opuestos sobre la proliferación de las células endoteliales y las CMLV. Mientras que NOR-1 regula genes necesarios para la progresión en el ciclo celular y su sobreexpresión aumenta la proliferación de las células vasculares10,28,31,40, como se comenta en detalle más adelante, Nur77 en cambio es un regulador negativo de la proliferación celular51–53. A continuación se detallan las evidencias experimentales que nos han permitido entender el papel de NOR-1 en los diferentes tipos celulares implicados en el remodelado vascular.
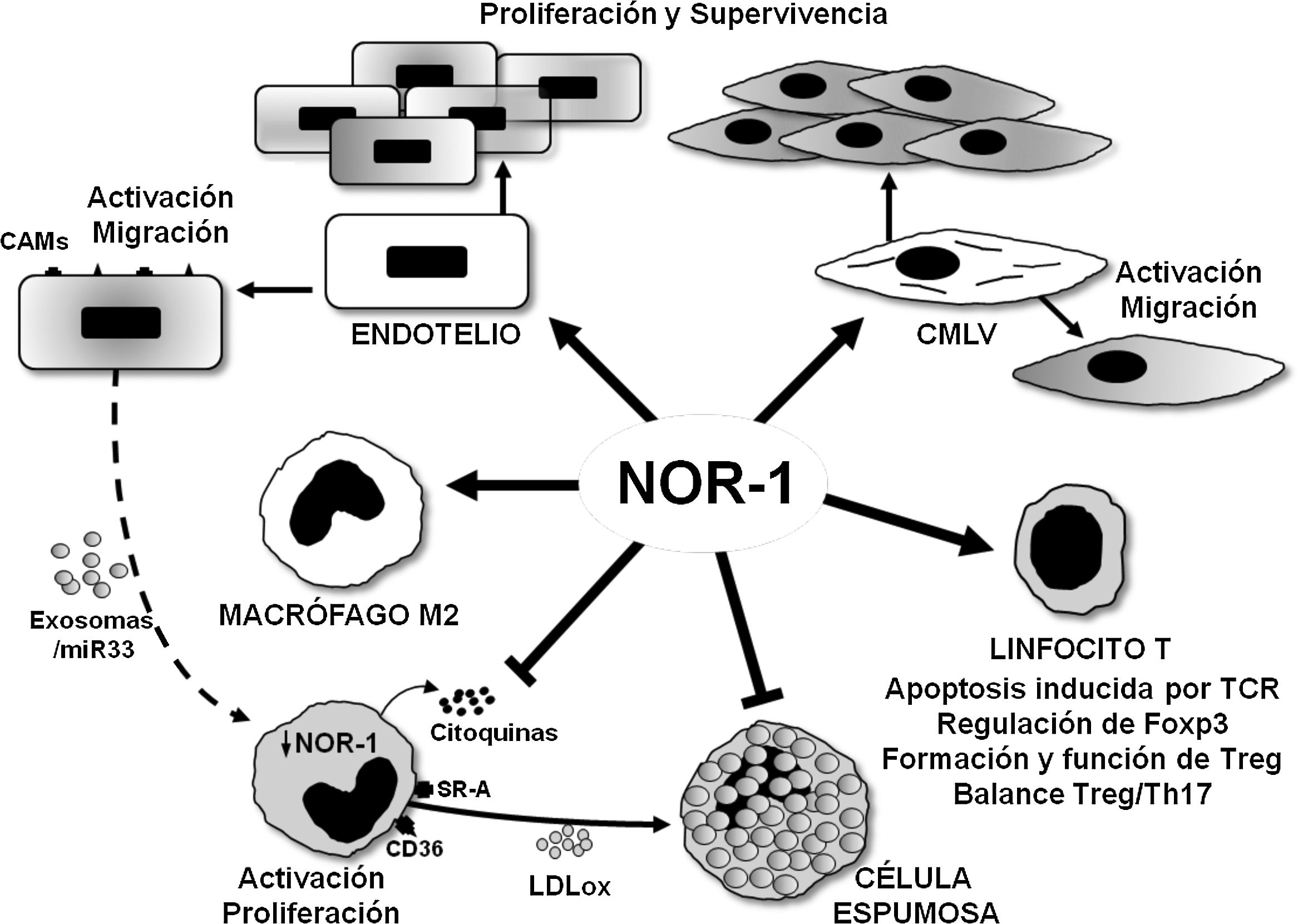
NOR-1 en la proliferación, supervivencia e inflamación del endotelio vascularNOR-1 se expresa en el endotelio vascular y su expresión es inducida por estímulos que promueven la migración, la proliferación y la supervivencia de las células endoteliales así como la angiogénesis (fig. 4). En efecto, en células endoteliales la expresión de NOR-1 aumenta de forma transitoria y muy acentuada cuando se exponen a concentraciones crecientes del factor de crecimiento del endotelio vascular (VEGF)30 o de trombina33,34. Estímulos que a través de sus receptores, VEGFR-2 (VEGF receptor-2) y PAR-1 (Protease-Activated Receptor 1), respectivamente, activan vías de señalización dependientes de Ca2+, PKC (Protein Kinase C) y proteínas quinasas activadas por mitógenos (ERK1/2 [Extracellular Signal-Regulated Kinase 1/2] y p38 MAPK [Mitogen-Activated Protein Kinase])30,33,34. De modo que al inhibir la expresión de NOR-1 se previene la respuesta migratoria y proliferativa a estos estímulos30,33,34. NOR-1 también se induce en células endoteliales expuestas a estrés hipóxico, por regulación directa de HIF-1 (Hypoxia-Inducible Factor 1)35,36. En este caso su inhibición incrementa la proporción de células que mueren por apoptosis mientras que su sobreexpresión limita la apoptosis y promueve supervivencia celular35,36. En este efecto prosupervivencia de NOR-1 parece clave la proteína antiapoptótica cIAP2 (cellular Inhibitor of Apoptosis 2)11,35 que NOR-1 regula a nivel transcripcional11. En relación con la angiogénesis, se ha sugerido que NOR-1 regula la expresión de endotelina 1 (ET-1), péptido vasoconstrictor con actividad proangiogénica54, mientras que su inhibición mediante la técnica CRISPR/Cas9 reduce la migración celular y la formación de angiotubos de las células HBMEC (Human Brain Micro Endothelial Cells)55.
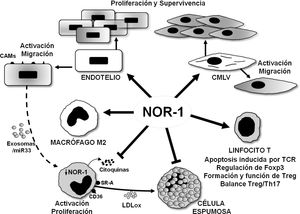
Representación esquemática de los efectos del receptor nuclear NOR-1 en las células vasculares y en las células inflamatorias/sistema inmune. En las células vasculares la inducción de NOR-1 conlleva su activación y el aumento de expresión de moléculas de adhesión (CAMs, Cell Adhesion Molecules) y regula la migración, la proliferación y la supervivencia celular. En los macrófagos NOR-1 favorece la polarización a fenotipo M2 antiinflamatorio, y limita su activación y proliferación, así como la secreción de citoquinas y la expresión de receptores implicados en la captación de lipoproteínas modificadas, con lo que previene su transformación en célula espumosa. Se ilustra la posible regulación indirecta de la expresión de NOR-1 en macrófagos a través de exosomas cargados de miR33. En linfocitos T modula la apoptosis inducida por el TCR (T Cell Receptor) y regula la expresión de Foxp3 factor de transcripción considerado el «gen maestro» que controla la formación y función de los linfocitos T reguladores (Treg).
La expresión endotelial de NOR-1 también aumenta en respuesta a estímulos inflamatorios y se relaciona con la inducción de VCAM-1 (Vascular Cell Adhesion Molecule 1)56, en cuya regulación participarían de forma indirecta miR-17 y miR-20a, dos microRNAs que modulan los niveles de NOR-157. Además, en estudios de aterosclerosis experimental la deficiencia de NOR-1, y la consiguiente reducción de la expresión endotelial de VCAM-1, disminuye el contenido de macrófagos de las lesiones ateroscleróticas y la aterosclerosis en el ratón ApoE-/- alimentado con dieta aterogénica56. La expresión de NOR-1 está aumentada en lesiones ateroscleróticas de pacientes diabéticos, y parece que media los efectos proinflamatorios y proaterogénicos de la apolipoproteína A-IV glicada (g-ApoA-IV)58. En efecto, g-ApoA-IV induce la expresión de este receptor nuclear, y al silenciar NOR-1 se previenen las respuestas inflamatorias que produce la g-ApoA-IV. Además, en animales ApoE-/-/ NOR-1-/- se reduce significativamente la aterosclerosis inducida por administración de g-ApoA-IV55. Finalmente, comentar que NOR-1 podría ejercer un efecto dual sobre la inflamación endotelial ya que también podría tener efectos antiinflamatorios a través de la regulación de la trombomodulina59, proteína de la superficie luminal del endotelio que posee una potente actividad anticoagulante, antifibrinolítica y antiinflamatoria.
Recientemente se ha observado que a nivel endotelial se produce una importante regulación postraduccional de NOR-1 de forma dependiente de ROS. Así, la reoxigenación de células endoteliales previamente privadas de oxígeno y glucosa produce una disminución de los niveles de proteína de NOR-160. El efecto es prevenido por el tratamiento con el antioxidante TRIOL, de tal modo que en monos cynomolgus (Macaca fascicularis) tratados con este compuesto se produce una recuperación de los niveles de NOR-1 que se asocia con la mejora de la hiperpermeabilidad de la barrera endotelial inducida por hipoxia hipobárica. Esta regulación de los niveles de proteína de NOR-1 depende de la interacción con SMARCB1 (SWI/SNF-related matrix-associated actin-dependent regulator of chromatin subfamily B member 1) a través de su DBD60.
NOR-1 en la proliferación de las CMLV y la hiperplasia de la íntimaLa expresión de NOR-1 en CMLV no proliferativas (quiescentes) es muy baja, pero se induce fuertemente en respuesta a diferentes agentes como factores de crecimiento (PDGF [Platelet-Derived Growth Factor], EGF [Epidermal growth factor]), trombina, LDL nativas y LDLox y citoquinas, y participa en los mecanismos moleculares que regulan la actividad migratoria y proliferativa de estas células y su respuesta inflamatoria10,16,28,31,49 (fig. 4). Como en las células endoteliales, en la inducción de NOR-1 por estos agonistas están implicadas múltiples vías de señalización dependientes de la movilización de Ca2+, de la PKC y de proteínas quinasas activadas por mitógenos (ERK1/2 y p38 MAPK), entre otros, y la inhibición de su expresión reduce la migración y proliferación de las CMLV10,28,31. La gran dependencia de las CMLV de NOR-1 para proliferar se evidencia también en estudios en los que se ha analizado el impacto de la forma celular en la proliferación. Utilizando matrices con microsurcos que fuerzan las CMLV a adquirir formas más elongadas frente a formas más epiteloides/romboides, se ha observado un patrón de expresión diferencial de NOR-1 relacionado con la proliferación celular61.
Para estudiar la función de NOR-1 en la pared vascular ha sido clave el uso de modelos animales modificados genéticamente. Nuestro grupo desarrolló un modelo de ratón transgénico que sobreexpresa el receptor NOR-1 humano en las CMLV62. En estos animales, al inducir lesión vascular mediante ligadura de la arteria carótida observamos un remodelado exacerbado que provoca mayor engrosamiento de la neoíntima62,63. Las CMLV de los animales transgénicos son más proliferativas, y exhiben características de CMLV menos diferenciadas como mayor expresión del marcador SMemb (embryonic Smooth Muscle myosin heavy chain)62,63. Posteriormente otros autores asociaron el efecto proproliferativo de NOR-1 a su capacidad de regular a nivel transcripcional la expresión de la ciclina D1, cuya actividad es necesaria para la transición de la fase G1 a la fase S del ciclo celular en la que se produce la replicación del ADN64. NOR-1 también regula la expresión del gen codificante para SKP2 (S phase kinase-associated protein 2)65, que es un componente limitante para la actividad del complejo SCF (Skp1/Cul1/Fbox) que degrada p27, condición necesaria para la transición a la fase S del ciclo celular66. En CMLV humanas de aorta se ha observado que NOR-1 es fosforilado por la DNA-PK (DNA-dependent Protein Kinase), lo que previene su degradación por ubiquitinación25. De hecho, NOR-1 y DNA-PK se detectan predominantemente en la íntima de placas ateroscleróticas humanas, y la inhibición de DNA-PK atenúa la formación de neoíntima en el modelo de inducción de lesión en arteria femoral en ratón25. Por otra parte, fármacos como la simvastatina, que reduce la proliferación de las CMLV y la formación de neoíntima, disminuye la expresión de NOR-1 inducida por LDL en CMLV y en la aorta de cerdos alimentados con dieta aterogénica49. De igual modo la exendina 4, un agonista de GLP1R (Glucagon-Like Peptide-1 Receptor) que reduce la proporción de CMLV proliferativas y la formación de neoíntima en el modelo de lesión de arteria femoral en animales diabéticos y no diabéticos, inhibe la señalización por ERK1/2 y la expresión de NOR-167.
Más allá de la regulación de proteínas directa o indirectamente implicadas en la proliferación celular, NOR-1 regula la expresión de otros genes estructurales que codifican para proteínas con un papel relevante en el remodelado vascular. Cabe destacar la regulación de la expresión y actividad de metaloproteinasas (MMPs) a través de varios mecanismos, entre ellos la inducción de la alfa-2-macroglobulina (A2M) un pan-inhibidor de MMPs68. También debe subrayarse la regulación a nivel transcripcional de la expresión de la vitronectina (VTN), una glicoproteína multifuncional presente en el plasma, las plaquetas y la MEX que juega un papel importante en la adhesión, migración y proliferación celular así como en trombosis y fibrinólisis69, que colocaliza con NOR-1 en las lesiones ateroscleróticas humanas70. Por último, la sobreexpresión de NOR-1 en CMLV humanas incrementa la producción de ROS de forma concomitante a un aumento de los niveles de la NADPH oxidasa NOX171. La regulación de NOX1 por NOR-1 se confirmó al silenciar NOR-1 mediante siRNA y por la colocalización de ambas proteínas en lesiones ateroscleróticas humanas. También se observó una regulación positiva de la superóxido dismutasa 1 (SOD1) y SOD3, y por el contrario una regulación negativa de la NOX4 y SOD2, esta última como consecuencia del antagonismo de NOR-1 con NFκB71. Por tanto, NOR-1 parece participar de múltiples formas en la intrincada red de genes que regulan la homeostasis redox y el estrés oxidativo en la vasculatura. Además, recientemente se ha identificado un RNA largo no codificante (lncRNA, long noncoding RNA) que se induce en las CMLV estimuladas con AngII a través de NOR-172. Como los microRNAs (18-22nt), los lncRNAs son RNA no codificantes pero más largos (>200nt) que regulan genes asociados con diversos procesos biológicos y que en los últimos años se han revelado importantes en las ECV73. Se observa una regulación coordinada de NOR-1 y Lnc-Ang164 por AngII y otros factores de crecimiento como PDGF, y el silenciamiento de Lnc-Ang164 inhibe tanto el estrés oxidativo como la proliferación inducidos por AngII72.
NOR-1 en la inflamación vascular y en la respuesta inmuneEn CMLV, NOR-1 es inducido por diversos estímulos inflamatorios como LPS, LDLox y citoquinas como IL-1β y TNFα y actúa como un modulador negativo de estos estímulos16. En efecto, la sobreexpresión lentiviral de NOR-1 reduce la expresión basal de citoquinas y quemoquinas (IL-1β, IL-6, IL-8, MCP-1 y CCL20) cuya expresión, en cambio, aumenta al silenciar NOR-116. Además, NOR-1 reduce la expresión de estos mediadores inducida por estímulos como el LPS, TNFα o LDLox en CMLV en cultivo, mientras que en animales transgénicos para NOR-1 se observa una atenuación de la respuesta inflamatoria aguda de la aorta en respuesta a la administración de LPS16. Este efecto parece consecuencia de la atenuación de vías de señalización dependientes de quinasas activadas por mitógenos (ERK1/2, p38 MAPK y Jun N-terminal quinasa), cuya activación en respuesta a LPS es menor en la pared vascular de animales transgénicos de NOR-1. Ello se traduce en una menor fosforilación y degradación de IκBα, menor fosforilación y translocación de p65 al núcleo y en consecuencia una menor activación de la vía de NFκB y de los genes de inflamación dependientes de NFκB16. Este efecto antiinflamatorio de los receptores NR4A por antagonismo con la vía de NFκB se ha observado en otros tipos celulares, y se produce a través de diferentes mecanismos como unión con baja afinidad a los elementos de respuesta a NFκB74, aumento de la expresión IκBα (inhibidor de NFκB)75 o interacción física con p6576.
Además de este papel en las CMLV, en la aterosclerosis intervienen diferentes células inflamatorias y del sistema inmune en las que NOR-1 parece jugar un papel importante, si bien, como se analiza en las siguientes secciones, en gran medida se desconoce hasta qué punto es relevante en la formación y evolución de las lesiones.
NOR-1 en la función de monocitos/macrófagosComo ya se ha comentado, en la aterosclerosis juegan un papel destacado los monocitos/macrófagos que captan las LDLox y contribuyen a la formación del núcleo lipídico de las lesiones3. Los primeros estudios sobre los receptores NR4A en las líneas celulares THP-1 y RAW264.7 reportaron su inducción por estímulos inflamatorios y por lípidos oxidados (LDLox, 25-hidroxicolesterol y 7β-hidroxicolesterol) a través de un mecanismo dependiente de NFκB29. Estos resultados parecían sugerir que los receptores NR4A jugaban un papel proinflamatorio, porque, además, su sobreexpresión en macrófagos RAW264.7 y J774 aumentaba la expresión de genes involucrados en el ciclo celular, la apoptosis y la inflamación77. Sin embargo, estudios posteriores sugieren que estos receptores ejercen fundamentalmente funciones antiinflamatorias.
Los tres receptores (NOR-1, Nur77 y Nurr1) se expresan en los macrófagos de lesiones ateroscleróticas humanas78, y en experimentos de ganancia y pérdida de función en células en cultivo reducen la activación de los macrófagos y su actividad proinflamatoria. Así, disminuyen la producción de citoquinas y quemoquinas (IL1β, IL8, MIP-1α [Macrophage Inflammatory Protein-1α], MIP-1β y MCP-1), así como la expresión de SR-A (Scavenger receptor type A) y CD36, lo que limita la captación de LDLox y la formación de células espumosas78 (fig. 4). Estos resultados, sin embargo, contrastan con los comentados anteriormente en células endoteliales, en las que la inducción de NOR-1 dependiente de NFκB aumenta la expresión de moléculas de adhesión, y con la menor infiltración de macrófagos y formación de placas ateroscleróticas en ratones ApoE-/- deficientes en NOR-156.
El papel antiinflamatorio de NOR-1 en monocitos/macrófagos también es apoyado por los estudios que lo vinculan con la polarización a macrófagos M2/antiinflamatorios (fig. 4). En efecto, la polarización in vitro de cultivos primarios de monocitos humanos a macrófagos M2 mediante tratamiento con la IL4 aumenta la expresión de NOR-179. Además, en lesiones ateroscleróticas humanas la expresión de NOR-1 es mayor en áreas enriquecidas en macrófagos CD68+ MR+, y su silenciamiento en macrófagos humanos reduce la expresión de varios marcadores M2, como el antagonista del receptor de IL1 (IL-1Ra, Interleukin-1 Receptor antagonist) y la IL-10, que poseen potenciales elementos de respuesta a NOR-1 en sus regiones promotoras79. Recientemente, el efecto proaterogénico de la endotelina 1 (ET-1)80, potente péptido vasoconstrictor, expresado primariamente por células endoteliales pero también por CMLV y macrófagos, que juega un importante papel en la homeostasis vascular81, se ha relacionado con la regulación negativa que las células endoteliales ejercerían sobre la expresión de los receptores NR4A en los macrófagos82. Medios de cultivo condicionados de células endoteliales que sobreexpresan ET-1 tratadas con LDLox liberarían exosomas cargados con miR-33 que al ser captados por los macrófagos atenuarían la expresión de los receptores NR4A y de marcadores de fenotipo M2 (Arg-1, PPARg, Mrc1 e IL-10), favoreciendo así la activación de los macrófagos y la inducción de genes proinflamatorios82 (fig. 4). A través de este mecanismo de comunicación intercelular el eje miR-33/NR4A contribuiría a la aterosclerosis exacerbada observada en animales ApoE-/- que sobreexpresan ET-1 específicamente en el endotelio82. Estudios sobre la función de los receptores NR4A en monocitos/macrófagos en otras patologías parecen ratificar su papel en la modulación de la polarización alternativa de los macrófagos y su efecto antiinflamatorio83–85. De hecho, son mayoría los estudios que abogan por un papel antiinflamatorio y antiaterogénico de NOR-1 en los monocitos/macrófagos. En este sentido, la deficiencia de NOR-1 específica en células madre hematopoyéticas acelera la aterosclerosis86. En animales ApoE-/- irradiados, a los que se reconstituyó la médula ósea con células madre hematopoyéticas de ratones deficientes en NOR-1 (NOR-1-/-), y alimentados con una dieta enriquecida en grasa saturada, se aceleró el reclutamiento de macrófagos y aumentó la aterosclerosis86. A su vez, la expresión de NOR-1 aumentó en células progenitoras de la médula tratadas con IL-3 o GM-CSF (Granulocyte-Macrophage Colony-Stimulating Factor), estímulos que promueven la proliferación y la diferenciación a linaje mieloide. Asimismo, la deleción de NOR-1 provocó un aumento de las células progenitoras de macrófagos y células dendríticas (MDP, Macrophague and Dendritic Progenitor cells) en la médula ósea, e indujo esplenomegalia y monocitosis Ly6C+, y a nivel vascular aumentó la tasa de replicación de los macrófagos en las lesiones ateroscleróticas y la formación de células espumosas86. Por tanto, la función de NOR-1 en las células madre hematopoyéticas protegería frente a la aterosclerosis modulando negativamente la mielopoyesis y previniendo la actividad proaterogénica de los macrófagos.
Como se ha comentado, los receptores NR4A son reguladores del metabolismo40–42, lo que unido a su fina regulación en células de linaje monocítico ha llevado a proponer a NOR-1 como un marcador de síndrome metabólico, ya que su expresión disminuye significativamente en células mononucleares de sangre periférica87. De hecho, el Random Forest Analysis determinó que tanto la expresión de NOR-1 como la de PPARγ disminuían específicamente en células CD14+ (principalmente monocitos) de los pacientes con síndrome metabólico88.
NOR-1 en la función de los linfocitos T y BLos receptores NR4A juegan un papel relevante en el desarrollo y activación de los linfocitos T85. De hecho, tanto NOR-1 como Nur77 regulan la apoptosis inducida por TCR (T Cell Receptor) en la selección negativa durante la diferenciación de los linfocitos T en el timo89,90. Más allá de su papel como factores de transcripción que regulan la expresión génica a nivel transcripcional, este proceso parece depender en gran medida de actividades extranucleares, ya que tanto Nur77 como NOR-1 son fosforilados por la PKC y se translocan a la mitocondria donde interaccionan con Bcl2 induciendo la exposición del dominio proapoptótico BH391,92. Los receptores NR4A también son factores imprescindibles para el desarrollo de los linfocitos T reguladores (Treg), un linaje crítico para la tolerancia. La especificación del linaje Treg y su función es controlada por el factor de transcripción Foxp3, cuya expresión es regulada por los receptores NR4A, sobre todo por Nur77 y NOR-193 (fig. 4). Los animales carentes de los receptores NR4A en linfocitos no producen células Treg y mueren prematuramente a causa de autoinmunidad sistémica. Por tanto, son clave para determinar el destino de los linfocitos T CD4+ en el timo y para la homeostasis inmune. Además, estos receptores, cuya expresión en Treg es superior a la de cualquier otro subtipo de linfocitos T, son esenciales en la regulación de la expresión génica para el mantenimiento y funcionalidad de estas células94.
En los últimos años se ha evidenciado el impacto de la inmunidad en la aterosclerosis y la importancia del balance entre Th17, Treg y sus citoquinas en el desarrollo de aterosclerosis y en la rotura de las placas vulnerables95,96. En este contexto, recientemente nuestro grupo ha caracterizado CD69 como un nuevo receptor de LDLox en linfocitos T necesario para la inducción de los receptores NR4A y la diferenciación a Treg32. La administración de dieta aterogénica a animales carentes de CD69 en el compartimento linfoide aumenta la relación Th17/Treg en sangre periférica y exacerba la formación de placas ateroscleróticas. A través de la unión a CD69, las LDLox activan la expresión de los receptores NR4A con actividad antiinflamatoria, en particular de NOR-1, e inhiben la formación de linfocitos Th17. Además, en leucocitos de sangre periférica de los participantes del estudio PESA (Progression of Early Subclinical Atherosclerosis), individuos con aterosclerosis subclínica, se observó una menor expresión de CD69 y de los receptores NR4A, lo que permite proponerlos como marcadores tempranos de aterosclerosis32.
Respecto a los linfocitos B, a través de la producción de anticuerpos y citoquinas, diferentes subtipos están implicados en la regulación de la aterosclerosis con funciones tanto ateroprotectoras como proaterogénicas97. Recientemente, se ha demostrado que NOR-1 y Nur77 son rápidamente inducidos por la estimulación del receptor de antígenos de los linfocitos B, y actúan de forma parcialmente redundante para restringir la respuesta de las células B a los antígenos cuando la coestimulación por linfocitos T es limitada o inexistente98. El efecto lo producen en parte reprimiendo la expresión del factor de transcripción BATF (Basic leucine zipper Transcription Factor ATF-like), así como de las quemoquinas CCL3 y CCL4 e ICAM-195. Hasta el momento ningún estudio ha analizado si esta actividad de NOR-1 en los linfocitos B impacta en el desarrollo de aterosclerosis. En cambio, un reciente estudio en animales LDLR-/-/Nur77-/− alimentados con dieta aterogénica evidencia que la pérdida de función de Nur77 en los linfocitos B, o específicamente en las células B de la zona marginal, aumenta la aterosclerosis99.
NOR-1 en mastocitos, neutrófilos y células dendríticasEn la progresión del remodelado vascular asociado a la aterosclerosis y en el AAA se reconoce un papel importante a las proteínas y mediadores lipídicos liberados por los mastocitos8,100. Los mastocitos activados contribuyen a la degradación de la MEX, la apoptosis, y al aumento del reclutamiento de células inflamatorias a la pared vascular a través de la liberación de proteasas como la quimasa y la triptasa, de factores de crecimiento, de histamina, y de quemoquinas101. Se ha observado que la activación de los mastocitos conlleva la inducción de NOR-1, en algunos casos de forma claramente diferencial respecto a los otros dos miembros de la familia NR4A cuya expresión no cambia significativamente102. De hecho, NOR-1 es el gen de todo el genoma de los mastocitos que más se induce en respuesta a ciertas infecciones103, y también el principal receptor NR4A inducido en estas células cuando se exponen a LPS102. NOR-1 parece regular la secreción de citoquinas/quemoquinas por parte de los mastocitos104; sin embargo, no se ha investigado en detalle el papel de NOR-1 en la regulación de la vasodilatación, la homeostasis vascular, la angiogénesis y las respuestas inmunes innata y adaptativa en las que participan estas células105.
Otras células implicadas en el remodelado vascular son los neutrófilos8,106 y las células dendríticas8,107. Los neutrófilos constituyen la primera línea de defensa del organismo y desempeñan un papel clave en la inmunidad innata. Un reducido número de neutrófilos o un bajo nivel de supervivencia de esta población celular suelen asociarse con desórdenes hematopoyéticos y enfermedades inflamatorias crónicas. Además, los neutrófilos son componentes esenciales de las llamadas trampas extracelulares de neutrófilos (NETs, Neutrophil Extracellular Traps) que participan en la patogénesis de la trombosis, la aterosclerosis y el AAA106,108. NOR-1 es uno de los genes que se activa en mayor medida en estas células en respuesta a la proteína quinasa A (PKA, Protein Kinase A), su expresión aumenta en sitios de inflamación en los que se acumulan neutrófilos, y se ha observado que el silenciamiento de este receptor reduce la apoptosis y alarga la vida media de estas células109. Respecto a las células dendríticas, participan en cada uno de los estadios de la aterosclerosis y del AAA a través de una miríada de funciones que desempeñan en la respuesta inmune, que van de la captación de lípidos, la eferocitosis y la presentación de antígenos a la secreción de citoquinas pro- y antiinflamatorias8,107. NOR-1 participa en la activación y la inducción de la expresión génica mediada por TLR (Toll-Like Receptors)110, y el eje NOR-1/FOXO1/CCR7 parece crítico para la migración de estas células111. Más recientemente, NOR-1 se ha revelado esencial para dirigir la diferenciación de monocitos a células dendríticas, transformación que se activa en respuesta a estimulación microbiana112. Sin embargo, pese al número creciente de estudios que describen el importante papel de NOR-1 en mastocitos y células dendríticas, hasta el momento no se han realizado estudios específicos que analicen si este receptor modula el remodelado vascular a través de su función en estas células.
Regulación de NOR-1 por microRNAs y papel en la hipertensión arterial pulmonarComo se ha comentado, NOR-1 regula la expresión de varios componentes esenciales para la progresión del ciclo celular, lo que explicaría el gran impacto que las intervenciones experimentales que potencian o inhiben su expresión tienen en la proliferación celular y el remodelado vascular. Asimismo, este papel crítico de NOR-1 en la proliferación de las CMLV explicaría por qué este receptor es diana de varios microRNAs relevantes en la hiperplasia y el remodelado vascular. En efecto, en las CMLV los niveles de ARN mensajero de NOR-1 están regulados por la acción combinada de múltiples microRNAs. Un microarray realizado en CMLV de aorta humana estimuladas con PDGF permitió identificar a miR638, microRNA altamente expresado en CMLV cuya expresión disminuye significativamente en respuesta a PDGF, como un modulador de NOR-1 e indirectamente de la migración y proliferación inducida por PDGF113. De hecho, la regulación a la baja de NOR-1 por miR638 sería la responsable del efecto inhibitorio de este microRNA sobre la inducción de la ciclina D1 por PDGF113. Una regulación similar por miR638 se ha observado en CML de las vías respiratorias en las que un remodelado excesivo (hiperplasia) puede contribuir a la patogénesis del asma114, y por miR-107 en CMLV humanas de arteria pulmonar que al reducir NOR-1 actuaría como modulador negativo de la migración y proliferación inducida por PDGF115. La regulación de la proliferación de las CMLV de arteria pulmonar ha puesto el foco sobre NOR-1 en relación con la HAP, patología que se caracteriza por un remodelado exacerbado de la íntima de la arteria pulmonar9. NOR-1 se ha revelado clave como factor de transcripción que regula la proliferación de las CMLV de la arteria pulmonar en respuesta a mitógenos y al remodelado inducido por hipoxia en la enfermedad pulmonar obstructiva crónica (EPOC)116,117. Diversos estudios identifican NOR-1 como un gen fundamental sobre el que actúan varios microRNAs, como miR-106b-5p118, 508-3p119 o miR-638120, para regular la hiperplasia de las CMLV de arteria pulmonar, lo que sitúa a este receptor en el centro de un eje crucial en el diseño de estrategias terapéuticas para la HAP y el embolismo pulmonar agudo. De hecho, el efecto preventivo del resveratrol sobre el remodelado vascular pulmonar, que ha suscitado un gran interés como posible aproximación terapéutica de la HAP, se ha vinculado con su capacidad de regular miR-638 y de ese modo actuar sobre el tándem NOR-1/ciclina D1120,121. El efecto opuesto a NOR-1 que Nur77 ejerce sobre la proliferación de las CMLV explica que, contrariamente, la activación de Nur77 prevenga la progresión de la HAP122,123. Se ha de subrayar que la HAP es una enfermedad para la que solo se dispone de tratamiento sintomático, basado en la administración de vasodilatadores que no evitan la progresión de la patología y que esta enfermedad se caracteriza por un remodelado progresivo de la vasculatura pulmonar, elevada presión de la arteria pulmonar, y resistencia de la vasculatura pulmonar que provoca insuficiencia del ventrículo derecho que puede causar la muerte8.
NOR-1 en el aneurisma de aorta abdominalLa expresión de NOR-1 está muy aumentada en muestras de aneurismas humanos procedentes de pacientes sometidos a cirugía de reparación11. En estas muestras, análisis inmunohistoquímicos detectan estabilización de HIF1α11, que podría participar en la inducción de NOR-1 cuya expresión es inducida por la hipoxia en células vasculares11,35,36; de hecho, varios estudios señalan la hipoxia y HIF1α como mediadores importantes en la regulación de la expresión génica en la capa media de las aortas aneurismáticas124. Por otra parte, en las CMLV de las lesiones aneurismáticas, NOR-1 colocaliza con cIAP2, proteína con funciones antiapoptóticas que es inducida por NOR-1 en respuesta a hipoxia tanto en células endoteliales como CMLV11,35,36. Teniendo en cuenta las propiedades antiinflamatorias de NOR-1 en macrófagos78,79,86 y en CMLV16, y la regulación y colocalización de NOR-1 con cIAP2 en las CMLV de la pared aórtica aneurismática, se planteó la hipótesis de que NOR-1 podría regular la expresión de genes con funciones vasoprotectoras y que el incremento de su expresión en la pared aneurismática podría ser parte de un mecanismo de compensación para frenar o ralentizar el daño progresivo que sufre la pared vascular a medida que avanza esta enfermedad crónica. Además, como se ha comentado anteriormente, la deficiencia de NOR-1 en las células madre hematopoyéticas aceleraba la aterosclerosis86. Con estos antecedentes, Qing et al.125 analizaron si la función de este receptor en el compartimento hematopoyético podría afectar al desarrollo de AAA125. Para ello, animales deficientes en el receptor de las LDL (LDLR−/−) fueron irradiados, su médula ósea fue reconstituida con células madre hematopoyéticas de ratones NOR-1−/−, y se les indujo AAA mediante infusión de AngII y una dieta rica en grasa saturada. Se observó que un gran número de genes relacionados con inflamación se regulaban diferencialmente en los macrófagos de los animales deficientes en NOR-1 respecto a los de animales control (36 de los 184 genes analizados). Sin embargo, no se apreciaron diferencias en el diámetro de la arteria aorta suprarrenal, por lo que se concluyó que la función de NOR-1 en células de linaje hematopoyético no juega un papel relevante en la formación de AAA, al menos en este modelo animal125.
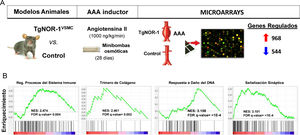
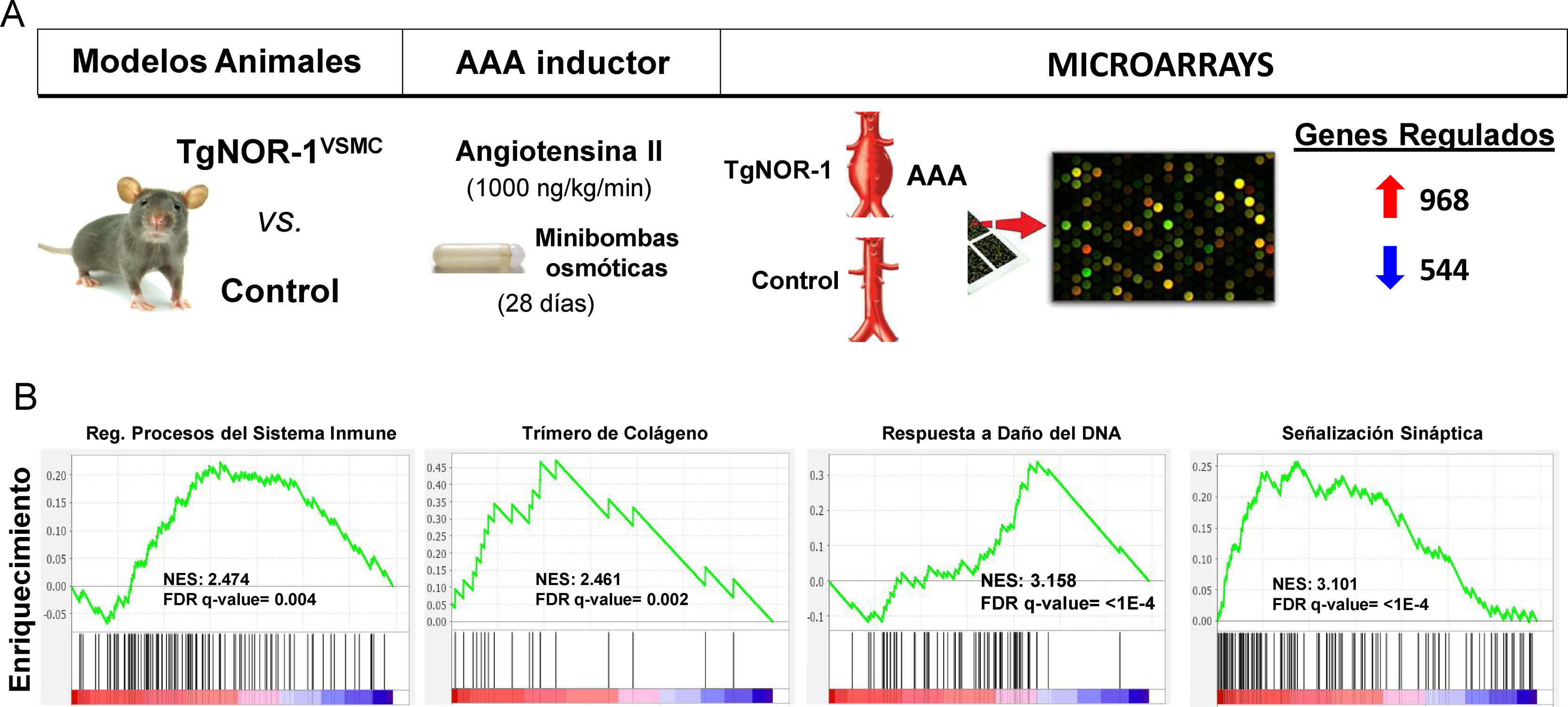
Más recientemente utilizando modelos animales que sobreexpresan NOR-1 en la pared vascular62,126, condición similar a la observada en la pared aneurismática humana en la que aumenta la expresión de NOR-1, pudimos determinar un aumento de la susceptibilidad de estos animales a la formación de AAA inducida por infusión de AngII12. Aunque la AngII aumentó la presión arterial igual que en los controles, en los animales transgénicos de NOR-1 provocó más inflamación (mayor producción de citoquinas y quemoquinas como IL-1β, IL6, MCP-1 y CXCL2), más estrés oxidativo (producción de ROS), mayor expresión y actividad de MMP2 y MMP-12 y mayor rotura de las láminas elásticas. En conjunto, la acción combinada de estos efectos venció la resistencia de los animales C57BL/6, fondo genético de los animales transgénicos de NOR-1, a desarrollar AAA en respuesta a AngII. El seguimiento ecocardiográfico permitió determinar que la transgénesis favorece la dilatación de la aorta inducida por la AngII, con un aumento del diámetro luminal significativo desde la primera semana, y la formación de AAA a las 4 semanas. Concluimos que el incremento de la expresión de NOR-1 en las CMLV de la capa media es condición necesaria y suficiente para el desarrollo de AAA en respuesta a AngII. Además, observamos que la doxiciclina, fármaco que reduce la inflamación en AAA humanos127 y cuya utilidad clínica se investiga128, previno la formación de AAA inducida por AngII en los animales transgénicos de NOR-112. Estos resultados subrayan la relevancia de NOR-1 en la fisiopatología del AAA y sugieren la utilidad de los animales transgénicos de NOR-1 para el estudio de los mecanismos fisiopatológicos del AAA y como modelos preclínicos para evaluar potenciales terapias para esta enfermedad. En este sentido, mediante microarrays de expresión se identificó un gran número de genes cuya expresión se induce o se reprime (960 vs. 544, respectivamente) en la pared de los animales transgénicos de NOR-1 (TgNOR-1VSMC) expuestos a AngII12. Mediante GSEA (Gene Set Enrichment Analysis) identificamos grupos de genes relacionados sobre todo con inflamación/respuesta inmune, remodelado de la MEX, y diferenciación de las CMLV, entre otros que podrían estar implicados en la respuesta diferencial mediada por NOR-1. A destacar un grupo de genes relacionados con la actividad simpática, que el análisis GSEA clasificaba dentro de genes de señalización sináptica (fig. 5). En particular, los genes codificantes para enzimas de la vía de síntesis de catecolaminas, como la tirosina hidroxilasa (TH) y la dopamina β-hidroxilasa (DBH) así como un transportador de noradrenalina (SLC6A2)12 cuya expresión se inducía significativamente en los animales transgénicos de NOR-1 infundidos con AngII. El aumento de expresión de TH, DBH y SLC6A2 también se detectó en AAA del modelo de ratón ApoE−/− infundido con AngII, y lo que es más importante, estos genes están muy inducidos en muestras de AAA humanos, en las que la expresión de TH es más de 100 veces superior a la de aortas control y correlaciona con la expresión de NOR-113. Tanto en la aorta aneurismática humana como en la de los modelos animales la expresión de TH se localizó sobre todo en nervios simpáticos que inervan la vasculatura, en linfocitos del infiltrado inflamatorio, y en menor medida en CMLV dispersas en la media. Resulta interesante que la inducción de AAA por AngII cursa con un aumento de la expresión de TH en la aorta de los animales susceptibles (transgénicos de NOR-1 y deficientes en ApoE−/−)13, y que el tratamiento con doxiciclina normaliza dicha expresión junto al resto de parámetros asociados a daño vascular (inflamación, estrés oxidativo y rotura de láminas elásticas)13. Por tanto, la vía de síntesis de catecolaminas, y en particular la TH, enzima limitante y principal punto de regulación de esta ruta biosintética, parece clave en la fisiopatología de los aneurismas aórticos. Tanto es así que el tratamiento con un inhibidor competitivo de la TH (alfa-metil-p-tirosina, AMPT) fue capaz de prevenir la dilatación aórtica y la formación de AAA tanto en animales TgNOR-1VSMC como ApoE−/− infundidos con AngII13. El AMPT redujo drásticamente la incidencia y gravedad de los aneurismas, y previno el daño vascular causado por la angiotensina: redujo la infiltración de células inflamatorias (macrófagos, linfocitos y neutrófilos), normalizó la expresión vascular de marcadores de inflamación como MCP-1, disminuyó el número de roturas de las láminas elásticas de la capa media, y previno el aumento de la expresión y actividad de metaloproteinasas que degradan la MEX como la MMP2 y el estrés oxidativo13. En conclusión, al inhibir la actividad de un enzima codificado por un gen regulado por NOR-1 se previno el desarrollo de AAA, lo que subraya el papel de NOR-1 en la fisiopatología de esta enfermedad.
Animales que sobreexpresan NOR-1 humano en las CMLV (TgNOR-1VSMC) son más susceptibles a desarrollar aneurisma de aorta abdominal (AAA) inducido por infusión de angiotensina II (AngII). A) Se muestra el diseño experimental en el que se comparó la formación de AAA y la expresión génica (mediante microarrays) de la aorta de animales TgNORVSMC y animales control después de infundir AngII (1000ng/kg/min) mediante minibombas osmóticas durante 28 días. El análisis de la expresión diferencial detectó 968 y 544 genes cuya expresión aumentaba o disminuía, respectivamente11. B) El análisis de vías por GSEA (Gene Set Enrichment Analysis) identificó grupos de genes regulados diferencialmente relacionados, entre otros procesos, con inflamación/respuesta inmune, remodelado de la matriz extracelular, respuesta al daño del ADN, y señalización sináptica, entre estos últimos los genes codificantes para enzimas de la vía de síntesis de catecolaminas como la tirosina hidroxilasa. FDR: False discovery rate; NES: Normalized enrichment score.
El receptor nuclear NOR-1 juega un papel relevante como regulador de las células vasculares y de las células inflamatorias y del sistema inmune implicadas en el remodelado vascular de la aterosclerosis, la HAP y el AAA. Destaca su contribución a la migración y la proliferación de las CMLV frente a la actividad antiinflamatoria que ejerce sobre células de linaje monocito/macrófago, y el papel que, conjuntamente con los otros receptores NR4A, ejerce en la homeostasis inmune a través de la regulación de la diferenciación y mantenimiento de la función de los linfocitos Treg. Sin embargo, todavía se desconoce, por ejemplo, si su función en linfocitos B, mastocitos, neutrófilos o células dendríticas es relevante en el remodelado vascular. Teniendo en cuenta sus posibles implicaciones terapéuticas, deberían acometerse nuevos estudios para dilucidar y conocer en detalle las funciones específicas y distintivas de cada uno de los receptores NR4A en los diferentes tipos celulares implicados en el remodelado vascular, para determinar así su impacto en el desarrollo, la progresión o en la posible regresión o estabilización del remodelado vascular patológico.
FinanciaciónEste trabajo ha sido realizado gracias a una beca de investigación del año 2019 de la Fundación Española de Arteriosclerosis (FEA) - Sociedad Española de Arteriosclerosis (SEA), y a los proyectos financiados por el Ministerio de Ciencia e Innovación (RTI2018-094727-B-100), el Instituto de Salud Carlos III (ISCIII) (PI18/0919), y la ayuda recibida de la Agència de Gestió d’Ajuts Universitaris i de Recerca (AGAUR) (2017-SGR-00333). C. B-S y L.P obtuvieron una beca del programa de formación de profesorado universitario (FPU) y del programa PFIS del ISCII, respectivamente.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.






![Estructura y función de los receptores NR4A. Los receptores NR4A activan la transcripción a través de la unión por su DBD (DNA Binding Domain, dominio de unión al ADN) a secuencias específicas del promotor de sus genes diana. Una de las más comunes es el elemento octamérico NBRE (Nerve Growth factor-Induced clone B [NGFI-B] Response Element) cuya secuencia consenso es AAAGGTCA. El NTD (N-terminal Domain, dominio amino-terminal) es importante para la regulación de la actividad de estos factores de transcripción, por ejemplo, mediante modificaciones postraduccionales como la fosforilación, y para la interacción con cofactores y con otros factores de transcripción. El LBD (Ligand Binding Domain, dominio de unión a ligando) es también un dominio multifuncional necesario para la dimerización y la interacción con otras proteínas. Estructura y función de los receptores NR4A. Los receptores NR4A activan la transcripción a través de la unión por su DBD (DNA Binding Domain, dominio de unión al ADN) a secuencias específicas del promotor de sus genes diana. Una de las más comunes es el elemento octamérico NBRE (Nerve Growth factor-Induced clone B [NGFI-B] Response Element) cuya secuencia consenso es AAAGGTCA. El NTD (N-terminal Domain, dominio amino-terminal) es importante para la regulación de la actividad de estos factores de transcripción, por ejemplo, mediante modificaciones postraduccionales como la fosforilación, y para la interacción con cofactores y con otros factores de transcripción. El LBD (Ligand Binding Domain, dominio de unión a ligando) es también un dominio multifuncional necesario para la dimerización y la interacción con otras proteínas.](https://static.elsevier.es/multimedia/02149168/0000003400000004/v2_202311230440/S0214916822000341/v2_202311230440/es/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)